La alteración de la marcha es frecuente en la esclerosis múltiple (EM) y tiene un gran impacto negativo en los pacientes pues conlleva a la pérdida progresiva de autonomía personal y social, y de productividad laboral. Esta guía pretende establecer recomendaciones para la evaluación del deterioro de la marcha y el uso de fampridina de liberación prolongada (fampridina-LP) como tratamiento de pacientes con EM y deterioro de la marcha en España.
DesarrolloFampridina-LP a dosis de 10mg cada 12 h es actualmente el único fármaco autorizado para mejorar el trastorno de la marcha en adultos con EM. En la práctica clínica, el fármaco ha demostrado además que mejora de forma significativa la calidad de vida de los pacientes que responden al tratamiento. La respuesta se puede evaluar mediante la prueba cronometrada de la marcha de 25 pies (T25FW) o el cuestionario MSWS-12 que deben realizarse antes y después del inicio del tratamiento. El tiempo mínimo recomendado para evaluar la respuesta inicial es de 2 semanas. Para considerar a un paciente como respondedor y continuar el tratamiento debe presentar, según indica la ficha técnica, una disminución en el tiempo T25FW o mejoría en el MSWS-12. Se recomienda realizar las revaluaciones al menos cada 6 meses. En los casos en que se considere la valoración de la calidad de vida, se recomienda la utilización del cuestionario de salud Short Form-36 (SF-36) o la escala MS Impact Scale-29 (MSIS-29). Es un fármaco en general bien tolerado y con buen perfil de seguridad. Se recomienda su administración en ayunas y control periódico de la función renal.
ConclusionesEstas recomendaciones permiten garantizar una prescripción eficiente y más segura, y ayudan al manejo de fampridina-LP como tratamiento del deterioro de la marcha en pacientes adultos con EM en España.
Gait impairment, a frequent sign in multiple sclerosis (MS), places a major burden on patients since it results in progressive loss of personal and social autonomy, along with work productivity. This guide aims to provide recommendations on how to evaluate gait impairment and use prolonged-release fampridine (PR-fampridine) as treatment for MS patients with gait impairment in Spain.
DevelopmentPR-fampridine dosed at 10mg every 12hours is currently the only drug approved to treat gait impairment in adults with MS. Additionally, PR-fampridine has been shown in clinical practice to significantly improve quality of life (QoL) in patients who respond to treatment. Treatment response can be assessed with the Timed 25-Foot Walk (T25FW) or the 12-item MS Walking Scale (MSWS-12); tests should be completed before and after starting treatment. The minimum time recommended for evaluating treatment response is 2 weeks after treatment onset. Patients are considered responders and permitted to continue the treatment when they demonstrate a decrease in their T25FW time or an increase in MSWS-12 scores. A re-evaluation is recommended at least every 6 months. The SF-36 (Short Form-36) and the MSIS-29 (MS Impact Scale-29) tests are recommended for clinicians interested in performing a detailed QoL assessment. This drug is generally well-tolerated and has a good safety profile. It should be taken on an empty stomach and renal function must be monitored regularly.
ConclusionsThese recommendations will help ensure safer and more efficient prescription practices and easier management of PR-fampridine as treatment for gait impairment in Spanish adults with MS.
La esclerosis múltiple (EM) es una enfermedad inflamatoria crónica autoinmune del sistema nervioso central, cuya etiología es aún desconocida. En la EM el sistema inmunológico daña las vainas de mielina, los oligodendrocitos y los axones de las neuronas, causando varios déficits neurológicos y discapacidad física y cognitiva1. Según el curso de la enfermedad, la EM se ha clasificado clásicamente en remitente-recurrente (EMRR), secundaria progresiva, primaria progresiva y progresiva recidivante2. Recientemente se ha propuesto redefinir la enfermedad en diferentes fenotipos clínicos (síndrome clínicamente aislado, EMRR y EM progresiva) según la actividad y la progresión de la enfermedad en base a información clínica y de resonancia magnética3. La EM es entre 2 y 3 veces más común en mujeres que en hombres y suele ser diagnosticada entre los 20 y 40 años de edad. Se ha calculado que en España existen 46.000 pacientes con EM (prevalencia de 100 casos/100.000). La incidencia anual de EM en España se estima en ≥ 4/100.000 personas4.
La reducción de la movilidad, y específicamente la dificultad para caminar, es un trastorno frecuente que impacta de forma muy negativa en los pacientes con EM5. Caminar es una de las funciones que más valoran los pacientes y su trastorno, con reducción de la marcha, implica grandes cargas económicas y sociales pues conlleva a una pérdida progresiva de productividad laboral y de autonomía personal5,6.
Este documento tiene como objetivo establecer una serie de recomendaciones para evaluar el deterioro de la marcha y su tratamiento mediante fampridina de liberación prolongada (fampridina-LP) en pacientes con EM en España.
MétodosExpertos españoles en EM definieron los temas relevantes a tratar en esta guía de tratamiento de cara al desarrollo de unas recomendaciones clínicas para la evaluación y tratamiento del deterioro de la marcha en pacientes con EM. Estas recomendaciones se centraron en el fármaco fampridina-LP, que hasta el momento es el único tratamiento aprobado por la Agencia Europea de Medicamentos y la Food and Drug Administration e indicado para la mejora de la marcha en pacientes con EM7,8. También se realizó una revisión bibliográfica del uso de fampridina-LP en ensayos clínicos y en estudios observacionales basados en la práctica clínica habitual.
DesarrolloImpacto del deterioro de la marcha en esclerosis múltipleEl deterioro de la marcha resulta de la combinación de varios síntomas comunes presentes en la EM, como son fatiga, debilidad, trastornos de la sensibilidad, espasticidad, ataxia y pérdida del equilibrio9,10. Si bien se ha publicado que hasta el 90% de los pacientes con EM experimentan algún grado de reducción en la movilidad5,11, el deterioro de la marcha afecta a más de 2 terceras partes de los pacientes con EM5. Por historia natural, sabemos que casi el 50% de los pacientes con EM necesitará alguna ayuda para caminar tras 15 años de enfermedad3,9. Aunque se ha observado que el deterioro de la marcha aumenta a medida que evolucionan la enfermedad y la discapacidad, los pacientes con Expanded Disability Status Scale (EDSS) <3,5 también pueden presentar alteraciones significativas de la marcha10,12.
Diferentes estudios han demostrado el impacto negativo que la EM tiene sobre la calidad de vida relacionada con la salud (CDVRS)13,14 y, en concreto, que el mantenimiento de la función física y de la marcha reduce dicho impacto de forma significativa9,10,15.
Si se compara con el dolor u otros problemas de cognición o visión3,16-20, el deterioro de la marcha es responsable de la mayor disminución de la CDVRS en pacientes con EM, pues afecta negativamente a su capacidad para realizar tareas diarias (91%), autoestima (84%), vida laboral (83%) y capacidad de desplazamiento (87%)15. Además, la pérdida de movilidad se correlaciona de forma independiente con el índice Instrumental Activities of Daily Living (IADL) de actividades de la vida diaria y se asocia a reducciones de las condiciones socioeconómicas en personas con EM9,21. La necesidad de un cuidador es el doble en pacientes con deterioro de la marcha comparado con el que presenta la población general con EM (37% vs. 18%). Este proceso de deterioro de la marcha no solo afecta a la CDVRS del paciente, sino también a la calidad de vida del cuidador9,22.
Tratamiento farmacológico del deterioro de la marchaTradicionalmente, la mayoría de los tratamientos utilizados para el deterioro de la marcha en la EM han sido de tipo no farmacológico, como por ejemplo terapias físicas y ayudas de tipo ortopédico, que pueden implicar un estigma adicional.
Desde el punto de vista farmacológico, los tratamientos modificadores de la enfermedad, que se centran en prevenir la aparición de brotes y retrasar en lo posible la progresión de la discapacidad, pueden estabilizar parcialmente la progresión del deterioro de la marcha, pero en general no mejoran su disfunción.
Otro grupo de tratamientos, denominados sintomáticos, se dirigen a mejorar los síntomas y a proporcionar una mejora funcional y de la CDVRS del paciente23.
Entre los fármacos sintomáticos que se utilizan para disminuir los múltiples síntomas asociados al deterioro de la marcha encontramos baclofeno, tizanidina, toxina botulínica y el derivado cannabinoide compuesto de delta-9-tetrahidrocannabinol y cannabidiol (nabiximols), que se utilizan para reducir la espasticidad24,25, la gabapentina y la pregabalina para el tratamiento del dolor26 y los betabloqueantes y la toxina botulínica para tratar los temblores27. Ningún ensayo clínico con esos fármacos sintomáticos ha demostrado que mejoren significativamente la capacidad de la marcha de los pacientes y ninguno de ellos tiene una indicación específica para el deterioro de la marcha.
Fampridina-LP es el único tratamiento autorizado en la actualidad para mejorar la marcha en personas adultas con EM8,28.
Fampridina de liberación prolongada: farmacocinética y farmacodinámicaLa desmielinización de los axones desencadena la exposición de los canales de potasio (K+) de la membrana axonal y ante un potencial de acción se produce la salida incontrolada de iones K+ que reduce y/o impide la producción y/o conducción de estos potenciales19,29.
Fampridina-LP, cuyo principio activo es 4-aminopiridina (4-AP) de liberación prolongada, es un inhibidor de amplio espectro de los canales de K+ dependientes del voltaje, capaz de aumentar la conducción de los potenciales de acción en axones desmielinizados8,28. La 4-AP es liposoluble, atraviesa la membrana axonal y bloquea los canales de K+ expuestos, lo cual disminuye la pérdida de K+, aumenta los potenciales de acción y la conducción, y potencia la transmisión sináptica y neuromuscular de la señal nerviosa28,30.
La farmacocinética de la fampridina-LP es lineal, con una absorción completa en el aparato digestivo8 que es más lenta que la 4-AP de liberación inmediata (4-AP-LI). Esto permite disminuir un 50% la concentración plasmática máxima reduciéndose, con ello, la aparición de efectos adversos (EA) relacionados con la dosificación16.
Recientemente, Jensen et al. analizaron la seguridad de fampridina-LP y 4-AP-LI de todos los ensayos clínicos realizados en humanos. El estudio mostró que la proporción de EA en los ensayos con 4-AP-LI y con fampridina-LP frente a placebo fueron del 9,60 y el 1,64%, respectivamente. Si bien los EA de ambos fármacos por vía oral son mayoritariamente leves o moderados, es la 4-AP-LI la que tiende a ocasionar con más frecuencia EA graves (EAG)31.
Por otra parte, se recomienda tomar fampridina-LP en ayunas porque su ingesta con alimentos aumenta la concentración plasmática máxima y, por ello, la posible aparición de acontecimientos adversos8,32.
Más del 97% de fampridina-LP no se une a proteínas plasmáticas8 y aproximadamente el 10% del fármaco se metaboliza a través de la vía del citocromo P450 2E1, siendo sus 2 metabolitos principales no activos farmacológicamente sobre los canales de K+8,28,32. La fampridina-LP es eliminada principalmente por vía renal y casi el 90% del fármaco se excreta sin modificación en un plazo de 24 h. Por eso debe utilizarse con precaución en pacientes con insuficiencia renal8,16,28,32.
Recomendación farmacológica de fampridina de liberación prolongada: paciente candidato y evaluación de la respuestaFampridina-LP está indicada por ficha técnica para mejorar la marcha en pacientes adultos con EM y con discapacidad evaluada mediante la escala EDSS entre 4,0 y 7,08. Los estudios disponibles han demostrado que la eficacia de fampridina-LP es independiente del tipo de EM, del fármaco modificador de la enfermedad usado, de la duración de la enfermedad y de las principales variables demográficas20,23,33.
Según ficha técnica, la dosis recomendada de fampridina-LP es de un comprimido de 10mg cada 12 h. Fampridina-LP no se debe tomar con alimentos, ni con mayor frecuencia ni a mayores dosis de las recomendadas8.
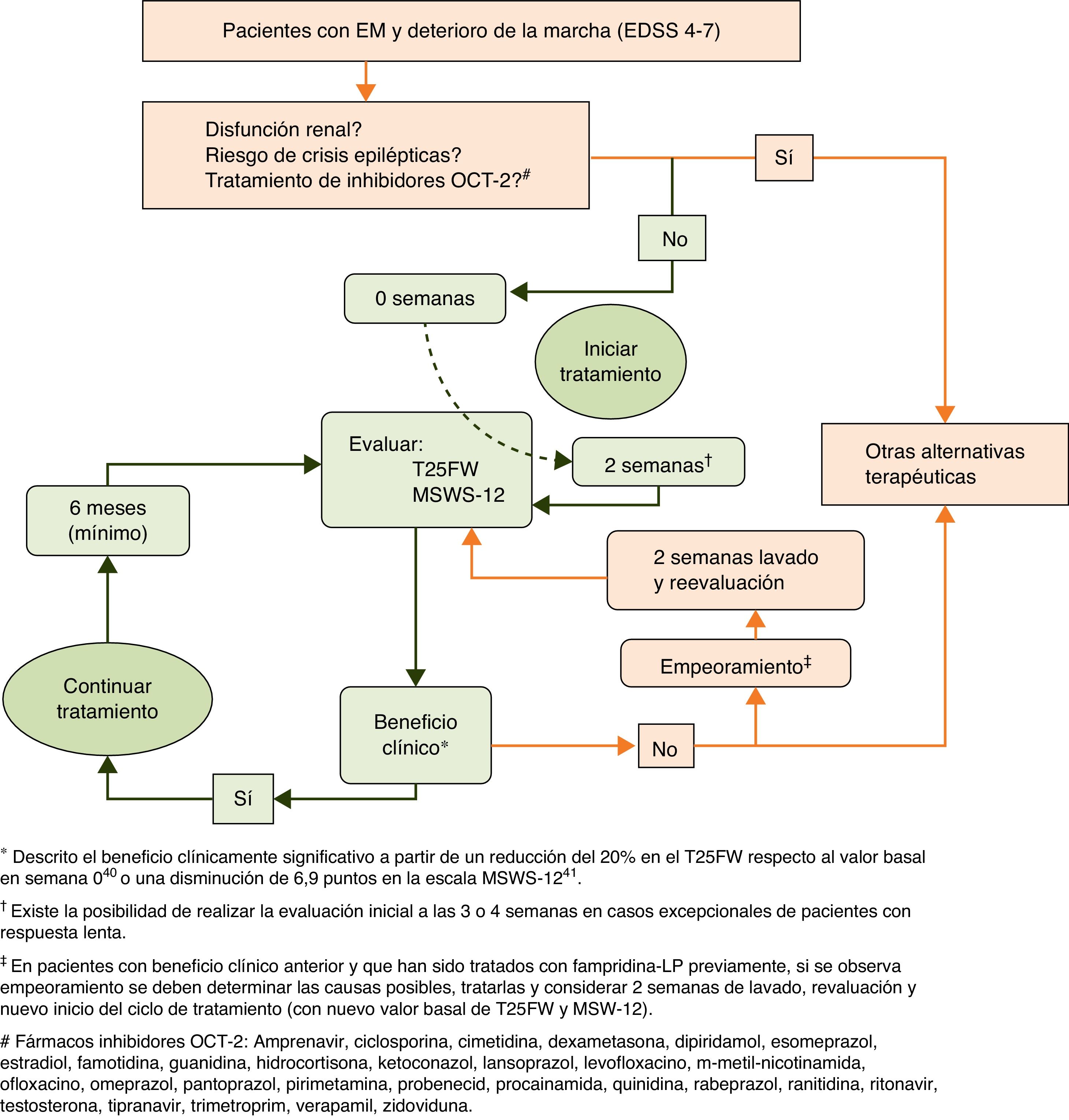
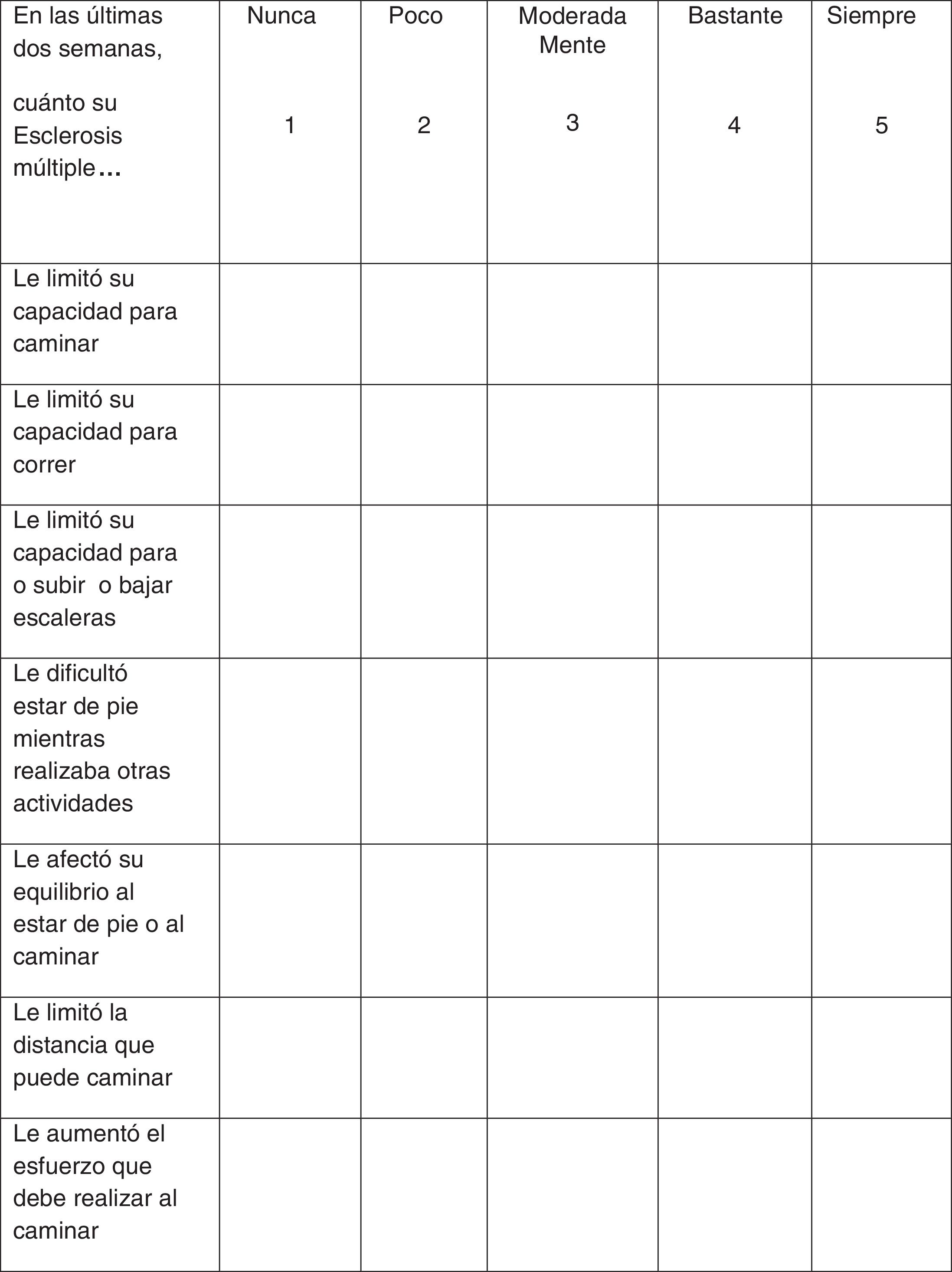
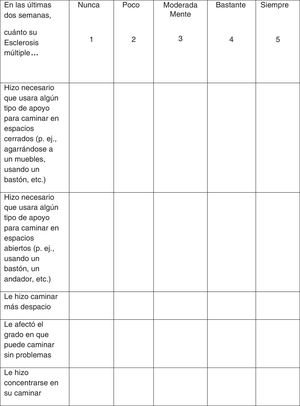
La evaluación de la respuesta al tratamiento se recomienda realizar a través de la prueba cronometrada de la marcha de 25 pies (T25FW, por sus siglas en inglés) y del cuestionario 12-item Multiple Sclerosis Walking Scale (MSWS-12) (fig. 1). Estas pruebas deben realizarse antes de iniciar el tratamiento para disponer de un valor basal de referencia y tras un período en tratamiento de forma que se pueda comparar y evaluar de forma objetiva la respuesta al mismo. Por otro lado, en los casos en los que se considere oportuno una evaluación de la evolución de la calidad de vida, en función del impacto que supone en ella el deterioro de la marcha, se recomienda utilizar el cuestionario de salud Short Form-36 (SF-36) y la escala MS Impact Scale-29 (MSIS-29)34-37.
Según las indicaciones de ficha técnica un paciente se considera respondedor y, por tanto, apto para continuar el tratamiento, si tras el período de evaluación presenta una disminución en el tiempo de la prueba T25FW38,39, que se ha descrito como clínicamente significativa a partir de una reducción del 20%40, o una disminución de la puntuación en la escala MSWS-1237, que se ha descrito como clínicamente significativa a partir de una reducción de 6,9 puntos41.
La recomendación es evaluar la respuesta inicial a fampridina-LP en 2 semanas, pues es el tiempo en el que generalmente ya pueden observarse los efectos beneficiosos sobre la marcha7,32,42. Se ha observado en la práctica clínica habitual que existen algunos pacientes con una respuesta lenta al fármaco. En estos casos, y de forma excepcional, se podría ampliar la evaluación inicial hasta 4 semanas. Si el paciente es respondedor, el tratamiento se debe continuar, y en caso contrario, suspenderlo.
Para los pacientes respondedores se recomienda revaluar la respuesta como mínimo cada 6 meses y valorarlo con respecto a la condición previa al inicio del tratamiento. Si en la revaluación a los 6 meses un paciente inicialmente respondedor deja de reflejar la mejoría en la marcha, fampridina-LP debería ser suspendida. En estos casos, se recomienda evaluar si ha habido algún proceso intercurrente relacionado con la propia enfermedad (brotes o progresión) o de otro origen (p. ej., infecciones u otros) que pudiera haber contribuido al deterioro de la marcha. Si fuera así, se recomienda, realizar el tratamiento pertinente del evento y tras un periodo de lavado de 2 semanas después de la discontinuación, iniciar de nuevo el ciclo de evaluación en base al nuevo valor basal de marcha (fig. 2).
Eficacia de fampridina de liberación prolongadaEnsayos clínicosLa eficacia de fampridina-LP ha sido demostrada en diferentes ensayos clínicos. El primer ensayo fue publicado por Schwid et al. en 10 pacientes con EM, comparando placebo con 17,5mg de fampridina-LP, administrada 2 veces al día, durante una semana43. Este trabajo demostró un efecto significativo positivo (p=0,02) en la velocidad de la marcha tras la administración de fampridina-LP, así como una tendencia a una mejoría de la fuerza muscular medida mediante la escala Lower Extremity Manual Muscle Test (LEMMT)43.
Los siguientes ensayos de efectividad de fampridina-LP fueron publicados por Goodman et al.44 después de determinar la seguridad de fampridina-LP con un ensayo de dosis-respuesta en 200745. Fue un ensayo aleatorizado, multicéntrico, doble ciego, controlado con placebo y de fase ii para examinar la eficacia y seguridad de 3 dosis diferentes (10, 15 y 20mg de fampridina-LP), administrada 2 veces al día, durante 15 semanas en 206 pacientes con EM44. Los resultados fueron que el porcentaje de pacientes con un aumento de >20% de la velocidad de la marcha en la prueba de T25FW fue del 12,8% en el grupo placebo y del 23,5, el 26,0 y el 15,8% en los grupos de 10, 15 y 20mg de fampridina-LP, respectivamente44. Los pacientes respondedores en los grupos de fampridina-LP mostraron una mejoría de velocidad que osciló entre el 25 y el 29%, mientras que en los pacientes con placebo el cambio fue del 4%. Se concluyó que la dosis más adecuada para el tratamiento era 10mg cada 12 h.
Posteriormente, se publicaron 2 ensayos de fase iii multicéntricos, doble ciego, controlados con placebo, que evaluaron la eficacia y la seguridad de fampridina-LP en pacientes con EM y alteración en la marcha7,42. En el primero se aleatorizó a 300 pacientes en proporción 3:1 a los que se administraron 10mg de fampridina-LP o placebo 2 veces al día durante 14 semanas. El 34,8% de pacientes con fampridina-LP fueron respondedores (con un aumento medio de la velocidad de marcha de un 25,2% y un cambio medio en la MSWS-12 de –6,8). En el grupo placebo fueron respondedores el 8,3% (con un aumento medio de la velocidad de marcha de un 4,7% y un cambio medio en la MSWS-12 de+1,4).
En el segundo ensayo clínico de fase iii se aleatorizó a en proporción 1:1 a 239 pacientes que tomaron 10mg de fampridina-LP o placebo 2 veces al día durante 9 semanas. Un total de 42,9% de pacientes con fampridina-LP fueron respondedores (aumento de la velocidad media de la marcha de un 24,7% y un cambio medio de la MSWS-12 de –6,04), comparado con un 15,3% de respondedores en el grupo placebo (aumento medio de la velocidad de marcha del 9,3% y un cambio medio de la MSWS-12 de+1,3)7.
Experiencia en práctica clínicaFampridina-LP fue autorizada en el 2010 en EE. UU. como tratamiento para mejorar la marcha de personas con cualquier forma de EM y en Europa en el 20118. A partir del año 2013 se publicaron los primeros estudios observacionales basados en la práctica clínica y siguiendo la ficha técnica de fampridina-LP.
En Alemania se realizó un estudio observacional abierto durante 9-12 meses que incluyó a 52 pacientes con EM, de los que el 58% permaneció en tratamiento al final del estudio por presentar un beneficio clínico demostrable, mantenían la adherencia al tratamiento y no se les había retirado la medicación por aparición de EA. Se observó una mejora en el T25FW y en la escala de fatiga de funciones motoras y cognitivas a las 2 semanas de iniciar el tratamiento y al final del seguimiento, la velocidad de la marcha (distancia máxima caminada/tiempo) a las 2 semanas y el Paced Auditory Symbols Audition Test (PASAT) al final del seguimiento46.
Cameron et al. publicaron los resultados de un estudio observacional de una cohorte de 39 pacientes tratados durante 12 meses en EE. UU.47. El 62% de los pacientes continuaron con el tratamiento después de 3-4 semanas y se observó una mejora significativa de las pruebas T25FW a las 6-8 semanas y del test MSWS-12 y en la distancia caminada en 2 min a las 6-8 semanas y al año47.
En un estudio observacional en Austria con 67 pacientes, el 71,6% de los pacientes continuaban con el tratamiento a los 6 meses, ya que percibían beneficio y no habían presentado EA48. A las 4 semanas de iniciar fampridina-LP, el 32,8% de los pacientes mejoró ≥ 20% en el T25FW y el 65,7% mejoró en el MSWS-12. Después de 6 meses, el 16,4% de los pacientes mejoró ≥ 20% en el T25FW, el 59,7% tuvo una mejoría en el MSWS-12 y los pacientes con beneficio clínico tuvieron una mejoría de un punto en promedio en la escala de gravedad de fatiga (FSS por sus siglas en inglés) y de 10 puntos en la MSWS-1248.
Calidad de vida con fampridina de liberación prolongadaTeniendo en cuenta que el deterioro de la marcha es uno de los síntomas más relevantes en la disminución de la CDVRS, su mejora puede tener efectos beneficiosos en los pacientes que responden a la terapia3,49.
La CDVRS en pacientes con EM se ha medido de manera fiable con los cuestionarios SF-3613,14 y EuroQol five-dimension (EQ-5D)50 que fueron diseñados para su aplicación en población general, y con las escalas MSIS-2951 y Patient Reported Outcome Indices for Multiple Sclerosis (PRIMUS)52 que son específicas para pacientes con EM. Utilizando la versión corta del SF-36 se observó que en el componente físico, los pacientes con deterioro de la marcha presentaban una CDVRS significativamente menor que los pacientes sin síntomas (p<0,001)53. Asimismo, se observó que los cambios de T25FW en pacientes con formas progresivas de la EM se asociaban a cambios positivos en el MSIS-2954.
En el estudio de Goodman et al.42, los 301 pacientes cumplimentaron el cuestionario MSWS-12 que evalúa la percepción subjetiva del paciente sobre las limitaciones para caminar durante las 2 semanas previas. Limone et al.55 convirtieron la puntuación del cuestionario MSWS-12 en puntuación EQ-5D y demostraron que los pacientes respondedores a fampridina-LP presentaban una mejoraría significativa en la CDVRS comparados con el grupo placebo, que se mantuvo durante el tratamiento y se perdió cuando el tratamiento fue suspendido. En los pacientes no respondedores no hubo diferencia con el grupo placebo a lo largo del estudio.
Recientemente, se ha publicado el estudio ENABLE56, fase iv abierto y multicéntrico, que evalúa la eficacia del tratamiento con fampridina-LP en la CDVRS de pacientes con EM respondedores al tratamiento tras 48 semanas. De un total de 901 pacientes estudiados, 707 (78,5%) fueron respondedores. Respecto al valor basal, en todas las visitas (semanas 12, 24, 36 y 48) los respondedores tuvieron una mejoría clínica estadísticamente significativa en la puntuación global de componente físico del SF-36 y en sus 8 subescalas, en la puntuación global del componente mental del SF-36 y en las puntuaciones de las escalas MSIS-29, PRIMUS (escala de limitaciones de actividad) y EQ-5D. Los pacientes no respondedores fueron seguidos a pesar de la discontinuación del tratamiento y, comparado con el valor basal, no mostraron ninguna mejoría significativa en ninguna de las visitas ni para ningún cuestionario.
También en los estudios de Cameron et al.47 como de Prugger y Berger48 se obtuvieron resultados positivos en las escalas que se utilizaron para medir la CDVRS.
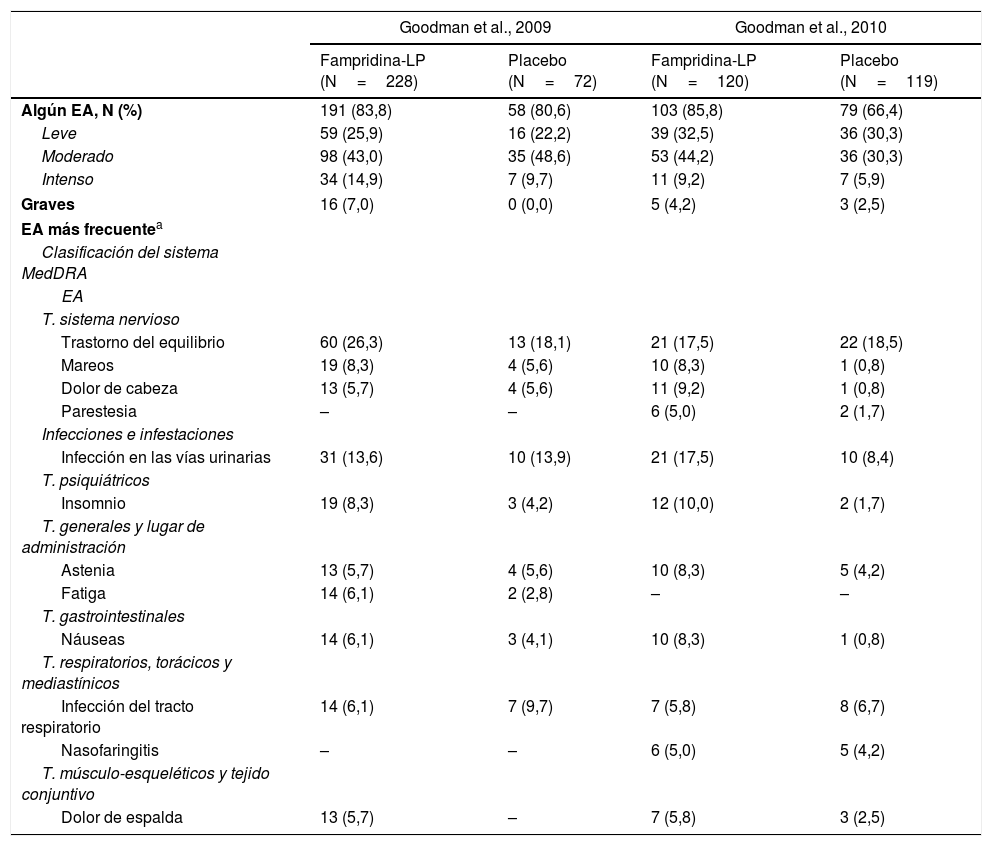
Seguridad de fampridina de liberación prolongadaEnsayos clínicosDel total de 539 pacientes con EM incluidos en los estudios de fase iii, 348 recibieron 10mg cada 12 h de fampridina-LP y 191 placebo (tabla 1)8. En el estudio más reciente, 103 pacientes (85,8%) en el grupo de fampridina-LP y 79 (66,4%) en el grupo placebo tuvieron algún EA (p<0,001). El EA más común fue la infección del tracto urinario y el trastorno del equilibrio, seguidos de insomnio, mareos, astenia, dolor de cabeza, náuseas y parestesias. En la mayoría de los pacientes los EA fueron leves (32,5% vs. 30,3% del placebo) o moderados (44,2% vs. 30,3% del placebo). Un 4,2% de los pacientes del grupo de fampridina-LP y un 2,5% de los pacientes del grupo de placebo presentaron un EAG. Las caídas se observaron en ambos grupos, con menor frecuencia en el de fampridina-LP que en el de placebo (11,7% vs. 16,8%, p=0,2724).
Resumen de efectos adversos en estudios clínicos de fase iii con dosis de 10mg de fampridina-LP, cada 12 h
| Goodman et al., 2009 | Goodman et al., 2010 | |||
|---|---|---|---|---|
| Fampridina-LP (N=228) | Placebo (N=72) | Fampridina-LP (N=120) | Placebo (N=119) | |
| Algún EA, N (%) | 191 (83,8) | 58 (80,6) | 103 (85,8) | 79 (66,4) |
| Leve | 59 (25,9) | 16 (22,2) | 39 (32,5) | 36 (30,3) |
| Moderado | 98 (43,0) | 35 (48,6) | 53 (44,2) | 36 (30,3) |
| Intenso | 34 (14,9) | 7 (9,7) | 11 (9,2) | 7 (5,9) |
| Graves | 16 (7,0) | 0 (0,0) | 5 (4,2) | 3 (2,5) |
| EA más frecuentea | ||||
| Clasificación del sistema MedDRA | ||||
| EA | ||||
| T. sistema nervioso | ||||
| Trastorno del equilibrio | 60 (26,3) | 13 (18,1) | 21 (17,5) | 22 (18,5) |
| Mareos | 19 (8,3) | 4 (5,6) | 10 (8,3) | 1 (0,8) |
| Dolor de cabeza | 13 (5,7) | 4 (5,6) | 11 (9,2) | 1 (0,8) |
| Parestesia | – | – | 6 (5,0) | 2 (1,7) |
| Infecciones e infestaciones | ||||
| Infección en las vías urinarias | 31 (13,6) | 10 (13,9) | 21 (17,5) | 10 (8,4) |
| T. psiquiátricos | ||||
| Insomnio | 19 (8,3) | 3 (4,2) | 12 (10,0) | 2 (1,7) |
| T. generales y lugar de administración | ||||
| Astenia | 13 (5,7) | 4 (5,6) | 10 (8,3) | 5 (4,2) |
| Fatiga | 14 (6,1) | 2 (2,8) | – | – |
| T. gastrointestinales | ||||
| Náuseas | 14 (6,1) | 3 (4,1) | 10 (8,3) | 1 (0,8) |
| T. respiratorios, torácicos y mediastínicos | ||||
| Infección del tracto respiratorio | 14 (6,1) | 7 (9,7) | 7 (5,8) | 8 (6,7) |
| Nasofaringitis | – | – | 6 (5,0) | 5 (4,2) |
| T. músculo-esqueléticos y tejido conjuntivo | ||||
| Dolor de espalda | 13 (5,7) | – | 7 (5,8) | 3 (2,5) |
AA: acontecimiento adverso; T: trastorno; N; número de pacientes; MedDRA: Diccionario Médico para Actividades Reguladoras.
En el conjunto de ensayos clínicos hubo un caso de crisis epiléptica con fampridina-LP y otro caso en el grupo placebo31,57.
Los ensayos clínicos de Goodman et al.7,42,44 presentaron periodos de extensiones de hasta 5 años de exposición a fampridina-LP, durante los cuales la tasa de crisis epilépticas fue de 4,1/1.000 pacientes/año, que es un riesgo similar al de la población general con EM58. A pesar de ello, y con los datos actuales, es preciso considerar otros factores adicionales, como la insuficiencia renal o la medicación concomitante, que pueden contribuir a aumentar el riesgo de aparición de convulsiones en estos pacientes2.
En relación con la posible cardiotoxicidad de fampridina-LP, March y Cardi llevaron a cabo un estudio en el que no registraron cambios clínicamente significativos en la frecuencia cardiaca ni en los intervalos QT, PR o QRS, ni utilizando las dosis habituales ni con dosis más elevadas de fampridina-LP59.
Experiencia en práctica clínicaJara et al.58 estudiaron los datos de seguridad poscomercialización en EE. UU. tras un año de exposición de 46.000 pacientes con EM tratados con fampridina-LP. En el estudio se identificaron un total de 11.549 EA y fueron consistentes con los descritos en los ensayos clínicos: mareos (5,7%), insomnio (4,5%), caídas y trastorno de equilibrio (3,9%), dolor de cabeza (3,2%), náuseas (2,8%) e infección urinaria (2,4%). Un total de 573 EA (5,0%) se produjeron como consecuencia de un uso inadecuado del fármaco. Hubo 85 casos de crisis epilépticas que en un 31% de los casos fueron durante la primera semana del inicio del tratamiento. La tasa de incidencia de convulsiones, tras la primera semana, fue de 3,9 casos por cada 1.000 pacientes/año de uso.
Aunque los datos de seguridad observados en la práctica clínica son coherentes con el perfil de seguridad observado durante el desarrollo clínico, es necesaria una vigilancia poscomercialización y a largo plazo para caracterizar correctamente el perfil completo de seguridad clínica de fampridina-LP.
ConclusionesLos ensayos clínicos y las observaciones derivadas de la práctica clínica habitual muestran que fampridina-LP es un fármaco bien tolerado, fácil de administrar y útil para el tratamiento del deterioro de la marcha. Está indicada en pacientes adultos con cualquier forma clínica de EM y una discapacidad en la escala EDSS entre 4,0 y 7,0.
Con la dosis de un comprimido de 10mg cada 12 h, los efectos adversos son transitorios y de naturaleza leve o moderada. Aunque los ensayos clínicos aleatorizados mostraron un beneficio clínico en el 35% de los pacientes, el estudio ENABLE y otros estudios observaciones en la práctica clínica muestran un beneficio en más del 50% de los pacientes. El grupo de pacientes respondedores se identifica fácilmente tras un período inicial de tratamiento de 2 semanas (excepcionalmente 4), lo que asegura que solo los pacientes con un beneficio clínico objetivo pueden seguir siendo tratados por más tiempo.
Aunque ya se dispone de datos a 3 años60, solo el seguimiento y los futuros estudios observacionales caracterizarán mejor el beneficio del fármaco sobre el trastorno de la marcha y sobre otros síntomas asociados a la EM, así como el perfil de seguridad del fármaco.
FinanciaciónLos autores no han recibido ninguna financiación específica para la realización de este manuscrito
Conflicto de interesesLluís Ramió-Torrentà ha recibido ayudas para investigación y congresos o compensaciones por asesorías en comités de Almirall, Bayer, Biogen, Genzyme, Merck-Serono, Novartis y TEVA.
José Carlos Álvarez-Cermeño ha recibido ayudas para investigación y congresos o compensaciones por asesorías en comités de Bayer, Biogen, Genzyme, Merck-Serono, Novartis y TEVA.
Rafael Arroyo ha recibido honorarios profesionales por conferenciante y por asesor científico de Almirall, Bayer, Biogen, Genzyme, Merck-Serono, Novartis, Roche, Sanofi y TEVA.
Bonaventura Casanova-Estruch ha recibido ayudas para investigación y congresos o compensaciones por asesorías en comités de Bayer, Biogen, Genzyme, Merck-Serono, Novartis y TEVA.
Oscar Fernández ha recibido honorarios como consultor y conferenciante, y financiación para la realización de ensayos clínicos y otros proyectos de investigación de Actelion, Almirall, Allergan, Bayer, Biogen, Merck-Serono, Novartis, Roche y TEVA.
Juan Antonio García-Merino ha recibido ayudas para investigación y congresos o compensaciones por asesorías en comités de Bayer, Biogen, Genzyme, Merck-Serono, Novartis y TEVA.
Miguel Ángel Hernández ha recibido ayudas para investigación y congresos o compensaciones por asesorías en comités de Almirall, Bayer, Biogen, Genzyme, Merck-Serono, Novartis y TEVA.
Guillermo Izquierdo ha recibido ayudas para investigación y congresos o consultorías de Almirall, Roche, Bayer, Biogen, Genzyme, Merck-Serono, Novartis y TEVA.
Sergio Martínez-Yélamos no declara conflictos de intereses.
José Meca ha recibido ayudas para congresos o consultorías de Almirall, Biogen, Genzyme, Merck-Serono, Novartis y TEVA.
Ester Moral no declara conflictos de intereses.
Javier Olascoaga ha recibido honorarios para conferencias, ayudas para congresos o consultorías, y becas de investigación de Biogen, Bayer, Genzyme, Merck-Serono, Novartis y TEVA.
José María Prieto ha recibido honorarios para conferencias, ayudas para congresos o consultorías, y becas de investigación de Bayer, Biogen, Genzyme, Novartis, Merck-Serono, Sanofi-Aventis, TEVA, Roche y Almirall.
Albert Saiz ha recibido ayudas para investigación y congresos o compensaciones por asesorías en comités de Bayer, Biogen, Genzyme, Merck, Novartis y TEVA.