El asma grave afecta del 3 al 10% de la población mundial, según estimaciones de la Iniciativa Global para el ASMA (GINA). El asma alérgica es uno de los fenotipos más comunes del asma grave y se caracteriza por una inflamación de tipo2 provocada por alérgenos y en el que la inmunoglobulinaE (IgE) es una mediadora clave, lo que la ha convertido en una diana terapéutica importante. La introducción de las terapias o de los tratamientos biológicos dirigidos ha supuesto la entrada del manejo del asma grave en la era de la medicina de precisión y que el objetivo del tratamiento aspirase a la remisión clínica de la enfermedad. Existe un porcentaje importante de pacientes con asma alérgica grave que no responden a los tratamientos y cuyos síntomas no están controlados. En este documento, un grupo de expertos en el manejo del asma alérgica grave ha revisado y evaluado la evidencia más relevante relativa a la fisiopatología y a los fenotipos del asma grave alérgica, la función de la IgE en la inflamación alérgica, la identificación de alérgenos, las técnicas, biomarcadores y retos diagnósticos y los tratamientos y estrategias disponibles para el manejo de la enfermedad, con un especial foco en los tratamientos biológicos. A partir de esta revisión se han desarrollado unas recomendaciones que han sido validadas a través de un proceso de consenso Delphi con el objetivo de ofrecer mejoras en el manejo del asma alérgica grave a los profesionales implicados e identificar las necesidades no cubiertas en el manejo de esta patología.
Severe asthma affects 3%-10% of the world's population, according to estimates by the Global Initiative for ASTHMA (GINA). Allergic asthma is one of the most common phenotypes of severe asthma and it is characterized by allergen-induced type2 inflammation in which immunoglobulinE (IgE) is a key mediator, making it an important therapeutic target. The introduction of targeted biological therapies or treatments has entered the management for severe asthma in the era of precision medicine, and the goal of treatment is clinical remission of the disease. There is a significant percentage of patients with severe allergic asthma who do not respond to treatments and whose symptoms are not controlled. In this paper, a group of experts in the management of severe allergic asthma reviewed and evaluated the most relevant evidence regarding the pathophysiology and phenotypes of severe allergic asthma, the role of IgE in allergic inflammation, allergen identification, techniques, biomarkers and diagnostic challenges, available treatments and strategies for disease management, with a special focus on biological treatments. From this review, recommendations were developed and validated through a Delphi consensus process with the aim of offering improvements in the management of severe allergic asthma to the professionals involved and identifying the unmet needs in the management of this pathology.
El fenotipo alérgico del asma se caracteriza por una inflamación eosinofílica de las vías respiratorias, en respuesta mediada por la inmunoglobulinaE (IgE) contra los alérgenos a los que previamente se ha sensibilizado el paciente, que conduce a diversas alteraciones, como la hiperreactividad y la remodelación de las vías respiratorias1. El asma alérgica (AA) afecta aproximadamente a dos tercios de todos los pacientes con asma y, según las cohortes de pacientes analizadas, puede afectar a más del 50% de los pacientes con asma grave (AG)2,3. A pesar de ello, y aunque se ha mejorado notablemente en el conocimiento de su fisiopatología, de su relevancia clínica, en el diagnóstico específico y en el tratamiento, existen distintos aspectos del AA que todavía generan controversia, y sobre los que la evidencia publicada es escasa o insuficiente.
Este trabajo tiene como objetivo identificar las necesidades no cubiertas en el conocimiento y en el manejo del asma alérgica grave (AAG), sobre todo en aquellos aspectos en los que la evidencia no es suficientemente robusta, así como responder a esas necesidades ofreciendo una serie de recomendaciones consensuadas desde el punto de vista experto.
MétodosEste trabajo se llevó a cabo siguiendo la metodología de consensos desarrollada por la RAND/UCLA4. El Grupo Elaborador de Recomendaciones (GER) estuvo compuesto por 3 alergólogos y 2 neumólogos (2 coordinadores y 3 asesores) con experiencia en el manejo del paciente con AAG. En la primera reunión el GER definió los conceptos a desarrollar en el consenso, a partir de los cuales se realizó una revisión de la literatura en las bases de datos PubMed (cierre de datos: mayo de 2022). A partir de la evidencia extraída, el GER formuló los enunciados relativos a los conceptos definidos anteriormente.
Un panel de 40 expertos en AAG (20 alergólogos y 20 neumólogos) evaluó 37 enunciados propuestos en un cuestionario online a través de un proceso iterativo tipo Delphi en dos rondas según una escala Likert de 1 a 9 (1: totalmente en desacuerdo; 9: totalmente de acuerdo)4. El 95% de los enunciados propuestos entre la primera y la segunda ronda Delphi fueron consensuados por el panel de expertos.
Papel de la IgE en el AAGLa IgE tiene un papel pleiotrópico que la sitúa en el centro de la fisiopatología del proceso inflamatorio del AAG y su acción es clave desde el comienzo de la enfermedad y durante todo su desarrollo. Su función biológica está relacionada con su capacidad de influir en el funcionamiento del sistema inmune y de distintas células estructurales implicadas en la patogenia de inflamación alérgica crónica a través de su interacción con receptores específicos: los receptores de alta afinidad (FcɛRI) y los de baja afinidad (CD23 o FcɛRII). Los receptores FcɛRI se expresan en mastocitos y basófilos, en células dendríticas (CD), en células del músculo liso de las vías respiratorias (MLVR), en células epiteliales y en eosinófilos5,6.
En el AAG, tanto la IgE como los eosinófilos participan en un complejo proceso en el que ejercen distintas funciones. En el AA, este proceso está mediado principalmente por quimiocinas e interleucinas como la IL-5, producidas por células Th2 de memoria específicas de alérgenos, previamente activadas por un mecanismo IgE-dependiente, por lo que podría considerarse que la IgE es la causa del AA, mientras que la eosinofilia es una consecuencia del proceso7.
Se ha demostrado que los eosinófilos en sangre expresan todas las cadenas de los receptores FcɛRI y FcɛRII y, por tanto, pueden ser diana de los anticuerpos IgE8. La tabla 1 resume los efectos de la IgE sobre la función de los eosinófilos. Se ha demostrado que el tratamiento con el anticuerpo monoclonal humanizado contra la IgE, omalizumab, induce la apoptosis de los eosinófilos reafirmando el efecto directo que ejerce la IgE sobre estas células9.
Efectos directos de la IgE sobre las funciones de los eosinófilos
| Acciones mediadas por FcɛRI | Acciones mediadas por FcɛRII |
|---|---|
| • Activación y desgranulación• Liberación de peroxidasa | • Expresión de integrinas (aumento de la migración tisular) y prolongación de la supervivencia celular• Liberación de TNF-α |
FcɛR: receptor de alta afinidad de inmunoglobulina E; FcɛRII: receptor de baja afinidad de la inmunoglobulina E o CD23; TNF-α: factor de necrosis tumoral alfa.
Fuente: modificada de Matucci et al.8.
La IgE también actúa sobre las células epiteliales de las vías respiratorias que expresan receptores de IgE de alta y baja afinidad, y que intervienen en el transporte de complejos IgE-alérgeno a través de la barrera mucosa de las vías respiratorias10. Dado que las células epiteliales son las primeras expuestas a los alérgenos inhalados, su función es clave en el inicio de la inflamación alérgica. Varios estudios han identificado diversas citocinas derivadas del epitelio de la vía aérea, como IL-25, IL-33 y la linfopoyetina estromal tímica (TSLP), que están implicadas en la patogenia del asma8. Los enunciados relacionados que han sido encontrados como apropiados por el panel se pueden ver en la tabla 2, enunciados 1-3.
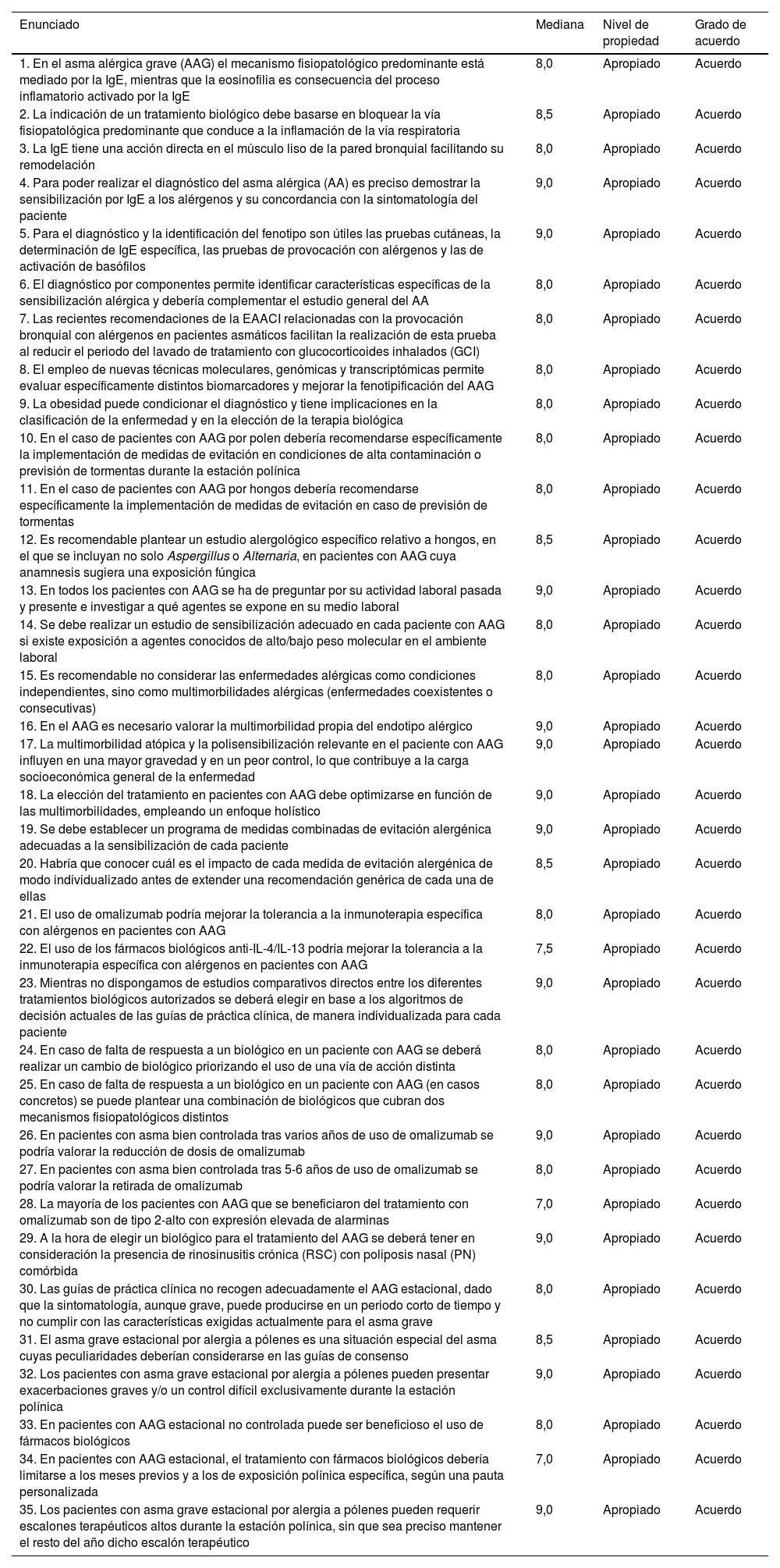
Recomendaciones aprobadas tras su validación por el panel Delphi
| Enunciado | Mediana | Nivel de propiedad | Grado de acuerdo |
|---|---|---|---|
| 1. En el asma alérgica grave (AAG) el mecanismo fisiopatológico predominante está mediado por la IgE, mientras que la eosinofilia es consecuencia del proceso inflamatorio activado por la IgE | 8,0 | Apropiado | Acuerdo |
| 2. La indicación de un tratamiento biológico debe basarse en bloquear la vía fisiopatológica predominante que conduce a la inflamación de la vía respiratoria | 8,5 | Apropiado | Acuerdo |
| 3. La IgE tiene una acción directa en el músculo liso de la pared bronquial facilitando su remodelación | 8,0 | Apropiado | Acuerdo |
| 4. Para poder realizar el diagnóstico del asma alérgica (AA) es preciso demostrar la sensibilización por IgE a los alérgenos y su concordancia con la sintomatología del paciente | 9,0 | Apropiado | Acuerdo |
| 5. Para el diagnóstico y la identificación del fenotipo son útiles las pruebas cutáneas, la determinación de IgE específica, las pruebas de provocación con alérgenos y las de activación de basófilos | 9,0 | Apropiado | Acuerdo |
| 6. El diagnóstico por componentes permite identificar características específicas de la sensibilización alérgica y debería complementar el estudio general del AA | 8,0 | Apropiado | Acuerdo |
| 7. Las recientes recomendaciones de la EAACI relacionadas con la provocación bronquial con alérgenos en pacientes asmáticos facilitan la realización de esta prueba al reducir el periodo del lavado de tratamiento con glucocorticoides inhalados (GCI) | 8,0 | Apropiado | Acuerdo |
| 8. El empleo de nuevas técnicas moleculares, genómicas y transcriptómicas permite evaluar específicamente distintos biomarcadores y mejorar la fenotipificación del AAG | 8,0 | Apropiado | Acuerdo |
| 9. La obesidad puede condicionar el diagnóstico y tiene implicaciones en la clasificación de la enfermedad y en la elección de la terapia biológica | 8,0 | Apropiado | Acuerdo |
| 10. En el caso de pacientes con AAG por polen debería recomendarse específicamente la implementación de medidas de evitación en condiciones de alta contaminación o previsión de tormentas durante la estación polínica | 8,0 | Apropiado | Acuerdo |
| 11. En el caso de pacientes con AAG por hongos debería recomendarse específicamente la implementación de medidas de evitación en caso de previsión de tormentas | 8,0 | Apropiado | Acuerdo |
| 12. Es recomendable plantear un estudio alergológico específico relativo a hongos, en el que se incluyan no solo Aspergillus o Alternaria, en pacientes con AAG cuya anamnesis sugiera una exposición fúngica | 8,5 | Apropiado | Acuerdo |
| 13. En todos los pacientes con AAG se ha de preguntar por su actividad laboral pasada y presente e investigar a qué agentes se expone en su medio laboral | 9,0 | Apropiado | Acuerdo |
| 14. Se debe realizar un estudio de sensibilización adecuado en cada paciente con AAG si existe exposición a agentes conocidos de alto/bajo peso molecular en el ambiente laboral | 8,0 | Apropiado | Acuerdo |
| 15. Es recomendable no considerar las enfermedades alérgicas como condiciones independientes, sino como multimorbilidades alérgicas (enfermedades coexistentes o consecutivas) | 8,0 | Apropiado | Acuerdo |
| 16. En el AAG es necesario valorar la multimorbilidad propia del endotipo alérgico | 9,0 | Apropiado | Acuerdo |
| 17. La multimorbilidad atópica y la polisensibilización relevante en el paciente con AAG influyen en una mayor gravedad y en un peor control, lo que contribuye a la carga socioeconómica general de la enfermedad | 9,0 | Apropiado | Acuerdo |
| 18. La elección del tratamiento en pacientes con AAG debe optimizarse en función de las multimorbilidades, empleando un enfoque holístico | 9,0 | Apropiado | Acuerdo |
| 19. Se debe establecer un programa de medidas combinadas de evitación alergénica adecuadas a la sensibilización de cada paciente | 9,0 | Apropiado | Acuerdo |
| 20. Habría que conocer cuál es el impacto de cada medida de evitación alergénica de modo individualizado antes de extender una recomendación genérica de cada una de ellas | 8,5 | Apropiado | Acuerdo |
| 21. El uso de omalizumab podría mejorar la tolerancia a la inmunoterapia específica con alérgenos en pacientes con AAG | 8,0 | Apropiado | Acuerdo |
| 22. El uso de los fármacos biológicos anti-IL-4/IL-13 podría mejorar la tolerancia a la inmunoterapia específica con alérgenos en pacientes con AAG | 7,5 | Apropiado | Acuerdo |
| 23. Mientras no dispongamos de estudios comparativos directos entre los diferentes tratamientos biológicos autorizados se deberá elegir en base a los algoritmos de decisión actuales de las guías de práctica clínica, de manera individualizada para cada paciente | 9,0 | Apropiado | Acuerdo |
| 24. En caso de falta de respuesta a un biológico en un paciente con AAG se deberá realizar un cambio de biológico priorizando el uso de una vía de acción distinta | 8,0 | Apropiado | Acuerdo |
| 25. En caso de falta de respuesta a un biológico en un paciente con AAG (en casos concretos) se puede plantear una combinación de biológicos que cubran dos mecanismos fisiopatológicos distintos | 8,0 | Apropiado | Acuerdo |
| 26. En pacientes con asma bien controlada tras varios años de uso de omalizumab se podría valorar la reducción de dosis de omalizumab | 9,0 | Apropiado | Acuerdo |
| 27. En pacientes con asma bien controlada tras 5-6 años de uso de omalizumab se podría valorar la retirada de omalizumab | 8,0 | Apropiado | Acuerdo |
| 28. La mayoría de los pacientes con AAG que se beneficiaron del tratamiento con omalizumab son de tipo 2-alto con expresión elevada de alarminas | 7,0 | Apropiado | Acuerdo |
| 29. A la hora de elegir un biológico para el tratamiento del AAG se deberá tener en consideración la presencia de rinosinusitis crónica (RSC) con poliposis nasal (PN) comórbida | 9,0 | Apropiado | Acuerdo |
| 30. Las guías de práctica clínica no recogen adecuadamente el AAG estacional, dado que la sintomatología, aunque grave, puede producirse en un periodo corto de tiempo y no cumplir con las características exigidas actualmente para el asma grave | 8,0 | Apropiado | Acuerdo |
| 31. El asma grave estacional por alergia a pólenes es una situación especial del asma cuyas peculiaridades deberían considerarse en las guías de consenso | 8,5 | Apropiado | Acuerdo |
| 32. Los pacientes con asma grave estacional por alergia a pólenes pueden presentar exacerbaciones graves y/o un control difícil exclusivamente durante la estación polínica | 9,0 | Apropiado | Acuerdo |
| 33. En pacientes con AAG estacional no controlada puede ser beneficioso el uso de fármacos biológicos | 8,0 | Apropiado | Acuerdo |
| 34. En pacientes con AAG estacional, el tratamiento con fármacos biológicos debería limitarse a los meses previos y a los de exposición polínica específica, según una pauta personalizada | 7,0 | Apropiado | Acuerdo |
| 35. Los pacientes con asma grave estacional por alergia a pólenes pueden requerir escalones terapéuticos altos durante la estación polínica, sin que sea preciso mantener el resto del año dicho escalón terapéutico | 9,0 | Apropiado | Acuerdo |
AA: asma alérgica; AAG: asma alérgica grave; EAACI: European Academy of Allergy and Clinical Immunology; IgE: inmunoglobulina E.
En el AG de perfil T2 alto, el fenotipo alérgico es el más prevalente y su diagnóstico requiere tanto la demostración de la sensibilización por IgE a los aeroalérgenos como la concordancia entre la sensibilización y la sintomatología. En ocasiones puede ser necesaria una prueba de provocación con alérgenos para identificar a los pacientes con AA y diferenciarlos de los que no presentan una respuesta clínica aparente. Sin embargo, estas pruebas se han considerado habitualmente como herramientas de investigación, y los protocolos existentes se adaptan a los pacientes asmáticos leves y no están diseñadas para ser realizadas en asmáticos moderados o graves. El diagnóstico correcto del fenotipo alérgico del asma ayuda a seleccionar a los pacientes candidatos para terapias inmunomoduladoras. Así la inmunoterapia con alérgenos (allergen immunotherapy [AIT]), sublingual o subcutánea, está recomendada por las guías internacionales de manejo de asma para pacientes con AA controlada o parcialmente controlada provocada por los ácaros del polvo doméstico (house dust mites [HDM]) y que presentan un volumen espirado forzado en 1segundo (FEV1) >70%11, así como también con alto nivel de evidencia, en el caso de ser provocada por polen de gramíneas12, entre otros alérgenos. En este escenario, es de gran interés el poder realizar un fenotipado correcto a los pacientes con AAG, lo que en algunos casos puede requerir la realización de pruebas de provocación específicas. El documento de posicionamiento del grupo de trabajo de la European Academy of Allergy & Clinical Immunology (EACCI)13, tras una revisión actualizada de la literatura, ha propuesto cambios metodológicos en la prueba de provocación, como un periodo de lavado de corticoides inhalados considerablemente más corto y la posibilidad de poder realizar estas pruebas en pacientes con AAG. Su aplicación clínica se traduciría en un mejor fenotipado del asma en la vida real y en una selección más precisa de los pacientes candidatos a recibir terapias inmunomoduladoras. Los enunciados relacionados que han sido encontrados como apropiados por el panel se pueden ver en la tabla 2, enunciados 4-7.
Biomarcadores de diagnóstico generalLa presentación heterogénea del asma y de la alergia respiratoria necesita herramientas de diagnóstico precisas. Los biomarcadores son características objetivas y cuantificables de un proceso biológico. Su uso riguroso es recomendable en la evaluación de una patología como el AAG, en la que la mayoría de las características que definen los distintos fenotipos incluyen factores clínicos y factores inflamatorios inespecíficos. En la actualidad, los biomarcadores disponibles para el AAG son básicamente la IgE total y específica, la eosinofilia, la linfopoyetina estromal tímica (TSLP) y la fracción exhalada de óxido nítrico (FENO), que son útiles a la hora de seleccionar el tratamiento biológico más adecuado (anti-IgE, anti-IL-5/IL-5R, o más recientemente anti-IL-4/IL-13) para pacientes en los que la enfermedad no se ha logrado controlar en un escalón terapéutico anterior. La determinación del valor predictivo de gravedad futura en el asma moderada para estos biomarcadores ayudaría a valorar el inicio precoz de un tratamiento específico, o la interrupción de un tratamiento en caso de que la enfermedad estuviera totalmente controlada.
En el artículo de Cremades-Jimeno et al. (2021)14 se estudió un grupo de biomarcadores que podrían ser útiles para la distinción de fenotipos clínicos (es decir, AA, asma no alérgica [ANA] o alergia respiratoria sin asma [AR]) y para determinar la gravedad de la enfermedad. El análisis mecanístico realizado identificó 17 proteínas fuertemente relacionadas con el AA, 11 asociadas a la AR y 16 al ANA, de las que 12 proteínas eran específicas del AA, 7 de la AR y 2 del ANA.
Biomarcadores de fenotipo y gravedad del AGEn el reciente trabajo de Sun et al. (2022)15 se comparó el perfil de expresión de citoquinas séricas entre pacientes con AA de diverso grado de gravedad y se buscaron biomarcadores útiles para el seguimiento de la enfermedad y la elección de agentes terapéuticos. En este estudio se concluyó que las proteínas YKL-40, eotaxina-1 y MCP-1 podrían ser biomarcadores candidatos para reflejar la gravedad de los pacientes con AA.
Beuraud et al. (2019)16 analizaron los linfocitos tipo2 (type 2 innate lymhoid cells [ILC2]) positivos para CCR10 (CCR10+) en la sangre de individuos sanos o de pacientes con AA y ANA, concluyendo que los ILC2 CCR10+ circulantes y las concentraciones plasmáticas de CCL27 se asociaban con la gravedad del asma.
Gaballah et al. (2018)17 investigaron la posible contribución a la patogénesis del asma atópica de la señalización de nucleotide-binding oligomerization domain containing 2 (NOD2), las citocinas proinflamatorias, la quitotriosidasa1 (chitotriosidase-1 [CHIT1]), el aumento del estrés oxidativo y el daño del ADN. Los autores concluyeron que la inflamación alérgica de las vías respiratorias era mediada por la interacción entre todos ellos, contribuyendo así a la patogénesis del asma atópica. Esta combinación de variables podría constituir un nuevo panel de biomarcadores no invasivos útil para la monitorización de la gravedad del asma.
La posible afectación de los niveles de biomarcadores T2 por el índice de masa corporal (IMC) fue investigada en el estudio recientemente publicado por Sharma et al. (2023)18. El estudio concluyó que la obesidad afectaba a los niveles de biomarcadoresT2 con las consiguientes implicaciones que esto tiene en el momento de diagnosticar la enfermedad y seleccionar la terapia biológica más adecuada. Discriminar si esto se debe a un enmascaramiento del estado subyacente de T2-alto o al desarrollo de un endotipo verdaderamente T2-bajo requiere una investigación más profunda. Los enunciados relacionados que han sido encontrados como apropiados se pueden ver en la tabla 2, enunciados 8-9.
AlérgenosLos aeroalérgenos son responsables de las características clínicas y de gravedad del AAG. Además, su expresión clínica está asociada con el período de exposición ambiental al alérgeno y la zona geográfica en la que reside el paciente19. Cualquier aeroalérgeno puede inducir el desarrollo del AAG. Además, la exposición a alérgenos es una causa frecuente de exacerbaciones en pacientes alérgicos, especialmente si concurre con una infección vírica.
Alérgenos de exteriorLa exposición al polen de las personas sensibilizadas provoca una inflamación de la vía respiratoria20,21, y esta respuesta puede desencadenarse posteriormente ante una exposición en menor grado22.
Además, la intensidad de la alergia al polen y su efecto en la vía respiratoria, así como el inicio y la duración de las estaciones polínicas, se ven afectados por el impacto de los contaminantes ambientales23,24, y se ha observado que el cambio climático impacta en la composición molecular del polen y en sus niveles25,26.
Las tormentas eléctricas pueden favorecer la concentración en el ambiente de aeroalérgenos, como ocurre más comúnmente con el polen de gramíneas, otros pólenes y esporas de mohos. Su inhalación en altas concentraciones por individuos sensibilizados puede inducir respuestas asmáticas tempranas que pueden seguirse de una fase inflamatoria tardía y del consiguiente desarrollo de exacerbaciones26,27.
Alérgenos de interiorSe ha demostrado que la presencia de sensibilización a los ácaros del polvo doméstico (HDM), y particularmente la respuesta a nivel de IgE a las moléculas del ácaro Dermatophagoides pteronyssinus Derp1 o Derp23 son factores predictores de desarrollo de asma en edad escolar28. Se ha descrito la dominancia de los alérgenos del grupo2 de los HDM, tales como Derp2, en pacientes con asma T2 de moderada a grave29, que podría ser igualmente relevante en niños con AA a los HDM30. Derp37, un nuevo alérgeno identificado de 26kDa con homología a las proteínas de unión a la quitina, puede ser un marcador sustituto para presentar niveles significativamente más altos de IgE frente a los principales alérgenos de HDM, reaccionar con más alérgenos de HDM y mayor riesgo de asma31.
La sensibilización alérgica a los hongos está mediada por la respuesta inmune adaptativa que activa a las células Th2, y por la respuesta inmune innata activada tras daño en el epitelio32,33. En niños, los hongos del género Alternaria y, en menor medida, del género Cladosporium son los que se asocian más frecuentemente al asma y a las exacerbaciones incluso graves de la enfermedad34,35, un efecto que puede verse aumentado en el contexto del cambio climático26. En adultos, los géneros Aspergillus y Penicillium son los agentes causantes de asma, muchas veces grave, como consecuencia de la respuesta alérgica a los filamentos termorresistentes de los hongos, que además pueden colonizar y germinar en las vías respiratorias, generando en algunos casos un estímulo alérgico persistente que puede derivar en daño tisular. Algunos otros géneros, como Candida, Malassezia o Trichophyton, también son capaces de generar respuestas mediadas por IgE, pero se desconoce todavía su verdadera implicación en el desarrollo del AG36.
La alergia y la exposición prolongada a mascotas (particularmente la exposición a gato) también se asocian a un mayor riesgo de desarrollar asma y de exacerbaciones, y a una peor evolución clínica y un peor control de la enfermedad37. Los altos niveles de IgE específica inducida por la exposición a gatos, perros y caballos y la polisensibilización a los tres animales se definen como marcadores de asma más grave38. La proteína Feld1, presente en los gatos y responsable del 95% de las reacciones alérgicas de los pacientes alérgicos a gatos, puede tener un diámetro <5μm, lo que favorece que pueda alcanzar bronquiolos pequeños e inducir asma. La sensibilización a más de un alérgeno de perros y caballos se asocia con el desarrollo de rinitis y asma más graves. En el ámbito del asma laboral, la asociación entre la exposición a alérgenos de roedores y el asma ya era bien conocida, pero el aumento de la exposición a roedores considerados como animales de compañía ha contribuido al aumento de la incidencia de AA, y existen estudios que demuestran el empeoramiento en la función pulmonar y el aumento del número de exacerbaciones en individuos expuestos39. Los enunciados relacionados que han sido encontrados como apropiados por el panel se pueden ver en la tabla 2, enunciados 10-12.
Asma ocupacionalActualmente sigue existiendo un importante retraso en la identificación y en el diagnóstico del asma relacionada con el trabajo, lo que hace necesaria una adecuada educación orientada a conocer los potenciales agentes causantes para favorecer la detección y el diagnóstico tempranos de la enfermedad40.
En un metaanálisis se analizaron los diferentes métodos inmunológicos para el diagnóstico y la monitorización de la alergia a agentes industriales mediada por IgE usados actualmente41 y se confirmó una buena sensibilidad y especificidad frente a agentes de alto peso molecular. Sin embargo, para los agentes de bajo peso molecular se observó una sensibilidad muy baja y una especificidad alta. Por tanto, un resultado negativo no excluye la relación causal entre un agente sensibilizante y el desarrollo de asma. Aún no se conocen en profundidad los perfiles o fenotipos del asma ocupacional inducida por agentes de alto y bajo peso molecular, pero parece que pueden existir diferencias a nivel clínico, funcional e inflamatorio42.
Los metales y los disolventes son agentes que se comportan como sensibilizadores y/o irritantes de bajo peso molecular. Algunos están bien identificados y es posible realizar estrategias de evitación/control; sin embargo, la incorporación de nuevos productos a la industria hace necesario actualizar la identificación de nuevos agentes potencialmente causales para poder evitar exposiciones y el desarrollo de enfermedades43. Los enunciados relacionados que han sido encontrados como apropiados por el panel se pueden encontrar en la tabla 2, enunciados 13-14.
ComorbilidadesComorbilidad y multimorbilidadEn el AAG, además de las comorbilidades del asma, a menudo coexisten diferentes enfermedades que comparten un mecanismo fisiopatológico inflamatorio subyacente común, lo que lleva al concepto de alergia como enfermedad sistémica44. El término multimorbilidad se utiliza para indicar el agrupamiento y la coexistencia de enfermedades con un mecanismo patológico común, cuando la enfermedad primaria no está clara. De esta manera, se considera que el AAG se interrelaciona con multimorbilidades atópicas como son la rinitis/rinoconjuntivitis alérgica, la dermatitis atópica (DA), la alergia a alimentos o la esofagitis eosinofílica (EE)45.
La asociación de asma y multimorbilidad alérgica (sobre todo rinitis y eccema) se ha relacionado con una mayor carga de síntomas respiratorios, un peor control del asma y una mayor afectación en la calidad de vida en comparación con los sujetos que solo presentan asma, aun con niveles similares de marcadores inflamatorios de tipo246.
Necesidades no cubiertas en el diagnóstico de comorbilidadesLos niveles elevados de IgE total se han asociado con la ocurrencia de más de una afección alérgica47, al igual que ocurre con los niveles elevados de FENO, aunque no en todos los casos46. En la asociación de rinitis y AAG sería útil conocer los niveles de óxido nítrico de cada tramo del árbol respiratorio, ya que la disfunción de las vías respiratorias periféricas en pacientes con rinitis alérgica es bastante similar a la descrita en el asma48.
Es preciso disponer de una metodología diagnóstica adecuada que valore la relevancia de los alérgenos implicados, ya que la sensibilización alérgica no es una variable dicotómica47,49. Además, existen importantes diferencias clínicas e inmunológicas entre los pacientes mono- y polisensibilizados, siendo este último fenotipo el más frecuente entre pacientes con multimorbilidad47 y con asma moderada o grave50. La polisensibilización con relevancia clínica (polialergia) y la multimorbilidad se asocian con la frecuencia, la persistencia y la gravedad de los síntomas alérgicos45. Los enunciados relacionados que han sido encontrados como apropiados por el panel se pueden ver en la tabla 2, enunciados 15-18.
Tratamiento y manejoMedidas de evitaciónTomando como ejemplo el plan nacional llevado a cabo en Finlandia durante 10años, parece que cambiar la estrategia de evitación tradicional y proporcionar educación a gran escala puede ayudar a conseguir la tolerancia alergénica en la población y reducir así su impacto51. En las guías de práctica clínica (GPC) se recomienda evitar o minimizar la exposición a los alérgenos ante los que el paciente está sensibilizado52. Esta recomendación abarca medidas generales que incluyen el uso de barreras físicas, la reducción de los reservorios alergénicos, la regulación de la humedad y de la temperatura, la utilización de filtros de alta eficiencia (HEPA) y la evitación de las fuentes alergénicas.
InmunoterapiaLa AIT específica con alérgenos es útil en la enfermedad respiratoria alérgica49 y puede ser un tratamiento eficaz para el AA bien controlada, siempre que se haya demostrado una sensibilización mediada por IgE frente a aeroalérgenos comunes que sea clínicamente relevante y se utilicen extractos bien caracterizados y estandarizados53. Sin embargo, su uso está contraindicado en el AAG no controlada, ya que pueden tener un mayor riesgo de reacciones adversas graves54.
Estos pacientes, con una mayor tasa de mal control de la enfermedad, pueden tener un mayor riesgo de reacciones adversas sistémicas. Existen algunos trabajos que analizan el uso de fármacos biológicos (omalizumab en la mayoría de los casos publicados) en pacientes con AAG alérgica55,56 para lograr un adecuado control de la enfermedad como tratamiento previo a la AIT57. Los enunciados relacionados que han sido encontrados como apropiados por el panel se pueden ver en la tabla 2, enunciados 19-22. Por el contrario, el enunciado1 de la tabla 3 no fue validado por el panel.
Recomendaciones no aprobadas tras su validación por el panel Delphi
| Enunciado | Mediana | Nivel de propiedad | Grado de acuerdo |
|---|---|---|---|
| 1. El uso de los fármacos biológicos anti-IL-5/IL-5R, al mejorar el control del asma, podría aumentar la tolerancia a la inmunoterapia específica con alérgenos en pacientes con AAG | 6,0 | Dudoso | Desacuerdo |
| 2. El tratamiento con omalizumab en los pacientes con AAG beneficia más a los que presentan síntomas más graves e inflamación eosinofílica más acentuada | 7,0 | Apropiado | Neutral |
AAG: asma alérgica grave; IL-5/IL-5R: interleucina 5/receptor de la interleucina 5.
En la última década hemos asistido a la revolución que ha supuesto el tratamiento del AG con anticuerpos monoclonales y ya disponemos de GPC11,58 y consensos12,59 que nos ayudan y orientan en la elección del biológico según su fenotipo. No obstante, no disponemos de un algoritmo unificado y consensuado por todos los profesionales que tratan el AG.
En la actualidad existen comparativas indirectas y metaanálisis que pretenden identificar diferencias entre los tratamientos biológicos con anticuerpos monoclonales, pero no disponemos de comparativas directas entre dos biológicos en una misma población54,60.
También existen análisis post hoc de ensayos clínicos aleatorizados (ECA) para identificar factores predictores de respuesta o analizar la respuesta entre distintos subgrupos de pacientes. Estos análisis han demostrado que existe una respuesta variable pero eficaz con los diferentes tratamientos biológicos61-63.
Existe evidencia adicional de casos y series sobre la respuesta a un determinado biológico tras el fallo a uno previo (switch), e incluso casos de éxito al combinar dos biológicos con diferente mecanismo de acción. Ningún biológico ha demostrado ser superior a los otros en cuanto a respuesta en estos escenarios64-67.
Cada vez existen más estudios de vida real de los diferentes tratamientos biológicos que muestran resultados de eficacia superiores a los de los ECA61,68,69. Los enunciados relacionados que han sido encontrados como apropiados por el panel se pueden ver en la tabla 2, enunciados 23-25.
Omalizumab en el AAGDesde los estudios pivotales que demostraron la eficacia y la seguridad de omalizumab se han realizado y publicado numerosos trabajos que han aportado información adicional a la del inicio de su desarrollo clínico, como, por ejemplo, su efecto sobre la reducción de corticoides orales, las cifras de eosinófilos en sangre periférica o de FENO, o las comorbilidades asociadas68,70-84. En los casos de buena respuesta mantenida se ha planteado la posibilidad de reducir o de retirar el tratamiento, ya que se producía una regulación a la baja de los receptores de baja afinidad para IgE85. Se ha comprobado que dicha retirada es posible en algunos de estos pacientes, aunque no existen datos suficientes acerca de cómo realizarla86-89.
Existen pocos datos acerca del uso de omalizumab durante periodos cortos en pacientes con AAG estacional90, si bien no se han observado diferencias de respuesta en los sujetos sensibilizados a aeroalérgenos estacionales91 con respecto a otros alérgenos perennes.
El uso de biomarcadores como los niveles de eosinófilos en sangre o la FENO como predictores de respuesta a omalizumab ha sido investigado por numerosos grupos. La mayoría de estudios en este sentido, en donde hay mayor eosinofilia o valores de FENO y en menor medida los valores de periostina sérica se han asociado a una mejor respuesta a omalizumab (menor tasa de exacerbaciones, control sintomático, uso de corticoides orales, hospitalizaciones y función pulmonar)70,79,92-94, aunque hay algunos estudios que no han encontrado dicha asociación81,95.
En el estudio de Huang et al. (2019)96 se evaluó si los perfiles de citoquinas proinflamatorias en los pacientes con AAG no controlada eran diferentes según la respuesta al omalizumab. El estudio concluyó que la mayoría de los pacientes con AAG que se beneficiaron del tratamiento eran de tipo2-alto con expresión elevada de IL-33, IL-25 y TSLP. En aquellos que respondieron parcialmente al tratamiento debía evaluarse la presencia de rinosinusitis o de una inflamación mixta de las vías respiratorias con eosinófilos y neutrófilos96.
En el otro lado de la balanza estaría el asma no eosinofílica. Morimoto et al. (2021)97 analizaron el papel de la IL-18 en la respuesta insuficiente al omalizumab y encontraron que niveles elevados de IL-18 libre en suero al inicio del tratamiento con omalizumab podían predecir una menor reducción de las exacerbaciones en pacientes alérgicos graves con asma de tipo2 baja97. Los enunciados relacionados que han sido encontrados como apropiados por el panel se pueden ver en la tabla 2, enunciados 26-28. El enunciado2 de la tabla 3 no fue validado por el panel.
Tratamiento de comorbilidades con asmaSe recomienda considerar aquellos tratamientos que beneficien de forma conjunta a los pacientes con asma y multimorbilidades atópicas, como pueden ser la AIT y/o el tratamiento con biológicos.
Las evidencias sugieren que el tratamiento del AA con omalizumab mejora no solo los síntomas respiratorios sino también los de otras enfermedades coexistentes45, y beneficia particularmente a los pacientes con AAG y con multimorbilidades, observándose una mayor respuesta en aquellos con ≥3 enfermedades98, de manera independiente a la carga de comorbilidad99. Además, omalizumab también mejora la rinosinusitis crónica con poliposis nasal (RSCcPN) coexistente80,100. También se ha observado alguna mejoría en pacientes con aspergilosis broncopulmonar alérgica, aunque con un tamaño de muestra demasiado pequeño para poder confirmar un claro beneficio101,102, por lo que son necesarios estudios más amplios para poder extraer una evidencia firme.
Por otra parte, los fármacos biológicos anti-IL-5 también han demostrado su efectividad en mejorar el asma con poliposis nasal63. Dupilumab ha sido aprobado para tratar la DA, el asma y la RSCcPN y se encuentra en ECA activos para el tratamiento de la EE103. El enunciado relacionado que ha sido validado como apropiado por el panel se puede encontrar en la tabla 2, enunciado29.
Asma estacionalDiagnósticoLa variabilidad de los síntomas observados en pacientes con alergia respiratoria dificulta la clasificación basada en los criterios de las GPC sobre rinitis y asma49.
La mayoría de los pacientes diagnosticados de rinoconjuntivitis alérgica y asma por sensibilización a pólenes experimentan manifestaciones clínicas, alteraciones de la función pulmonar e inflamación de las vías respiratorias exclusivamente durante la temporada de exposición al polen104. También pueden presentar síntomas asociados, como el síndrome de alergia oral con alimentos vegetales19.
Las actuales guías de consenso no encuadran adecuadamente el asma estacional grave, ya que la clasificación del asma se basa en las necesidades de terapia de mantenimiento, que a la vez se fundamentan en un tratamiento escalonado según las necesidades del paciente59,105. Además, proponen diferenciar las exacerbaciones graves del asma y el asma de difícil control del AG persistente no controlada. Para este último escenario es necesario demostrar que el asma sigue siendo grave una vez optimizado el tratamiento y se han abordado adecuadamente los desencadenantes principales y las comorbilidades, lo que implica un seguimiento de al menos seis meses. Debido a esto, los pacientes que no están controlados durante una temporada de polen limitada pueden requerir un tratamiento encuadrado en los últimos escalones terapéuticos, pero no pueden ser clasificados de AG refractaria de forma estricta según las guías de consenso actuales. Esta clasificación podría impedir el uso de los tratamientos biológicos en estos pacientes que, sin embargo, presentan síntomas intensos, requieren el uso de medicamentos controladores a dosis altas y presentan exacerbaciones graves, incluso mortales. Los enunciados relacionados que han sido encontrados como apropiados por el panel se pueden ver en la tabla 2, enunciados 30-33.
TratamientoLa AIT es la única terapia modificadora que puede cambiar el curso natural de la enfermedad respiratoria alérgica106, aunque no hay experiencia en su uso en AAG.
Omalizumab ha sido aprobado para el tratamiento de la polinosis grave del cedro japonés por los resultados obtenidos en un estudio complementario en rinitis alérgica grave107. Los enunciados relacionados que han sido encontrados como apropiados por el panel se pueden encontrar en la tabla 2, enunciados 34-35.
Asma grave durante las tormentasLas descargas de tormentas eléctricas pueden concentrar aeroalérgenos (pólenes y también esporas de hongos) a nivel del suelo, donde se liberan partículas alergénicas respirables después de la rotura por choque osmótico, generando aerosoles biológicos atmosféricos. Este fenómeno también puede ocurrir en el AA por sensibilización a esporas de hongos108.
Debido al constante cambio climático, es probable que futuros eventos de tormentas sean más comunes, desastrosos e impredecibles, por lo que es importante tener un conocimiento profundo sobre este tema para prevenir exacerbaciones de asma108.
ConclusionesUno de los objetivos de este trabajo es señalar las necesidades no cubiertas en el manejo del asma alérgica grave (AAG). Una necesidad no cubierta es la de generación de evidencia que confirme la eficacia y la seguridad de este abordaje terapéutico, o si el uso de otros fármacos biológicos puede influir en el aumento de la tolerabilidad a la AIT en AG. Otra necesidad es la falta de reconocimiento como ente diferenciado en guías y consensos tal y como son consideradas el asma ocupacional, o el broncoespasmo inducido por ejercicio, con esquemas terapéuticos particulares.
Estas necesidades no cubiertas se reflejan en los ítems que no han sido consensuados por el panel de expertos. En una de las recomendaciones que no ha sido aprobada (tabla 3, enunciado1) los panelistas apuntaron a la falta de evidencia respecto al uso de fármacos anti-IL-5/IL-5R para aumentar la tolerancia a la AIT, o que el uso de la AIT no está indicado en el AG, aunque también señalaron el atractivo de la AIT al ser una intervención terapéutica capaz de cambiar la historia natural del AA no grave. Con respecto al segundo ítem no aprobado (tabla 3, enunciado2), la aparición de nuevas alternativas que actúan directamente sobre la vía de la inflamación eosinofílica hace que el omalizumab deje de ser la opción prioritaria, aunque la evidencia indica su efectividad en estos casos79,109,110.
Entre las fortalezas de este trabajo cabe destacar la búsqueda bibliográfica y la experiencia de los expertos en el manejo del AAG en la que se sustentan las recomendaciones, así como la de un panel de expertos equilibrado entre las especialidades representadas. Como limitaciones, la falta de evidencia en algunos aspectos, y las limitaciones de representación que puede presentar este tipo de metodología.
FinanciaciónEste trabajo ha recibido una beca irrestricta por parte de Novartis para sufragar el desarrollo del proyecto y del manuscrito.
Contribuciones de los autoresLa coordinación del proyecto ha estado a cargo de JDO y de JD. Todos los autores han colaborado en la concepción, desarrollo y validación del manuscrito.
Conflictos de interésJD ha participado en reunión de asesoría para Astra y Bial. Ha recibido gratificaciones como ponente de AstraZeneca, Bial, Chiesi, GlaxoSmithKline y Sanofi. Ha recibido financiación de proyectos de AstraZeneca. Y ha recibido financiación para investigación de Sanofi y Menarini.
ANP ha participado en reunión de asesoría para Stallergenes Ibérica, y como ponente en sesiones financiadas por Diater, Menarini, LETI Pharma, Uriach, Chiesi, Allergopharma Organon y GSK, en los tres últimos años.
FAG ha participado en ponencias, consejos asesores y prestó servicios de consultoría en los últimos tres años financiados por: AstraZeneca, Bial, Chiesi, GSK, Novartis, Orion-Pharma y Sanofi. FAG declara no haber recibido, directa o indirectamente, financiación de la industria tabacalera o de sus filiales.
CCS participó en ponencias, consejos asesores, colaboraciones y prestó servicios de consultoría en los últimos tres años financiados por: AstraZeneca, Chiesi, GSK, GebroPharma, Novartis y Sanofi.
JDO ha participado en reuniones de asesoría para Novartis, GSK, Sanofi y AstraZeneca. Además, ha recibido gratificaciones como ponente en sesiones financiadas por ALK, AstraZeneca, Chiesi, GSK, LETI Pharma, Novartis, Teva y Sanofi.
Los autores quieren agradecer a los siguientes expertos por su participación en el Delphi: Alicia Habernau, Complejo Hospitalario de Mérida, Mérida; Alicia Padilla Galo, Hospital Costa del Sol, Marbella; Ana Gómez Bastero, Hospital Universitario Virgen Macarena, Sevilla; Ana Rosado Ingelm, Hospital Universitario Fundación de Alcorcón, Alcorcón; Andrea Trisán Alonso, Hospital Universitario Puerta de Hierro, Madrid; Astrid Crespo Lessmann, Hospital Universitario de la Santa Creu i Sant Pau, Barcelona; Carlos Martínez Rivera, Hospital Universitari Germans Trias i Pujol, Badalona; Darío Antolín, Hospital Universitario Ramón y Cajal, Madrid; Ebymar Arismendi, Hospital Clínic, Barcelona; Eva Martínez Moragón, Hospital Doctor Peset, Valencia; Fernando Sánchez Toril, Hospital Arnau de Vilanova, Valencia; Ignacio Antépara, Hospital Universitario de Basurto, Vizcaya; Iñigo Ojanguren, Hospital Universitario Vall d’Hebron, Barcelona; Irina Bobolea, Hospital Clínic, Barcelona; Isabel Urrutia Landa, Hospital Universitario Galdakao-Usansolo, Galdakao; Ismael García Moguel, Hospital Universitario 12 de Octubre, Madrid; José Ángel Carretero Gracia, Hospital Clínico Universitario Lozano Blesa, Zaragoza; José Gregorio Soto Campos, Hospital Universitario de Jerez, Jerez de la Frontera; José Serrano Pariente, Hospital Comarcal de Inca, Inca; Juan Carlos Miralles, Hospital Reina Sofía, Murcia; Juan Fraj, Hospital Clínico Universitario Lozano Blesa, Zaragoza; Juan Luis García Rivero, Hospital Universitario Marqués de Valdecilla, Santander; Lorena Soto, Hospital Universitario de la Santa Creu i San Pau, Barcelona; Manuel Castilla Martínez, Hospital Los Arcos del Mar Menor, Murcia; Manuel Rial, Complejo Hospitalario Universitario A Coruña, A Coruña; Mar Gandolfo Cano, Hospital Universitario Fuenlabrada, Fuenlabrada; Mar Moro, Hospital Universitario de Toledo, Toledo; Mar Mosteiro Añon, Hospital Álvaro Cunquiero, Vigo; María Rubio Pérez, Hospital Universitario Infanta Sofía, Madrid; María Vázquez de la Torre Gaspar, Hospital Universitario Infanta Leonor, Madrid; Paula Galván Blasco, Hospital Universitario Vall d’Hebron, Barcelona; Pilar Cebollero Ribas, Complejo Hospitalario de Navarra, Pamplona; Remedios Cárdenas, Hospital Universitario de Guadalajara, Guadalajara; Rocío Magdalena Díaz Campos, Hospital Universitario 12 de Octubre, Madrid; Rubén Andújar Espinosa, H.C.U. Virgen de la Arrixaca, Murcia; Ruperto González, Hospital Universitario de Canarias, La Laguna; Santiago Quirce, Hospital Universitario La Paz, Madrid; Silvia Sánchez Cuéllar, Hospital Universitario Ramón y Cajal, Madrid; Victoria García Gallardo, Hospital Universitario de Burgos, Burgos; Virginia Bellido, Hospital Universitario Virgen de Valme, Sevilla, y el soporte en la redacción científica proporcionado por Antoni Torres-Collado, PhD, y Susana Cañón, PhD, de Medical Statistics Consulting (MSC, Valencia).