La esporotricosis es una infección causada por especies pertenecientes al complejo Sporothrix schenckii. Dependiendo de la especie, estos organismos pueden tener virulencia y formas clínicas diferentes.
ObjetivoVerificar la virulencia de una cepa de Sporothrix globosa en un modelo murino usando 2 concentraciones de inóculo, en aplicación intraperitoneal o subcutánea.
Materiales y métodosEstudio experimental no aleatorizado en murinos inoculados con una cepa de S. globosa (CBS 14.076M), por vía intraperitoneal y subcutánea, a 0,5 y 4 de concentración McFarland. Se utilizaron 18 roedores CF-1 (ISP, Santiago, Chile).
ResultadosLa cepa estudiada no provocó enfermedad ni lesiones, todos los animales sobrevivieron, no hubo desarrollo de hongos en el cultivo de tejidos y el análisis histopatológico de órganos no mostró alteraciones sugerentes de infección.
ConclusionesLa cepa de S. globosa estudiada no presentó virulencia en modelos murinos y no provocó enfermedad al ser inoculada a concentración McFarland 0,5 y 4, tanto por vía intraperitoneal como subcutánea.
The sporothricosis disease is an infection caused by species included in Sporothrix schenkii complex.
ObjectiveVerify the virulence of a strain of S. globosa using two different concentrations of inoculum by intraperitoneally and subcutaneously, into a mouse model.
Materials and methodsNonrandomized pilot study, in murine inoculated with a strain of S. globosa (CBS 14.076M) by intraperitoneally and subcutaneously with inoculum concentrations of 0.5 and 4 McFarland. For this purpose 18 rodents CF-1 (ISP, Santiago, Chile) were used.
ResultsThe studied strain did not induce illness or injury on animals, they all survived and neither the tissue culture nor the histopathological analysis showed fungal growth or suggestive infection by organ abnormalities.
ConclusionsThe S. globosa strain did not present any virulence enough to cause disease at 0.5 and 4.0 McFarland concentration inoculum when inoculated in both intraperitoneally and subcutaneously, in murine models.
El complejo Sporothrix schenckii está conformado por un grupo de hongos dimorfos distribuidos en distintos ambientes de la naturaleza; sin embargo, se concentran principalmente en zonas tropicales y subtropicales7. Son los agentes causales de la esporotricosis, una micosis subaguda o crónica que afecta a humanos y otros mamíferos5,7. La presentación clínica linfocutánea de extremidades es la más común, pero se han descrito infecciones en distintos órganos y formas diseminadas4,5,14. Es considerada una enfermedad profesional, pues afecta principalmente a granjeros, jardineros, agricultores, veterinarios o a aquellas personas que presentan alguna herida punzante o mordedura por algún animal4,5,14. En América, se han comunicado casos de esporotricosis en la mayoría de los países1. En Chile, se han aislado las especies del citado complejo en forma esporádica, tanto de muestras médicas como del ambiente5,12.
Distintos trabajos taxonómicos demuestran la alta variabilidad genética del complejo, el que se encuentra constituido por S. schenckii sensu stricto, Sporothrix brasiliensis, Sporothrix globosa, Sporothrix luriei, Sporothrix mexicana y Sporothrix pallida, las 3 primeras con importancia clínica y las otras aisladas principalmente de diversos sustratos ambientales8,11,13. Las distintas especies pueden presentar virulencia y formas clínicas diferentes, ya que S. schenckii sensu stricto y S. brasiliensis pueden provocar lesiones cutáneas, profundas y diseminadas; en cambio, S. globosa se ha descrito principalmente en infecciones linfocutáneas2,3,5,11 y S. pallida en queratitis y onicomicosis9,12.
El objetivo del presente trabajo fue verificar la virulencia de una cepa de S. globosa5 en un modelo murino usando 2 concentraciones de inóculo y en aplicación por vía intraperitoneal o subcutánea.
Materiales y métodosSe llevó a cabo un estudio experimental no aleatorizado en modelos murinos.
Cepa inoculadaSe eligió una cepa de origen clínico de S. globosa (CBS 14.076M), identificada previamente por morfofisiología en el laboratorio de Micología de la Universidad de Valparaíso y confirmada por biología molecular en el CBS-KNAW Fungal Biodiversity Centre.
AnimalesSe utilizaron en total 18 ratones CF1 (ISP, Santiago, Chile) de 6 semanas de edad, de 30 a 39 g de peso. Los roedores se manejaron teniendo en cuenta las normas del bioterio y del comité de ética animal de la Universidad de Valparaíso. El protocolo de supervisión utilizado fue el de Morton y Griffiths10.
Preparación del inóculoLa cepa se sembró en placas con agar con extracto de papa y glucosa (PDA; papa, 200g; glucosa, 10g; agar agar, 18g; agua destilada, 1000ml) y se incubaron durante 4 días a 30°C.
Luego se preparó una suspensión de conidios agregando solución salina al 0,9% a los cultivos y rascando suavemente la superficie. Después se resembraron en 250ml de caldo papa glucosa (PDC; papa, 200g; glucosa, 10g; agua destilada, 1000ml) y se incubaron a 30°C por 5 días. Posteriormente, los caldos de cultivo se filtraron a través de gasas estériles, se lavaron 3 veces con solución salina mediante centrifugación (2500rpm, 10min) y el sedimento se resuspendió también en solución salina. Por turbidimetri¿a del nefelómetro de McFarland, el inóculo se ajustó a las concentraciones de 0,5 y 4 (1,5 y 12×108 células/ml, respectivamente). La viabilidad se comprobó con siembras en PDA de cada dilución realizada.
El experimento constó de 2 tratamientos de acuerdo con la concentración del inóculo (0,5 y 4 McFarland).
Se crearon 2 modelos de infección, uno con inoculación intraperitoneal de 1ml de la suspensión final y otro subcutáneo, por inoculación en el dorso a la misma concentración. Seis roedores fueron inoculados con una solución a una concentración 0,5 McFarland y los otros 6 con una concentración de 4 McFarland, además cada tratamiento tenía 3 roedores de control inoculados con Sporothrix chilensis, especie recientemente reconocida y cuya baja virulencia ya fue demostrada12. La observación y el control se realizaron durante 30 días. A las lesiones subcutáneas se les asignó una categoría, según se describe en la tabla 1.
SupervivenciaTodos los animales se mantuvieron en observación durante 30 días. Solo serían sacrificados antes de ese plazo aquellos que presentaran un puntaje mayor de 8 según el protocolo de Morton y Griffiths10.
Histopatología y carga fúngicaA los 30 días de la inoculación, los animales fueron sacrificados según el protocolo del bioterio de la Universidad de Valparaíso. Se extrajeron asépticamente la región subcutánea de inoculación, el bazo, el hígado, los riñones y los pulmones. Un trozo de cada órgano se fijó en formalina al 10%, se procesó y se incluyó en parafina. Se realizaron secciones de 3μm que se tiñeron con hematoxilina-eosina, ácido periódico-reactivo de Shiff y Grocott- Gomori para su estudio histológico. Muestras de 1 g de la región subcutánea de inoculación y de los órganos extraídos fueron homogeneizadas en 2,5ml de solución salina al 0,9% y sembradas en PDA para conteo de las unidades formadoras de colonias.
ResultadosConcentración de conidios y características de las lesionesEn la fase 1 (0,5 McFarland), ningún roedor inoculado por vía intraperitoneal o subcutánea presentó signos de infección en el sitio de inoculación ni signos generales de enfermedad durante los 30 días de observación.
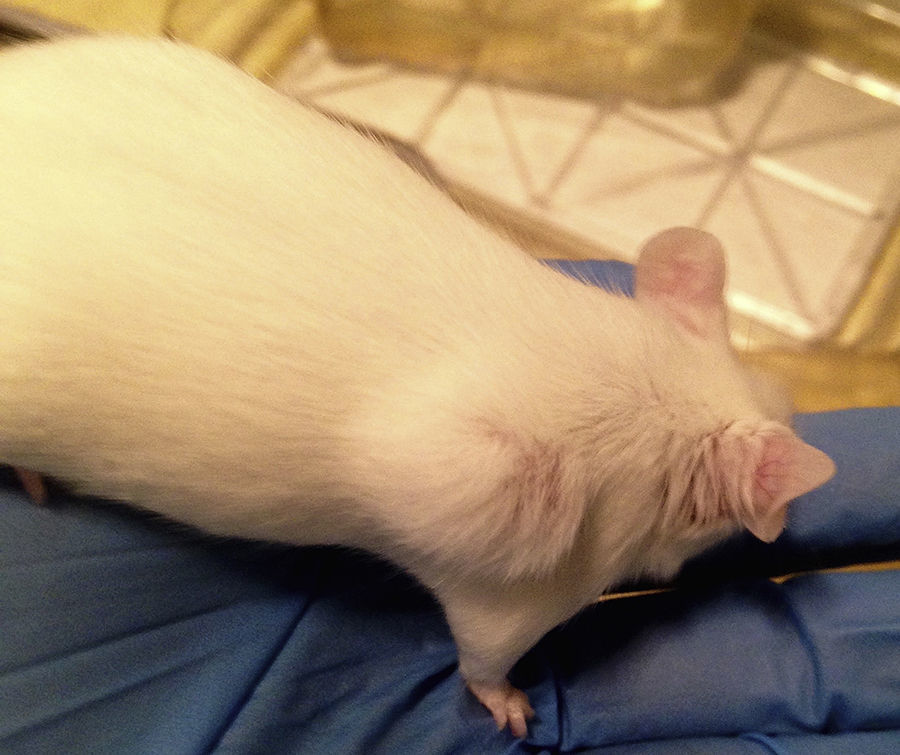
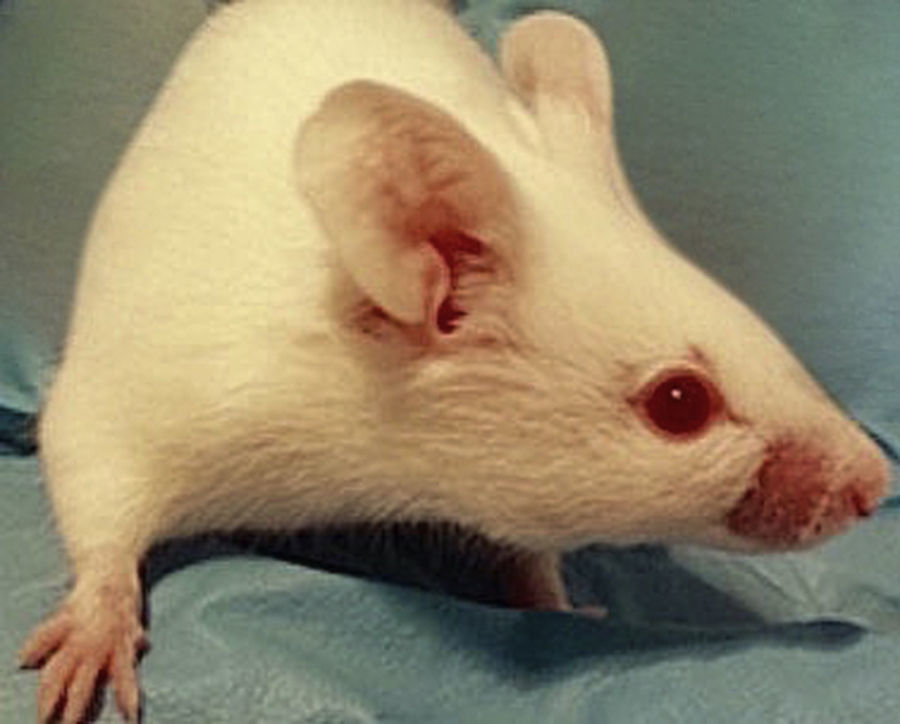
En la fase 2 (4 McFarland), los animales inoculados vía intraperitoneal tampoco presentaron lesiones durante los 30 días de observación. Un ratón inoculado subcutáneamente presentó una lesión nodular en el sitio de inoculación al día 7, sin calor local ni pérdida de pelo (lesiones grado 1), sin signos de sufrimiento de acuerdo con el protocolo de supervisión (fig. 1). Esta lesión se mantuvo sin cambios hasta los 30 días. Al mismo tiempo, 2 ratones inoculados por vía subcutánea presentaron máculas de tono rosado oscuro en la zona perinasal, asociadas a la pérdida de bigote (fig. 2).
Los animales inoculados con la cepa control no presentaron lesiones ni enfermedad.
SupervivenciaLa supervivencia fue de un 100% en los ratones inoculados, tanto subcutánea como intraperitonealmente, al igual que los de control.
Carga fúngicaLos cultivos de todos los órganos estudiados no presentaron desarrollo de hongos. En los animales de control, tampoco hubo aislamiento del hongo.
Estudio histopatológicoEn los animales inoculados intraperitonealmente no hubo alteraciones histológicas ni presencia de elementos levaduriformes indicativos de infección por Sporothrix. En los animales inoculados subcutáneamente hubo uno que presentó un nódulo en el sitio de inoculación; sin embargo, en la histología solo se observó inflamación inespecífica y no se observaron elementos levaduriformes indicativos de infección por S. globosa. En los animales de control la histología fue normal.
DiscusiónSe describe a S. brasiliensis y S. schenckii sensu stricto como las especies del complejo que tienen mayor virulencia y pueden provocar lesiones, tanto subcutáneas como profundas2,3. En Chile, se han identificado a nivel de especie solo S. globosa y S. chilensis5,12. S. globosa se describe como de baja virulencia y asociada principalmente a infección linfocutánea2,3,5. En nuestro estudio no se logró reproducir la enfermedad por inoculación intraperitoneal ni subcutánea en las 2 concentraciones estudiadas, lo que difiere de otros estudios en murinos, donde a una menor concentración de conidios se reprodujo la infección, tanto sistémica como subcutánea2,3,6. Esto podría explicarse debido a una menor virulencia de nuestra cepa, la cual se aisló de una paciente adulta mayor que cursó con esporotricosis linfocutánea, virus de la inmunodeficiencia humana (–), en quien no se realizó estudio de complemento C3 y C4, ni cuantificación de inmunoglobulinas IgA, M y G5.
Estudios de supervivencia han mostrado que murinos inoculados sistémicamente con cepas de S. brasiliensis y S. schenckii sensu stricto tuvieron una letalidad de 100% entre la segunda y la sexta semana, a diferencia de S. globosa, para la que no se describe letalidad2,3,6. Esto coincide con los resultados de nuestro trabajo, en el que el total de los murinos sobrevivieron a los 30 días y sin signos de enfermedad o sufrimiento según el protocolo de Morton y Griffiths10. Esto también podría estar dado por la menor virulencia de nuestra cepa, sin capacidad para provocar infección subcutánea o profunda en ratones inmunocompetentes.
En un estudio realizado con anterioridad, tanto la carga fúngica como el compromiso histológico (cantidad de levaduras en el tejido) provocado por S. globosa fue menor comparado con S. brasiliensis y S. schenckii sensu stricto2,3. En esta investigación no hubo desarrollo de colonias de hongos ni compromiso histológico de órganos profundos indicativo de infección, tampoco presencia de elementos levaduriformes en los tejidos de los roedores. Esto sugiere que nuestra cepa no tiene la capacidad para invadir tejidos profundos, a diferencia de otras cepas de S. globosa aisladas en otras zonas geográficas.
Uno de los ratones presentó una lesión dorsal sin signos clínicos, micológicos ni histológicos de infección, lo cual se interpretó como una posible reacción inespecífica a la punción o a la suspensión inoculada. Las lesiones rosadas en la región perinasal de 2 de los roedores, al no evidenciar infiltración fúngica en la histopatología ni desarrollo de Sporothrix en el cultivo, se explicarían por un comportamiento llamado barbering o «efecto Dalila», que consiste en la remoción de bigotes y piel perinasal a compañeros de jaula para demostrar dominancia15.
La cepa de S. globosa utilizada en esta investigación, que había sido aislada de una paciente de la quinta región de Chile, podría ser menos virulenta que las presentes en otras regiones. Esto podría ser una de las razones por las cuales la esporotricosis se presenta esporádicamente en nuestro país y sin compromiso de órganos profundos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses