El síndrome hepatopulmonar (SHP) es una enfermedad grave y progresiva cuya fisiopatología reside en un shunt intrapulmonar con hipoxia y deterioro clínico severo. Como único tratamiento efectivo se ha postulado el trasplante hepático (TH), en pacientes adecuadamente seleccionados.
ObjetivoReconocer la importancia del diagnóstico temprano del SHP.
Pacientes y métodosMediante un estudio observacional, descriptivo, con carácter retrospectivo de 8 pacientes con SHP, a los que se les realizó TH en el período entre abril del 2006 y agosto del 2014. Se han revisado los datos clínicos previos al trasplante y el seguimiento tras este.
Se empleó un estudio multivariante (stepwise forward logistic regression analysis), para determinar cuál variable podría incrementar el riesgo de muerte.
ResultadosDe los 8 pacientes, el resultado de muerte solo pudo ser predicho significativamente por el factor presión parcial de oxígeno en sangre arterial (PaO2) pre-TH (p = 0,002).
La PaO2 pre-TH promedio ± desviación estándar de los pacientes que fallecieron era de 51,5 ± 2,49, siendo la diferencia estadísticamente significativa (p = 0,002).
Ninguna variable resultó estadísticamente significativa para reversibilidad del SHP.
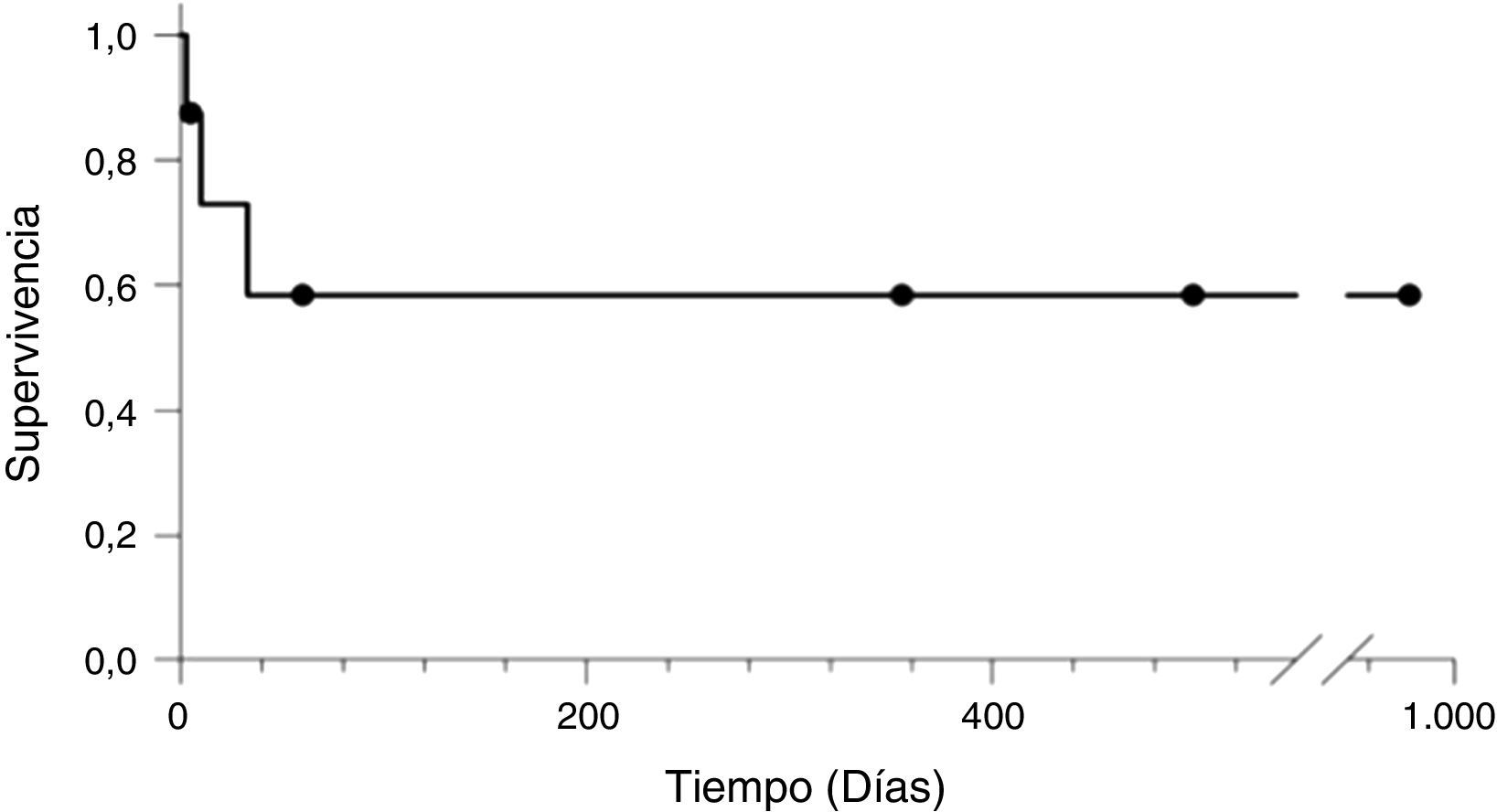
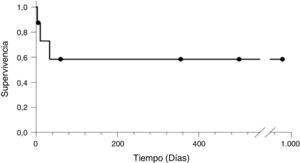
La supervivencia de los pacientes con criterio de SHP posterior al TH fue de 62,5%.
ConclusionesEl grado de hipoxemia pre-TH es un factor predictor importante de mortalidad en el postoperatorio inmediato. La precocidad en la detección de la entidad es fundamental tanto para disminuir la morbimortalidad post-TH como para indicar este en el momento óptimo, independientemente del estadio de la enfermedad hepática. Protocolos adecuados de detección precoz del SHP mediante cribado de hipoxemias en pacientes con hipertensión portal pueden ser la estrategia clínica más eficiente.
Hepatopulmonary syndrome (HPS) is a serious, progressive disease. Its pathophysiology resides in a hypoxic intrapulmonary shunt and severe clinical deterioration. Liver transplantation (LT) is the only effective treatment in appropriately selected patients.
ObjectiveTo acknowledge the importante of early diagnosis of HPS.
Patients and methodsObservational, descriptive, retrospective trial including 8 patients with HPS that received LT between April 2006 and August 2014. The clinical data prior to transplantation and follow-up after the procedure were reviewed.
A multivariate analysis (stepwise forward logistic regression analysis) was used to identify the variable that could potentially increase the risk of death.
ResultsOf the 8 patients, death could only be significantly predicted based on the pre-LT arterial blood partial oxygen pressure (PaO2) (P=.002).
The average pre-LT PaO2 of the patients that died was 51.5 ± 2.49 SD, with a statistically significant difference (P=.002).
None of the variables was statistically significant for HPS reversibility.
The survival rate of patients diagnosed with HPS following the LT was 62.5%.
ConclusionsThe level of pre-LT hypoxemia is an important predictor for immediate postoperative mortality. Early detection of the condition is critical to reduce the post LT morbidity and mortality so that the indication for transplant is made at the right time, regardless of the stage of liver disease. The most efficient clinical strategy could be the use of appropriate early detection protocols for HPS through screening of hypoxemia in patients with portal hypertension.
La primera publicación que evidencia la asociación entre la alteración hepática y pulmonar fue en 1884 por Fluckieger; sin embargo, el término de síndrome hepatopulmonar (SHP) no fue acuñado hasta 1977 por Kennedy y Knudson1. Inicialmente se creía que esta era una entidad irreversible que, por tanto, contraindicaba el TH, y no fue hasta principios de los años 90 cuando observaron que el SHP podría resolverse después del TH e incluso que este era su único tratamiento efectivo en términos de reversibilidad.
El SHP es una entidad de baja prevalencia pero elevada morbimortalidad, que puede comprometer severamente el estado funcional de los pacientes con enfermedad hepática avanzada y/o hipertensión portal2. Se presenta debido a un déficit en la depuración hepática de diversos mediadores vasculares, creando un desequilibrio de sustancias vasodilatadoras y vasoconstrictoras, produciendo una vasodilatación intrapulmonar anormal que conduce a un shunt intrapulmonar y, como consecuencia, una alteración en la oxigenación arterial, que no siempre mejora con O2 suplementario, presentando clínica de platipnea (disnea que aumenta en posición erecta) y ortodesoxia (desaturación > 5% o caída > 4mmHg de PaO2 al pasar de posición decúbito a erecta). Estas alteraciones en la PaO2 se deben principalmente a un desequilibrio en la ventilación/perfusión, con shunt pulmonar al que se añade una alteración en la capacidad de difusión del oxígeno debido al aumento del diámetro capilar junto con la disminución del tiempo de tránsito del hematíe a través del capilar por un gasto cardiaco elevado propio del SHP3.
El hallazgo ecocardiográfico de un shunt extracardíaco e intrapulmonar confirma el diagnóstico4. Para diferenciar si el shunt existente es intracardiaco o extracardiaco debe observarse si el paso de microburbujas tras la inyección intravenosa de suero frío agitado desde cavidades derechas a izquierdas es precoz (< 3 ciclos cardíacos), lo que indicaría cortocircuito intracardiaco, o tardío (> 3 ciclos cardiacos), lo cual diagnosticaría cortocircuito intrapulmonar. Los criterios diagnósticos de SHP son: “presión parcial de oxigeno <80 mmHg o gradiente alveolo-arterial de oxigeno mayor o igual a 15mmHg mientras respira oxigeno ambiente, hallazgos positivos en la ecocardiografía realizada con contraste, hipertensión portal (más común) con o sin cirrosis. Con un gradiente alveolo-arterial de oxigeno mayor o igual a 15 mmHg el grado de severidad depende de la presión parcial de oxigeno, siendo leve PO2 >80mmHg; moderado PO2 >60 a <80 mmHg; severo PO2 >50 a <60 mmHg; muy severo PO2 <50 mmHg” 5.
Hasta el momento el único tratamiento que se ha visto efectivo es el trasplante hepático en casos correctamente seleccionados y en los que el procedimiento se ha indicado en un momento determinado de la enfermedad pulmonar6.
Pacientes y métodosHemos realizado un estudio observacional y descriptivo recogiéndose retrospectivamente los datos de pacientes a quienes se les realizó TH entre abril del 2006 y agosto del 2014. De un total de 815 trasplantes efectuados en dicho período, hay 8 pacientes (1%) con diagnóstico de SHP, de los cuales 7 (87,5%) eran hombres y 1 (12,5%) mujer, con un rango de edad entre 32 y 60 años en el momento del TH. A todos se les había diagnosticado SHP, mediante gammagrafía pulmonar o ecocardiografía, y presentaban, además, alteración de la oxigenación en la gasometría arterial. El estudio fue aprobado por el comité de ética institucional con código de aprobación 2016/0125.
Los datos clínicos recogidos fueron edad, sexo, MELD y Child-Pugh, etiología de la hepatopatía, última gasometría inmediatamente previa al trasplante, requerimientos de oxigenoterapia domiciliaria preoperatoria, tiempo de ventilación mecánica (VM) postoperatoria, tiempo de estancia en reanimación y causas de fallecimiento.
Para la distribución de variables cualitativas se emplearon las frecuencias absolutas de cada categoría y se aplicó el test exacto de Fisher. La variable dependiente fue sobrevida y las variables independientes utilizadas fueron: requerimientos de O2 domiciliario pre-TH, signos de síndrome de reperfusión durante el TH, requerimientos de VM no invasiva postextubación, y si habían tenido larga estancia en la unidad de reanimación postoperatoria fijando 48 h como tiempo estimado normal.
El análisis estadístico de las variables cuantitativas se expresó como media ± desviación estándar de los pacientes vivos y los que fallecieron (tabla 1). Se realizó, asimismo, un estudio multivariable, stepwise forward logistic regression analysis, para determinar cuál variable podría predecir significativamente el riesgo de muerte. El nivel de significación estadística se fijó en 0,05.
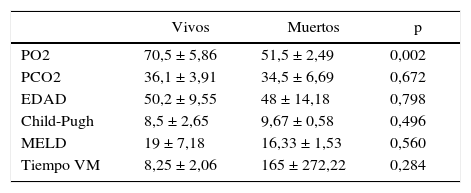
Características demográficas, clínicas y estadio funcional hepático
| Vivos | Muertos | p | |
|---|---|---|---|
| PO2 | 70,5 ± 5,86 | 51,5 ± 2,49 | 0,002 |
| PCO2 | 36,1 ± 3,91 | 34,5 ± 6,69 | 0,672 |
| EDAD | 50,2 ± 9,55 | 48 ± 14,18 | 0,798 |
| Child-Pugh | 8,5 ± 2,65 | 9,67 ± 0,58 | 0,496 |
| MELD | 19 ± 7,18 | 16,33 ± 1,53 | 0,560 |
| Tiempo VM | 8,25 ± 2,06 | 165 ± 272,22 | 0,284 |
Media ± DE.
Fuente: autores.
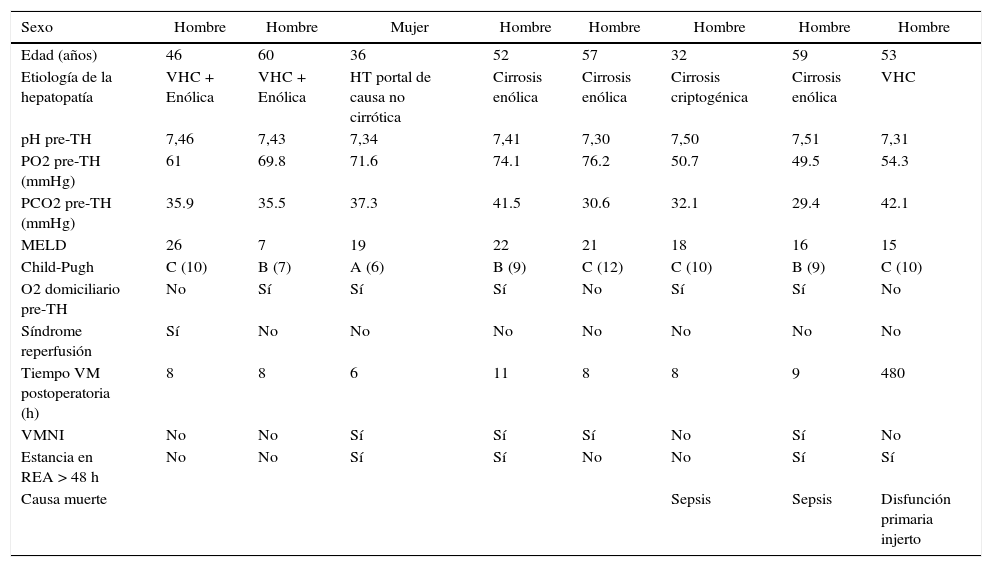
Las características basales de los 8 pacientes trasplantados con SHP durante el período de estudio se exponen en la tabla 2, refiriéndose tanto a la tipología y la gravedad de la enfermedad hepática como a los datos que permiten evaluar la situación pulmonar del pre y del postoperatorio. La etiología de la insuficiencia hepática quedó definida en: cirrosis de origen enólico, cirrosis por virus de la hepatitis C, cirrosis criptogénica y un caso de SHP por hipertensión portal de causa no cirrótica de origen prehepático presinusoidal. La distribución del estadio Child-Pugh de la muestra fue de un paciente en estadio A, 3 en estadio B y los otros 4 en estadio C.
Aspectos clínicos
| Sexo | Hombre | Hombre | Mujer | Hombre | Hombre | Hombre | Hombre | Hombre |
|---|---|---|---|---|---|---|---|---|
| Edad (años) | 46 | 60 | 36 | 52 | 57 | 32 | 59 | 53 |
| Etiología de la hepatopatía | VHC + Enólica | VHC + Enólica | HT portal de causa no cirrótica | Cirrosis enólica | Cirrosis enólica | Cirrosis criptogénica | Cirrosis enólica | VHC |
| pH pre-TH | 7,46 | 7,43 | 7,34 | 7,41 | 7,30 | 7,50 | 7,51 | 7,31 |
| PO2 pre-TH (mmHg) | 61 | 69.8 | 71.6 | 74.1 | 76.2 | 50.7 | 49.5 | 54.3 |
| PCO2 pre-TH (mmHg) | 35.9 | 35.5 | 37.3 | 41.5 | 30.6 | 32.1 | 29.4 | 42.1 |
| MELD | 26 | 7 | 19 | 22 | 21 | 18 | 16 | 15 |
| Child-Pugh | C (10) | B (7) | A (6) | B (9) | C (12) | C (10) | B (9) | C (10) |
| O2 domiciliario pre-TH | No | Sí | Sí | Sí | No | Sí | Sí | No |
| Síndrome reperfusión | Sí | No | No | No | No | No | No | No |
| Tiempo VM postoperatoria (h) | 8 | 8 | 6 | 11 | 8 | 8 | 9 | 480 |
| VMNI | No | No | Sí | Sí | Sí | No | Sí | No |
| Estancia en REA > 48 h | No | No | Sí | Sí | No | No | Sí | Sí |
| Causa muerte | Sepsis | Sepsis | Disfunción primaria injerto |
MELD score: model for end stage liver disease; PO2: presión arterial de oxígeno; PCO2: presión arterial de dioxido de carbono; REA: Unidad de Reanimación; TH: trasplante hepático; VM: ventilación mecánica; VHC: virus de hepatitis C; VMNI: ventilación mecánica no invasiva.
Fuente: autores.
Todos tenían alteraciones de la oxigenación en la gasometría arterial en grado variable.
Según nuestro análisis estadístico, el resultado de muerte solo pudo ser predicha significativamente por el factor PaO2 (p = 0,002). El resto de las variables no predecían significativamente el riesgo de muerte: edad (p = 0,798), PCO2 (p = 0,672), Child-Pugh (p = 0,496), MELD (p = 0,560), tiempo VM (p = 0,284).
La PaO2 pre-TH promedio de los pacientes que fallecieron era de 51,5 ± 2,49, y el promedio de los pacientes que sobrevivieron fue de 70,54 ± 5,86, siendo esta diferencia estadísticamente significativa (p = 0,002).
De los pacientes estudiados, 3 (37,5%) fallecieron durante el postoperatorio, entre los días 3-33. Las causas de los fallecimientos fueron: 2 de ellos por procesos sépticos y el tercero relacionado con fracaso multiorgánico en el contexto de una insuficiencia respiratoria global. Se debe destacar que la causa de mortalidad más frecuente es la misma que en los pacientes trasplantados sin SHP.
Los pacientes que sobrevivieron tuvieron un periodo de seguimiento entre 5-979 días hasta el cierre del estudio (fig. 1).
Al mismo tiempo, se intentó determinar que variables de las estudiadas podrían predecir la reversibilidad del SHP, considerando reversibilidad total como una mejoría en la hipoxemia (PaO2) y reversibilidad parcial una disminución de los requerimientos de O2 domiciliario. Teniendo en cuenta el mismo test y las mismas variables, no resultó ninguna de ellas estadísticamente significativa (p ≥ 0,05); de los 5 pacientes vivos, 3 tuvieron reversión total del SHP, 2 al alta hospitalaria y uno a los 6 meses post-TH, y 2 han presentado una reversión parcial del SHP con disminución de los aportes de O2 domiciliario respecto al requerido previo al trasplante.
DiscusiónLos TH por SHP representan el 1% de los TH realizados en nuestro centro en el periodo descrito, con una supervivencia aproximada post-TH del 62,5% respecto a las series de otros centros trasplantadores, que describen una prevalencia variable entre el 4 y el 30%7, lo cual refleja, por una parte, el probable sobrediagnóstico de la entidad en ciertas series, así como la infraestimación de la misma en la nuestra. Esto puede estar determinado por la dificultad en la detección hasta estadios avanzados de la enfermedad cuando ya aparece la disnea y, en cuyo caso, la situación global de los pacientes y, sobre todo, la situación respiratoria podrían haber determinado la exclusión de la candidatura al trasplante. Parece ser que en el periodo a estudio se hubieran descartado para trasplante en nuestro centro casos en los que el TH pudiera haber sido la terapia de primera elección, por pasar inadvertidos, lo cual nos hace reflexionar sobre la necesidad de cribados rutinarios a nivel pulmonar que vayan más allá de las pruebas funcionales respiratorias que en muchos pacientes con SHP son normales8,9.
El trasplante hepático controla el SHP, con desaparición del shunt intrapulmonar y mejora en la oxigenación arterial, por lo que debería priorizarse el TH en estos pacientes, ya que tiene una supervivencia importante en casos seleccionados correctamente y detectados en fases en las que todavía es viable la realización del TH, asumiendo una morbilidad postoperatoria que no se diferencie de la existente en los casos de TH sin SHP con el mismo grado de hepatopatía pre-TH10. Según los datos actuales, el empeoramiento de la hipoxemia es progresivo y refractario al tratamiento médico11, y diferentes estudios han demostrado un aumento de mortalidad en pacientes con cirrosis asociada a la presencia de SHP, por lo que el TH se postula como único tratamiento eficaz de esta rara pero letal entidad12.
Ni la etiología ni la gravedad de la enfermedad hepática influyen en la aparición del síndrome, lo que contribuye a la hipótesis de la predisposición genética como la causa del SHP en pacientes con enfermedad hepática. Sin embargo, sí se ha visto asociada de manera significativa a la hipertensión portal, incluso sin cirrosis establecida, como ocurre en el síndrome de Budd-Chiari o en la fibrosis hepática13,14. Por tanto, quizás la manera de enfocar un programa de cribado de SHP pudiera ser en pacientes con diagnóstico de hipertensión portal con cirrosis manifiesta y/o síndromes asociados a la aparición de la misma, aunque presenten normalidad en la función hepática, que además presenten alteraciones respiratorias inespecíficas como disnea, que puedan alertar hacia cierto grado de sospecha clínica. En este escenario, cobra importancia la exactitud y la utilidad de la oximetría de pulso. Se han realizado numerosos estudios que han demostrado que una saturación periférica de O2 (SpO2) del 94% o menor detecta todos los sujetos con una PaO2 igual o inferior a 60mmHg15. Estos estudios de coste-efectividad concluyen que es una técnica simple y de bajo costo, no invasiva, precisa, fiable y aplicable desde la misma consulta de hepatología en los controles de seguimiento habituales16. Tras un primer cribado, convendría descartar que la disnea y/o la hipoxia de los pacientes detectados pudieran ser debidas a causas cardíacas o enfermedades pulmonares habituales que coexisten hasta en un tercio de los pacientes hepatópatas17, con pruebas diagnósticas más específicas, como la ecocardiografía con contraste, la angiografía pulmonar y pruebas exhaustivas de la función pulmonar.
El hecho de que la PaO2 pre-TH se postule como un factor predictivo importante de mortalidad post-TH, y considerándola la principal herramienta en la toma de decisiones respecto al momento más adecuado para el TH, nos encontramos ante la necesidad que se establezca un rango de oxemias en el cual es mandatario priorizar la indicación de TH para optimizar el éxito terapéutico. Otros grupos con amplias series de TH con SHP establecen unos niveles de pO2 basal entre 50-60mmHg como rango idóneo de indicación del TH. En general, se excluye de dicho procedimiento a aquellos pacientes con PaO2 inferior a 50mmHg y pO2 <30mmHg es considerada por algunos grupos como contraindicada para el procedimiento18. No obstante, existen algunos casos con resultados exitosos post-TH en que se observa una supervivencia superior a aquellos no trasplantados de la misma categoría gasométrica en pacientes con PaO2 pre-TH menor de 50mmHg, lo que traduce que se deberán evaluar globalmente ciertos casos de SHP con hipoxemias severas e indicarse el TH independientemente de la gravedad de la hipoxemia19.
El hallazgo de la PO2 como único factor predictor de mortalidad puede explicarse por el shunt pulmonar que tienen los sujetos con SHP, debido a la alteración en la capacidad de difusión del oxígeno por la vasodilatación capilar junto con la disminución del tiempo de tránsito de los hematíes a través del capilar por un gasto cardiaco elevado. Esta alteración tiende a ser relativamente permanente, si no se logra corregir a tiempo, por lo que pacientes con PO2 no demasiado baja son excelentes candidatos a trasplante hepático prioritario; en cambio, sujetos con PO2 baja presentan mal pronóstico y mala respuesta ventilatoria incluso tras el trasplante.
El resto de nuestras variables a estudio no predicen significativamente el riesgo de muerte ni de reversibilidad, lo cual no implica que no puedan estar relacionadas, pues es probable que estos resultados estén limitados por el tamaño de nuestra muestra. Series de casos más amplias serían necesarias para evaluar dichas variables.
Debemos tener en cuenta, además, que en lo que respecta al grado de hepatopatía el MELD no refleja pronóstico en pacientes con SHP asociado a hepatocarcinoma, enfermedades metabólicas, síndromes de hipertensión portal y todas aquellas otras situaciones clínicas que no se relacionan directamente con el grado de cirrosis.
En estos casos la asignación de prioridad respecto a la indicación de TH debe estimarse según la probabilidad de progresión de la enfermedad y realizarles seguimiento estrecho hasta un grado hipoxemia que pueda poner en controversia la indicación del TH por la alta morbimortalidad postoperatoria20.
De los pacientes que fallecieron durante el postoperatorio inmediato cabe destacar que la principal causa de mortalidad no está relacionada con insuficiencia respiratoria, sino que está fundamentalmente asociada a disfunción primaria del injerto, complicaciones biliares, sangrado perioperatorio, sepsis y demás causas habituales de morbimortalidad en el TH sin SHP, como ya se vio en el trabajo del grupo de Toronto en 2010, que implicaba una amplia serie de casos de 6 años en 2 centro trasplantadores21.
En todos los pacientes que sobrevivieron, el TH mejoró la oxigenación arterial, aunque revisiones sistemáticas de la literatura en series amplias de casos muestran resultados más variables en cuanto a la reversibilidad de la hipoxemias post-TH22. A pesar de que en 2 pacientes persistió cierto grado de hipoxemia, esta fue mejorando en los controles posteriores, con disminución de los requerimientos de O2 domiciliario (reversibilidad parcial del SHP), lo que corrobora la importancia que tiene la disfunción hepática en la patogenia del SHP.
En conclusión, según nuestra serie, pese a que el SHP tiene una prevalencia baja entre los pacientes candidatos a TH, se le atribuye una importante morbimortalidad con las medidas de tratamiento médico existentes23. Hallándose como factor predictivo importante de mortalidad postoperaoria la pO2 con significación estadística, esta debe tenerse en cuenta en la priorización de pacientes en lista de espera para TH y ser la herramienta clave en los programas de cribado para la detección de enfermedad pulmonar concomitante y potencialmente reversible. Aunque las demás variables estudiadas no predicen significativamente el riesgo de muerte, ni reversibilidad, es necesario realizar más estudios, con tamaños muestrales mayores.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciamientoLos autores no recibieron patrocinio para llevar a cabo este artículo
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses