Introducción
La hemofilia es el trastorno hereditario severo de coagulación más frecuente y se caracteriza por un intenso sangrado espontáneo o después de traumatismos ligeros. El término de hemofilia A se reserva a las deficiencias del factor VIII y hemofilia B a las deficiencias del factor IX, las cuales son indistinguibles clínicamente, siendo la B siete a 10 veces menos frecuente que la A (hemofilia clásica). El defecto de la coagulación en las hemofilias y para-hemofilias da lugar a un sangrado anormal en músculos y articulaciones. De ahí el importante papel que el ortopeda juega en el tratamiento integral de la misma, que en este caso se transforma de enfermedad hematológica en enfermedad ortopédica. La frecuencia de las crisis hemorrágicas en los hemofílicos dependerá del nivel sanguíneo de factor VIII; si dicho nivel es menor del 2% la hemofilia es grave y así lo serán sus síntomas; cuando el factor VIII es de 3 a 5% del nivel normal se dice que la hemofilia es moderada, y aunque los pacientes sufren hemartrosis ocasionales, casi siempre pueden llegar a la edad adulta sin deformidades incapacitantes. Los casos ligeros de hemofilia tienen entre 6 a 30% de factor VIII, y solamente se sospecha el diagnóstico por el sangrado anormal después de exodoncias o procedimientos quirúrgicos.18
Hemartrosis
Es el episodio más frecuente en el aparato locomotor, presentando el 83% de los pacientes.20
Etiología
El sangrado anormal proviene del plexo venoso subsinovial donde se ha demostrado la ausencia de actividad tromboplástica.3 Es un episodio intracapsular que al aparecer lleva a la articulación a la posición de máxima capacidad con una secundaria contractura muscular defensiva. Si esta hemartrosis no es tratada correctamente la contractura se hace fija, llevando a la articulación a una situación mecánica anormal que favorece la recurrencia de la hemartrosis y conduce a una destrucción progresiva de la articulación; de ahí la importancia de su tratamiento precoz. Existen factores que influyen en la gravedad de la hemartrosis tales como el tipo de articulación; sangran más las trocleartrosis o en charnela, como la rodilla y codo y son más frecuentes en niños y menos frecuentes en adultos, siendo más dolorosas en los adultos pues la progresiva fibrosis de las múltiples hemartrosis hacen la articulación menos distensible; aquella articulación que ha sangrado antes sangrará con más facilidad; y por supuesto la presencia de inhibidores hará más grave el sangrado y más difícil la cobertura. El tratamiento consistirá en elevar el nivel de factor antihemofílico (FAH) a niveles terapéuticos, tratar el dolor y distensión con medios físicos tales hielo y un vendaje compresivo en la posición de reposo y si es necesario una férula de yeso en la misma posición. Al ceder el cuadro agudo se comenzará precozmente la rehabilitación, siendo a veces necesario mantener férulas posicionales con corrección progresiva para impedir nuevos sangrados, hasta que se recupere totalmente la fuerza muscular.9
Fisiopatología
Existe un «fenómeno de cascada» que lleva a la hemartrosis recidivante (tabla 1). Al acontecer la hemartrosis aparece dolor y distensión, dando lugar a una contractura muscular con disminución de la actividad, que lleva a una hipotrofia muscular con una disfunción mecánica (menor del tono muscular) y biológica (con alteración de la nutrición del cartílago). Todo ello junto con el líquido sinovial alterado por los depósitos de hemosiderina (de la degradación de la sangre) producirá una recurrencia de la hemartrosis. Esta hemartrosis recurrente y debido al acumulo intrarticular de sangre produce una reacción sinovial con hipertrofia vascular y endotelial: fase de hipertrofia pigmentaria (tabla 2) favoreciendo así nuevos sangrados que acumulan más hemosiderina en los histiocitos con una disminución de la celularidad y vasos por la fibrosis progresiva: hipertrofia fibrosa, (tabla 3) con disminución de los sangrados pero destrucción de la articulación. Estas hemartrosis recidivantes actuando sobre huesos en crecimiento dan lugar a geodas y osteoporosis, y a un anormal estímulo metafisario con crecimiento irregular, dando lugar a epífisis asimétricas y deformidades axiales.
Clasificación
La artropatía hemofílica, dependiendo de su gravedad clínica, se puede clasificar en grados.
Grado I o de sinovitis transitoria en que después del episodio de hemartrosis la articulación se recupera totalmente.
Grado II o de sinovitis permanente con aumento del diámetro articular, engrosamiento de la sinovial y disminución del arco de movimiento.
Grado III o artropatía crónica en que además de lo anterior existirán deformidades axiales y rotacionales y atrofia muscular.
Grado IV o de anquilosis fibrosa u ósea.
Síntomas
La clínica de las hemartrosis en la hemofilia es igual a la de cualquier otro proceso: dolor, distensión, contractura e impotencia funcional.
Tratamiento de la hemartrosis aguda
Lo primero a realizar será cubrir al paciente con factor anti hemofílico (FAH) en cantidad adecuada y tiempo suficiente. De allí la importancia del control por parte del hematólogo que debe vigilar la cobertura. A esta cobertura deben seguir medios ortopédicos como inmovilización blanda con vendaje de Robert Jones modificado; si es necesario se utilizará una férula de yeso posterior en la posición de reposo, hielo y reposo que serán suficiente como tratamiento de la fase aguda. El problema de aspirar o no aspirar sigue siendo muy discutido; nosotros no somos partidarios de aspirar pues con correcta cobertura e inmovilización ceden la gran mayoría de las hemartrosis. Las hemartrosis recidivantes suelen acontecer en articulaciones crónicamente afectadas con tabicaciones que hacen difícil la aspiración y si además se ha cubierto al paciente, la sangre se habrá coagulado dificultando aún más el procedimiento. Si con un correcto tratamiento ortopédico y de cobertura, la hemartrosis no mejora deberemos pensar en la presencia de inhibidores. Al ceder el cuadro agudo modificaremos la posición de inmovilización para permitir la carga al paciente y comenzar inmediatamente la rehabilitación. Si persiste una contractura en flexión procederemos a su corrección por medio de yesos aplicados en posición de máxima corrección. Se abre el yeso por su parte posterior y distal a la articulación para abrir esta cuña y rellenar con yeso en la posición obtenida corrigiendo un promedio de 10° cada vez. Cada dos yesotomías debe cambiarse el yeso para disminuir la presión del fulcrum sobre la rótula; este procedimiento puede ser practicado sin necesidad de cobertura. Al llegar a unos 160° se colocará un aparato largo con tornillo posterior sin fin para lograr progresiva y activamente el resto de la falta de extensión. Si la contractura previa era muy grave, antes de las yesotomías se coloca al paciente en una tracción cutánea tipo Russele. La cirugía y las osteotomías extensoras tipo Moore serán sólo para casos recalcitrantes que no ceden a tratamiento ortésico.
Tratamiento de las hemartrosis recidivantes
Para prevenir las hemartrosis recidivantes deberemos actuar sobre la sinovial ya por resección (sinovectomía)14,22-24 o mejor por fibrosis de la misma (sinoviortesis) que fibrosa el plexo venoso subsinovial.1,2,8,10,11,13,16,19 Esta sinoviortesis se puede practicar con ácido ósmico, muy dolorosa y destructiva, o rifampicina que actúa por su acción fibrosante y antifibrinolítica produciendo esclerosis de la sinovial y estrangulando los posibles vasos sangrantes. Últimamente se consideran a los coloides radioactivos como el material de elección para practicar las sinoviortesis.
La sinovectomía quirúrgica, publicada por primera vez en hemofilia por Storti y cols. en 1969,23 requiere como cualquier procedimiento quirúrgico gran cantidad de FAH para elevar el nivel a 100% el día de la intervención. Por encima de 50% la primera semana postoperatoria y por encima de 30% hasta la cuarta semana, seguido de un período de rehabilitación intensiva para evitar rigideces, y requiere por supuesto de hospitalización. Muchos han sido los resultados publicados de sinovectomías quirúrgicas en hemofilia14,22-24 con un 80% de casos con ausencia o gran disminución de las hemartrosis, pero con grados más o menos variables de rigidez residual. Nuestra experiencia quirúrgica consiste en sólo 5 casos de fracasos de sinoviortesis anteriores. Se ha empleado la técnica de Mori con dos incisiones parapatelares. Según la clasificación propuesta más arriba, las indicaciones de sinoviortesis vendrán dadas según el siguiente esquema.
Grado I: Sinoviortesis preventiva cuando ocurran más de 3 hemartrosis en un período de 6 meses.
Grado II: Sinoviortesis de elección. Debe practicarse en todos los casos para evitar el deterioro de la articulación.
Grado III: Sinoviortesis de recurso debido a la tabicación de la articulación que dificulta el acceso del material radioactivo o químico.
Grado IV: Artropatía avanzada con anquilosis. No se recomienda la sinoviortesis.
Sinoviortesis radioactiva
El uso de material radioactivo para fibrosar la sinovial fue practicado por primera vez por Ahlberg en 1971.1 Este procedimiento tiene la ventaja de requerir mínima cobertura con FAH (15% por 48 horas), se pueden practicar en varios pacientes en una misma sesión, hacerse en carácter ambulatorio y como es un procedimiento no invasivo nunca deja limitación de movimientos. En relación a sus resultados, éstos son similares a los publicados para la sinovectomía quirúrgica con un 80% de resultados exitosos.8-10,16,21,25 Se practica por medio de la inyección intrarticular de un coloide radioactivo que fibrosará la membrana sinovial (ondas beta) previniendo así las hemartrosis. Se hace ambulatoriamente y nosotros hemos llegado a practicar hasta 16 pacientes en una sesión. El método utilizado en nuestra Unidad de Caracas consiste en: previamente a la sesión se hace un control de la articulación con Tc 99m para tener una imagen objetiva de la inflamación; se eleva el FAH a 15% por encima del nivel de coagulación y entonces se practica la inyección del material radioactivo previa artrocentesis con anestesia local; al terminar la inyección se lava la aguja antes de retirarla con anestesia para evitar que haya un transvase del material y una posible quemadura. Se inmoviliza la articulación con yeso durante 4-7 días y en caso de haber usado un coloide con radiación gamma (Au 198, Re 189) se practica una gammagrafía para comprobar que la inyección fue intrarticular y no ha habido ninguna fuga del material radioactivo. Se hacen controles clínicos periódicos, evaluando las posibles recurrencias, los requerimientos de FAH necesarios para tratar éstas y los días de tratamiento. También se practican estudios cromosómicos antes y después de la inyección para evaluar la posible presencia de aberraciones cromosómicas.6,10 Los materiales radioactivos usados en nuestra Unidad han sido oro (Au 198), renio (Re 189) e itrio (Y 90) (tabla 4).
Las dosis a utilizar son: rodillas 5 milicuries disueltos en 10 a 15 cc de solución fisiológica, hombros % cc disueltos en 5 cc de solución, codos 3 milicuries disueltos en 3 cc de solución y tobillos 2 milicuries disueltos en 2 cc de solución.
Estudios cromosómicos
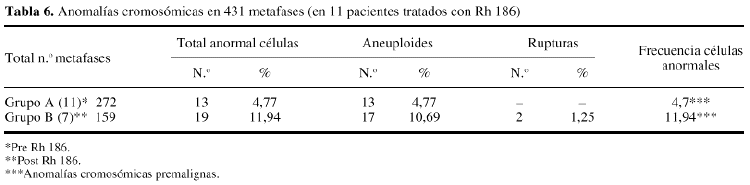
Con el fin de comprobar la seguridad de la sinoviortesis radioactiva desde el punto de vista de lesiones cromosómicas, se llevaron a cabo una serie de estudios cromosómicos por métodos de banda y técnicas de fluorescencia en hemofílicos no irradiados, antes de la sinoviortesis y 1, 2, 5 y 6 años después de la inyección de material radioactivo6,8,10 y se demostró que con Au 198 aparecieron lesiones premalignas del tipo marcador y dicéntricos en proporción menor a 2% (considerada peligrosa) y que desaparecieron totalmente en el segundo estudio practicado a dichos pacientes, no reapareciendo. Estas anomalías no aparecieron en los estudios con Re 189 e Y 90. Se puede concluir que no existieron lesiones premalignas achacables al isótopo radioactivo, pudiéndose así considerar un material seguro (tablas 5 y 6).
Sinoviortesis con rifampicina
En 1989 se propuso el uso de rifampicina intrarticular que debido a su acción fibrosante actúa sobre la sinovial esclerosándola y reduciendo así la posibilidad de hemartrosis. Las dosis utilizadas fueron: para rodillas 500 mg disueltos en 10 cc de anestesia, hombros la misma dosis en 5 cc de anestesia, y codos y tobillos 250 mg en 3 cc de anestesia, practicando una inyección semanal durante 5 a 7 semanas según evolución cubriendo al paciente con FAH el día de la inyección a 30%.11
La sinoviortesis con rifampicina es un procedimiento altamente satisfactorio, si se hace una buena selección de los pacientes, especialmente casos Grado II. Su inconveniente es que se requieren varias sesiones, lo que encarece por el precio del FAH y es dolorosa sobre todo las 3 primeras inyecciones. Está contraindicada en casos agudos y casos crónicos con articulaciones «llenas»; los resultados obtenidos con este procedimiento son totalmente superponibles a los obtenidos con sinoviortesis radioactiva.
Sinoviortesis con clorhidrato de oxitetraciclina
Ante la dificultad de obtener rifampicina inyectable, se ha desarrollado este año el uso del Clorhidrato de Oxitetraciclina (emiciina, Pfizer) como material fibrosante intrarticular. Este antibiótico, con condiciones fibrosantes y antifibrinolíticas similares a la rifampicina viene en frascos de 20 y 100 cc de producto con una actividad de 50 mg por cc. Las dosis utilizadas son, para rodillas de 4 a 8 cc (200 a 400 mg) según el volumen articular y disueltos en 5 a 10 cc de anestesia; codos 2 cc (100 mg) disueltos en 3 cc de anestesia y tobillos 1 cc (50 mg) disueltos en 1 cc de anestesia. También es dolorosa la inyección, pero tiene la ventaja que con sólo 3 inyecciones con intervalos semanales, se obtienen resultados similares a la rifampicina, por lo que el precio del tratamiento es menor.
Hematomas musculares
Es el segundo episodio en frecuencia y acontece en el 53% de los pacientes. La etiología de estos episodios está ligada a traumas que aunque pequeños darán lugar a equimosis más o menos extendidas y al ser de mayor intensidad darán lugar a los típicos hematomas de distinta gravedad e importancia según la localización. Excepto el hematoma del psoas (una emergencia real) los hematomas no suelen recidivar por la acción fibrosante de la cicatrización que estrangula los vasos sangrantes. En casos de hemofilia severa el hematoma puede ser espontáneo.4,5,7,9,15
Patología
Al existir un acúmulo de sangre a presión entre las fibras musculares, algunas de estas fibras se necrosan viéndose histológicamente como células sin núcleo en el coágulo. Aparece una reacción defensiva celular con polimorfonucleares, fagocitos mononucleares y células conjuntivas inmaduras. Al reabsorberse el hematoma aparece la típica fibrosis, que impedirá la recurrencia, pero al comprimir las células musculares vecinas las lesionará. Si el tamaño del hematoma hace difícil la reabsorción del mismo por los fagocitos antes de que esta fibrosis ocurra, aparecerá una lesión tipo quística rellena de detritus con tendencia a enquistarse y crecer produciendo necrosis y atrofia de los tejidos vecinos y adquiriendo un aspecto pseudotumoral, que puede llegar a romper por la piel con el peligro consiguiente de infección. Si el quiste está en un músculo bien limitado puede quedar confinado a él, pero si es en un músculo de inserción ancha, como el psoasilíaco el quiste puede invadir el periostio y luego el hueso, dando lugar a los pseudotumores hemofílicos.4,7
El dolor producido por el hematoma es de menor intensidad que el de la hemartrosis y depende de la tensión del músculo en su fascia. Por lo tanto, si el músculo permite poca distensión el dolor será más intenso y precoz que aquellos que puedan distenderse, ya que tolerarán mejor hemorragias de mayor tamaño.
Habrá un aumento de volumen de consistencia más o menos dura y dolorosa al tacto. La superficialidad de su localización permite un fácil control de la evolución. Los músculos afectados colocarán a las articulaciones vecinas en posición de máxima protección y reposo. Estas contracturas deberán ser tratadas precozmente para evitar rigideces y disminución del rango articular que conducirán a una artropatía hemofílica secundaria. Cualquier intento de corregir estas contracturas, durante la fase aguda, por métodos violentos producirá no sólo un aumento del dolor sino un nuevo sangrado y empeoramiento del hematoma. El hematoma puede comprimir nervios satélites dando lugar a síntomas neurológicos debido a la neuropraxia o axonotmesis producida por la brusca o progresiva compresión externa. Al ceder el hematoma se producirá una completa recuperación de los síntomas neurológicos excepto los reflejos involucrados que permanecerán abolidos, probablemente debido a una obliteración de los vasa vasorum. Los síntomas neurológicos aparecen varios días después del hematoma vecino.
Tratamiento
El tratamiento irá encaminado a controlar el sangrado y disminuir el dolor, cosa que se consigue elevando el nivel de FAH a niveles terapéuticos por encima de 50-70% hasta ceder los síntomas agudos, generalmente 5 a 7 días, dependiendo de la intensidad del sangrado muscular y luego continuar la cobertura a niveles más bajos hasta que la recuperación total tenga lugar. Entonces se deberá mantener o recuperar la función venciendo las contracturas que conducirán a cambios crónicos articulares. Localmente, se colocará hielo en las fases agudas para dar lugar a una vasoconstricción y disminuir la progresión del hematoma, y luego se aplicará calor, una vez el hematoma esté establecido, para favorecer la reabsorción. Esto lo podremos lograr con calor local, ultrasonido, onda corta, etc. Deberemos lograr una cierta inmovilización con reposo, no uso de las articulaciones y en caso de miembros inferiores evitar el apoyo.
Por muy grande que nos parezca el hematoma nunca se deberá aspirar. La movilización se iniciará al ceder el cuadro agudo, empezando entonces el uso y apoyo siempre al principio bajo cobertura de FAH. Si hay un compromiso de un nervio satélite es útil la vit E y la electroestimulación. Si en ausencia de inhibidores y a pesar de un correcto tratamiento persistiese el hematoma, deberemos pensar en que éste se esté transformando en un pseudoquiste. El tratamiento consistirá en recalcular la cobertura y el uso de radioterapia con 800-1.200 rads divididas en varias sesiones.3-5,7,17
Quistes hemofílicos
Primeramente descritos por Starker en 1918,4 pueden ser descritos como un reservorio encapsulado de sangre con tendencia a crecer y aumentar progresivamente de tamaño ya rápida o ya lentamente y dependiendo de su localización invadir tejidos vecinos, imitando un tumor. Se llaman quistes cuando son pequeños y poco trabeculados y pseudotumores cuando son grandes, trabeculados e invasivos. Pueden ser espontáneos sin causa para el sangrado en un espacio cerrado y postraumáticos apareciendo después de un traumatismo. Se llaman «verdaderos» cuando se trate de un sangrado intraóseo y «falsos» cuando se originan en una inserción muscular.
Los quistes pueden ser en tejidos blandos, subperiósticos, yuxtaóseos e intraóseos. Más frecuentes en fémur y pelvis seguidos de tibia, huesos del pie y mano, húmero, mandíbula y radio. Su localización dependerá de la maduración ósea. Así en los niños suelen ser de localización distal (antebrazo, pierna, manos y pies) y en los adultos más proximales (pelvis y epífisis proximales de húmero y fémur). Clinicamente el aumento de tamaño puede no acompañarse de dolor. En los quistes de rápido crecimiento existirá dolor acompañado de consistencia elástica y de agresividad expansiva. Los quistes intraóseos son al principio duros pero al romper la cortical en su crecimiento se convierten en elásticos. El aspecto radiológico de estos quistes y pseudotumores no es característico y puede ser confundido con otras patologías incluso tumorales. Los quistes situados en tejidos blandos se verán como áreas de densidad aumentada superponiéndose a tejidos vecinos. Los subperiósticos o yuxtaóseos se verán como engrosamientos o elevaciones del periosteo y la cortical del hueso. Los intraóseos o quistes verdaderos se verán como áreas lobuladas y trabeculadas con lesiones osteolíticas que al crecer pueden destruir la cortical.
Tratamiento
Su prevención es de suma importancia y consiste en tratar el hematoma muscular antes de que éste se transforme en un quiste o pseudotumor. Una vez presente deberá cubrirse con altas dosis de FAH, radiaciones del orden de 1.000 a 15.000 rads e inmovilización. La cirugía estará indicada sólo si es de gran tamaño y de gran agresividad.
Desde noviembre de 1982 se ha desarrollado un nuevo método de tratamiento percutáneo de los quistes o grandes pseudotumores no resecables quirúrgicamente. El procedimiento consiste en previa localización del quiste con el intensificador de imágenes radiográficas, la introducción de un trócar para proceder al vaciamiento de la sangre del quiste. Se llena entonces este espacio a presión con «Cola de Fibrina» (tissucol, berinplast), y se retira el trócar. La cola de fibrina es un preparado comercial con grandes concentraciones de fibrinógeno, factor XIII y proteínas no criosolubles y aprotinina como inhibidor de la fibrinólisis y como precipitador un segundo componente formado por trombina y cloruro de calcio. Esta preparación tiene propiedades hemostáticas, selladoras y cicatrizantes. La cantidad de cola de fibrina a inyectar es de 1 cc por cada 4 cc de sangre extraída del quiste.
En la Unidad de Buenos Aires ampliamos esta técnica para aquellos casos de quistes de mayor tamaño en que abordamos la lesión intraósea de forma tal de poder introduciir un trócar de mayor tamaño para, a la hora de rellenarla hacerlo además de con cola de fibrina con injertos óseos. Últimamente se ha desarrollado una técnica endoscópica que ha permitido, en los grandes pseudotumores blandos, explorar completamente por método visual el pseudotumor, su contenido y paredes y comprobar el correcto relleno.