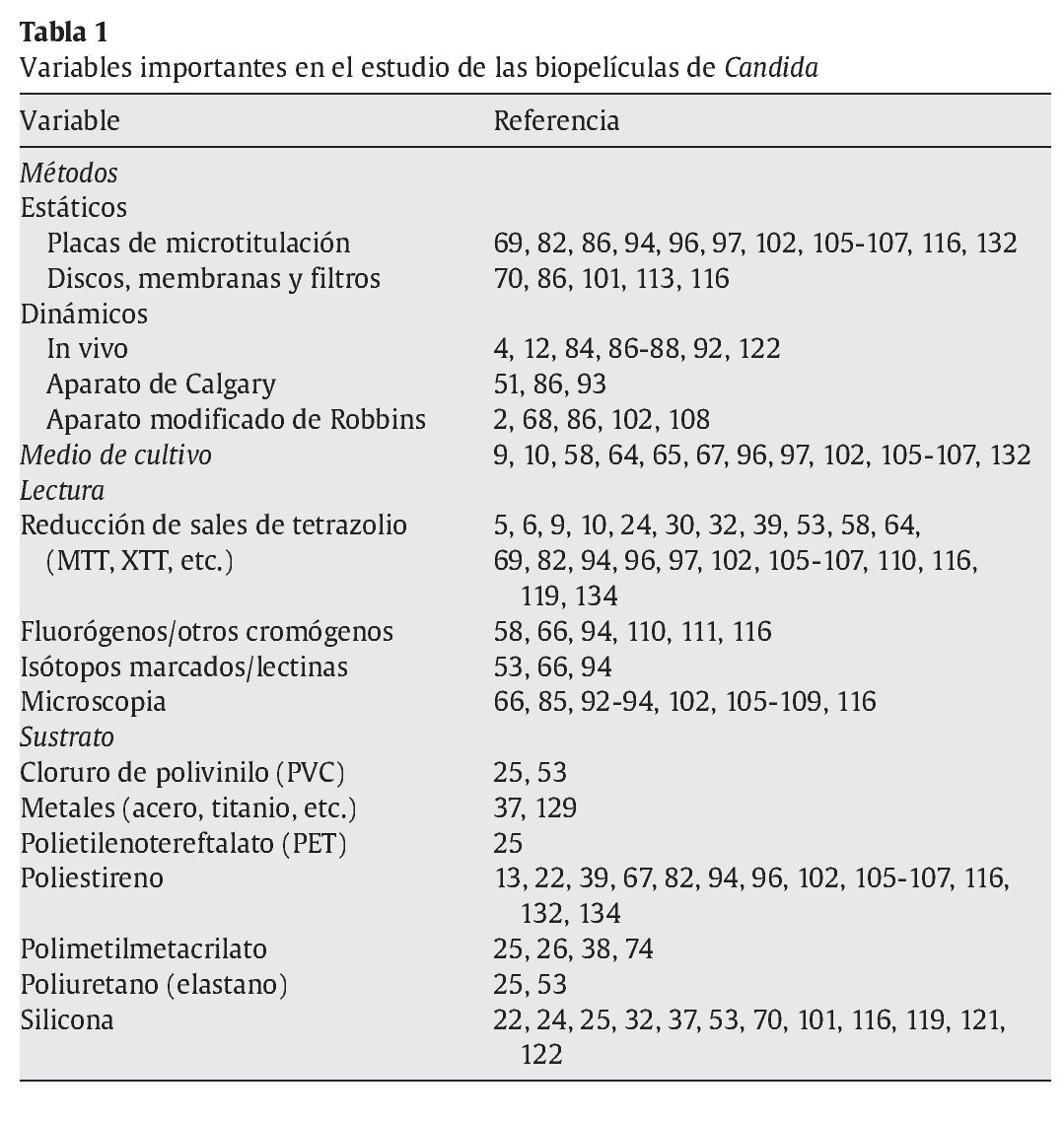
Las micosis invasoras han aumentado su incidencia debido al mayor número de personas con enfermedades predisponentes, como los pacientes receptores de trasplantes de órganos, pacientes de sida y otros pacientes inmunodeficientes, recién nacidos de peso bajo, pacientes críticos con múltiples catéteres o pacientes con neoplasias. La mayoría de micosis invasoras están sometidas a múltiples maniobras diagnósticas y terapéuticas, se tratan con fármacos antimicrobianos de amplio espectro o son portadoras de catéteres y otros dispositivos intravasculares. La morbilidad y la mortalidad elevadas, junto con un pronóstico sombrío, las han convertido en un problema de salud importante104,124,125. Muchas de las micosis más recalcitrantes al tratamiento se asocian a la colonización y la formación de biopelículas. Tumbarello et al130 han observado que la producción de biopelícula por Candida se asocia a una mortalidad más elevada en pacientes con candidemia, probablemente porque impide la erradicación completa de este microorganismo del torrente circulatorio. Se estima que entre el 10 y el 30% de los catéteres urinarios se asocia a la presencia de infección y formación de biopelículas, y lo mismo ocurre con el 5-10% de los materiales de fijación de fracturas óseas, el 3-8% de los catéteres venosos centrales, el 1-7% de los marcapasos, injertos vasculares, prótesis articulares y válvulas cardíacas mecánicas40,90,133. La formación de biopelículas es muy frecuente en prótesis dentales y laríngeas y en cualquier otro aparato o dispositivo biomédico empleado en contacto con las superficies cutáneas y mucosas28,31,33,77,127. Las biopelículas son difíciles de eliminar por los mecanismos defensivos inmunológicos75,85,87,88,114,115 y con el tratamiento antimicrobiano habitual43,62,71,76,85,104,117. Las biopelículas pueden convertirse en un reservorio y fuente de infección humana14,15,28 y el crecimiento microbiano sobre los dispositivos biomédicos puede alterarlos, disminuir su funcionalidad o inhabilitarlos1,85,127.
Una biopelícula es una comunidad microbiana bien estructurada con las células fúngicas inmersas en una matriz extracelular de naturaleza predominantemente polisacárida. Las biopelículas se unen de modo irreversible a un sustrato, y las células sésiles que la componen muestran características fenotípicas diferentes a sus correspondientes células de vida libre o planctónicas. El conocimiento alcanzado sobre biopelículas bacterianas es abundante, pero los estudios acerca de las biopelículas fúngicas son más recientes y menos numerosos8,26,43,71,76,85,86,96,103,104. La mayoría se han realizado con Candida, aunque otros géneros, como Aspergillus27, Cryptococcus78-81, Fusarium61 o Pneumocystis34, son capaces de producir biopelículas. En el género Candida destacarían por su capacidad de producir biopelículas Candida albicans, Candida dubliniensis, Candida glabrata, Candida guilliermondii, Candida krusei, Candida parapsilosis y Candida tropicalis1,2,7,18,30-32,56,72,111,123,135. Sin embargo, es probable que la mayoría de los hongos patógenos produzcan biopelículas como una ventaja adaptativa, tanto en la colonización de las células y tejidos humanos, como de prótesis, implantes y catéteres médicos16,39,50,61.
En las biopelículas candidiásicas conviven diferentes formas celulares con un sistema de comunicación intercelular (quorum sensing) que modula su desarrollo y permite el crecimiento y la dispersión celular57. Moléculas, como tirosol y farnesol, actúan como mensajeros en esta comunicación entre células3,59,60. Estas mismas biomoléculas también se han detectado en las biopelículas desarrolladas por otros hongos, como Pneumocystis34. El tirosol favorece la formación de las hifas y la biomasa de la biopelícula en las etapas iniciales (1-6 h). Se ha comprobado que las células sésiles producen cantidades significativamente mayores de tirosol que las planctónicas3. El farnesol inhibe la formación de hifas, evita el desarrollo excesivo de la biopelícula madura y favorece la dispersión celular a otras localizaciones3,19,59,60,104. Algunos antifúngicos, como fluconazol y voriconazol, estimulan in vitro la producción de farnesol por las células sésiles13,59,60,63. La dispersión celular también se ve facilitada por el ácido cis-2-decenóico y otros ácidos grasos de cadena corta que actuarían como señales de comunicación entre las células36. La combinación del farnesol o de ácidos grasos de cadena corta con fluconazol o voriconazol tiene un efecto reductor de las biopelículas candidiásicas45,63.
La formación de las biopelículas de Candida tiene varios estadios diferenciados. En las fases iniciales (≤ 6 h), se produce una adhesión celular al sustrato con la formación de capas sencillas de levaduras gemantes con gran actividad metabólica. Después se produce una progresiva maduración que va dotando a la biopelícula de una arquitectura cada vez más compleja con abundancia de hifas. En estas biopelículas maduras (> 24-48 h), destaca la presencia de una serie de canales acuosos que permiten el flujo de agua, nutrientes y productos de desecho. El origen de estos microcanales parece asociarse al despegue y liberación de microcolonias de Candida dentro de la biopelícula33. Mukherjee et al85 evaluaron la arquitectura y el grosor de las biopelículas en catéteres de pacientes que presentaban candidemias o candidiasis invasoras. Estas biopelículas, que estaban sometidas a un estrés de presión por la fuerza del torrente sanguíneo, tenían una estructura compacta y estaban compuestas en su mayoría por levaduras con una actividad metabólica importante. Además, observaron una gran variación de la morfología y arquitectura de las biopelículas según las condiciones ambientales. Tsang et al129 observaron que la formación de biopelículas de C. albicans sobre discos de titanio no se modificaba por la presencia de alteraciones, estriaciones o rugosidades de la superficie de este metal. Sin embargo, cuando estas biopelículas eran expuestas a diferentes concentraciones de anfotericina B, las biopelículas formadas sobre superficies poco o muy rugosas eran más sensibles a la acción fungicida que las desarrolladas sobre superficies con una rugosidad intermedia que permitían a las células sésiles sobrevivir en las alteraciones de la superficie metálica. También es importante la asociación de la capacidad de filamentación de Candida con la adhesión a las superficies: las hifas, por tigmotropismo, crecen hacia los lugares de la superficie donde hay más irregularidades, rugosidades u oquedades que van a facilitar la multiplicación del hongo, la producción de microcolonias y el desarrollo de biopelículas76.
Mayor resistencia de las biopelículas a los antifúngicos
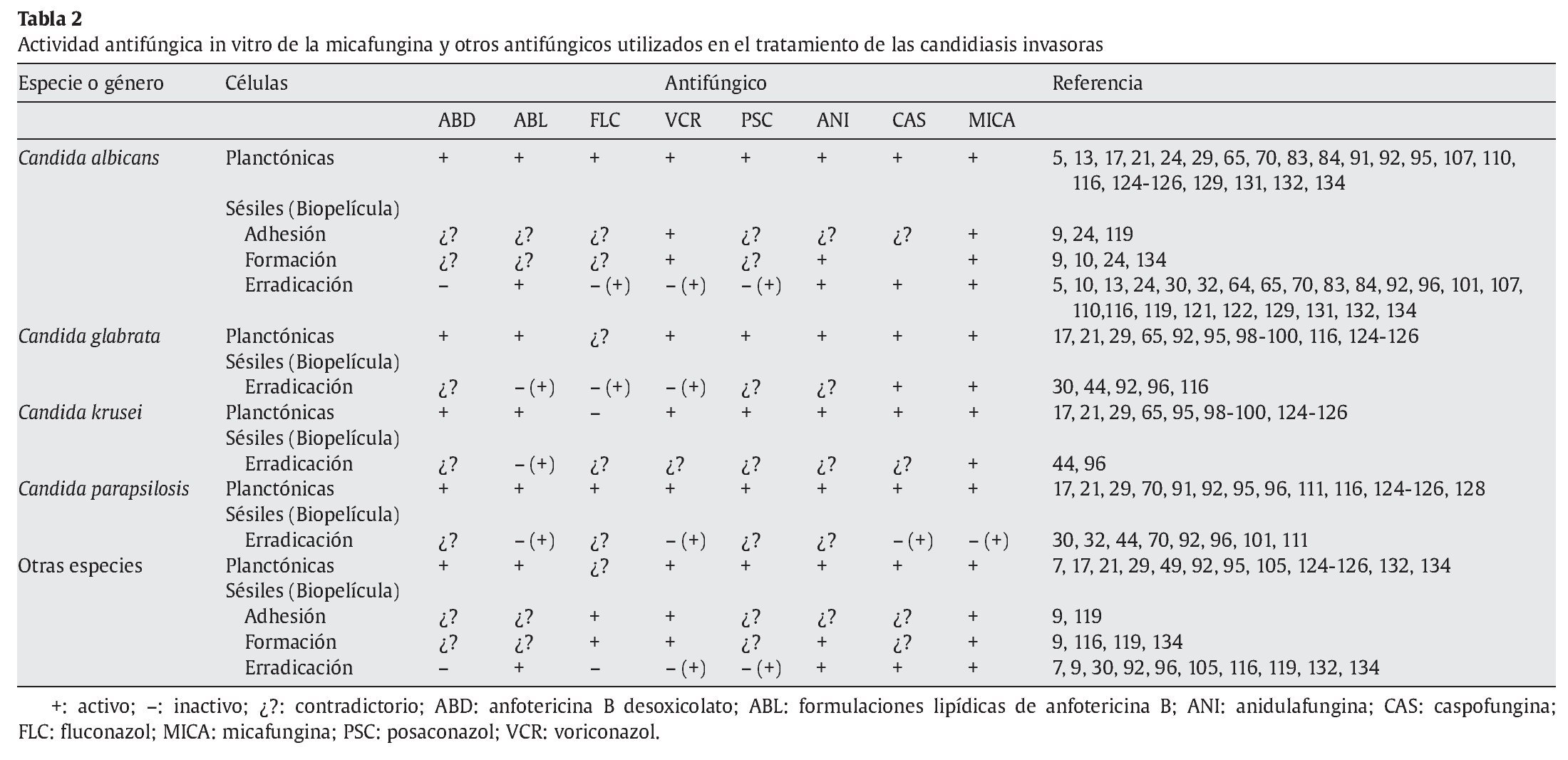
En 1995, Hawser et al52,53 observaron que las biopelículas de C. albicans desarrolladas sobre discos de cloruro de polivinilo (PVC), eran entre 30 y 2.000 veces más resistentes a fluconazol, anfotericina B, 5-fluorocitosina, itraconazol y ketoconazol que las células planc tónicas. Después de su publicación, la mayoría de los estudios rea lizados sobre la actividad antifúngica en biopelículas han constatado que el fluconazol y los nuevos triazoles (posaconazol, ravuconazol y voriconazol) carecen de una actividad importante contra las biopelículas de C. albicans y otras especies diferentes de Candida13,18,26,42,43,50,53,62,63,83,96,111. Sin embargo, las formulaciones lipídicas de la anfotericina B y las equinocandinas son más activas sobre las biopelículas que la anfotericina B desoxicolato o los azoles (tablas 1 y 2)122. La resistencia de las biopelículas de Candida a los antifúngicos es un fenómeno multifactorial en el que parecen intervenir diferentes mecanismos como: a) la barrera física formada por la matriz polimérica extracelular; b) la presencia de células persistentes, tolerantes o durmientes, con menor actividad metabólica; c) los distintos fenotipos celulares dentro de la biopelícula; d) la sobreexpresión de diferentes genes asociados con los mecanismos moleculares de resistencia a los antifúngicos, y e) un microambiente pericelular poco propicio para la actividad de los antifúngicos.
La matriz extracelular, formada por hidratos de carbono, proteínas, hexosamina, fósforo y ácidos nucleicos, está altamente hidratada y confiere a la biopelícula un aspecto gelatinoso2. La matriz es el soporte principal de la biopelícula y su producción aumenta con el tiempo de maduración2,25,26. Su composición varía según la especie: así, en las biopelículas de C. albicans está presente de forma mayoritaria la glucosa (32%), mientras que en las de C. tropicalis abunda la hexosamina (27%)2. La composición de la matriz puede ser la causa del distinto grado de penetración de los antifúngicos. Se ha comprobado que la difusión de la 5-fluorocitosina y fluconazol es más lenta en las biopelículas de C. tropicalis que en las de C. albicans43. Esta composición no parece tener tanta importancia en la difusión de la anfotericina B y las equinocandinas2,32,43. Sin embargo, las biopelículas estudiadas con métodos dinámicos (tabla 1) son más resistentes a la anfotericina B y fluconazol, así como también lo son las biopelículas mixtas de Candida con Staphylococcus epidermidis que se vuelven también más resistentes a los antibióticos antiestafilocócicos, como la vancomicina2. El β-1,3-D-glucano, aumentado en las biopelículas, podría desempeñar un papel importante en la reducción de la actividad de los azoles y los polienos, cuya actividad frente a las biopelículas de C. albicans aumenta marcadamente cuando se añaden glucanasas in vitro88.
La existencia de células persistentes (tolerantes o durmientes) es controvertida68,71,73,75. Al-Dhaheri y Douglas1 observaron que no se encontraban células persistentes entre las poblaciones celulares planctónicas de C. albicans, C. glabrata, C. krusei, C. parapsilosis y C. tropicalis, n en las biopelículas de C. glabrata y C. tropicalis. Sin embargo, detectaron células persistentes en las biopelículas desarrolladas por una de las 2 cepas de C. albicans estudiadas y en las de C. krusei y C. parapsilosis. LaFleur et al73 observaron que las células persistentes eran muy tolerantes a la presencia de cicloheximida y anfotericina B, y eran capaces de continuar con el desarrollo de la biopelícula en presencia de estos compuestos. También, Khot et al68 describieron una subpoblación de células levaduriformes dentro de las biopelículas que eran resistentes a la anfotericina B a diferencia del resto de las células sésiles. Estas células exhibían una regulación diferente de varios genes, como ERG1, ERG25, SKN1 y KRE1, relacionados con la composición de la membrana y la pared celular fúngica.
Además, en las células sésiles de las biopelículas de C. albicans se ha observado una sobreexpresión de los genes que regulan la síntesis de aminoácidos, nucleótidos y proteínas48, y que los mecanismos de bombeo de expulsión de fluconazol y otros antifúngicos también estaban aumentados en las células sésiles de diferentes modelos de biopelículas de Candida4. Mukherjee et al83 observaron que las células sésiles de C. albicans expresan los genes CDR y MDR1 (codifican bombas de expulsión de fármacos) en todas sus fases de desarrollo de la biopelícula. También se ha observado que las células sésiles de C. tropicalis sobreexpresan ERG11 (codifica la 14 α-demetilasa del lanosterol) y MDR17. Por otra parte, se ha detectado una sobreexpresión de CgCDR1 y CgCDR2 en las fases iniciales de la biopelícula formada por C. glabrata, pero no en las biopelículas maduras de esta especie, mientras que CgERG11 no se sobreexpresaba en ninguna fase del desarrollo135. La expresión de bombas de expulsión de fármacos se ha asociado a la resistencia a los antifúngicos azólicos de las biopelículas inmaduras, pero parece improbable que sea un factor importante en la resistencia observada en biopelículas maduras de Candida73,83. En las biopelículas maduras se ha descrito una disminución del contenido de ergosterol y una reducción de la expresión de ERG11, lo que provoca que los azoles (fluconazol, posaconazol o voriconazol) que actúan inhibiendo la síntesis de ergosterol y los polienos (anfotericina B y nistatina) -cuyo mecanismo de acción implica la unión del antifúngico a esta molécula de la membrana celular- vean disminuida su actividad antifúngica. Sin embargo, la presencia de concentraciones menores de ergosterol en la membrana citoplásmica o la biosíntesis reducida de éste es poco probable que influyan en la actividad inhibitoria de la síntesis de β-1,3-D-glucano de la pared celular por las equinocandinas48,71,83,85. Para una información más detallada sobre los mecanismos moleculares de resistencia a los antifúngicos, puede consultarse la reciente revisión de Espinel-Ingroff46.
La densidad y la edad celulares son factores que se han asociado con la resistencia a los antifúngicos, pero sin unanimidad en los estudios97,118. También se ha asociado la densidad celular y el microambiente pericelular, con modificaciones del pH y de las concentraciones de metabolitos, con la disminución de la actividad de los antifúngicos, principalmente de los azoles y anfotericina B, contra las células sésiles de C. albicans en ausencia de sobreexpresión de bombas de expulsión y en cepas carentes del gen CHK1, que son insensibles a la molécula de quorum sensing, farnesol97.
Actividad de la micafungina y otras equinocandinas contra las biopelículas fúngicas
Las 3 equinocandinas disponibles para el tratamiento de las micosis invasoras -anidulafungina, caspofungina y micafungina- y la nueva equinocandina en estudio -aminocandina- han mostrado una actividad excelente contra las biopelículas de C. albicans (tabla 2). Su acción es eficaz tanto en las fases iniciales de adhesión y desarrollo de la biopelícula, como en la erradicación de las biopelículas ya formadas5,23,24,64,67,96,132,134. Esta actividad es comparable e incluso mayor que la obtenida con las formulaciones lipídicas de anfotericina B y hay estudios in vitro e in vivo que, en mayor o menor medida, muestran la actividad de las equinocandinas contra las biopelículas de otras especies de Candida5,24,32,64,132. Sin embargo, hay que tener en cuenta que la mayoría de los estudios se han realizado con un número limitado de cepas o aislamientos clínicos y la especie más estudiada ha sido C. albicans.
A partir de estos estudios, hay 2 datos destacados: a) la actividad contra las biopelículas requiere concentraciones de equinocandina superiores a las que inhiben el crecimiento de las células planctónicas (entre 10 y 100 veces superiores), y b) esta actividad muestra una gran variabilidad entre especies e, incluso, dentro de los aislamientos clínicos de la misma especie, según el origen de éstos o del sustrato empleado para el estudio (tablas 1 y 2)5,67,70,119. Un ejemplo claro son C. parapsilosis y C. tropicalis, las cuales presentan aislamientos productores de biopelículas sensibles, menos sensibles y resistentes a las equinocandinas30,64. Esta mayor actividad en las biopelículas de las equinocandinas se relaciona con su acción en el β-1,3-D-glucano, que es esencial en la pared celular de Candida y desarrolla un papel importante en la adhesión de este microorganismo a las superficies87,88,116.
La micafungina es una nueva equinocandina fungicida para Candida y fungistática con otros hongos patógenos, como Aspergillus, tanto sobre células planctónicas99,120,134, como sésiles24,30,70. Los mecanismos por los que se produce la acción contra las biopelículas no son completamente conocidos70, pero puede asociarse tanto a su acción contra la matriz polimérica extracelular2,70, como a su actividad reductora del metabolismo de las células sésiles93 y a su mejor difusión y alcance de la diana terapéutica2, el β-1,3-D-glucano de la pared96,98,99,116. Esta acción selectiva contra la pared fúngica provoca alteraciones estructurales (fig. 1) e inestabilidad osmótica que puede causar la muerte del hongo: las células gradualmente aumentan de tamaño, con deformación del contorno, formación de septos anómalos y una disminución prominente de la capa intermedia de la pared89.
Figura 1. Efecto antifúngico in vitro de la micafungina (0,25 μg/ml) en las células sésiles de Candida albicans.
Hay varios estudios que resaltan la importancia de la actividad antibiopelícula de las equinocandinas (tabla 2). Así, Seidler et al116 observaron que la micafungina era activa frente a las biopelículas desarrolladas en poliestireno o secciones de catéter venoso central por diferentes aislamientos clínicos de 6 especies diferentes de Candida (C. albicans, C. dubliniensis, C. glabrata, C. kefyr, C. parapsilosis y C. tropicalis). También Katragkou et al67 han descrito el efecto inhibitorio de las equinocandinas en el metabolismo de las biopelículas de C. albicans y C. parapsilosis que eran resistentes a anfotericina B desoxicolato, fluconazol, nistatina, ravuconazol o voriconazol.
Villar-Vidal134 observó que las concentraciones de micafungina (medias geométricas de las concentraciones mínimas inhibitorias [CMI]50) necesarias para inhibir las biopelículas preformadas eran 0,07 μg/ml y 0,205 μg/ml para C. albicans y C. dubliniensis, respectivamente. Sin embargo, hallaron una gran diversidad en la sensibilidad a la micafungina: los aislamientos de C. dubliniensis de sangre (media geométrica de la CMI = 0,17 μg/ml) y orales (media geométrica de la CMI = 0,249 μg/ml) eran menos sensibles que los aislamientos de C. albicans de sangre (media geométrica de la CMI = 0,05 μg/ml) y orales (media geométrica de la CMI = 0,101 μg/ml). Villar-Vidal134 t ambién evaluó la actividad de anidulafungina y micafungina en la fase inicial de la formación de biopelícula, ya que una vez iniciada la adhesión, se pone en marcha una complicada maquinaria celular que culmina con el desarrollo de una compleja biopelícula difícil de erradicar. Encontró que las concentraciones necesarias eran muy similares a las que inhibían el crecimento de las células planctónicas (de 0,06 a 0,5 μg/ml). Choi et al30 obtuvieron resultados parecidos, con una reducción significativa de la actividad de las biopelículas de Candida (p < 0,05) a concentraciones relativamente bajas de micafungina y caspofungina (0,0125 a 1 μg/ml). La caspofungina y la micafungina ejercían un efecto reductor del 80% de la actividad metabólica de reducción del XTT con concentraciones entre 0,25 y 1 μg/ml contra las biopelículas de C. albicans y C. glabrata; sin embargo, su actividad es mucho menor frente a las biopelículas de C. parapsilosis30.
Cateau et al24 comprobaron que la micafungina tiene una actividad inhibidora excelente de la adhesión de C. albicans a los catéteres de silicona, impide el desarrollo de biopelículas sobre este sustrato y erradica las biopelículas ya desarrolladas en 12 h a 5 días, manteniendo este efecto durante 48 h, lo que permite considerar su utilidad potencial para el sellado de catéteres intravasculares. La actividad antibiopelícula de las equinocandinas también se ha podido comprobar en diversos modelos animales o celulares121, sin que se encontraran ventajas significativas en esta actividad con la combinación de caspofungina con otros antifúngicos, como voriconazol122.
En la mayoría de los estudios no hay una correlación entre la CMI de equinocandinas obtenidas con las células planctónicas y las obtenidas con las células sésiles, pero sí una correlación de la actividad de las diferentes equinocandinas, aunque haya variaciones particulares entre ellas para cada aislamiento concreto2,134. La existencia de diferencias importantes en la actividad de las equinocandinas contra las biopelículas de Candida se ha descrito con anterioridad30,70. También se ha descrito una actividad menor de la anidulafungina contra las biopelículas desarrolladas por C. tropicalis que contra las desarrolladas por C. albicans132. Además, Melo et al82 han descrito un efecto paradójico de la caspofungina, con un resurgimiento del crecimiento de las biopelículas formadas por las especies C. albicans, C. parapsilosis, C. metapsilosis y C. orthopsilosis, con concentraciones de caspofungina superiores a la CMI. Este efecto paradójico no era tan claro con las biopelículas de C. tropicalis, porque las células planctónicas y sésiles de esta especie presentaban una sensibilidad menor a la caspofungina. Hay que valorar que la mayoría de los estudios de la actividad in vitro de los antifúngicos se han realizado con biopelículas de aislamientos de origen oral o de sangre. Como ejemplo, está el estudio de Jain et al65, los cuales observaron que las biopelículas de aislamientos obtenidos de catéteres urinarios mostraban una resistencia a caspofungina y fluconazol, aunque eran inhibidas por CMI50 < 1 μg/ml de anfotericina B.
Esta menor actividad contra C. parapsilosis también la han descrito Khun et al70 y Melo et al82, los cuales comprobaron que eran necesarias concentraciones más altas de equinocandinas para inhibir las biopelículas de C. parapsilosis (media geométrica, 9,1 μg/ml para 7 aislamientos), Candida orthopsilosis (media geométrica, 4 μg/ml para 8 aislamientos) y Candida metapsilosis (media geométrica, 2 μg/ml para 5 aislamientos)82. Finalmente, la caspofungina, y probablemente también las demás equinocandinas, no es activa contra las biopelículas de Trichosporon ashaii39 o Cryptococcus neoformans78-81.
Debido a esta variabilidad de la sensibilidad de las biopelículas a los antifúngicos, se están evaluando nuevas estrategias para el tratamiento de las micosis asociadas a las biopelículas. Estas propuestas están en fase de estudio e incluyen nuevos compuestos (terpenos - como timol11,35, carvacrol35 o geraniol35-, ácidos grasos de cadena corta45, baicaleina18, eugenol55, lisozima112, quitosano20, etc.) y combinaciones de fármacos (anfotericina B con doxiciclina o rifampicina44, miconazol con clorhexidina74, anfotericina B complejo lipídico con ácido etilendiaminotetracético [EDTA]101, nistatina, miconazol o anfotericina B con lisozima112, inhibidores de la calcineurina -ciclosporina y FK506- y fluconazol131, etc.), la inmersión de los biomateriales en soluciones microbicidas96, ondas acústicas54, modificación de la superfície o liberación de antimicrobianos de los catéteres y dispositivos biomédicos25,41,47, EDTA38,51,101, etc. La mayoría de estas aproximaciones serían útiles en aplicación tópica (cepillos de dientes, prótesis dentales, etc.) o en el sellado de catéteres o recubrimiento de materiales biomédicos5, pero todavía deben realizarse estudios más amplios que permitan valorar su utilidad real en la prevención y el tratamiento de las micosis invasoras asociadas al desarrollo de biopelículas.
Conclusión
La actividad antifúngica de la micafungina sobre las biopelículas de Candida refuerza su indicación terapéutica en el tratamiento de las candidemias y las candidiasis invasoras asociadas a catéteres, prótesis y otros implantes biomédicos.
Agradecimientos
Los autores han recibido financiación de los proyectos PI061895 del Fondo de Investigación Sanitaria y GIC07/123-IT-222-07 del Gobierno Vasco-Eusko Jaurlaritza.
Declaraciones de los autores
Los autores no tienen nada que declarar.
Historia del artículo:Recibido el 6 de febrero de 2009 Aceptado el 12 de febrero de 2009
*Autor para correspondencia.
Correo electrónico: guillermo.quindos@ehu.es (G. Quindós).