La información disponible sobre el uso de ciclopirox olamina en niños es limitada.
ObjetivosEl objetivo de este estudio fue evaluar la seguridad y eficacia de ciclopirox olamina crema al 1% en el tratamiento de la dermatomicosis en pacientes pediátricos.
MétodosEnsayo clínico fase iii multicéntrico, no controlado y abierto en pacientes de entre 3 meses y 9 años de edad diagnosticados de dermatomicosis mediante microscopía directa y cultivo, y tratados con ciclopirox olamina crema al 1% durante 28 días. Las evaluaciones clínicas y micológicas fueron realizadas antes del inicio del tratamiento, a los 7, 14 y 28 días de su inicio, y a los 28 días tras la finalización del mismo.
ResultadosSe incluyeron 21 pacientes con una media de edad de 2,7 años (rango 3 meses-9 años). La localización más frecuente de la micosis fue la ingle (62%), y el agente causal más común Candida spp. (71%). El 62% de los pacientes no presentó ningún acontecimiento adverso; se notificaron acontecimientos adversos leves o moderados y únicamente uno, una dermatitis irritativa, se relacionó con el tratamiento. La seguridad global fue excelente en el 95% de los casos, y buena en el 5%. Tras la primera semana de tratamiento, 12 de 13 (92%) pacientes mostraron mejoría clínica, y en 5 de 7 (71%) se constató una eficacia clínica y micológica favorable. Al final del tratamiento, la curación clínica se observó en 7 de 9 (78%) pacientes. Ningún caso sufrió recidivas.
ConclusionesCiclopirox olamina crema al 1% constituye un tratamiento seguro y efectivo de las micosis cutáneas superficiales, particularmente en infecciones por levaduras del género Candida, en niños de entre 3 meses y 10 años.
There is scarce information on the use of ciclopirox olamine in children.
AimsThe aim of this study was to evaluate the efficacy and safety of ciclopirox olamine cream 1% for the treatment of dermatomycosis in pediatric patients.
MethodsA multicenter, non-randomized, open-label, phase iii study was conducted on patients aged 3 months to 9 years diagnosed with dermatomycosis confirmed by direct microscopy and culture, and treated with ciclopirox olamine cream 1% for 28 days. Clinical and microbiological evaluations were performed before starting the treatment therapy, at 7, 14 and 28 days after starting the treatment, and 28 days after its completion.
ResultsTwenty-one patients with a median age of 2.7 years (range 3 months-9 years) were included. The most frequent mycosis location was the inguinal region (72%). The most frequently isolated etiological agent was Candida spp. (71%). No adverse events were reported in 62% of the patients. Among the mild and moderate reported adverse events, only one, irritative dermatitis, was considered as possibly related to the treatment. Safety evaluation was excellent in 95% of the patients, and good in 5%. After the first week of treatment, 12 patients out of 13 (92%) showed a clinical improvement, and 5 out of 7 (71%) had both clinical and mycological improvements. At the end of the treatment, clinical cure was observed in 7 out of 9 patients (78%). No relapses occurred.
ConclusionsCiclopirox olamine cream 1% is a safe and feasible treatment for superficial cutaneous mycotic infections, especially Candida spp. infection, in children aged between 3 months and 10 years.
Las micosis superficiales o dermatomicosis son enfermedades dermatológicas comunes en la infancia26. Las dermatomicosis en niños difieren de aquellas en adultos particularmente en su localización y los síntomas clínicos. Las infecciones por Candida son comunes en la edad pediátrica. La sobreinfección por Candida se encuentra asociada hasta en un 77% de los casos a la dermatitis del área del pañal, alteración dermatológica muy frecuente en la infancia13,19. Respecto a las dermatofitosis, la tinea corporis y la tinea capitis son frecuentes antes de los 12 años, mientras que la tinea pedis, la tinea cruris y la onicomicosis adquieren mayor protagonismo a partir de esa edad21.
La estrategia terapéutica para las dermatomicosis incluye el uso de antifúngicos de aplicación tópica9. Sin embargo, los datos publicados sobre la terapia tópica óptima en niños son escasos, y la mayoría de los compuestos tópicos actualmente indicados en adultos y adolescentes se emplean de forma empírica en la edad pediátrica.
Las posibles secuelas de las infecciones micóticas en niños, la hipersensibilidad a algunos antimicóticos como los derivados imidazólicos y el desarrollo de resistencia a los azoles en infecciones por Candida, entre otros factores, hacen especialmente relevante la necesidad de alternativas terapéuticas con un amplio espectro de acción antifúngica, y un perfil de eficacia y seguridad favorable.
Ciclopirox y su sal, ciclopirox olamina, son agentes antimicóticos pertenecientes al grupo de las hidroxipiridonas que poseen un mecanismo de acción único y complejo18,20,22,24,25 que proporciona un amplio espectro de acción antimicrobiana, con actividad frente a dermatofitos, hongos levaduriformes, mohos y algunas bacterias grampositivas y gramnegativas10,14, y un bajo potencial de desarrollo de resistencia fúngica20. La eficacia y seguridad de este agente frente a infecciones por dermatofitos o levaduras en adultos es ampliamente conocida1,3,6,16. Sin embargo, los estudios disponibles sobre la aplicación tópica de ciclopirox olamina en niños menores de 10 años con micosis superficiales son muy limitados, generalmente antiguos11,14, y no se restringen al tratamiento con la formulación en crema7,8,28.
El presente estudio se planteó con el fin de evaluar la seguridad de ciclopirox olamina crema en niños de 3 meses a 10 años afectados de dermatomicosis por levaduras o dermatofitos.
Material y métodosDiseño del estudioSe llevó a cabo un ensayo clínico fase iii multicéntrico, no controlado y abierto en pacientes ambulatorios atendidos en consultas externas de Dermatología de tres centros hospitalarios españoles. Tras la visita de selección (basal), los pacientes debían acudir a cuatro visitas tras 1, 2 y 4 semanas del inicio del tratamiento, y a las 4 semanas de la finalización del mismo.
La variable principal de estudio fue la seguridad global del tratamiento, y las variables secundarias, la eficacia clínica y micológica, y la aparición de recidivas.
Población de pacientesSe incluyeron pacientes consecutivos de entre 3 meses y 10 años diagnosticados de dermatomicosis por levaduras o dermatofitos mediante microscopía directa utilizando hidróxido de potasio y confirmado posteriormente mediante el crecimiento en cultivo. Antes del inicio del tratamiento se tomaron muestras para cultivo de dermatofitos y levaduras. El cultivo era supervisado en cada visita, en caso de negatividad en la visita anterior, siempre que persistiera alguna lesión visible, dado que el crecimiento del cultivo puede requerir de 2 a 5 semanas. Se excluyeron los pacientes con micosis en el cuero cabelludo o las uñas, los que habían tenido un tratamiento previo con antimicóticos orales o tópicos y aquellos con previsión de un tratamiento con corticosteroides.
Se obtuvo el consentimiento informado de todos los progenitores o representantes legales de los niños antes del inicio del estudio. Este fue aprobado por el Comité Ético del Hospital Reina Sofía de Córdoba, y se encuentra registrado en www.clinicaltrials.gov con el número de identificación NCT00605345.
El estudio fue llevado a cabo de acuerdo con la Declaración de Helsinki, las Guías de Buenas Prácticas Clínicas y la legislación vigente en España en referencia a los ensayos clínicos en población pediátrica.
TratamientoEl tratamiento con ciclopirox olamina en crema al 1% (Ciclochem®) debía aplicarse tópicamente una vez cada 12h durante 28 días.
No estaba permitido el uso de otros tratamientos antifúngicos ni corticosteroides (tópicos o sistémicos).
Evaluaciones del estudioEvaluación de la seguridadSe registraron los acontecimientos adversos (AA) notificados durante el tratamiento y 28 días después de la última aplicación del mismo.
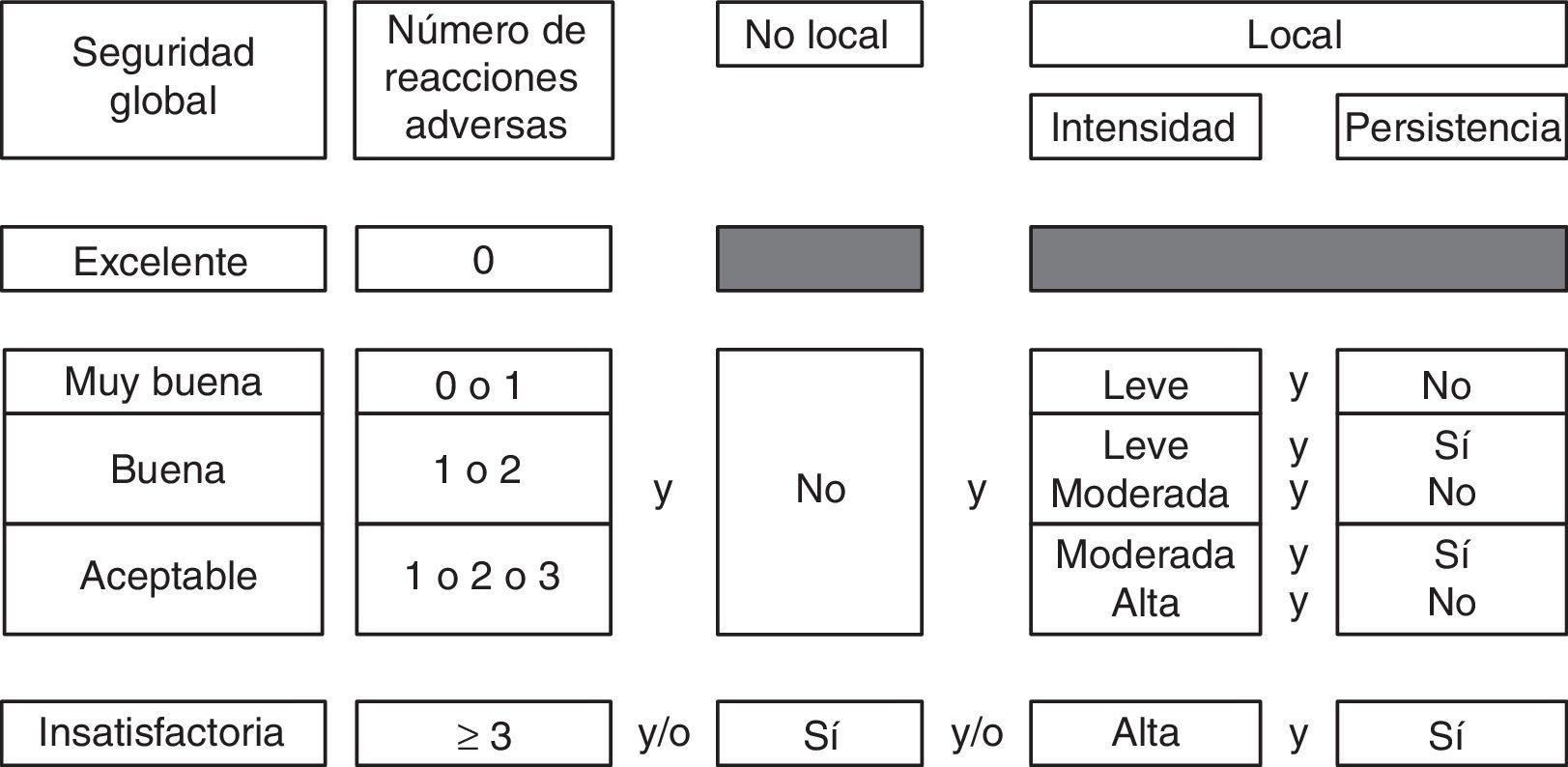
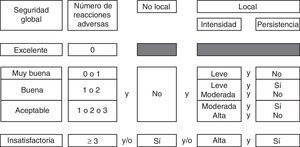
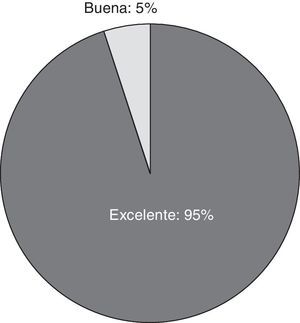
La evaluación de la seguridad global se realizó en función de las características de las reacciones adversas (RA) (número, intensidad, persistencia y localización). La seguridad global se estableció mediante un algoritmo de valoración en 5 categorías (fig. 1). La aplicación del tratamiento se consideró segura si la seguridad global se catalogaba como excelente o muy buena.
Evaluación clínicaSe evaluó el número, tamaño, signos y síntomas de las lesiones (eritema, descamación, prurito, vesículas, inflamación, edema, fisuras, exudación, maceración y pápulas) en todas las visitas por un dermatólogo distinto del que diagnosticó la lesión con el fin de evitar sesgos.
La gravedad de las lesiones se evaluó mediante una escala de cuatro categorías: 0=sin síntomas; 1=ligera (apenas perceptible); 2=moderada (presencia distintiva); 3=severa (marcado, intenso). La respuesta clínica se evaluó en función del porcentaje de reducción de la valoración global (suma de puntuaciones individuales) en cada visita respecto a la basal.
Evaluación micológicaLa respuesta micológica se evaluó mediante microscopía directa y cultivo en todas las visitas, y se consideró favorable si el resultado de ambos era negativo. La eficacia clinicomicológica se valoró a partir de la evaluación de la eficacia clínica y la eficacia micológica, considerándose favorable en caso de curación (curación clínica y microscopía/cultivo negativos), mejoría moderada (mejoría clínica moderada/ligera y microscopía/cultivo negativos) o mejoría significativa (mejoría clínica marcada y microscopía/cultivo negativos o curación clínica evidente y microscopía/cultivo positivo).
Se consideró la presencia de recidiva si, tras la desaparición previa de los signos y síntomas clínicos y la negativización del cultivo, reaparecían y se obtenía un cultivo positivo para el mismo agente patógeno a los 28 días de la finalización del tratamiento.
Cumplimiento del tratamientoEl grado de cumplimentación se valoró en función del número de aplicaciones registradas en el diario del paciente por los progenitores o tutores legales: 100%=14 en 7 días;≥80% y<100%=≥11 en 7 días;≥50% y<80%=7 y 10 en 7 días;<50%=≤6 en 7 días.
Consideraciones estadísticasAsumiendo que el 5% de los pacientes podría presentar seguridad global insatisfactoria de acuerdo con el trabajo de Stary et al.28, se estimó que con una muestra de 30 pacientes se tendría aproximadamente un 80% de probabilidad de encontrar al menos un niño con una tolerabilidad insatisfactoria.
Se realizó un análisis estadístico descriptivo de las variables mediante SPSS® versión 17.0 (SPSS Inc., Chicago, IL, EE. UU.). En el análisis de seguridad se incluyeron todos los pacientes que recibieron el tratamiento, independientemente de la confirmación de la positividad del cultivo basal. Los análisis de eficacia fueron realizados en dos grupos de pacientes: (1) la población por intención de tratar modificada (ITTM), definida por todos los pacientes con confirmación de la positividad del cultivo basal que recibieron la medicación de estudio, y (2) la población por protocolo modificada (PPM), definida por todos los pacientes con confirmación de infección micológica que completaran el estudio sin violaciones mayores del protocolo o discontinuación prematura por ineficacia del tratamiento o AA.
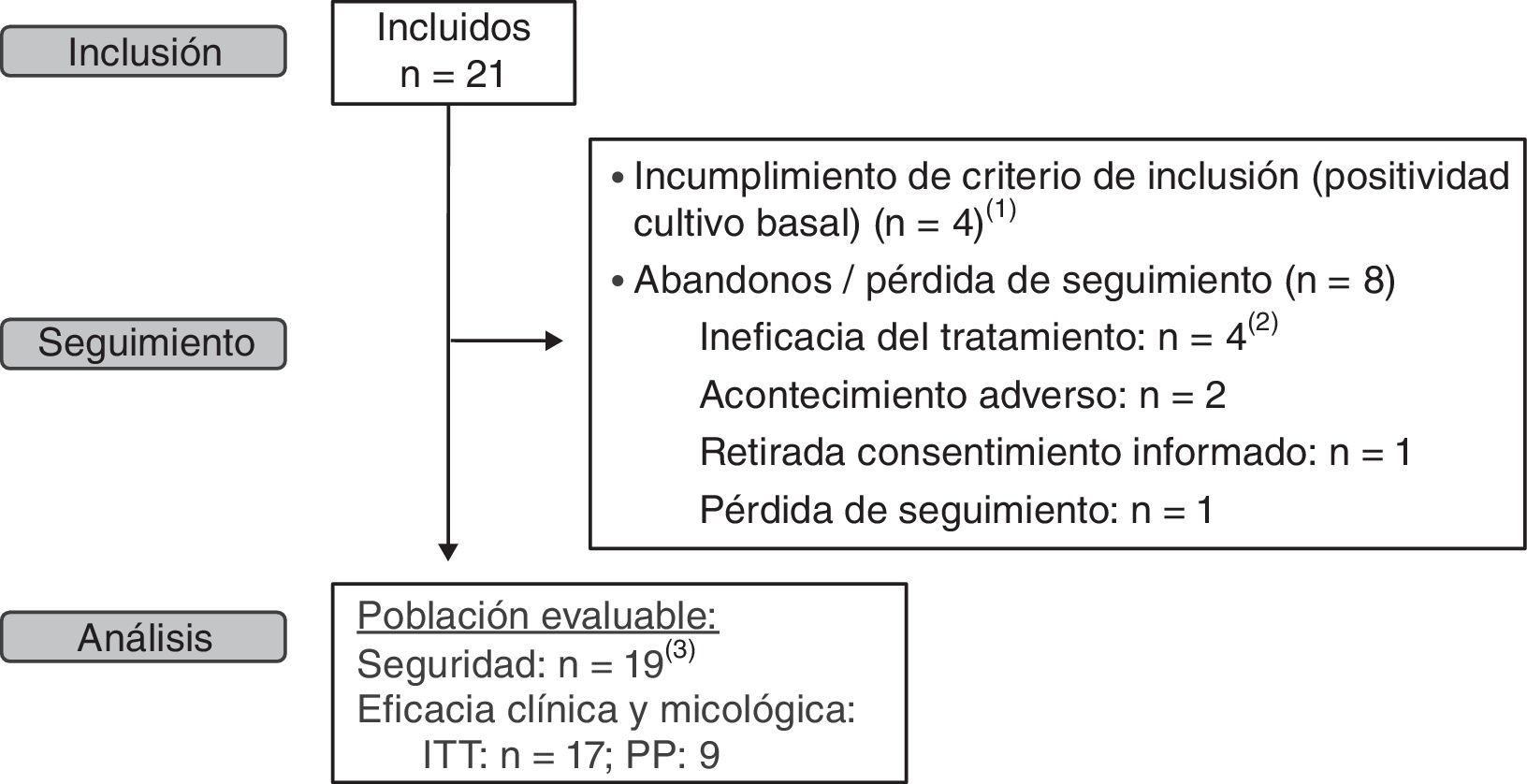
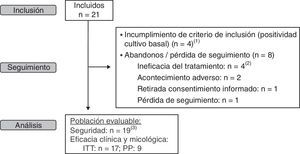
ResultadosCaracterísticas de los pacientesDesde noviembre de 2008 hasta abril de 2009 fueron incluidos en el estudio un total de 21 pacientes. No se pudo alcanzar el tamaño muestral previsto debido a dificultades en la selección de niños. De los 21 pacientes incluidos inicialmente en el estudio, 4 fueron excluidos durante el seguimiento al no confirmarse la infección micológica, por lo que se dispuso de 17 pacientes para el análisis por ITTM. Además, 8 pacientes abandonaron prematuramente el estudio, por lo que se incluyeron 9 pacientes en la población PPM. El análisis de seguridad fue realizado en 19 pacientes de los 21 inicialmente incluidos, dado que a dos pacientes se les perdió el seguimiento tras la visita basal, siendo excluidos de dicho análisis (fig. 2).
Esquema del flujo de pacientes durante el estudio. (1) De los 4 pacientes en los que no se confirma el diagnóstico de dermatomicosis, uno de ellos además presentó ineficacia del tratamiento y a otro se le perdió el seguimiento. (2) Un caso de tiña del vello fue retirado del estudio, ya que esta forma de presentación precisa de tratamiento oral. (3) Se excluyen del análisis dos pacientes con pérdida de seguimiento.
La mayoría de los pacientes presentaba infección por Candida (12/17), fundamentalmente con localización en la ingle (10/12), y 2/12 pacientes en la cara y el pliegue del cuello, respectivamente. El resto de los pacientes (5/17) presentaba tinea corporis. Las características demográficas y clínicas de los pacientes se exponen en la tabla 1.
Características demográficas y clínicas de los pacientes
| Características | Valor |
|---|---|
| Edad, media±DT, añosa | 2,7±2,4 |
| Sexo, n (%) | |
| Varón | 10 (48) |
| Mujer | 11 (52) |
| IMC, media±DT, Kg/m2 | 17,9±5,1 |
| Tiempo de evolución de la enfermedad, mediana (rango), días | 8 (7-21) |
| Localización de la dermatomicosis, n (%)b | |
| Ingle | 15 (72) |
| Cuerpo y extremidades | 7 (33) |
| Cara | 1 (5) |
| Otras localizacionesc | 4 (19) |
| Tipo de microorganismo identificado en cultivo, n (%)d | |
| Candida spp. | 12 (71) |
| Trichophyton spp. | 3 (18) |
| Microsporum spp. | 2 (12) |
| Enfermedades concomitantes dermatológicas, n (%)e | 7 (33) |
| Enfermedades concomitantes no dermatológicas, n (%)f | 4 (19) |
DT: desviación típica; IMC: índice de masa corporal.
En la tabla se muestran las localizaciones más frecuentes. Los porcentajes pueden sumar más del 100% debido a que los pacientes podían presentar más de una localización afectada por la dermatomicosis.
Otras localizaciones menos frecuentes: escroto, pene, interglúteo (n=1), pliegue cuello (n=1), rodilla izquierda (n=1) y pubis (n=1).
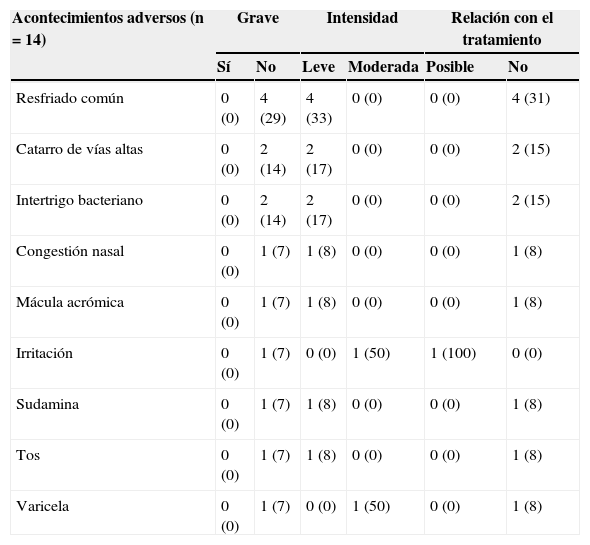
Un total de 13 de los 19 pacientes evaluados no presentó ningún AA. Únicamente 3 pacientes experimentaron más de un AA. Se notificaron 14 AA, todos ellos leves o moderados. Los AA más frecuentemente notificados fueron resfriado común (n=4), catarro de vías altas (n=2) e intertrigo bacteriano (n=2) (tabla 2). Únicamente uno de los AA registrados, dermatitis irritativa, se consideró como posiblemente relacionado con el tratamiento de estudio. Se trataba de una dermatitis irritativa local de intensidad moderada que no se había observado en el último seguimiento, y por la que se suspendió permanentemente el tratamiento en el paciente que la experimentó.
Acontecimientos adversos
| Acontecimientos adversos (n=14) | Grave | Intensidad | Relación con el tratamiento | |||
|---|---|---|---|---|---|---|
| Sí | No | Leve | Moderada | Posible | No | |
| Resfriado común | 0 (0) | 4 (29) | 4 (33) | 0 (0) | 0 (0) | 4 (31) |
| Catarro de vías altas | 0 (0) | 2 (14) | 2 (17) | 0 (0) | 0 (0) | 2 (15) |
| Intertrigo bacteriano | 0 (0) | 2 (14) | 2 (17) | 0 (0) | 0 (0) | 2 (15) |
| Congestión nasal | 0 (0) | 1 (7) | 1 (8) | 0 (0) | 0 (0) | 1 (8) |
| Mácula acrómica | 0 (0) | 1 (7) | 1 (8) | 0 (0) | 0 (0) | 1 (8) |
| Irritación | 0 (0) | 1 (7) | 0 (0) | 1 (50) | 1 (100) | 0 (0) |
| Sudamina | 0 (0) | 1 (7) | 1 (8) | 0 (0) | 0 (0) | 1 (8) |
| Tos | 0 (0) | 1 (7) | 1 (8) | 0 (0) | 0 (0) | 1 (8) |
| Varicela | 0 (0) | 1 (7) | 0 (0) | 1 (50) | 0 (0) | 1 (8) |
Datos expresados como n (%).
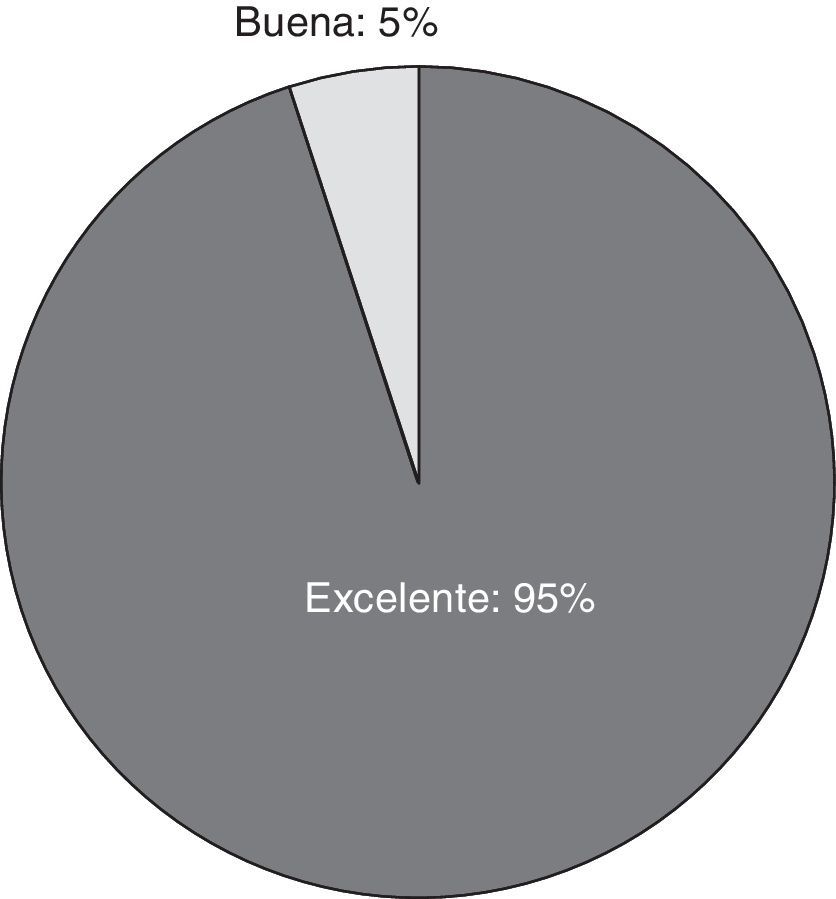
La seguridad global fue excelente en 18 (95%) pacientes, y buena en uno (5%) (fig. 3).
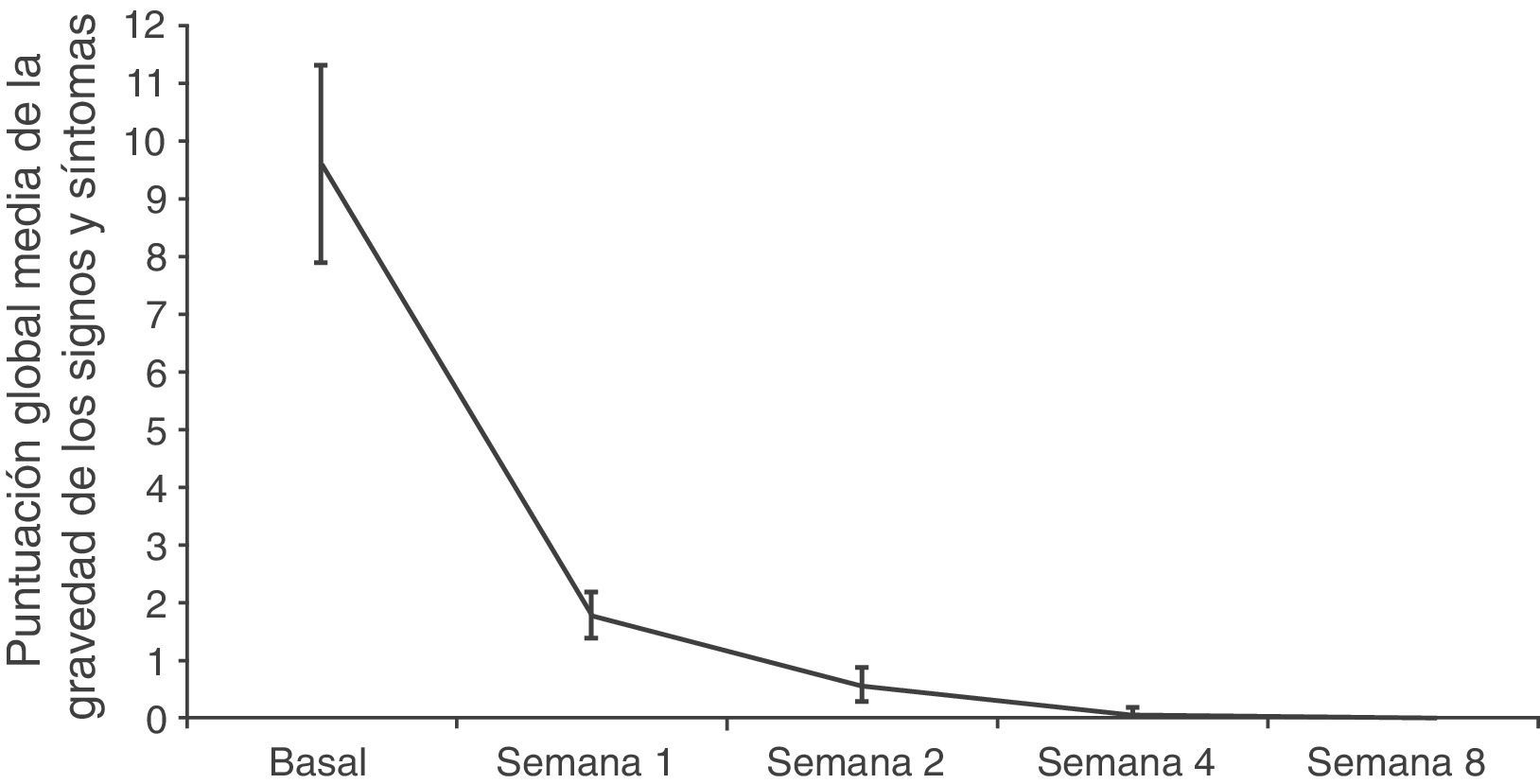
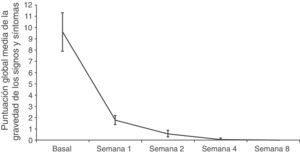
Eficacia clínica y micológicaTanto el número como el área de las lesiones fueron disminuyendo a lo largo del estudio (datos no mostrados). La puntuación global media de los signos y síntomas de las lesiones disminuyó desde 11,7±1,3 en la visita basal a 4,1±1,7 tras la primera semana de tratamiento, y a 0,1±0,1 al final del tratamiento en el análisis por ITTM. Los resultados en la población PPM mostraron una disminución comparable en la primera semana (de 9,6±1,7 a 1,8±0,4) (fig. 4).
Evolución de la puntuación global de la gravedad de los signos y síntomas de las lesiones durante el estudio. La gravedad de las lesiones se evaluó mediante una escala de cuatro categorías: 0=sin síntomas; 1=ligera (apenas perceptible); 2=moderada (presencia distintiva); 3=alta (marcado, intenso). Se exponen los datos de la población por protocolo modificada. Se presentan la media y el error típico de la puntuación global en cada visita.
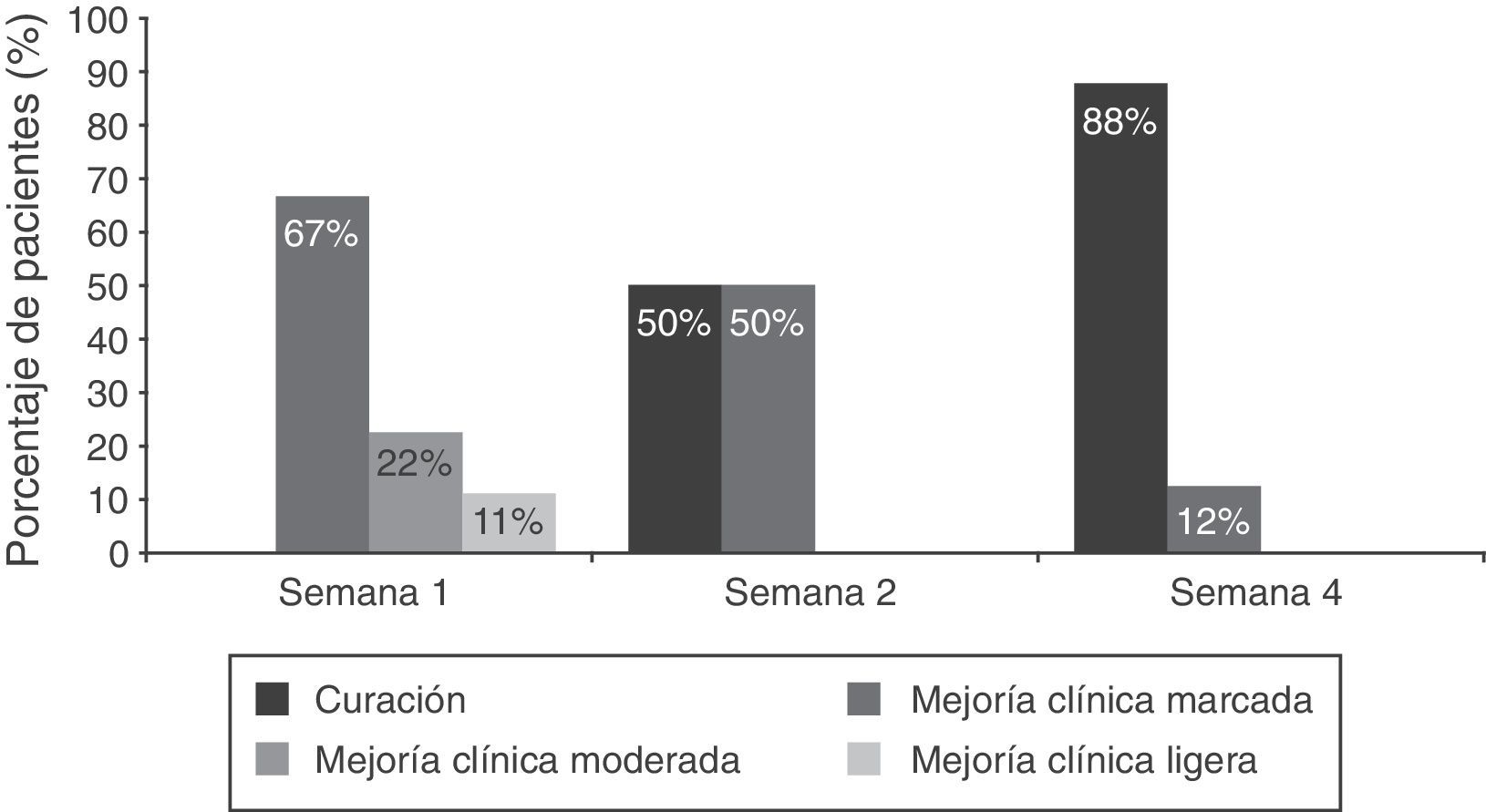
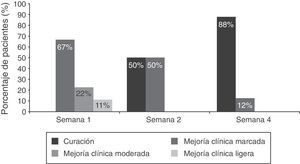
Tras la primera semana, 12/13 pacientes de la población por ITTM analizada y todos los pacientes (9/9) de la población PPM presentaban mejoría clínica, con prácticamente la mitad de la población por ITTM y dos tercios de la población PPM mostrando mejoría clínica marcada. El número de pacientes en los que se alcanzó la curación clínica aumentó desde 4/12 en la segunda semana hasta 7/9 al final del tratamiento en el análisis por ITTM. Los resultados en la población PPM analizada fueron de 4/8 (semana 2) frente a 7/8 pacientes (semana 4) (fig. 5). De los 3 casos con ineficacia del tratamiento, uno de ellos se trataba de una tiña del vello, criterio de exclusión del estudio, ya que esta forma de presentación precisa de tratamiento oral.
Eficacia clínica de ciclopirox olamina. La respuesta clínica se evaluó en función del porcentaje de reducción de la valoración global (suma de puntuaciones individuales) en cada visita respecto a la basal: curación clínica (100%), mejoría clínica marcada (>75% y<100%), mejoría clínica moderada (>50% y≤75%), mejoría clínica ligera (>25% y<50%), sin cambios clínicos (≤25%), agravamiento clínico (>puntuación basal). Se exponen los datos de la población por protocolo modificada. Se presentan los porcentajes de los pacientes que presentaron curación clínica, mejoría clínica marcada, moderada o ligera.
La evaluación micológica se pudo realizar únicamente en 7 y 4 pacientes de la población por ITTM, y en 6 y 3 pacientes de la población PPM en la primera y segunda semana de tratamiento, respectivamente. A la segunda semana permanecían curados micológicamente 5/7 y todos los pacientes (3/3) de la población por ITTM y PPM, los cuales ya habían presentado negativización tras la primera semana de tratamiento. Al final del tratamiento se disponía únicamente de los datos del cultivo en dos pacientes, negativo en ambos casos. Todos los cultivos negativizados tras la primera semana de tratamiento habían sido positivos para Candida albicans.
Un total de 5/7 y 4/6 pacientes de las poblaciones por ITTM y PPM, respectivamente, mostraron una eficacia clinicomicológica favorable tras la primera semana de tratamiento. Los dos pacientes en los que se pudo evaluar la eficacia clinicomicológica en la segunda semana presentaban una evolución favorable.
Ningún paciente presentó recidivas.
Cumplimiento del tratamientoEl 94, 87 y 100% de los pacientes registraron un cumplimiento del 100% a los 7, 14 y 28 días del inicio del tratamiento, respectivamente. Únicamente un paciente presentó un cumplimiento menor del 50% durante la primera semana de tratamiento, y ninguno en las siguientes visitas.
DiscusiónEl presente estudio muestra que ciclopirox olamina en crema al 1% representa una opción terapéutica segura y activa para el tratamiento tópico de las micosis cutáneas superficiales en niños de entre 3 meses y 10 años.
La experiencia clínica disponible con antifúngicos tópicos de primera línea para las diferentes micosis cutáneas superficiales en niños es escasa2,5,12,27, y son pocos los compuestos tópicos actualmente indicados en adultos y adolescentes que disponen de indicación para su uso en la edad pediátrica en España. Únicamente la nistatina se encuentra autorizada para todas las edades, y el miconazol a partir de los 2 años, por lo que el resto de los antifúngicos tópicos son empleados de forma empírica en la práctica clínica.
Los estudios que han evaluado ciclopirox olamina crema en micosis cutáneas superficiales son muy limitados, la mayoría fueron realizados en la década de los 801,3,6,16, y la población pediátrica se encontraba muy escasamente representada. La experiencia clínica con ciclopirox en niños se limita a su evaluación en tinea capitis4, onicomicosis7,23 y candidiasis del pañal8, en todos los casos con formulaciones distintas a la crema tópica. El estudio de Stary et al. constituye la única experiencia disponible hasta el momento de ciclopirox olamina en crema frente a varias infecciones micóticas en niños, particularmente candidiasis de la zona urogenital, aunque se evaluó conjuntamente con las presentaciones de solución y polvo. En dicho estudio, los resultados de seguridad global alcanzados (seguridad global muy buena y buena, 95%) fueron similares a los obtenidos en el estudio actual28. Hasta donde conocemos, este es el primer estudio realizado únicamente con ciclopirox olamina en crema en una población de niños menores de 10 años diagnosticados de dermatofitosis y candidiasis.
El presente estudio muestra que ciclopirox olamina en crema muestra una excelente tolerabilidad en niños. Trece de los 19 pacientes evaluados no experimentaron ningún AA, y en aquellos casos en que se detectaron fueron leves o moderados. Únicamente un paciente sufrió un AA, dermatitis irritativa, que se consideró como posiblemente relacionado con el tratamiento. Se trataba de una irritación cutánea local de intensidad moderada que supuso el abandono del tratamiento por parte del paciente. La frecuencia de RA y de irritación cutánea local en nuestro estudio es comparable con la encontrada en los ensayos aleatorizados previos con ciclopirox olamina crema en adultos, adolescentes y niños mayores de 10 años (1-4%)1,3,15. Por otro lado, la incidencia de AA es similar a la encontrada en niños con dermatitis del área del pañal tratados con nistatina (n=14) y clotrimazol (n=10), que al igual que en nuestro estudio, no fueron relacionados con el tratamiento, a excepción de la presencia de irritación e inflamación en un niño tratado con clotrimazol12.
Los resultados de este ensayo apuntan a que ciclopirox olamina crema parece inducir un efecto favorable temprano sobre los signos y síntomas clínicos de la afección a tenor de la marcada reducción de la puntuación global de la severidad en la primera semana de tratamiento. Esta respuesta temprana sobre la severidad de las lesiones también se observa en niños con dermatitis del área del pañal tratados con miconazol27, clotrimazol y nistatina12, y es comparable a la respuesta clínica alcanzada tras la primera semana de tratamiento en pacientes adultos con micosis cutáneas superficiales en estudios aleatorizados1,3. Se ha planteado que la eficaz atenuación de la expresión de los signos y los síntomas podría ser debida a las propiedades antiinflamatorias de ciclopirox olamina17. La tasa de curación clínica en la segunda semana de tratamiento en nuestro estudio (4/12) es superior a la reportada por Bagatell et al. frente a la infección por Candida (17%)1. Por otro lado, a modo de comparación descriptiva únicamente, la tasa de curación clínica en la segunda semana de tratamiento es similar a la descrita con miconazol en niños con dermatitis del área del pañal (38 y 43% en el análisis por ITTM y PPM, respectivamente)27, y en niños con dermatitis del pañal complicada con candidiasis tratados con nistatina (47%) y clotrimazol (68%) en un análisis en la población PPM12.
Respecto a los agentes etiológicos, el género Candida fue el más frecuentemente aislado (71%) en nuestro estudio, como era esperable en una población de niños menores de 10 años, y siendo la dermatofitosis más infrecuente en esta población. La tasa de respuesta micológica resultó también considerable tras la primera semana de tratamiento. La baja disponibilidad de muestras de cultivo a partir de la primera semana se debió principalmente a la falta de lesiones y escamas de piel para la toma de muestras debido a la rápida respuesta clínica.
Es importante destacar que el cumplimiento del tratamiento por parte de los pacientes en el estudio fue excelente, y este factor resulta fundamental para que se haya obtenido una eficacia clínica favorable con ciclopirox olamina crema en esta investigación.
La principal limitación del estudio radica en la reducida muestra de pacientes incluida. El tamaño muestral inicialmente estimado para evaluar el objetivo principal del estudio, la seguridad global del tratamiento, permitía detectar RA con una frecuencia del 3%. No obstante, a pesar de no haber alcanzado el tamaño muestral inicialmente previsto, con la muestra seleccionada todavía se pudieron detectar RA que aparecieran con una frecuencia del 5%.
A pesar de la limitación de la muestra, este estudio resulta especialmente interesante en el escenario actual dada la falta de indicación de la mayoría de los antifúngicos tópicos disponibles en niños menores de 10 años. Además, ciclopirox olamina puede representar una alternativa terapéutica eficaz y segura en niños hipersensibles a algunos derivados imidazólicos y en infecciones por Candida resistentes a azoles.
En conclusión, la aplicación tópica de ciclopirox olamina crema al 1% ofrece un tratamiento seguro y eficaz en niños de entre 3 meses y 10 años con micosis cutáneas superficiales, particularmente infecciones por levaduras del género Candida. Los resultados de este trabajo podrían servir de base para futuros estudios aleatorizados que evalúen la eficacia y seguridad de ciclopirox olamina crema en una población más amplia de niños con dermatomicosis.
FinanciaciónEste estudio ha sido financiado por Ferrer Internacional, S. A., Barcelona, España.
Conflicto de interesesE. Gómez Moyano, A. Hiraldo Gamero, A. Vera Casaño, V. Crespo Erchiga, M.A. González Enseñat, M.A. Vicente Villa y J.C. Moreno Giménez declaran no presentar ningún conflicto de intereses. I. Zsolt pertenece al Departamento Médico de Grupo Ferrer.
Los autores quieren agradecer a Ferrer Internacional, S. A. su apoyo para la elaboración del estudio y el haber proporcionado la crema de ciclopirox olamina. También queremos agradecer a Cristina Vidal y Antonio Torres, de Dynamic, S. L., sus servicios de redacción médica y su labor editorial.