Las mucormicosis son infecciones poco frecuentes en pacientes inmunocompetentes, y se han descrito muy pocos casos de mucormicosis asociadas a aspergilosis en pacientes no hematológicos.
Caso clínicoUn varón de 17 años, inmunocompetente y sin factores de riesgo previamente conocidos, ingresó en el hospital tras presentar crisis convulsivas 11 días después de sufrir un accidente de moto. Presentó un curso clínico tórpido por infección fúngica invasiva mixta, con afectación pulmonar por Aspergillus niger y mucormicosis diseminada por Rhizomucor pusillus (diagnóstico histopatológico y microbiológico en varios lugares no contiguos). Fue tratado con anfotericina B liposomal durante 7 semanas (dosis total acumulada>10g) y precisó múltiples reintervenciones quirúrgicas. El paciente sobrevivió y fue dado de alta de UCI tras 5 meses de evolución y múltiples complicaciones.
ConclusionesEl tratamiento con anfotericina B liposomal y el manejo quirúrgico agresivo consiguió la erradicación de la infección fúngica invasiva mixta, pero alertamos de la necesidad de mantener un mayor grado de sospecha clínica y de realizar técnicas de diagnóstico precoz de infecciones fúngicas invasivas en pacientes no inmunodeprimidos para evitar la diseminación de la enfermedad y el mal pronóstico asociado.
Mucormycosis infections are rare in immunocompetent patients, and very few cases of mucormycosis associated with aspergillosis in non-haematological patients have been reported.
Case reportA 17-year-old male, immunocompetent and without any previously known risk factors, was admitted to hospital due to a seizure episode 11 days after a motorcycle accident. He had a complicated clinical course as he had a mixed invasive fungal infection with pulmonary involvement due to Aspergillus niger and disseminated mucormycosis due to Rhizomucor pusillus (histopathological and microbiological diagnosis in several non-contiguous sites). He was treated with liposomal amphotericin B for 7 weeks (total cumulative dose>10g) and required several surgical operations. The patient survived and was discharged from ICU after 5 months and multiple complications.
ConclusionsTreatment with liposomal amphotericin B and aggressive surgical management achieved the eradication of a mixed invasive fungal infection. However, we emphasise the need to maintain a higher level of clinical suspicion and to perform microbiological techniques for early diagnosis of invasive fungal infections in non-immunocompromised patients, in order to prevent spread of the disease and the poor prognosis associated with it.
Las mucormicosis son infecciones poco frecuentes en el ser humano, pero han de ser consideradas infecciones emergentes. Su incidencia predomina en pacientes inmunodeprimidos y con factores de riesgo6,7, pero pueden aparecer en individuos inmunocompetentes sin criterios de sospecha.
En nuestro medio, las mucormicosis tienen una incidencia de 0,43 casos por millón de habitantes y de 0,62 casos por cada 100.000 admisiones hospitalarias28. Y en países próximos como Francia, la incidencia se incrementó desde 0,7 casos en 1997 a 1,2 casos por millón de habitantes en 20065,24. Se estima que son la tercera infección fúngica sistémica tras la candidiasis y la aspergilosis, habiéndose descrito ocasionalmente asociaciones como infecciones mixtas.
Se consideran infecciones agudas, angioinvasivas, y se han descrito 6 formas clínicas de presentación, basadas en su localización anatómica: 1) rinoorbitocerebral; 2) pulmonar; 3) cutánea; 4) abdominopélvica o gastrointestinal; 5) diseminada, y 6) una miscelánea de otras formas (endocarditis, osteomielitis, etc.). La forma clínica de presentación está muy relacionada con los factores de riesgo4,26. Estas micosis tienen una elevada mortalidad, globalmente entre el 40-60%, y mayor del 80% en los casos de mucormicosis diseminadas. Representan el 8-13% de todas las infecciones fúngicas diagnosticadas en autopsias20.
En la literatura, existen muy pocos casos de infecciones fúngicas invasivas mixtas diseminadas producidas por especies de Mucorales y Aspergillus spp. en pacientes inmunocompetentes2,18,22,29, y no tenemos conocimiento de ningún caso publicado de mucormicosis diseminada a distancia y coinfección pulmonar por aspergilosis en pacientes inmunocompetentes.
Caso clínicoPresentamos el caso de una infección fúngica invasiva mixta en un varón de 17 años que ingresó en el hospital tras presentar una crisis convulsiva tónico-clónica. Once días antes había sufrido un traumatismo craneofacial por accidente de moto, sin pérdida de conciencia. Los estudios radiológicos demostraron fracturas faciales múltiples, del suelo orbitario derecho y de los huesos propios. Sus familiares no referían ningún otro antecedente. Fue intervenido 6 días después del accidente, practicándosele reconstrucción del suelo orbitario mediante abordaje transconjuntival, fijación del arbotante maxilomalar por vía intraoral, y reducción de la fractura nasal. No se realizaron cultivos intraoperatorios. Fue tratado con amoxicilina-clavulánico 1g iv cada 8h, dexametasona 8mg iv cada 12h, omeprazol y metamizol. A los 3 días de la intervención quirúrgica recibió el alta hospitalaria, siguiendo tratamiento con amoxicilina-clavulánico y antiinflamatorios por vía oral.
Al día siguiente presentó fiebre elevada con deterioro del nivel de conciencia y del estado general, y a las 48h, una crisis convulsiva tónico-clónica, por lo que fue trasladado al hospital más próximo en estado poscrítico, con un Glasgow Coma Score (GCS) de 9 puntos, con sospecha de meningoencefalitis postraumática. La TAC craneal inicial no mostró hallazgos patológicos, y de la punción lumbar se obtuvo un líquido claro, con glucosa 67mg/dl (en sangre 107mg/dl), proteínas 66mg/dl, 46 hematíes, 180 leucocitos/μl (neutrófilos 4%), sin visualización de microorganismos en la tinción de Gram. Fue tratado con fenitoína, propofol, dexametasona 12mg iv/8h y antibioterapia con meropenem y linezolid, y posteriormente fue trasladado al hospital de referencia por su estado de gravedad.
La exploración en ese momento, bajo los efectos de sedoanalgesia residual, le mostró estuporoso, poco colaborador, con temperatura de 36,5°C, y posición en gatillo. Respondía a estímulos dolorosos y movilizaba las cuatro extremidades. El EEG no mostró foco epileptógeno. Los hemocultivos y el cultivo del LCR no presentaron crecimiento de patógenos.
A las 72h del ingreso, el paciente presentó deterioro del estado neurológico y respiratorio, precisando intubación y soporte respiratorio (VMC). La TAC craneal con contraste reveló hipodensidad corticosubcortical de localización frontotemporoparietal derecha con pérdida de diferenciación de la sustancia gris, e importante efecto masa con herniación uncal y subfalciana, sin defectos de repleción en arterias o venas cerebrales que evidenciaran trombosis. Se implantó sensor de presión intracraneal y posteriormente precisó craniectomía descompresiva.
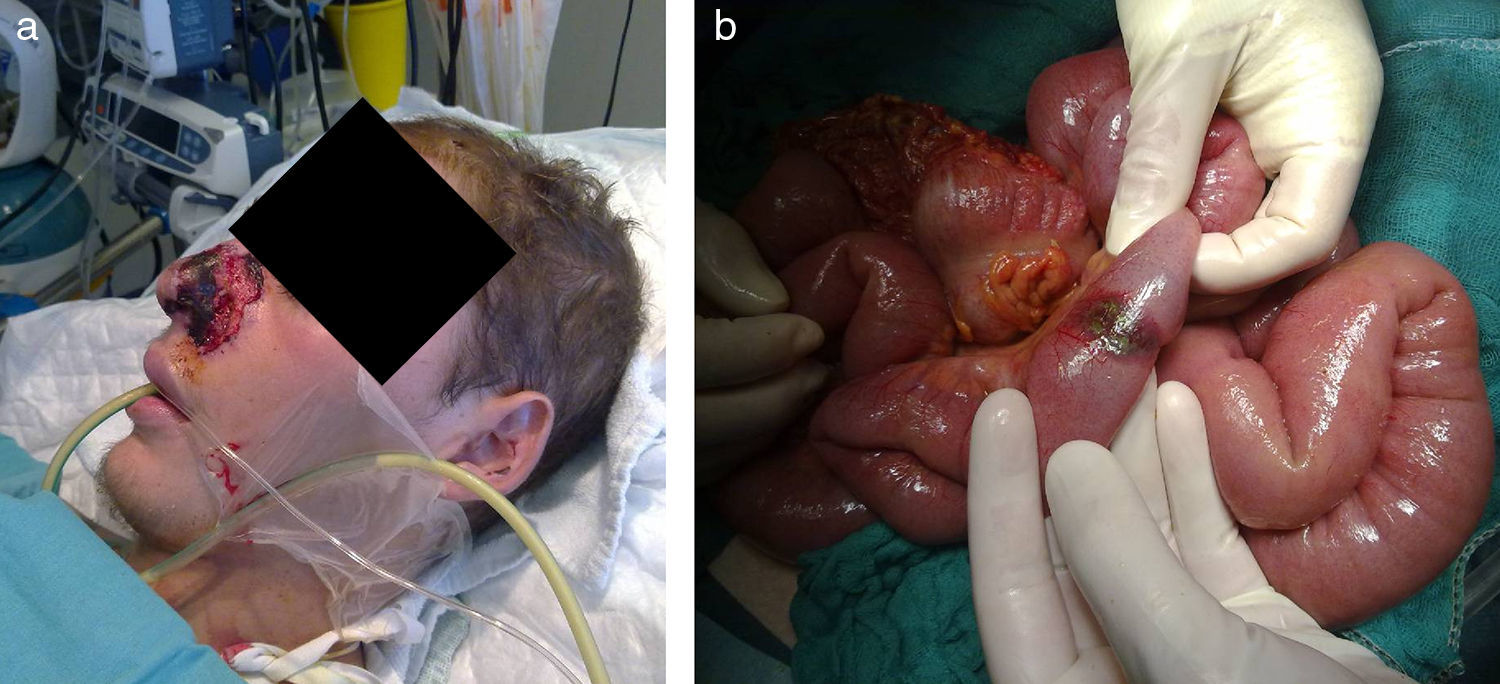
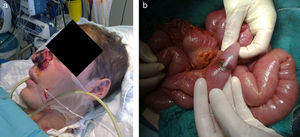
A partir de la primera semana se apreció una evolución muy tórpida. Presentó anemización progresiva sin exteriorización, y criterios de síndrome de distrés respiratorio agudo (SDRA) con crecimiento de Aspergillus niger en broncoaspirado no-selectivo y test de galactomanano en sangre muy positivo (>5 IDO). Se inició tratamiento con voriconazol en el día D14 del ingreso (200mg cada 12h, con 2 dosis de carga previas). Posteriormente aparecieron lesiones en las alas de la nariz, que evolucionaron a la necrosis en 4 días (fig. 1a). En el D26 se realizaron biopsias cutáneas y se inició tratamiento empírico con anfotericina B liposomal (AmB-L) a dosis de 300mg/d (6mg/kg/d), sustituyendo al voriconazol.
Al mes del ingreso en UCI, el paciente presentó melenas y distensión abdominal, habiendo precisado múltiples transfusiones de hematíes a partir de la segunda semana. La endoscopia digestiva alta mostró lesiones ulceradas en esófago, cuerpo gástrico y duodeno. Se tomaron biopsias. Hubo de ser intervenido, apreciándose una úlcera antral perforada y múltiples lesiones diseminadas en tubo digestivo, de aspecto ulcerado-necrótico (fig. 1b). Se realizó cierre de la perforación, resección de una lesión ileal y extirpación de un fragmento de duodeno para diagnóstico anatomopatológico. Una semana después presentó nuevo neumoperitoneo. Fue reintervenido, apreciándose deserosamientos de lesiones en íleon terminal, con lesiones previas en fase de remisión. Tras la cirugía el paciente mantenía criterios de SDRA persistente, presentó clínica de polineuromiopatía y múltiples complicaciones infecciosas.
Las lesiones pulmonares inflamatorias evolucionaron a la cavitación, con formación de múltiples neumatoceles y neumotórax bilaterales secundarios recidivantes. Presentó sobreinfección respiratoria, sepsis por Pseudomonas aeruginosa y una bacteriemia no relacionada a catéter por estafilococos coagulasa negativos, tratada con vancomicina. También presentó deterioro leve de la función renal, hipokaliemia persistente que precisaba importante reposición diaria de potasio, y episodios de poliuria relacionados con síndrome pierde sal.
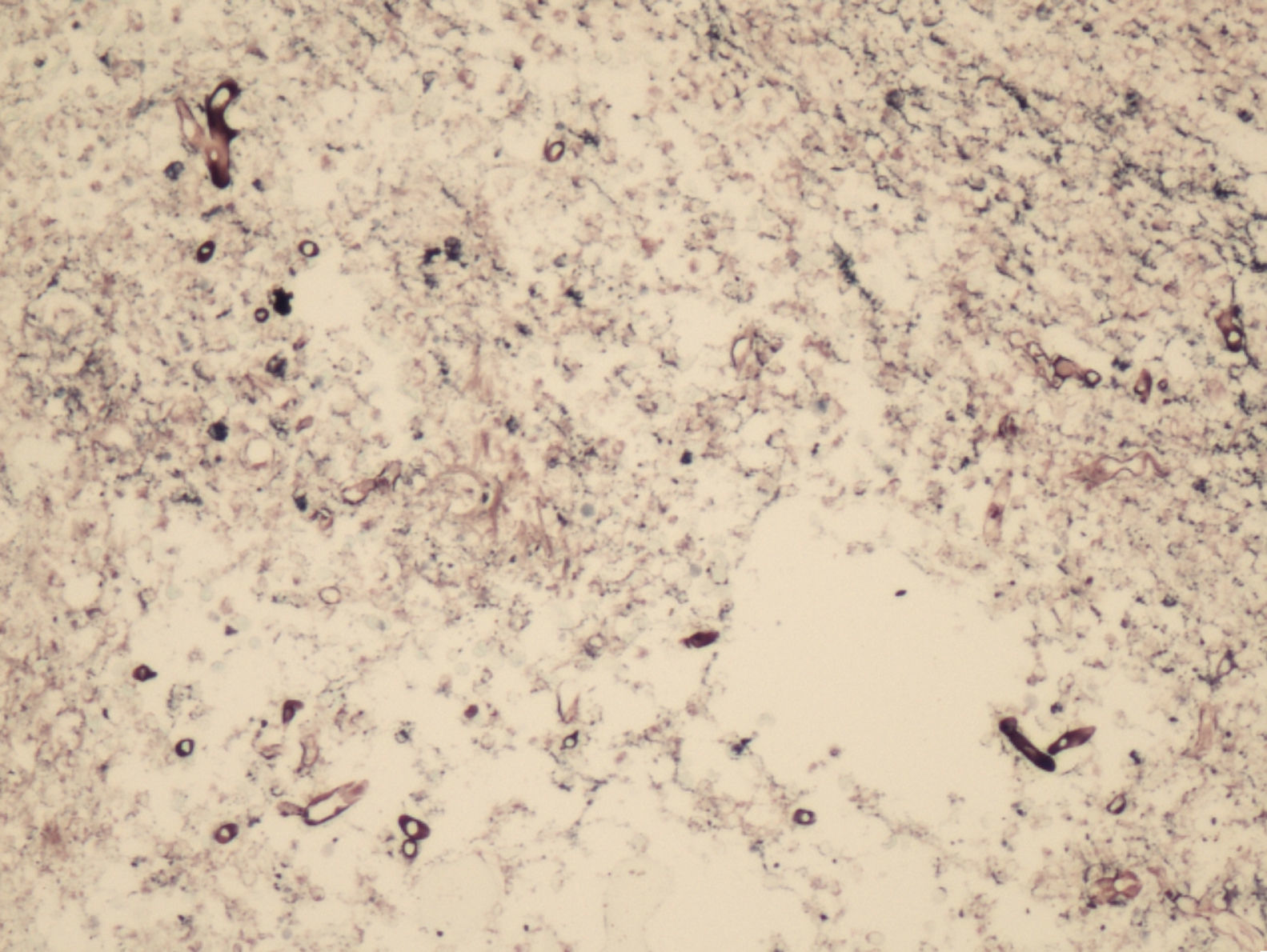
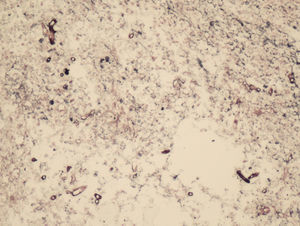
Los estudios anatomopatológicos arrojaron las siguientes evidencias: 1) rinitis granulomatosa y necrosante con trombos vasculares y zonas necróticas, con presencia de células fúngicas tubulares y anchas (fig. 2); 2) biopsias de cuerpo gástrico y duodeno con inflamación crónica, muscular propia con necrosis y estructuras fúngicas PAS positivas no septadas en fondo de úlcera con reacción granulomatosa de células gigantes, y 3) fragmento quirúrgico de duodeno con hallazgo de estructuras fúngicas de las mismas características.
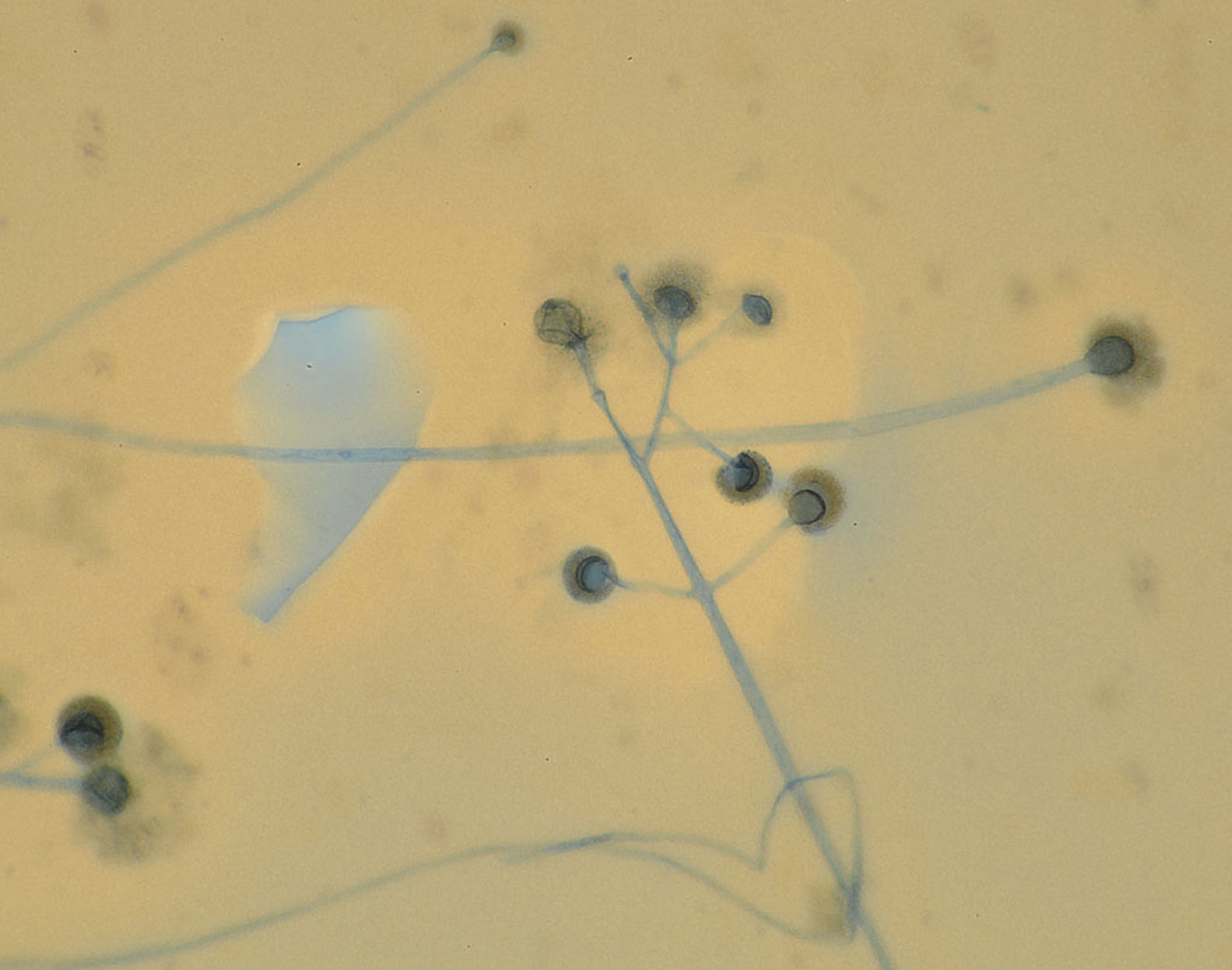
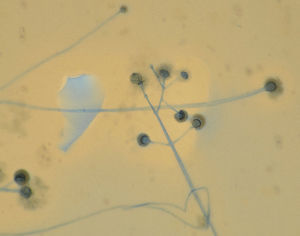
En las pruebas microbiológicas se obtuvo el crecimiento de un hongo filamentoso no septado identificado como Rhizomucor pusillus (fig. 3).
Se mantuvo el tratamiento con AmB-L durante 7 semanas (dosis total 13,30g), consiguiéndose repetidos cultivos de vigilancia negativos, y mejoría clínica significativa de las lesiones cutáneas, gastrointestinales, pulmonares y cerebrales.
El paciente se mantuvo en coma vigil durante los 2 primeros meses. La evolución posterior fue favorable, con recuperación progresiva del nivel de conciencia. Fue dado de alta de UCI al quinto mes, consciente, GCS 15, aunque con hemiparesia izquierda y otras secuelas neurológicas; precisó tratamiento anticomicial prolongado por reiteración de crisis convulsivas, aunque el EEG no mostraba hallazgos patológicos en los intervalos intercrisis. El paciente se mantiene sin recidiva de la enfermedad fúngica después de 2 años del comienzo del cuadro.
En resumen, se trata de un cuadro de mucormicosis diseminada producida por Rhizomucor pusillus, y coinfección pulmonar por Aspergillus niger en un paciente inmunocompetente9,10,26.
DiscusiónLas mucormicosis aparecen generalmente en pacientes de riesgo, individuos inmunodeprimidos con factores de riesgo predisponentes. Aunque cada día se incrementan los casos en pacientes sin inmunodepresión conocida, personas sin factores de riesgo aparentes, o con estados de inmunodeficiencia ocultos11,25, habitualmente relacionados con traumatismos1,3,19,22,30, suponen actualmente alrededor del 20% de todos los casos13,23.
La forma clínica de presentación está relacionada con el perfil de riesgo de los pacientes, con su grado de inmunodepresión y con factores de riesgo concomitantes; así, predomina la presentación rinocerebral en los pacientes diabéticos, la pulmonar en aquellos con hemopatías malignas, y las formas cutáneas en pacientes traumatizados. Las formas diseminadas aparecen en el 15-25% de los casos17,20.
El diagnóstico clínico de sospecha de mucormicosis es el factor de mayor impacto sobre la supervivencia del paciente. Las lesiones cutáneas en las formas rinoorbitarias pueden ser características, por el edema y la tumefacción o por las lesiones necróticas secundarias a la invasión vascular. Y es obligado el análisis histopatológico inmediato para establecer el diagnóstico. El diagnóstico de la enfermedad puede ser microbiológico si existe crecimiento fúngico en muestras estériles, pero el diagnóstico de confirmación de las mucormicosis es histopatológico.
El cuadro de mucormicosis diseminada debe ser establecido por la confirmación de la enfermedad en dos focos no contiguos. En el presente caso se constató la presentación rinosinusal (diagnóstico histológico y microbiológico de partes blandas, con afectación radiológica de los senos maxilar y esfenoidal), y la gastrointestinal (diagnóstico histológico y microbiológico). Además, se consideró la afectación cerebral por lesiones radiológicas compatibles y contigüidad de la afectación rinosinusal, y la afectación pulmonar, en coinfección con Aspergillus niger, por la coincidencia en el tiempo, la vía de entrada común, las características clínicas y radiológicas y la mala respuesta al voriconazol. No se realizaron biopsias, ni se tomaron cultivos de parénquima cerebral ni pulmonar que permitieran establecer el diagnóstico histopatológico definitivo.
Sospechamos que el caso reportado presentó una coinfección pulmonar por Aspergillus niger y Rhizomucor pusillus, dado que el diagnóstico de aspergilosis pulmonar invasiva estaba bien establecido de acuerdo con los criterios de EORTC/MSG por el cultivo en muestras respiratorias, la clínica compatible, y la tasa elevada de galactomanano en sangre9,10, y teniendo en cuenta que Rhizomucor no posee una cantidad relevante de este antígeno en su pared8, por lo que sería raro un diagnóstico falso positivo. Las lesiones radiológicas en ambas entidades tienden a la cavitación, pero no son patognomónicas y pueden ser indistinguibles. Se han descrito imágenes con signo de halo más frecuentemente en la aspergilosis, y con signo de halo reverso en la mucormicosis12,31, pero pueden aparecer en ambos casos.
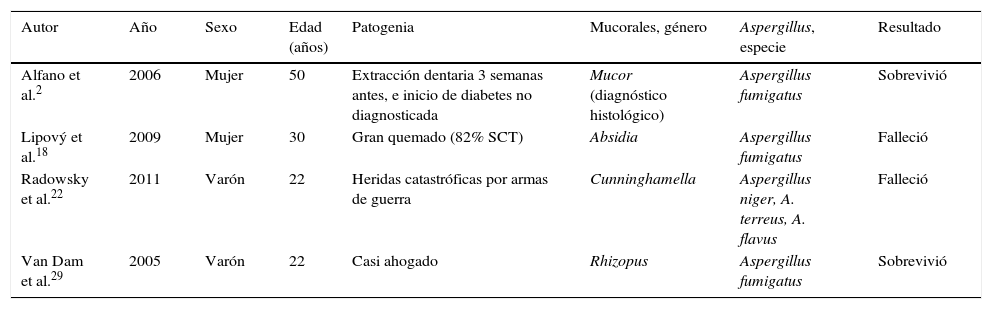
Aunque la patogenia y los factores de riesgo de ambas micosis tienen algunas características similares, se han publicado muy pocos casos de infecciones simultáneas o dobles por mucorales y Aspergillus spp., y la mayoría de ellas han sido en pacientes diabéticos o hematológicos. En la tabla 1 revisamos los casos reportados en PubMed de infecciones fúngicas invasivas mixtas (aspergilosis y mucormicosis) diseminadas en pacientes inmunocompetentes. La mayoría de los casos se producen como consecuencia de agresiones físicas muy intensas, con pérdida de barreras anatómicas y deterioro grave del sistema inmunológico en pacientes previamente sanos.
Infecciones fúngicas invasivas mixtas diseminadas (mucormicosis y aspergilosis) en pacientes inmunocompetentes
| Autor | Año | Sexo | Edad (años) | Patogenia | Mucorales, género | Aspergillus, especie | Resultado |
|---|---|---|---|---|---|---|---|
| Alfano et al.2 | 2006 | Mujer | 50 | Extracción dentaria 3 semanas antes, e inicio de diabetes no diagnosticada | Mucor (diagnóstico histológico) | Aspergillus fumigatus | Sobrevivió |
| Lipový et al.18 | 2009 | Mujer | 30 | Gran quemado (82% SCT) | Absidia | Aspergillus fumigatus | Falleció |
| Radowsky et al.22 | 2011 | Varón | 22 | Heridas catastróficas por armas de guerra | Cunninghamella | Aspergillus niger, A. terreus, A. flavus | Falleció |
| Van Dam et al.29 | 2005 | Varón | 22 | Casi ahogado | Rhizopus | Aspergillus fumigatus | Sobrevivió |
El paciente había recibido tratamiento con altas dosis de corticoides durante un corto periodo (<3 semanas) y fue sometido a cirugía del macizo facial, factores que pudieron facilitar la invasión fúngica. Ambos factores se describen en la mayoría de los casos de mucormicosis rinocerebrales postraumáticas.
No se constataron episodios de acidosis por bajo gasto cardiaco u otras causas, excepto posiblemente en los breves periodos de las crisis convulsivas. Tampoco presentó episodios de neutropenia postraumática, aunque es conocido que existen defectos cualitativos de la actividad fagocítica que permiten un crecimiento no restringido de las hifas, favoreciendo la actividad invasiva11,15.
La necesidad de múltiples transfusiones puede ser considerada como un factor de riesgo por la sobrecarga de hierro, que actúa como un mecanismo patogénico16, o como una manifestación clínica de la enfermedad por las lesiones mucosas producidas. La sobrecarga de hierro se reconocía ya en el pasado como un factor patogénico que incidía en los pacientes en diálisis y en tratamiento con deferoxamina7,14.
El curso clínico en los casos de mucormicosis en pacientes inmunocompetentes suele ser tórpido, y posiblemente peor en los casos de micosis debidas a más de un patógeno. Es habitual la existencia de un periodo de latencia de 2-4 semanas hasta el comienzo de los síntomas, preciso para la germinación de las conidias aspiradas o inoculadas durante el trauma y la invasión de las hifas3,21,30.
Nuestro paciente fue tratado con AmB-L durante 7 semanas27, y cirugía del foco nasal y de las complicaciones gastrointestinales.
El pronóstico de los pacientes inmunocompetentes con infecciones fúngicas invasivas mixtas podría ser mejor que en pacientes inmunodeprimidos, aunque depende de forma muy significativa de la patogenia de la infección; en este caso fue bueno, con resultado de supervivencia. Pero a pesar del diagnóstico etiológico y el tratamiento adecuado, el resultado final no fue óptimo por la gravedad del cuadro clínico desarrollado por la diseminación. Solo la sospecha clínica precoz, incluso en pacientes no inmunodeprimidos, y la implementación de nuevas técnicas de diagnóstico podrán mejorar estos resultados clínicos.
Responsabilidades éticasConfidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
AutoríaJCPL ha participado en la concepción y realización del trabajo, en la redacción del texto y sus revisiones y ha aprobado la versión final.
APM, JCRA, MDBR, ACA, MTCC y MJLS han participado en la redacción del texto y sus revisiones y han aprobado la versión final.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses, ni tienen relaciones económicas o personales que hayan podido o puedan sesgar o influir inadecuadamente en sus actuaciones.
Queremos expresar nuestro especial agradecimiento a todas las enfermeras y médicos de la Unidad de Medicina Intensiva del Hospital Reina Sofía (Dr. Guerrero), y a las fisioterapeutas del Servicio de Rehabilitación. También a los Dres. A. Toledano (Neurocirugía), A. González (Digestivo), E. Torres (Cirugía), F. Bravo y J. Escribano (Radiología). A todos ellos porque sin su esfuerzo el resultado no hubiera sido el mismo.