Analizar los niveles de daño que se registran en el ADN de espermatozoides de donantes y estimar la velocidad a la que este se degrada tras la descongelación.
Material y métodosDosis seminales procedentes de donantes (n=50) y un grupo control formado por pacientes normozoospérmicos (n=40). Se estudiaron los valores de fragmentación del ADN espermático (SDF) en su nivel basal, así como los valores de SDF tras incubación de las muestras a 37°C durante 2, 6 y 24h. Se calcularon las velocidades de degradación del ADN por tramos de incubación.
ResultadosEl semen criopreservado de donante presenta unos niveles basales de SDF 2 veces inferiores a los observados en los controles, y su ADN es 2,5 veces más longevo que el del grupo control. Niveles basales de SDF sobre un 8% generan una sensibilidad de un 82% y una especificidad de un 65% para discriminar entre los donantes y los controles. Los valores de incremento del daño de 1,8% por hora, analizados durante las 2 primeras horas de incubación, identifican a los donantes con un 77% de sensibilidad y un 65% de especificidad. Ambos valores no muestran ninguna correlación dentro del grupo de los controles, ni entre los donantes.
ConclusionesEl establecimiento de este tipo de valores umbral se podría utilizar para identificar donantes considerados como «superdonantes» en relación con sus bajos niveles de SDF y su alta estabilidad de la cromatina. Los donantes que se seleccionaron en las diferentes clínicas presentan características equiparables para estos parámetros.
The study was made to analyze the baseline levels of damage recorded in sperm DNA fragmentation (SDF) and to estimate sperm DNA longevity as observed in donors after thawing.
Material and methodsFifty donors and forty individuals attending a clinic and classified as a normo-zoospermic population were compared. The baseline SDF levels and the increasing rate of SDF (r-SDF) obtained after thawing when the sperm was incubated for a period of 24h with different sub-sampling performed after 2, 6 and 24h of incubation were considered as the independent variables and compared.
ResultsCryopreserved donor sperm exhibited baseline SDF values approximately 2 times lower than those observed in the control group. DNA stability was 2.5 times higher than that observed in the control cohort. Baseline values of SDF of approximately 8% generates 65% sensitivity and 82% specificity to discriminate between the donors and controls. Values of increase of damage of 1.8% per hour, analyzed during the first hours of incubation, identify the donor characteristics with 77% sensibility and 65% specificity. Neither value show any correlation within the control and donor cohorts group.
ConclusionThe establishment of these types of threshold values can be used to identify donors considered as “super-donors” in relation to their low levels of SDF and high chromatin stability. The donors selected from the different clinics participating in this study showed similar characteristics for these parameters.
La selección de donantes de muestras seminales se realiza bajo unos criterios multifactoriales de riesgo tal y como se explicita en la Ley Española de Reproducción Asistida de 1988 (Ley 35/1988, de 22 de noviembre)1. En esta ley se contemplan tanto aquellos aspectos que atañen a la calidad de la muestra seminal que se utilizará para producir las dosis seminales, como a los de carácter genético, tanto de ausencia de enfermedades de transmisión sexual, como obtenidos de una exploración física general que descarte posibles malformaciones transmisibles. Tras la realización de un seminograma, en el que se valora el número de espermatozoides (≥50 millones por ml), la movilidad (≥50% con movilidad progresiva) y la morfología (≥14% de formas normales), se valora cómo la muestra supera el proceso de congelación y descongelación. De forma paralela se debe realizar un cultivo microbiológico o bien un análisis por PCR para detectar posibles enfermedades de transmisión sexual (hepatitisC y B, VIH, herpes, sífilis, Chlamydia/Mycoplasma, citomegalovirus y gonorrea. Un análisis de sangre, que incluye el grupo sanguíneo así como el Rh, y los antecedentes familiares son también necesarios para descartar enfermedades genéticas que potencialmente pueden ser transmisibles. Se recomienda realizar un análisis del cariotipo para evitar posibles reorganizaciones del genoma no deseadas. El conjunto de análisis mencionados son relativamente caros, pero generan, en cierta medida, un marco de seguridad para el uso de estas muestras en mujeres que van a ser sometidas a técnicas como la inseminación artificial o la fecundación in vitro utilizando muestras procedentes de banco de semen.
Uno de los parámetros que no es necesario utilizar en la selección de los donantes es el que se relaciona con el daño que puede sufrir la molécula de ADN o la predisposición al daño que ese donante pueda tener. Sin embargo, en la era del ICSI, y teniendo en cuanta que estos espermatozoides se someten a procesos parabiológicos tales como centrifugaciones, lavados en medios fisiológicos o bien la congelación-descongelación, la calidad del ADN puede representar un nuevo parámetro a considerar como una prueba adicional con la que catalogar de forma más eficiente a los donantes. Este concepto gana importancia dado que los niveles de daño en el ADN de los espermatozoides pueden comprometer el éxito reproductivo2–5. En la mayoría de los estudios en los que se analiza la fragmentación del ADN del espermatozoide (SDF, de sperm DNA fragmentation) se maneja el valor del daño como un concepto estático y que nos informa del porcentaje de espermatozoides que tienen la molécula de ADN fragmentada en una unidad de finita tiempo. Sin embargo, la SDF, lejos de ser un valor estático, tiende a aumentar a medida que el esperma se procesa ex vivo bajo condiciones parabiológicas. La pérdida de funcionalidad que experimenta el espermatozoide al ser manejado ex vivo se relaciona con el impacto del daño iatrogénico que puede afectar no solo a la molécula de ADN, sino también a otras estructuras del espermatozoide tales como las membranas, el acrosoma o la actividad mitocondrial. Este fenómeno ocurre en todas las especies en las que se utilizan muestras de semen ex vivo para inseminación5–7 y, de hecho, este daño puede permanecer como no visible (daño críptico) por un periodo de tiempo que suele depender del agente que provoca el estrés8. Particularmente, en el caso de los humanos, el impacto del daño iatrogénico sobre el ADN se manifiesta como un valor creciente de la SDF a medida que las muestras seminales se manejan ex vivo y que se detecta de forma patente durante las 6 primeras horas de manejo de las muestras9. De esta forma, tras la descongelación de muestras criopreservadas en las que se valora en el daño a lo largo de un periodo de tiempo variable, se observa un incremento diferencial del daño que está asociado, en principio, al individuo que puede alcanzar tasas de crecimiento de tipo logarítmico hasta exponencial9. De hecho, si traspasamos las barreras intraespecíficas y comparamos las velocidades a las que se incrementa el daño en el ADN entre especies diferentes de mamíferos, encontraremos que las diferencias en el diseño del genoma y que se relacionan con la conformación final de las protaminas estipulan la longevidad del ADN para una especie en cuestión10. Por lo tanto, podemos aseverar que, cuando manejamos el espermatozoide ex vivo, encontraremos una longevidad diferencial de la molécula de ADN, que se pone de manifiesto tanto a nivel intraespecífico como interespecífico.
Una hipótesis de trabajo plausible podría plantear que aquellos varones que actúan como donantes deberían presentar niveles de daño menores que los observados en los controles, y adicionalmente mostrarían una buena estabilidad de la cromatina. Todo ello redundaría en un menor impacto del daño iatrogénico y en una mayor longevidad de la molécula de ADN para ser manejada ex vivo, ofreciendo ciertas garantías de éxito reproductivo. Dentro de este escenario, el incremento dinámico del daño que se registra en el ADN, considerado este como el incremento del daño por unidad de tiempo durante el manejo de eyaculado ex vivo, puede ser un elemento a considerar en el momento de seleccionar muestras de posibles donantes que se derivarán a criopreservación en los bancos de semen. Una de las hipótesis de trabajo que podríamos generar está encaminada a descubrir si aquellos individuos que presenten una menor proporción de espermatozoides con ADN fragmentado y cuya cromatina sea más estable tras la descongelación serían una mejor opción para ser utilizados en los procesos de inseminación, con tasas de éxito mayores. En una primera aproximación a esta pregunta de amplio espectro, el objetivo de este estudio prospectivo es conocer los niveles de daño registrado en el ADN del espermatozoide en su nivel basal, así como el comportamiento dinámico del daño tras la descongelación en varones que fueron seleccionados como donantes.
Material y métodosLos donantes fueron proporcionados por 4 clínicas diferentes (n=50). Como grupo control se utilizaron varones normozoospérmicos (n=40) que asistieron en busca de ayuda para la reproducción en una de las clínicas que participó en el estudio. En el caso de los controles, se excluyeron todos los casos de varones en los que durante la realización de un seminograma rutinario se apreciaba algún carácter de no normalidad en el eyaculado de acuerdo con los criterios de la OMS en lo que se refiere a concentración, morfología y motilidad. Todas las muestras fueron criopreservadas de acuerdo con los protocolos establecidos para cada una de las clínicas participantes, y se descongelaron y procesaron en los laboratorios del Departamento de Genética de la Universidad Autónoma de Madrid, para evitar posibles desviaciones asociadas a: 1) la metodología de manejo de los espermatozoides tras la descongelación, y 2) a la cuantificación de los niveles de daño en el espermatozoide tras la descongelación.
Dado que el impacto de la descongelación y procesado diferencial de la muestra de semen puede introducir variaciones en los resultados obtenidos, describiremos con detalle los pasos seguidos en nuestro modelo experimental. La descongelación de las muestras se realizó tras 10s de inmersión de la muestra criopreservada en un baño atemperado a 37°C. Una vez descongelada la muestra, y sin demora, los espermatozoides se centrifugaron a 300g durante 5min con el objeto de eliminar los crioprotectores y los diluyentes utilizados durante la criopreservación. Una vez retirado el sobrenadante, el sedimento resultante se resuspendió de nuevo en medio modificado HAM-HEPES-F10 (Irvine Scientific, Santa Ana, CA, EE. UU.). La concentración espermática final de trabajo se ajustó en todos los casos a 10 millones de espermatozoides por ml en todas las muestras analizadas. La concentración espermática final que se utilice en el experimento es importante dado que esta puede tener influencia en la velocidad de generación del daño cuando los espermatozoides se sometan a cualquier episodio de estrés posterior11. Para evaluar la longevidad del ADN espermático cuando este se maneja ex vivo, se calculó la tasa de fragmentación del ADN (rate SDF; rSDF), entendida como el incremento de la SDF por unidad de tiempo evaluado en horas cuando el espermatozoide ex vivo se incuba en determinadas condiciones experimentales. En nuestro caso, la muestra se incubó a 37°C durante 24h en el medio arriba explicitado. Durante el proceso de incubación se determinaron los valores de SDF tras la descongelación (t0: antes de eliminar los crioprotectores y T0: tras la eliminación de los crioprotectores). Adicionalmente, se realizaron submuestreos para la evaluación de la r-SDF tras 2h (T2), 6h (T6) y 24h (T24) de incubación de la muestra. La SDF se evaluó utilizando Dyn-Halosperm® (Halotech S.L., Madrid, España). Es importante que en cada submuestreo se evalúen los niveles de daño de forma rápida tras la obtención de la muestra y nunca se debe mantener esta a temperatura ambiente, dado que el daño en el ADN continúa aumentando. Una alternativa logística para evitar realizar series de análisis de fragmentación individuales es congelar directamente (−20°C) una parte alícuota de cada fracción en el tiempo estipulado de recogida de la muestra (50microlitros aproximadamente). Una vez acumulada toda la serie, se descongelan todas las muestras y se procesan de forma simultánea de forma rápida tras la descongelación. Los valores de SDF registrados antes y después de la descongelación deben ser idénticos a los de antes de la congelación, dado que el ADN no se afecta de forma directa por este proceso. La longevidad de la molécula de ADN entre 2 espacios determinados de tiempo de incubación se corresponde con la pendiente de la recta entre los 2 puntos establecidos de acuerdo con una ecuación tipo y=m x+b, donde x e y son las variables en un plano (SDF inicial y SDF final) y m es la pendiente de la recta.
Las muestras procesadas con Dyn-Halosperm® se analizaron utilizando microscopia de fluorescencia y se contabilizaron por un mismo observador. Todas las pruebas estadísticas se realizaron utilizando el programa estadístico Statistical Package for the Social Sciences® 17 (SPSS Inc., Chicago, IL, EE. UU.). Se utilizaron tests no paramétricos para muestras relacionadas (prueba de rangos con signo Wilcoxon) y no relacionadas (U de Mann-Whitney). El componente de normalidad se determinó mediante el test de Kolmogorov-Smirnov. Las correlaciones utilizadas entre distintas variables fueron también no paramétricas (Pearson). Finalmente, se aplicaron curvas de tipo receiver operating characteristic (ROC) para analizar tanto la sensibilidad como la especificidad para la discriminación de los mejores donantes y los valores predictivos de las distintas variables con respecto a la condición de donante o control. Los valores de corte para las distintas variables se dedujeron tras la aplicación del índice de Youden obtenidos con los valores de sensibilidad y especificidad para cada curva.
ResultadosAnálisis estático del daño en el ácido desoxirribonucleicoEn lo que se refiere a la evaluación estática del daño en el ADN espermático, es decir, los valores obtenidos tras la eyaculación antes y después del lavado, no existen diferencias entre los valores encontrados para t0 y T0 (tabla 1). Al separar la muestra entre los 2 grupos preestablecidos, controles y donantes, tampoco se observan diferencias entre t0 y T0 (tabla 1).
Distribución de los valores obtenidos para los niveles basales de daño tras descongelación (t0) y tras lavado de las mismas muestras (T0)
| SDF-t0 | SDF-T0 | p | |
| SDF total | 12,0±5,1 | 12,2±5,4 | Prueba de rangos con signo Wilcoxon: Z −1,087; p=0,277 |
| SDF control | 16,7±11,2 | 17,18±12,2 | Wilcoxon: Z −1,179; p=0,242 |
| SDF donantes | 8,3±5,4 | 8,3±5,4 | Wilcoxon: Z −0,242; p=0,809 |
Al comparar los valores basales de fragmentación obtenidos para los tiempos t0 y T0 (SDF t0 y SDF T0 en la tabla 1) entre el grupo control y el grupo de donantes, sí que existen diferencias significativas (t0 U de Mann-Whitney 464,50; p=000; T0 U de Mann-Whitney 445; p=000). Los valores registrados del daño en el grupo control son significativamente superiores a los observados en los donantes.
Con objeto de comprobar si los niveles de daño basal registrado tras la congelación de la muestra a −20°C (T-20°C) varían con respecto a los registrados en la muestra descongelada y lavada (T0), se utilizaron 20 donantes donde una parte alícuota de la muestra ya lavada para retirar los crioprotectores (T0) se congeló directamente en el medio de cultivo a T-20°C y se realizó un nuevo análisis de fragmentación transcurridas 24h de congelación. Las diferencias obtenidas entre los valores de la SDF para T0 y T-20°C no fueron significativas (media T0=8,31, DE=4,29; media T-20°C=8,54, DE=4,42; Z -0,678; prueba de los rangos con signo de Wilcoxon: p=0,498).
Análisis dinámico del daño en el ácido desoxirribonucleicoEn lo que se refiere al estudio de la longevidad de la molécula de ADN, las tasas de incremento en el daño observadas en los distintos tiempos en los que se realizó el muestreo tras el periodo de incubación a 37°C se contemplan en la tabla 2.
Distribución de los valores obtenidos para los incrementos del daño (rSDF) entre los periodos experimentales de incubación considerados en el experimento (T0-2, T2-6, T6-24 y T0-24)
| rSDF-T0-2 | rSDF-T2-6 | rSDF-T6-24 | rSDFT0-24 | |
| Control | 3,63±2,77 | 0,58±0,53 | 0,21±0,20 | 0,55±0,25 |
| Donantes | 1,59±1,8 | 0,79±0,93 | 0,37±0,49 | 0,54±0,52 |
| p | U Mann-Whitney; 535, p=0,000a | U Mann-Whitney; 877, p=0,317 | U Mann-Whitney; 792, p=0,091 | U Mann-Whitney; 797, p=0,099 |
Los valores de rSDF se estiman en unidades de incremento del daño por hora.
Para fijar los niveles de corte asociados a las variables tanto de daño estático como de daño dinámico, así como la sensibilidad y especificidad del sistema utilizando los 2 grupos identificados a priori -donantes y controles-, se realizó un análisis de curvas ROC. El análisis se planteó para estudiar la sensibilidad y especificidad de los valores asociados a t0/T0 y para las distintas rSDF obtenidas entre los diferentes intervalos de tiempo de incubación y muestreo. Los resultados de las curvas ROC obtenidas se muestran en la figura 1. Los valores de área bajo la curva de mayor magnitud lo presentan las variables t0, T0 y rSDF-T0-2 (área=0,818, área=0,824, área=0,682, respectivamente), con intervalos de confianza asintóticos al 95% de 0,74-0,89 para t0; 0,747-0,901 para T0 y 0,593-0,771 para rSDF-T0-2, para los límites superiores e inferiores respectivamente (p=0,000). De esta forma el índice de Youden identifica valores de SDF-t0/T0=9,5/7,8, que son capaces de identificar a los donantes con aproximadamente un 82% de sensibilidad y un 65% de especificidad. Para el análisis dinámico del daño en el ADN se genera un mayor poder de discriminación entre ambos grupos cuando se utilizan los valores ofrecidos por la rSDF-T0-2. Valores de incremento del daño de 1,8 por hora generan un valor de corte asociado a un 77% de sensibilidad y un 65% de especificidad. Los valores suministrados por las rSDF-T2-6, rSDF-T6-24 y rSDF-T0-24 no discriminan con la misma eficacia los donantes del grupo control (fig. 1).
Curvas ROC para las distintas variables utilizadas en el experimento. a. Sensibilidad y especificidad obtenidas con las siguientes variables: t0: línea azul medio; T0: línea verde; rSDF-T0-2: línea azul oscuro; rSDF-T2-6: línea morada; rSDF-T6-24: línea azul claro, y rSDF-T0-24: línea roja. b. Sensibilidad y especificidad obtenidas con la variable combinada tasa de daño combinado.
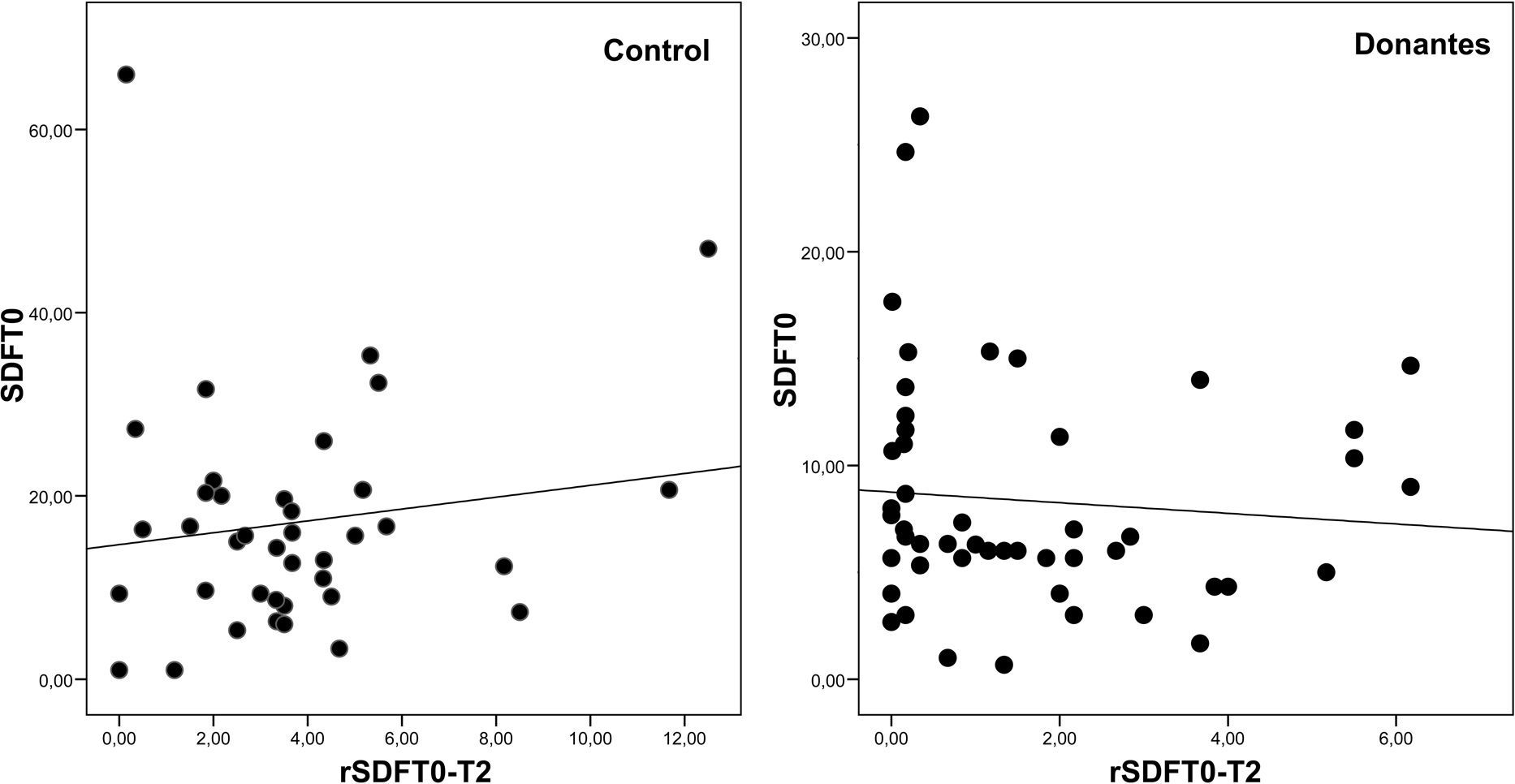
Puesto que los valores T0 y rSDF-T0-2 eran los que ofrecían una mejor discriminación, se analizó la posible correlación entre ambos valores para comprobar si se comportaban como variables independientes. Tanto en el caso de los controles como en el de los donantes, la correlación obtenida entre T0 y la rSDF-T0-2 fue muy baja (Pearson 0,145, p=0,384 y Pearson -0,083, p=0,565, respectivamente) (fig. 2).
Al tratarse de variables independientes, estudiamos si una composición de ambas variables podría ofrecer un mejor valor de discriminación entre los donantes y los controles. Para ello, realizamos una combinación de las 2 variables independientes (T0 y rSDF-T0-2) para definir la tasa de daño combinado (TDC). Consideramos la TDC como el producto del daño observado en T0 por el incremento del daño registrado durante las 2 primeras horas de incubación (rSDF-T0-2). Con este nuevo panel de valores realizamos una nueva aproximación utilizando las curvas ROC para estudiar los valores de sensibilidad y de especificidad ofrecidos. En este caso, los valores de área bajo la curva para el índice TDC fueron de área=0,816, con intervalos de confianza asintóticos al 95% de 0,720-0,913 para los límites superiores e inferiores, respectivamente (p=0,000). El índice de Youden identifica valores de TDC=23,8 unidades y les subroga una capacidad de identificación de los donantes en torno al 70% de sensibilidad y 78% de especificidad.
Si asumimos los valores derivados de las ROC para SDF-T0≤7,8%, una rSDF-T0-2=1,8% por hora y una TDC≤23,8 unidades, no todos los donantes elegidos como tales cumplirían estos requisitos. De hecho, tan solo el 36% del total de la muestra de donantes cumplen las 3 exigencias fijadas en la tabla 3. Estos individuos podrían ser tipificados como donantes de una alta estabilidad en su molécula de ADN y altamente resistentes al impacto del daño iatrogénico, y compartirían entre ellos el presentar niveles muy bajos de daño en su ADN basal. El 40% de los donantes fueron considerados como fuera de esta norma, pero cumplen al menos 2 de las condiciones fijadas. Si estos niveles de corte se aplican al grupo control, se obtiene que el 5% de ellos podrían ser teóricos donantes de buena calidad para los parámetros considerados, ya que superarían el nivel de corte establecido para los 3 parámetros (tabla 3).
Tabla de doble entrada en la que se identifican los valores de corte para T0, rSDF-T0-2 y TDC y la proporción tanto de donantes como de controles que cumplen las condiciones fijadas en distintos niveles
| Valores | SDF-T0 | rSDF-T0-2 | TDC |
| <7,8% | <1,8 por hora | <23,8 |
| Cumplen las 3 | Cumplen al menos 2 | Cumplen 1 o 0 | |
| Donantes | 18 (36%) | 20 (40%) | 12 (24%) |
| Control | 2 (5%) | 9 (50%) | 29 (30%) |
El presente trabajo muestra que tanto los niveles basales del daño en el ADN de los donantes, como la velocidad de degradación del ADN del espermatozoide trascurridas las 2 primeras horas de la descongelación, son menores y significativamente diferentes que las observadas en una muestra de individuos normozoospérmicos utilizados como controles. Por lo tanto, podemos afirmar que, en general, la selección de donantes que se está realizando en distintas clínicas asegura unos niveles bajos de daño en el ADN y una estabilidad alta de la molécula de ADN en el espermatozoide. Este hecho debiera redundar en un mayor éxito reproductivo cuando se utiliza semen procedente de estos donantes. Conviene resaltar que esta selección positiva ejercida sobre estos parámetros de calidad seminal se está realizando de forma absolutamente empírica, dado que en ningún caso las clínicas utilizaron estos parámetros como indicadores de una mejor calidad seminal cuando se realiza un seminograma de forma rutinaria.
Los valores basales de SDF observados en el grupo control son del orden de 2 veces mayores que los obtenidos en el grupo de donantes. Por otra parte, la velocidad de degradación del ADN es más elevada durante las primeras 2h de incubación. En el caso del grupo control la velocidad de degradación del ADN oscila entre un 1 y un 6% de incremento del daño por hora, dependiendo del individuo. Este valor, en el caso de los donantes, oscila entre un 1 y un 3% por hora, y los valores medios resultan del orden de 2,5 veces inferiores a los observados en el grupo control. Estas diferencias no son tan patentes a medida que aumenta el tiempo de incubación. Este efecto tiene su explicación en el incremento en la cantidad de espermatozoides con daño en su ADN, que se acumula de forma progresiva a medida que aumenta el tiempo de incubación. La consecuencia lógica de este efecto es que todos los individuos tienden a homogeneizar los valores del daño transcurridas 24h de la incubación. Por ello, las diferencias que se observan entre individuos tienden a no ser significativas cuando se comparan periodos largos de incubación (24h), mientras sí que se aprecian diferencias significativas tras periodos de incubación relativamente cortos (2h). Desde un punto de vista logístico este hecho es interesante, ya que no es necesario realizar análisis dinámicos de fragmentación de larga duración, por lo que el test dinámico de fragmentación sería rápido en su ejecución. Este aspecto tiene interés desde un punto de vista clínico, dado que 2h de incubación es un tiempo prudencial que suele transcurrir entre la descongelación de la muestra seminal y la fertilización. Durante este periodo no es deseable que se genere un incremento del daño que pudiera comprometer el desarrollo embrionario tras la singamia.
Con independencia de que un individuo haya sido seleccionado para ser incluido en un programa de donación de semen, es evidente que no todos los donantes son iguales, ni por las características de selección establecidas en la legislación vigente ni por las restricciones impuestas por las clínicas. La explicación de esta realidad subyace en parte en la propia variabilidad genética asociada a los genomas de las especies. De todas formas, asumiendo que se trata de individuos que no han sufrido episodios de estrés previos a la obtención de la muestra que pueda comprometer la calidad del semen, se podrían argumentar algunos aspectos que condicionan e influyen en la calidad del ADN del espermatozoide. Es conocido que tanto los niveles de daño que afectan al espermatozoide tras la eyaculación, como la longevidad del ADN cuando el espermatozoide se maneja ex vivo, son diferentes cuando se comparan especies distintas10, como al comparar individuos dentro de una misma especie12–14. La explicación de las diferencias interespecíficas en el caso de los mamíferos parece relacionarse con la presencia de la protamina 2 (Prot2) en la cromatina del espermatozoide. Es conocido que las protaminas mayoritarias presentes en el espermatozoide de los mamíferos y encargadas de dar estabilidad a una molécula muy compactada de ADN son tanto la protamina 1 (Prot1) como la Prot215,16, si bien existen toda una serie de proteínas de transición que participan en la exclusión casi total de las histonas a las que reemplazan. Las protaminas están relativamente conservadas, si bien existen variantes de secuencia que pueden cambiar ligeramente la estructura final de la proteína resultante17. Sin embargo, mientras que todas las especies de mamíferos presentan Prot1 en el espermatozoide, un suceso evolutivo determinó que algunas especies, tales como Bos taurus o Sus domestica, presenten los genes para codificar esas proteínas, pero los rARN que generarían la Prot2 no llegan a traducirse10,18. En aquellos mamíferos que presentan ambas protaminas, parte de la Prot1 es sustituida durante la maduración del espermatozoide por Prot2. Debido a que la Prot1 es más rica en puentes disulfuro que la protamina Prot219, la estabilidad del ADN en el espermatozoide de las especies que solo presentan Prot1 es más elevada10. ¿Qué ocurre, en términos de estabilidad en la molécula de ADN, en las especies donde la Prot1 es reemplazada por la Prot 2, como es el caso de los humanos? En general, si no existe una relación estequiométrica de equilibrio 1:1 en lo que se refiere a las cantidades de Prot1:Prot2, el daño que se observa en el ADN es mayor que cuando esta relación es 1:119-21,29, y también es mayor la velocidad a la que se degrada el ADN22. Por lo tanto, se podría especular que, en el momento de seleccionar donantes de semen de alta calidad por su bajo nivel de daño en los niveles basales y en la alta longevidad de su molécula de ADN, estamos seleccionando genomas que presentan una buena relación estequiométrica para Prot1:Prot2. Esta hipótesis no nos tiene que llevar a pensar que aquellos individuos que no se encuadren en los niveles de corte sugeridos en este estudio se verían siempre afectados por desequilibrios en la correcta producción de las protaminas, dado que existen multitud de circunstancias que pueden producir daño en el espermatozoide, tales como los elevados niveles de estrés oxidativo, la temperatura o la condición genética del individuo, entre otras23,24, si bien, tendríamos que asumir que este tipo de circunstancias no concurren de forma continuada en el caso de aquellos individuos que se seleccionaron como donantes.
Es un hecho conocido que existe una pérdida de la calidad en los parámetros seminales convencionales cuando las muestras se manejan ex vivo. De hecho, la incidencia del llamado daño iatrogénico sobre el espermatozoide es una de las constantes en la literatura relacionada con temas sobre fecundación6. El manejo ex vivo del espermatozoide impone la separación del plasma seminal. Esta separación parece que genera beneficios sobre la calidad final de los espermatozoides contenidos en la muestra que se utilizará para fertilizar, dado que se recuperan los mejores espermatozoides y se eliminan aquellos que fisiológicamente están más afectados25–28. Sin embargo, los beneficios netos no son tan reales como asumimos, dado que el espermatozoide se daña debido al manejo que hacemos de él ex vivo2. Esto ocurre cuando las muestras de esperma se exponen a temperaturas incluso fisiológicas, y son muchos los casos que en la literatura relatan este tipo de efectos en todos los mamíferos. Por ejemplo, en el caso del ganado bovino, la fertilidad asociada a un macho reproductor se conserva razonablemente bien entre periodos de 3 a 5 días cuando el semen se almacena simplemente a temperatura ambiente. Después de este tiempo, la fertilidad decae en una tasa aproximada de un 3 a 6% por día. No parece que existan grandes diferencias entre almacenar las muestras a 5 o a 15°C, pero este efecto es muy notable cuando las temperaturas de almacenamiento son superiores a 25°C30. La respuesta diferencial de las características seminales clásicas se puede ver también condicionada por el tipo de diluyente seminal que se utilice. Así, por ejemplo, en el caso del ganado porcino, donde los diluyentes seminales están muy avanzados, existen diferencias en la respuesta de las membranas del espermatozoide dependiendo del tipo de diluyente que se utilice. Las variaciones se circunscriben a periodos de almacenamiento superiores a 48h de diferencia (3-5 días) para obtener resultados de fertilidad similares31,32. Por lo tanto, parece evidente que la temperatura, o quizás de forma más precisa habría que decir los cambios de temperatura en las muestras seminales, pueden producir efectos nocivos sobre la viabilidad del esperma cuando este se maneja ex vivo. En el caso de los humanos, se ha demostrado que la recogida de muestras de semen en sitios distantes de donde será utilizado para fertilizar conduce a un daño de carácter iatrogénico que provoca descensos en el potencial éxito reproductivo de esos pacientes33. Se ha comprobado que en pacientes que presentan azoospermia obstructiva, la fragmentación del ADN en espermatozoides del testículo se incrementa de forma notable entre las 4 y las 24h tras la obtención de estas muestras34.
Dado que la pérdida de calidad del ADN parece ineludible cuando el esperma se maneja ex vivo, y que los niveles de daño en el ADN pueden influir en el momento de conseguir un embrión normal, cierto control sobre el daño existente en el espermatozoide o el potencialmente producido se debería considerar como un valor adicional para seleccionar los mejores donantes. De los datos que se desprenden en este estudio, niveles basales de daño en el ADN inferiores a un 8% y pérdidas de la calidad del ADN de aproximadamente un 2% por hora durante las 2 primeras horas de descongelación podrían ser considerados como valores de corte para discriminar entre donantes normales y «superdonantes», para las características consideradas en este estudio. Es interesante enfatizar el hecho de que tanto los niveles de daño basales como las velocidades de degradación del ADN en los individuos utilizados como control se alejan mucho más de estos valores. Por lo tanto, con independencia del impacto que pueda tener este aspecto en el caso de los donantes, sí que resulta evidente que la situación para estos parámetros tiene un peor pronóstico en el caso de algunos pacientes. Refuerza la falsabilidad de la hipótesis planteada en este trabajo el hecho de que algunos pacientes cumplen y superan con creces los valores de corte establecidos para discriminar entre los donantes y los «superdonantes».
Las características que debe cumplir un individuo que será seleccionado como un potencial donante de muestras de semen implican parámetros fenotípicos, genotípicos, fisiológicos, psicológicos y, por supuesto, los referentes a la calidad seminal. En la actualidad, y asumida la decreciente calidad de los parámetros seminales de las poblaciones que se ubican en estructuras sociales llamadas desarrolladas, el estricto cumplimiento de estos mínimos hace que el número de donantes potenciales se vea notablemente reducido. El disminuir las exigencias en los criterios de selección implica que podemos incurrir en ofrecer a determinadas pacientes una muestra seminal procedente de donantes que se considerarían borderline para las condiciones de normalidad establecidas en relación con la calidad del ADN. En este escenario, el disponer de estrategias adicionales que nos puedan asegurar que si un donante no tiene un recuento por encima de los 50×106, pero tiene unos niveles de daño basal en el ADN bajos y una longevidad de la molécula de ADN alta, puede, en cierta medida, paliar el efecto negativo que se derivaría de, por ejemplo, presentar una concentración relativamente baja de espermatozoides. En la era del ICSI, sería lógico asumir que la calidad del ADN tendría que ser considerada de forma más fehaciente, dado que ni el número de espermatozoides ni el presentar una motilidad reducida, que en este caso puede ser fruto del mismo proceso de manejo ex vivo, incluido el procedimiento de congelación/descongelación, representan obstáculos para que el espermatozoide pueda fertilizar.
Conclusiones- 1.
Las muestras de semen criopreservado procedentes de donantes de distintas clínicas muestran niveles de fragmentación de su ADN del orden de 2 veces inferiores a los que presentan un grupo control que podría ser representativo de una población normal.
- 2.
El ADN procedente de las muestras seminales de los donantes es del orden de 2,5 veces más longevo que el de la población control.
- 3.
Los valores basales de SDF estimados tras la eyaculación en torno a un 8%, identifican a los donantes con un 82% de sensibilidad y un 65% de especificidad.
- 4.
Valores de incremento del daño de 1,8 por hora durante las 2 primeras horas de incubación identifican a los donantes con un 77% de sensibilidad y un 65% de especificidad.
- 5.
El uso combinado de las 2 variables anteriores transformadas en el índice TDC le subroga una capacidad de identificación de los donantes en torno al 70% de sensibilidad y 78% de especificidad para un TDC=23,8 unidades.
- 6.
La utilización de este tipo de índices podría llevarse a cabo para categorizar aquellos donantes considerados como «superdonantes» si cumplen las condiciones anteriormente expuestas.
- 7.
Los donantes que se seleccionaron en las diferentes clínicas que participaron en este estudio presentan características equiparables para estos parámetros.
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEl presente trabajo se financió con el proyecto procedente del Ministerio de Educación y Ciencia de España (BFU2010-16738/BFI) y los fondos aportados por las distintas fundaciones de las clínicas participantes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores desean expresar su gratitud a todas las personas que han participado en este estudio de forma directa o indirecta.