Desarrollar y poner a punto la técnica de dispersión de la cromatina espermática (SCD) para evaluar el grado de fragmentación del ADN en semen.
Materiales y métodosSe incluyeron 57 pacientes normozoospérmicos (OMS 2010), los cuales fueron invitados a participar del estudio luego de firmar los consentimientos correspondientes. Se evaluó el grado de fragmentación mediante técnica de SCD, de manera objetiva y subjetiva, en muestras sometidas a estrés oxidativo con H2O2 y seleccionadas mediante swim up o gradiente de densidad, así como congeladas y descongeladas.
ResultadosLa evaluación objetiva demuestra que la menor fragmentación se asociaría a un mayor tamaño del halo por definición, aunque se observa un aumento (p<0,05) en el tamaño del núcleo. El tratamiento oxidante (>100μM de H2O2) aumenta el índice de fragmentación de forma dosis-dependiente sin afectar la viabilidad ni la motilidad espermática. Las técnicas de selección de espermatozoides mótiles evaluadas (swim up o gradiente de densidad) disminuyen el índice de fragmentación, aunque se observa cierta susceptibilidad individual. La congelación directa a –20°C permite diferir la realización del test, independientemente del tipo de muestra.
ConclusiónLa evaluación subjetiva de la técnica SCD es suficiente para su uso en el laboratorio clínico, siempre que se evalúe la relación halo/núcleo para la clasificación. La utilización del tratamiento oxidante permite introducir un control positivo de daño para la puesta a punto de la técnica. La selección espermática mediante técnicas de uso habitual en reproducción asistida disminuye el índice de fragmentación, observándose cierta susceptibilidad individual. La técnica SCD puede ser diferida mediante congelamiento de la muestra, lo que permite un ahorro de insumos, reactivos y tiempo de procesamiento.
To develop the sperm chromatin dispersion test (SCD) for evaluating the DNA fragmentation in semen.
Materials and methods57 normozoospermic (WHO 2010) patients were invited to participate in the study after signing the consents. DNA fragmentation was evaluated by SCD, objectively and subjectively, after oxidative stress with H2O2 and also in motile selected samples (swim up or density gradient), as well as in frozen and thawed samples.
ResultsThe objective assessment showed that minor fragmentation is associated to a larger halo size by definition, but also a significant increase in the size of the nucleus is observed. Oxidizing treatment (>100μM of H2O2) increases the fragmentation index in a dose-depend way without affecting sperm viability and motility. Different techniques of motile sperm selection (swim up or density gradients) decrease the fragmentation index with an individual susceptibility. Regardless of the sample (semen, suspension or post swim up direct freezing to –20°C allows to delay the test.
ConclusionSubjective evaluation of the SCD test is sufficient for the clinical laboratory, evaluating the relation halo/nucleoid for the classification. To set up the SCD a dose-response curve with oxidizing treatment is required as a positive control of damage. The use of sperm selection methods used in assisted reproduction, decreases the fragmentation index, however individual susceptibility was observed. The SCD could be delayed by freezing the sample which allows saving of reagents and processing time.
La infertilidad humana afecta a un 15-20% de parejas, siendo la mitad de los casos de origen masculino1. La integridad del ADN espermático es un prerrequisito para que ocurra la fecundación y transferencia de la información genética paterna. Las anomalías en el genoma masculino son un riesgo potencial para la fecundación y responsables de fallas en el desarrollo embrionario2-4. Si bien el espermograma tradicional es la mejor herramienta diagnóstica disponible para abordar el factor masculino, no detecta defectos a nivel genómico5. Un gran porcentaje de parejas no consiguen el embarazo, aun presentando espermogramas normales. La evidencia clínica indica que los espermatozoides de hombres infértiles con parámetros espermáticos normales poseen mayor daño en el ADN que los espermatozoides de hombres fértiles6,7.
Se disponen de diferentes técnicas para evaluar la fragmentación del ADN espermático: ensayo del COMETA8, de la estructura de la cromatina espermática (SCSA)9, hibridación fluorescente in situ (DBD-FISH)10, marcado de extremos libres por dUTP (TUNEL)11 y de traducción in situ de extremos libres (ISNT)12. Todas requieren equipamiento y reactivos complejos, son costosas y poco prácticas12. Actualmente se cuenta con el ensayo de dispersión de la cromatina (SCD), el cual es simple, rápido, reproducible, y permite evaluar la fragmentación del ADN espermático utilizando microscopia óptica13,14.
El objetivo de este estudio fue mejorar la técnica SCD para aplicarla al laboratorio andrológico de rutina. Así, la lectura subjetiva fue comparada con la evaluación objetiva mediante microscopio óptico. Se evaluó el efecto de un agente generador de daño oxidativo como control positivo, y el impacto de la selección de espermatozoides mótiles, así como la congelación directa sobre el índice de fragmentación (IF), con la intención de diferir el momento de la evaluación.
Materiales y métodosLa comisión de Bioética de la Facultad de Ciencias Bioquímicas y Farmacéuticas de la Universidad Nacional de Rosario aprobó este proyecto. Cada paciente que fue invitado a participar firmó su consentimiento informado.
Análisis seminal y procesamiento inicialLas muestras de semen de pacientes que concurrieron para evaluar su calidad seminal (n=57) fueron analizadas y procesadas según normativas de la OMS5. Los espermatozoides mótiles se seleccionaron mediante swim up (SU) o gradiente de densidad (Gra), utilizando medio HamF-10 (Gibco BRL, Life Technologies, Paisley, Escocia).
Test de dispersión de la cromatina (SCD)El SCD se realizó de acuerdo a la técnica descripta previamente13,14. Se utilizó agarosa de bajo punto de fusión (Promega, Madison, EE.UU.) 1% en agua y portaobjetos recubiertos con agarosa estándar (ICN Biomedicals Inc., Aurora, Ohio, EE.UU.) 0,65% en agua. La suspensión de espermatozoides se mezcló con la agarosa de bajo punto de fusión y se depositó sobre los portaobjetos pretratados con agarosa. Los preparados se expusieron 7min a solución desnaturalizante (0,08N HCl) y solución de lisis compuesta por 0,2M dithiothreitol (Sigma Chemical Co, St. Louis, EE.UU.), 2,5M ClNa (Merck, Darmstadt, Alemania), 0,2M Tris (Promega, Madison, EE.UU.) y 1% Triton X-100 (Promega, Madison, EE.UU.) de pH 7,5, por 25min a temperatura ambiente. Luego de fijados con etanol 70, 90 y 100%, fueron teñidos con solución de Wright (BIOPUR SRL, Rosario, Argentina).
Evaluación subjetivaSe analizaron 5 muestras y se evaluaron 200 espermatozoides por duplicado en microscopio óptico (inmersión, 1.000×) y, para aceptar los replicados, se calculó la máxima diferencia aceptable según el intervalo de confianza centrado en 95% según OMS5. Se clasificaron según: a) halo grande, b) halo medio, c) halo pequeño, d) sin halo, y e) degradado13,14. El IF se calcula como el porcentaje de c+d+e.
Evaluación objetivaSe analizaron 5 muestras y se evaluaron 200 espermatozoides a partir de la digitalización de la imagen tomada con cámara fotográfica (Olympus, Tokio, Japón) en microscopio óptico (1.000×). Se utilizó el programa de procesamiento de imagen digital de dominio público ImageJ (National Institute of Health http://rsb.info.nih.gov/ij/) para calcular el diámetro (μm) menor del núcleo y el grosor del halo de los espermatozoides de cada uno de los patrones de fragmentación nombrados anteriormente.
Tratamiento oxidantePara inducir estrés oxidativo, los espermatozoides mótiles recuperados por SU (5-10×106esp/ml) fueron expuestos a H2O2 (50, 100, 200 y 300μM) o medio (control: HamF-10) durante 30min a 37°C. Se realizaron controles de motilidad y viabilidad antes y después de cada tratamiento. Se analizó el IF y se determinó si el daño se asociaba a algún patrón específico de fragmentación. Se realizaron 6 experimentos completos.
Separación del plasma seminalSe evaluaron distintas técnicas de selección de espermatozoides mótiles, para determinar la fragmentación de ADN en las poblaciones recuperadas. Un grupo fue procesado mediante SU (n=12) según se describió previamente. Otro grupo fue procesado mediante Gra (n=24), y para ello se prepararon las fracciones 90 y 50% a partir de la solución stock de SilSelect Stock (Fertipro, Beernem, Bélgica) y HamF-10 10×. En tubo cónico se depositaron capas 90-50% y por encima, el semen. Se centrifugó a 400g durante 20min. Posteriormente se descartaron el plasma seminal y la fracción de 50%, y se lavó la fracción de 90% con 2ml de HamF-10 a 400g por 10min. Se evaluó el IF basal y luego de los tratamientos.
Procesamiento pre y poscongelaciónSe procesaron 10 muestras según: semen (S), semen suspendido en PBS 1X (SS) y espermatozoides recuperados mediante SU (SU). Cada alícuota fue procesada como muestra en fresco y congelada a –20°C durante al menos 2 días. Se analizó el IF antes y después del congelado.
Análisis estadísticoLos datos fueron analizados mediante el programa GraphPad InStat (GraphPad Software, San Diego, CA, EE.UU.). Se utilizaron ANOVA, test de Student-Newman-Keuls Multiple Comparisons y test de Tukey. Para diferencias entre 2 valores se utilizó el test de Student. Los resultados se expresaron como media±SEM, considerando significativo un valor de p<0,05.
ResultadosLos pacientes (n=57) exhibieron parámetros seminales superiores a los correspondientes al percentil 5.o, descriptos para una población fértil por la OMS5, presentando valores de volumen: 2,7±0,2ml; pH: 7,5±0,0; concentración: 117,7±12,3×106esp/ml; espermatozoides progresivos: 75,6±3,3%, vivos: 92,6±1,2%, y formas normales: 10,4±0,9%.
La evaluación objetiva permitió la medición del grosor del halo promedio en cada grupo, el cual por definición de patrones resultó mayor para «halo grande» respecto a los otros grupos (p<0,001) (tabla 1). Sin embargo, el tamaño medio del núcleo del grupo considerado como «halo grande» también resultó superior (p<0,001) a los otros grupos.
Diámetro del halo y diámetro menor del núcleo de espermatozoides procesados por la técnica SCD (n=5)
| Halo grande | Halo medio | Halo pequeño | Sin halo | Degradado | |
|---|---|---|---|---|---|
| Diámetro mínimo del núcleo (μm) | 14,7±0,6a | 10,0±0,5 | 10,6±0,3 | 9,9±0,3 | 7,4±1,0 |
| Grosor del halo (μm) | 19,6±0,9b | 6,3±0,4c | 2,1±0,1 | 0,0±0,0 | 0,0±0,0 |
Los datos representan la media±SEM.
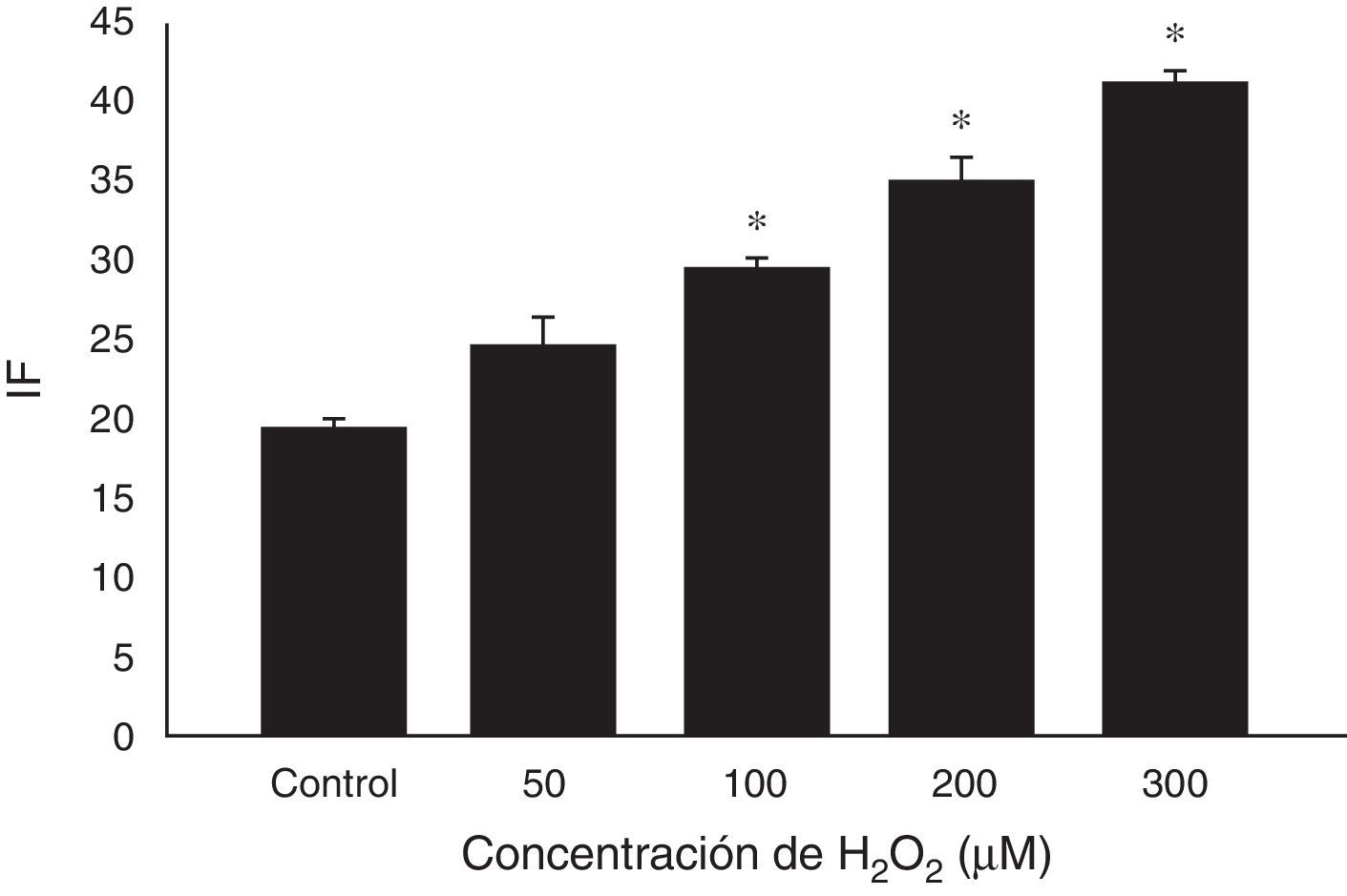
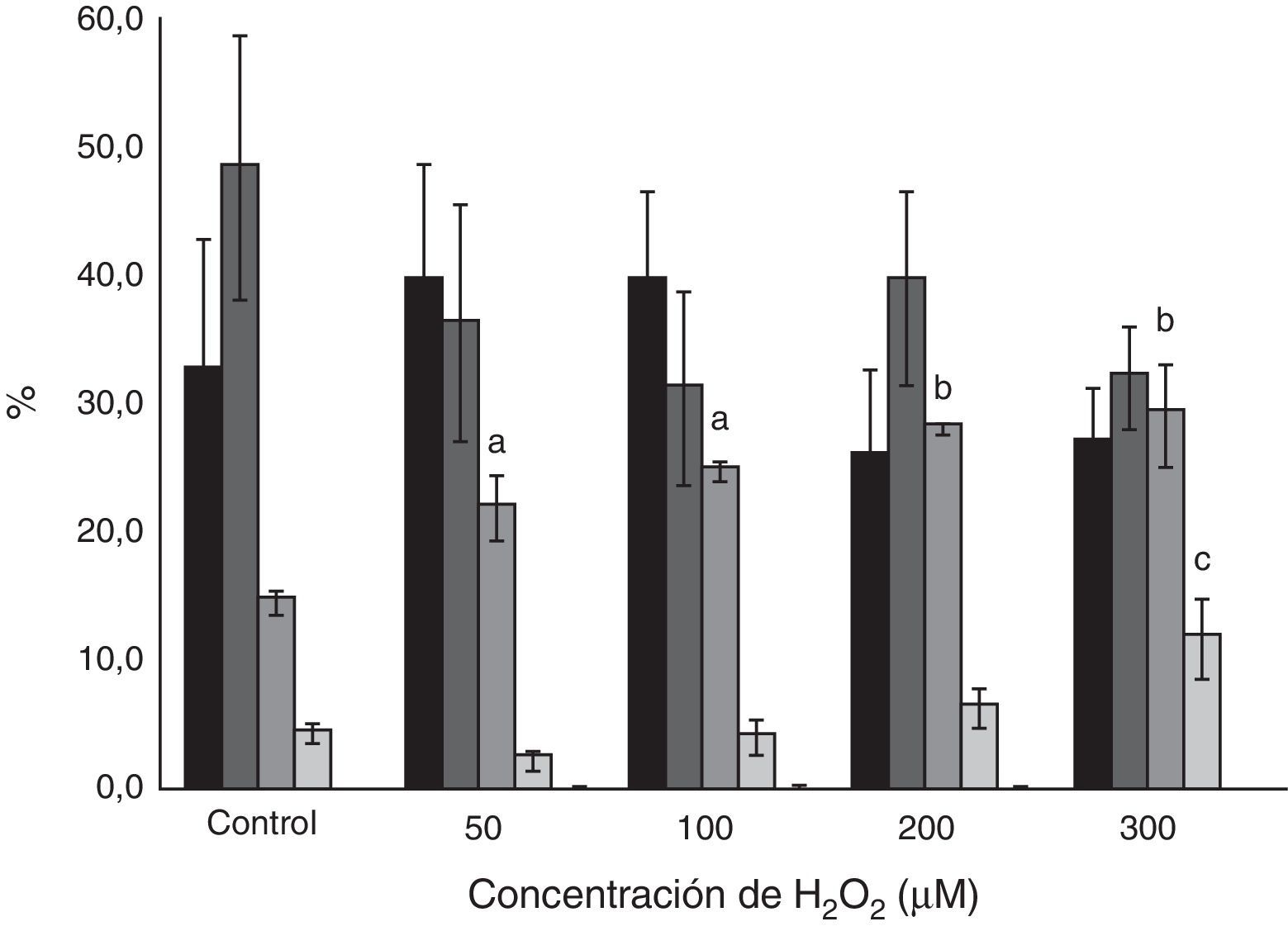
Se utilizó H2O2 para generar estrés oxidativo, sin efecto sobre la motilidad (>88%) ni la viabilidad (>93%) espermática. En presencia de concentraciones crecientes de oxidante, el IF aumentó en forma dosis-dependiente (p<0,001) a partir de 100μM (fig. 1). El aumento en el IF fue a expensas del patrón «halo pequeño» (p<0,05 para H2O2 50 y 100μM y p<0,01 para H2O2 200 y 300μM respectivamente) (fig. 2). Más aún, a concentraciones de 300μM también se observó un aumento significativo (p<0,05) del porcentaje de espermatozoides con el patrón «sin halo».
Efecto del H2O2 sobre el índice de fragmentación del ADN espermático. Se realizó la técnica de SCD luego de haber incubado los espermatozoides mótiles durante 30min a las distintas concentraciones de H2O2. Los resultados se expresan como media±SEM (n=6).
*p<0,001 respecto del control.
Efecto del H2O2 sobre los patrones de fragmentación del ADN espermático. Espermatozoides mótiles fueron incubados 30min a las distintas concentraciones de H2O2 y luego fueron procesados por la técnica SCD (
halo grande; halo medio; halo pequeño; sin halo, y degradado).Los resultados se expresan como media±SEM (n=6). a) p<0,05 respecto al control; b) p<0,01 respecto al control; c) p<0,05 respecto al control.
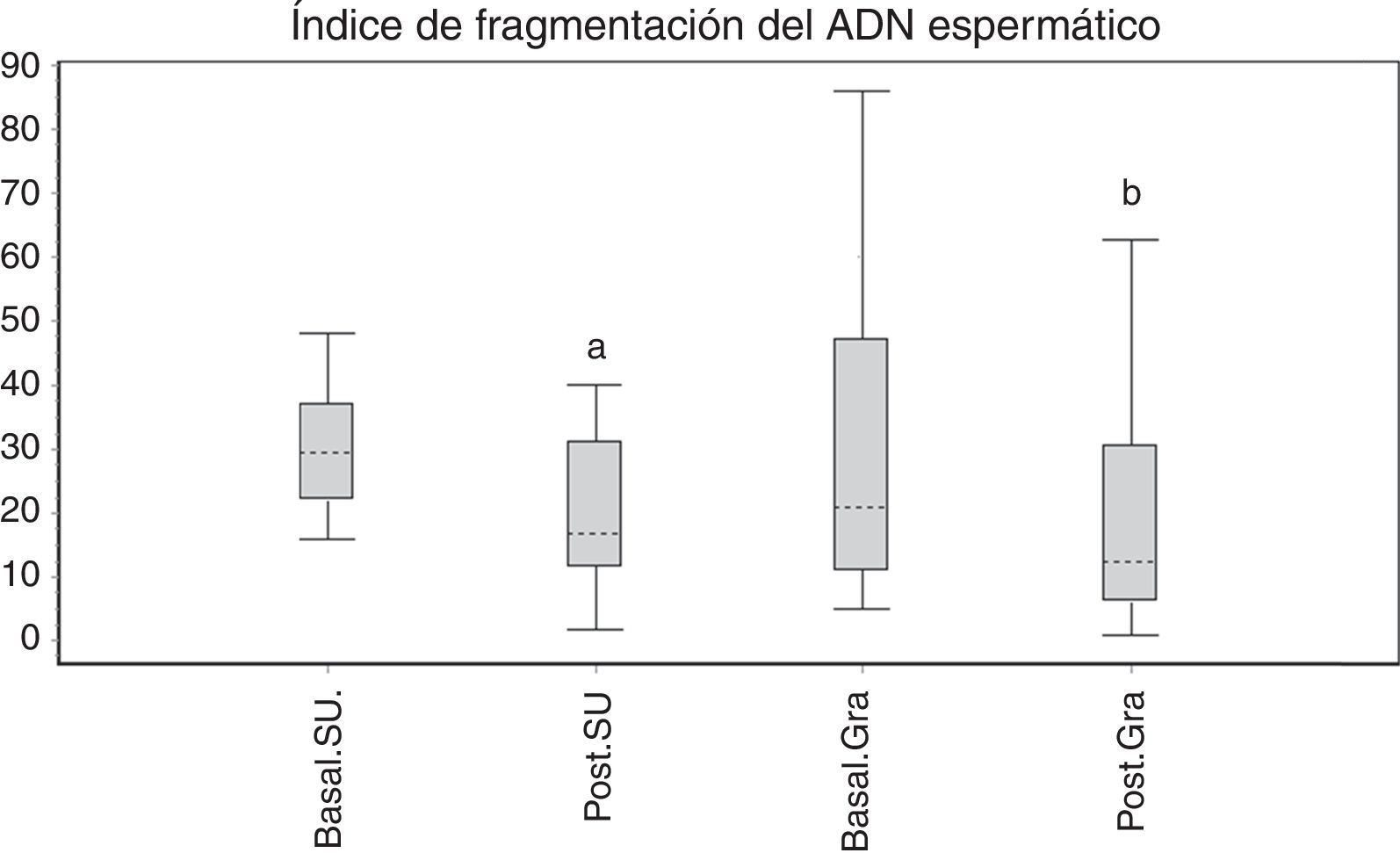
Cuando se seleccionaron espermatozoides mediante SU o Gra, se observó una disminución significativa del IF tras la selección (p<0,001) (fig. 3). Solo 4 de 12 pacientes (33%) para SU y 5 de 24 (21%) para Gra no mejoraron luego de la selección.
Al analizar el efecto generado al congelar las muestras, independientemente del tipo de muestra utilizada, encontramos que no hubo variación en el IF para basal versus poscongelado (tabla 2) (S, SS o SU; p>0,05; n=10). El control de estrés oxidativo, en todos los casos, generó un IF >50%.
DiscusiónSe ha propuesto un valor de corte de IF del 30% por encima del cual las posibilidades de fecundación in vivo disminuyen marcadamente, acercándose a cero. Un valor superior al 30% no solo es perjudicial para la fecundación in vivo, sino también para la inseminación intrauterina (IIU)15-17, siendo en esos casos aconsejado el uso de técnicas de alta complejidad como FIV o ICSI18,19. Por lo tanto, la evaluación del IF espermático tiene un alto valor predictivo, tanto para el éxito de la concepción natural, como para la elección de la técnica de reproducción asistida con mejores posibilidades de éxito. Existe un gran debate respecto a qué mide cada metodología disponible para evaluar el grado de fragmentación del ADN. En los métodos llamados directos (TUNEL, ISNT), las roturas, tanto de cadena sencilla como de cadena doble, se marcan sobre el espermatozoide, evaluándose el daño «real» del ADN20. Los métodos indirectos (SCD, SCSA, COMET) se basan en que las roturas del ADN incrementan la susceptibilidad a la desnaturalización que se inicia a partir de los extremos libres, por lo que se propone que estas técnicas miden el daño «potencial» del ADN9–12. En la técnica de SCD, la decondensación se utiliza como una manera de medir la fragmentación, ya que el ADN fragmentado es el único que puede desnaturalizarse bajo las condiciones utilizadas en este método, generando ADN simple hebra (ADNss). Solo el ADN doble hebra (ADNds) (no fragmentado) puede ser decondensado, permitiendo la expansión de halos de dispersión21,22. La técnica SCD consiste en el tratamiento de los espermatozoides con una solución desnaturalizante (ácida), la cual produce ADNss a partir del extremo de un fragmento de ADN roto. Si no está fragmentado, permanecerá como ADNds aún después del tratamiento con solución ácida. Posteriormente, los espermatozoides son tratados con una solución de lisis (con agentes reductores y detergentes) que rompe los enlaces disulfuro y remueve las proteínas del núcleo, permitiendo la decondensación del ADNds y el desenrollamiento de los bucles empaquetados en la matriz nuclear, provocando halos de dispersión. Sin embargo, el ADNss interactúa dentro de la cabeza del espermatozoide de manera tal que la remoción de las proteínas nucleares no provoca la dispersión del ADN (mecanismo desconocido). De esta manera, luego de la tinción, solo los espermatozoides con ADN intacto presentan halos de dispersión, mientras que no lo presentan aquellos con ADN fragmentado14,22,23. La principal ventaja es que la interpretación de los resultados no requiere la determinación de color ni de intensidad de fluorescencia. Tampoco necesita de un equipo complejo ni personal especializado, y solo es necesario un observador entrenado21. En este trabajo se ha evaluado si la lectura objetiva tras la digitalización de la imagen, y medida micrométrica del grosor del halo y núcleo, mejora la microscopia tradicional. Cabe destacar que, si bien el grosor de los halos fue significativamente superior de acuerdo al criterio de evaluación propuesto, el tamaño del núcleo de los espermatozoides del grupo «halo grande» también resultó significativamente mayor (p<0,001) respecto a los otros grupos. Esto podría deberse a que este patrón presenta la mayor dispersión de los bucles de ADN, por lo que su núcleo podría estar más esparcido que los núcleos de los otros patrones. Se han incorporado los sistemas computarizados de análisis del movimiento espermático al laboratorio andrológico de rutina, los cuales resultan muy útiles para evaluar el movimiento y la cinética espermática. El avance de estos sistemas al momento de evaluar el estado de fragmentación de ADN llevó a desarrollar programas para analizar los halos totales generados al evaluar la SCD. Aquí presentamos datos mostrando que el tamaño total del grupo «halo medio» se superpone con el clasificado como halo pequeño, por lo cual, si no se analizara la relación grosor del halo/núcleo en forma subjetiva, podríamos estar considerando espermatozoides dañados como «sanos». Así se estaría generando una subestimación del IF presente. Nuestros datos apoyan la importancia de la evaluación subjetiva, realizada por un operador entrenado, ya que no solo es necesario estimar el tamaño total del halo, sino también la relación entre el grosor de este y el núcleo.
Respecto a la inducción de daño, nuestros resultados mostraron un aumento dosis-dependiente en el IF con la concentración de H2O2, siendo la fragmentación significativamente superior (p<0,001) a partir de una concentración de H2O2 100μM, sin que estén afectadas ni la viabilidad ni la motilidad espermática, a ninguna de las concentraciones planteadas. Estos datos concuerdan con los hallazgos de Aitken et al., quienes describen un aumento significativo (p<0,001) en el daño del ADN utilizando dosis de H2O2 que varían entre 25 y 200μM, alcanzando el 90% de fragmentación para la dosis mayor (200μM)23. Luego de la incubación de espermatozoides mótiles 2h a 37°C en presencia de H2O2 10-200μM, Duru et al. observaron un aumento dosis-dependiente en el porcentaje de espermatozoides con ADN fragmentado, siendo la fragmentación significativamente superior para las dosis más elevadas de H2O2 (100 y 200μM)24. Sin embargo, a diferencia de nuestros resultados, estos investigadores notaron una disminución en la motilidad espermática luego de la incubación. Esto podría deberse a que los espermatozoides permanecieron expuestos mayor tiempo al H2O2 (2h) que lo realizado en nuestro modelo (30min). Luego de la incubación de espermatozoides con concentraciones crecientes de nitropruciato de sodio (otro agente oxidante) durante 1h a temperatura ambiente, el grupo de Fernández et al. demostró un incremento dosis-dependiente del IF a expensas del patrón «halo pequeño» y «sin halo», coincidiendo con nuestros resultados14. Es de destacar que algunos colegas suponen que estos espermatozoides sin halo, en realidad presentarían un grado de dispersión tan extremo que no lo detectaríamos en el campo microscópico; sin embargo, no hay evidencia científica que avale esta suposición. Según el grupo de Fernández et al., el no incremento en el número de espermatozoides con patrón «degradado» podría deberse a que una fragmentación extrema no se produce por el ataque de los radicales, al menos inicialmente, y probablemente podría estar asociado a la degradación de la matriz nuclear14. La posibilidad de discriminar este daño extremo es una clara e importante ventaja de la técnica SCD, especialmente en pacientes que presentan varicocele, ya que esta patología parece promover la fragmentación del ADN espermático, de modo que el daño nuclear tiende a ser más marcado, con incremento del número de espermatozoides con patrón «degradado»25. Esto podría deberse a un mayor tiempo de exposición a radicales libres generados por la acción del reflujo venoso anómalo.
La utilización de técnicas de reproducción asistida como IIU, FIV o ICSI requiere una selección previa de los espermatozoides. En este trabajo observamos que tanto el SU como el Gra seleccionan una subpoblación con menor IF, lo cual implicaría un mayor beneficio respecto a la población seleccionada. Sin embargo, existe alguna susceptibilidad individual que hace que algunos pacientes no mejoren sus parámetros por el tratamiento. Esto sugiere la necesidad de la evaluación en un ciclo previo respecto de posibilidades de recuperación y del grado de fragmentación postselección para así decidir, a priori, la mejor alternativa a ser utilizada el día del procedimiento asistido. A nivel terapéutico, en casos de altos niveles de fragmentación en semen (>30%) se propone separación magnética por columnas de anexina-V (MACS-magnetic-activated cell sorting). Este método se basa en que los espermatozoides dañados externalizarán en su membrana fosfatidilserina, la cual se une a microesferas metálicas cubiertas con anexina-V. Al pasar los espermatozoides por un campo magnético, se retienen los dañados, pasando libremente a través de la columna solo los no afectados26. La utilización de esta metodología junto a ICSI reporta aparentemente buenas posibilidades de embarazo27. Sin embargo, el efecto teratogénico del campo magnético no ha sido todavía completamente analizado, y su uso, aún hoy, resulta controvertido.
Por último, la posibilidad de congelar las muestras y procesarlas otorga una ventaja importante respecto al tiempo del operador, así como un aprovechamiento de los recursos por una reducción de reactivos al colectar las muestras y poder procesar varias el mismo día. Se observó que, independientemente de la muestra, el IF no se vio afectado por la congelación directa a –20°C. En conclusión, proponemos a la técnica de SCD como simple, estandarizable en laboratorios andrológicos, y que permite una relativamente sencilla incorporación al laboratorio de rutina.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEste estudio fue parcialmente financiado por la Universidad Nacional de Rosario, Argentina.
AutoríaLos autores son los únicos responsables por el contenido del texto y su preparación.
Conflicto de interesesLos autores reportan no tener ningún conflicto de intereses.