INTRODUCCIÓN
El tracto genital masculino y las vías urinarias comparten varios de sus principales componentes anatómicos, sistemas de inervación y mecanismos celulares y moleculares de regulación de su musculatura lisa. No es sorprendente que también coexistan sus enfermedades. Así, diversos trabajos recientes han demostrado asociaciones significativas entre el deterioro de la función eréctil y/o eyaculatoria, y la de síntomas del tracto urinario inferior (STUI) (tabla 1)1, también denominados con frecuencia con la abreviatura inglesa LUTS (lower urinary tract symptoms). Por otra parte, se comienza a documentar que el tratamiento de la disfunción eréctil (DE) con inhibidores de la fosfodiesterasa tipo 5 (iFDE5), en el que dichos fármacos muestran notables tasas de éxito, se puede acompañar de mejora de los STUI. Esto refuerza la noción de que existen mecanismos fisiopatológicos comunes a ambos tipos de problemas susceptibles de corrección con este tipo de fármacos. En este estudio se discuten los principales datos existentes que sustentan esta relación, sus posibles mecanismos fisiopatológicos y sus implicaciones terapéuticas.
ASOCIACIÓN DE TRASTORNOS DEL TRACTO URINARIO INFERIOR Y DE LA FUNCIÓN SEXUAL
La frecuente concurrencia en los mismos sujetos de STUI y trastornos de la función sexual masculina, en especial dificultades con la erección del pene y la eyaculación (ausencia, disminución de volumen o carácter doloroso de ésta) ha sido bien documentada por diversos estudios epidemiológicos que muestran asociaciones significativas entre ambos grupos de síntomas2-7. Además, se ha encontrado una buena relación cuantitativa entre éstos ("efecto dosis-respuesta": a mayor gravedad de los STUI peor la disfunción sexual)4,7-9. Muchos de estos estudios destacan la hipertrofia de la próstata (HPB) como principal correlato de la DE y/o trastornos eyaculatorios, indicada por una mayor asociación de la disfunción sexual con los síntomas urinarios de tipo "obstructivo" o "de vaciado". Otras investigaciones encuentran también asociaciones significativas de la existencia y la magnitud de la disfunción sexual masculina con los síntomas urinarios del tipo "irritativo" o "de llenado", lo que se ha documentado también en las mujeres (particularmente, incontinencia)10.
Se debe tener presente, sin embargo, que una asociación epidemiológica como la comentada, por fuerte que sea, no es prueba inequívoca de causalidad11,12. Ambos tipos de trastornos concurren con frecuencia en personas de edad avanzada, lo que hace plausible la hipótesis alternativa de que sean consecuencias de ésta, con su constelación de deterioros funcionales de varios sistemas y enfermedades asociadas que suele conllevar, aunque independientes entre sí2,3,7,11.
MECANISMOS FISIOPATOLÓGICOS
Se han propuesto diversos mecanismos que podrían explicar las referidas asociaciones entre ambos tipos de trastornos. Las dificultades frecuentes en la eyaculación, incluida su ausencia o disminución de volumen4 (probablemente por tratarse de eyaculaciones retrógradas, hacia la vejiga) o la sensación de dolor durante ésta13 podrían ser explicables en términos anatómicos por una hipertrofia prostática importante.
Sin embargo, la asociación de la DE con los STUI requiere de explicaciones más funcionales. Se ha invocado una variedad de mecanismos, no excluyentes, para una base fisiopatológica común; entre ellos: a) disminución de la producción de óxido nítrico (NO) en los órganos de la pelvis; b) sobreexpresión de vías bioquímicas sensibilizantes al calcio (facilitadoras de la actividad contráctil), como el sistema rho cinasa y/o endotelina; c) hiperactividad simpática; d) isquemia de los órganos de la pelvis; c) síndrome metabólico, etc.12,14. En este estudio se examinará el primero de ellos y el potencial de intervención terapéutica inmediatamente accesible que conlleva.
SISTEMA DE SEÑALIZACIÓN ÓXIDO NÍTRICO (NO)-GUANOSÍN MONOFOSFATO CÍCLICO (GMPC)-FDE5
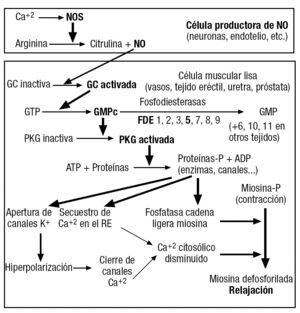
Se encuentra presente en la práctica totalidad de los diversos órganos y sistemas del cuerpo. El gas NO se forma a partir de la arginina, un aminoácido, por la acción de una familia de enzimas, las NO sintasas (NOS), de las que se conocen distintas isoformas presentes en diversa proporción en los diferentes tipos de células (fig. 1). Así, la neuronal (nNOS) se expresa en fibras nerviosas, generalmente del sistema parasimpático, donde se colocaliza con frecuencia con la acetilcolina y péptidos vasodilatadores, como el péptido intestinal vasoactivo (VIP); el NO así formado es, por tanto, un neurotransmisor. Una isoforma endotelial (eNOS) se encuentra fundamentalmente en los vasos sanguíneos, donde produce NO en respuesta a la distensión mecánica y a neurotransmisores, como la acetilcolina. Las isoformas nNOS y eNOS se expresan de modo permanente, por lo que se conocen como "constitutivas", aunque su cantidad puede variar en algunas circunstancias, incluyendo cambios en el medio hormonal y el envejecimiento. La activación de nNOS y eNOS requiere del complejo Ca+2-calmodulina, cuya concentración aumenta por entrada de Ca+2 al citosol producida como consecuencia de los potenciales de acción neuronales, que representarían, así, la señal reguladora de esta actividad enzimática en las fibras nerviosas o, en las células endoteliales, por su distorsión mecánica (shear stress) o por la activación de receptores muscarínicos de la acetilcolina. Hay una tercera isoforma, descrita inicialmente en macrófagos, cuya actividad no requiere de Ca+2-calmodulina, cuyos valores se regulan mediante el aumento de la síntesis de la proteína: es la isoforma "inducible" (iNOS), que generalmente se expresa en condiciones inflamatorias y puede contribuir a la fisiopatología de varios trastornos. El NO difunde fuera de las células productoras por un gradiente de concentración a medida que se va formando (no existe mecanismo para su almacenamiento).
Figura 1. Esquema del sistema de señalización NO-GMPc-FDE en la regulación de la actividad contráctil de las células musculares lisas de diversos órganos.
El NO penetra en las células donde, si éstas la expresan, encuentra y activa su principal diana molecular: la enzima guanilil ciclasa soluble (GCs), lo que pone en marcha una cascada de reacciones que se amplifican enzimáticamente. La GCs, tras su activación por el NO, cataliza la transformación del guanosín trifosfato (GTP) en guanosín monofosfato cíclico (GMPc), principal "mensajero intracelular" del NO. El GMPc activa al enzima proteincinasa G (PKG) que fosforila diversas proteínas enzimáticas y cambia su actividad. El efecto resultante depende de la especialización de la célula en que se produzca. En las células musculares lisas, determina su relajación (fig. 1). El efecto relajante del NO en el músculo liso (vascular, cavernoso o del tracto urinario, como ejemplos relevantes) se produce por diversas acciones de la PKG, como la apertura de canales de K+ con la consiguiente hiperpolarización, la disminución por varios mecanismos de los valores sde Ca+2 en el citosol y la activación de la fosfatasa de las cadenas ligeras de miosina, con lo que se incapacita esta proteína contráctil para su interacción con la actina, fenómeno básico de la contracción muscular; todo lo cual lleva a su inhibición (fig. 1).
Para que la señalización por el sistema NO/GMPc sea eficaz se requiere un mecanismo de eventual terminación de su acción. Está representado por un conjunto heterogéneo de enzimas que hidrolizan a los nucleótidos cíclicos como el GMPc y el adenosín monofosfato cíclico (AMPc), otro importante mensajero intracelular que media reacciones parecidas, aunque a través de proteincinasas diferentes. Se trata de las fosfodiesterasas (FDE), de las que se distinguen 11 familias con diversas características, incluida su especificidad de sustrato. Así, las FDE tipo 5, 6 y 9 son selectivas para el GMPc y las 4, 7 y 8, para el AMPc, mientras que las 1, 2, 3, 10 y 11 pueden inactivar ambos nucleótidos. La mayoría de los tejidos expresan varias de estas FDE, aunque en proporciones muy diferentes, según su especialización funcional. El grado de nucleótidos cíclicos dentro de una célula y, por ende, la magnitud de sus efectos dependen de la relación entre la tasa de su producción, en el caso que nos interesa por la GCs activada por el NO, y la de su inactivación por las correspondientes FDE. Por ello, la inhibición farmacológica de dichas enzimas hidrolíticas aumenta los valores del nucleótido cíclico, con lo que se amplifican sus efectos (para referencias véanse los trabajos de Francis y Corbin15 y Ückert et al16).
FUNCIONES DEL SISTEMA NO-GMPc-FDE5 EN EL TRACTO UROGENITAL
Órganos genitales
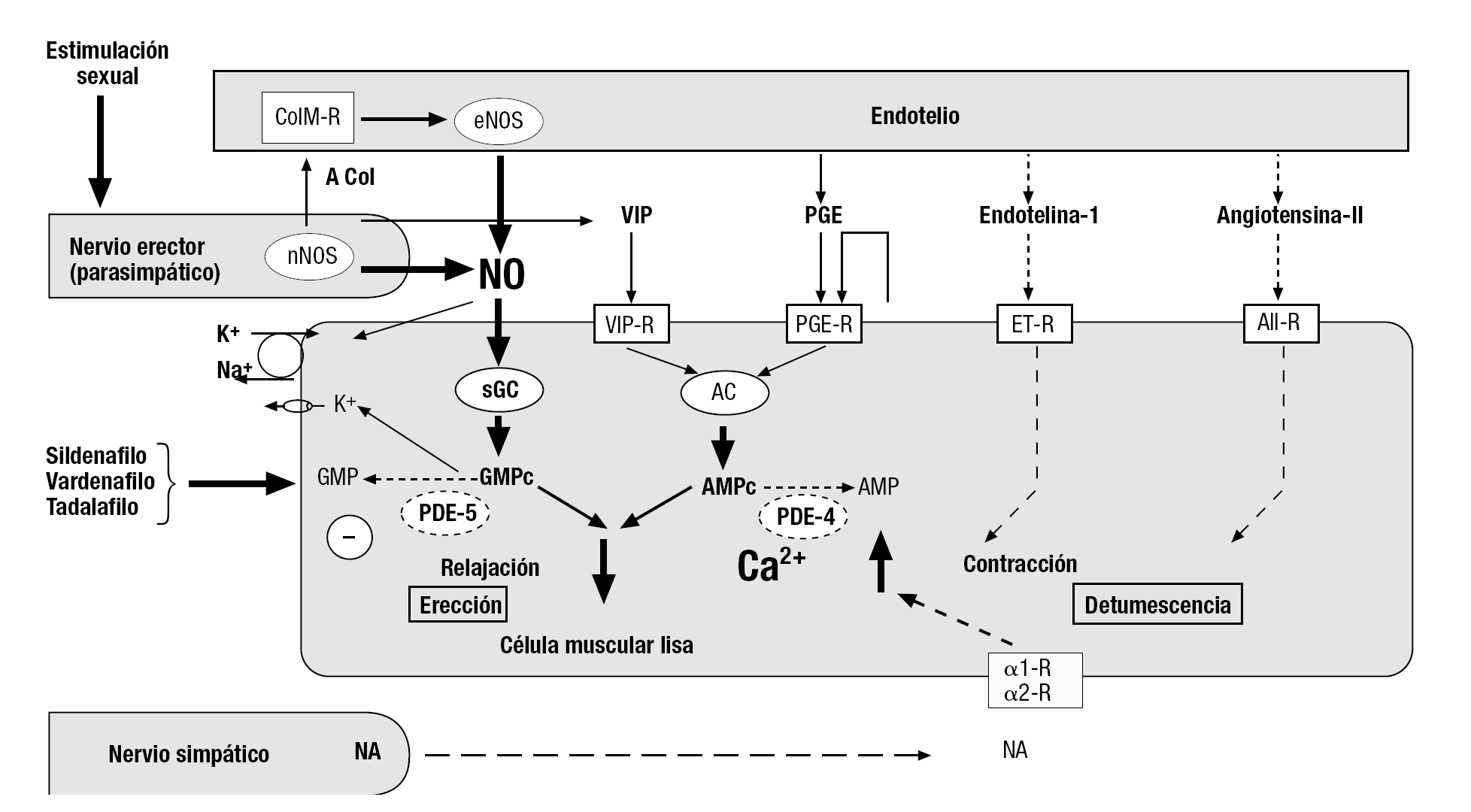
En la actualidad, se reconoce universalmente el papel crucial del NO como mensajero químico mediador de la erección del pene. Los mecanismos fisiológicos de este fenómeno y su regulación por el sistema NO-GMPc-FDE5 han sido objeto de numerosas descripciones pormenorizadas, por lo que aquí se resumen concisamente (para una revisión actualizada véanse los trabajos de Dean y Lue17 y Mas18). En el tejido eréctil de los cuerpos cavernosos y esponjoso se encuentran en cantidad importante las isoenzimas nNOS, localizadas en las terminaciones nerviosas de los nervios erectores, y eNOS, en el revestimiento endotelial de los vasos sanguíneos y sinusoides (fig. 2). Durante la excitación sexual, la descarga de las fibras parasimpáticos de los nervios cavernosos activa estas enzimas, y el aumento resultante de NO induce, en las células musculares lisas de las trabéculas y las arteriolas cavernosas, la formación de GMPc que, mediante los mecanismos descritos anteriormente, produce su relajación. Aumenta, así, considerablemente la entrada de sangre a los sinusoides y se produce la tumescencia del pene, lo que lleva a la compresión del plexo venoso subalbugíneo y las venas comunicantes y la subsiguiente rigidez. La acción vasorrelajante del GMPc en el pene se ve limitada por su hidrólisis por la FDE5, abundante en sus células musculares lisas. La inhibición de esta enzima mediante fármacos, como el sildenafilo, el tadalafilo o el vardenafilo, prolonga la vida del CMPc y potencia eficazmente la respuesta de erección (fig. 2).
Figura 2. Esquema de las principales señales inter e intracelulares que intervienen en el control de la actividad contráctil del músculo liso de los tejidos eréctiles del pene y, al parecer en gran medida, del clítoris. Parece que muchas señales, particularmente la vía relajante NO-GMPc y la constrictora noradrenérgica, operan de modo similar en las estructuras del tracto urinario. Las señales relajantes se indican con trazos continuos, y la señales constrictoras, con trazos discontinuos. El tamaño de los caracteres y el grosor de las flechas indica la importancia relativa aproximada de cada señal. Neurotransmisores: ACol: acetilcolina; NA: noradrenalina; NO: óxido nítrico; VIP: péptido intestinal vasoactivo. Los receptores se representan como rectángulos, por ejemplo: a1-R, a2-R: receptores adrenérgicos, AII-R: receptor de angiotensina-II, ColM-R: colinérgico muscarínico, etc. Las enzimas se representan como elipses. AC: adenilato ciclasa; eNOS: NO sintasa endotelial; nNOS: NO sintasa neuronal; PDE3: fosfodiesterasa tipo 3; PDE5: fosfodiesterasa tipo 5; sGC: guanilato ciclasa soluble. En la parte izquierda de la célula muscular, lisa se apuntan algunas acciones adicionales relevantes del NO y el CMPC, como son el aumento de la actividad de la bomba sodio-potasio y la apertura de canales de K+.
Hay pruebas de que un mecanismo similar contribuye sustancialmente a la tumescencia del clítoris y la vasocongestión de las paredes vaginales, determinante del aumento de lubricación vaginal, fenómenos ambos característicos de la reacción de excitación sexual femenina (para una revisión véase el trabajo de Mas19).
Se debe tener presente, sin embargo, que la regulación de la actividad de los tejidos eréctiles es compleja, y en ella participan, junto a la importante vía NO-GMPc-FDE5 antes discutida, varios sistemas de señalización inter e intracelular (fig. 2) y otros tipos de FDE. Así, en el cuerpo cavernoso humano se han detectado los ARN mensajeros (ARNm) de 13 isoenzimas de la FDE (tabla 2), lo que sugiere algún papel para todas ellas en la regulación de la erección peniana20.
Es de la mayor relevancia la actividad vasoconstrictora (antieréctil) de la inervación simpática, mediada esencialmente por receptores adenérgicos α1. Este tipo de receptor también abunda en regiones del tracto urinario inferior, como el cuello vesical y la próstata, que recibe, asimismo, una importante inervación simpática noradrenérgica. La activación por la noradrenalina de receptores a1 de los músculos lisos cavernoso y del tracto urinario inferior produce su contracción y resulta, respectivamente, en inhibición de la erección y estrechamiento de la vía urinaria.
Tracto urinario
Las enzimas del sistema de señalización NO-GMPc-FDE5 se expresan también en los distintos segmentos del tracto urinario humano, aunque con algunas importantes diferencias entre ellos (tabla 3). Así, se encuentra NOS en la inervación de todas las estructuras del tracto urinario, desde el uréter a la uretra, incluida la vejiga y la próstata21-27, donde también se expresa en el epitelio glandular25-27 (también se ha encontrado en fibras nerviosas y células glandulares de las vesículas seminales28). En la próstata, el NO parece intervenir en la regulación de la actividad contráctil, de la secreción glandular y probablemente la apoptosis25-27.
La distribución de la enzima diana del NO, la GC, es más variada. Expresan GC las células musculares lisas del uréter, la próstata y la uretra23,24, lo que es congruente con el efecto relajante que tiene el NO en la pared de estos órganos. Por el contrario, las células musculares lisas del detrusor no parecen contener GC. En la vejiga, esta enzima se localiza, fundamentalmente, además de en vasos sanguíneos, en las llamadas células intersticiales23, miofibroblastos considerados análogos a las células que describiera Cajal en el intestino con este nombre, a los que se atribuye una función de marcapasos y coordinación de la actividad contráctil y/o sensibilidad vesical al llenado29-31, funciones que, de ser así, estarían moduladas por el sistema NO-GMPc.
Por lo que respecta a las FDE, hay una gran coincidencia en la expresión de las diversas isoenzimas en el tracto urinario y los tejidos eréctiles genitales, y está particularmente bien representada la familia de la FDE5 (tabla 2)20,32,33. No obstante, hay también algunas diferencias; así, las FDE9A y 11A se expresan abundantemente en la próstata, pero no en el cuerpo cavernoso.
Va ganando creciente apoyo la hipótesis de que el sistema de señalización NO-GMPc-FDE5 se deteriora (por disminución de la expresión de nNOS y eNOS) con la edad avanzada, tanto en el pene como en la próstata y la uretra. Esto explicaría, en lo que respecta a la función del primero, la aparición de DE y, en la próstata, el aumento de su tamaño (por reducción de la apoptosis) y su tono contráctil (al faltar la acción relajante del NO). De ser así, el tratamiento de la DE con iFDE5 debería aliviar también los STUI, al menos los de tipo obstructivo, lo cual parece confirmarse en algunos estudios que se comentan posteriormente.
IMPLICACIONES TERAPÉUTICAS
Efectos sexuales del tratamiento de los STUI
En este estudio se considerarán solo, tanto por su elevada incidencia como por su relevancia, los STUI del varón relacionados con la HPB. El tratamiento médico de estos trastornos se orienta a 2 objetivos: a) relajar el músculo liso prostático y del tracto urinario inferior, en general, y b) disminuir el volumen prostático.
La relajación del músculo liso prostático y uretral se consigue eficazmente con los antagonistas α1 (tabla 4). Tras lo expuesto anteriormente, cabría esperar que el tratamiento con estos fármacos tuviese efectos facilitadores, o en todo caso no deletéreos, en la respuesta eréctil. Efectivamente, esta clase de agentes se ha utilizado como monoterapia (o, con mejores resultados, en combinación con otros tipos de fármacos) de la DE, y los antagonistas aα empleados para tratar los STUI no afectan negativamente la erección. Alguno de ellos (tamsulosina) puede producir, sin embargo, eyaculación retrógrada, particularmente si bloquean los receptores del cuello vesical (tabla 4), lo que impediría su cierre fisiológico durante la producción de este reflejo34-36.
La reducción del volumen de la próstata se logra eficazmente con el empleo de inhibidores de la enzima 5-α reductasa que, en el tejido prostático y otros, convierte la testosterona aportada por la circulación (T) en dihidrotestosterona (DHT), metabolito más potente que aquélla, al tener una mayor afinidad por el receptor androgénico. Sin embargo, mientras que la actividad de la 5-α reductasa parece esencial para el desarrollo y el crecimiento de la próstata en la edad madura, la cantidad de andrógenos necesaria para mantener la función y el apetito sexuales en el adulto es muy pequeña. Para su mantenimiento no es generalmente imprescindible la formación de DHT, y para ello bastan unos valores normales, o incluso algo reducidos, de T. Por ello, la incidencia de efectos sexuales adversos del tratamiento con los referidos inhibidores de la 5-α reductasa es más bien baja, aunque en individuos susceptibles puede producir disminución de la libido y de la erección (tabla 4)34-36.
Cuando la terapia farmacológica no basta para restaurar la operatividad de las vías urinarias ocluidas por una hipertrofia prostática importante, se recurre a la cirugía; el procedimiento más común es la resección transuretral (RTU). La función eréctil no suele afectarse negativamente por dicha intervención, e incluso en algunos pacientes mejora tras ésta. Sin embargo, sí es frecuente la eyaculación disminuida o retrógrada, como secuela34,37.
Posibles interacciones farmacológicas en el tratamiento de la DE y los STUI
La frecuente coexistencia de DE y STUI en los mismos sujetos hace muy probable que estos pacientes reciban simultáneamente prescripciones de fármacos para tratar cada uno de estos problemas. Ello plantea la posibilidad de que puedan producirse interacciones con efectos no deseados. Por ejemplo, es bien conocida la contraindicación estricta del uso simultáneo de iFDE5 y nitratos orgánicos (donantes de NO). Al actuar ambos tipos de fármacos facilitando la misma vía metabólica, aunque a distinto nivel, sus efectos se potencian (acción sinérgica), lo que puede traducirse en una hipotensión grave. En el caso de los antagonistas a1 empleados en el tratamiento de los STUI, si bien su acción produce, como los iFDE5, relajación de músculos lisos (prostático, cavernoso y en diverso grado el vascular), sus mecanismos de acción a escala celular son bien diferentes; es decir, cabría esperar de ellos efectos aditivos, pero no multiplicativos (o sinérgicos). De hecho, aunque se han documentado algunos casos de episodios de hipotensión con el empleo simultáneo de ambas clases de fármacos, éstos no han tenido la magnitud ni la gravedad de los ya referidos con nitratos. No obstante, las agencias reguladoras y los fabricantes han modificado los prospectos de los iFDE5 advirtiendo de cautelas relevantes que hay que tener en cuenta con el uso de estos fármacos (tabla 5).
Efecto en la función de las vías urinarias del tratamiento con iFDE5
En consonancia con el hallazgo de una importante expresión del sistema de señalización NO-GMPc-FDE5 en el tracto urinario descrito anteriormente, estudios in vitro con tejido prostático y uretral de animales (rata38 y perro26) y humanos21,26,38 han mostrado que tanto los donantes de NO21,26 como los iFDE538 relajan el músculo liso. Los iFDE5 inhiben también la proliferación celular del estroma prostática38. Para ambos efectos, parecen mostrar la misma relación de potencia que la mostrada en varios estudios en cuanto a relajación del músculo liso cavernoso (vardenafilo > sildenafilo > tadalafilo)38.
En el campo clínico, como se ha apuntado anteriormente, la DE se trata con éxito en un alto porcentaje de casos mediante los iFDE515,16. Algunos informes han documentado que el empleo de dichos fármacos "a demanda" en pacientes con DE puede resultar en una mejora de sus STUI39,40. Ello ha llevado a que se esté investigando en la actualidad su posible utilización reglada para tratar los STUI. Así, se ha comunicado que el tratamiento con sildenafilo a dosis diarias de 50-100 mg (tomado al ir a dormir o antes de la actividad sexual) durante 12 semanas a varones con DE y sintomatología prostática (IPSS > 12) mejoró sustancialmente ambos trastornos respecto al tratamiento con placebo41. Otro estudio similar con tadalafilo, a dosis de 5-20 mg, encontró igualmente una mejora de los STUI, aunque no se observaron efectos significativos en la flujometría urinaria (Qmáx)42.
Se ha explorado también la posibilidad de utilizar de modo pautado los iFDE5 con bloqueadores alfa (a pesar de los caveat señalados en el apartado anterior). Se han comparado los efectos en la DE y los STUI, en pacientes con ambos trastornos, del tratamiento durante 12 semanas con alfuzosina solamente (10 mg/día), sildenafilo solamente (25 mg/día) o la asociación de ambos. Los resultados mostraron una mejoría de los 2 trastornos (incluidos los hallazgos flujométricos) con los 3 tratamientos, aunque ésta fue mayor con la combinación del bloqueador alfa y el iFDE543. Aunque estos estudios son todavía preliminares (de hecho se han publicado por ahora sólo en forma de comunicaciones al Congreso de la American Urological Association, de 2006) sugieren una atractiva posibilidad de nuevos desarrollos terapéuticos.
Correspondencia:
Dr. M. Mas.
Facultad de Medicina.
Campus Ciencias de la Salud. 38071 La Laguna. Tenerife. España.
Correo electrónico: mmas@ull.es.