Evaluar los cambios de distribución del ácido siálico durante el proceso de capacitación y reacción acrosómica in vitro y estudiar las modificaciones morfométricas en estas condiciones fisiológicas en la región cefálica del espermatozoide humano.
Material y métodoEn este estudio prospectivo, evaluamos 6 muestras espermáticas normozoospérmicas. La distribución de ácido siálico se evaluó mediante la lectina Wheat germ agglutinin en diferentes condiciones fisiológicas: antes, después de la capacitación y tras la reacción acrosómica. La forma y el tamaño cefálico de cada estadio se estudiaron mediante métodos de morfometría geométrica.
ResultadosTras la capacitación, un 73,07±21,43% de espermatozoides presentaron ácido siálico en la región acrosomal en relación directa con una expansión del acrosoma y una contracción del segmento ecuatorial. Por otra parte, después de la reacción acrosómica se registra un mayor efecto alométrico entre los estadios debido a que los espermatozoides experimentaron una marcada expansión del segmento ecuatorial. En relación con la localización de Wheat germ agglutinin, encontramos una disminución significativa en el porcentaje de espermatozoides con fluorescencia en la región acrosomal, así como un incremento del marcaje en la banda ecuatorial.
ConclusionesNuestros resultados demuestran que la distribución de la lectina Wheat germ agglutinin covaría con importantes cambios en la morfometría de la cabeza del espermatozoide y evidencia importantes implicaciones en los procesos de capacitación y reacción acrosómica.
Assess changes in sialic acid distribution during capacitation and acrosome reaction processes, and evaluate head sperm morphometrics modifications in these physiological conditions in human sperm.
Material and methodIn this prospective study, we included 6 normozoospermics sperm samples. Sialic acid distribution was evaluated by Wheat germ agglutinin lectin in different physiological conditions: before, after capacitation and after acrosome reaction. Head shape and size of each stage were analyzed by means of geometric morphometric methods.
ResultsAfter capacitation, 73.07±21.43% of sperm showed sialic acid in acrosomal region, linked with an acrosome expansion and equatorial segment contraction. Otherwise, after acrosome reaction higher allometric effect between stages was recorded since sperm undergo further expansion of equatorial segment. Regarding Wheat germ agglutinin location, we found that sperm percentage significant decline in acrosomal fluorescence and an increase of equatorial band labeling.
ConclusionsOur findings demonstrate that modifications in Wheat germ agglutinin expression covariate with dramatic changes in sperm head morphometry, suggesting important implications in capacitation and acrosome reaction processes.
Las células espermáticas presentan una gran diversidad morfométrica debido a la evolución y a las presiones selectivas que actúan sobre la competencia espermática1. Su particular organización estructural en la especie humana resulta de cambios morfogenéticos complejos que se producen en los testículos durante la espermiogénesis. Una vez que los espermatozoides han abandonado los testículos, la fecundación dependerá de la capacidad para adquirir su funcionalidad en el tracto genital femenino. Este proceso de capacitación2 se encuentra asociado a una serie de factores secundarios, como la pérdida de colesterol, una reorganización de los glicoconjugados, un aumento de proteínas fosforiladas y la hiperactivación3. Además, durante la inducción de la reacción acrosómica, el espermatozoide libera enzimas hidrolíticas, permitiendo su paso a través de las cubiertas del óvulo4.
Existen numerosos estudios que demuestran la importancia de los hidratos de carbono en el reconocimiento y la unión espermatozoide-zona pelúcida en diferentes especies de mamíferos, incluida la humana5. Presentan, además, un papel destacado en otras funciones vinculadas a la inhibición de la capacitación prematura6, el paso a través del moco cervical7, la protección contra la inmunidad innata y adaptativa de la mujer8 o la formación del reservorio espermático9. De este modo, para culminar con éxito la fecundación, los espermatozoides deben permanecer íntegros en su estructura y funcionalmente activos durante el recorrido por el tracto genital femenino.
Dada su habilidad para unirse a hidratos de carbono específicos, el estudio del glicocáliz se vincula a la aplicación de lectinas10. En concreto, la Wheat germ agglutinin (WGA) ha sido comúnmente empleada debido a su afinidad por la N-acetilglucosamina –GlcNAc– y el ácido siálico –NeuNAc–11 de la membrana plasmática. Sin embargo, esta afinidad denota ser altamente superior hacia el ácido siálico12, cuya deficiencia se ha relacionado como posible causa subyacente de infertilidad masculina en individuos oligospérmicos13.
Las presiones selectivas influyen en el fenotipo del espermatozoide de una manera plástica14 y su variabilidad morfométrica se asocia al modo de fecundación y a la selección sexual15. No obstante, la población espermática de la especie humana, a diferencia de la mayoría de las especies de mamíferos, presenta una extrema variabilidad morfológica16, probablemente producida durante la espermiogénesis y a través de efectos pleiotrópicos poco conocidos. Esta elevada variación morfológica, junto con la utilización de técnicas de análisis subjetivas que dependen de la experiencia del observador, del método de tinción, así como del número de células evaluadas, limita la obtención de resultados contundentes y de carácter predictivo en el proceso reproductivo17. Adicionalmente, en la especie bovina se han observado cambios morfológicos en el espermatozoide a nivel cefálico durante la capacitación y tras la reacción acrosómica18. Otros estudios en roedores describen el efecto de la expresión de protaminas del mismo modo en la morfometría celular19.
El ácido siálico es el monosacárido más abundante en el extremo terminal de los glicoconjugados20, posición que le confiere una relevancia destacada durante el proceso de fecundación. Además, su localización está asociada con la morfología del espermatozoide humano21. Sin embargo, la distribución detallada de sus patrones y su relación con la morfometría durante la capacitación y tras la reacción acrosómica no es conocida. En este trabajo, evaluamos por primera vez la influencia de los cambios de distribución del ácido siálico en la variación morfométrica de la región cefálica durante el proceso de capacitación y reacción acrosómica. Este estudio tiene como finalidad identificar nuevos biomarcadores espermáticos indicadores del estado fisiológico y la capacidad fecundante del espermatozoide humano.
Material y métodosEste estudio se llevó a cabo en el Laboratorio de Reproducción del Departamento de Biotecnología de la Universidad de Alicante en el periodo de tiempo comprendido entre abril y diciembre del 2015.
Tratamiento de las muestras espermáticasLas muestras espermáticas se obtuvieron bajo consentimiento informado de 6 donantes mediante masturbación con un tiempo de abstinencia sexual de entre 3 y 5 días. Antes del transcurso de 1h se les realizó un seminograma básico y se incluyeron las muestras clasificadas como normozoospérmicas con base en criterios previos establecidos16. Posteriormente, las muestras se dividieron en 2 alícuotas para ser estudiadas antes y después de la capacitación in vitro.
Capacitación in vitroEl plasma seminal fue eliminado centrifugando la muestra durante 10min a 250g y, seguidamente, se le realizó un lavado con medio fluido tubárico humano (Origio) durante 5min a 250g. La capacitación de la muestra se llevó a cabo mediante la técnica de swim-up a 1h utilizando el medio fluido tubárico humano suplementado con 5mg/ml de albúmina de suero bovino (BSA) a 37°C y 5% CO2. Los resultados de movilidad obtenidos fueron≥95% en todas las muestras. Tras la capacitación, la mitad de la muestra fue destinada a fijación y la otra para la inducción de la reacción acrosómica.
Reacción acrosómicaLa inducción de la reacción acrosómica tuvo lugar mediante la adición de 10μM de ionóforo de calcio A23187 (Sigma) y 220mM de cloruro de calcio durante 1h a 37°C y 5% CO2, tomando como referencia protocolos previos22. A la muestra control únicamente se le añadió cloruro de calcio. Tras la inducción de la reacción acrosómica se verificó la viabilidad de la muestra mediante la tinción eosina-nigrosina, siendo este porcentaje>95% en todas las muestras.
FijaciónLas muestras antes y después de la capacitación, así como tras la reacción acrosómica fueron fijadas en paraformaldehído al 2% durante 1h a 4°C. Finalmente, se resuspendieron para lograr una concentración final de 1mill/ml y se conservaron a 4°C.
Técnicas de inmunofluorescenciaIntegridad del acrosomaPara la evaluación de la reacción acrosómica, las células previamente fijadas se incubaron con la lectina Pisum sativum agglutinin (PSA) conjugada con isotiocianato de fluoresceína (Vector Laboratories) a una concentración de 50μg/ml durante 30min en oscuridad. Tras 3 lavados con PBS, se utilizó el medio de montaje VectaShield con DAPI para su evaluación en el microscopio de fluorescencia (Leica DMRB). Aquellos espermatozoides que mostraron fluorescencia en el acrosoma fueron considerados como no reaccionados y los que presentaron marcaje en la banda ecuatorial, como reaccionados.
Fosforilación de tirosinaCon el objetivo de comprobar el estado de la capacitación, las células previamente fijadas se incubaron con el anticuerpo primario monoclonal antifosfotirosina (Sigma) 1:500 durante 1h, seguido de 3 lavados en PBS durante 5min. A continuación, se añadió el anticuerpo secundario policlonal anti-IgG de ratón conjugado con Alexa Fluor 488 (Jackson ImmunoResearch) 1:300 durante 1h en oscuridad y se procedió a su lavado 3 veces en PBS durante 5min. Finalmente, se utilizó el medio de montaje VectaShield combinado con DAPI y el resultado fue examinado mediante microscopia de fluorescencia (Leica DMRB). La presencia de tirosina fosforilada fue evaluada a nivel del flagelo.
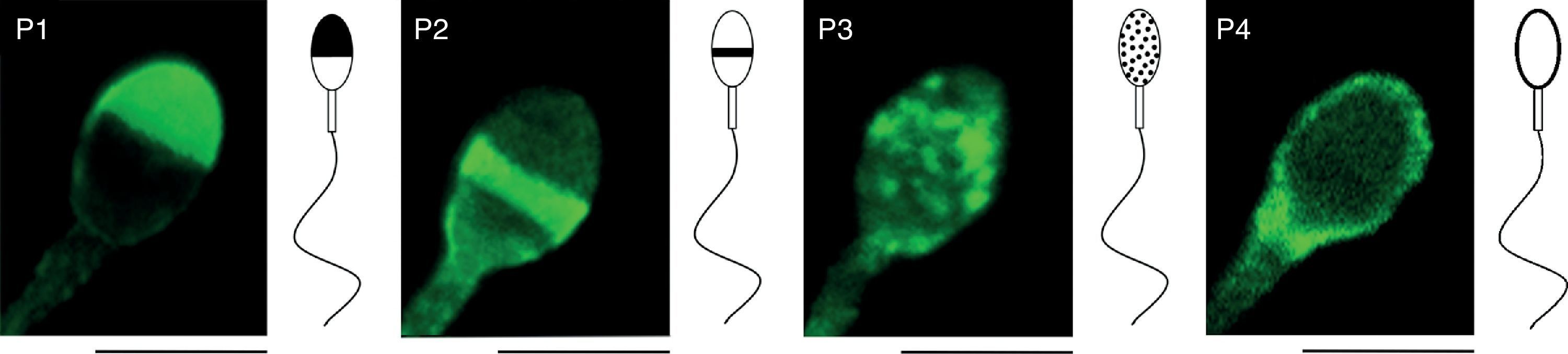
Inmunolocalización de Wheat germ agglutininLas muestras previamente fijadas se depositaron en cubreobjetos y, una vez secas, se incubaron con la solución de bloqueo de suero bovino fetal al 2% durante 30min. A continuación, se procedió al marcaje con la lectina WGA conjugada con isotiocianato de fluoresceína (Vector Laboratories) a una concentración de 20μg/ml durante 1h a temperatura ambiente en oscuridad y se realizaron 3 lavados en PBS. Para el montaje se utilizó VectaShield combinado con DAPI y el resultado se evaluó mediante microscopia de fluorescencia (Leica DMRB). Se caracterizaron aquellos patrones de marcaje presentes como mínimo en un 5% de la población espermática en función de modelos previamente establecidos23. En todos los experimentos fueron evaluados un mínimo de 200 espermatozoides.
Análisis morfométricoObtención de micrografíasEl análisis morfométrico del espermatozoide se realizó a partir de micrografías obtenidas por microscopia electrónica de barrido con una magnificación estandarizada de ×10.000 aumentos y a partir de nuevas técnicas de morfometría geométrica (MG)14,19, extrayendo la forma y el tamaño como variables independientes. La MG es una técnica de análisis definida como la unión entre la biología y la geometría24. En lugar de enfocarse en el análisis multivariante de un conjunto de medidas lineales entre puntos morfométricos, la MG analiza los cambios en la conformación de un objeto a partir del desplazamiento en el plano (2D) o en el espacio (3D) de un conjunto de landmarks.
Registro de forma y tamaño celularEl registro de la forma y el tamaño del espermatozoide a partir de técnicas de MG24 se llevó a cabo en 334 células de 6 donantes agrupadas en 3 condiciones fisiológicas, correspondientes a no capacitado (n=148), capacitado (n=109) y reaccionado (n=77). Por cada donante se analizó un número similar>50 células. Las micrografías (1.024×756TIFF) fueron procesadas en MakeFan6 para disponer 30 radios equiangulares de contorno con respecto al punto central de cada célula, delimitado por el acrosoma y punto de intersección con la pieza intermedia. Para el análisis de la variación morfométrica se identificaron 4 puntos anatómicos homólogos o landmarks, definidos por los límites del segmento ecuatorial y el que separa la cabeza de la pieza intermedia. El resto de las 26 coordenadas fueron consideradas como semi-landmarks14,25. Cada coordenada fue registrada y escalada a 1μm con tpsDIG2. Para el conjunto de células, las coordenadas se superpusieron por medio de un análisis de Procrustes generalizado considerando el deslizamiento de semi-landmarks por minimización de distancia de Procrustes24. El algoritmo del análisis de Procrustes generalizado permite minimizar la rotación, la traslación y el escalamiento de las configuraciones de coordenadas registradas, extrayendo los parámetros de forma y tamaño (centroid size [CS])24.
Análisis estadísticoLa variación en los patrones a nivel intra e interestadio fue analizada estadísticamente mediante t-test. La dependencia entre forma y tamaño se calculó por medio de una regresión multivariante de las coordenadas Procrustes y el logCS. La variabilidad morfométrica para las 3 subpoblaciones de células fue analizada a partir de los residuos derivados de un análisis de componentes principales26. El análisis de MG y estadístico univariante (ANOVA y HSD Tukey) se realizó con MorphoJ y PAST 3.0. En todos los casos el nivel de significación estadística fue α=0,05.
ResultadosValoración de la reacción acrosómica mediante Pisum sativum agglutininDespués de la inducción de la reacción acrosómica un 82,00±8,85% de los espermatozoides se encontraban reaccionados, frente al 17,50±5,25% registrado en los controles.
Valoración de la fosforilación de tirosina mediante anticuerpo primario monoclonal antifosfotirosinaEl porcentaje promedio de espermatozoides que mostraron fosforilación de tirosina a nivel del flagelo antes de la capacitación fue de 3,64±2,33%. Tras la capacitación (23,45±8,41%) y la inducción acrosómica (17,64±7,43%), este valor aumentó de forma significativa (p<0,001).
Distribución de Wheat germ agglutininLa fluorescencia de la WGA fue evaluada a partir del registro de 4 patrones definidos como región acrosomal (P1), segmento ecuatorial (P2), región cefálica punteada (P3) y contorno de la membrana plasmática a nivel cefálico (P4) (fig. 1). El porcentaje de patrones (media±σ) de la lectina WGA (tabla 1) muestra como el porcentaje de P1 no sufre cambios significativos tras la capacitación, pasando de un 60,15±12,45% a un 73,08±21,43%. Sin embargo, después de la inducción de la reacción acrosómica disminuye significativamente (p<0,05) hasta un 36,92±13,62%. El P2 antes de la capacitación presentó un 6,69±8,00%, en capacitado un 4,85±6,67% y tras la inducción de la reacción acrosómica aumentó significativamente (p<0,05) hasta el 29,00±20,52%. En cuanto al P3 y al P4, sus valores no mostraron diferencias estadísticamente significativas entre los diferentes estadios. De este modo, el P3 presentó un 24,00±8,18% en fresco, un 15,84±13,50% en capacitado y un 22,69±11,93% tras la reacción acrosómica. Por su parte, el P4 mostró en fresco un 9,15±9,55%, en capacitado un 6,23±8,88% y un 11,38±5,39% en reaccionado.
Expresión de los patrones de WGA en las diferentes condiciones fisiológicas
| P1 | P2 | P3 | P4 | |
|---|---|---|---|---|
| No capacitado | 60,15±12,45 | 6,69±8,00 | 24,00±8,18 | 9,15±9,55 |
| Capacitado | 73,08±21,43 | 4,85±6,67 | 15,84±13,50 | 6,23±8,88 |
| Reaccionado | 36,92±13,62a | 29,00±20,52a | 22,69±11,93 | 11,38±5,39 |
Los valores se muestran como media±σ (%) para cada patrón (P1-4).
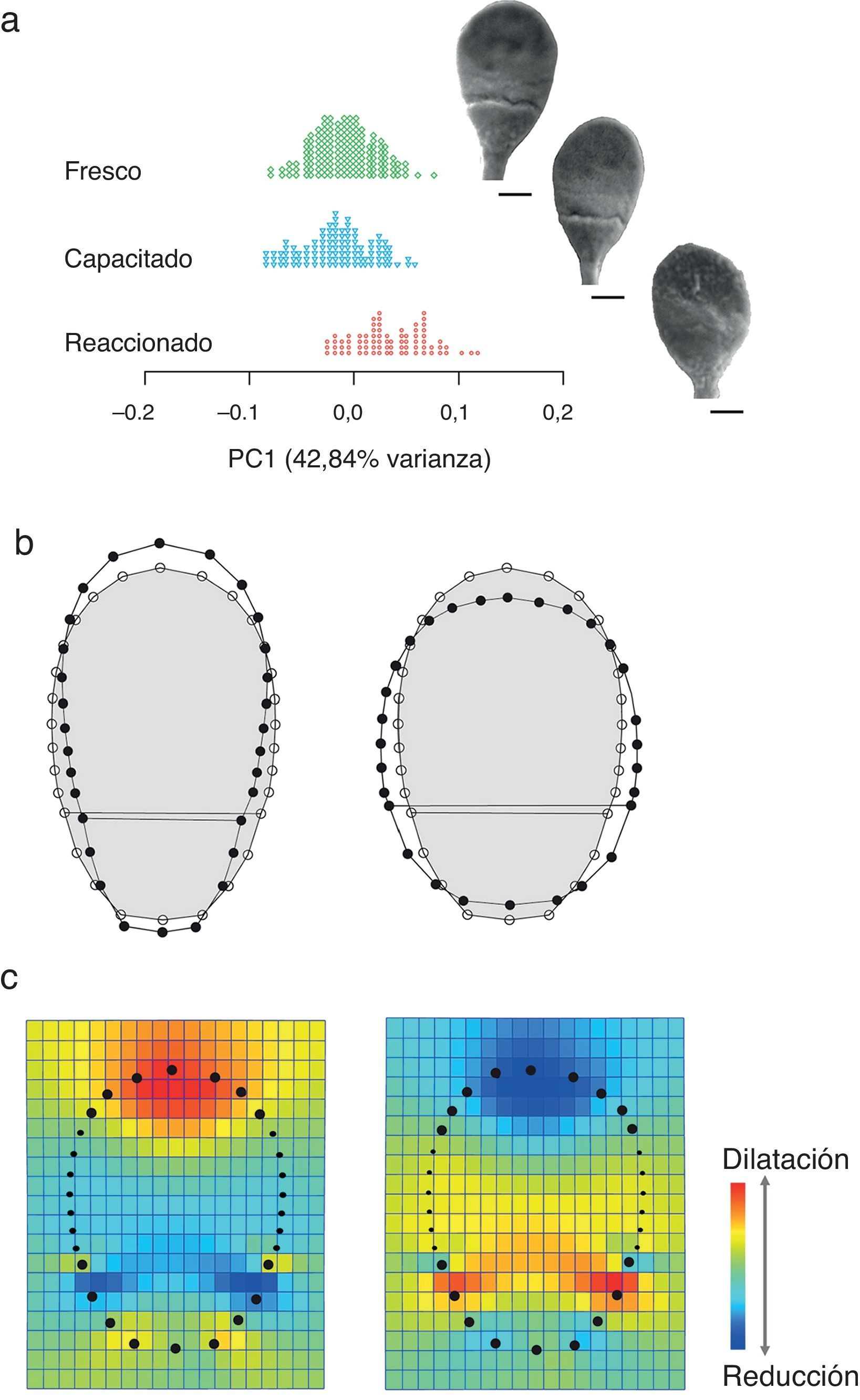
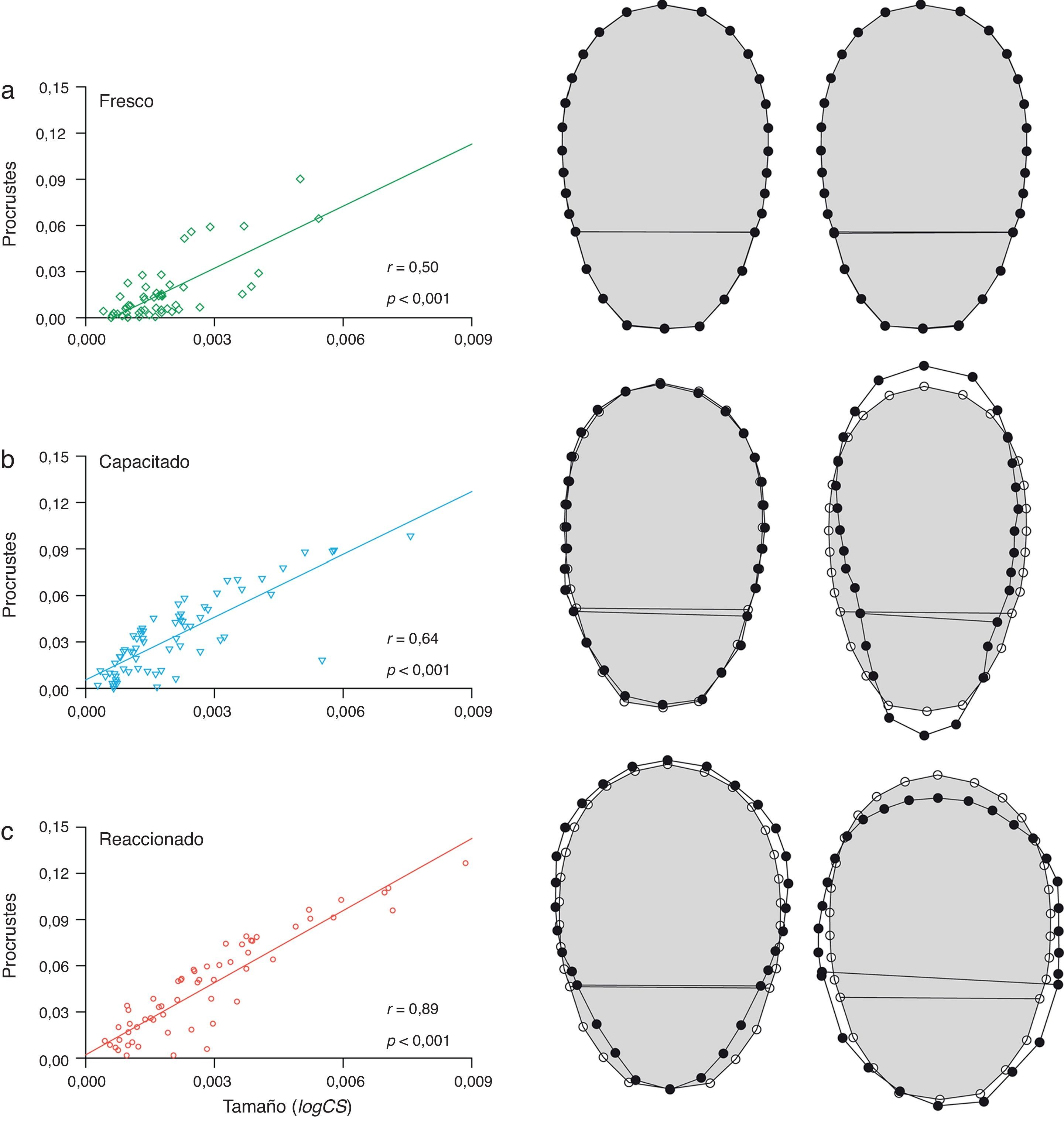
Los 3 primeros componentes principales (CP1-3) extraídos del análisis multivariante morfométrico explican un 72,20% de variabilidad de la varianza. La varianza registrada a partir del CP4 es<5%. Únicamente el CP1 (42,84% de la varianza) presenta diferencias significativas entre las poblaciones espermáticas (ANOVA: F2, 331=49,735; p<0,001) (fig. 2a) y permite discriminar la forma celular entre grupos. Con respecto al fresco, los capacitados expresan una dilatación del acrosoma y una reducción de la anchura del segmento ecuatorial que confieren cambios en sus respectivas conformaciones (HSD Tukey; p=0,009) (fig. 2b-c). No obstante, existen diferencias mayores entre la morfometría de la población de espermatozoides reaccionados con respecto a aquellos frescos y capacitados (HSD Tukey; p<0,001). Durante la reacción acrosómica, el cambio morfométrico expresa una dilatación del segmento ecuatorial, confiriendo una reducción proporcional del acrosoma (fig. 2c). Por otro lado, las diferencias en tamaño (CS) entre poblaciones (ANOVA: F2, 331=16,976; p<0,001) se derivan de la heterogeneidad celular. El análisis alométrico indica que existe a nivel intrapoblación un cambio de configuración en la morfometría celular (matriz Procrusters) con respecto al CS (r Pearson≥0,5; p<0,001) (fig. 3). No obstante, el porcentaje de predicción para el espermatozoide reaccionado (33,22%) es mayor que para el capacitado (14,70%) y fresco (4,10%).
Variación de la morfometría del espermatozoide. (a) Distribución de los casos en el primer componente principal (CP1) de forma. Micrografías por microscopia electrónica de barrido ×10.000 de los tipos fresco, capacitado y reaccionado; escala 1μm en todos los casos. (b) Cambios de forma (wireframes) en los extremos negativo y positivo con respecto al consenso (gris). Nótese el cambio de conformación (mapas de deformación) en el espermatozoide reaccionado que afecta a la reducción del acrosoma y dilatación del segmento ecuatorial (c).
Relación forma-tamaño entre poblaciones de espermatozoides frescos (a), capacitados (b) y reaccionados (c). La forma (matriz de Procrustes) muestra una covariación positiva y significativa (p<0,001) con el tamaño (logCS). Los cambios de forma (wireframes) representan los casos extremos (negro) en relación con el consenso (gris). La alometría expresa un mayor cambio de conformación en capacitados (14%) y reaccionados (33%) y evidencia que la variabilidad en frescos (4%) es menor.
Nuestros resultados muestran que la capacitación in vitro aumenta significativamente el porcentaje de espermatozoides que presentan fosforilación de tirosina a nivel del flagelo. Estos datos concuerdan con estudios previos que confirman la presencia de tirosina fosforilada en el flagelo del espermatozoide y su marcada relación con la hiperactivación de la motilidad durante el proceso de capacitación27.
Las lectinas, dada su habilidad para unirse específicamente a hidratos de carbono, permiten registrar la distribución de las glicoproteínas presentes en la membrana plasmática del espermatozoide10. Su empleo revela los múltiples cambios que afectan a la distribución de glicoconjugados durante la maduración epididimaria, así como en la capacitación y tras la reacción acrosómica23,28. En concreto, la lectina PSA que se une a residuos de manosa presentes en la vesícula acrosomal es un marcador del estado del acrosoma de los espermatozoides29. El porcentaje de espermatozoides reaccionados tras la inducción de la reacción acrosómica mediante ionóforo de calcio A23187 y valorado mediante la lectina PSA confirma que el 82,00% de los espermatozoides evaluados en este grupo habían desencadenado la reacción acrosómica. Sin embargo, en el grupo control este porcentaje fue significativamente menor (17,50%), resultados que concuerdan con trabajos previos29.
La morfología del gameto masculino puede ser un claro indicador de la capacidad fecundante de los espermatozoides30. No obstante, una definición óptima de su morfología no implica necesariamente la correcta funcionalidad, muchas veces ligada a la incapacidad de unión del espermatozoide, bien con la zona pelúcida31, bien con el oolema32, del ovocito. En este contexto, la relación entre la distribución de los glicoconjugados de membrana plasmática y la morfometría del espermatozoide humano no ha sido hasta ahora analizada en detalle.
El empleo de técnicas de MG permite establecer con precisión los cambios estructurales del espermatozoide y su relación con la distribución de los glicoconjugados a lo largo del proceso de capacitación y reacción acrosómica. El registro morfométrico de los espermatozoides analizados en nuestro estudio, tras la capacitación, muestra un proceso de dilatación acrosomal y una reducción en anchura del segmento ecuatorial. Por lo tanto, a partir del modelo establecido y propuesto en la figura 3, es posible registrar una evidente plasticidad estructural que se asocia con los cambios moleculares que acontecen durante la capacitación. Entre ellos, la pérdida de colesterol, que le otorga un mayor grado de fluidez a la membrana, permitiendo la redistribución de dominios lipídicos y proteicos que van a favorecer finalmente el proceso de fecundación3. Además, tras la capacitación observamos un aumento en el porcentaje de espermatozoides, en los que la presencia del ácido siálico se localizó en la región acrosomal, con respecto a los espermatozoides nativos. Aunque no se encontraron diferencias significativas entre ambas poblaciones, esta relocalización está en concordancia con otros estudios en los que se evidenció la importancia de la redistribución del ácido siálico durante el proceso de capacitación33, así como la relación de un elevado porcentaje de expresión del ácido siálico en el acrosoma de espermatozoides capacitados con mejores tasas de reproducción in vitro34.
Por otro lado, tras la reacción acrosómica, el registro morfométrico en este estudio revela que en el espermatozoide humano se produce una disminución del acrosoma y una dilatación del segmento ecuatorial, como se ilustra en la figura 3. La disminución del acrosoma está asociada a la descrita exocitosis del contenido de la vesícula acrosómica3. Sin embargo, la dilatación del segmento ecuatorial podría estar relacionada con la incorporación de parte del contenido acrosomal necesario para continuar con el proceso de penetración espermática20. Este cambio morfométrico, con base en la forma y al tamaño, del segmento ecuatorial en el espermatozoide humano tras la inducción de la reacción acrosómica se detalla por primera vez en este trabajo. La pérdida de la membrana plasmática también se corrobora con la relocalización de la WGA, disminuyendo significativamente la presencia del ácido siálico a nivel del acrosoma y aumentando en la región del segmento ecuatorial. Esto está en concordancia con trabajos recientes en los que se observó la presencia de ácido siálico en el sobrenadante tras la capacitación espermática35. Además, la ausencia del ácido siálico tras la reacción acrosómica sería un marcador de la pérdida de la membrana acrosomal externa, la cual permite desenmascarar moléculas presentes en la membrana interna implicadas en el reconocimiento de la zona pelúcida12,28.
Por lo tanto, este trabajo demuestra que el estudio simultáneo de diferentes biomarcadores espermáticos y la aplicación de nuevas herramientas morfométricas permiten definir de forma precisa los cambios celulares y moleculares que experimenta el espermatozoide durante el proceso de capacitación y reacción acrosómica. Este modelo de análisis establece una herramienta de mejora de los métodos de selección espermática, permitiendo desarrollar avances en los tratamientos de reproducción asistida.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEste trabajo ha sido subvencionado por la Cátedra Human Fertility de la Universidad de Alicante y el proyecto del Ministerio de Economía y Competitividad AGL2015-70159-P.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.