INTRODUCCIÓN
En una secuencia definida, el espermatozoide experimenta varias etapas de maduración antes de adquirir la capacidad de fecundar al ovocito1. La maduración epididimaria es la primera etapa de esta secuencia, seguida por lo que se conoce como capacitación, que ocurre de forma concomitante con la hiperactivación. El espermatozoide se considera capacitado cuando está apto para experimentar la reacción del acrosoma (RA).
La maduración epididimaria del espermatozoide está relacionada con la activación de la cascada de fosforilación de tirosina inducida por adenosina monofosfato cíclico (AMPc), cascada que recientemente se ha asociado con la expresión de funciones espermáticas dependientes del proceso de capacitación, como el movimiento hiperactivado y la exocitosis acrosomal2. Los espermatozoides presentes en el semen han sufrido el proceso de maduración mencionado anteriormente, son motiles y se encuentran condicionados por los componentes del fluido seminal, sin embargo, aún no son capaces de fecundar3.
Durante su migración por el tracto genital femenino, o durante períodos de incubación in vitro en medios de cultivo adecuados, los espermatozoides experimentan una serie de cambios bioquímicos y biofísicos, llamados en conjunto capacitación, que les preparan para la RA y, en consecuencia, para fecundar al ovocito3,4.
¿QUÉ ES LA REACCIÓN DEL ACROSOMA?
El acrosoma es un organelo con forma de capucha, ubicado en la región apical del espermatozoide, sobre el segmento anterior del núcleo, cuyo contenido incluye una mezcla única de enzimas, tales como acrosina y otras enzimas presentes en el lisosoma, peroxisoma e incluso en el citoplasma5-10. Cada espermatozoide está dotado de un único acrosoma, cuya forma y tamaño varía ampliamente entre las especies10. La formación de este organelo, a partir del aparato de Golgi, es un proceso altamente sincronizado y bastante lento en comparación con la biogénesis de otras vesículas secretoras y, en mamíferos, está asociada con la diferenciación de espermátidas durante la espermatogénesis8. Generalmente, se acepta que la formación del acrosoma comienza con la espermatogénesis, pero en humanos, monos rhesus y ratones, la síntesis de muchas enzimas específicas del acrosoma, como proacrosina y acrogranina, comienza cuando el espermatocito se encuentra en paquiteno8.
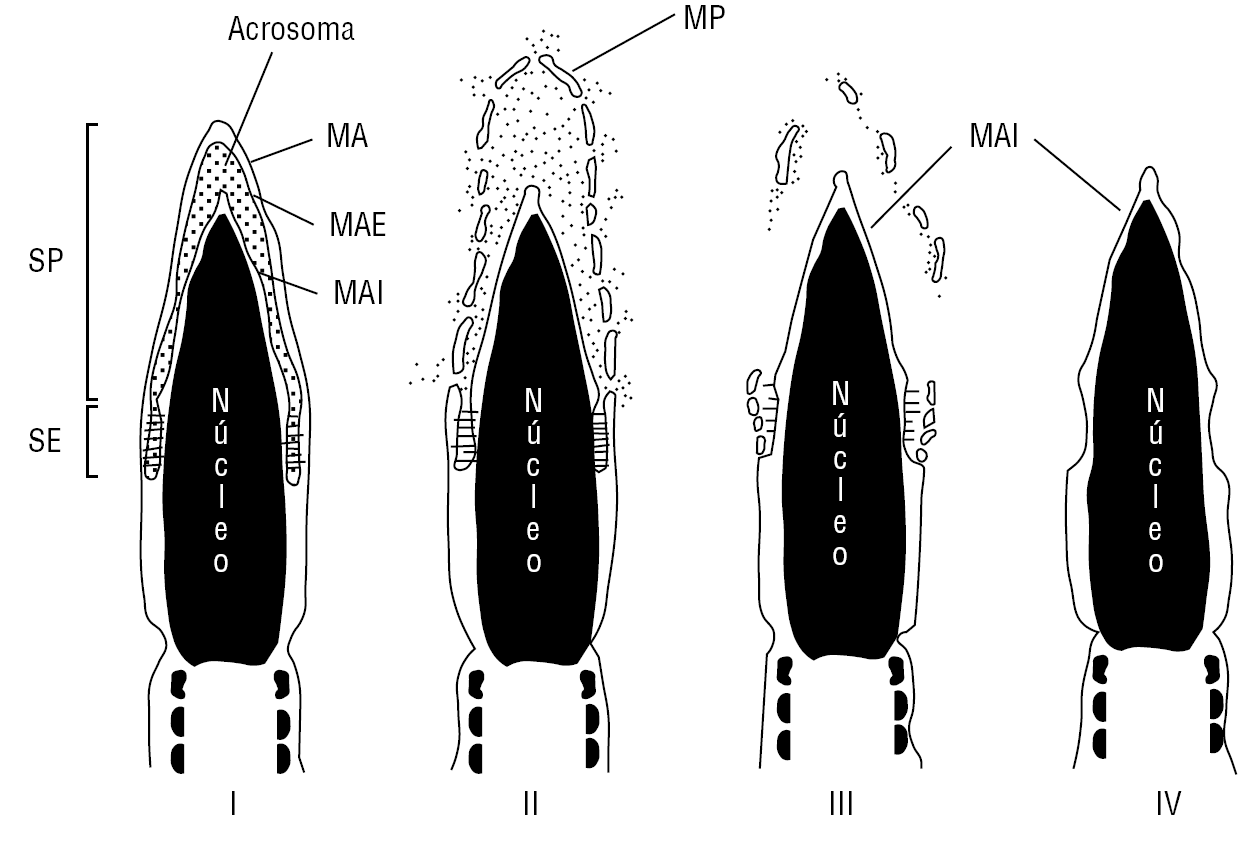
La RA es un evento exocítico, que involucra generalmente la fusión y fenestración de la membrana plasmática con la membrana acrosomal externa del segmento principal del acrosoma. Con posterioridad a la reacción del segmento principal del acrosoma, el segmento ecuatorial puede reaccionar11. La RA en el segmento ecuatorial también involucra la fusión de la membrana plasmática con la membrana acrosómica externa. Este proceso se puede producir durante el contacto del espermatozoide con la matriz extracelular del ovocito o con la zona pelúcida9,12 y desencadena una serie de eventos como: a) liberación de las enzimas acrosomales que favorecen el paso a través de la zona pelúcida11; b) exposición de la membrana acrosomal interna como el nuevo dominio de membrana en la superficie celular9,11,13; c) adquisición en el caso de la reacción del segmento principal del acrosoma, de la capacidad fusogénica de la membrana plasmática sobre el segmento ecuatorial del espermatozoide. En el caso de la RA del segmento ecuatorial se ha demostrado que la membrana plasmática postecuatorial adquiere la capacidad fusogénica1,9. Sólo la membrana plasmática de espermatozoides que han experimentado la RA es capaz de fusionarse con la membrana plasmática del ovocito (fig. 1).
Figura 1. Reacción del acrosoma en el espermatozoide humano. I. Espermatozoide con el acrosoma intacto (no reaccionado). II. Reacción del segmento principal (SP) del acrosoma: fusión de la membrana acrosomal externa (MAE) y la membrana plasmática (MP) en el segmento principal del acrosoma. III. Reacción acrosómica en el segmento ecuatorial (SE). IV. Espermatozoide con reacción acrosómica del segmento principal y ecuatorial. La membrana acrosómica interna se continúa con la membrana plasmática del segmento postecuatorial.
REQUERIMIENTOS PARA LA REACCIÓN DEL ACROSOMA
Capacitación e hiperactivación
Para poder fecundar al ovocito, el espermatozoide debe experimentar una fase final de desarrollo posteyaculación llamada capacitación14. Este proceso consiste en una serie de modificaciones, entre las que se encuentran4: aumento en la fluidez de la membrana; disminución del contenido de colesterol plasmático15; aumento en la concentración de calcio intracelular y de AMPc16,17; fosforilación de residuos de tirosinas en proteínas flagelares, y cambio en los patrones de movimiento y motilidad quimiotáctil del espermatozoide. Los cambios mencionados anteriormente parecen estar compartimentalizados; por ejemplo, la fosforilación de proteínas ocurre principalmente en el flagelo y conduce a cambios en el patrón de motilidad espermática. Estas modificaciones en la motilidad, que constituyen el proceso de hiperactivación, se traducen en un aumento en el desplazamiento lateral de la cabeza del espermatozoide y el cambio desde un movimiento rectilíneo, que predomina en espermatozoides maduros no capacitados, a uno curvilíneo. De esta manera, el espermatozoide adquiere un movimiento asimétrico y amplio del flagelo, que lo llevará a moverse en círculos para liberarse de las criptas oviductales, avanzar y alcanzar el ámpula, donde ocurrirá la fecundación.
Los mecanismos moleculares involucrados en las funciones espermáticas no se han dilucidado con claridad. Sin embargo, hay cierta evidencia del rol del AMPc, tanto como promotor de la hiperactivación de la motilidad modulada por especies reactivas de oxígeno como inductor indirecto de la RA18.
Requerimientos iónicos
Hay requerimientos iónicos específicos para la promoción y soporte tanto de la capacitación como de la RA3. Algunos de estos compuestos son:
Calcio: este ión es necesario para la capacitación, la hiperactivación y la RA14,19-22. Se ha observado que la serotonina, que en otros sistemas celulares se asocia a un aumento de la permeabilidad para el Ca2+, es capaz de estimular la reacción del acrosoma23,24. Este hecho, junto a la presencia de calmodulina en la cabeza del espermatozoide25 reforzaría la idea de la necesidad de Ca2+ para la RA.
Potasio26, sodio27 y cloruro28: se ha demostrado que durante la capacitación hay la modulación de estos iones.
Cinc: podría jugar un rol importante en la desestabilización de la membrana plasmática durante la capacitación29.
Bicarbonato: regula la actividad de la adenilato ciclasa y el metabolismo de AMPc30, necesarios para la fosforilación de tirosinas de las proteínas durante la capacitación. Este compuesto además podría ser el responsable del aumento de pH intracelular que se observa en la capacitación31,32.
Disminución del contenido de colesterol
Durante la capacitación ocurren modificaciones en la distribución y composición de los lípidos y fosfolípidos de la membrana plasmática, que conducen a cambios en la composición y aumento en su fluidez33. Una de estas transformaciones es la eliminación de colesterol, que permitirá la entrada de Ca2+ extracelular y una disminución de la razón colesterol/fosfolípido en la membrana plasmática, prerrequisitos para que ocurra la fusión de las membranas en la RA34,35.
Requerimientos enzimáticos
Aparte de la acción del Ca2+, se requiere la participación de ciertas enzimas hidrolíticas en la RA. La activación de estas enzimas acrosomales ocurriría a través de un aumento del pH intracrosomal durante la capacitación34,36.
La inhibición de la RA en espermatozoides de hámster, utilizando inhibidores de la tripsina de baja masa molecular, como la benzamidina, apoya la teoría de la participación de enzimas hidrolíticas durante esta reacción37. Sin embargo, en el cobayo los inhibidores de la tripsina no impiden la formación de vesículas de las membranas durante la RA, sino que impiden la dispersión del contenido intraacrosomal38. Por otra parte, en espermatozoides humanos se ha sugerido la participación de una enzima tipo tripsina en el mecanismo a través del cual el espermatozoide humano realiza la RA inducida por la zona pelúcida o por el fluido folicular39. Estas diferencias han llevado sustentar el hecho de que, según la especie, se pueden encontrar distintos mecanismos de participación de estas enzimas en la RA38.
Otra enzima característica de este proceso es la acrosina, que participaría en la unión inicial de la zona pelúcida y el espermatozoide y en los eventos bioquímicos tempranos de RA39.
pH
Si bien se encuentran bien establecidos los requerimientos iónicos y la necesidad de un promotor de la disminución del contenido de colesterol, como la albúmina, para el desarrollo de la RA in vitro, la influencia de otros componentes del medio en el cual se realizan las incubaciones es poco conocida. Recientemente, se demostró que la capacidad de reacción ante estimulantes de la RA in vitro es sensible a cambios en el pH extracelular. A pH bajos (6,7-7,0), se observó una inhibición de la respuesta acrosomal y del aumento del pH intracelular que ocurre durante la capacitación. Esta carencia en el incremento de pH podría explicar la inhibición de la RA esperada14.
Complexina I
La regulación de la exocitosis suele estar controlada por el complejo SNARE, que incluye 3 proteínas que promueven la fusión de membrana. La complexinas I y II están altamente relacionadas con proteínas citosólicas que se unen al complejo SNARE y regulan la exocitosis neuronal. Si bien el espermatozoide tiene una exocitosis regulada, la liberación de una única gran vesícula hace a este proceso diferente del observado en la exocitosis neuronal. La fusión de la membrana plasmática con la membrana acrosomal externa ocurre en múltiples puntos. El mecanismo a través del cual se activa esta fusión y la manera en que ocurre la sincronización de la formación y progreso de estos puntos de fusión, permanece difuso. Recientemente, se ha demostrado que las complexinas I y II, detectadas en espermatozoides maduros con el acrosoma intacto, no se encuentran después de la exocitosis acrosomal. Aunque espermatozoides deficientes en complexina I son capaces de responder a ionóforos de calcio, no pueden reaccionar en presencia de proteínas de la zona pelúcida y tienen una capacidad fertilizante reducida in vitro. Se postula que esta complexina desarrollaría funciones importantes en el proceso de exocitosis, constituyendo uno de los requerimientos específicos para la ocurrencia de la RA10.
FACTORES QUE INFLUYEN EN LA OCURRENCIA DE LA REACCIÓN DEL ACROSOMA
Hay factores fisiológicos y no fisiológicos que afectan la ocurrencia de la RA40; algunos de ellos son:
Progesterona
La progesterona estimula la RA in vitro además de inducir naturalmente este proceso11,41,42. Esta hormona tendría efectos sobre la RA de carácter dependiente de la dosis mediados por la activación de un receptor de membrana espermático3,11,12,43. Se ha demostrado que la disminución de colesterol de la membrana plasmática durante la capacitación determina la capacidad de respuesta de espermatozoides humanos a progesterona34. En el fluido folicular preovulatorio inmediato se encuentran altas concentraciones de progesterona. Esto haría que en condiciones fisiológicas en el momento de la ovulación se liberen altas concentraciones de progesterona hacia la trompa de Falopio, lo cual induciría la RA, para así asegurar una fecundación exitosa.
Estradiol
Investigaciones recientes han mostrado que hormonas como el estradiol podrían actuar, a través de una vía rápida/no genómica, en varios tipos celulares, incluyendo el espermatozoide12,44. Este proceso se desarrollaría a través de 2 subtipos de receptores de membrana: a y b, y un influjo de calcio podría mediar el efecto no genómico44,45. Se ha demostrado que el estradiol presente en altas concentraciones en el moco cervical durante el período fértil de la mujer podría ejercer un rol inhibitorio sobre la RA en humanos. Ello prevendría una ocurrencia prematura de la RA durante el paso del espermatozoide por el cuello uterino. Esto, junto con el rol estimulador de progesterona sobre la RA, indicaría que las concentraciones de hormonas esteroidales a lo largo del ciclo menstrual estarían ejerciendo un rol en la fisiología espermática11.
Ácido gamma-aminobutírico
El ácido gamma-aminobutírico (GABA), molécula cuya participación en el sistema nervioso se conoce ampliamente, también se encuentra presente en tejidos periféricos, como el útero humano, oviductos y ovarios46. Además se han registrado altas concentraciones de este ligando en el plasma seminal humano47. Hay evidencia de receptores de GABA en sitios específicos de la superficie de espermatozoides humanos48.
En espermatozoides, GABA se ha caracterizado como inductor de la RA, donde su efecto describe una curva unimodal49. En ratones se ha demostrado que este comportamiento se debe a la activación temprana (a bajas concentraciones) de los receptores de GABAa (inductores), por el contrario en altos valores del ligando se activan los receptores de GABAb (inhibidores), generando un control balanceado del proceso a través de la activación coordinada de ambos receptores50.
La relación de GABA con los efectos de la progesterona ha sugerido que el receptor del ácido mediaría la respuesta de la progesterona.
La acción conjunta de GABA y progesterona se ha interpretado como una sumatoria de los valores independientes de cada ligando, aludiendo a mecanismos de acción separados49. Sin embargo, la acción de GABA en la RA no está claramente establecida a la fecha.
Proteína ZP3
ZP3 es una glucoproteína de la zona pelúcida, responsable tanto de la inducción de la RA como del reconocimiento entre el espermatozoide capacitado con el acrosoma intacto y el ovocito3,9,13,39,43. La exocitosis inducida por ZP3 del contenido acrosomal procede a través de 2 vías de señalización espermáticas51. En la primera, la unión de ZP3 a GalT y a otros receptores potenciales resulta en la activación de una proteína de unión a GTP heterotrimérica y de fosfolipasa C, lo cual eleva la concentración de Ca2+ citoplasmático. Actualmente se postula que ZP3 estimularía la producción de fosfatidilinositol-(3,4,5)-trifosfato en la membrana del espermatozoide, evento que sería parte del inicio de esta vía de transducción de señal9. En la segunda vía, la unión de ZP3 a los mismos receptores estimularía un ingreso transiente de Ca2+ a través de los canales tipo T. En una fase posterior de señalización, estos eventos iniciales inducidos por ZP3 producen una entrada adicional de Ca2+ a través de los canales para Ca2+ de la familia Trp, lo que resulta en un aumento sostenido de la concentración del Ca2+ citoplasmático, que desencadena la RA9,51,52.
Ionóforo A23187
El ionóforo A23187 se ha utilizado ampliamente como inductor de la reacción, pero es potencialmente citotóxico y las concentraciones utilizadas se deben escoger cuidadosamente de acuerdo con las condiciones de incubación3. Este ionóforo de Ca2+ acelera el curso de la reacción en espermatozoides de especies como cobayo, hámster y humanos53,54, corroborando el requerimiento de este ión para el desarrollo de la RA.
Agentes fusogénicos
Agentes fusogénicos como la lisofosfatidilcolina55,56, en presencia de Ca2+ son capaces de acelerar la RA. Sin embargo, en espermatozoides de bovino se ha demostrado que este efecto es dependiente del pH extracelular, ya que a pH < 7,2 no se desarrolla la exocitosis acrosomal esperada14.
Otros
Hay otros componentes que ejercerían un rol inhibitorio sobre la RA. Entre estos se han identificado:
Interleucina-657.
Clatrina: proteína seminal bovina que modularía el transporte de calcio58.
Cinc: presente en el semen en altas concentraciones3.
CONCLUSIONES
En resumen, la RA, que involucra la fusión de la membrana plasmática con la membrana acrosómica externa y la consiguiente liberación del contenido acrosomal, ocurre una vez que el espermatozoide se encuentra capacitado. In vivo, las condiciones vendrían dadas para que durante el período fértil las altas concentraciones de estradiol presentes en el moco cervical inhiban la RA. Posteriormente, el espermatozoide en su recorrido por el tracto genital femenino estaría expuesto a inductores de la RA, como altas concentraciones de progesterona provenientes del fluido folicular y que estarían presentes en la trompa de Falopio. Otras moléculas que estimularían la RA serían proteínas presentes en la cubierta ovocitaria, como ZP3.
Actualmente también se han identificado moléculas, como GABA, que estarían presentes en el útero y también tendrían un rol en la RA. Esto, junto a la acción no genómica que las hormonas esteroidales estarían ejerciendo sobre el espermatozoide, plantea un desafío para futuras líneas de investigación en la fisiología reproductiva.
Correspondencia: Dra. Pilar Vigil.
Facultad de Ciencias Biológicas.
Pontificia Universidad Católica de Chile.
Alameda Bernardo O'Higgins, 340. Santiago. Chile.
Correo electrónico: pvigil@bio.puc.cl