INTRODUCCIÓN
Los avances terapéuticos de los últimos años han mejorado la supervivencia de pacientes con cáncer, por lo que varones jóvenes con buena esperanza de vida pueden optar por la criopreservación espermática para preservar su fertilidad. En este sentido, hay varias opciones disponibles, pero en cualquier caso la opción del banco de semen debe ofrecerse a un varón antes de comenzar la terapia oncológica, independientemente de la tasa de descongelación. Por esta razón, en este trabajo se pretende ofrecer una revisión acerca los principales aspectos de la criopreservación de semen en estos pacientes, fundamentados en la medicina basada en la evidencia, método que depende de la utilización de controles aleatorizados y revisiones sistemáticas de ensayos clínicos, aunque no necesariamente restringida a estos aspectos (tabla 1).
CRIOPRESERVACIÓN DE SEMEN Y CÁNCER
Los avances terapéuticos en los últimos 10 años han mejorado la supervivencia de pacientes con neoplasia maligna. El 5% de los cánceres tienen lugar en pacientes de menos de 35 años de edad. Actualmente, cerca del 85% de los tumores en niños y jóvenes se pueden tratar con éxito, con una buena expectativa de vida1,2. Sin embargo, el tratamiento del cáncer, bien sea quirúrgico, radiológico o farmacológico, puede afectar severamente y ejercer efectos iatrogénicos durante largo tiempo en la fertilidad masculina3. La radioterapia (RT) y quimioterapia (QT) comprometen la fertilidad por el efecto citotóxico que se ejerce en la gametogénesis, y el grado de efecto gonadotóxico es dependiente del tipo de régimen utilizado y de la duración del tratamiento4. Así, numerosos estudios clínicos han demostrado claramente el efecto adverso que la terapia oncológica tiene en la fertilidad masculina5-7 (nivel 3 de evidencia; tabla 1). Dicho efecto adverso en la fertilidad puede ser reversible en algunos casos, pero no en todos, por lo que el grado de afectación no puede predecirse. Una media del 15 al 30% de los varones curados de cáncer, permanecen azoospérmicos varios años después8.
Hay que tener en cuenta que las enfermedades más frecuentes en los varones que acuden a un banco de semen para criopreservación espermática, son: enfermedad de Hodgkin, cáncer de testículo, leucemia, linfoma no hodgkiniano y cáncer de tiroides4. Por tanto, la criopreservación de semen debería considerarse en situaciones en las cuales se va a aplicar un tratamiento que probablemente afecte a la fertilidad, como en el caso de las enfermedades mencionadas anteriormente.
QUIMIOTERAPIA Y FERTILIDAD
Actualmente, y aunque hay unos 700.000 agentes antineoplásicos, en la práctica clínica no se usan más de 509. Esos principales agentes antineoplásicos se agrupan de la siguiente forma:
Agentes alquilantes: cisplatino, ciclofosfamida, procarbazina, etc.
Antimetabolitos: metrotexato, 5-fluoracil, etc.
Antibióticos: adriamicina, bleomicina, mitoxantrona, etc.
Antimitóticos: vinblastina, vincristina, etc.
Enzimas: L-asparaginasa, etc.
La arriba comentada espermiotoxicidad de la QT está correlacionada con algunas variables: grupo del agente antineoplásico, número de fármacos utilizados, dosis total, duración del tratamiento, edad del paciente y sensibilidad individual2. En cualquier caso, el principal objetivo de todos los protocolos de QT es alcanzar un balance entre los mejores resultados de curación y los menores efectos adversos.
Tumores testiculares
El cisplatino es el principal agente quimioterápico en los protocolos oncológicos para tumores testiculares. El cisplatino afecta el ADN celular y su resultado está relacionado con la dosis. Otros fármacos utilizados en esta patología son: etopósido, vinblastina, bleomicina e ifosfamida. La asociación de cisplatino con etopósido y bleomicina es el protocolo más comúnmente utilizado10. Respecto a la espermiotoxicidad del cisplatino, la mayoría de los pacientes mostrarán azoospermia temporal o permanente. La azoospermia temporal se resuelve en unos 2 años en el 50% de los pacientes, y en 5 años en el 80% de los casos11. No obstante, el cisplatino está considerado actualmente como esencial en los protocolos de tumores testiculares (nivel 3 de evidencia; tabla 1).
Linfomas
El tratamiento de los linfomas está basado en la QT sola o asociada a RT. El protocolo más utilizado actualmente para el linfoma de Hodgkin es el ABVD: doxorrubicina, bleomicina, vinblastina y dacarbazina12.
Los agentes alquilantes como la ciclofosfamida son extremadamente peligrosos para el epitelio germinal y reducen la fertilidad en aproximadamente un 50% de los varones. Altas dosis de estas sustancias pueden causar azoospermia durante más de 3 años en el 60% de los casos. Una dosis acumulada > 6 g/m2 conduce a importantes daños en la espermatogénesis, muchas veces irreversibles. La procarbazina, otro agente alquilante que se utiliza frecuentemente en los linfomas, daña la espermatogénesis cuando se da en dosis > 4 g/m2. La recuperación, en la mayoría de los casos, es sólo parcial. La procarbazina parece ser la causa principal de la infertilidad postratamiento en los linfomas no hodgkinianos, frente a los pacientes con linfoma de Hodgkin8.
La actividad espermiotóxica del metrotexato, un antimetabolito que interfiere con la síntesis de ácidos nucleicos, no está definida claramente, aunque los efectos parecen ser temporales13. Otros citostáticos que actúan a través de las uniones no covalentes del ADN (la ya mencionada doxorrubicina, también conocida como adriamicina, mitoxantrona, etc.) y en el huso mitótico (vincristina, vinblastina, etc.), parece ser que sólo tienen actividad espermiotóxica temporal en la mayoría de los casos.
En general, los agentes quimioterápicos con efecto más lesivo en la espermatogénesis son los alquilantes (sobre todo ciclofosfamida y procarbazina). Cuando la dosis acumulativa de ciclofosfamida no excede los 10 g/m2, la deplección de las células germinales puede ser reversible. El riesgo de aplasia germinal con agentes como la vinblastina o cisplatino es mucho menor (nivel 3 de evidencia; tabla 1).
Resumen: quimioterapia y fertilidad
En la tabla 2, y a modo de síntesis, se muestran los tratamientos quimioterápicos que se utilizan con más frecuencia para cáncer de testículo, linfoma y enfermedad de Hodgkin y su afectación a la fertilidad14 (nivel 4 de evidencia; tabla 1).
RADIOTERAPIA Y FERTILIDAD
Las 2 principales fuentes de radiación utilizadas durante la RT radiación electromagnética (rayos X) y radiación corpuscular (electrones) producida por un acelerador lineal, afectan la función testicular. La radiación testicular directa con dosis de más de 0,35 Gy causa azoospermia reversible. Los espermatozoides no pueden tolerar dosis de más de 6 Gy15. Dosis de más de 15 Gy causan daño en las células de Leydig, que son irreversibles con dosis de más de 20 Gy. La recuperación de la espermatogénesis se puede alcanzar espontáneamente en 1 año en los casos más favorables, mientras que en otros puede tardar varios años (nivel 2 de evidencia; tabla 1).
CRIOPRESERVACIÓN DE SEMEN EN PACIENTES ONCOLÓGICOS
La criopreservación de semen debe ofrecerse a todos los pacientes diagnosticados de cáncer, tan pronto como sea posible y antes de iniciar cualquier terapia. Oncólogos, cirujanos y urólogos implicados en los tratamientos, deben conocer, antes de empezar la QT o RT, los procedimientos que probablemente afectarán la espermatogénesis y el manejo de la infertilidad postratamiento (nivel 4 de evidencia; tabla 1). Incluso la criopreservación de semen puede realizarse en pacientes con cáncer de testículo después de la orquiectomía unilateral8 (nivel 3 de evidencia; tabla 1). No obstante, la aceptación y realización de esta técnica es irregular. Así, Horning et al13, en un trabajo publicado en 1988, afirman que el 91% de los oncólogos está de acuerdo en que la criopreservación debe ofrecerse a todos los varones oncológicos, aunque sólo se les ofreció siempre en el 10%, y en ocasiones en el 27%.
Es aconsejable que los pacientes congelen tantos eyaculados como sea posible antes de comenzar el tratamiento oncológico. Sin embargo, esto dependerá de la antelación con la que hayan sido remitidos a un banco de semen y de las características iniciales del eyaculado. En caso de disponer de tiempo suficiente antes del tratamiento, factores tales como el volumen, la concentración espermática y la movilidad, serán decisivos para el número de congelaciones. En pacientes normozoospérmicos, 3 o 4 eyaculaciones son suficientes para su utilización posterior. En muestras patológicas, cuantas más dosis se congelen habrá más posibilidades futuras de recuperación espermática16. La mayoría de las veces, la urgencia de los oncólogos para comenzar el tratamiento es el factor decisivo para referir a los pacientes al banco de semen. Sin embargo, incluso una única muestra de semen de calidad limitada es suficiente para realizar varios ciclos de microinyecciones espermáticas ICSI (intra-cytoplasmatic sperm injection). La congelación de semen con el sistema de píldoras permite descongelar varias bolitas para distintos procedimientos17 (nivel 4 de evidencia; tabla 1).
A continuación se analizarán los factores pronósticos en la utilización de espermatozoides recuperados de la criopreservación, referidos a las alteraciones producidas por la QT, la recuperación espontánea de la fertilidad, la utilización de las muestras congeladas y resultados con las técnicas de reproducción asistida.
Alteraciones producidas por la quimioterapia
La mayoría de los pacientes que han comenzado la QT desarrolla azoospermia 2 o 3 meses después de ésta8 (nivel 2 de evidencia; tabla 1). Sin embargo, la congelación de semen durante el tratamiento, para poder solucionar la urgencia del problema, ha sido recomendada por algunos autores18. Al mismo tiempo, la QT puede inducir anomalías genéticas a corto y largo plazo. Estudios realizados con el test de hámster y espermatozoides humanos, así como técnicas citogenéticas de fluorescencia e hibridación in situ (FISH) han demostrado que la QT y la RT pueden provocar aneuploidías a corto19 y largo plazo20-22. A largo plazo también se han publicado mutaciones en semen de pacientes que han sido tratados con QT23 (nivel 2 de evidencia; tabla 1). Incluso se han publicado trabajos que demuestran la presencia de mayores tasas de aneuploidías24 y un incremento en el daño del ADN25 antes de comenzar el tratamiento en estos pacientes. De hecho, hay autores que recomiendan la utilización de medidas anticonceptivas de 6 meses a 1 año posfinalización del tratamiento26. Por otro lado, esos mismos autores afirman que no hay una evidencia clínica de anomalías cromosómicas en la descendencia de niños nacidos de varones que están o han estado en tratamiento con QT26. Por todo ello, en caso de no haber otra solución se puede congelar el semen una vez haya empezado el tratamiento. Es imprescindible, no obstante, que los pacientes estén informados de los riesgos, o que, adicionalmente, se les ofrezca la posibilidad del diagnóstico genético preimplantacional para controlar el peligro de aneuploidías27.
Recuperación de la fertilidad de los pacientes oncológicos
La mayoría de los estudios demuestran que la prevalencia de la infertilidad en pacientes oncológicos, aún a pesar de la frecuente recuperación espermática, es mayor que en la población general28 (nivel 3 de evidencia; tabla 1). Ya que se desconoce la posibilidad real de recuperación de la fertilidad en los varones con cáncer, debido a variables como patología inicial, empleo de QT y/o RT, dosis empleadas, en todos los casos se recomienda criopreservar el semen antes de iniciar el correspondiente tratamiento. Transcurrido 1 año de su finalización es aconsejable un análisis de semen. Si hay deseo de gestación y se encuentra una azoospermia o una oligoastenoteratozoospermia severa, se puede utilizar el semen criopreservado. Otra opción sería, si no se consigue embarazo tras 1 año de exposición coital no protegida, recomendar la realización de técnicas de reproducción asistida con el semen criopreservado, en vez de utilizar el semen fresco "recuperado" post-QT (nivel 3 de evidencia; tabla 1).
Utilización de las muestras congeladas de pacientes oncológicos
La mayoría de los trabajos publicados al respecto reportan que sólo entre un 4 y un 8% de los pacientes que han criopreservado semen utilizan posteriormente las muestras congeladas para conseguir una gestación27-29. La principal razón aportada por la gran parte de los estudios es la falta de información de los pacientes y los oncólogos acerca de los efectos de la criopreservación, el uso posterior de los espermatozoides descongelados y las técnicas actuales de reproducción asistida30-33 (nivel 3 de evidencia; tabla 1).
Resultados de las técnicas de reproducción asistida en pacientes oncológicos
Con las actuales técnicas de reproducción asistida, se han comunicado embarazos y nacimientos con el empleo de espermatozoides criopreservados de pacientes con cáncer, sin un aumento del riesgo de anomalías congénitas e independientemente del tiempo de almacenamiento9,11 (nivel 3 de evidencia; tabla 1). En un caso incluso se ha informado del embarazo de una paciente con semen criopreservado durante 21 años34.
Aunque hay pocas referencias acerca de la utilización de este tipo de espermatozoides en reproducción asistida, un trabajo realizado en el año 2004 analiza los resultados con semen criopreservado de pacientes oncológicos en 87 ciclos de reproducción asistida (inseminación intrauterina, fecundación in vitro e ICSI). No se encontraron diferencias en los resultados de gestación con respecto a la técnica ni al tipo de cáncer que presentase inicialmente el paciente. En total nacieron 11 niños, ninguno de ellos con anomalías congénitas. El 40% de los pacientes que ha utilizado el semen criopreservado con estas técnicas han conseguido una gestación4.
CONSENTIMIENTOS INFORMADOS
Según marca la Ley de Reproducción Asistida35 (14/2006 de 26 de mayo), es necesario que el paciente que va a criopreservar semen firme el correspondiente consentimiento informado, en el cual se le informará de los siguientes aspectos:
1. Según lo establecido en la Ley Orgánica 15/1999, de protección de datos de carácter personal, dichos datos de carácter personal, así como los datos de carácter sanitario, quedarán registrados en un fichero, propiedad de la entidad que corresponda, pudiendo ser utilizados y cedidos única y exclusivamente, a los efectos de la actuación encargada, gozando de los derechos de acceso, rectificación y cancelación. Todos los datos que se deriven del proceso quedarán reflejados en la correspondiente historia clínica que será custodiada en las instalaciones de la entidad para garantizar su correcta conservación y recuperación.
2. Si se va a someter a una cirugía o tratamiento que puede potencialmente causar esterilidad, podrá depositar tantas muestras como desee o pueda antes de comenzar el proceso. Por otra parte, dependiendo de la condición inicial del eyaculado así será el número de dosis obtenido y la calidad posdescongelación. Esto es:
A mayor volumen de eyaculado, mayor número de dosis obtenidas.
Tras la descongelación del semen se pierde aproximadamente un 20% de movilidad espermática.
3. No hay riesgos para los espermatozoides ni para la posible descendencia debida al hecho de la criopreservación.
4. Que la última modificación de la Ley de Reproducción Asistida (14/2006) contempla que "el semen podrá criopreservarse en bancos de gametos autorizados al menos durante la vida del donante, por lo que a priori no hay límite de tiempo para la conservación del semen.
5. En el caso de que ocurra su fallecimiento, para que el semen pueda utilizarse en la fecundación de su esposa o compañera, habrá de haberlo consentido previamente en escritura pública o testamento, y utilizarse el semen dentro de los 12 meses siguientes a su fallecimiento. Tratándose de un varón casado, el nacimiento de la forma indicada producirá los efectos legales que se derivan de la filiación matrimonial. Para el varón no casado, el consentimiento referido servirá de título para iniciar el expediente del artículo 49 de la Ley de Registro Civil (de inscripción de la filiación natural), sin perjuicio de la acción judicial de reclamación de paternidad.
6. Las dosis quedarán a disposición del banco de semen en caso de no poder contactar con el depositario transcurridos 2 años desde el depósito en el mismo.
CONCLUSIONES-RECOMENDACIONES
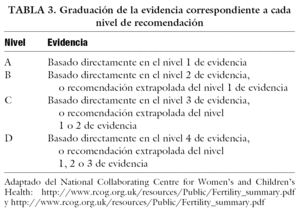
Para finalizar, y a modo de conclusiones, se resumen y describen las siguientes recomendaciones, según niveles de evidencia (tabla 3).
Debe ofrecerse la posibilidad de criopreservación de semen a los varones que vayan a someterse a un tratamiento que pueda causar esterilidad, ya que se ha establecido la efectividad del procedimiento (nivel B de evidencia).
En pacientes normozoospérmicos es suficiente congelar 3 o 4 eyaculados. En sémenes patológicos sería conveniente congelar muestras adicionales hasta el momento de comenzar el tratamiento (nivel C de evidencia).
La congelación de semen debe realizarse antes de comenzar con la QT o RT, por el posible riesgo de alteraciones cromosómicas de los espermatozoides (nivel B de evidencia).
Es aconsejable utilizar medidas anticonceptivas al menos durante los 6 meses posteriores de la finalización del tratamiento de quimioterapia (nivel C de evidencia).
Si no hay otra posibilidad que la de congelar semen cuando ya ha comenzado la QT, debe informarse al paciente de los posibles riesgos y de la posibilidad de utilizar en el futuro el diagnóstico genético preimplantacional (nivel B de evidencia).
Si no se consigue embarazo tras 1 año de exposición coital no protegida, se recomienda la realización de técnicas de reproducción asistida con el semen criopreservado, en vez de utilizar el semen fresco "recuperado" post-QT (nivel D de evidencia).
Deben haber protocolos de actuación para asegurar que los profesionales de la sanidad conozcan el valor de la congelación de semen en estas circunstancias (nivel C de evidencia).
Es imprescindible que el paciente que va a criopreservar semen firme el correspondiente consentimiento informado basándose en la legislación vigente (nivel B de evidencia).
Correspondencia: Dra. R. Núñez Calonge.
Clínica Tambre.
Tambre, 8. 28002 Madrid. España.
Correo electrónico: rocio@clinicatambre.com