El cáncer gástrico (CG) mantiene alta prevalencia en Chile, con una tasa de mortalidad de 20/100.000 habitantes. Se reconocen dos variantes histológicas, el tipo difuso y el tipo intestinal. El primero crece en forma de células sueltas y el segundo forma glándulas semejantes a las intestinales. Para el intestinal, la histogénesis se inicia con una gastritis atrófica, seguida de metaplasia, displasia y cáncer a diferencia del difuso cuya histogénesis es diferente, en mucosa fúndica. Ambos pueden presentarse combinados, en ambos se reconoce asociación con el Helicobacter Pylori y otros factores ambientales, pero el de tipo intestinal es el más caracteristico de áreas de alta incidencia y el difuso tiene una vertiente más asociada a factores hereditarios. Además, entre ambos existen diferencias de comportamiento clinico. La clasificación de origen japonés en cáncer incipiente y avanzado mantiene utilidad por su trascendencia pronóstica y terapéutica. Para la etapificación clinica (c) y patológica (p)se ha universalizado el sistema TNM. Los sintomas son inespecificos y sugieren una enfermedad avanzada. Esto justifica politicas de prevención, el reconocimiento de factores de riesgo y la endoscopía con biopsia aun ante síntomas sutiles. La etapificación clínica y el tratamiento se definen en comité multidisciplinario. La tomografía de tórax, abdomen y pelvis es el examen inicial y se complementa según necesidad y disponibilidad. Para el tratamiento no existe un procedimiento estándar Para tumores T1a se considera la resección endoscópica y para los avanzados, la resección quirúrgica tipo D2- RO. Esta puede hacerse por vía abierta o laparoscópica. Para tumores avanzados o con compromiso ganglionar se indica neoadyuvancia o adyuvancia. En algunos pacientes el tratamiento solo tiene objetivos paliativos.
Gastric Cancer (GC) is highly prevalent in Chile, with a mortality rate of 20/100.000 inhabitants. Two histological entities are recognized: diffuse type (isolated tumoral cells) and intestinal type (intestinal-like glandular structures). For the latter the sequence of atrophy, metaplasia, displasia and progression to cancer is recognized whereas the diffuse type grows mainly in fundic mucosa. Both may present combined, and both have carcinogenetic association with Helicobacter Pylori. The intestinal type is characteristic for high risk areas whereas the diffuse type has been associated more frequently with genetic-hereditary predisposition. The Japanese classification of early and advanced GC mantains therapeutic and prognostic value. For clinical (c) and patological (p) staging the TNM system is of generalized use. Symptoms are non specific, and suggest an advanced disease. Therefore strategies for prevention in high risk areas must be designed. Clinical awareness, the recognition of risk factors, and early endoscopy with biopsy may be helpful for an early diagnosis. Individual staging and treatment are mutidisciplinary. Computed tomography of the chest, abdomen and pelvis is complemented by other studies according to individual indication. Treatment should be individually tailored. For Tla tumors endoscopic treatment is available with excellent results but with follow-up commitment. For advanced localized tumors D2-R0 resection is indicated. Neo adyuvant or adyuvant treatment should be considered in these patients. Some patients with diseminated disease only allow palliative treatment.
El cáncer gástrico (CG) sigue siendo una enfermedad de alta prevalencia en Chile y en el mundo aun cuando la distribución geográfica de su incidencia no es uniforme (1). Asi se han definido áreas de alta ncidencia, entre las que se mantiene Chile, y otras en las que la incidencia se hizo progresivamente menor a lo largo del Siglo XX, como ocurrió en algunos paises europeos, Canadá y los Estados Unidos de Norteamérica.
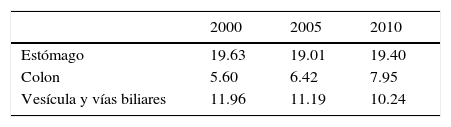
En nuestro país las tasas de mortalidad por CG tampoco son uniformes, reconociéndose que son más altas en la zona centra sur que en otras, especialmente la zona norte. Como ejemplo, en la Región del Biobío y en la Araucanía la tasa de mortalidad fue cercana a 26 por 100.000 habitantes el año 2010, en tanto que en Arica y Parinacota, Tarapacá, Antofagasta y Atacama el mismo año, fue cercana a 11 por 100.000. La tendencia general en el país fue declinante hasta el año 2000, pero se ha estabilizado desde entonces tanto para hombres (26/100.000) como para mujeres (12/100.000) (2). La Tabla 1 muestra cifras para Chile el año 2000, 2005 y 2010, comparando tres tumores digestivos. Se puede ver que si bien la tasa es ascendente para tumores de colon y estable para tumores de vía biliar, el CG mantiene con distancia la mayor tasa de mortalidad por tumores digestivos en Chile. Estas cifras confirman la importancia de esta patología en Chile y la necesidad de reforzar estrategias de prevención, de diagnóstico oportuno y de tratamiento.
Tasas de mortalidad observada en chile para tumores gástricos, de colon y de vesícula y vía biliar. (2)
| 2000 | 2005 | 2010 | |
|---|---|---|---|
| Estómago | 19.63 | 19.01 | 19.40 |
| Colon | 5.60 | 6.42 | 7.95 |
| Vesícula y vías biliares | 11.96 | 11.19 | 10.24 |
Histología: es importante tener presente que el CG es un grupo heterogéneo de tumores de diferente histopatologia, mecanismos y asociaciones patogénicas y también de diferente comportamiento clínico (en esta presentación no se incluyen otros tumores malignos del estómago como los linfomas, tumores estromales y neuroendocrinos asi como no se incluye el grupo de los tumores de la unión gastroesofágica, cuya oncogénesis es distinta).
Una de las clasificaciones más utilizadas para la caracterización histológica es la de Laurén (3) que reconoce dos tipos básicos de tumor:
- -
Cáncer de tipo difuso.
- -
Cáncer de tipo intestinal.
El cáncer difuso es aquel que crece en forma de células sueltas, o aisladas y el intestinal es aquel que forma glándulas y por esta vía se asemeja a un cáncer de colon, de donde deriva su denominación (Tabla 2). Ambos tipos pueden presentarse mezclados o combinados pero en su expresión más característica tienen comportamiento anátomo patológico y clínico diferente (3,4): el cáncer difuso es más frecuente en pacientes más jóvenes, tiende más hacia la carcinomatosis peritoneal, es característico también de la forma conocida como Linitis Plástica o de los tipos III o IV de la clasificación de Borrmann (5) y se asocia más al cáncer hereditario. El intestinal, por su parte es el más frecuente en los tipos I y II de Borrmann, tiende a la metástasis hematógena más que a la diseminación peritoneal y es caracteristicamente también el que se presenta como secundario a factores ambientales, propio de áreas de alta incidencia.
Histología del cáncer gástrico: clasificación de lauren (3)
| Tipo Intestinal: | Adenocarcinoma tubular. Adenocarcinoma papilar. |
| Tipo Difuso: | Adenocarcinoma de células en anillos de sello. Carcinoma indiferenciado. Carcinoma mucinoso. |
Patogenia: Aspectos generales.
Nuevamente, en su expresión más típica, hay dosvariedades diferentes en la patogenia del CG:
- -
Aquella modalidad que se reconoce como “ambiental” o “epidémico” en zonas de alto riesgo, desencadenado por factures relacionados a hábitos o, como su nombre lo indica, secundario a factores externos o propios del ambiente en interacción con el huésped.
- -
El cáncer hereditario, cuya expresión más típica es el CG Hereditario Difuso secundario a mutaciones del gen de la E-Cadherina (6, 7).
- -
Cáncer Epidémico: responde en su oncogénesis a factores desencadenantes externos en interacción con respuestas a nivel molecular del huésped. Numerosos estudios han buscado la asociación entre hábitos de alimentación (u otros) y riesgo de CG. Con buen nivel de evidencia se reconocen el exceso de consumo de sal, el consumo de nitratos, el tabaquismo, y además el bajo consumo de verduras y frutas frescas, con el escaso aporte de antioxidantes como consecuencia.
Sin perjuicio de la importancia de todos estos y otros factores, el descubrimiento del Helicobacter pylori (HP) y la altisima frecuencia de la colonización gástrica por este germen en la población mundial y en Chile (8,9) han contribuido a complementar el conocimiento acerca de la influencia de los factores ambientales en la histogénesis de estos tumores. Se reconoce a este germen como el desencadenante o gatillo de la inflamación de la mucosa gástrica que lleva finalmente al cáncer. La diferencia entre áreas geográficas de mayor o menor incidencia estaria dada por la interacción entre todos estos factores. Desde el descubrimiento de este germen, se han ido reconociendo también distintas cepas, a las que se atribuye mayor o menor agresividad (10) lo que podría tener influencia en este aspecto. Sin embargo, aparentemente es la precocidad a la que se produce esta infección en un sujeto lo que contribuye a definir mejor áreas de alto riesgo, como se ha podido ver en nuestro país (11). El proceso histológico que lleva a la aparición del cáncer ha sido definido ya con claridad: inflamación que se hace crónica, atrofia de la mucosa, metaplasia intestinal, displasia y finalmente cáncer. Esta secuencia histológica se reconocía desde antes de conocerse la colonización gástrica por HP, y se atribuía a los factores ambientales y de hábitos descritos. Con posterioridad se acumuló evidencia que permitió reconocer sin duda la accián de este germen como carcinógeno (12,13). Los tumores que provienen de esta forma de evolucián histológica son de tipo intestinal y se sitúan preferentemente en la mitad distal del estómago.
Sin embargo también se reconoce que en algunos pacientes la infección por HP genera una gastritis corporal con infiltrado inflamatorio de tipo agudo, que se asocia más a cánceres de cuerpo y fondo, de tipo difuso, mixto o mal diferenciado, por lo que no todos los tumores asociados al HP son intestinales. El mecanismo por el cual se genera una u otra respuesta histológica no está aclarado, pero es en este aspecto donde la respuesta proinflamatoria tisular del huésped a nivel molecular adquiere particular relevancia. Por otro lado, el HP no se asocia a mayor riesgo de adenocarcinoma esofágico (13).
Cáncer Hereditario: esta es una vertiente patogénica que se ido reconociendo y caracterizando progresivamente en los últimos años. Nuevamente, hoy se reconoce una variedad de tumores de tipo hereditario. El mejor definido, pero infrecuente, es aquel que proviene del déficit del gen de la E-Cadherina; este tumor es de tipo difuso, es claramente familiar e identificable con los estudios genéticos adecuados por lo que permite un algoritmo de control y de prevención que puede llegar hasta la gastrectomía profiláctica (14).También se sabe que hay otras alteraciones genéticas que pueden llegar a manifestarse por este tumor (14,15).
Por otra parte, también existe el cáncer familiar de tipo histológico intestinal, pero en este caso el trastorno genético ha sido más difícil de definir y de distinguir de factores ambientales cuya influencia y predominio pueden seguir presentes (14,15).
En la Tabla 4 se resumen los requisites para establecer el diagnóstico de cáncer familiar. En la práctica, esta posibilidad debe tenerse presente cada vez que uno se enfrente a un paciente con CG que tenga menos de 40 a 50 años de edad, con un cáncer difuso o bien cuando se documenta este diagnóstico en más de un integrante de una misma familia, especialmente si son menores de 50 años y su parentesco es de primer grado.
Requisitos para el diagnóstico de cáncer hereditario. (6)
| A. Cáncer hereditario difuso - criterio ampliado (*) |
| 1. Cualquier paciente con dos casos documentados de cáncer difuso en familiares de primer o segundo grado, uno de ellos menor de 50 años. |
| 2. Tres o más casos documentados de cáncer difuso en familiares de primer o segundo grado, a cualquier edad. |
| * 3. Cualquier individuo con cáncer difuso menor de 40 años. |
| * 4. Cualquier individuo con cáncer difuso y cáncer lobular de mama. |
| * 5. Un familiar con cáncer difuso del estómago y otro con cáncer lobular de mama. |
| * 6. Un familiar con cáncer difuso del estómago y otro con cáncer de colon de células en anillo de sello. |
| B. Criterios para el Diagnóstico de Cáncer Hereditario de tipo intestinal en paises de alta incidencia. |
| 1. Tres casos documentados en una familia, siendo uno de ellos familiar de primer grado de los otros 2. |
| 2. Compromiso de 2 generaciones sucesivas. |
| 3. Diagnóstico bajo los 50 años de edad en uno de los casos. |
Los trastornos moleculares a nivel celular o tisular que llevan finalmente a la aparición de un cáncer son objeto de intensos estudios y se conocen solo en forma parcial. Su análisis detallado está fuera del alcance y del objeto de esta revisión. Cabe señalar que la evolución del conocimiento a este respecte en el último tiempo ha sido exponencial e incluye alteraciones de la secuencia genética, activación de oncogenes y/o inactivación o alteración de genes supresores de tumores entre otros mecanismos (15).
Anatomia Patolóqica: consideraciones generalesLa definición de origen japonés del cáncer avanzado y del incipiente o precoz mantiene vigencia y utilidad. Los tumores incipientes son aquellos que invaden hasta la mucosa o hasta la submucosa y los avanzados son aquellos que llegan hasta la muscular propia o más allá. Lamentablemente en nuestro país y en general en occidente esta es la variedad predominante, lo que tiene claras consecuencias negativas en el pronóstico de los pacientes. Japón, a través de estrategias de detección precoz, ha logrado que aproximadamente el 50% de los pacientes llegue al tratamiento en etapa incipiente, obteniendo así resultados terapéuticos que son claramente superiores.
Tanto para el cáncer incipiente como para el avanzado existen clasificaciones clásicas que definen las variedades macroscópicas que son de conocimiento común: tipos I (elevado), Il (plano), con tres subtipos, y III (ulcerado) para el incipiente, que suelen presentarse en forma combinada, en tanto que para los avanzados se mantiene la clásica clasificación de Borrmann, agregándose un tipo V para los inclasificables (5). Al respecte, cabe señalar que las formas elevadas se asocian más a tumores bien diferenciados de tipo intestinal con limites precisos, en tanto que en los formas III o IV de Borrmann o en la linitis plástica predomina el tipo difuso, cuyos limites son más difíciles de définir. Estas caracteristicas tienen consecuencias terapéuticas, por cuanto las formas difusas obligan a ampliar los márgenes de resección.
Cáncer Gástrico, enfrentamiento clínico: prevención, diagnóstico oportuno y etapificaciónEl progreso y el mayor y mejor conocimiento de esta patologia se debe en buena medida al trabajo realizado en Japón. Al respecto, en un registra de 187 hospitales de ese país, que incluyó información completa de 12004 pacientes tratados el año 2001, se obtuvo una sobrevida global a 5 años de 69,1%. La resecabilidad fue de 97%, con una mortalidad operatoria de 0,6%. Cerca del 50% de los casos correspondió a cáncer ncipiente. Estas cifras publicadas recientemente (16) corresponden a pacientes tratados hace algo más que una década. Elias constituyen una demostración perentoria de que hay un enorme espacio para el progreso si las contrastamos con las de nuestro país.Tratar de igualarlas no es realista, pero aprovechar la experiencia japonesa para desarrollar estrategias de mejor enfrentamiento del problema es fundamental para la prevención de esta enfermedad y para mejorar su pronóstico.
La sola consideración que 70 a 80% de los pacientes en Chile tiene un cáncer asociado a hábites y a la infección precoz por HP abre posibilidades de prevención posibles de concretar por medio de politicas de salud pública que podrían llevar a nuestro país a cifras más bajas de incidencia. Se ha mencionado incluso la posibilidad de desarrollar una vacuna para prevenir la infección por HP (8).
Por otra parte, la conciencia de que existen diversos tipos de origen genético, hereditario para este tumor, obliga a estar especialmente atento a aquellos casos de pacientes jóvenes por la posibilidad de prevención o de diagnóstico precoz en algún familiar, sobre todo en los de primer grado.
Diagnóstico OportunoDesgraciadamente en nuestro país todavía en la mayoría de los casos se haceel diagnóstico cuando la enfermedad ya está avanzada. Solo en aproximadamente el 15 % de los pacientes llega al tratamiento en etapa precoz o incipiente. Aun cuando pueda ser objeto de polémica, hay que pensar hoy en día que la endoscopía, complementada si es necesario con biopsias, puede ser considerada casi parte del examen fisico, sobre todo si se considéra que esta enfermedad no présenta signos o síntomas patognomónicos. Entre estes, sin embargo, constituye motivo especia de alarma el hallazgo de anemia crónica hipocroma o de síntomas obstructives progresivos sugerentes de obstrucción del cardias o del píloro, o bajas de peso sin explicación clara. Incluso, un CG puede manifestarse inicialmente como un cuadro depresivo. En todo caso, la indicación oportuna del examen endoscópico en pacientes aun con dispepsia inespecifica, debe ser considerada valida, sobre todo si es de aparición reciente. Asimismo, como se mencionó, la busqueda en familiares de pacientes ya tratados puede proporcionar la satisfacción del diagnóstico precoz. Por otra parte, la confirmación de atrofia o metaplasia gástrica justifica el seguimiento endoscópico e histológico periódico y por esta via, eventualmente, un diagnóstico más oportuno.También debe tenerse presente que hoy se busca el tumor en etapas iniciales, por lo que ante cualquier anomalia de la mucosa, la biopsia es de indicación perentoria. Claramente es preferible la seguridad de una biopsia normal que el diagnóstico posterior de un tumor avanzado o incurable. De igual manera, a veces la biopsia puede ser falsamente negativa por lo que ante la sospecha clinica o endoseópica clara sugerente de CG, debe repetirse. En muy contados casos incluso puede llegarse a la cirugia aun con biopsia negativa, situación que se da en algunos casos de linitis plástica, en donde la infiltración tumoral es predominantemente submucosa.
También es necesario reconocer factores de aumento de riesgo de CG. Entre estos están la gastritis atrófica autoinmune (anemia perniciosa), la presencia de adenomas y el antecedente de gastrectomía subtota antigua por úlcera, sobre todo si es del tipo Billroth II, entre otras. El seguimiento cuidadoso de estos pacientes tiene el potenciál de facilitar el diagnóstico precoz.
Si bien la endoscopía ha desplazado al estudio radiológico baritado como primer método de estudio, esta alternativa mantiene vigencia frente a síntomas atípicos, algunos tumores obstructivos y también en pacientes con cirugías previas. El método del doble contraste es de excelente rendimiento en manos expertas y ayuda además a precisar la extension del tumor.
EtapificaciónLa “etapificación” o estudio del grado de avance de la enfermedad tiene dos propósitus fundamentales: Precisar el mejor plan terapéutico en cada caso.
- -
Precisar lo mejor posible el pronóstico del paciente, aspecto fundamental para él y para su familia.
Mantiene valor práctico como aproximación inicial la clasificación japonesa que distingue entre cáncer precoz o incipiente o cáncer avanzado, por cuanto permite acercarse a una definición del pronóstico, teniendo presente que aun con todos los recursos disponibles actualmente, existe siempre un margen de error por lo cual la entrega de la información debe ser hecha con prudencia. En paralelo y con el importante objetivo adicional de uniformar el lenguaje y recopilar información valida y comparable, se ha generalizado en el mundo el sistema propuesto por la UICC (Union Internationale Contre le Cancer) en conjunto con la AJCC (American Joint Commission on Cancer), (17), actualmente en su septima version y que se présenta en la tabla 5. El antefijo “c” previo a TNM significa etapificación clinica, el antefijo “y” significa etapificación si ha habido neoadyuvancia y el antefijo “p” représenta la etapificación anátomo patológica que représenta el examen de la pieza resecada. En este sistema, T se refiere al tumor en sus grados de profundidad de Invasión, el N a los linfonodos, y M define la presencia o ausencia de metástasis a distancia. En conjunto, la calidad oncológica de la operación se define con la sigla “R”: R 0: ausencia de tumor residual; R1 : residuo microscópico, R2: residuo tumoral macroscópico. Esta caracterización de la operación efectuada es de alto valor pronóstico.
Sistema de etapificación tnm para cáncer gástrico. la combinación de t n y m determina el estadío (17)
| T | Tx | Tumor primario no évaluable. |
| To | Sin evidencia de tumor. | |
| Tis | Carcinoma in Situ (Sin invasión de lámina propia). | |
| T1 | Tumor que invade la lámina propia, muscular de la mucosa o submucosa. | |
| T1 a Invasión de lámina propia, o muscular de la mucosa. | ||
| T1 b Invasión de submucosa. | ||
| T2 | Invasión de muscular propia. | |
| T3 | Invasión hasta subserosa. | |
| T4 | Invasión de peritoneo visceral o estructuras vecinas. | |
| T4 a Invasión de peritoneo visceral. | ||
| T4 b Invasión de estructuras vecinas. | ||
| N | Nx | Compromiso ganglionar linfático no évaluable. |
| No | Sin metástasis ganglionar linfática. | |
| N1 | Metástasis en 1 o 2 ganglios linfáticos. | |
| N2 | Metástasis en 3 a 6 ganglios linfáticos. | |
| N3 | Metástasis en 7 o más ganglios linfáticos. | |
| N 3 a Metástasis en 7 a 15 ganglios linfáticos. | ||
| N 3 b Metástasis en 16 o más ganglios linfáticos. | ||
| M | Mo M1 | Sin metástasis a distancia. |
| M1 | Metástasis a distancia. | |
| R | Tumor residual post cirugía. | |
| Prefijo | C | Etapificación clínica. |
| Prefijo | P | Etapificación anatomo patológica. |
| Prefijo | Y | Terapia multimodal o neoadyuvancia. |
| Y C : etapificación preoperatoria luego de neoadyuvancia. | ||
| Y P : etapificación después de neoadyuvancia y cirugía. |
En Japón y países asiáticos se ha utilizado un sistema distinto diseòado por la JGCA (Japanese Gastric Cancer Association), con modificaciones recientes que han homologado ambos sistemas, para uniformidad de lenguaje y de información. El lenguaje común tiene la ventaja adicional de permitir la comparación de las experiencias de occidente con la de los países asiáticos, cuyo desarrollo en este tema mantiene liderazgo incuestionable.
Estrategias de Etapificación ClínicaEste aspecto es de fundamental importancia. Si fuera posible définir de manera exacta y segura la extension de la enfermedad, se abriria la posibilidad de planificar el tratamiento para cada paciente en forma individualizada, evitando, en teoria, el tratamiento insuficiente para algunos, o por otro lado, evitando la cirugía excesiva y/o innecesaria (18). Sin embargo, y pesé a la variedad de recursos de etapificación disponibles actualmente no existe un sistema infalible, por lo que se hace recomendable trabajar de acuerdo a protocolos de estudio y tomar las mejores decisiones para cada paciente en un comité multidisciplinario. Los recursos disponibles incluyen la ecotomografia, la tomografia computada, la resonancia nuclear, la Tomografia Emisora de Positrones (PET o PET CT), la endosonografia y la laparoscopia. Este orden va también de menor a mayor en términos de complejidad y también de costo, pero no siempre de rendimiento.
En nuestra experiencia, ya la endoscopía experta proporciona una adecuada información relativa al avance y a la resecabilidad del tumor. Nuestro hábito es complementar el estudio con una Tomografia Computada de Torax, Abdomen y Pelvis. Ambos estudios (el endoscópico y el tomográfico) ofrecen en conjunto resultados de suficiente especificidad y sensibilidad como para iniciar la planificación terapéutica. La endosonografia es complementaria y de uso selectivo, con especia índicación en el estudio de un tumor en etapa incipiente o T1, donde permite asegurar mejor esta condición, la profundidad de la Invasión (mucosa o submucosa), y sugerir la presencia o ausencia de metástasis ganglionares linfáticas, lo que es determinante en la selección del mejor tratamiento. En el gran tumor pierde algo de especificidad.
A estos recursos se ha agregado el PET CT. Su limitación en el CG es que una buena proporción de estos tumores, en particular los de tipo difuso no captan el metabolito (tumores no ávidos) por lo que su uso es selectivo, sin perjuicio de que en el diagnóstico de recurrencias o de metástasis a distancia puede ser definitorio (19).
La indicación de resonancia nuclear también debe hacerse caso a caso. Puede contribuir al diagnóstico diferenciál de un nódulo retroperitonea o peripancreático o hepático o ante la sospecha de recurrencias de esta localización.
El uso de la laparoscopia también ha sido objeto de discusión y muestra especial utilidad en el diagnóstico de la carcinomatosis localizada no visible con otras técnicas (al igual que en el cancer de pancreas). En el protocolo de estudio de los pacientes candidates a neoadyuvancia también demuestra utilidad y debiera ser parte de su estudio, permitiendo la toma de muestras para estudio citológico del peritoneo, cuya positividad es de alto valor pronóstico. Sin embargo, en nuestro centra la indicación de la laparoscopía ha evolucionado progresivamente sustituyendo la cirugía abierta incluso para los cánceres avanzados, por lo que su uso debe evaluarse en este nuevo contexte de indicación terapéutka más que de estudio.
TratamientoHasta hace alrededor de dos décadas el tratamiento estándar para esta enfermedad era la resección quirúrgica en pacientes que no tuvieran contraindicaciones. Hoy se dispone de nuevas y variadas alternativas, que como se ha mencionado, son de análisis y decisión multidisciplinaria para cada caso en particular. El objetivo buscado es la erradicación compléta de la enfermedad o tratamiento curativo ante la enfermedad localizada. La forma en que este objetivo se puede cumplir dépende del grado de avance o estadio del CG al momente del diagnóstico. Por otra parte, hay pacientes de edad avanzada y/o con comorbilidades graves, en quienes la indicación de un procedimiento mayor o incluso de un eventual tratamiento no quirúrgico, con quimio o radioterapia, esta fuera de alcance. Ocasionalmente estas patologías pueden compensarse y acercar al paciente al tratamiento necesario. Si el tumor ha comprometido el estado general y nutritivo del paciente también es posible hoy la recuperación de sus condiciones generales para procéder al tratamiento con menos riesgo.
El otro factor determinante es el estadio clínico de la enfermedad, mencionado anteriormente. Dependiendo de este, se elabora el plan terapéutko y existen incluso nomogramas que son capaces de predecir el pronóstico para cada caso (20), aun cuando el sistema TNM ya ofrece una aproximación valiosa.
Tratamiento EndoscópicoPara tumores con Invasión limitada a la mucosa, de preferencia del tipo intestinal bien diferenciado el tratamiento endoscópico adecuadamente indicado ofrece excelentes resultados. En la actualidad la técnica de elección es la Disección Submucosa Endoscópica (DSE) cuyas indicaciones se presentan en la tabla 6. Esta técnica ha desplazado prácticamente a la resección mucosa y permite la resección compléta del tumor, lo que se debe confirmar mediante un estudio anátomo patológico completo de la pieza. En caso de compromiso de alguno de los bordes o de compromiso en profundidad debe procederse en segunda instancia a la resecciôn quirurgica, dado que el riesgo de recurrencia o de metástasis ganglionares linfáticas que comprometan el carácter curativo o R0 del tratamiento es alto. De igua manera, este tratamiento obliga al seguimiento endoscópico periódico para el diagnóstico oportuno de un segundo primario en el estómago o una recurrencia (21). En todo caso, si se respetan las indicaciones y el seguimiento, los resultados para estes pacientes no difieren de los de la cirugía abierta y se élimina el riesgo propio de una cirugía mayor. Esta alternativa ya está presente en nuestro país con resultados alentadores y experiencia creciente (22).
Criterios para el tratamiento endoscópico del cáncer gástrico
| 1. Tumor T1 a (compromiso de mucosa). |
| 2. Tumor diferenciado. |
| 3. Tumor no ulcerado. |
| 4. Diámetro menor de 2 cms. |
| Criterios extendidos |
| 5. Tumor diferenciado, no ulcerado, mayor de 2 cms. |
| 6. Tumor diferenciado, ulcerado y menor a 3 cms. |
| 7. Indiferenciado, no ulcerado y menor de 2 cms. |
El tratamiento quirúrgico-resección del tumor y del territorio linfático potencialmente comprometido sigue siendo la única alternativa terapéutka capaz de curar al paciente, y en lo posible debe hacerse siempre con este objetivo, buscando la cirugía R0 (sin tumor residual) (17,18). La cirugia que no consigue este objetivo se cataloga como R1 o R2 pasando a ser de carácter paliativo con recurrencia prácticamente asegurada en el tiempo.
La resección gástrica se ajusta a la localización del tumor en el estómago: para tumores distales (antra o mitad distal del cuerpo), la operación de preferencia continúa siendo la gastrectomía subtotal distal, siempre que se asegure un borde proximal negativo para tumor. Para esto se recurre a la biopsia contemporánea. En algunos casos de cáncer difuso, generalmente en pacientes jóvenes, la indicación de gastrectomía total es necesaria de entrada. Esto se debe a que asegurar un margen negativo puede ser imposible aun con biopsia intraoperatoria. Nuestra preferencia para la reconstrucción del tránsito en la gastrectomía subtotal es la gastroyeyunostomía, que también puede hacerse con asa desfuncionalizada (en Y de Roux) con excelentes resultados funcionales. En la gastrectomía total mantiene plena vigencia la esófago-yeyunostomía en asa desfuncionalizada en Y de Roux, aun cuando existe una variedad de técnicas para este propósito que son de preferencia del cirujano o del protocolo de trabajo de cada centra. El atractivo de la técnica en Y de Roux es su simpleza.
El éxito del tratamiento quirúrgico dépende además de la extirpación de los ganglios linfáticos potencialmente comprometidos por tumor (metástasis ganglionares linfáticas) (23, 24). Junto a la profundidad de la Invasión tumoral, el compromiso linfático es determinante del pronóstico del paciente. Existe controversia en la magnitud de la disección ganglionar que debe hacerse y comprobar su beneficio en occidente ha sido difícil (25, 26). En Japón la disección compléta de la segunda barrera (D2) es rutinaria y se denomina “gastrectomía estándar” (23). En occidente este procedimiento se ha establecido progresivamente (26-28) y su uso se ha generalizado en nuestro pais. En todo caso, hoy existe consenso que la pancreatectomía y/o la esplenectomía asociadas, que antiguamente eran rutinarias, se indican solo ante la invasión directa de esos órganos y ya no como parte de la disección ganglionar (23). En tumores incipientes (T1b) se puede restringir la disección a los ganglios perigástricos y a los de la arteria gástrica izquierda, hepática y tronco celíaco (D1 +) (24) sin comprometer el pronóstico del paciente. En tumores más avanzados operados con intención curativa, como se mencionó, la disección hasta la segunda barrera (D2) se ha transformado en el procedimiento habitual. Se ha demostrado además que disecciones más extensas tipo D3 (territorio retroperitoneal, periaórtico) no se asocian con una mejor sobrevida por lo que su uso no está recomendado (29). La resección R0 (sin residuo tumoral) es otro factor pronóstico determinante y debe buscarse siempre que sea posible. Para tumores de etapas intermedias (T2 y 3), con cirugía R0, la sobrevida alcanza a cifras que fluctúan entre el 30 y hasta 50% a 5 años, dependiendo de diversos factures. Los protocolos de tratamiento complementario buscan mejorar estas cifras.
El tratamiento quirúrgico puede hacerse por via clásica o laparoscópica, incluso para el cáncer avanzado, como se ha demostrado en el extranjeroy también en Chile (30, 31), lo que está promoviendo un uso progresivo de esta vía. Se ha visto que la técnica laparoscópica favorece la disección ganglionar por la excelente exposición retroperitoneal que se obtiene y por la disección metódica y hemostática que se consigue con los recursos actuales. Es posible que en el futuro esta pase a ser la vía habituai para tratar estos tumores. Para su uso, se requière del entrenamiento necesario, con su curva de aprendizaje, que se obtiene en centros con alto volumen de cirugía laparoscópica. Probablemente también sea aconsejable iniciar la experiencia con casos de estadios más bajos, como aquellos casos de cáncer incipiente no tratables por vía endoscópica o para aquellos en que el tumor no compromete la serosa. El obstáculo mayor está dado por tumores avanzados con sospecha de compromiso esofágico o aquellos que Megan hasta el piloro. Para estos casos, hay que asegurar bordes negativos y no comprometer por esta razón el carácter R0 de esta operación. Las anastomosis se pueden hacer según sea la experiencia y preferencia del cirujano con sutura manual o mecánica. Existe evidencia de que por esta vía se reduce el dolor, se acelera la recuperación y no se compromete la sobrevida.
En Japón, la mortalidad operatoria está bajo el 1% (16) y en nuestro país bajo el 4% (32). Es claro que ha habido progreso, pero tanto estas como las cifras de morbilidad obligan aun a buscar mejores resultados. La dehiscencia de sutura se mantiene como complicación grave, pero afortunadamente los recursos disponibles en la actualidad permiten su tratamiento y la recuperación del paciente en la mayoría de los casos de modo que su impacto directe como causa de mortalidad ha disminuido.
Tratamiento Adyuvante o NeoadyuvanteLa evidencia actual indica que los resultados obtenidos con la cirugía en términos de curación y sobrevida se benefician si se incorporan al tratamiento protocolos de adyuvancia o de neo adyuvancia. Una revisión reciente publicada en esta misma revista (33) presenta un resumen de los criterios de trabajo en plena vigencia y un adecuado algoritmo de manejo que nosotros compartimos. En todo caso, la decisión frente al paciente en particular se debe tomar en comité multidisciplinario, lo que abre sitio para distintos protocolos cuyos resultados deben estar en permanente revisión. A manera de ejemplo, en Japón, la adyuvancia con S1, agente que se administra por via oral es de uso habituai (33), con resultados que no se han podido reproducir en Occidente, donde se privilegian esquemas con combinación de drogas. La neoadyuvancia tiene por objeto reducir en el preoperatorio la carga tumoral, especialmente ante la evidencia de metástasis linfáticas o de tumores avanzados, con compromiso de serosa, facilitando así la operación de carácter R0 y puede, según protocolo, complementarse con quimioterapia en el postoperatorio. Hay casos de respuesta patológica completa, como uno publicado recientemente (34), que aun cuando son infrecuentes alientan en la exploración de nuevas alternativas y sobre todo en la busqueda de factures capaces de predecir las probabilidades de mayor o menor respuesta. En este aspecto de gran importancia para evitar el riesgo del tratamiento inútil se ha utilizado el PET CT, con las limitaciones que este présenta en el CG (19). Aquel paciente con un tumor avanzado, resecado, también puede beneficiarse con quimioterapia o con una combinación de quimio y radioterapia para lo cual existe hoy buena evidencia (35-37). Sin embargo, la indicación de estos tratamientos no debe hacerse a costa de sacrificar la calidad de la cirugía como ha sido criticado en algunos trabajos (36).
En síntesis, los tumores de menor estadió son de indicación primaria de resección, y eventual adyuvancia postoperatoria según los hallazgos de anatomía patológica, en tanto que aquellos de estadio más avanzado especialmente si hay evidencia preoperatoria de compromiso ganglionar linfático se tratan con distintos esquemas de neoadyuvancia para aumentar la probabilidad de una resección de tipo RO (35-37) seguidos de cirugía.
Tratamiento PaliativoEsta modalidad tiene por objeto paliar o atenuar los síntomas en patentes incurables o fuera de alcance terapéutico. En ocasiones esto ocurre porque la edad del paciente, sus condiciones generales o sus co-morbilidades impiden cualquier acción terapéutica de intención curativa. Hoy en dia no existen limites fijos de edad para contraindicar la cirugía. En esta decision influye mas la condición del paciente que su edad cronológica.
Así también es de importancia central la voluntad que el paciente manifieste luego de ser informado de su enfermedad. El tratante debe complementar los conocimientos técnicos con el reconocimiento de la situación que está viviendo el paciente con su familia.
En otras oportunidades la decisión de paliación pasa por la enfermedad diseminada al peritoneo o a otros órganos. Nuevamente debe considerate el potenciál beneficio de alguna terapia contra el détériora en la calidad de vida que esta puede significar. La información no sesgada contribuye a facilitar la decision.
En ocasiones la paliación consiste en aliviar una obstrucción o un sangrado para lo cual existen recursos que deben indicarse caso a caso y que pueden incluir una intervención quirúrgica sin pretension curativa, lamada a veces de aseo. Su buena indicación puede prolongary aliviar la sobrevida.
En los grupos de manejo multidisciplinario se incluye hoy en día a especialistas en el manejo del dolor, a oncólogos geriatras y médicos generales que actuando en conjunto tienen la responsabilidad del mejor manejo médico para la paliación en estos pacientes.
Los autores dedaran no tener conflictos de interés, con relación a este artículo.