El cáncer de piel no-melanoma incluye principalmente las neoplasias queratinocíticas (carcinoma basocelular y espinocelular) y tumores de menor frecuencia tales como: linfomas cutáneos, carcinoma de células de Merkel, sarcoma de Kaposi, angiosarcomas, enfermedad de Paget, e histiocistomas malignos entre otros. En este artículo revisaremos la epidemiología, patogénesis, clínica, histopatología, diagnóstico y modalidades terapéuticas de los dos principales cánceres de la piel no melanoma: basocelular y espinocelular.
The non-melanoma skin cancer refers mainly to the queratinocitic neoplasias (basal cell carcinoma and spinous cell carcinoma) and less frequently tumours like: lymphomas, Merkel cell carcinoma, Kaposi’s Sarcoma, angio sarcomas, Paget disease and malignant hystiocitomas. In this article we will review the epidemiology, pathogenesis, clinical picture, histopathology, diagnosis and treatment of the two more frequent non-melanoma skin cancers: basal cell carcinoma and squamous cell carcinoma.
Es el cáncer más común en seres humanos. En EE.UU. cerca de 1.200.000 casos de cáncer no-melanoma son diagnosticados anualmente, de los cuales el 80% corresponde a CB (1). Es un cáncer que, aunque generalmente no da metástasis, causa una morbilidad significativa, especialmente si no es diagnosticado y tratado en forma adecuada y oportuna (2).
EpidemiologíaEl cáncer más común diagnosticado en caucásicos. No tiene predilección por sexo y se relaciona con la exposición al sol. Australia es el país con la más alta incidencia anual con promedios de 1 a 2% por año (3) y su incidencia ha ido en aumento tanto en Europa como EE.UU., especialmente en el adulto joven, en relación a los hábitos de exposición al sol. En Chile existen pocos estudios de prevalencia. En el Registro poblacional del cáncer en la provincia de Valdivia, el cáncer de la piel es el 3ero en orden de frecuencia, siendo un poco mayor en el sexo femenino: 55%, apareciendo casos aislados antes de los 30 años, aumentando desde los 40 años, alcanzando a los 70 años tasas de 119 x 100.000 en mujeres y 141 x 100.000 en hombres. El CB constituye el 60% de los diagnósticos (4).
PatogénesisEl factor más común involucrado en el desarrollo del CB es la exposición a la luz ultravioleta, especialmente en aquellas personas de piel tipos I y II (que se queman fácilmente y prácticamente no se broncean) y que viven más cerca de la línea de Ecuador (5-7). La exposición a otras fuentes de radiación ultravioleta como camas solares y tratamientos médicos con luz UV, son factores que aumentan el riesgo. La exposición al sol puede actuar tanto en forma de daño acumulativo, como de exposición intermitente. El daño al ADN de la célula, producido por dicha exposición y la inhabilidad para repararlo, explicarían la aparición de algunos carcinomas basocelulares (8, 9). Además, la luz UV puede producir mutaciones en genes de supresión tumoral, especialmente p53, que prevendría la muerte de las células dañadas, favoreciendo su propagación (10, 11). Alteraciones en el gen de supresión tumoral PTCH, localizado en el brazo largo del cromosoma 9, se asocia a CB esporádico y está también presente en pacientes con el Síndrome del Nevus Basocelular. Se ha encontrado que las alteraciones en la expresión genética en el cáncer no-melanoma es muy variable y las alteraciones en genes relacionados con enzimas, funciones estructurales y moléculas de adhesión son más constantes en la mayoría de los tumores lo que abre un camino de investigación en las vías metabólicas relacionados con ellos, para lograr tratamientos que funcionen en la gran mayoría (12). Otros factores ambientales que favorecen la aparición de CB son las radiaciones ionizantes (13), la exposición a arsénico (14) y el uso de mostaza nitrogenada tópica. El CB también puede, ocasionalmente, aparecer en cicatrices y en nevus sebáceos (15, 16).
HistogénesisVarias teorías han sido propuestas para explicar su origen: a partir de células basales de la epidermis, del infundíbulo o de la vaina externa del folículo piloso, células germinales epiteliales dormidas, células epiteliales pluripotenciales de la capa basal que persisten a través de la vida, células de la unidad piloseáacea y células de otros anexos de la piel (17, 18). Esto puede explicarse por la variedad histológica y el sitio anatómico de las muestras tomadas. Lo más observado desde el punto de vista histopatológico, es el origen a partir de la epidermis y el folículo pilosebáceo. Algunos autores sugieren que tanto el CB como el espinocelular, compartirían un mismo origen a partir de una celular epitelial pluripotencial y factores del estroma participarían en su ulterior diferenciación (19).
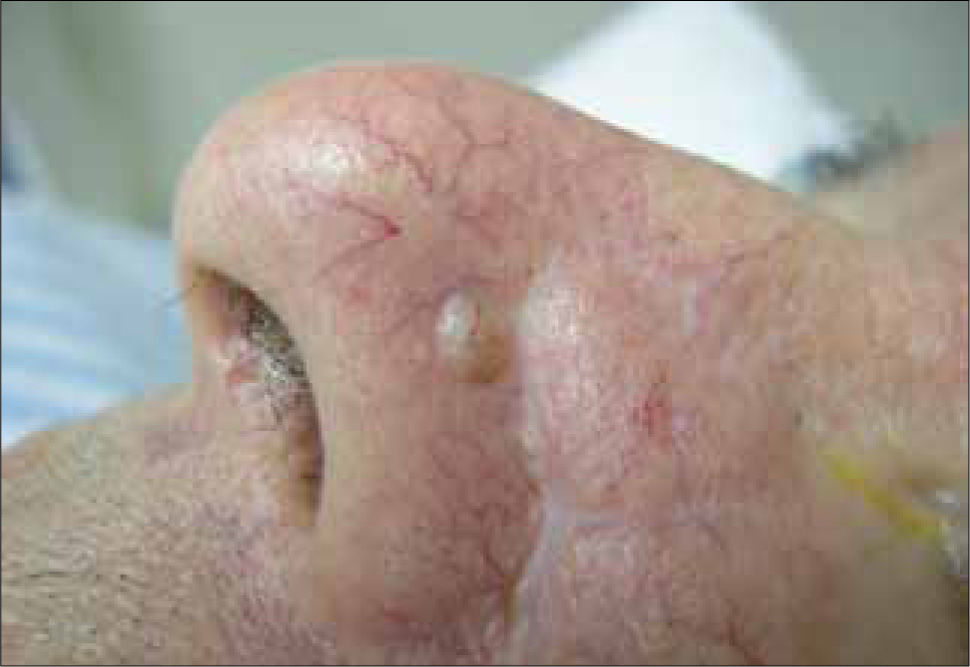
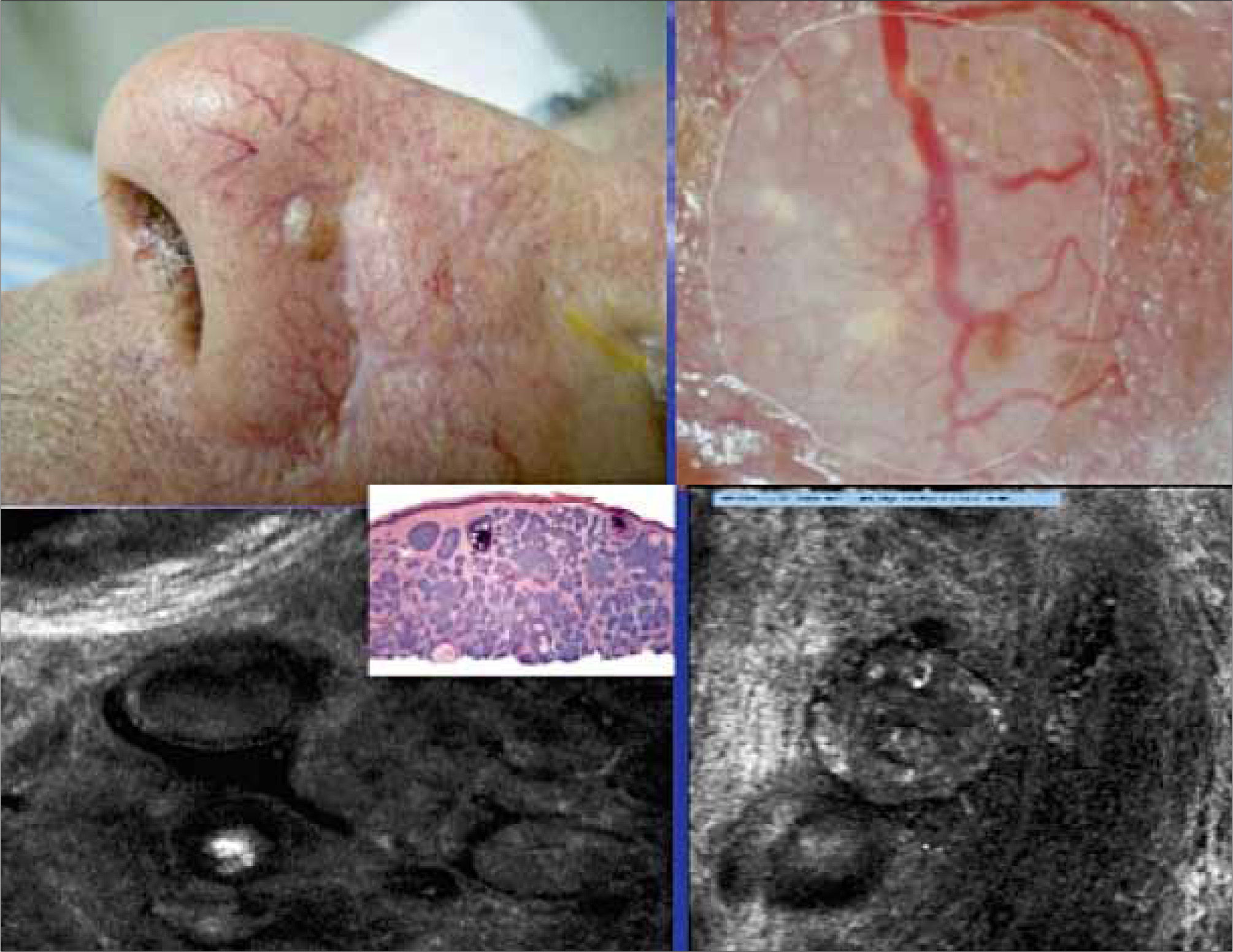
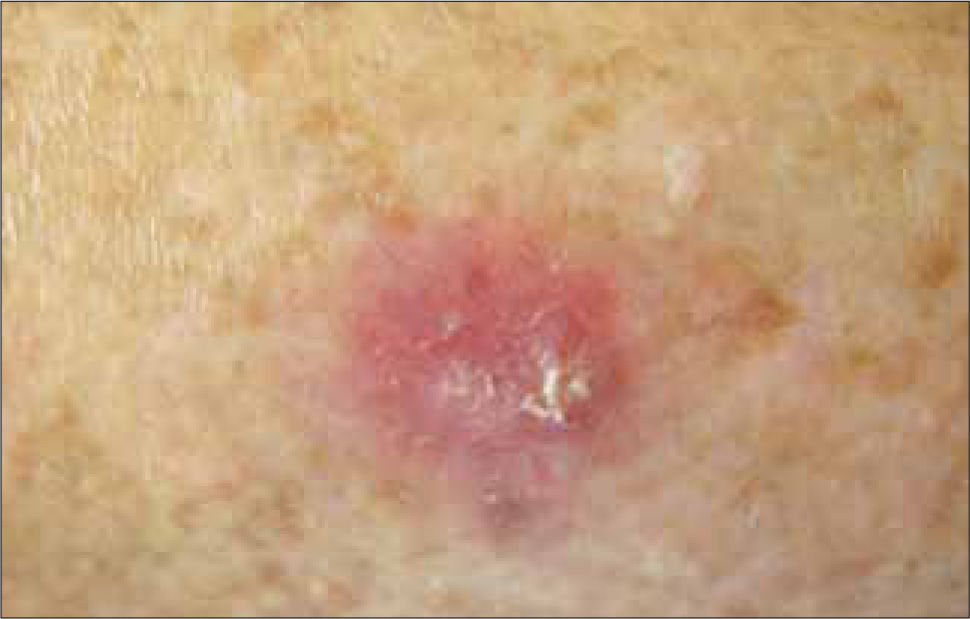
Variantes clínicas1) Nodular: la más común y responsable del 60% de los carcinomas basocelulares primarios. Consiste en un nódulo eritematoso o rosado bien definido, con una apariencia translúcida y cubierto de telangiectasias, que a medida que crece puede llegar a ulcerarse (Figura 1). La presencia de melanina en su superficie le puede dar una tonalidad café o negra, que lleva a confundirlo con una lesión melanocítica. Si bien es de crecimiento lento, dejado su libre evolución puede alcanzar grandes tamaños y una gran profundidad, destruyendo planos adyacentes (nariz, párpados, órbita, etc).
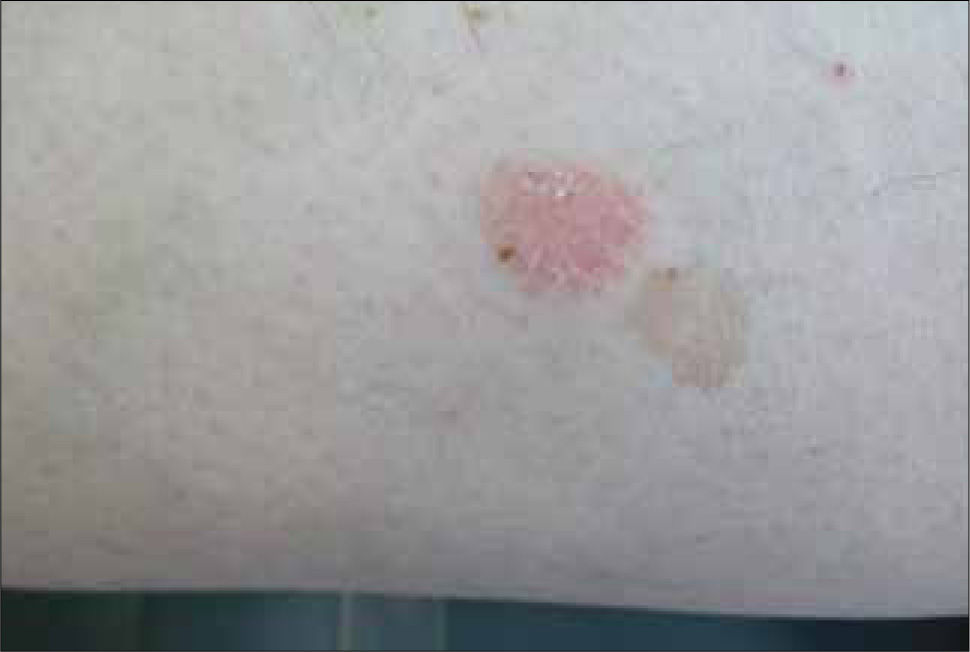
2) Superficial (multicéntrico): es una variante común, más frecuente en el tronco y las extremidades, aunque también puede comprometer cabeza y cuello. Se presenta como una mácula eritematosa o roja, a veces con una escama superficial que orienta hacia una placa de eccema o psoriasis (Figura 2). Puede presentar áreas de regresión espontánea, caracterizadas por atrofia e hipopigmentación, como también zonas con pigmentación, que pueden llevar a confusión con una lesión melanocítica. A pesar de que su crecimiento suele ser en el plano horizontal, a través del tiempo puede hacerse infiltrativo y presentarse como una zona indurada, susceptible de ulcerarse y formar un nódulo. Puede presentar extensión lateral subclínica, lo que explicaría la significativa tasa de recurrencia.
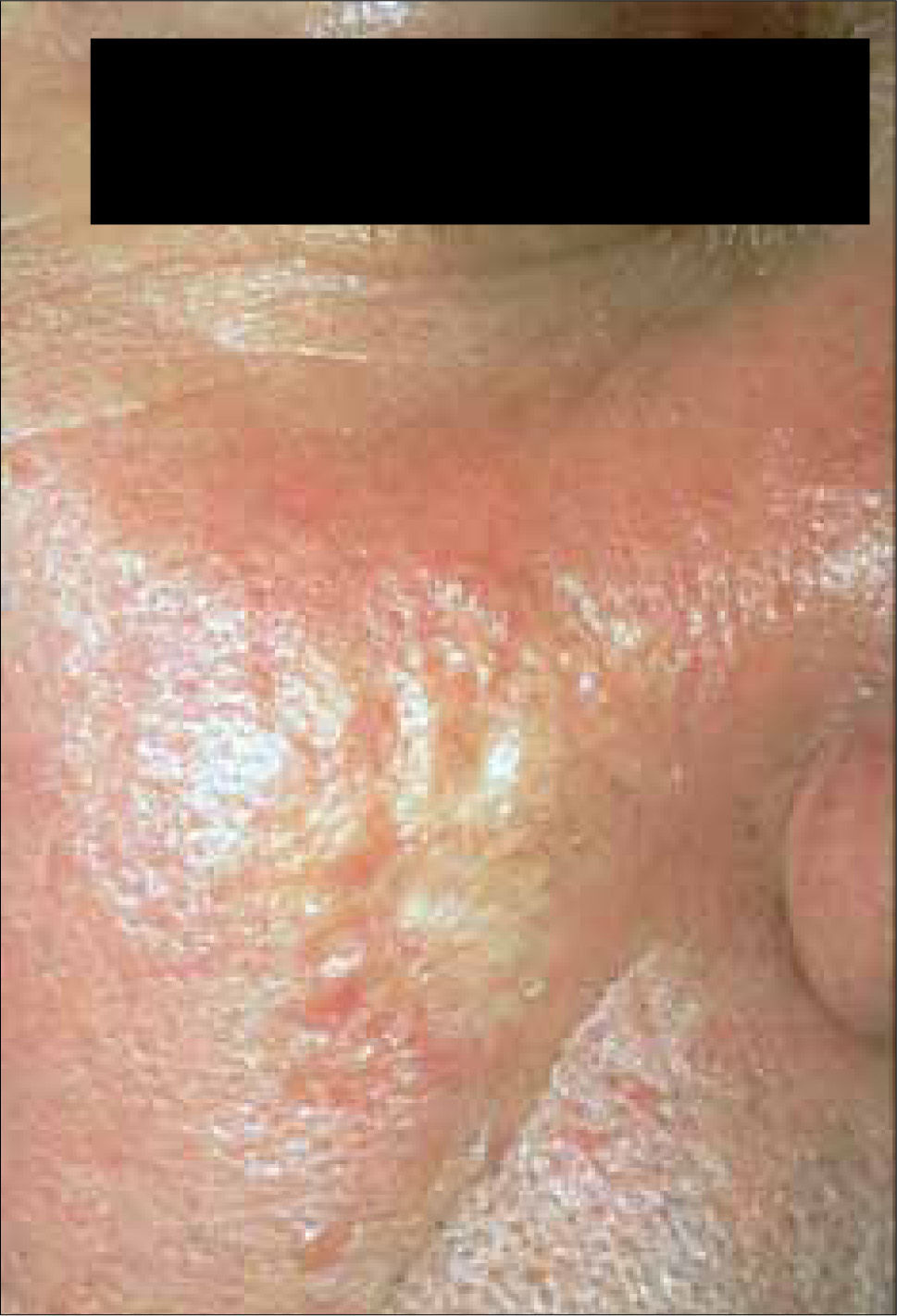
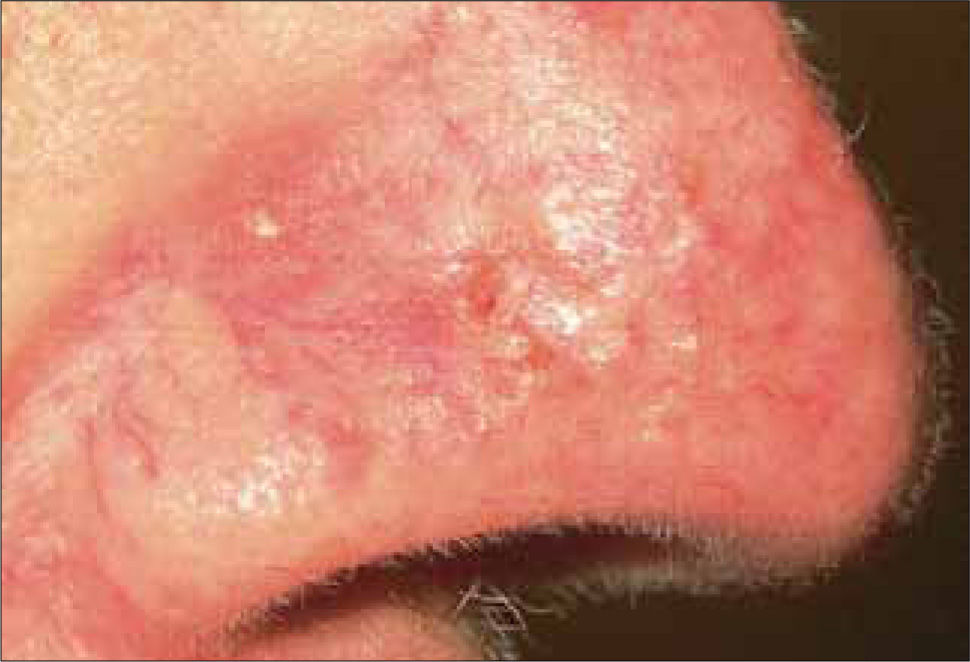
3) Morfeiforme: esta variedad se caracteriza por una placa indurada de color marfil similar a morfea (escleroderma localizada), que puede estar cubierta con telangiectasias (Figura 3). Su tratamiento suele ser difícil, ya que la extensión subclínica característica, dificulta la identificación de los márgenes.
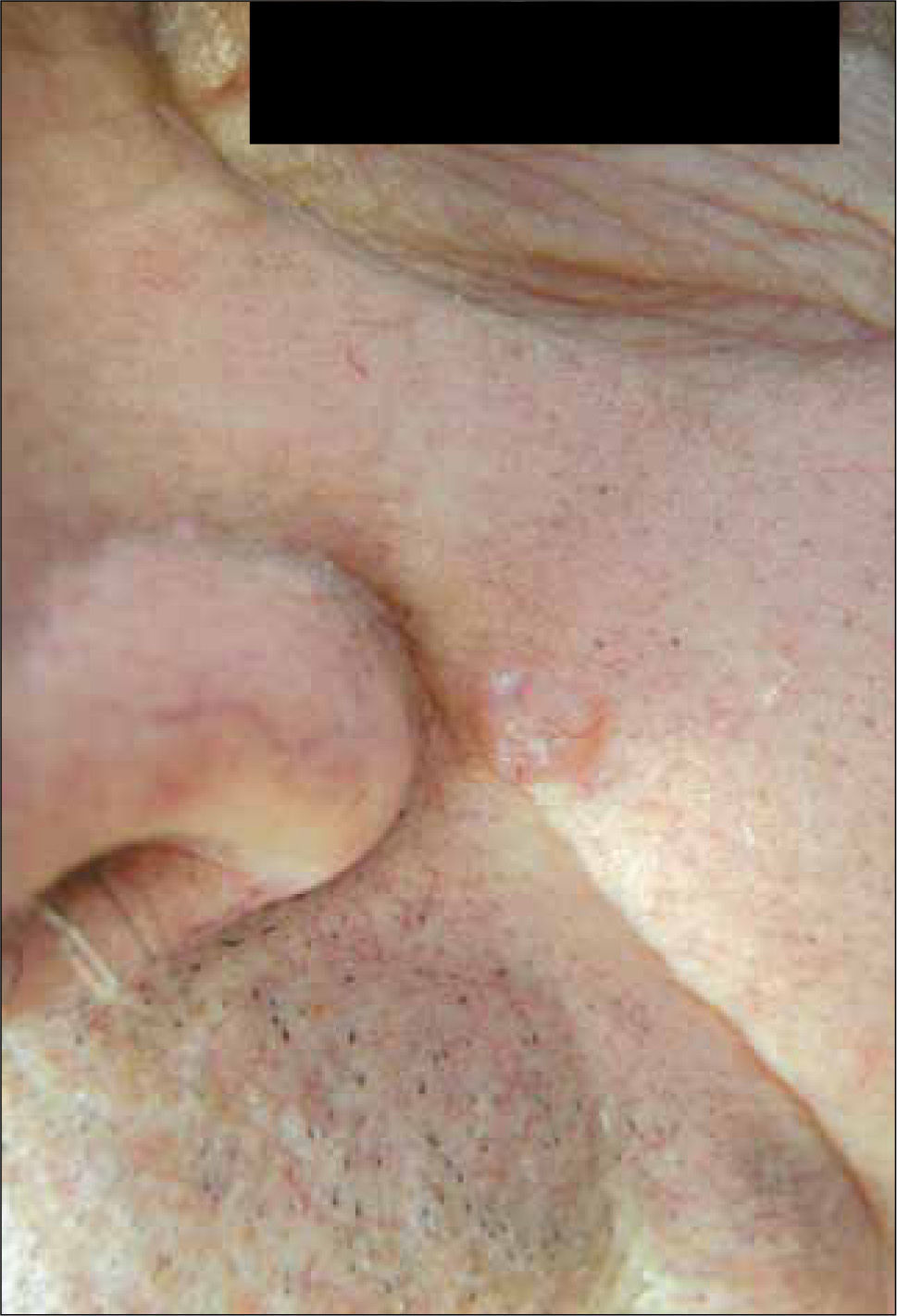
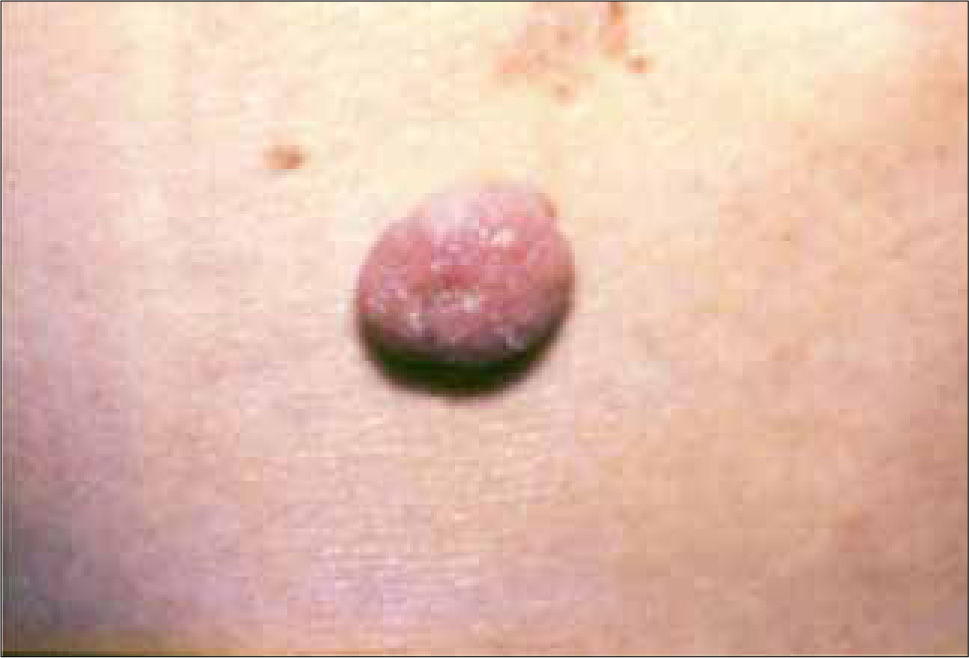
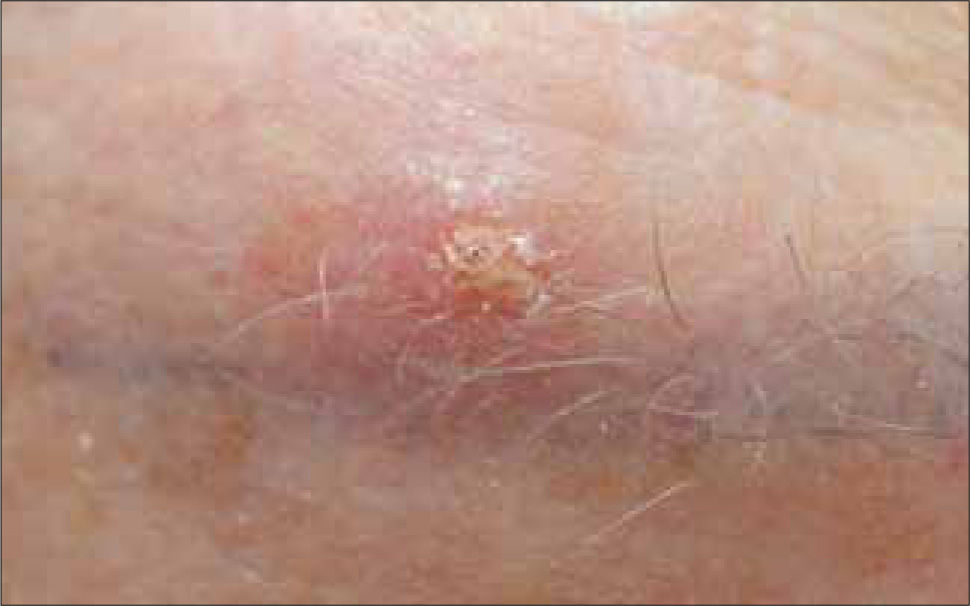
4) Quístico: la degeneración quística de un CB a veces es solo un hallazgo en la histopatología, por lo que clínicamente solo puede tener el aspecto de basocelular nodular o el de una lesión azul grisácea translucida de aspecto quístico, que al puncionarla puede dar salida a un líquido claro (Figura 4) (20).
5) CB con patrón agresivo de crecimiento (infiltrativo o micronodular): se caracteriza por lesiones planas o placas ligeramente elevadas, con límites mal definidos o una placa firme de aspecto morfeiforme (Figura 5). Estos tipos tienen un comportamiento agresivo y destructivo, con diseminación subclínica y alto porcentaje de recurrencia, por lo que su caracterización histopatológica es primordial.
6) Fibroepitelioma de Pinkus: variante muy poco frecuente con características histológicas típicas. Se ubica principalmente en el dorso y clínicamente es una lesión eritematosa nodular de superficie suave y frecuentemente pedunculada, que simula un acrocordon (Figura 6).
HistologíaLa clasificaciones basadas en el patrón de crecimiento, más que en el tipo de diferenciación, suelen ser mas útiles en la planificación del tratamiento y lo dividen en: cirscunscrito representado por la forma nodular y sus variantes (sólido, adenoideo, quístico, pigmentado, etc) o con patrón de crecimiento difuso: superficial, morfeiforme, infiltrativo, micronodular, etc) (21, 22).
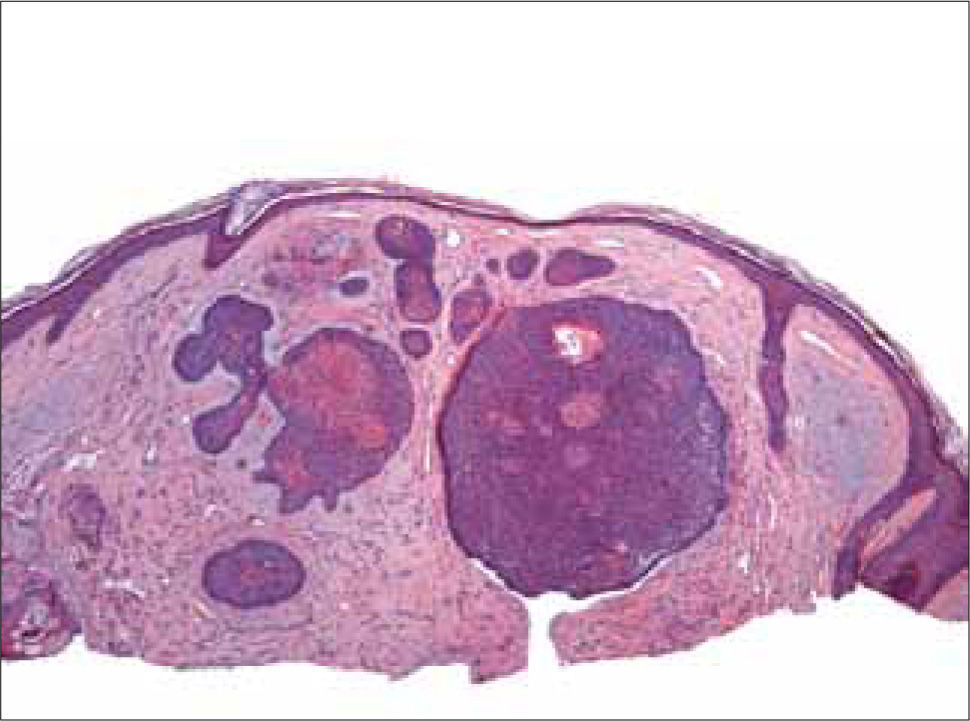
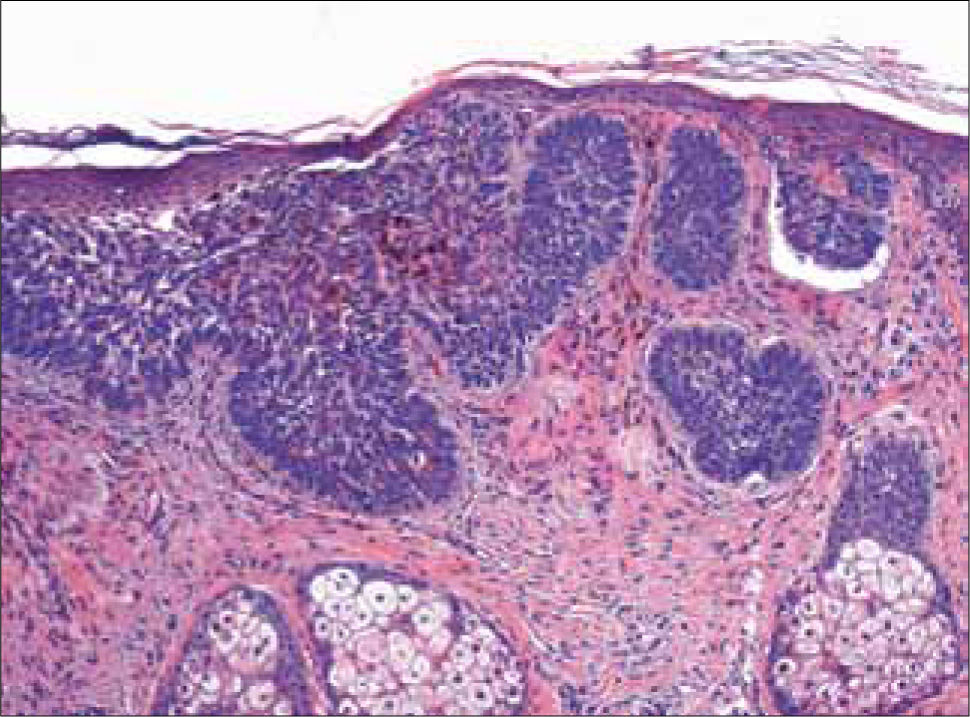
CB circunscrito: el tipo nodular o noduloulcerativo es el más común de los CB y está compuesto por grandes islotes de células basaloides, de forma y tamaño regular y cohesionados entre sí, con un estroma fibrovascular. Los márgenes son convexos y el tumor crece en forma expansiva, con márgenes profundos y laterales bien circunscritos.
Los tipos más frecuentes de la forma cirscunscrita son:
a) Sólido: caracterizado por grandes islotes de células basaloides, sin signos de diferenciación hacia ninguna estructura anexial (Figura 7). Células uniformes en tamaño con grandes núcleos y escaso citoplasma. Las células en la periferia de los islotes, están alineadas en forma paralela formando empalizadas.
b) CB con metaplasia escamosa (basoescamoso, metatípico): algunos CB presentan regiones con características celulares que simulan carcinomas espinocelulares (CE). Se caracterizan por células con características basaloides y escamoides, pero que, a diferencia del CE, retienen su organización típica en CB y su característica proliferación estromal.
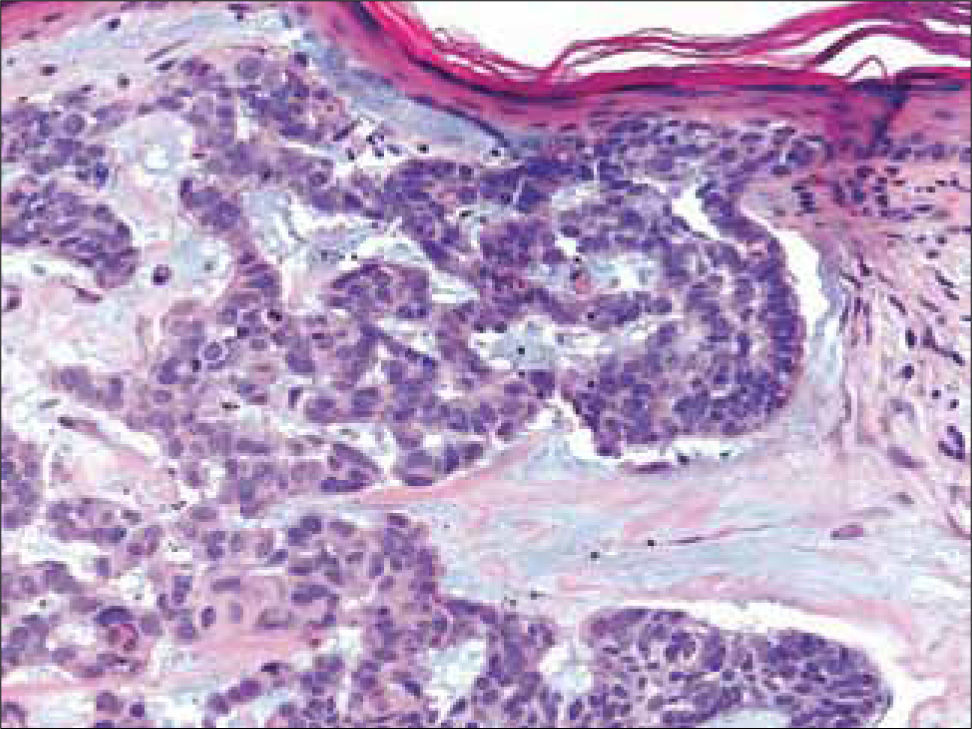
c) CB adenoideo: consiste en bandas finas de células basaloides de diferentes tamaños, rodeadas de un estroma mucinoso (Figura 8). Este atrapamiento de la mucina dentro de los islotes celulares, produce el aspecto de estructuras tubulares o glandulares.
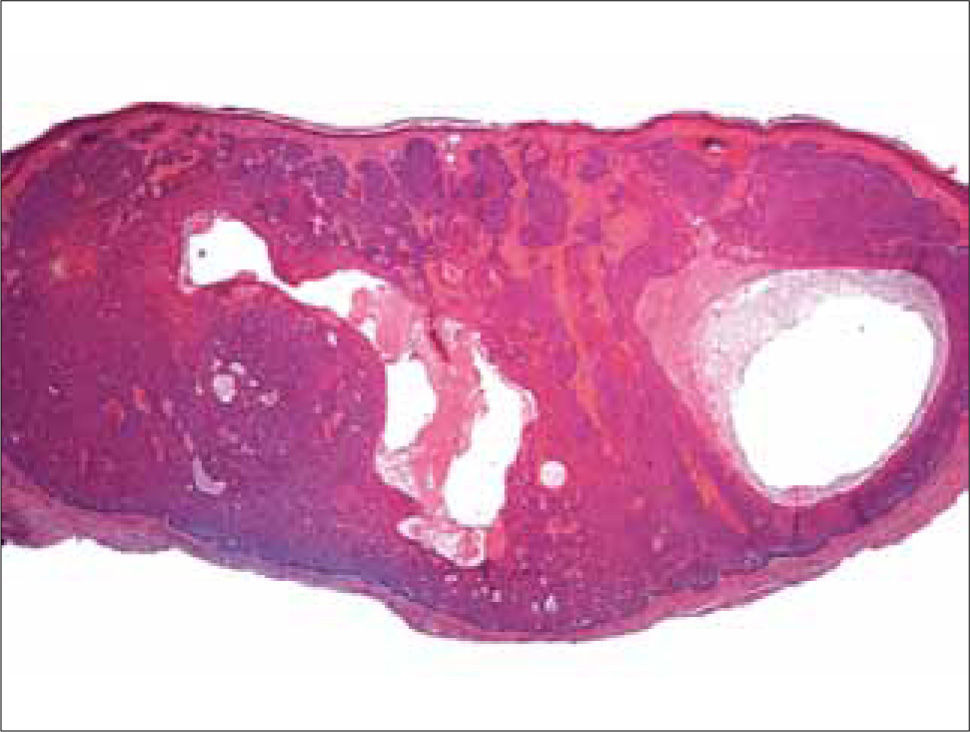
d) CB quístico: son los que presentan una o excepcionalmente más de una gran laguna central, que contiene restos amorfos y células epiteliales acantolíticas parcialmente degeneradas (Figura 9).
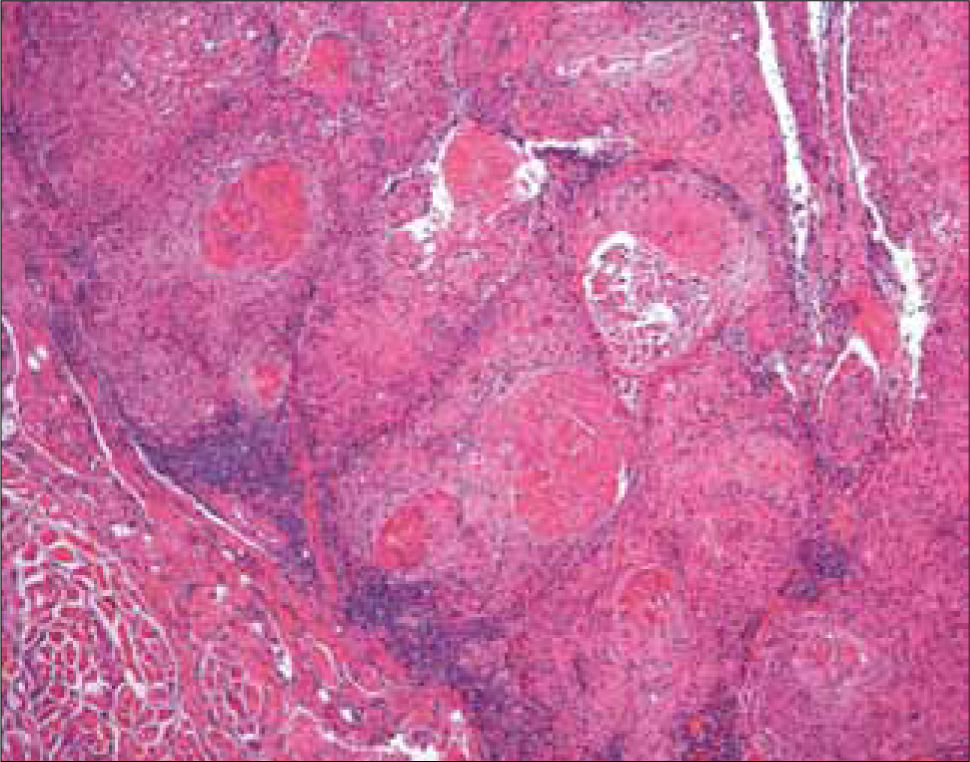
e) CB pigmentado: A pesar de que cualquier CB puede contener cantidades variables de melanina, con la excepción del morfeiforme, la mayoría de los pigmentados son del tipo solido (Figura 10). Los melanocitos se encuentran entre las células basales y las células neoplásicas y contienen cantidades variables de melanina. En el estroma hay numerosos macrófagos, con gran contenido de melanina.
CB con patrón de crecimiento difuso: a diferencia de la variante común nodular que se presenta en forma de pápula redondeada de bordes bien definidos, las lesiones con crecimiento difusa tienden a ser en placas o planas, crecen horizontalmente y tienen bordes mal definidos.
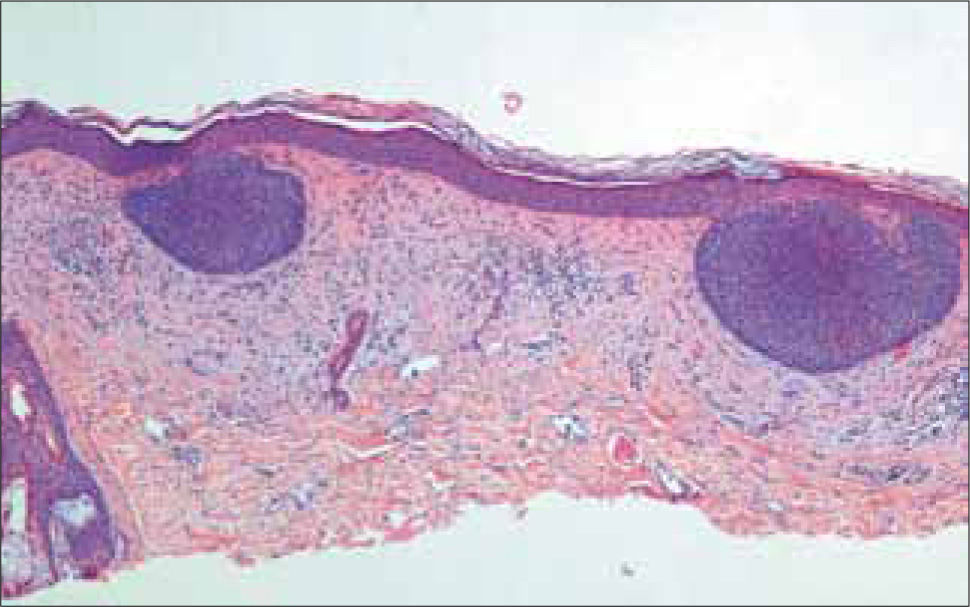
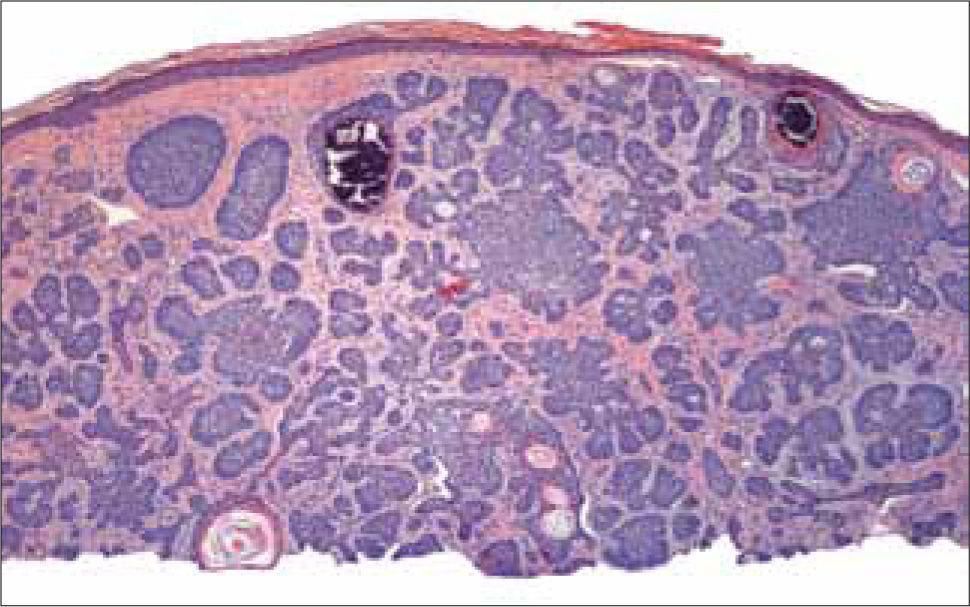
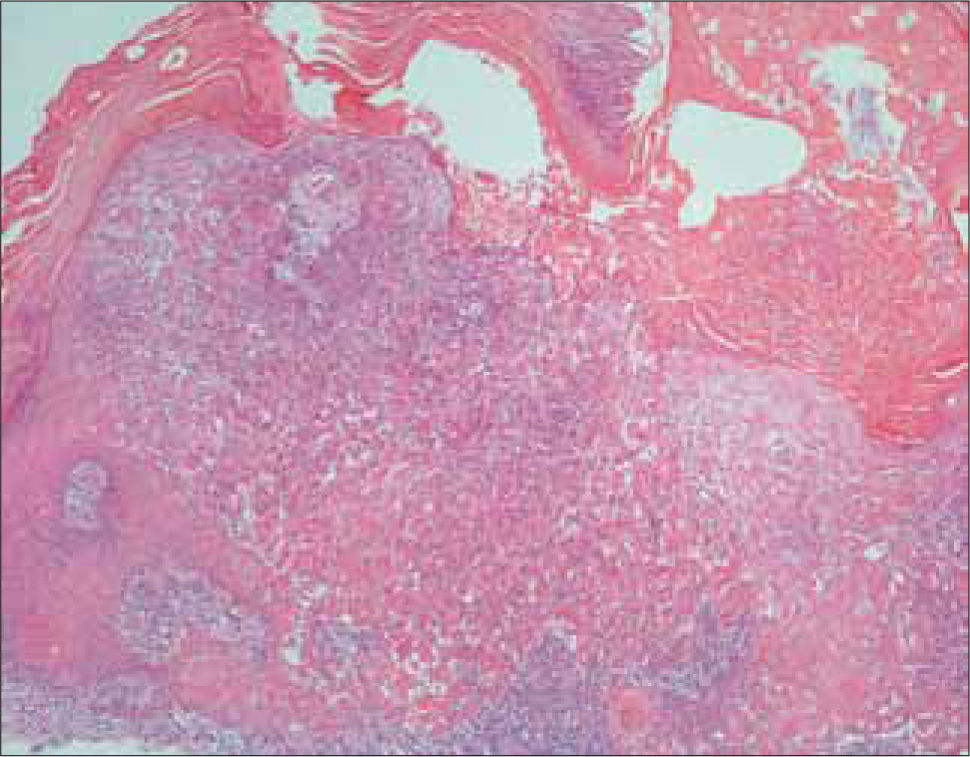
a) CB superficial: consiste en lóbulos de células atípicas basales en el dermis papilar que contienen amplias conexiones con la epidermis, por lo que no hay extensión en profundidad hacia la dermis. Los lóbulos muestran la característica empalizada y están rodeados por un estroma fibrovascular delgado (Figura 11).
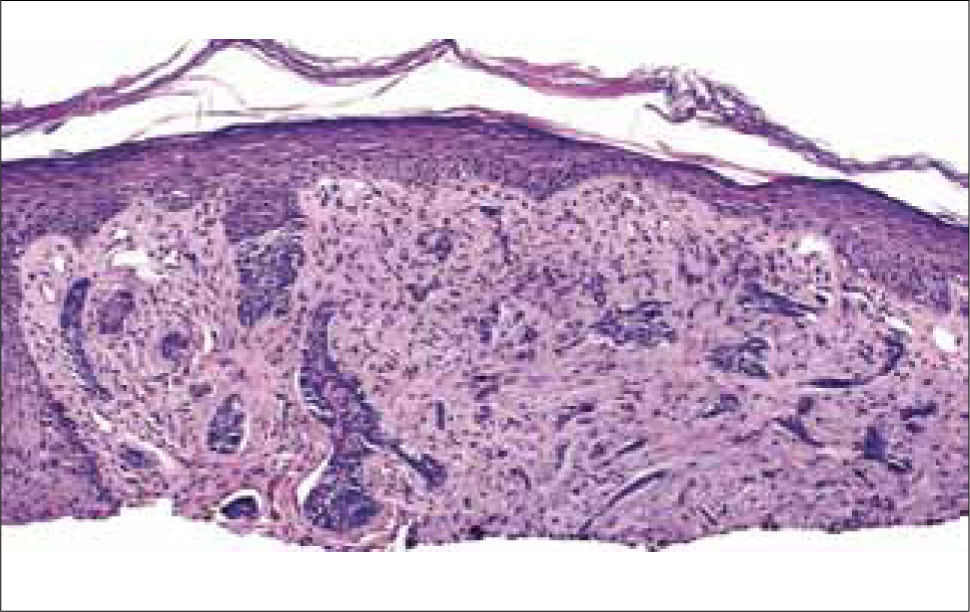
b) CB morfeiforme: son los de mayor dificultad terapéutica, por sus extensiones centrifugas múltiples (en promedio 7mm) lo que dificulta la delimitación clínica de sus márgenes, tanto por inspección como palpación. Contienen un estroma fibroso denso, lo que impide el tratamiento mediante curetaje. Están formados por cordones, hebras y pequeños nidos de células basaloides, embebidas en un estroma denso de haces de colágeno engrosados (Figura 12).
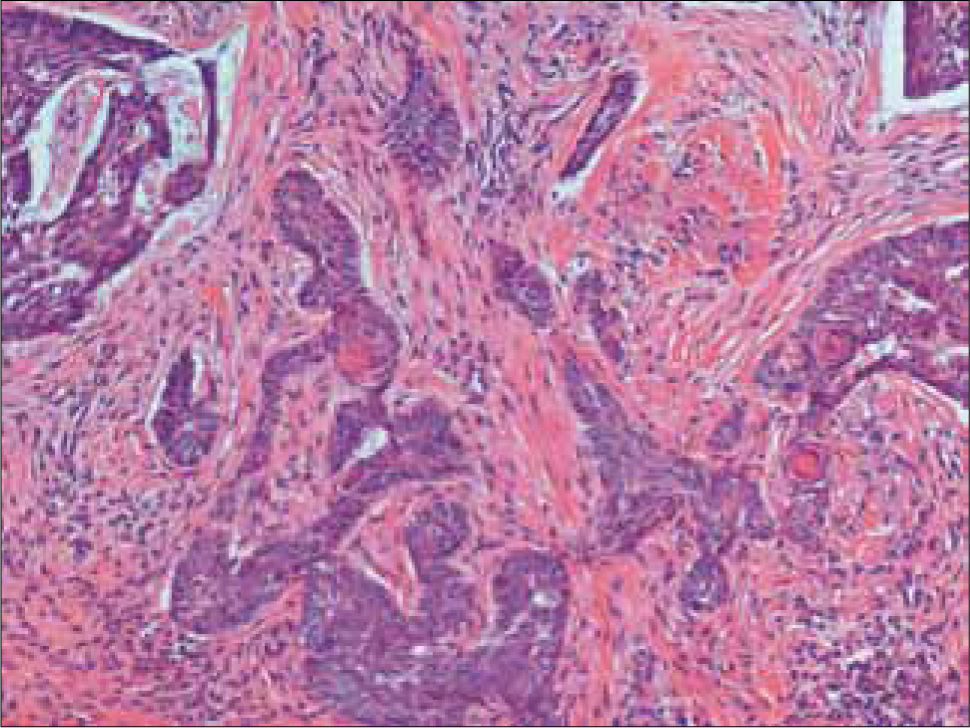
c) CB infiltrante: es un tipo característico, que si no es tratado adecuadamente, sigue un curso agresivo con gran destrucción local. Se caracteriza por islotes elongados y cordones de células atípicas ampliamente separadas, los nidos son angulados y pueden estar orientados perpendicularmente a la superficie. Puede haber empalizada, pero es mínima. A diferencia del morfeiforme que se expande periféricamente, este también lo hace en profundidad (Figura 13).
d) Micronodular: comparte con el anterior su propensión a la dispersión de los nidos de células epiteliales. Esta compuesto de agregados de células basaloides pequeños y redondeados, con fenómeno de empalizada muy bien desarrollado. Son lesiones mal definidas y planas, con capacidad de invadir profundamente (Figura 14).
Comportamiento biológico: una característica esencial de CB es su dependencia del estroma, lo que explicaría su baja capacidad de metastizar (23, 24). Al parecer cambios estromales preceden a la aparición del tumor, así como al ser cultivadas células tumorales en ausencia de su estroma, tienden a diferenciarse hacia queratinocitos formando epidermis normal (25). La lenta velocidad de crecimiento del CB se explicaría porque cursa en ciclos que alternan con fases de regresión (26). Los microfilamentos fundamentales en la motilidad celular y que se encuentran especialmente en los tumores con capacidad de metastizar, son más comunes en las variedades que presentan un patrón de crecimiento agresivo infiltrante (27). La presencia de colagenasa tipo I es característica de las formas nodulares, las variedades más agresivas como las desmoplásicas producen colagenasa tipo IV capaz de permear la membrana basal (28). Las metástasis del CB, aunque muy raras, se producen vía linfática y se diseminan a huesos y pulmones, siendo la cabeza y cuello las zonas de origen mas frecuentes. Ocurren principalmente en tumores ulcerados, resistentes al tratamiento, de gran tamaño y larga evolución, encontrándose principalmente en las variantes adenoidea y metatípica. El crecimiento del CB habitualmente sigue el patrón de menor resistencia, especialmente los planos embriológicos de fusión (canto interno, surco nasolabial, filtrum, parte media del labio inferior y mentón, área pre-auricular y surco retroauricular) que se consideran zonas de alto riesgo (29, 30). Cuando alcanzan estos planos, pueden diseminarse en forma extensa, especialmente cuando alcanzan superficies óseas (orbita, hueso nasal y cartílago, hueso temporal) (31, 32).
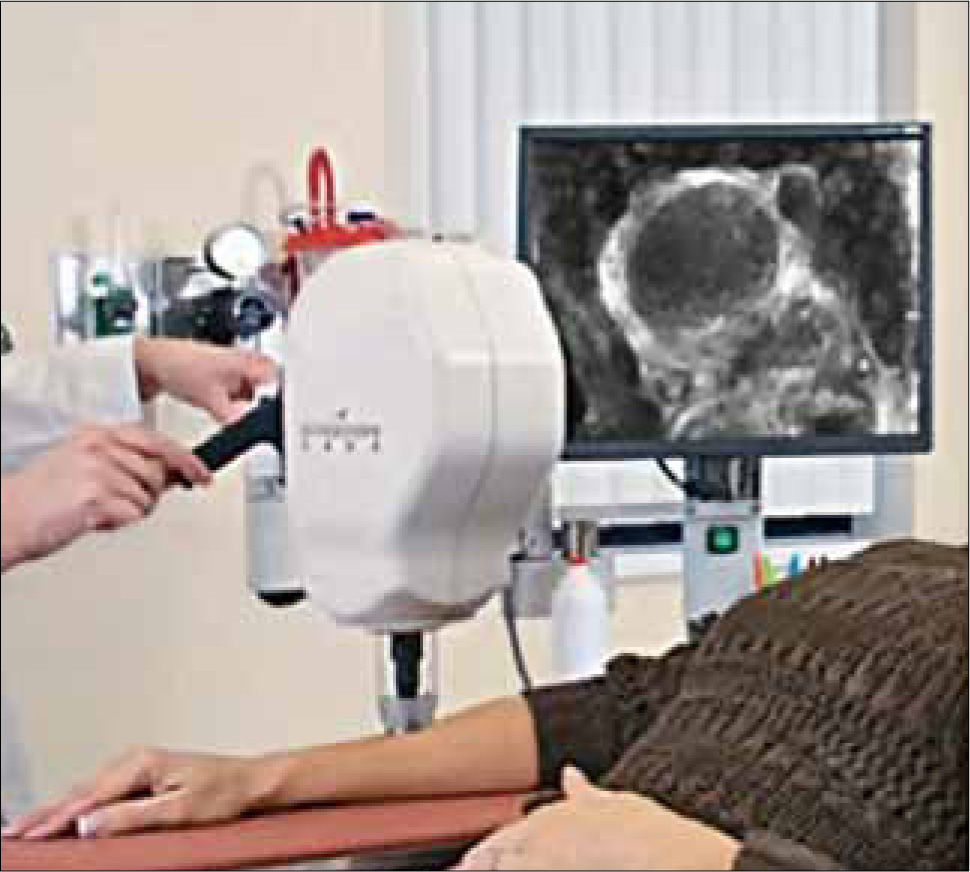
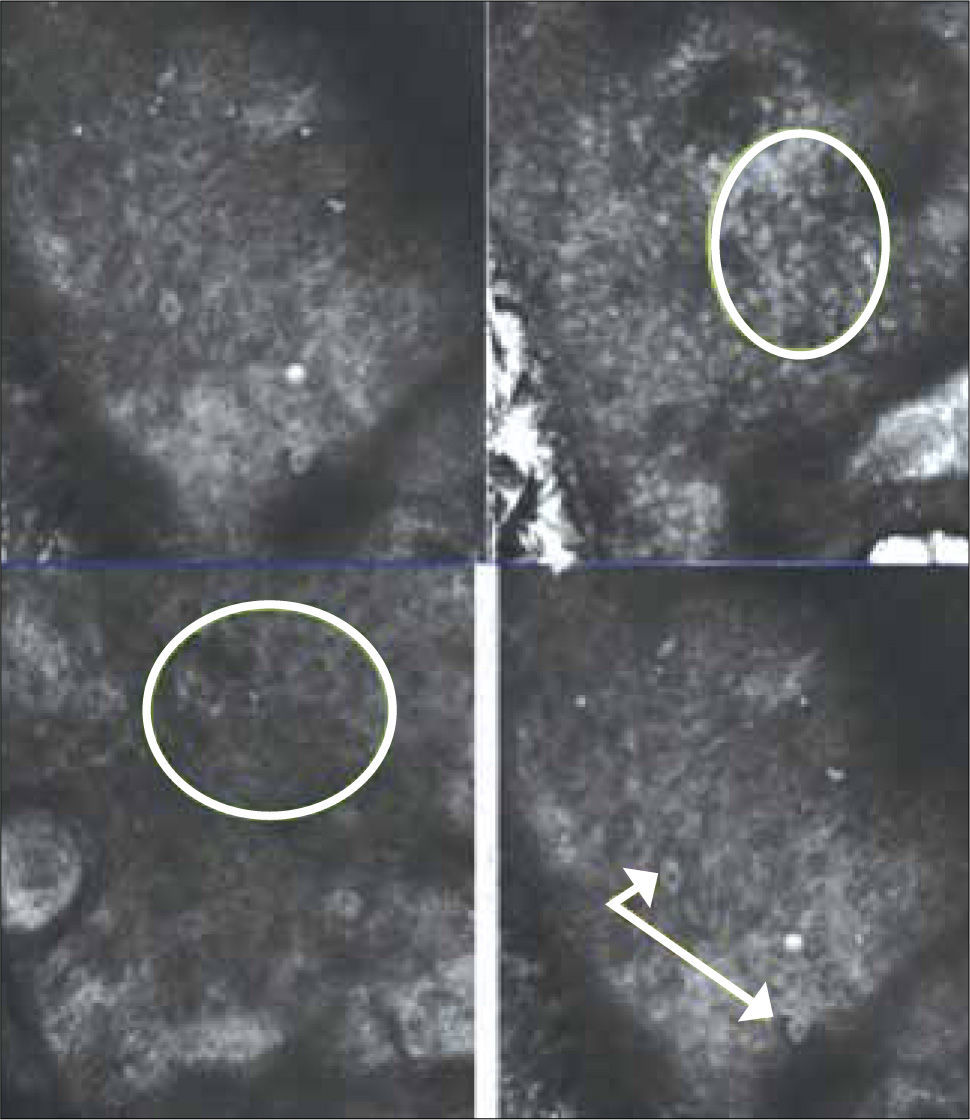
DiagnósticoEl diagnóstico se basa en las características clínicas ya descritas y la utilización de tecnologías especialmente la dermatoscopía (33). Esta técnica consiste en la utilización de un dermatoscopio (Figura 15) que, con un aumento de 10x, permite observar estructuras propias del CB (Figuras 16, 17) (34, 35), no visibles a ojo desnudo y que permiten una altísima aproximación diagnóstica. La microscopía confocal utiliza un microscopio de reflactancia (Figura 18) que consiste en un láser de baja potencia, que permite enfocarse en puntos específicos del tejido, creando imágenes tisulares hasta una profundidad de 250 a 350 micrones, con resolución lateral de 0.5 a 1 micrón y cortes tisulares de 3 a 5 micrones de grosor permitiendo una “biopsia in vivo” con altos niveles de sensibilidad y especificidad (Figura 19) (36, 37). En el grupo de trabajado del autor esta técnica se utiliza hace dos años y ha permitido resolver casos de dificultad diagnóstica (38) como lesiones eritematosas o acrómicas. La biopsia cutánea, previo al tratamiento del tumor, permite ver la variedad histológica y su extensión para una mejor planificación del tratamiento definitivo.
Los objetivos son:
a) remoción o destrucción completa del tumor,
b) preservación del tejido normal
c) preservar la función y
d) resultado cosmético óptimo.
La remoción completa del tumor es el objetivo principal y no debe ser descuidado en beneficio del cumplimiento de los otros.
Modalidades de tratamiento:
a) Electrocoagulación y curetaje: es el tratamiento de elección para tumores nodulares de bordes bien definidos, de menos de 1 cm de diá-metro que están confinados al dermis superior y en aquellos que no estén en zonas de alto riesgo (39).
b) Extirpación quirúrgica: se tiene un control histológico óptimo, con rápida cicatrización y adecuado resultado cosmético, puede ser utilizado en cualquier variedad de o localización del CB. No es muy útil cuando son múltiples lesiones, ya que la cicatriz quirúrgica puede ser mayor que al utilizar otras modalidades terapéuticas. Se sugieren márgenes de 3 a 5 mm para CB primario pequeño y de 1.3 a 5 cms en el caso de recurrentes (40).
c) Cirugía micrográfica de Mohs: es la mejor metodología en términos de control histológico y preservación del tejido sano. Tratamiento de elección en CB grandes e invasores, aquellos con características histológicas agresivas o morfeiformes, en áreas de alto riesgo, recurrentes, con extensión perineural, bordes mal definidos, en áreas donde se requiere la máxima preservación de tejido sano y aquellos con extirpación incompleta (41).
d) Radioterapia: es un procedimiento que permite conservar el tejido sano, está indicado en casos que requieren grandes cirugías reconstructivas que pueden ser desfigurantes, especialmente región nasal, pabellón auricular y periocular. Es útil en pacientes ancianos que rechazan cualquier procedimiento quirúrgico o están en malas condiciones de salud. En lesiones de 1cm o menos, alcanza altos índices de curación, especialmente si es utilizada en forma fraccionada. En tumores de mayor tamaño, ubicación en zonas de alto riesgo, o patrones histológicos agresivos, la respuesta es menor (42). El resultado cosmético puede empeorar a través del tiempo y no se aconseja en gente joven.
e) Criocirugía: es un procedimiento operador dependiente, por lo que se necesita experiencia y un adecuado equipo. Se requieren 2 ciclos de congelación-descongelamiento para llegar a una temperatura de -50ºC a excepción de los superficiales que requieren solo un ciclo y en todos los casos debe considerarse un margen de piel “aparentemente sana” para compensar el crecimiento subclínico. En casos complejos puede ser necesario una biopsia preoperatoria para determinar el tipo histológico y extensión, así como post-tratamiento para evaluar el éxito terapéutico. Utilizada en tumores de menos de 1cms se ha alcanzado promedios de curación de hasta un 97%, siendo la recidiva altísima en tumores de mayor tamaño. Es una buena opción terapéutica en pacientes en mal estado de salud, que toman anticoagulantes o usan marcapasos (43).
f) Láseres: el láser de CO2 ha sido utilizado con éxito en el tratamiento del CB, pudiendo cortar el tumor sin dañar la muestra, además de coagular la zona, sellar los linfáticos y hasta remover cartílago o hueso si es que hubiera compromiso (44). La cicatrización es rápida y hay menos riesgo de infección ya que esteriliza al cortar, ideal en pacientes con anticoagulantes o marcapasos.
g) Terapia fotodinámica: consiste en la aplicación en el tumor de un fotosensibilizante endovenoso, tópico o intralesional y una fuente de luz que lo activa y produce la necrosis. El tumor lo capta selectivamente, por lo que se respeta el tejido sano. El procedimiento es algo doloroso y la cicatriz residual generalmente es pequeña. El problema es la penetración, por lo que se ha utilizado especialmente en la variedad superficial, ya que en el nodular requiere múltiples tratamientos y la tasa de recurrencia es alta. Siendo una modalidad todavía en desarrollo, no cabe duda que se perfeccionará con el tiempo (45).
h) Modificadores de la respuesta inmune: el imiquimod actúa estimulando la producción de interferón alfa, factor de necrosis tumoral alfa y una gran variedad de citoquinas, que llevan a la destrucción selectiva del tejido tumoral. Se utiliza en forma tópica al 5 % y ha demostrado altos índices de curación en el CB superficial, con una tasa de curación mas baja en el nodular (46, 47).
2Carcinoma espinocelular (CE)Corresponde al 10-20% de todos los cánceres de la piel y es el segundo más frecuente después del CB. Se origina del queratinocito epidérmico que sufre mutaciones repetidas como consecuencia de la exposición a la radiación ultravioleta (RUV). Es muy común en las personas de piel clara y tiene un 95% de curación detectado y tratado adecuadamente.
EpidemiologíaEs el que causa la mayor cantidad de muertes en el cáncer de la piel no-melanoma, a pesar de que es mucho menos frecuente (4 basocelulares por cada espinocelular). Afecta principalmente a hombres mayores de piel tipo I, aumentando la incidencia después de los 40 años. La exposición intensa al sol durante la vida, ya sea por actividades recreacionales o trabajo, aumenta considerablemente el riesgo. La incidencia varía de 100 x 100.000 habitantes en Holanda hasta 1332 x 100.000 en Australia país con la más alta incidencia por su geografía y la población de tipo Caucásica (48). Este cáncer ha doblado su incidencia en los últimos 40 años, probablemente por una mayor exposición a actividades recreacionales y una mayor consulta por el efecto de las campañas publicitarias preventivas. El rol de la depleción de la capa de ozono así como la mayor cantidad de individuos sometidos a inmunodepresión de diversa índole, también han influido en este aumento. Los pacientes que han tenido trasplantes de órganos sólidos (corazón, pulmón, riñón y páncreas) tienen un altísimo riesgo de desarrollar cáncer de la piel, constituyéndose en el principal problema en muchos casos, debido al aumento en la longevidad (49). En general los pacientes trasplantados tienen cuatro veces más riesgo de desarrollar un CE que un CB, cifra muchísimo más frecuente que la población normal, además el CE en este grupo tiene un comportamiento más agresivo (mayor frecuencia de metástasis y muerte) y es de aparición múltiple. El riesgo de CE en este grupo aumenta en 65 veces, así como 84 veces para Sarcoma de Kaposi y tres veces para melanoma.
PatogénesisEl desarrollo del CE es multifactorial e involucra factores genéticos y ambientales. Existen múltiples factores carcinogénicos implicados, sin embargo la RUV es claramente el factor demostrado más importante, ya que el 80% de los CE ocurren en zonas expuestas de la piel, como también los individuos de piel tipo I son los mas afectados. La luz UVB es la más responsable, ya que es 1000 veces más potente que la UVA en su capacidad de inducir cáncer. Es considerado un iniciador y promotor de carcinogénesis cutánea. Actúa a nivel del ADN produciendo mutaciones en dímeros de pirimidina, lo que puede llevar a errores en la transcripción y replicación celular (50). Mutaciones en el gen de supresión tumoral p53 están presentes en el 40-50% de todos los cánceres de la piel, esta mutación permite que células dañadas proliferen y puedan progresar a cáncer (51). La luz UVA actuaría principalmente por su rol inmuno-supresor, evitando el rechazo inmunológico de células cancerosas y por ende facilitando su progresión. Carcinogénicos químicos como hidrocarburos aromáticos policíclicos (alquitrán, brea, etc), están claramente reconocidos como factores productores, así como el arsénico ingerido en el agua o como medicamentos. En el caso del arsénico, los pacientes desarrollan queratosis arsenicales y carcinomas espinocelulares agresivos y otras malignidades como CB, cáncer de pulmón, región urogenital y tracto gastrointestinal. Cicatrices antiguas causadas por traumatismos y enfermedades crónicas (hidroadenitis supurativa, epidermólisis bulosa) son sitios con mayor riesgo de desarrollar CE, especialmente en los bordes de las heridas. El virus papiloma humano(VPH), tiene propiedades oncogénicas que han sido bien estudiadas y actúa inhibiendo la función del p53, permitiendo la replicación de clones malignos (52).
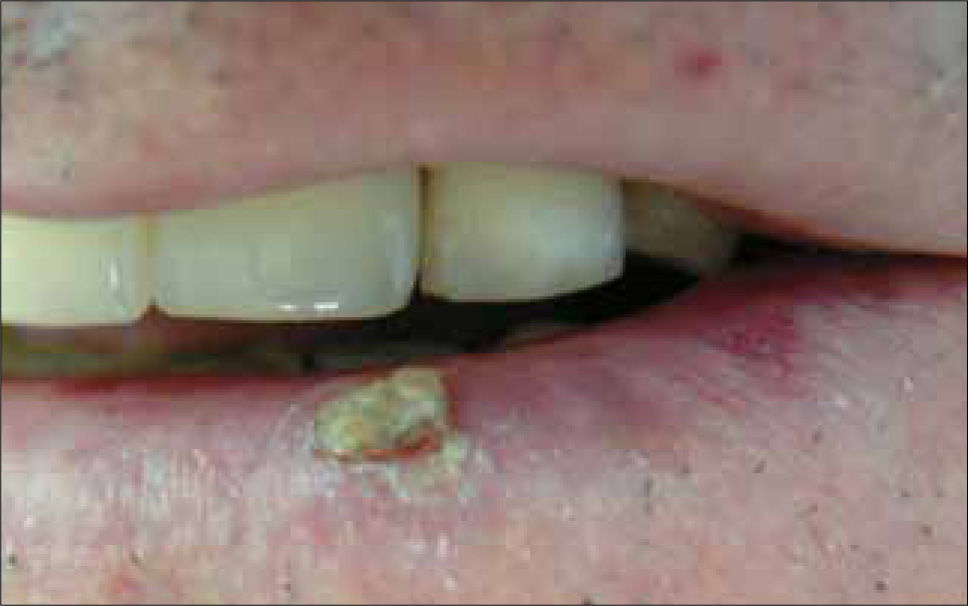
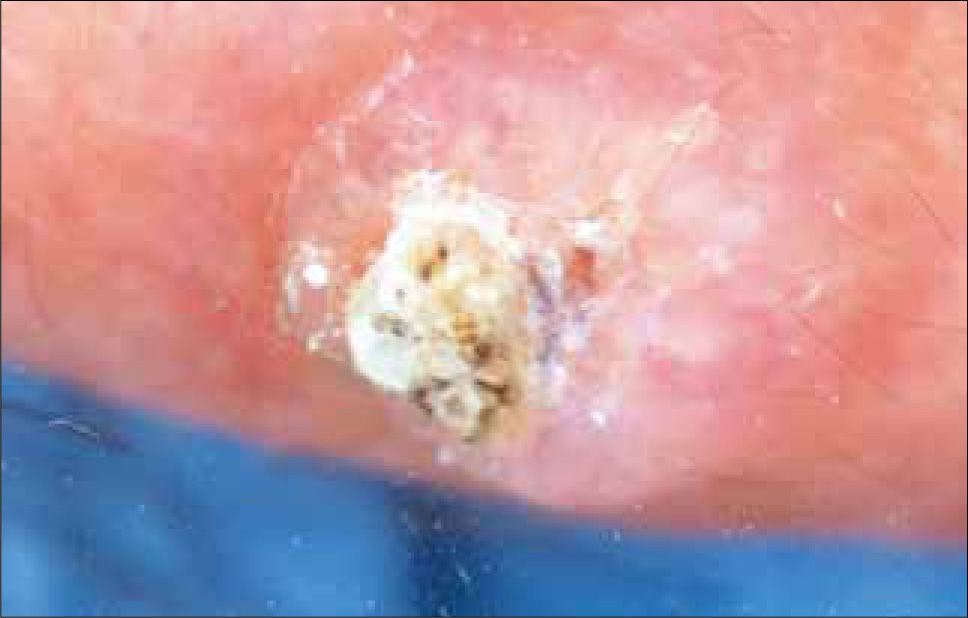
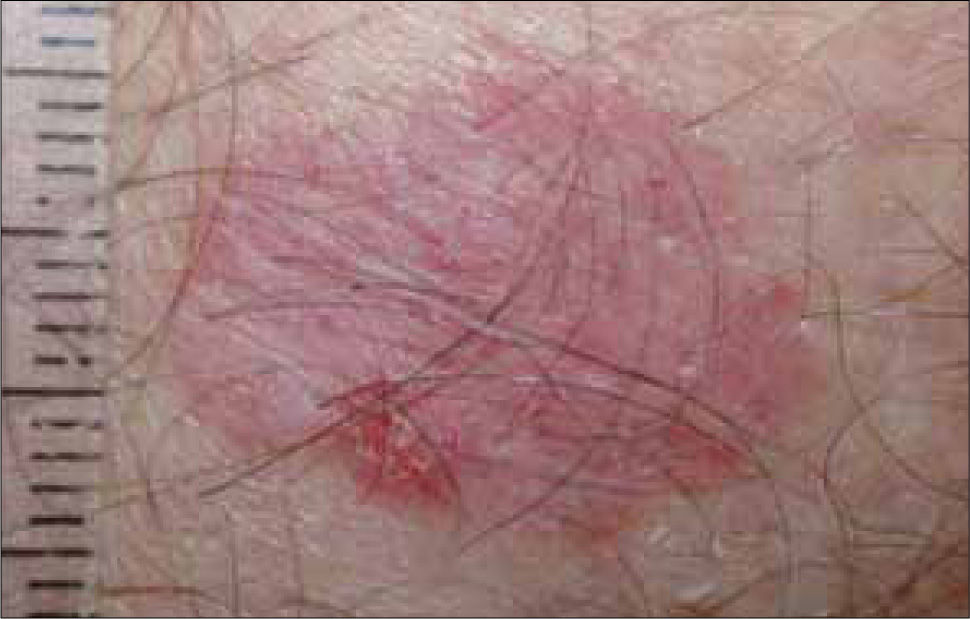
Características clínicasAparece preferentemente en zonas fotoexpuestas en individuos de fototipos I y II. Las localizaciones principales son: cabeza y cuello (70%), extremidades superiores (15%). También puede afectar la región genital y glúteos, sugiriendo otros factores además de la R.U.V como causales. La forma más frecuente es la asociada a queratosis actínicas (QA) que están presentes en piel con fotodaño marcado. La QA es el precursor que histológicamente presenta atipia queratinocítica similar al CE. Las Q.A son máculas o pápulas de superficie áspera que se encuentran en zonas fotoexpuestas de la piel de bordes mal definidos y con una base eritematosa (a veces se sienten más que se ven), pueden ser hiperqueratósicas (que son más difíciles de distinguir de un CE) o pigmentadas (Figura 20, 21). Una lesión única tiene un riesgo de hasta un 13% de transformarse en un CE (53) y se evidencia clínicamente por un crecimiento rápido, induración o erosiones. El CE del labio aparece en el labio inferior (Figura 22), afecta principalmente a hombres y suele ser más agresivo, con mayor frecuencia de metástasis que en otras localizaciones faciales. Su precursor es la queilitis actínica, donde el vermillon pierde su definición y se torna seco, atrófico, queratósico e hipopigmentado. La presencia de eritema, erosión, induración o elevación en una queilitis actínica previamente estable, debe sugerir el diagnóstico. Las formas intra orales de CE son de difícil diagnóstico y se localizan especialmente en el piso anterior de la boca, lengua y vestíbulo bucal siendo su lesión precursora una leucoplaquia o eritroplaquia, esta última con el más alto índice de degeneración maligna (54). El comportamiento del CE intraoral es bastante agresivo con un 20-70% de riesgo de metástasis, el tabaco y el alcohol parecen ser factores predisponentes, así como la infección por virus papiloma y el liquen plano erosivo. El carcinoma anogenital también suele ser muy agresivo. Clínicamente se caracteriza por lesiones eritematosas, friables, a veces erosivas, sin escamas (especialmente en zonas intertriginosas) y que puede tener asociado prurito y dolor. Los tumores en el pene aparecen en el glande, generalmente en pacientes no circuncidados, con hábitos de poca higiene y ocasionalmente asociados a procesos inflamatorios crónicos (liquen escleroso y atrófico). El VPH también se ha asociado a algunos CE subungueales (tipo 16), verrucosos de la región anogenital (tipos 6 y 11), mucosa oral o del pie que tienen características de invadir profundamente y ser muy localmente destructivos, pero generalmente no metastizan. El queratoacantoma o CE autoresolutivo (Figura 23), se caracteriza por un nódulo exofítico de 1 a 3 cms con una parte central crateriforme llena de queratina, que crece por algunas semanas se estabiliza e involuciona posteriormente, dejando una cicatriz residual. Existe controversia si es un tumor benigno o una verdadera neoplasia. La enfermedad de Bowen (Figura 24) es un CE in situ y su equivalente clínico es una placa eritematosa, delgada, escamosa que se confunde fácilmente con tiña, psoriasis o eccema numular y se denomina eritroplasia de Queyrat cuando está localizado en el pene. Cuando el CE metastiza el pronóstico suele ser ominoso, con una sobrevida a 5 años después de metástasis regionales de solo un 25%. Las metástasis suelen ser linfáticas y los pacientes pueden presentarse con adenopatías palpables. Las lesiones ubicadas en áreas fotoexpuestas tienen el más bajo índice de diseminación (2%), excepto pabellón auricular (8,8%) y labio (13.7%). Algunas variables que influyen negativamente en el pronóstico son: tamaño > 2 cms y tumor recurrente que elevan el riesgo de metástasis a un 30,2%.
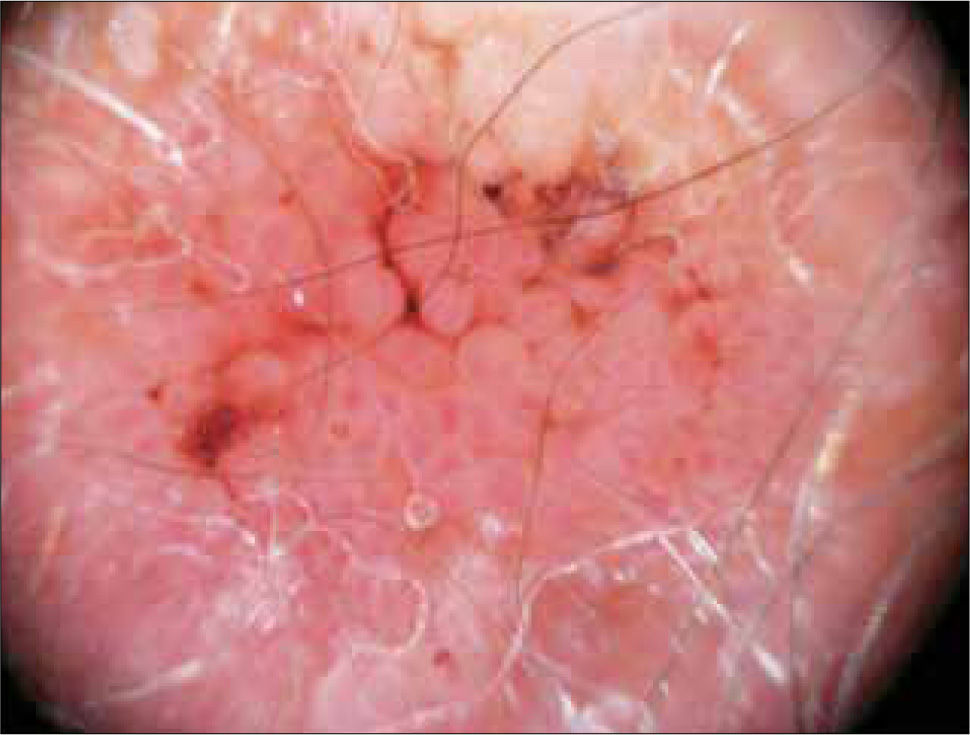
DiagnósticoSe basa en su presentación clínica y evaluación histológica. La historia se basa en identificar factores de riesgo (radiación previa, cicatrices, inmunosupresión, etc), el examen físico debe ser completo para detectar aquellos en zonas cubiertas que tienen el peor pronóstico, siempre examinando la cavidad oral. La palpación de las lesiones, así como de adenopatías regionales es fundamental. El uso de la dermatoscopía permite identificar algunos patrones orientadores del diagnóstico (Figura 25) (55). La microscopía confocal también ha posibilitado el diagnóstico “in vivo” (Figura 26) (56), así como ha permitido descartar otras neoplasias (por ej: melanoma amelanótico) cuyo diagnóstico clínico es complejo. El estudio con imágenes esta indicado si hay nódulos palpables o en tumores de alto riesgo (ubicación, tamaño, recurrencia, inmunosupresión e histología). La biopsia de ganglio centinela está siendo utilizada en la etapificación del CE de cabeza y cuello, aunque su rol en el manejo de pacientes con adenopatías no palpables, con positividades en el ganglio centinela no está claro.
Histopatología: el CE muestra proliferación de células epiteliales escamosas eosinofílicas con anaplasia. Existe queratinización manifestada por perlas córneas. Cuando se profundiza se manifiesta por brotes tumorales en forma de islotes, espículas o células individuales (Figura 27). Las lesiones in situ son completamente intraepiteliales, mientras que las invasoras traspasan la membrana basal. La hiperplasia seudoepiteliomatosa es una epidermis proliferativa bien diferenciada que aparece gene-ralmente alrededor de heridas crónicas en proceso de cicatrización y es difícil de distinguir del CE requiriendo de una evaluación por patólogos experimentados. El CE puede ser dividido en 4 grados dependiendo del porcentaje de queratinización (Broders) siendo el último grado (o el más indiferenciado) con los índices más altos de metástasis (17%). Existen variantes histológicas descritas como: acantolítico, de células fusadas y adenoescamoso. El de células fusadas es infrecuente y puede ser difícil de diferenciar de fibroxantoma atípico, melanoma o leiomiosarcoma, siendo necesario marcadores específicos para llegar al diagnóstico final. El queratoacantoma es una proliferación bien diferenciada, simétrica con forma cupuliforme y cráter central lleno de queratina, la atipia celular y mitosis es mínima (Figura 28). El antígeno nuclear de proliferación celular localizado periféricamente puede ayudar en la diferenciación con el C.E.
TratamientoLa mayoría de los pacientes con CE se presenta con enfermedad localizada donde la resección quirúrgica completa es el tratamiento de elección ya que las lesiones recurrentes son más difíciles de tratar y tienen mayor riesgo de metástasis (42%).
La crioterapia o aplicación de N. Líquido (-198.ºC) se utiliza en tumores pequeños (<1 cm) bien diferenciados y delimitados con porcentaje de curación de 95% a 5 años, especialmente útil en los localizados en extremidades (57).
La electrocoagulación y curetaje es una técnica adecuada para CE superficial, requiere de la experiencia del operador y tiene indicaciones similares a las de la crioterapia, permitiendo además la delimitación de los márgenes superficiales y profundos, ya que el tejido tumoral es friable y fácilmente cureteable. Si el CE tiene extensiones foliculares puede no ser resecado mediante este método, así como en aquellos profundos que se extienden hasta el celular subcutáneo.
El láser de CO2 es una buena alternativa, siempre que sea utilizado como complementario con otros métodos como el anteriormente descrito. Puede ser utilizado como corte y coagulación.
La radioterapia es una modalidad no quirúrgica que puede ser utilizada como un tratamiento primario o coadyuvante. Aquellos pacientes que no son candidatos para una cirugía o con lesiones irresecables, se benefician con esta modalidad terapéutica. El porcentaje de curación a los 5 años es de 90%. No es aconsejable en pacientes menores de 55 años, debido a la morbilidad a largo plazo y el riesgo de desarrollo de un CE en el sitio de tratamiento. En pacientes con nódulos linfáticos negativos, pero tumores de alto riesgo, se puede utilizar en forma profiláctica mientras en pacientes con nódulos positivos, se utiliza como coadyuvante a la cirugía. La sobrevida en pacientes con enfermedad metastásica a pesar del tratamiento combinado (cirugía y radioterapia) es baja.
La extirpación quirúrgica tiene la ventaja de que puede ser realizada en cualquier tipo de tumor y de tener un control histológico de los márgenes. En CE de bajo riesgo (tumor < 2cms, Grado I (bien diferenciado), sin invasión del tejido celular subcutáneo y de localización en tronco y extremidades) un margen de 4mm alcanza un 95% de curación. En tumores de alto riesgo: > 2 cms de diámetro, Grado II (50% o menos de queratinización), con invasión al celular subcutáneo, o en localizaciones de alto riesgo (centrofacial, pabellón auricular, pre y post-auricular, región temporal, cuero cabelludo, genital, manos y pies) se requiere un margen mínimo de 6mm (58). Con el tratamiento quirúrgico el porcentaje global de curación en 5 años es de un 92%, que disminuye a 77% en el caso de tumor recurrente. La cirugía micrográfica de Mohs es el tratamiento de elección en el CE de alto riesgo, sin enfermedad nodal, alcanzando el más alto porcentaje de curación en 5 años, con la ventaja de realizarse en forma ambulatoria y conservar la máxima cantidad de tejido sano.
Los CE in situ que se originan de queratosis actínicas, pueden ser tratados con terapias no-quirúrgicas como el inmunomodulador imiquimod, también utilizado en el tratamiento del área genital y perigenital que son zonas de mayor complejidad quirúrgica (59). La terapia fotodinámica se ha utilizado especialmente en el tratamiento de las queratosis actínicas, cuando están presentes en grandes números y en zonas muy extensas. Consiste en la aplicación de un fotosensibilizante (que es absorbido específicamente por el tejido neoplásico) y después de un período de incubación (30 minutos a 11/2 horas), exposición a luz azul o roja que produce una reacción fototóxica con la necrosis del tejido tumoral (60).
Los autores declaran no tener conflictos de interés, en relación a este artculo.