El cáncer pulmonar es el más mortal de todos los cánceres. Debido a que la gran mayoría de los cánceres pulmonares son causados por el hábito de fumar, su erradicación es la mejor estrategia de prevención primaria. El diagnóstico del cáncer pulmonar en etapas tempranas mejora significativamente su pronóstico, por lo que ésta es la mejor estrategia de prevención secundaria. Recientemente se ha reportado que un programa de pesquisa de cáncer pulmonar con escáner de tórax (TAC) reduce la mortalidad por cáncer. El objetivo de esta revisión es, en primer lugar, apelar a la evidencia en cuanto al rendimiento de los programas de pesquisa de cáncer pulmonar en poblaciones de alto riesgo, y en segundo lugar, analizar las distintas estrategias que tiene un médico cuando se enfrenta a un paciente a quien se le ha encontrado incidentalmente un nódulo pulmonar.
Lung cancer is a deadly disease. Since this cancer is closely related to tobacco smoke, the best way to avoid this disease is smoking prevention. Unfortunately smoking is a worldwide epidemic and in Chile its prevalence is not decreasing. The second best strategy is an early detection. For the first time there is a report showing that screening with the use of low-dose CT reduces mortality from lung cancer. The prognosis is much better in early stages. The purpose of this publication is to review the evidence about screening of lung cancer, and to analyze the different strategies to deal, in the general practice, with a finding of a lung nodule.
El cáncer pulmonar es la primera causa de muerte por cáncer en hombres y mujeres en EE.UU., aunque no es el cáncer más frecuente. Esta discordancia se debe, en parte, a que entre el 75 a 80% de los cánceres pulmonares son diagnosticados en etapas tardías de la enfermedad (1). En el mismo país, entre los años 1979 y 1998 la mortalidad por cáncer pulmonar en hombres disminuyó en 11,8%, mientras que en mujeres aumentó en 63,3%, probablemente por los cambios en el hábito tabáquico. En los países en desarrollo la mortalidad por cáncer pulmonar va en aumento, en Chile por ejemplo, entre 1989 y 1999, ha aumentado en 57% en mujeres y 26% en hombres, siendo actualmente, la segunda causa de muerte de todos los cánceres (2).
Prevención del cáncer pulmonarPrevención primaria: como el tabaquismo es un hábito adquirido y es la causa del cáncer pulmonar en el 90% de los casos, la suspensión del hábito de fumar prácticamente eliminaría este tipo de cáncer, además de otras enfermedades de alta prevalencia y morbi mortalidad como las enfermedades cardiovasculares y la enfermedad pulmonar obstructiva crónica (EPOC). Ésta es sin duda la mejor estrategia de prevención del cáncer pulmonar.
En EE.UU. la prevalencia de tabaquismo ha disminuido en hombres y mujeres entre 1975 y 2006 (3). Sin embargo, en Chile la prevalencia sigue siendo muy alta y no muestra declinación. El consumo diario se mantiene alrededor de 30% entre 2006 y 2008 (4). Además, como el riesgo de cáncer se mantiene alto varios años después de dejar de fumar (5), esta estrategia va a tener un importante tiempo de latencia en nuestro país hasta que se tomen medidas efectivas para lograr un aumento significativo de las tasas de cese.
Prevención secundaria: la sobrevida del cáncer pulmonar depende de la etapa en que se diagnostique, desde 60% de sobrevida a 5 años en etapa I, hasta menos de 5% en etapa IV. Varias características del cáncer pulmonar sugieren que la pesquisa precoz podría ser efectiva: alta mortalidad, alta prevalencia, factores de riesgo conocidos, fase pre clínica prolongada y que el tratamiento es más efectivo en etapas precoces que en etapas tardías.
Hasta hace algunos años se asumía que cualquier nódulo pulmonar no calcificado era potencialmente canceroso y que para descartar esa probabilidad había que constatar que éste no creciera en dos años mediante un estrecho seguimiento radiológico (6). Esta conducta se basaba en que un alto porcentaje de los nódulos pulmonares detectados por radiografía de tórax demostraban ser cánceres. La mayoría de estos nódulos tenían un diámetro entre 1 y 3cm. Desde la introducción de la TAC de tórax, especialmente los modelos con detectores múltiples, se ha hecho muy común detectar nódulos, especialmente menores a 5mm. Sin embargo, la gran mayoría de estos nódulos son benignos, como se demuestra en varios estudios de pesquisa de cáncer pulmonar con TAC de tórax (7).
La mayoría de las guías que recomiendan conductas sobre nódulos pulmonares provienen de estudios de pesquisa precoz de cáncer pulmonar, las que no pueden aplicarse literalmente a pacientes con un hallazgo incidental de un nódulo pulmonar.
Pesquisa precoz de cáncer pulmonarLos datos del USA Surveillance Epidemiology and End Results Registry mostraron que en ausencia de campañas de pesquisa, solo 16% de los casos de cáncer pulmonar en la población general fueron detectados en estadios I y II (8).
Desde 1960 se han hecho estudios de diagnóstico precoz de cáncer pulmonar. Los primeros utilizaron radiografía de tórax y citología de expectoración. Se detectaron más cánceres en etapas precoces (proporción en estadio I y II = 30-45%), pero la mortalidad por cáncer no mejoró en los grupos de pesquisa comparados con los grupos de control. Un metanálisis que incluye 5 de los estudios previos tampoco encontró beneficio en hacer pesquisa de cáncer en población de riesgo.
En los estudios iniciales de pesquisa con TAC de tórax de baja dosis, la proporción de enfermedades detectadas en estadio I fue de 50-85%.
Al momento de escribir esta revisión se publica el estudio NLTS (9) (The National Lung Screening Trial Research Team). Se estudian 53.454 personas con alto riesgo de cáncer pulmonar que se dividen aleatoriamente en dos grupos, 26.722 se someten a seguimiento anual por 3 años con TAC de tórax de baja dosis y 26.732 a radiografía de tórax. El estudio se detuvo antes del tiempo planificado ya que se demostró que el grupo seguido con TAC tenía una disminución de mortalidad de 20% (IC 95% 6,8 a 26,7; p=0,004) en relación al grupo control. Este es el primer estudio de pesquisa de cáncer pulmonar que demuestra una reducción de mortalidad. Sin embargo antes de iniciar un programa de pesquisa de cáncer que intente replicar estos resultados, hay que considerar los siguientes puntos:
- 1.
Como era de esperar se encontraron muchos pacientes con nódulos pulmonares sospechosos de cáncer (39%), los que en su gran mayoría (96%) fueron falsos positivos. Sin embargo el estudio de ellos se hizo con un porcentaje bajo de procedimientos invasivos y de complicaciones (1,4%).
- 2.
Es probable que el éxito de este programa se deba en gran parte a que la mortalidad asociada a la cirugía de resección fue muy baja, 1% comparada con un 4% en la población general de EE.UU.
- 3.
Los dos puntos anteriores se pueden explicar por el cumplimiento estricto del protocolo diagnóstico, y que se realiza en centros de excelencia en el diagnóstico y tratamiento del cáncer pulmonar en EE.UU.
- 4.
Falta por hacer una evaluación económica, que permita analizar la relación costo beneficio de esta estrategia para reducir las muertes por cáncer pulmonar.
El estudio DANTE (10) en Italia está siguiendo a 2.811 fumadores por 10 años, haciendo TAC de tórax de baja dosis y comparando con control médico habitual. Los resultados preliminares a 3 años no muestran beneficio del grupo experimental en relación al control.
El estudio NELSON, en Holanda y Bélgica está siguiendo a 7.557 fumadores o ex fumadores por 10 años comparando TAC de tórax contra seguimiento sin TAC. Este estudio evalúa los nódulos de acuerdo a su volumen. Se publicaron resultados parciales que muestran que utilizando este algoritmo la sensibilidad de la pesquisa fue de 94,6%, y el valor predictivo negativo 99,9% (11).
El Danish Lung Cancer Screening Trial (12) está siguiendo a 4.104 fumadores o ex-fumadores con TAC de tórax de baja dosis o sin TAC. El efecto de este sistema de pesquisa en los hábitos de tabaquismo 1 año después, refejaron una tasa de cese de 11,9% en el grupo de TAC y 11,8% en el grupo control. Las tasas de cese fueron mayores y las recaídas menores en los sujetos con hallazgos anormales en los TAC basales y que requirieron control a los 3 meses (13).
En enero de 2008 el Centro de Enfermedades Respiratorias y Cirugía de Tórax, en conjunto con la Unidad de Medicina Preventiva, de Clínica Las Condes, comenzaron a ofrecer un chequeo respiratorio para fumadores y ex fumadores ≥40 años. Este examen tiene por objeto detectar EPOC, cáncer pulmonar y bronquiolitis respiratoria en fumadores y ex fumadores aparentemente sanos, de acuerdo a una pauta diagnóstica previamente definida por neumólogos, radiólogos, y cirujanos de tórax (14).
El examen consiste en una espirometría con broncodilatador, una prueba difusión pulmonar de gases, una TAC de tórax y una evaluación posterior por médico neumólogo. Hasta ahora se han evaluado 210 personas, edad mediana 55 años (rango 40 a 83), fumadores de mediana de 33 paquetes año (rango 5 a 96), fumadores activos 80%, ex fumadores 20%. La espirometría es normal en 87% según criterio GOLD (VEF1/CVF <70%), y 80% según criterio de la Sociedad Chilena de Enfermedades Respiratorias (SER, percentil 95%). Sin embargo la TAC mostró enfisema en 46%, siendo este leve en 71% y bronquiolitis respiratoria en 19%.
De 146 pacientes con seguimiento 68% tenían al menos un nódulo pulmonar en el TAC de tórax, de los cuales el 13% eran mayores de 5mm. A 4 de esos pacientes se le diagnosticó cáncer, lo que significa una prevalencia de cáncer de 2,7% (4 de 146). A otros 2 pacientes se les diagnosticó cáncer durante el seguimiento. 4 de los 6 pacientes tenían lesiones en etapas precoces (1 hiperplasia adenomatosa atípica y 3 cánceres de células no pequeñas en etapa 1 A).).
Otra experiencia chilena es la publicada el año 2009 por Canals y colaboradores quienes realizan TAC a 239 voluntarios, fumadores, mayores de 38 años, reportando nódulos pulmonares en 21% de los hombres y 25% de las mujeres, de los cuales 7 en hombres y 10 en mujeres tendrían indicación de biopsia por su tamaño (15).
Daños potenciales de un programa de pesquisa de cáncer pulmonarAunque la pesquisa tiene el beneficio potencial de reducir la morbilidad y mortalidad por cáncer pulmonar también tiene alto costo y los siguientes daños potenciales:
- 1.
Morbilidad y mortalidad asociada a procedimientos diagnósticos en un nódulo pulmonar que resulta ser benigno.
- 2.
Riesgo de cánceres asociados a radiación derivada de las TAC. Ansiedad derivada de seguimiento de nódulos pulmonares por varios años.
- 3.
Riesgo de resultados falsos negativos, en que se concluye que no hay cáncer pulmonar cuando en realidad lo hay.
Los estudios de pesquisa tiene que realizarse dentro de un programa que cumpla con una metodología estructurada y en el que participen en forma coordinada los neumólogos, cirujanos de tórax, radiólogos, oncólogos, internistas y patólogos, como el que está en curso actualmente en Clínica Las Condes.
Nódulos pulmonaresUn nódulo pulmonar solitario se define como una opacidad esférica que mide menos de 3cm y está rodeado completamente de pulmón o adyacente a una superficie pleural. Sobre los 3cm se denomina masa pulmonar, y debe ser manejada como una lesión con una alta probabilidad de ser maligna (16).
Los nódulos pulmonares se clasifican radiológicamente como sólidos y sub sólidos. Los primeros se caracterizan por que no permiten ver el parénquima pulmonar a través de ellos. Los segundos si permiten verlo. Los analizaremos en forma separada.
Nódulos sólidosEn estudios de pesquisa en personas fumadoras, la prevalencia de nódulos en TAC de baja dosis alcanza el 50%, de éstos, solamente entre el 2 al 13% terminan siendo malignos (17). La probabilidad de malignidad aumenta con el tamaño, existiendo marcada diferencia en el riesgo si el nódulo es <1cm, entre 1 y 2cm y > 2cm.
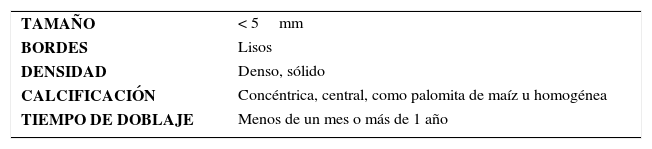
Las causas de nódulos pulmonares benignos más frecuentes son los granulomas antiguos, infecciones granulomatosas activas (tuberculosis, aspergilosis, histoplasmosis y otras micosis endémicas etc.) y hamartomas. Sus características se resumen en la Tabla 1. Causas más raras incluyen fibrosis focal inespecífica, abscesos, neumonías redondas, atelectasias redondas, quistes broncogénicos, residuos de infartos pulmonares, hemorragias focales, hemangiomas y malformaciones arterio venosas.
Criterios radiológicos sugerentes de benignidad de nódulo pulmonar (23)
| TAMAÑO | < 5mm |
| BORDES | Lisos |
| DENSIDAD | Denso, sólido |
| CALCIFICACIÓN | Concéntrica, central, como palomita de maíz u homogénea |
| TIEMPO DE DOBLAJE | Menos de un mes o más de 1 año |
Entre las causas malignas de nódulos pulmonares, la más frecuente es el adeno carcinoma pulmonar, luego el carcinoma de células escamosas, las metástasis solitarias, el cáncer de células pequeñas y el carcinoma bronquíolo alveolar. Mucho menos frecuentes son el carcinoma de células grandes, el tumor carcinoide y los linfomas intra pulmonares.
Antes de solicitar exámenes complementarios al pesquisar un nódulo pulmonar, es necesario determinar la probabilidad de que este sea maligno (probabilidad previa al examen). Existen varios modelos cuantitativos que usan el sistema de Bayes (18) o modelos de regresión logística multivariada (19, 20). Estos modelos han sido validados (21) y se pueden aplicar mediante ecuaciones, sin embargo no se utilizan frecuentemente en la práctica médica.
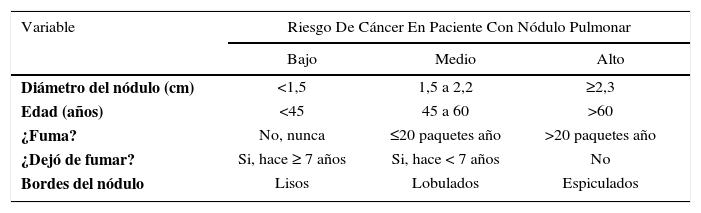
Una forma más descriptiva de análisis de un nódulo pulmonar se puede ver en la tabla 2. (22)
Evaluación del riesgo de cáncer en pacientes con un nódulo pulmonar
| Variable | Riesgo De Cáncer En Paciente Con Nódulo Pulmonar | ||
|---|---|---|---|
| Bajo | Medio | Alto | |
| Diámetro del nódulo (cm) | <1,5 | 1,5 a 2,2 | ≥2,3 |
| Edad (años) | <45 | 45 a 60 | >60 |
| ¿Fuma? | No, nunca | ≤20 paquetes año | >20 paquetes año |
| ¿Dejó de fumar? | Si, hace ≥ 7 años | Si, hace < 7 años | No |
| Bordes del nódulo | Lisos | Lobulados | Espiculados |
Cuando se analiza un nódulo pulmonar, es fundamental comparar con imágenes previas. En términos generales, sin un nódulo no crece no es cáncer. Para ser más específico, habría que estimar la tasa de crecimiento, en términos del tiempo de doblaje del volumen del nódulo. Un doblaje de volumen de una esfera corresponde a un aumento de alrededor de 26% de su diámetro. Los nódulos malignos tienen habitualmente un tiempo de doblaje entre 20 y 300 días, sin embargo, la mayoría se dobla en <100 días. Considerando estas cifras se acepta que si un nódulo sólido, no crece más de un 30% en un plazo de 2 años no es cáncer y se puede suspender su seguimiento radiológico. Por la misma razón, si un nódulo sólido crece más de un 30% en menos de 1 mes, la probabilidad de que sea cáncer también es muy baja. Este análisis es más complicado de hacer en nódulos pequeños, por ejemplo un nódulo que inicialmente mide 4mm al doblar su tamaño medirá 5mm, lo que es muy difícil de medir con exactitud. En el caso de opacidades en vidrio esmerilado, el control debe prolongarse más allá de 2 años, como se analiza posteriormente.
Si se diagnostica un nódulo pulmonar en una radiografía de tórax, su estudio se debe complementar con una TAC de tórax, excepto en los casos en que el nódulo se ha mantenido sin cambios de tamaño por varios años, ya que el TAC entrega información más específica de su ubicación, densidad, bordes y relación con otras estructuras. Además, muestra el mediastino, el resto del parénquima y el abdomen superior.
En el TAC se pueden analizar detalladamente algunas características sugerentes de malignidad de un nódulo, como los bordes espiculados, la convergencia vascular al nódulo, (que sugiere invasión vascular y/o linfática), un bronquio dilatado que lleva al nódulo, y la presencia de una cavitación, especialmente con pared gruesa e irregular en la cara interna. Los hamartomas generalmente son pequeños (< 20mm), de bordes lisos y con densidad grasa menor a 25 unidades Hounsfield (UH).
Otra característica que ayuda en el diagnóstico diferencial de un nódulo pulmonar es su comportamiento con la inyección de medio de contraste. El aumento de su densidad con el contraste hace más probable que sea neoplásico. Sin embargo este hallazgo no es muy específico. Por el contrario, la ausencia de ganancia con contraste es altamente sugerente de patología benigna (24).
El riesgo de la radiación emanada en una TAC única es bajo. Sin embargo, la radiación acumulativa de estudios seriados puede ser significativa. Por esto surge la necesidad de establecer algoritmos formales, con la menor cantidad de TAC posibles y definiendo aquellos TAC que se pueden realizar con baja dosis (25).
Uno de los estudios más modernos que se utiliza en el análisis de un nódulo pulmonar es la tomografía con emisión de positrones (PET) con F-18 fluorodeoxiglucosa. El rendimiento diagnóstico del PET para caracterizar nódulos, muestra una sensibilidad entre 80 y 100%, y una especificidad entre 40 y 100%. (16) La sensibilidad disminuye mucho cuando los nódulos miden menos de 8mm. También se pueden dar falsos negativos en PET en carcinoma bronquiolo alveolar, en tumores carcinoides y en adeno carcinomas mucinoso. Los falsos positivos se ven en patologías infecciosas como tuberculosis, neumonías bacterianas, por hongos o por parásitos y en patologías inflamatorias como nódulos reumatoides, neumonía en organización o sarcoidosis.
El escenario más costo-efectivo para la indicación de PET en nódulos pulmonares es cuando hay una probabilidad pre prueba de malignidad baja a moderada y la TAC es indeterminada (26).
Un paso intermedio entre el estudio de imágenes y la resección quirúrgica, es el intento de obtener histología por métodos menos invasivos. Uno de estos métodos es la biopsia con aguja guiada por TAC que cuando es positiva tiene una alta especificidad (84%) en lesiones entre 2 y 4cm (27). Sin embargo, hasta un 40% de las biopsias no hacen diagnóstico (28). La biopsia trans bronquial por fibrobroncoscopía en nódulos periféricos tiene un rol limitado. Nuevas técnicas de mapeo y navegación, como la electromagnética abren nuevas alternativas de estudio (29).
La resección quirúrgica permite un diagnóstico definitivo y debe llegarse a ella cuando todo el proceso diagnóstico no permite descartar la incertidumbre de malignidad. La decisión de cirugía debe siempre sopesar el riesgo de ser sometido a ella. La cirugía toracoscópica video-asistida, con anatomía patológica intraoperatoria, se ha convertido en la técnica preferida para la resección diagnóstica de nódulos pulmonares periféricos (sensibilidad y especificidad cercana al 100% y menos de 1% de complicaciones en manos entrenadas) (30).
Debido a que más del 50% de las TAC de tórax realizadas en fumadores encuentran nódulos pulmonares es necesario restringir los criterios de seguimiento y de procedimientos de ellos.
Recomendaciones de manejo de nódulos pulmonares sólidosExisten numerosos esquemas diagnósticos frente al hallazgo de nódulos pulmonares. Sin embargo, hasta ahora ninguno tiene un sustento suficientemente sólido como para ser tomado como una norma. El siguiente es el esquema sugerido por la Fleischner Society (31). Estas recomendaciones se refieren al hallazgo incidental de nódulos, esto es un estudio radiológico que no está motivado por síntomas del paciente.
- 1.
Nódulos ≤ a 4mm: el hallazgo incidental de nódulos sólidos no calcificados ≤ a 4mm en pacientes de bajo riesgo de cáncer (no fumadores y sin otro factor de riesgo) no requiere seguimiento. Por otra parte el hallazgo de estos mismos nódulos en fumadores o con otros factores de riesgo (alto riesgo) debieran controlarse en 12 meses y si no hay crecimiento no es necesario seguirlos. Esta recomendación se basa en que en el estudio pionero de pesquisa de cáncer pulmonar con TAC de tórax no se detectó ningún cáncer en el seguimiento de este tipo de nódulos de 378 pacientes fumadores, considerados de alto riesgo de cáncer pulmonar. (7)
- 2.
Nódulos >4 y <6mm: en población de bajo riesgo se recomienda hacer un control de TAC en 12 meses, y si no hay cambio, no volver a controlar. En población de alto riesgo, control de un primer TAC entre 6 y 12 meses, y si no hay crecimiento un segundo TAC entre los 18 y 24 meses. Si persiste sin crecer no hacer más controles. Si hay crecimiento en cualquiera de los controles se requiere biopsia.
- 3.
3Nódulos >6 y hasta 8mm: en pacientes de bajo riesgo se recomienda hacer un primer control de TAC entre 6 y 12 meses, y si no hay crecimiento un segundo TAC entre los 18 y 24 meses. Si persisten sin crecer no hacer más controles. Si hay crecimiento en cualquiera de los controles se requiere biopsia.
En pacientes de alto riesgo, hacer un primer control de TAC entre 3 y 6 meses, luego un segundo TAC entre los 9 a 12 meses y un tercero a los 24 meses si no ha habido cambios. Si hay crecimiento en cualquiera de los controles se requiere biopsia.
- 4.
Nódulos mayores de 8mm: pacientes de bajo y de alto riesgo: Controles con TAC a los 3, 9 y 24 meses. Si hay crecimiento en cual quiera de los controles se requiere biopsia. Esta conducta se basa en que entre los nódulos mayores de 8mm hay un 10 a 20% de cánceres (31).
En este tipo de nódulos es posible utilizar, además de biopsia, otros métodos diagnósticos, como el uso de TAC con contraste dinámico y PET/CT integrado. La elección de alguno de ellos depende de la disponibilidad de esos equipos y de la experiencia de los grupos de trabajo.
Una forma más sencilla (32) de enfrentar el hallazgo de nódulos pulmonares, basada en los resultados hasta ahora publicados de estudios de pesquisa es:
- 1.
Nódulos < 10mm: seguimiento con TAC de tórax con alguno de los esquemas previamente mencionados.
- 2.
Nódulo ≥ 10mm o con morfología muy sospechosa de cáncer: biopsia con aguja, FBC o cirugía.
Los nódulos sub sólidos se dividen en nódulos en vidrio esmerilado y nódulos mixtos. Los primeros permiten ver a través de ellos completamente las estructuras del parénquima pulmonar como vasos, bronquios y líneas septales, los segundos son una mezcla de nódulo sólido y en vidrio esmerilado. (33)
Se justifica analizar a los nódulos sub sólidos en forma separada de los sólidos porque tienen una epidemiología y pronóstico distintos.
Aunque los nódulos sólidos son el tipo de lesión más frecuentemente descrita, es menos probable que sean malignas, en comparación con los nódulos sub sólidos (32).
Los nódulos sub sólidos pueden ser malignos o benignos. Entre los primeros están;
- (1)
la hiperplasia adenomatosa atípica (HAA), una lesión considerada pre maligna, cuyo tiempo de doblaje de volumen es de 988 ± 470 días,
- (2)
el carcinoma bronquíolo alveolar (CBA) de crecimiento lento, con un tiempo de doblaje de volumen de 567 ± 168 días, menos asociado a tabaquismo que los otros cánceres de pulmón, con mayor incidencia en mujeres jóvenes, asociado a zonas de fibrosis pulmonar, multi focal y que responde a tratamiento con inhibidores de tirosina kinasa y
- (3)
el adeno carcinoma mixto, más agresivo, con un tiempo de doblaje de 384 ± 212 días.
A pesar de sus diferencias, los nódulos sub sólidos malignos tienen un mejor pronóstico que los nódulos sólidos malignos. Por ejemplo el tiempo de doblaje de un carcinoma escamoso periférico es 122±68 días, mucho menor que los sub sólidos descritos.
Entre los nódulos sub sólidos benignos están la neumonía en organización, la fibrosis focal o una inflamación focal.
La utilidad del TAC de tórax en el diagnóstico diferencial de los nódulos sub sólidos está en pleno desarrollo y hay hallazgos contradictorios. En un estudio retrospectivo (34) el 81% de nódulos sub sólidos persistentes fueron hiperplasia adenomatosa atípica, carcinoma bronquíolo alveolar o adeno carcinomas con componente de carcinoma bronquíolo alveolar, mientras que el 19% restante fueron benignos. En este estudio la caracterización de los nódulos en cuanto a su forma, presencia de lobulaciones, o de espiculaciones no permitió diferenciar los benignos de los malignos. Por el contrario otro estudio (35) describe que la presencia de lobulaciones es un factor pronóstico para nódulos malignos.
En general mientras mayor sea el componente de vidrio esmerilado mejor el pronóstico de la lesión (36). Un hallazgo importante es que la probabilidad de que un nódulo sub sólido sea una metástasis pulmonar de un cáncer extra torácico es muy baja (37).
Seguimiento radiológico: como los nódulos sub sólidos malignos tienen un tiempo de crecimiento lento, la falta de crecimiento en 2 años de uno de ellos no significa que sea benigno. Hay estudios que incluso reportan nódulos malignos que disminuyen de tamaño en intervalos cortos de seguimiento (38). Por otra parte un aumento en la densidad radiológica del nódulo o de una parte de él, hace probable que se trate de una lesión neoplásica. Estas características de los nódulos sub sólidos obligan a usar TAC de tórax de cortes finos, con algoritmos adecuados, que maximicen su sensibilidad reduciendo al mínimo la exposición a radiaciones.
El rol de la tomografía de emisión de positrones (PET) en el diagnóstico de los nódulos sub sólidos no está defnida. No está tampoco bien definido el rol de la citología y de la biopsia por punción bajo TAC o por fibrobroncoscopía.
Recomendaciones de manejo de los nódulos sub sólidos(33)ANódulos únicos- 1.
Nódulos en vidrio esmerilado, menores de 5mm, muy probablemente no son malignos y no requieren ser seguidos.
- 2.
Nódulos en vidrio esmerilado entre 5 y 10mm requieren un control de TAC en 3 a 6 meses para ver si han desaparecido. Si persisten, es preferible seguirlos con TAC, en vez de resecarlos. El seguimiento debiera ser anual por al menos 3 años. El uso de PET es de dudosa utilidad en este tipo de lesiones. Si se quisiera hacer diagnóstico histológico, se debe preferir una biopsia bajo TAC con aguja gruesa.
- 3.
Nódulos en vidrio esmerilado mayores de 10mm, que persisten en control a los 3 o 6 meses deben ser resecados.
- 4.
Nódulos mixtos (componente sólido y en vidrio esmerilado), deben enfrentarse como los nódulos en vidrio esmerilado mayores de 10mm, independientemente de su tamaño, por que tienen mayor probabilidad de ser malignas. En estas lesiones se justifica el uso de PET o preferible PET/CT por su mayor rendimiento en el diagnóstico de la lesión y posibles metástasis.
- 1.
Nódulos múltiples, todos en vidrio esmerilado y menores de 5mm, deben seguirse al menos por 1 año.
- 2.
Nódulos múltiples, todos en vidrio esmerilado y entre 5 y 10mm, deben manejarse igual que en el caso de ser únicos (grupo número 2).
- 3.
En caso de nódulos múltiples en que alguno sea mayor de 10mm o de aspecto mixto, la conducta se basa en el nódulo más sospechoso.
Los autores declaran no tener conflictos de interés, en relación a este artículo.