En los últimos años, se ha observado un aumento sostenido de la mortalidad por cáncer colorrectal (CCR) en Chile, por lo que su prevención y detección precoz cobra cada vez más importancia. El riesgo de CCR de un individuo asintomático se determina considerando sus antecedentes familiares (AF). Personas sin AF tienen un riesgo promedio que aumenta después de los 50 años de edad, momento en que se sugiere iniciar exámenes preventivos anuales con Test de Sangre Oculta en Deposiciones inmunológico (TSODi), seguido de una colonoscopía al obtener un resultado positivo. Individuos con AF tienen un riesgo elevado y requieren una colonoscopía sin previo TSODi los más tardar a los 40 años. En el caso de una sospecha de un Síndrome de Lynch (SL) por criterios clínicos (Amsterdam/Bethesda) y/o estudio genético, el riesgo es alto lo que justifica una vigilancia estricta con colonoscopía anual a partir de los 25 años.
Over the past years, a sustained increase of mortality from colorectal cancer (CRC) has been observed in Chile. In this scenario, CRC screening and prevention are gaining more and more importance. Family history (FH) is essential to determine the CRC risk in asymptomatic subjects. Persons without any FH have an average CRC risk which increases after age 50, moment in which CRC screening should start with a yearly immunological fecal occult blood test (iFOBT), followed by colonoscopy in case of obtaining a positive result. Subjects with FH present an elevated CRC risk, and should undergo colonoscopy without prior iFOBT at age 40 or earlier. If FH suggests the presence of a Lynch Syndrome (LS) by clinical criteria (Amsterdam/Bethesda) and/or genetic testing, the subject is at high risk, and a close surveillance with annual colonoscopies starting at age 25 is warranted.
El cáncer de colon y recto (CCR) es un cáncer frecuente en el mundo, constituyendo la 4ta causa de muerte por cáncer a nivel mundial. En 2008, se le atribuyeron 7,5 millones de las defunciones ocurridas en el mundo, lo que equivale aproximadamente a un 13% de las muertes en ese año (1). La incidencia más alta se observa en países como Australia, Nueva Zelandia y Europa Occidental, con cifras de hasta 41 nuevos casos por 100.000 habitantes por año. Países con baja incidencia se encuentran en África (exceptuando Sudáfrica) y Asia Central, con tasas de incidencia entre 5 y 7 × 100.000 habitantes. Según las cifras de la Organización Mundial de Salud (OMS), los países latinoamericanos se encuentran en un punto intermedio con incidencias estimadas de entre 12 y 14 × 100.000 habitantes (2). Sin embargo, hay que tener en cuenta que en muchos países subdesarrollados no existen buenos registros de salud, razón por la cual hay que considerar las estadísticas de estos países son más bien de carácter referencial.
En Chile no se dispone de un registro nacional de cáncer, por lo que la única forma de acercarse al tema es a través de las estadísticas de mortalidad. Entre 1983 y 2008, la mortalidad por cáncer de colon y recto en Chile se ha prácticamente duplicado, constituyendo actualmente la 4ta causa de muerte por cáncer en el país (3). Si bien se desconocen las causas exactas de este aumento sostenido, surge la sospecha que el desarrollo del país contribuya a esta evolución mediante los cambios en el estilo de vida y de alimentación derivados de este (sedentarismo, obesidad, tabaquismo, consumo elevado de proteínas de origen animal y de grasas saturadas, y la falta de fibra en la dieta) (4).
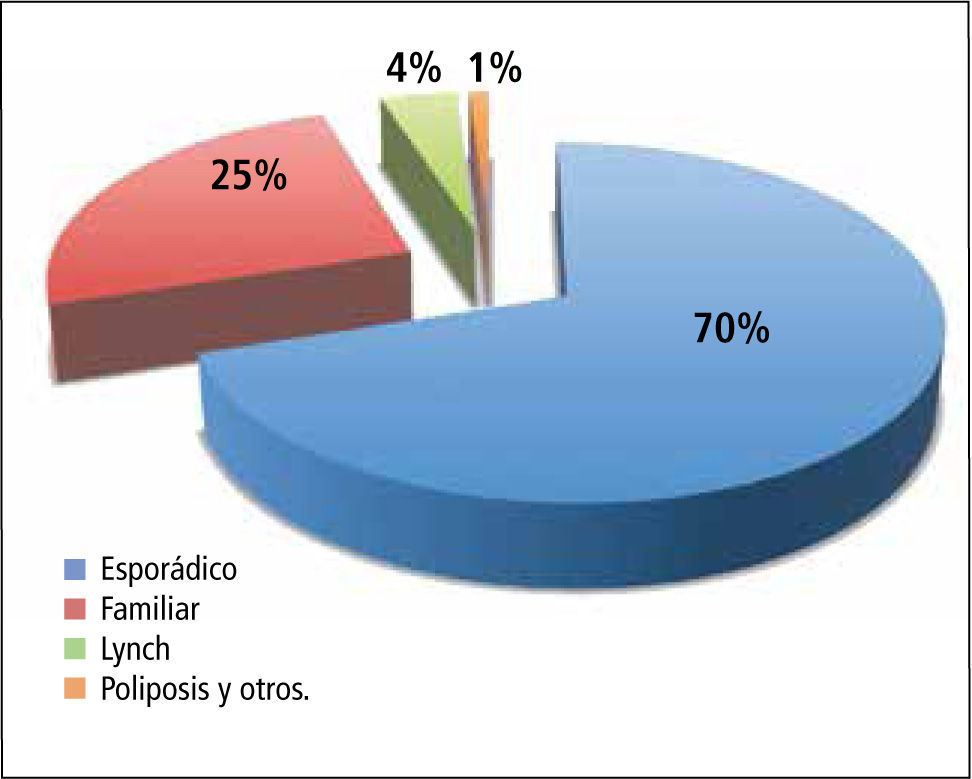
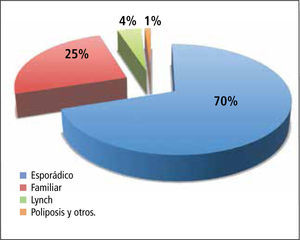
El CCR se divide en distintos grupos según su ocurrencia en el contexto familiar del paciente. La gran mayoría de los casos se denominan esporádicos, porque no hay antecedentes de otros casos en la misma familia sanguínea del paciente. En aproximadamente un tercio de los casos se observa una coincidencia con otro CCR en algún integrante de la familia, sin corresponder a ningún patrón hereditario formal (CCR familiar). Un número bajo de pacientes se encuentra en un contexto familiar de varios pacientes más con CCR y/o tumores relacionados dentro de un patrón hereditario establecido por criterios clínicos (Amsterdam / Bethesda), ubicando de esta manera al paciente dentro de un grupo sospechoso de un síndrome hereditario como el Cáncer Colorrectal Hereditario No Polipósico (CCHNP), o Síndrome de Lynch (Figura 1).
De la misma manera, el riesgo de un individuo de desarrollar un CCR depende de su historia familiar, en el sentido que un sujeto sin ningún antecedente familiar presenta un riesgo promedio de CCR, mientras individuos con antecedentes familiares (CCR familiar/hereditario), tienen un riesgo elevado de CCR, por lo que la estrategia de detección precoz debe ser diferente de un sujeto de riesgo promedio (ver más adelante).
A diferencia de otros cánceres, el CCR presenta algunas características que lo hacen susceptible a ser prevenido o detectado precozmente en una etapa inicial. El CCR esporádico se desarrolla en la mayoría de los casos a partir de un pólipo adenomatoso en el colon o recto en un plazo de 6 - 8 años, obedeciendo a una secuencia de cambios genéticos en las células comprometidas, que interfieren con la regulación del ciclo celular (secuencia adenoma-carcinoma). Es decir, que el CCR posee con el pólipo una lesión precursora, que es detectable durante un examen endoscópico, y que puede ser extirpado durante el mismo examen, lo que constituye una forma de prevención secundaria del CCR.
Pesquisa en individuos de riesgo promedio - cáncer colorrectal esporádicoConsiderando que la mayoría de los CCR esporádicos se diagnostican en la sexta y séptima década de la vida, y que el desarrollo del CCR a partir del pólipo se demora algo menos de 10 años, los exámenes de pesquisa deberían iniciarse a partir de los 50 años en individuos asintomáticos con riesgo promedio. En individuos de riesgo elevado, como por ejemplo personas con síntomas (rectorragia, cambio del hábito intestinal, dolor abdominal persistente), o con una historia familiar de CCR, el esquema de exámenes de pesquisa varía, como se analizará más adelante.
Dado que los exámenes de pesquisa se tienen que realizar a una gran cantidad de personas, hay que elegir un examen de primera línea que sea de bajo costo, tenga buena sensibilidad y especificidad, sea fácil de aplicar, sea no invasivo y tenga una buena adherencia (5). Si bien la colonoscopía posee excelente sensibilidad y especificidad para el CCR y sus precursores, no cumple con los criterios para un examen de pesquisa poblacional, básicamente por el alto costo, la baja disponibilidad, el requerimiento de unidades y personal especializado, y el carácter invasivo. Es por ello, que en muchos países del mundo se ha optado por el test de sangre oculta en deposiciones (TSOD) como primer examen de pesquisa en individuos asintomáticos.
En los años 90, el TSOD utilizado fue el test denominado guayaco, basado en la reacción de peroxidasa, la que no es específica para sangre humana. En consecuencia, para obtener resultados confiables hay que respetar restricciones alimentarias (carnes rojas etc.) y de medicamentos (aspirina y otros) en los días previos a la toma de muestra. Sumando a esto el hecho que la obtención de las muestras no es muy amigable, se entiende una adherencia baja a este examen (40 - 50%) (6). En los últimos años se ha implementado un TSOD inmunológico (TSODi), basado en anticuerpos monoclonales contra hemoglobina humana. Este test no requiere ningún tipo de preparación o restricción, por lo que facilita la toma de muestra al paciente. En consecuencia, se ha observado una mejor adherencia el examen (7, 8). En un programa de pesquisa realizado en varias ciudades chilenas entre 2007 y 2009, se observa una adherencia de un 77% aplicando el TSODi en los 6348 individuos estudiados (9), lo que coincide con cifras publicadas a nivel internacional.
En individuos con TSOD positivo se requiere una colonoscopía por la sospecha de presencia de adenomas de alto riesgo y/o CCR. La colonoscopía representa el “gold standard” para la detección de adenomas y adenocarcinomas de colon y recto, aunque incluso en manos experimentadas se observa una tasa de falsos negativos de 12 - 13% para pólipos de 5-10mm, y de hasta un 26-28% para pólipos < 5mm (10,11). La calidad de la colonoscopía depende de varios factores, como el grado de preparación, la experiencia del endoscopista y del personal, la conformación anatómica del paciente, y la duración del examen, entre otros. Si bien la colonoscopía es el examen de elección para detectar y tratar lesiones precoces, siendo un procedimiento invasivo no está exenta del riesgo de complicaciones como la perforación o la hemorragia digestiva, que ocurren aproximadamente en el 0,1% de los procedimientos (12). Para realizar colonoscopías de pesquisa se requiere idealmente un centro endoscópico de alto rendimiento, con procesos estandarizados y indicadores de calidad (por ejemplo una tasa de llegada al ciego > 90%). El examen de elección es la colonoscopía completa, dado que solamente el 70% de las lesiones neoplásicas se encuentran en el colon izquierdo, y una colonoscopía izquierda sin hallazgos puede entregar una falsa sensación de seguridad al paciente y médico tratante (13).
Otros exámenes como la colonoscopía virtual (tomografía axial computada) o el enema baritado no son exámenes de primera elección para la pesquisa de CCR y sus precursores por su rendimiento inferior a la colonoscopía y la falta de opciones diagnósticas y terapéuticas como la biopsia de pólipos y la polipectomía endoscópica (14). En el caso de no lograr una colonoscopía completa por razones técnicas, la colonoscopía virtual es la opción de segunda línea, teniendo en cuenta que solamente logra visualizar pólipos de tamaño mayor a 5mm con suficiente sensibilidad y especificidad (15). El enema baritado ofrece un rendimiento incluso algo inferior (16, 17), por lo que en general no se recomienda para la pesquisa de pólipos o CCR, salvo que sea el único examen disponible.
Hay varios trabajos a nivel internacional que han demostrado que utilizando un TSOD seguido de colonoscopía en los pacientes positivos en el marco de programas de pesquisa, se ha logrado disminuir la mortalidad por CCR entre un 13% y un 33% (18). En una revisión comprehensiva reciente de los trabajos más importantes al respecto, se observa una disminución global del riesgo relativo de CCR en un 16%, permitiendo de esta manera evitar 1 de cada 6 muertes por CCR en países con alta incidencia (19, 20). En el caso de pacientes diagnosticados con un cáncer ya establecido, éste se diagnostica en estadíos más tempranos en individuos sometidos a programas de pesquisa comparados con grupos controles (21-23). A modo de ejemplo, en EE.UU. se observa que la mortalidad de CCR ha disminuido de 25 a 17 en 100.000 entre los años 1995 y 2005, lo que podría deberse por lo menos parcialmente a la amplia aplicación de programas de pesquisa en ese país (24). Del mismo modo, la incidencia de CCR en EE.UU. ha disminuido de 50 a 34 en 100.000 entre los años 1985 y 2008, probablemente por la consecuente extirpación endoscópica de las lesiones precursoras durante las colonoscopías de pesquisa. En la actualidad, el 40% de los CCR diagnosticados en EE.UU. se encuentra en una etapa localizada, la que ofrece una sobrevida de >90% a 5 años (25).
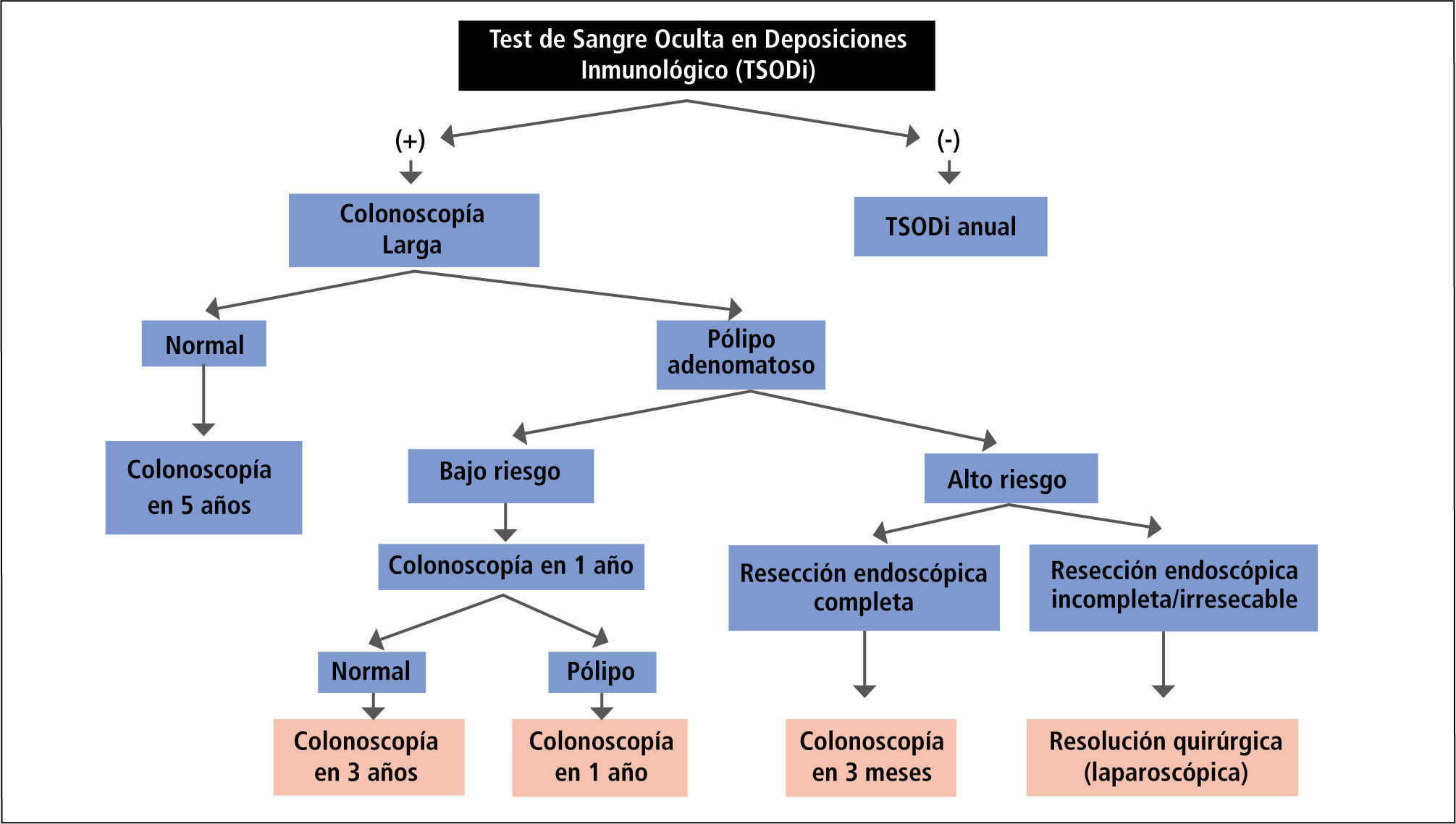
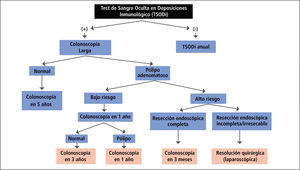
En resumen, el esquema de exámenes de pesquisa para CCR en individuos asintomáticos de riesgo promedio incluiría un TSODi en todo individuo desde los 50 años de edad. En caso de obtener un resultado negativo, se recomienda la repetición del TSODi en forma anual. En caso de detectarse sangre oculta en las deposiciones, se le indica al paciente una colonoscopía completa. En el caso de encontrarse pólipos adenomatosos con displasia de bajo grado en la colonoscopía, se recomienda una nueva colonoscopía de seguimiento al cabo de un año. En caso de detectar adenomas de alto riesgo (componente velloso, 3 ó más pólipos simultáneos, displasia de alto grado), hay que considerar un tratamiento endoscópico con un seguimiento precoz (1-3 meses) o un tratamiento quirúrgico según sea el caso (Figura 2).
Pesquisa en individuos de alto riesgo - cáncer colorrectal familiar y hereditarioComo anteriormente mencionado, las estrategias de pesquisa de CCR en individuos familiares de primer grado de un paciente con CCR y/o perteneciente a una familia con características de CCR hereditario difieren de la estrategia para el individuo asintomático sin antecedentes.
El riesgo de un individuo con un familiar de primer grado con CCR es 5-6 veces mayor para adenocarcinoma/adenomas de alto riesgo comparado con la población general, y 2-4 veces mayor para adenomas de cualquier tipo (26, 27). En ese contexto, y teniendo en cuenta el valor predictivo negativo del TSODi, se recomienda realizar la colonoscopía sin previo TSODi a partir de los 40 años, o desde 10 años menor que la edad de diagnóstico en el familiar comprometido (28, 29).
El Síndrome de Lynch (SL) (también denominado Cáncer Colorrectal Hereditario No Polipósico, CCHNP) es la forma hereditaria más frecuente del CCR y consiste en una enfermedad genética autosómica dominante que tiene su origen en mutaciones de genes reparadores de errores de replicación de ADN. Los genes más frecuentemente involucrados son MLH 1 y MSH 2, que representan aproximadamente el 90% de las mutaciones observadas. El 80% de los portadores de mutaciones expresarán la enfermedad durante su vida. El SL no solo causa CCR, sino también involucra otros tipos de cáncer, como el cáncer de endometrio, ovario, urotelio, estómago, intestino delgado, páncreas, y otros. El CCR dentro del SL se caracteriza por presentarse a una edad más joven (promedio 45 años comparado con 69 años en la población general), desarrollarse en forma más rápida (2-3 años comparado con 6-8 años en CCR esporádico), ubicarse más frecuentemente en el colon derecho proximal al ángulo esplénico (70% vs 30%), y mostrar una alta tasa de CCR metacrónicos (aproximadamente 25-30% a 10 años) (30).
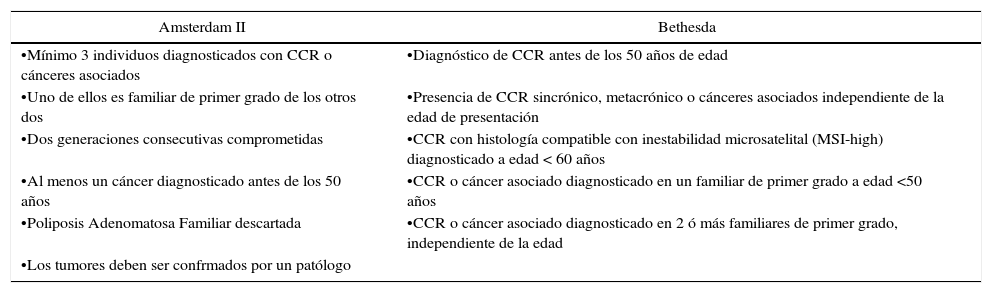
El diagnóstico clínico del SL se basa en los antecedentes familiares, los que se evalúan bajo los criterios de Amsterdam o de Bethesda (Tabla 1). La sospecha clínica se confirma con el estudio genético en el paciente índice. Una vez identificada la mutación, se le puede ofrecer a los familiares asintomáticos el diagnóstico molecular para confirmar o descartar la presencia de ella en cada individuo. Mientras que los no portadores tienen un riesgo de CCR igual a la población general, los portadores deben someterse a un esquema de vigilancia estricta tanto de CCR como de los cánceres extracolónicos asociados al SL. Individuos pertenecientes a familias con SL sin diagnóstico molecular deben considerarse portadores, y en consecuencia someterse a los mismos exámenes que ellos.
Criterios para el diagnóstico clínico del síndrome de lynch
| Amsterdam II | Bethesda |
|---|---|
| •Mínimo 3 individuos diagnosticados con CCR o cánceres asociados | •Diagnóstico de CCR antes de los 50 años de edad |
| •Uno de ellos es familiar de primer grado de los otros dos | •Presencia de CCR sincrónico, metacrónico o cánceres asociados independiente de la edad de presentación |
| •Dos generaciones consecutivas comprometidas | •CCR con histología compatible con inestabilidad microsatelital (MSI-high) diagnosticado a edad < 60 años |
| •Al menos un cáncer diagnosticado antes de los 50 años | •CCR o cáncer asociado diagnosticado en un familiar de primer grado a edad <50 años |
| •Poliposis Adenomatosa Familiar descartada | •CCR o cáncer asociado diagnosticado en 2 ó más familiares de primer grado, independiente de la edad |
| •Los tumores deben ser confrmados por un patólogo |
En relación a la vigilancia de CCR en los portadores de mutación, las recomendaciones internacionales indican la realización de una colonoscopía anual o bianualmente a partir de los 25 años de edad. El riesgo a 10 años de detectar una lesión durante el seguimiento con este esquema es de 30% para adenomas y de 12% para CCR (31). El riesgo cumulativo a los 60 años para adenoma es de 68% en hombres y 48% en mujeres, mientras el riesgo cumulativo para CCR es de 35% en hombres y 22% en mujeres (32). Otro estudio encontró que el 38% de los CCR detectados durante el seguimiento de portadores de SL se diagnosticaron antes de los 2 años desde la última colonoscopía (33), razón por la cual se recomienda acortar los intervalos de las colonoscopías a un año.
El tumor extracolónico más frecuente es el cáncer de endometrio, que ocurre en 40 - 60% de las mujeres portadoras de SL. Por esta razón es esencial, incluir en el esquema de vigilancia un examen ginecológico anual con ecografía ginecológica transvaginal a partir de los 30 años. Otros exámenes como de orina, ecografía de las vías urinarias, endoscopía digestiva alta etc., se indican en forma individualizada basado en los antecedentes de este tipo de cáncer en el árbol genealógico de la familia.
El manejo de familias con SL es complejo dado que incluye la confección de la genealogía de la familia, la entrega de información y educación a los familiares, la realización de los estudios genéticos, la consejería genética y la coordinación de la vigilancia de los integrantes comprometidos, entre otros. Idealmente se organiza en torno a un registro de tumores hereditarios, que consiste en un equipo multidisciplinario incluyendo enfermeras, médicos, bioquímicos, consejeros genéticos, psicólogos y otros.
En conclusión se puede decir, que la estrategia de prevención y detección precoz del CCR en individuos asintomáticos depende fundamentalmente de los antecedentes familiares. Una persona asintomática sin antecedentes familiares debiera realizarse un test de sangre oculta inmunológico anualmente a partir de los 50 años de edad, seguido de una colonoscopía en caso de obtener un resultado positivo. Por otro lado, un sujeto con un uno o más familiares con CCR requiere una colonoscopía a los 40 años de edad, ó 10 años antes de la edad del diagnóstico de CCR en su familiar. Si existe la sospecha de un Síndrome de Lynch, se recomienda la identificación de personas en riesgo mediante genealogía y estudio genético, idealmente en el contexto de un registro de tumores hereditarios. Portadores de una mutación requieren una vigilancia estricta desde temprana edad, para la detección precoz tanto del CCR como de cánceres extracolónicos asociados.
El autor declara no tener conflictos de interés, en relación a este artículo.