En la actualidad, el trasplante hepático es el único tratamiento curativo para enfermedades como la cirrosis en etapas avanzadas y falla hepática fulminante. Sin embargo, la escasez de donantes, su alto costo y la morbimortalidad asociada son limitaciones importantes de este procedimiento. A causa de lo anterior surge la idea de utilizar células madre como terapia alternativa al trasplante hepático. Numerosos tipos de células madre exhiben potencial para desarrollarse en hepatocitos viables: células madre embrionarias, células progenitoras hepáticas, células madre derivadas de la médula ósea, entre otras. A su vez, existe una gran variedad de estudios experimentales y clínicos que evalúan el tratamiento con células madre en diferentes escenarios. Si bien muchos de estos estudios han demostrado mejoría en algunos de los parámetros de la función hepática a través de diferentes mecanismos, aún se desconocen los beneficios y efectos colaterales reales de esta terapia. Por otro lado, el corto periodo de seguimiento y la heterogeneidad de los estudios dificultan la comparación de estos y la obtención de conclusiones científicas. Estudios homogéneos, prospectivos, con un mayor número de pacientes y seguimiento prolongado permitirán definir el rol de esta terapia a futuro.
Currently liver transplantation is the only curative treatment for diseases such as cirrhosis in advanced stages and acute liver failure. However, the shortage of donors, its high cost and associated morbidity and mortality are important limitations of this procedure. In order to avoid or reduce these limitations, therapy with stem cells could be used as an alternative to liver transplantation. Numerous types of stem cells exhibit potential to develop into viable hepatocytes: embryonic stem cells, liver progenitor cells, bone marrow stem cells, among others. There are a variety of experimental and clinical studies evaluating treatment with stem cells in different scenarios. Many of these studies have shown improvement in some parameters of liver function, however, the real benefits and side effects of this therapy are still unknown. On the other hand, the short follow-up and the heterogeneity of these studies do not allow to compare the results or to draw scientific conclusions. Homogeneous, prospective studies, with larger sample size and longer follow-up will allow defining the role of stem cell therapy in the future.
Tanto la cirrosis hepática como la insuficiencia hepática son enfermedades que implican un alto costo en salud, morbilidad y mortalidad, siendo el trasplante hepático el único tratamiento curativo actualmente disponible para un pequeño grupo de pacientes que padecen de esta enfermedad en etapas avanzadas 1–3. Sin embargo, existen ciertas limitantes tales como la escasez de donantes, alto costo, morbilidad y mortalidad asociado al procedimiento y tratamientos médicos posteriores 1,4,5. Es por esta razón que ha nacido la idea de utilizar células madre como eventual alternativa al trasplante hepático 1,3.
La capacidad del cuerpo humano para auto regenerar células en órganos dañados está mediado por células madre adultas, las cuales normalmente se encuentran en estado quiescente, pero que se activan frente a una pérdida celular y migran al sitio dañado gracias a factores tisulares 1.
Definición células madreUna célula madre es aquella que es capaz de dividirse indefinidamente y diferenciarse a distintos tipos de células especializadas, no sólo morfológicamente sino también de forma funcional 6. En el caso particular del hígado, existirían numerosos tipos celulares que exhiben un potencial para desarrollarse en hepatocitos viables tales como células madre derivadas de la médula ósea, del hígado o células progenitoras hepáticas (ovales en modelo animal), de la sangre del cordón umbilical, hepatocitos fetales, embrionarias humanas y del tejido graso entre otras 7. La clasificación de las células madre según capacidad de diferenciación se muestra en la Tabla 11.
CAPACIDAD DE DIFERENCIACIÓN DE DISTINTAS CÉLULAS MADRE
| CAPACIDAD DE DIFERENCIACIÓN | |
|---|---|
| Totipotenciales | Pueden diferenciarse en tipos celulares embrionarios y extraembrionarios. Pueden construir un organismo completo y viable. |
| Pluripotenciales | Pueden diferenciarse en células de las 3 capas embrionarias (ectodermo, mesodermo y endodermo). |
| Multipotenciales | Puede diferenciar en células de diferentes linajes dentro de una sola capa embrionaria. |
| Oligopotenciales | Pueden diferenciarse en células de unos pocos linajes. |
| Unipotenciales | Es capaz de producir un solo tipo de células. |
1. Kumar A, Pati NT, Sarin SK. Use of stem cells for liver diseases-current scenario. J Clin Exp Hepatol 2011; 1:17-26.
En base a lo anterior es importante mencionar algunos aspectos relevantes sobre el origen embrionario del hígado con el fin de comprender las vías necesarias para su formación.
El hígado está formado por diversos tipos de células que surgen de diferentes orígenes embriológicos, siendo los dos principales los hepatocitos y colangiocitos, provenientes del endodermo embrionario. Otros tipos celulares del hígado incluyen células hematopoyéticas, de Kupffer, estromales y células estrelladas de origen mesodérmico 9.
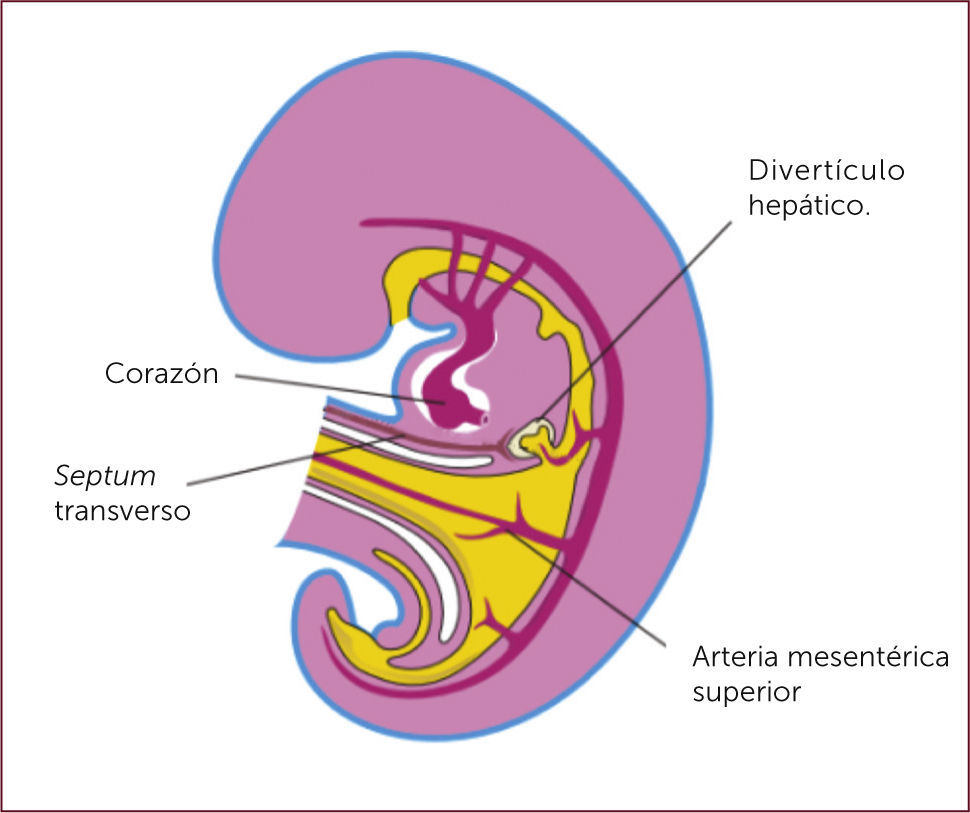
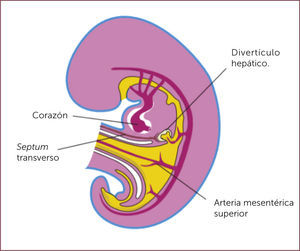
El desarrollo embrionario del hígado comienza en la cuarta semana de gestación, con el inicio del crecimiento ventral de la porción más distal del intestino proximal conocido como divertículo hepático 10. Eventualmente este divertículo dará lugar al hígado y vesícula biliar 11,12 (Figura 1).
Diversas vías de estimulación son requeridas en el caso específico del desarrollo hepático. Es así como las células epiteliales endodérmicas reciben estímulos de células mesodérmicas cardíacas que provocan cambios en la expresión génica y división celular 13. A su vez, se ha sugerido que las células endoteliales presentes en el septum transverso del corazón en desarrollo tendrían un rol en la organogénesis temprana del hígado 13. Esta estructura además contendría células endoteliales vasculogénicas las que participarían en el desarrollo hepático 13.
Una de las vías de estimulación conocida es la que involucra al factor de crecimiento fibroblástico (FCF) el cual es secretado por el corazón en desarrollo e interactuaría con células bipotenciales induciendo la formación del divertículo hepático 10. El FCF realiza su acción al comienzo del desarrollo del hígado iniciando la expresión génica hepática en el endoderma del intestino anterior ventral 14. En segundo lugar, la expresión temprana del FCF-8b, o una molécula relacionada a ella que aún no ha sido identificada, podría potenciar la actividad morfogenética de las células hepáticas incipientes 13. Otro mecanismo de estimulación que mediaría estos procesos, es a través de la estimulación de una familia de glucoproteínas conocidas como Wnt/B-catenina 10. Estas se unen a receptores conocidos como Frizzled (receptores acoplados a proteína G y a proteínas relacionadas con receptores lipoproteícos de baja densidad), proceso que logra estabilizar la-catenina e iniciar una compleja cascada de señales relacionadas con mecanismos de regulación génica 15.
TIPOS DE CÉLULAS MADREPLURIPOTENCIALESEntre ellas encontramos dos tipos: las células madre embrionarias y las células madre pluripotenciales inducidas (CMPi) 16.
Células madre embrionariasSon aquellas células aisladas del blastocito embrionario capaces de formar cualquier tipo celular provenientes de las tres capas embrionarias 17. Muchos han postulado que podrían ser las células más efectivas en la medicina regenerativa debido a su potencial suministro ilimitado de células diferenciadas 7. De hecho, estas células serían capaces de diferenciarse in vitro en células similares a hepatocito, las cuales poseerían algunas propiedades del hepatocito maduro, sin lograr reemplazar su función completa 3. Por otro lado, se ha descrito que la administración de éstas en ratones inmunodeficientes generaría teratomas 9. Lo anterior sumando a factores éticos y el riesgo de rechazo inmunológico de las células trasplantadas dificultarían su uso en humanos 3.
Células madre inducidasEstas células son producidas in vitro al reprogramar células somáticas, generalmente fibroblastos de la piel obtenidos mediante biopsia 18. Las células se expanden en cultivo y son sujetas a “reprogramación” mediante la expresión forzada de factores de transcripción tales como OCT3/4, SOX2, KLF4, y c-MYC mediante el uso de vectores retrovirales 3,18.
Las células similares a hepatocitos originadas de CMPi han sido usadas de forma exitosa en algunos desórdenes metabólicos congénitos hepáticos como el déficit de α1-antitripsina, hipercolesterolemia familiar y tirosinemia hereditaria entre otros y modelos experimentales de injuria hepática y hepatectomía parcial 18. Sin embargo, aún faltan estudios que aclaren el riesgo de tumores, memoria epigenética de las células reprogramadas y las posibles consecuencias ante cambios genéticos producto del proceso de “reprogramación” 3,18.
MULTIPOTENCIALESDentro de ellas se encuentras las de origen hematopoyético, mesenquimáticas, progenitoras hepáticas y endoteliales 16. Además podemos encontrar células madre en placenta y cordón umbilical 19.
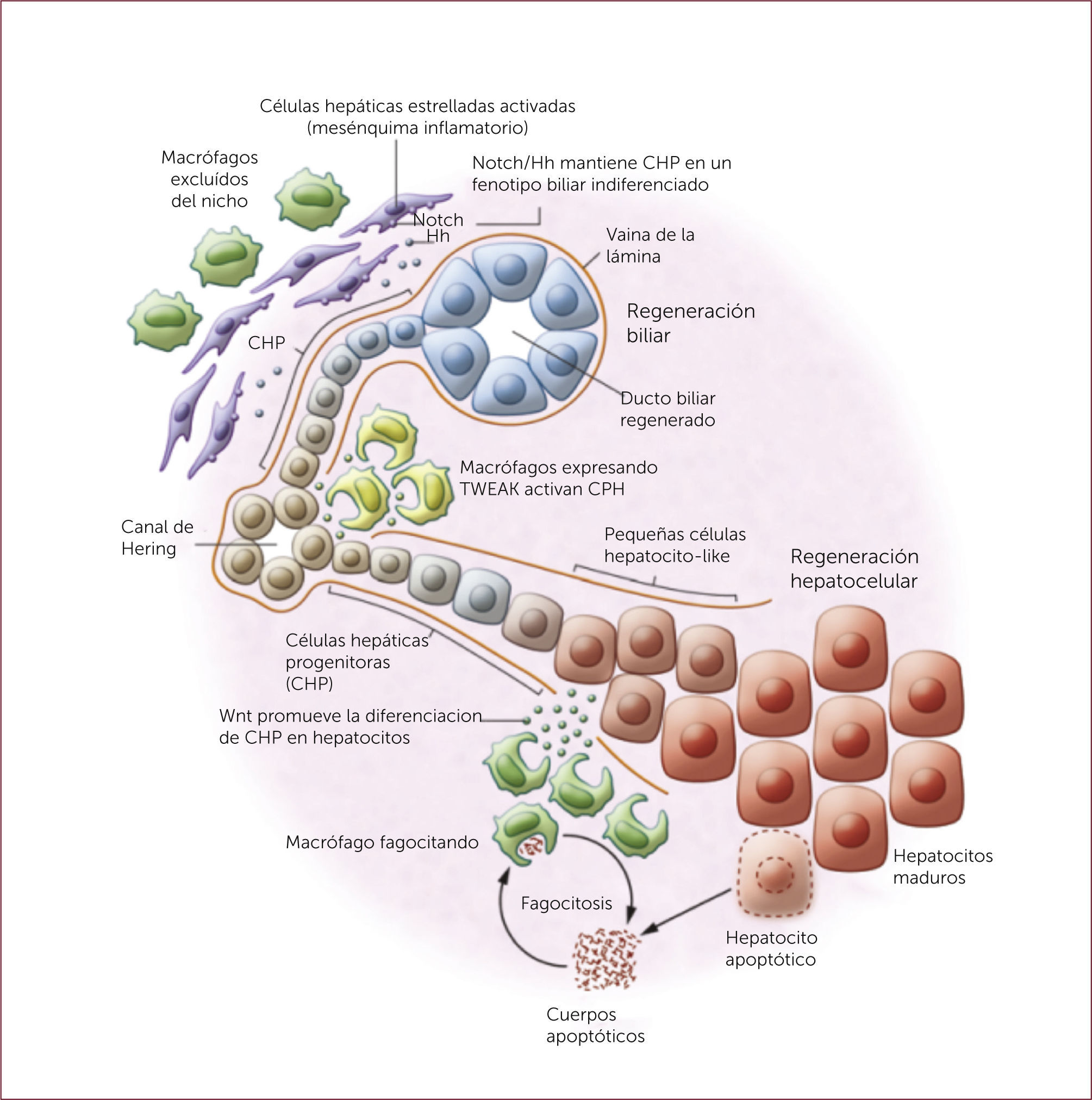
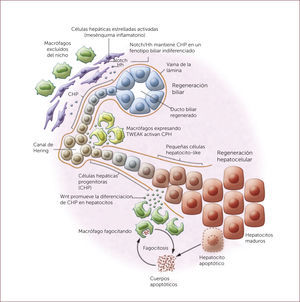
Células progenitoras hepáticasCorresponde a una población de células clonales, de aspecto ovalado, que se originarían del área periportal del hígado. Se ha propuesto que estas células constituyen el nicho de células madre hepáticas capaces de dar lugar a una gran población de hepatocitos. Estas células parecerían migrar desde el área portal a la vena central en el lobulillo hepático, diferenciándose en su recorrido en células parenquimatosas 20. La activación de células madres hepáticas fue descrita por primera vez en la rata, sometidas a injuria hepática en combinación con hepatectomía parcial, provocando la aparición de un nuevo tipo celular descrito de acuerdo a su morfología nuclear como célula oval 21. Cuando la replicación de hepatocitos se ve deteriorada, estas células que se localizan en la cercanía de los canales de Hering, comienzan a proliferar 18 (Figura 2). A pesar de que existen algunos estudios prometedores, en donde se ha observado reducción de la fibrosis luego del trasplante de estas células, otros estudios han observado el efecto contrario, resultando en un estímulo fibrótico severo 18.
REGENERACIÓN HEPÁTICA Y BILIAR
La regeneración hepática y biliar está dada por la activación de diferentes vías de activación. Por un lado, la interacción entre células progenitoras hepáticas (CPH) y Notch2 producen diferenciación y regeneración biliar. Por el otro, las CPH expuestas a Wnt, el cual es liberado por macrófagos, promueve la diferenciación y regeneración hepatocelular 22.
* Figura adaptada de Boulter L et a, J Clin Invest 2013; 123:1867-73 22.
Corresponden a las células circulantes derivadas de médula ósea (CMP-MO) CD34 y CD133 positivas 18. Se ha descrito que las células CD34+ corresponderían al 0.04% de la población de células nucleadas circulantes en la sangre periférica en ratones adultos, lo que implica una baja cantidad de células y por lo tanto requerirían de expansión celular para ser utilizadas como terapia 23. Para lograr inducir la diferenciación celular de estas células a hepatocitos la mayoría de los protocolos utilizan en el medio de cultivo factores de crecimiento y mitógenos, tales como: factor de crecimiento de hepatocitos (FCH), FCF, y Oncostatina M (OM) entre otros 1. Sin embargo, actualmente se piensa que el efecto beneficioso de la terapia celular con células hematopoyéticas está dado por un efecto paracrino que estas tendrían sobre las células progenitoras hepáticas, produciendo su activación 3. A pesar de que su eficiencia aún está siendo evaluada, el uso de estas células pareciera ser bastante seguro ya que no posee riesgos de rechazo ni necesidad de inmunosupresión 3.
Células madre mesenquimáticas (CMM)Estas células también forman parte de las CMP-MO y pueden además encontrarse en el tejido adiposo 18. Tanto las células mesenquimáticas obtenidas de médula ósea como las obtenidas desde el tejido adiposo han demostrado una mejoraría en la función hepática y promoverían su regeneración al ser trasplantadas 19.
Las CMM se caracterizan por sus múltiples propiedades terapéuticas, entre ellas se encuentran: diferenciación en células similares a hepatocitos, actividad inmunomoduladora, secreción de factores tróficos, actividad anti-fibrótica y anti-oxidante 24. Además, estas células tienen la particularidad de poseer una baja expresión de antígenos del complejo de histocompatibilidad clase I y ausencia del complejo mayor de histocompatibilidad clase II entre otras moléculas, lo que reduciría su potencial inmunogénico permitiendo su uso en trasplante alogénico 24.
En cuanto a las fuentes de obtención, se ha descrito en la literatura, que el tejido adiposo sería una de las fuentes más adecuadas para terapia celular, dada su fácil recolección a través de una liposucción simple, que a su vez tiene una mínima morbilidad en comparación con la obtención de CMP-MO las que se obtienen a través de procedimientos invasivos como la punción de médula ósea 25. Por otro lado, a diferencia de las células obtenidas de médula ósea, el número de células obtenidas del tejido graso no están influidas por la edad, sexo, presencia de osteoporosis ni exposición previa a quimioterapia o radioterapia 26. Cabe destacar que es posible obtener hasta 40 veces más CMM en 200ml de lipoaspirado que de 40ml de médula ósea 26,27.
Al igual que las CMH, la diferenciación celular de las CMM a hepatocitos requiere de factores de crecimiento y mitogénicos tales como FCH, FCF, OM, entre otros 24.
Estudios experimentales que han utilizado células madre provenientes de tejido adiposo (CMP-TA) humanas en ratones inmunodeficientes y daño hepático producido por tetracloruro de carbono, se ha observado una disminución significativa en las concentraciones de amonio, ácido úrico, aspartato aminotransferasa, y alanino aminotransferasa a las 24 horas del trasplante celular. La tinción inmunológica con antígeno leucocitario humano 1 (HLA-1) revelaría que estas células humanas estaban presentes en el ratón después de 24 horas de trasplante. Estos resultados indicarían que las CMP-TA estarían en este caso involucradas en la regeneración hepática in vivo26.
A pesar de que las CMM han sido ampliamente utilizadas en estudios clínicos y pre-clínicos de fibrosis hepática, varios factores aún deben ser considerados, incluyendo la potencialidad fibrogénica y oncogénica dada su capacidad para estimular el crecimiento de células tumorales y neovascularización 24,25. Desde el punto de vista fibrogénico, se ha descrito que las CMM podrían diferenciarse en miofibroblastos en lugar de hepatocitos, lo que podría depender de la vía de administración de estas células y el grado de fibrosis hepática. Por otra parte, un número significativo de CMM humanas exhiben una morfología miofibroblástica en la falla hepática aguda 24.
Vías de administraciónEn cuanto a la vía de infusión, por vena periférica parecería ser la ruta de elección, dado que se han descrito algunos efectos adversos al utilizar la vía sanguínea central. Por ejemplo, se ha reportado que al inyectar las células directamente en la vena porta existe el riesgo de provocar sangrado variceal por el incremento de la hipertensión portal ya existente. Por otro lado, la inyección de células madre en la arteria hepática presentaría el riesgo de disección de la arteria 28.
EXPERIENCIA CLÍNICAA la fecha existen un número importante de ensayos clínicos que han analizado el efecto de diferentes tipos celulares en la regeneración hepática, sin embargo la entrega de conclusiones válidas aún no ha sido posible dado la heterogeneidad de estos estudios 17. Al momento de analizarlos, el hecho de que se hayan usado diferentes vías de administración y se evalúen distintos resultados en el tiempo, hace que este proceso sea complejo. Además, la mayoría de los estudios fueron realizados en cohortes pequeñas de pacientes, con un seguimiento relativamente corto 28,29. A pesar de ello, cabe destacar que el trasplante de células madre demostró ser seguro independiente de la ruta utilizada. Por otro lado, la gran mayoría de los estudios demostraron mejoría de la función hepática, donde algunos de ellos además demostraron una disminución de la puntuación de MELD y Child Pugh 28,30,31.
Recientemente estudios en pacientes con falla hepática aguda sobre crónica secundaria a infección por Virus Hepatitis B, en donde se ha utilizado células madre de origen mesenquimático 32 y factor estimulante de colonias granulocitos (G-CSF) 33, han observado que la infusión de estas células y el uso subcutáneo de esta terapia, serían seguras y efectivas en la mejoría de la función hepática por la puntación de MELD. En otro estudio reciente se utilizó G-CSF seguido de la infusión de CMM autólogas por vía venosa periférica en pacientes con daño hepático crónico por Virus Hepatitis C con resultados favorables, donde no sólo observaron mejoría de la función hepática, sino que también una disminución en los niveles séricos de marcadores de fibrosis hepática 34.
A pesar de que existan algunas evidencias a favor de las células madre, en otros estudios no se ha demostrado beneficio. Un ensayo clínico randomizado mostró que el trasplante de células mononucleares autólogas de médula ósea en pacientes con daño hepático alcohólico descompensado no fue beneficioso, poniendo en duda su uso como terapia regenerativa al menos en este tipo de pacientes 35. Por otro lado, como ya se había mencionado antes, un riesgo potencial en el trasplante de CMM en paciente con cirrosis hepática es la formación de fibroblastos, contribuyendo así en la fibrogénesis 16.
Uso de factor estimulante de colonias granulocitas (g-csf)Se ha descrito que el tratamiento con G-CSF potencia significativamente la migración de células madre provenientes de médula ósea CMP-MO al hígado fibrótico y aumenta la expresión de metaloproteinasa 9 (MMP-9), lo que se asociaría a una resolución acelerada de las bandas fibrosas. Estos resultados sugieren que el G-CSF no solo recluta CMP-MO de la sangre periférica sino que también influye de forma positiva en su migración y cambio fenotípico en el hígado fibrótico 36.
ComplicacionesComo se ha mencionado previamente, las cuatro principales complicaciones derivadas del uso de células madre serían:
- 1)
Relacionadas con la vía de infusión
- 2)
Riesgo de rechazo inmunológico, principalmente con el uso de células madre embrionarias
- 3)
Fibrosis
- 4)
Carcinogénesis
Con relación a la fibrosis, existiría evidencia en animales de experimentación que indicaría que las CMP-MO podrían tener un efecto potencialmente dañino en el parénquima hepático, en donde éstas no se diferenciarían en hepatocitos y se mantendrían como células mesenquimales, expresando colágeno y alfa actina de músculo liso, marcador de diferenciación miofibroblástico, lo que podría contribuir al desarrollo de tejido fibrótico 37. Este comportamiento se debería a que el hígado dañado secretaría factores de crecimiento y citoquinas, como por ejemplo factor de necrosis tumoral alfa, interleuquina 6 y factor de crecimiento transformante beta 1 (TCF-B1). De esta forma, niveles aumentados de TCF-B1 podría inducir la migración de CMP-MO a través de moléculas tales como CD44 y la diferenciación de CMP-MO a miofibroblastos 37.
En cuanto a complicaciones oncogénicas, el mayor temor se relacionaría al potencial riesgo de hepatocarcinoma (HCC) dado que se ha sugerido que el HCC poco diferenciado se originaria a partir de células hepáticas ovales y CMP-MO 38. Sin embargo, se ha descrito que la transformación espontánea de las CMM en tumores es rara y ocurriría luego de un tiempo relativamente largo de cultivo (> 5 semanas) 39.
Estas observaciones tanto de factores a favor y en contra de la terapia con células madre se resumen en la Tabla 2.
FACTORES A FAVOR Y EN CONTRA DEL USO DE CÉLULAS MADRE
| FACTORES A FAVOR | FACTORES EN CONTRA |
|---|---|
| Fácilmente accesibles | Poco disponible |
| Administración segura* | Requieren cultivo y expansión |
| Bajo riesgo de rechazo (autólogas) | Riesgo de fibrosis* |
| Regeneración y mejoría de la función hepática* | Riesgo de tumores* |
| Factores éticos (embriológicas) | |
| ¿Costo?** |
* Aún por confirmar.
** Por definirse, según realidad de cada centro.
Las células madre podrían ser una alternativa razonable al trasplante hepático en el futuro. A pesar de que numerosos estudios experimentales y clínicos han utilizado estas terapias y han demostrado una mejoría en algunos aspectos de la función hepática con un perfil de seguridad adecuado, aún no es posible determinar a ciencia cierta cuales son los beneficios, riesgos reales y duración de esta terapia. Cabe considerar que los riesgos de oncogenicidad y fibrosis aún no están resueltos. Por otro lado, los estudios son heterogéneos, lo que dificulta la comparación de los resultados. Se requiere de más estudios homogéneos, prospectivos, con un mayor número de pacientes y seguimiento prolongado en el tiempo para determinar los beneficios y efectos colaterales reales de esta terapia.
Los autores declaran no tener conflictos de interés, en relación a este artículo.