La cetoacidosis diabética es una complicación de la diabetes mellitus que se da con más frecuencia en pacientes
con DM tipo 1. Los factores desencadenantes pueden ser desde falta de adherencia al tratamiento a infecciones,
siendo estas últimas las más frecuentes. Sin embargo, en ocasiones, detrás de esta situación subyacen problemas
neoplásicos. La DM se asocia con diversas neoplasias, entre las que destaca, la neoplasia de páncreas.
Diabetic ketoacidosis is a complication of diabetes mellitus that occurs more frequently in patients with Type
1 Diabetes Mellitus. The triggers can be from lack of adherence to treatment to infections, the latter being
the most frequent. However, sometimes behind this situation lie neoplastic problems. DM is associated with
various neoplasms, among which, the pancreatic neoplasm stands out.
La CAD ocurre con mayor frecuencia en pacientes con DM 1 autoinmune. El número acumulado de casos de CAD en pacientes con diabetes de tipo 2 (DM 2) representa al menos un tercio de todos los casos, asociada en estos casos a situaciones de estrés extremo. La CAD ocurre como debut de la diabetes en un 30-40% de los niños con DM 1, y en cerca del 20% de los pacientes adultos y es la principal causa de mortalidad entre los niños y los adultos jóvenes con DM 1.
Entre los mecanismos que dan lugar a la CAD se encuentra una combinación de reducción de la secreción y acción de la insulina y niveles elevados de hormonas contrarreguladoras (glucagón, catecolaminas, cortisol y hormona de crecimiento). La deficiencia de insulina de la CAD puede ser absoluta, como en la diabetes de tipo 1, o relativa, como en la diabetes de tipo 2 en presencia de una liberación aumentada de hormonas contrarreguladoras que causan un empeoramiento de la resistencia a la insulina y un mayor deterioro de la secreción de insulina. Dentro de los factores precipitantes se encuentran múltiples causas, siendo la más frecuente la presencia de una infección intercurrente -en especial las infecciones del tracto urinario y la neumonía-. Existen otras circunstancias que pueden actuar como precipitantes, tales como una irregular adherencia al tratamiento, accidente cerebrovascular, abuso de alcohol, pancreatitis, embolia pulmonar, infarto de miocardio y el tratamiento con algunos fármacos que afectan el metabolismo de los hidratos de carbono, como los corticosteroides, las tiazidas, los agentes simpaticomiméticos, la pentamidina y los agentes antipsicóticos atípicos.
La DM se ha asociado a diversos procesos tumorales1. La incidencia general de cáncer en pacientes con diabetes es entre un 10-20% mayor que en la población general2. Múltiples estudios ponen de manifiesto su relación con el cáncer de páncreas (CP), hígado, endometrio, mama y colorrectal3. El CP es la neoplasia que con mayor frecuencia se asocia a la DM, con un riesgo relativo en torno a 1.5 veces en pacientes con DM respecto a la población general4. Entre los pacientes que padecen ambos procesos no se ha encontrado mayor incidencia de hábito tabáquico, pancreatitis, antecedentes de gastrectomía o colelitiasis en comparación con los diabéticos sin CP, aunque los pacientes con CP son más añosos y tenían antecedentes de otros procesos neoplásicos.
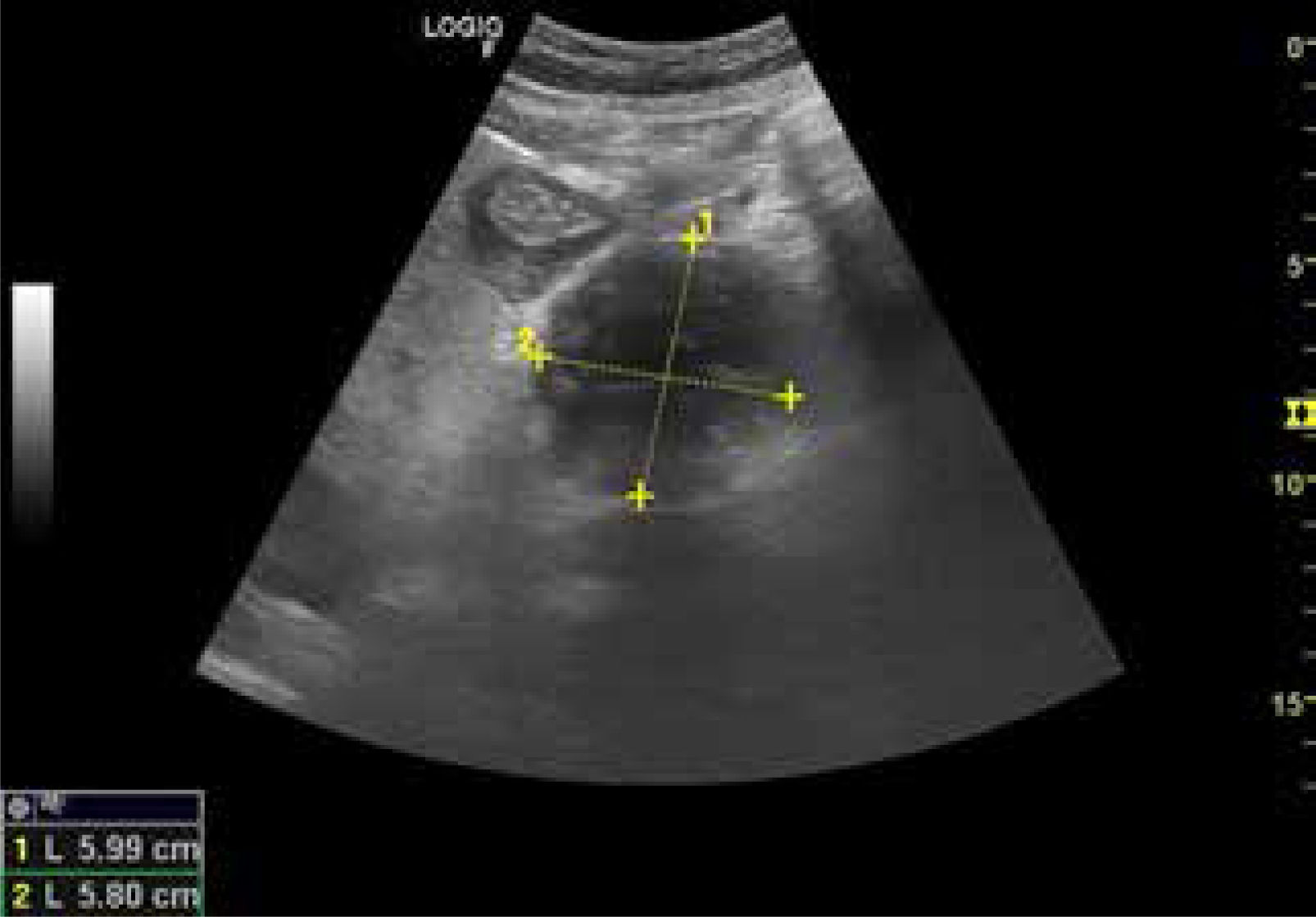
2CASO CLÍNICOVarón de 68 años, fumador de 30 paquetes/año y con antecedentes personales de obesidad (IMC 31kg/m2), diabetes mellitus tipo 2 con adecuado control metabólico y sin complicaciones micro ni macrovasculares e hipertensión arterial esencial, en tratamiento con metformina 850mg cada 12 horas y ramipril 5mg cada 24 horas. Padre diabético fallecido de cáncer de páncreas. Consultó en el servicio de urgencias por cuadro de 4 días de evolución caracterizado por polidipsia, poliuria y polifagia, acompañado de deterioro del estado general y dolor abdominal difuso. Presentaba pérdida ponderal de 5kg en aproximadamente mes y medio. En la exploración física destacó ictericia, sequedad mucocutánea y dolor a la palpación en epigastrio e hipocondrio derecho, sin presencia de irritación peritoneal. En cuanto a la analítica, el hemograma fue normal y en la bioquímica destacó una glucosa de 541mg/dl, bilirrubina total de 3.3mg/dl (valor normal —VN— hasta 1.20mg/dl) a expensas de bilirrubina directa, GOT de 98 U/L (VN hasta 21 U/L) y GPT de 202 U/L (VN hasta 12 U/L). La lipasa, sodio, potasio, magnesio y la proteína C reactiva fueron normales. La gasometría venosa reveló un pH de 7.31, pCO2 41mmHg, HCO3 15.40 mmol/l. El sistemático de orina reveló glucosa+++y cuerpos cetónicos++++. La radiografía de tórax fue normal. Con el diagnóstico de cetoacidosis diabética (CAD), se inició tratamiento con bolo de insulina rápida (0,1 UI/kg de peso corporal), seguido de bomba de perfusión de insulina (50 U de insulina rápida en 500ml de suero a un ritmo de salino a 0.1 UI/kg/h) con posterior reducción del ritmo infusión a 0.05 UI/kg/h cuando la glucemia fue menor de 200mg/dl, momento en el que se pautó 16 UI de insulina glargina y se suspendió la bomba cuatro horas después y sueroterapia con solución salina isotónica (0.9% de cloruro sódico) a una velocidad de 500-1000mL/h durante las primeras dos horas, con posterior reducción del ritmo a 250ml/h y la adicción de suero glucosado al 5% cuando la glucemia fue menor de 200mg/dl. Se realizó ecografía abdominal clínica en la cabecera del paciente que reveló lesión y dilatación de la vía biliar intra y extrahepática (fig. 1).
La TC de abdomen confirmó la presencia de la lesión pancreática y se realizó colangiopancreatografía retrograda (CPRE) que permitió colocar un drenaje biliar tras colocación de prótesis biliar plástica y realizar punción con aguja fina que permitió el diagnóstico de adenocarcinoma de páncreas.
3RESULTADOSEl desarrollo de DM en pacientes con CP ha sido, y es, objeto de estudio en múltiples estudios. Gullo et al. concluyeron que en el 16% de los pacientes con CP, la DM se manifiesta 2 años antes del diagnóstico del CP y simultáneamente hasta en el 40% de los pacientes5. En un primer momento, la patogenia de esta asociación se explicó por la severidad de la enfermedad neoplásica. En su estudio, Permet et al. observaron que los pacientes con CP presentaban, en ayunas, valores elevados del polipéptido amiloide de los islotes (IAPP), de glucagón y de somatostatina, sin embargo estas elevaciones no se han observado en otros procesos malignos, a excepción del cáncer colorrectal, en el que se evidencia una elevación de somatoestatina6. Estos hallazgos sugieren que en pacientes con DM conocida, que sufren descompensación diabética sin una causa aparente (infecciones, adherencia escasa al tratamiento…) debería pensarse en el CP como causa la misma7. Estos autores observaron que el tratamiento quirúrgico conducía a una normalización de los valores de IAPP, glucagón y mejoría del estado diabético. Hallazgos que sugieren que el metabolismo de los hidratos de carbono observados en el CP está relacionado con el propio tumor, que es fuente de secreción hormonal8. Sin embargo, se han reportado casos en los que la cirugía no mejora el control glucemia, dejan entrever la existencia de otros factores etiopatogénicos implicados9.
Hoy en día, los mecanismos que conducen a DM en el CP están sin esclarecer. Publicaciones más recientes asocian la DM con el desarrollo periférico de resistencias a la insulina, dejando en su segundo plano la destrucción de células beta por el tumor. Con esta hipótesis se justifica la mejora del control glucémico como consecuencia de la pérdida de peso que experimentan los pacientes tras la cirugía de CP10.
Otro hecho que nos debe hacer reflexionar a cerca de la presencia simultánea de DM y CP es que ambas entidades comparten factores de riesgo para su desarrollo, tales como, la edad avanzada, obesidad, dietas ricas en grasas saturadas, consumo de alcohol, tabaquismo y pancreatitis crónicas.
La incidencia de DM en pacientes con carcinoma pancreático es muy alta. Paralelamente, la DM predispone al desarrollo del tumor. La rentabilidad de realizar cribado en toda la población diabética es muy baja, dada la alta incidencia de DM en la población general. Es importante destacar que las infecciones y la falta de adherencia terapéutica son las causas más frecuentes de descompensación de un paciente diabético, pero en ausencia de estas o incluso coexistiendo con estas puede haber una patología maligna. Por ello, si consideramos a los pacientes diabéticos un grupo de riesgo, el inicio de la diabetes o la descompensación aguda de DM no sólo podría considerarse un factor riesgo de desarrollo de CP, sino como guía diagnóstica para un diagnóstico temprano.
4CONCLUSIONESLa DM puede manifestarse hasta dos años antes del diagnóstico del cáncer de páncreas. Por lo que una descompensación diabética sin causa aparente junto con síndrome constitucional nos puede hacer sospechar la presencia de neoplasia.
En un 40% de los pacientes, la presencia de DM es simultánea al diagnóstico de CP. El inicio de la diabetes no sólo podría ser un factor de riesgo de desarrollo de cáncer de páncreas, sino un signo temprano del mismo.
5Declaración conflicto de interesesLos autores declaran que no tienen ningún conflicto de interés
[Cetoacidosis diabética como guía diagnóstica:Caso clínico - Javier Miguel Martín Guerra y cols.][REV. MED. CLIN. CONDES - 2019; 30(4) 323-325]