La enfermedad venosa tromboembólica es una patología de alta morbimortalidad que se presenta en un variado espectro de pacientes. La angiotomografía de tórax es actualmente el estándar de oro para su diagnóstico y suele sobresolicitarse, con una alta tasa de resultados negativos. Es por esto que debe estandarizarse la racionalidad del estudio diagnóstico de esta enfermedad de una manera eficiente, introduciendo escalas de probabilidad clínica pretest validadas. Una vez hecho el diagnóstico se debe establecer el riesgo de mortalidad, dado fundamentalmente por la disfunción aguda del ventrículo derecho, que se evidencia en parámetros clínicos, de laboratorio, tomográficos y ecocardiográficos.
Venous thromboembolic disease is an entity with high morbidity and mortality that occurs in a wide spectrum of patients. Chest CT angiography is currently the gold standard for diagnosis and is usually over requested, with a high rate of negative results. This is why rationality should be given to standardize diagnostic studies of this disease in an efficient manner, introducing pretest clinical probability scales validated. Once the diagnosis is done, it is important to establish the risk of mortality, mainly given by acute right ventricular dysfunction, as evidenced by clinical, laboratory, and tomographic and echocardiographic features.
La enfermedad tromboembólica venosa (TEV) involucra la trombosis venosa profunda (TVP) y el tromboembolismo pulmonar (TEP) y complica a pacientes de todas las edades, especialmente postoperados, oncológicos y embarazadas. El TEP es la tercera causa de muerte cardiovascular, tras la enfermedad coronaria y los accidentes vasculares cerebrales. No es una enfermedad que se pueda diagnosticar ni excluir con certeza sin la ayuda de estudios de imágenes de alto costo, lo que obliga a incorporar estrategias de enfrentamiento costo-efectivas. El análisis siempre debe empezar por la probabilidad clínica del diagnóstico TVP/TEP, basándose en los factores de riesgo presentes: antecedentes de TEV anteriores, edad avanzada (70 años), cáncer activo (especialmente pulmón, páncreas, colorrectal, riñón y próstata), poca movilidad por trauma o cirugía reciente, daño neurológico o uso de férulas de inmovilización, viajes prolongados, portadores de catéteres intravenosos, embarazo, anticonceptivos orales o terapia de reemplazo hormonal con estrógenos, obesidad, trombofilias adquiridas (mutación de factor V Leiden o gen de protrombina y deficiencias de proteina S, C o antitrombina), síndrome antifosfolípidos, insuficiencia cardíaca congestiva, enfermedad inflamatoria intestinal, síndrome nefrótico, hiperhomocisteinemia, policitemia vera, trombocitosis esencial o hemoglobinuria paroxística nocturna.
Diagnóstico de tromboembolismo venosoLa trombosis venosa profunda se presenta como dolor y edema localizado a lo largo del sistema venoso profundo de extremidades inferiores o superiores. Las principales complicaciones de la TVP son TEP y síndrome post-trombótico. La tromboflebitis superficial también debe incluirse en este espectro patológico, ya que hasta en 25% de los casos hay TVP concomitante. Un examen de dímero-D con sensibilidad apropiada (ELISA o método turbidimétrico avanzado) en un paciente con baja probabilidad clínica, descarta TVP con tranquilidad. Los pacientes con probabilidad clínica moderada o alta deben someterse a una ecografía Doppler dúplex color venosa de toda la extremidad para excluir o confirmar el diagnóstico. En localizaciones centrales como región subclavia o pelviana se pueden requerir imágenes adicionales como tomografía computada o resonancia magnética.
De todas las TVP proximales de extremidades inferiores, 50% embolizan al pulmón, muchas veces en forma asintomática. Los síntomas que más frecuentemente se asocian con TEP son disnea, dolor torácico tipo pleurítico, hemoptisis, síncope y tos. Al examen físico los pacientes pueden presentar taquipnea, taquicardia e hipotensión. En la radiografía de tórax (habitualmente normal) puede verse hemidiafragma elevado por pérdida de volumen pulmonar, opacidades segmentarias, derrame pleural o atelectasias lineales. El electrocardiograma (alterado en menos de 10% de las veces) puede mostrar taquicardia sinusal, S1Q3T3, desviación del QRS a derecha, BCRD transitorio, inversión de ondas T y depresión del segmento ST en percordiales derechas. En los gases arteriales, que pueden ser normales hasta en 40% de los TEP, puede existir hipoxemia, hipocapnia y aumento de la diferencia alvéolo-arterial de oxígeno.
Al enfrentar un paciente con sospecha de TEP se deben analizar los factores de riesgo y los elementos clínicos para llegar a una apuesta de probabilidad clínica. Se recomienda siempre implementar en Servicios de Urgencia algún sistema de puntuación de probabilidad diagnóstica de TEP previo a los exámenes (dímero-D o angioTAC). El más utilizado es el Puntaje de Wells Simplificado (Tabla 1), que tiene un rendimiento similar a otros más complejos (Wells original o Ginebra revisado)1. Separa a los pacientes en dos grupos de riesgo: bajo y alto. Al igual que en TVP, si la probabilidad clínica es baja para TEP y el dímero-D es normal, no se requiere más estudio ni tratamiento, ya que el valor predictivo negativo (VPN) es 99%. Existe evidencia actual que sugiere que el punto de corte del dímero-D debe ajustarse por edad en pacientes sobre 50 años2. Si el punto de corte es 500 mcg/L, se debe multiplicar por la edad por 10 (es decir a los 60 años el valor normal es 600 mcg/L y a los 75, 750 mcg/L).
Criterios modificados y simplificados de wells para evaluación de probabilidad pretest de tep
| CRITERIO | PUNTOS |
|---|---|
| Síntomas y signos clínicos de TVP | 3.0 |
| Diagnóstico alternativo menos probable que TEP | 3.0 |
| Frecuencia cardíaca >100x’ | 1.5 |
| Inmovilización prolongada | 1.5 |
| Cirugía en las últimas 4 semanas | 1.5 |
| TVP o TEP previos | 1.5 |
| Hemoptisis | 1.0 |
| Cáncer (en tratamiento actual o menos 6 meses o en cuidados paliativos) | 1.0 |
| RIESGO | |
| Baja | <4 |
| Alta | ≥4 |
Si la probabilidad clínica es alta o el dímero-D está elevado, se debe realizar una angiotomografía computada (angioTAC) de tórax helicoidal multicorte, con protocolo de TEP, que tiene sensibilidad y especificidad mayores a 95%, con un VPN a tres meses de 99%3. En pacientes con contraindicación absoluta de medio de contraste por anafilaxia o insuficiencia renal, se puede usar un cintigrama V/Q si no hay opacidades parenquimatosas ni derrame pleural que interfieran con la interpretación (examen de primera línea en embarazo por menor radiación). Una ecografía Doppler positiva para TVP en paciente con alta probabilidad clínica de TEP certifica diagnóstico sin necesidad de más imágenes (conducta útil en embarazo, período en que el dímero-D pierde rendimiento y mayor riesgo por radiación del angioTAC).
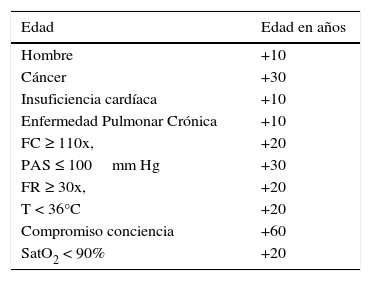
ESTRATIFICACIÓN DE RIESGO Y MANEJO DE PACIENTES CON TEPUna vez hecho el diagnóstico de TEP es necesario clasificar el riesgo de mortalidad de TEP precozmente en la evaluación: bajo riesgo, submasivo o masivo. Alrededor de 70% de los TEP son de bajo riesgo y actualmente hay evidencia que sugiere que pueden ser manejados en forma ambulatoria4. El riesgo de mortalidad en TEP lo confiere fundamentalmente la presencia de sobrecarga del ventrículo derecho. La primera cortina de evaluación de riesgo es la clínica. La escala más utilizada es el puntaje Pulmonary Embolism Severity Index (PESI)5, que toma en cuenta comorbilidad y signos clínicos al momento de la evaluación inicial (Tabla 2). Divide a los pacientes en 5 grupos de riesgo según puntaje total, teniendo los grupos 1-2 3,5% de mortalidad en el seguimiento a largo plazo. La segunda barrera de estratificación de riesgo por disfunción de ventrículo derecho es la bioquímica, donde el pro-BNP y las troponinas han demostrado tener un valor predictor de complicaciones, recurrencia y mortalidad,6,7. Finalmente, una relación alta de diámetros de ventrículo derecho/ventrículo izquierdo (VD/VI), medidos en el angioTAC de tórax, es otro marcador de mal pronóstico validado en TEP8. Por lo tanto un paciente con diagnóstico de TEP, pero con un puntaje clínico de PESI bajo, con proBNP y troponinas normales y una relación VD/VI bajo 1, tiene bajo riesgo de mortalidad y puede iniciar anticoagulación efectiva y manejarse en forma ambulatoria precozmente con un control estrecho9. Si alguno de los parámetros descritos orientan a disfunción de ventrículo derecho, el paciente se rotula de TEP al menos submasivo y debe hospitalizarse en una unidad de monitorización estricta, ya que un 5% evoluciona con hipotensión y shock, es decir, TEP masivo.
En el cuidado del paciente con TEP submasivo o masivo es indispensable la monitorización hemodinámica, ya que la progresión a shock es progresiva, a veces rápida, siendo la taquicardia el signo más precoz. El ecocardiograma de superficie es muy útil en esta etapa ya que sirve para evaluar la función del ventrículo derecho, permitiendo identificar pacientes de alto riesgo aunque estén hemodinámicamente estables10. Si el paciente que se hospitalizó sin criterios de TEP de bajo riesgo (PESI alto, elevación de proBNP y/o troponina o dilatación de VD en angioTAC de tórax) no tiene criterios de disfunción de ventrículo derecho en ecocardiografía y no desarrolla compromiso hemodinámico en las primeras 24-48 horas de evolución, se clasifica de TEP submasivo, se inicia anticoagulación efectiva y puede seguir manejo en ambiente de pacientes estables. La fibrinolisis con alteplase o tenecteplase en este grupo de pacientes no representa beneficio y puede aumentar el daño al aumentar los sangrados significativos, incluyendo hemorragia intracerebral11. Si hay desarrollo de hipotensión y shock por hipodébito secundario al TEP se transforma en una situación clínica de alta mortalidad (masivo) y está indicada la fibrinolisis sistémica (t-PA 100mg en 2 horas o 50mg en 15 min) o intrapulmonar, otras terapias dirigidas por catéter (trombolisis fármaco-mecánica) e incluso embolectomía quirúrgica de salvataje12.
La anticoagulación es el tratamiento estándar para TVP de extremidad superior, inferior y TEP. El filtro de vena cava inferior se reserva para aquellos pacientes en que hay contraindicación absoluta de anticoagulación, que han hecho TEV recurrente a pesar de anticoagulación efectiva o en pacientes que han hecho un TEP y tienen muy baja reserva cardiopulmonar, con una alta mortalidad en caso de una recurrencia13.
La terapia anticoagulante se ha simplificado sustancialmente en la actualidad por contar con heparinas de bajo peso molecular (HBPM) que han reemplazado a la no fraccionada intravenosa y con anticoagulantes orales que no necesitan monitorización de niveles plasmáticos terapéuticos como con los antagonistas de la vitamina K (acenocumarol o warfarina).
El esquema clásico de inicio de terapia en TEV es de heparina seguida por acenocumarol o warfarina, reduciendo la mortalidad por TEP de 25-30% a alrededor de 2.5%. No se debe utilizar acenocumarol o warfarina solas inicialmente porque aumenta el riesgo trombótico los primeros días. Las HBPM (enoxaparina, dalteparina) son tan efectivas y seguras como la heparina no fraccionada y logran llegar a dosis terapéuticas más rápido, se usan en dosis fijas y confieren menos riesgo de sangrados mayores. La heparina no fraccionada intravenosa tiene un nicho aún en pacientes con insuficiencia renal con VFG 30 ml/min o pacientes muy inestables con eventual indicación de cirugía de salvataje, ya que las HBPM son parcialmente reversibles con protamina. La enoxaparina se usa en dosis de 1 mg/kg subcutánea cada 12 horas o 1.5 mg/kg cada 24 horas. La dalteparina, 120 U anti-Xa/kg subcutánea cada 12 horas. El traslape a acenocumarol o warfarina se inicia generalmente en primeras 24 horas desde el diagnóstico y se debe mantener la heparina por 5 días o hasta tener al menos 2 días de niveles de INR terapéutico (2.0 – 3.0). En pacientes oncológicos que presentan TEV significativo se sugiere que sigan con HBPM y no hacer transición a antagonistas de vitamina K orales por 3 veces más riesgo de recurrencia.
La actividad de las HBPM generalmente no se monitoriza, excepto en embarazadas, en pacientes con VFG 30 ml/min o en obesos mórbidos, en quienes se sugiere medir actividad pico anti-Xa. La trombocitopenia inducida por heparina (TIH) es una complicación infrecuente pero grave de la terapia con heparina, que causa trombosis arterial y venosa, rara vez, hemorragias. Se produce por anticuerpos anti-plaquetarios dependientes de heparina y se debe sospechar en pacientes que hacen trombos bajo heparina o que desarrollan plaquetopenia. Es raro que se presente después de los 14 días con heparina.
La dosis inicial de warfarina generalmente es de 5mg (usar menos dosis en pacientes muy enflaquecidos o con daño hepático crónico) y es mejor usarla en las tardes. Las dosis subsecuentes varían según el tiempo de protrombina/INR, que debe medirse al menos 2 veces la primera semana (no antes del 3er día con warfarina). Los pacientes bajo warfarina por 3 meses en rango terapéutico tienen un riesgo de sangrado mayor de 6%/ año y sus niveles plasmáticos se ven interferidos por alimentos y otros medicamentos, elementos que deben estar contemplados en la educación del paciente.
La anticoagulación de una TVP o de un TEP con factor provocador evidente debe extenderse por tres meses. Si no hay un factor de riesgo, se debe discutir el riesgo-beneficio de descontinuar la terapia con cada paciente, siendo conveniente extender la anticoagulación si el riesgo de sangrado es bajo, ya que el riesgo de recurrencia alcanza el 30% a 5 años. En el contexto de TEV en paciente con cáncer activo, el tiempo de terapia debe ser al menos 6 meses y en TEV recurrentes o trombofilias de alto riesgo la anticoagulación debe ser indefinida, reevaluando periódicamente el riesgo-beneficio. El riesgo que se asume al detener terapia anticoagulante es siempre motivo de ansiedad en el paciente. Una forma de evaluar el riesgo es medir dímero-D un mes después de detenida la terapia. Si persiste elevado el riesgo de recurrencia es mayor y se puede prolongar la terapia anticoagulante. Otra manera de evaluar riesgo al suspender terapia es con ecodoppler de EEii, buscando TVP residual. Hay evidencia del beneficio de continuar con aspirina en dosis bajas (100 mg) como prevención secundaria de TEV después de descontinuada la terapia anticoagulante. Los datos para apoyar el beneficio de estatinas como prevención secundaria de TEV son menos fuertes, pero vale la pena continuar en pacientes que ya utilizaban.
Nuevos anticoagulantes. Drogas que prometen no requerir monitorización, ser igual o más eficaces con menos riesgo de sangrado. El problema es que hasta el momento no hay fácil disponibilidad de antagonistas para lograr rápida reversión de efecto anticoagulante. El rivaroxabán antagoniza el factor X activado (Xa) y no está recomendado en pacientes con falla renal y contraindicado con VGF 30 ml/min. Ha demostrado ser al menos no inferior a warfarina y no necesita uso inicial de heparina14. Ha sido utilizado en esquemas extendidos de hasta 12 meses en primeros episodios idiopáticos de TEP. Se usa en dosis iniciales de 15mg cada 12 horas por 3 semanas y luego 20 mg/día de mantención con costo mensual equivalente a 287 dólares en enero 2014 en EE.UU. El dabigatrán tiene como blanco el factor II activado y ha demostrado no inferioridad al comprarse con warfarina, ambos con terapias iniciales con HBPM o heparina no fraccionada15. La dosis es de 150mg 2 veces al día con costo de 315 dólares mensuales. El apixibán, que se usa inicialmente con 10mg 2 veces al día por 1 semana y luego 5mg al día (valor entre 286 – 573 dólares mensuales), también está dirigida contra factor Xa y también ha demostrado no inferioridad a terapia estándar16. El fondaparinux es un pentasacárido sintético que se une a antitrombina e inhibe Xa17, útil en presencia de TIH ya que tiene baja afinidad por factor 4 plaquetario. Se usa en 1 dosis diaria subcutánea y no requiere monitorización de laboratorio.
El embarazo es un estado procoagulante, con fuerte asociación a trombofilias, con mayor incidencia de TEV, ya sea durante el embarazo o en las 4 a 6 semanas postparto. Una mujer con trombofilia de alto riesgo como déficit de antitrombina o síndrome antifosfolípidos o con TEV en un embarazo previo debe recibir profilaxis con HBPM durante todo el embarazo (no cruza la placenta). Un antecedente de las otras trombofilias sin TEV obliga a seguimiento cercano pero no profilaxis necesariamente. La warfarina no se usa en embarazo por teratogénica y mayor riesgo de hemorragia intracraneal en el parto.
Se sugiere hacer estudio de trombofilia en aquellos pacientes con TEV no provocada con fuerte historia familiar o bajo 50 años, en sitios raros (cerebral, mesentérica), con episodios recurrentes, abortos a repetición o en embarazo. Se sugiere hacer el estudio de trombofilia unas 6 semanas después de terminado el uso de antagonistas de vitamina K o 6 semanas después del episodio agudo con nuevos anticoagulantes.
En individuos en alto riesgo de TEV que viajarán más de 8 horas pueden beneficiarse de 1 dosis plena de HBPM 2-4 horas antes del viaje. Con riesgo moderado basta sugerir medias elásticas compresivas (15-30 mmHg), hidratación adecuada, deambular durante el viaje con ejercicios de pantorrillas. Aún no hay evidencia que respalde el uso de nuevos anticoagulantes con este fin.
TRATAMIENTO ENDOVASCULAR EN TEPEl tratamiento endovascular está indicado en TEP de alto riesgo con contraindicación absoluta o relativa a la trombolisis sistémica, o en pacientes que fueron sometidos a trombolisis sistémica, pero no logran recuperar el estatus hemodinámico ni ventilatorio18.
Los pacientes de alto riesgos son:
- •
Pacientes que se presentan con shock o hipotensión
- •
Post paro cardiorespiratorio
- •
Paciente que se presenta con falla ventricular derecha aguda
- •
Visualización de trombos por eco en arteria pulmonar principal
El objetivo de intervención percutánea es remover o fragmentar el trombo obstructivo de la arteria pulmonar principal y así, disminuir la resistencia vascular pulmonar (la post carga del ventrículo derecho) y recuperar la función ventilatoria y el gasto cardíaco.
La angiografía pulmonar antiguamente era utilizada como herramienta de oro para el diagnóstico o exclusión de TEP, en la que se documenta un defecto de llene o amputación de una o más las pulmonares en al menos dos proyecciones. Los trombos de menos de 2mm en arterias subsegmentarias son difíciles de identificar. Durante el procedimiento es fundamental el registro y medición de presiones en la circulación pulmonar, para estimar la severidad y los cambios hemodinámicos durante la intervención.
Actualmente es utilizada como guía durante de intervención. Las técnicas intervencionales y dispositivos utilizados son:
- •
Fragmentación de trombos: Consiste en desorganizar el trombo y dividirlo en fragmento de menor tamaño, esto puede se realizar en forma manual con catéteres como pigtail o con balones que dilatan la zona donde esta el trombo. La desventaja de esta técnica es que desencadena macroembolías y podrían desencadenar mayor deterioro hemodinámico.
- •
Trombectomía reolítica: Es un catéter que inyecta solución salina a presión a nivel del trombo y genera, por el principio de Bernoulli, remoción de fragmentos de trombos (Angiojet®). Los efectos adversos descritos son bradicardia y hemoglobinuria secundaria a hemólisis que habitualmente es reversible.
- •
Embolectomía por succión: Es la extracción de trombos por succión, puede ser manual con catéter de lúmenes 8-9F aplicando presión negativa con jeringas de 60ml, inconveniente de esta técnica es la hipovolemia y la anemia asociada a cada succión.
- •
Trombectomía rotacional: Es un catéter (Aspirex ®) que en su parte central tiene un espiral y en su superficie tiene múltiples orificios en forma de L. Al girar a alta velocidad este espiral genera una presión negativa aspirando el material y macerando el trombo.
- •
Trombolisis directa por catéter: es otra estrategia en pacientes sin contraindicación a trombolisis, o con contraindicación relativa, se han descritos pequeñas series y los regímenes de tratamiento han sido variables con dosis de 2 a 10mg de t-PA por arteria pulmonar principal, y se describen menor numero de complicaciones hemorrágicas.
Habitualmente se realiza una combinación de técnicas, y del punto de vista angiográfico el objetivo es la apertura de las arterias pulmonares principales ocluidas y una disminución de la presión arteria pulmonar media en 5 a 10mm Hg. Luego esperar que el tratamiento farmacológico logre lisis de estos trombos. El mayor riesgo de estas técnicas es la perforación de las arterias pulmonares, y la recomendación es solo intervenir las ramas principales y las de los lóbulos inferiores. Ramas menores de 6mm no deben intervenirse.
La evidencia de estas intervenciones no ha sido comparada en ensayos randomizados versus trombolisis sistémica, solo son series de casos en un solo centro. Estos estudios concluyen que la tasa de éxito clínico, definido como estabilización de los parámetros hemodinámicos, resolución de la hipoxia y sobrevida al alta fue 87%, presentado complicaciones mayores en rango de 2 a 8%. Existe un subreporte de complicaciones como muerte por falla cardiaca derecha, embolización distal, perforación de arterias pulmonares con hemorragia pulmonar, complicaciones por sangrado, taponamiento pericárdico, bradicardias y bloqueos cardiaco, hemólisis, nefropatía por contraste, o complicaciones relacionadas a la punción venosa19.
CONCLUSIÓNEl tromboembolismo pulmonar es una enfermedad de alta prevalencia, de diagnóstico esquivo si el índice de sospecha no es alto en población de alto riesgo y de mucho estudio de imágenes fútiles si se busca en pacientes de bajo riesgo. Es un ejemplo de patología multidisciplinaria en la que convergen varias especialidades médicas, siendo posible una protocolización ordenada y eficiente si el manejo es consensuado.
Los autores declaran no tener conflictos de interés, en relación a este artículo.