Dolor crónico y depresión son patologías altamente prevalentes. Las publicaciones que dan cuenta de la relación entre dolor crónico y alteraciones anímicas datan de los años 40. En los años posteriores, con el avance de la psicofarmacología, se dieron los primeros pasos para tratar de entender la relación neurofisiológica entre depresión y dolor. Los datos epidemiológicos demuestran esta relación tanto en la sintomatología, diagnóstico, pronóstico y blancos para el tratamiento. Así también, la presencia de ambas patologías tiene serias repercusiones para el paciente, ya que implica un detrimento de la funcionalidad, mayores índices de gravedad, empeoramiento en la percepción de salud, mayor uso de opioides, entre otros. Se ha descrito una hipótesis capaz de integrar el conocimiento disponible de la fisiopatología del dolor crónico y la depresión. Un estresor persistente en el tiempo alteraría el eje hipotálamo hipófisis adrenal (HHA), aumentando la liberación de cortisol, que provoca cambios desadaptativos con la consecuente desregulación de factores inflamatorios, disminuye la neurogénesis y la transmisión monoaminérgica, estas últimas están implicadas tanto en la depresión como en la modulación descendente del dolor. Por último, se han estudiado algunas mutaciones que favorecerían la presencia de esta comorbilidad. Este estudio tiene como objetivo hacer una revisión bibliográfica de la relación entre dolor crónico y depresión, para entender el momento actual del conocimiento en este tema y qué interrogantes son importantes ir respondiendo al futuro.
Chronic pain and depression are highly prevalent pathologies. The publications that account for the relationship between chronic pain and mood alterations date back to the 1940s. In the years that followed, and with the advances in psychopharmacology, the first steps were taken to try to understand the neurophysiological relationship between depression and pain. Epidemiological data demonstrate this relationship in symptomatology, diagnosis, prognosis and targets for treatment. The presence of both pathologies has serious repercussions for the patient, such as reduced functionality, higher severity indices, a worsening in the perception of health, higher use of opiods, among others. A hypothesis that integrates current knowledge of the physiopathology of chronic depression and pain has been put forward. A stress factor, persisting over time would alter the hypothalamic-pituitary-adrenal axis (HPA), thus increasing the release of cortisol, which causes maladaptive changes and results in deregulation of inflammatory markers, and decreases neurogenesis and monoaminergic transmission, these latter two involved in depression as well as descending modulation of pain. Some other studies have focused on certain mutations, which could be responsible for the presence of this comorbidity. The objective of this study is to review the bibliography of the relationship between chronic pain and depression in order to assess the current knowledge status on the subject, and the questions that need to be addressed in the future.
Dentro de los aspectos que vuelven interesante el estudio de la relación de dolor crónico y depresión, se encuentra el importante aumento de su prevalencia en los últimos años, constituyéndose como dos de las principales causas de consulta en pacientes ambulatorios. A modo de ejemplo, la prevalencia de dolor lumbar puede alcanzar un 45% en países industrializados [1]. En Chile, se estima que 5 millones de personas sufren de dolor crónico, siendo en un 28.8% de ellas, el dolor de intensidad severa [2]. Por otro lado, la depresión ocupa el tercer lugar en carga de enfermedad a nivel mundial [3]. La encuesta nacional de salud (ENS 2011) estableció que la prevalencia de “sintomatología depresiva” en Chile alcanza un 17.2% en hombres y un 25.7% en mujeres [4]. Sin embargo, no contamos con datos epidemiológicos de ambos síndromes en conjunto.
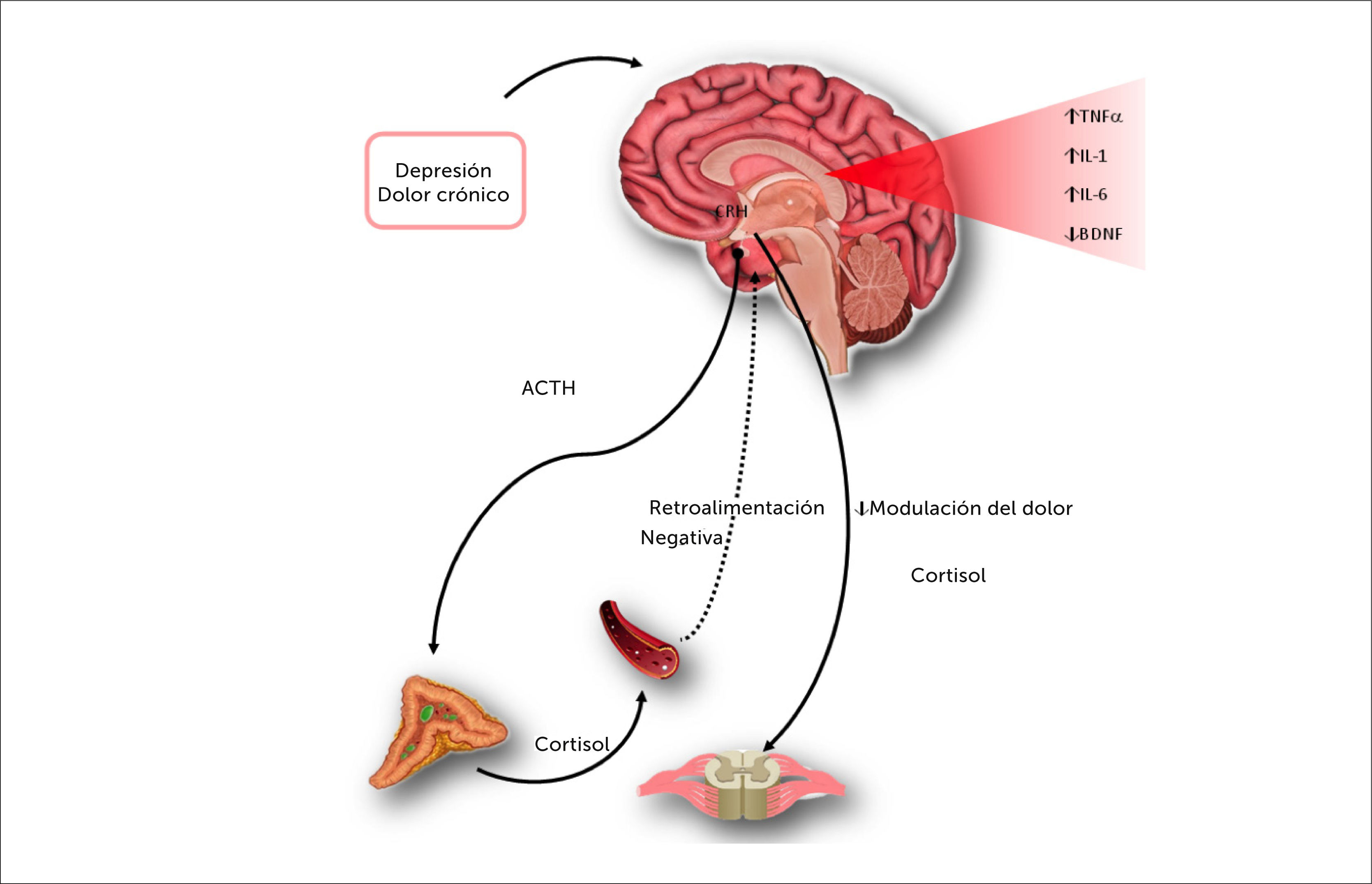
Un estresor crónico activará el HHA y aumenta la liberación de cortisol.
La persistencia del estímulo provoca la pérdida de la retroalimentación negativa. La liberación permanente de cortisol da paso a cambios desadaptativos que desregulan los factores inflamatorios. La elevación de citoquinas disminuye el Factor Neutrófico Derivado del Cerebro (BDNF) y la neurogénesis impactando negativamente en la transmisión monoaminérgica. La vía descendente del dolor, dependiente de monoaminas, pierde su capacidad de inducir analgesia [30,31].
El componente emocional del dolor es considerado en su propia definición. La International Association for Study of Pain (IASP) lo define como “una experiencia emocional y sensorial desagradable, asociada a un daño tisular, real o potencial, o descrito en términos de ese daño” [5]. La relación entre dolor y emoción fue propuesta por primera vez en un estudio publicado el año 1947 titulado “Reumatismo psicosomático no articular” [6], en el que se describen pacientes con dolores de diversas localizaciones, principalmente musculares y en que no se encuentran causas conocidas; ante esto los autores proponen “un cambio en la percepción del dolor o una disminución del umbral del dolor” como origen del cuadro psicosomático.
En el caso particular de la depresión, la asociación con síntomas dolorosos fue identificada precozmente en la clínica y ha recibido diferentes nombres, tales como “equivalentes depresivos” a modo de semejanza con los equivalentes ansiosos, o “depresión enmascarada”, lo que sugiere que el dolor sería un síntoma que encubre o se superpone a las molestias anímicas.
La utilidad de los antidepresivos, en particular los tricíclicos, en el tratamiento del dolor crónico, incluso en pacientes no deprimidos, es conocida desde los años 60. Éstos han sido evaluados con resultados positivos en cefalea [7], dolor facial [8], neuropatías periféricas [9], entre muchos otros. La efectividad de estos fármacos tanto en depresión como en dolor planteó la pregunta acerca de la naturaleza de esta relación. Las primeras observaciones de la respuesta a tricíclicos supuso un déficit de neurotransmisores como base común [10], estudios posteriores [11] encontraron que los inhibidores selectivos de recaptura de serotonina no lograban el mismo efecto, deduciendo que hay más componentes involucrados que el déficit de serotonina.
Incluso se postuló la idea de que dolor crónico y depresión pudieran corresponder a una misma entidad clínica. Sin embargo, ya en 1986, la idea de que el dolor fuera una variante de la enfermedad depresiva no estaba sustentado por la evidencia [12]. Aun cuando parecen guardar una estrecha relación, ambos cuadros tienen orígenes multifactoriales que guardan diferencias [13].
Con el avance de la investigación, la comprensión de dicha relación se ha profundizado, si bien no ha sido resuelta en su totalidad. A continuación, revisaremos parte de la evidencia disponible.
2EpidemiologíaEntre las limitaciones que presentan los estudios poblacionales existentes, encontramos la falta de homogeneidad de las muestras, el hecho de que distintos tipos de dolor podrían tener diferentes causas que guarden relación con patología depresiva (por ejemplo, las enfermedades inflamatorias aumentan el riesgo de depresión de manera independiente al dolor), el setting en que se encuentra el paciente (hospitalizados, centros de dolor, centros de psiquiatría, etc), el uso de diferentes escalas de medición de dolor y depresión, entre otros.
Teniendo en cuenta las limitaciones descritas, encontramos una prevalencia de síntomas dolorosos en pacientes deprimidos que varía entre un 15% a un 100%. En pacientes deprimidos de atención primaria, los dolores que se reportan con más frecuencia serían cefalea, dolor abdominal, artralgia y dolor de pecho [14]. Un estudio de cohorte de 10 años de seguimiento encontró que los pacientes deprimidos tendrían mayor riesgo de presentar dolor lumbar, dolor de hombro y cuello, y síntomas musculoesqueléticos [15].
Visto desde la perspectiva del dolor, la prevalencia de depresión en este grupo de pacientes en atención primaria alcanza un promedio de 27% y puede llegar a un 56.8% si se considera la prevalencia de vida [15]. Estos resultados proponen que la relación entre dolor crónico y depresión no solo puede observarse de manera concomitante, sino que puede presentarse a lo largo de los años. Si se considera el origen del dolor, la depresión en paciente con dolor neuropático es menos frecuente que en pacientes con dolor sin causa conocida [16].
Por otro lado, el diagnóstico de depresión en pacientes que tienen síntomas dolorosos puede llegar a ser muy difícil. Las escalas de medición de depresión pueden incluir sintomatología presente en dolor crónico, ya sea por la intensidad o frecuencia, como son cambios en el apetito, peso corporal o sueño [17,18].
Otras asociaciones importantes de mencionar son que la probabilidad de padecer depresión, es mayor en pacientes con más números de sitios dolorosos o que tengan dolor de mayor intensidad [19]. Es así como pacientes deprimidos que presentan dolor en diferentes zonas del cuerpo, como dolor abdominal, lumbar, torácico, facial y cefalea, tienen mayor número de síntomas depresivos. Los pacientes que presentan uno o más de estos dolores, tendrían una prevalencia de depresión 3 a 5 veces mayor (5.9 a 10.7%) versus los pacientes sin dolor (2%). Además, mientras más grave la depresión, las quejas de dolor son más frecuentes [20].
La asociación entre estos dos cuadros, también se refleja en el pronóstico. En los pacientes deprimidos que presentan dolor al inicio de su cuadro, se ha observado que la mayor severidad del dolor se asocia con peores resultados, entre ellos: depresiones más graves, mayor limitación funcional relacionada al dolor, mayor desempleo, peor autopercepción de salud, mayor uso de opioides y de consultas médicas ambulatorias [21,22]. En tanto, el dolor lumbar es el tipo de dolor más estudiado y se ha encontrado que su asociación con depresión se refleja en un peor pronóstico. Estos pacientes presentan más quejas de dolor, mayor intensidad y duración, mayor amplificación de los síntomas y menor posibilidad de recuperación [23]. Teniendo además un impacto negativo similar al caso de los pacientes deprimidos con dolor, en cuanto a mayores limitaciones del funcionamiento social, desempleo e insatisfacción [24]. Se postula que la depresión tiene un impacto mayor que otros factores pronósticos en dolor y que un manejo inadecuado sería una causa de falta de respuesta al tratamiento del dolor [22].
2.1FisiologíaLos primeros hallazgos neurobiológicos acerca de la relación entre dolor y ánimo fueron vistos al objetivar el efecto analgésico de los antidepresivos tricíclicos, el cual resulta ser independiente de su efecto sobre los síntomas depresivos. Sin embargo, los inhibidores selectivos de la recaptura de serotonina no presentaban el mismo nivel de eficacia que los tricíclicos. Esta situación generó las primeras sospechas del rol de la noradrenalina (en particular su balance con serotonina) en el efecto analgésico, sin embargo, el efecto de los inhibidores de serotonina y noradrenalina no alcanza la eficacia de los tricíclicos. Ante esta disyuntiva, el bloqueo de los receptores NMDA y canales de calcio podrían ser los responsables de dicha diferencia [25,26].
Con el desarrollo de modelos animales de estrés crónico, especialmente en lo que se refiere al eje hipotálamo-hipófisis-adrenal (HHA), se pudo comprender y describir varios cambios en la regulación endocrina [27], que guardan coincidencias notables con los hallazgos de alteraciones neuroendocrinas en los estudios de depresión en humanos [28], por ejemplo: un aumento de la activación central del eje HHA, elevación de las concentraciones basales de glucocorticoides, alteración del ritmo circadiano de la liberación de adrenocorticotropina, una lenta supresión de la respuesta al estrés e hipertrofia adrenal [29].
Se sabe que al menos la mitad de los pacientes deprimidos tienen un nivel de cortisol elevado [25], y por consiguiente presentarían las alteraciones descritas en la Tabla 1.
Cambios psiconeuroendocrinos de estrés crónico y depresión
| • Depresión/estrés crónico |
| • CRH/CRH mRNA |
| • Afinidad del receptor CRH/número |
| • AVP/AVP mRNA |
| • Nivel de CRH/AVP en LCR |
| • Co expresión de CRH/AVP |
| • GR/MR número/función |
| • Alteración de las concentraciones plasmáticas de ACTH/ritmo circadiano |
| • Hipersensibilidad suprarrenal a ACTH |
| • Corticosterona/cortisol |
| • Feedback negativo |
| • Hipertrofia adrenal |
| • Respuesta exagerada de corticoesterona/cortisol al estrés |
| • Déficit cognitivo/alteración conductual |
Resumen de los cambios psiconeuroendocrinos comunes para modelos animales de estrés crónico y modelos humanos de depresión.
CRH: hormona liberadora de corticotropina; AVP: arginina vasopresina; ACTH adrenocorticotropina; LCR: líquido cefaloraquídeo; GR: receptor de glucocorticoides; MR: receptor de mineralocorticoides; mARN: ácido ribonucleico mensajero [30].
En la revisión de Blackburn del 2001 [30], se propone una hipótesis de trabajo que da cuenta de la relación entre depresión y dolor crónico, centrando la mirada en el eje HHA, y conceptualizando tanto al dolor crónico como la depresión bajo el modelo de “estrés crónico”. A continuación, se revisará dicha hipótesis y parte de la evidencia que la sustenta.
El eje HHA es el encargado de la “respuesta lenta” ante los estresores, entendiendo un estresor como una amenaza a la homeostasis. Esta respuesta considera el enfrentamiento cognitivo, conductual y endocrino al estrés. En condiciones normales, ante un estresor agudo, el eje HHA responderá a través de la liberación de cortisol. El mecanismo de retroalimentación negativa del eje, vuelve al sistema a su estado previo, una vez que el estresor desaparece.
Cuando el estresor persiste en el tiempo, será necesario que la liberación de corticoesteroides se mantenga a pesar de la presión de la retroalimentación negativa, e incluso tener la capacidad de liberar una cantidad extra en caso de que un nuevo estresor aparezca. Esta condición requiere de una adaptación especial del eje, pero en el caso de que el período de estrés sea muy prolongado, puede terminar por perderse la retroalimentación negativa, con la consiguiente liberación permanente de corticoides, tornándose en una situación desadaptativa [29] que favorece la aparición de citoquinas.
En la revisión de Fascik del 2015 [31], se presentan nuevos antecedentes que amplían la comprensión de estos fenómenos. Prácticamente cualquier injuria se asocia con una activación del sistema inmune, con la consiguiente liberación de citoquinas como el factor de necrosis tumoral alfa, interleuquina 1 e interleuquina 6 (TNFα, IL-1 y IL-6) [29]. En condiciones normales, el cortisol es el encargado de regular la liberación de las citoquinas y devolver la homeostasis.
Como se explicó anteriormente, los cambios desadaptativos del eje HHA impiden la regulación de las citoquinas, es así como el TNFα que normalmente se encuentra en el hipocampo, aumentará su concentración. El aumento de esta citoquina tiene un impacto sobre la transmisión noradrenérgica, disminuyéndola por diferentes vías, por una parte, inhibe la liberación de norepinefrina, pero también activa los receptores presinápticos de norepinefrina (α2 -AR), que aumentan su expresión y sensibilidad ante la exposición prolongada a estrés y dolor, frenando la liberación de norepinefrina. En condiciones normales, la liberación de norepinefrina ejerce una retroalimentación negativa sobre el TNFα, por lo que la situación descrita previamente, favorece un nivel de TNFα elevado en el hipocampo.
El aumento de TNFα se ha asociado, por ejemplo, con el desarrollo de hiperalgesia [32], así como de conductas depresivas tras microinfusiones en el hipocampo en modelos animales [33].
El aumento de citoquinas también afecta negativamente a la neurogénesis [34]. Las citoquinas activan el sistema inmune, incluidos los macrófagos que liberan aún más citoquinas; esto deriva en una alteración de la relación neurona-glía, la cual en condiciones normales se sustenta en una relación bidireccional donde la glía modula los neurotransmisores, citoquinas y factores neurotróficos y a su vez, la neurona responde con señales neurotróficas. Al verse alterada esta relación, termina en atrofia y muerte neuronal. El fenómeno anterior es también compartido con la depresión. La pérdida del trofismo impactará negativamente en la transmisión monoaminérgica [35]. Todo lo anterior podría mediar en parte el componente afectivo-cognitivo del dolor que incluye los cambios de ánimo relacionados al dolor, las estrategias de afrontamiento y la formación de memorias relacionadas a estímulos dolorosos. Esto supone que las citoquinas, y especialmente el TNFα y su efecto en el hipocampo, tendrían un rol central en la patogénesis del dolor crónico y la depresión [35].
Dentro de los neurotransmisores, la norepinefrina parece jugar un papel crucial en dolor. La norepinefrina, con conjunto con serotonina, opioides endógenos y GABA, ejerce una modulación de la vía dolorosa desde centros nerviosos del cerebro y tronco cerebral hacia el asta dorsal de médula espinal y sistema nervioso central, siendo la sustancia gris periacueductal el centro de relevo de este sistema [36]. Estas vías constituyen un sistema de “analgesia por estrés”. Además del componente somático del dolor, la sustancia gris periacueductal recibe aferencias desde la amígdala, el hipotálamo y la corteza frontal, que aportan el componente afectivo y cognitivo a la modulación del dolor [31].
Para nuestros fines, tiene especial importancia el efecto en las estructuras supraespinales [12]. La exposición prolongada a estrés y dolor aumenta la expresión y sensibilidad de los receptores α2 y la expresión del transportador de noradrenalina en las neuronas del locus ceruleus (LC). Es interesante destacar que un estudio en modelo animal demostró que estos cambios se correlacionan temporalmente con el inicio de sintomatología ansiosa y depresiva [26].
Blackburn [30] describe que el aumento de corticoides provoca en un primer momento que las neuronas del núcleo del rafe liberen serotonina. A medida que el estrés se cronifica, la serotonina se agota y se aumenta la expresión de los receptores presinápticos 5-HT1A (receptor que inhibe la liberación de serotonina), a la vez que se disminuye la expresión de los receptores 5-HT1A postsinápticos (que favorecen la transmisión serotoninérgica) del hipocampo. La situación anteriormente descrita daría paso a los síntomas ansiosos y depresivos, así como a una disminución del umbral del dolor.
Desde un punto de vista anatómico también encontramos estructuras que podrían participar en ambos cuadros. A saber, la señal dolorosa se transmite a través de fibras nociceptivas al asta posterior de la médula, y desde allí a estructuras supraespinales, como el mesencéfalo, tálamo, hipotálamo, corteza límbica (corteza insular y cingulado anterior), corteza somatosensorial y parietal posterior. Estructuras que también tienen un rol importante en depresión [24,37].
3GenéticaLa sensibilidad al dolor tiene un componente genético importante, esto ha sido observado tanto en modelos animales como en humanos [38]. Estudios recientes en gemelos han relacionado algunos cuadros de dolor crónico con síntomas ansiosos y depresivos, lo que podría suponer una base genética común [39,40]. Otro dato interesante, es que los pacientes con dolor crónico tienen más familiares de primer grado que sufren depresión que la población general, aun cuando ellos no presenten episodios depresivos [41].
Además de los estudios poblacionales, se han revisado mutaciones específicas de genes. Por ejemplo, una mutación Val66Met del gen que codifica para el factor neurotrófico derivado del cerebro (BDNF) estaría asociado a la comorbilidad de dolor crónico y depresión [42]. Otro gen candidato para explicar la comorbilidad es el gen del transportador de serotonina, específicamente una inserción/deleción (SLC6a4) se asocia con mayor riesgo de presentar dolor crónico, esta misma mutación confiere un mayor riesgo de desarrollar depresión [43,44]. En el caso del gen de la enzima Catecol O-Metiltransferasa (COMT), que es la responsable del catabolismo de la epinefrina, norepinefrina y dopamina; la variante Val159Met (Rs4680) codifica una proteína con menor actividad enzimática, y se asocia con dolor musculoesquelético crónico [31]. Estudios posteriores fueron capaces de definir 3 haplotipos según la sensibilidad al dolor, siendo estos el de baja sensibilidad de dolor, sensibilidad al dolor promedio y alta sensibilidad al dolor (LPS, APS y HPS respectivamente) [45]. Sin embargo, la alteración del gen que codifica para la COMT y su correlación con la depresión no ha podido ser completamente demostrado, posiblemente por el origen multifactorial de la depresión [46].
4ConclusionesTanto el dolor como la depresión son trastornos altamente frecuentes, que pueden evolucionar hacia la cronicidad o recurrencia y que tienen una grave repercusión en diversas variables, tanto a nivel de salud pública como a nivel de la salud individual de quien sufre ambas patologías en conjunto. A pesar de su importancia, los estudios que hacen referencia a su comorbilidad son escasos y tienen limitaciones importantes. La presencia de ambas enfermedades en conjunto es muy frecuente, y esto podría deberse en parte a que cada una de ellas favorece la aparición de la otra y más aún, esta comorbilidad empeora el curso de ambas enfermedades.
Como se menciona en esta revisión, desde el punto de vista clínico, la asociación entre dolor y depresión se observa desde hace muchos años. Sin embargo, el estudio de la fisiopatología que podría sustentar esta asociación es escaso. Entre los primeros hechos que caben destacar, está la respuesta clínica de dolor crónico con el uso de antidepresivos tricíclicos, posteriormente se trató de reproducir esto con Inhibidor Selectivo de Recambio de Serotonina (ISRS), siendo el resultado una menor respuesta, lo anterior dio origen al estudio de noradrenalina como un importante neurotransmisor involucrado en esta asociación.
Por otro lado, el modelo de estrés crónico permitió el desarrollo de una hipótesis capaz de dar cuenta de esta relación. Esta hipótesis integra distintas disfunciones descritas en ambas patologías, tales como alteraciones endocrinas, inflamatorias y de neurotransmisores.
La vulnerabilidad para presentar ambas condiciones también podría estar mediada por factores genéticos como ha sido propuesto en estudios poblacionales. Algunos genes candidatos son una mutación del gen codificante de BDNF, el gen del transportador de serotonina y el gen que codifica para la COMT.
En la revisión se presenta la evidencia disponible a la fecha, y aun cuando hay claridad en la estrecha relación que existe entre ambas condiciones, las bases neurobiológicas de esta interacción continúan en desarrollo.
El óptimo abordaje clínico de los pacientes requiere del manejo de ambas condiciones de manera simultánea.
Declaración conflictos de interés.
Los autores declaran no tener conflictos de interés.






![Un estresor crónico activará el HHA y aumenta la liberación de cortisol. La persistencia del estímulo provoca la pérdida de la retroalimentación negativa. La liberación permanente de cortisol da paso a cambios desadaptativos que desregulan los factores inflamatorios. La elevación de citoquinas disminuye el Factor Neutrófico Derivado del Cerebro (BDNF) y la neurogénesis impactando negativamente en la transmisión monoaminérgica. La vía descendente del dolor, dependiente de monoaminas, pierde su capacidad de inducir analgesia [30,31]. Un estresor crónico activará el HHA y aumenta la liberación de cortisol. La persistencia del estímulo provoca la pérdida de la retroalimentación negativa. La liberación permanente de cortisol da paso a cambios desadaptativos que desregulan los factores inflamatorios. La elevación de citoquinas disminuye el Factor Neutrófico Derivado del Cerebro (BDNF) y la neurogénesis impactando negativamente en la transmisión monoaminérgica. La vía descendente del dolor, dependiente de monoaminas, pierde su capacidad de inducir analgesia [30,31].](https://static.elsevier.es/multimedia/07168640/0000003000000006/v1_201912181331/S0716864019300902/v1_201912181331/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)