El síndrome de dolor regional complejo (SDRC) fue descrito por primera vez por el cirujano francés Ambroise Paré en el siglo XVI [1]; en 1864 Silas Weir Mitchell describe los signos y los síntomas característicos del SDRC (él lo denominó causalgia) [1]; en 1901 Nonne, un discípulo de Sudeck, acuña el nombre “Atrofia de Sudeck”; en 1946 James Evans lo denomina “distrofia simpática refleja” debido al papel que desempeñaba el sistema nervioso simpático en este tipo de dolor [1,2]. En 1993, la IASP (International Association for the Study of Pain) propone cambiar el nombre a “Síndrome de dolor regional complejo”. Es un síndrome doloroso cuya fisiopatología es poco clara y de curso clínico impredecible. La enfermedad es a menudo resistente a los diversos tratamientos, y lamentablemente el curso natural de la misma no siempre favorable. El diagnóstico se basa en signos y síntomas derivados de la historia clínica y del examen físico. Los principales pilares de su tratamiento son el manejo del dolor y la rehabilitación física de las extremidades. Estos deben iniciarse tan pronto como sea posible. Sin embargo, si no hay mejoría funcional de la extremidad, y el dolor intenso persiste, se debe plantear un manejo intervencionista del dolor.
Complex regional pain syndrome (CRPS) was first described by the french surgeon Ambroise Paré in the sixteenth century [1]; in 1864 Silas Weir Mitchell describes the signs and symptoms characteristic of CRPS (he called it causalgia) [1]; in 1901 Nonne, a disciple of Sudeck, coined the name “Atrophy of Sudeck”; in 1946 James Evans calls it “reflex sympathetic dystrophy” due to the role played by the sympathetic nervous system in this type of pain [1,2]. In 1993 the IASP (International Association for the Study of Pain) proposed changing the name to “Complex regional pain syndrome”. It is a painful syndrome whose pathophysiology is unclear and has an unpredictable clinical course. The disease is often resistant to various treatments, and unfortunately, its natural course is not always favorable. Diagnosis is based on signs and symptoms derived from the clinical history and physical examination. The main pillars of its treatment are proper pain management and intense physical rehabilitation of the extremities. These should be started as soon as possible. However, if there is no functional improvement of the extremity, and the intense pain persists, interventionist pain management should be considered.
El síndrome de dolor regional complejo (SDRC) fue descrito por primera vez por el cirujano francés Ambroise Paré en el siglo XVI [1]; en 1864 Silas Weir Mitchell describe los signos y los síntomas característicos del SDRC (él lo denominó causalgia) [1]; en 1901 Nonne, un discípulo de Sudeck, acuña el nombre “Atrofia de Sudeck”; en 1946 James Evans lo denomina “distrofia simpática refleja” debido al papel que desempeñaba el sistema nervioso simpático en este tipo de dolor [1,2]. En 1993 la IASP (International Association for the Study of Pain) propone cambiar el nombre a “Síndrome de dolor regional complejo”, y lo define como una alteración que se caracteriza por dolor espontáneo o inducido, desproporcionado con relación al evento inicial y que se acompaña de una gran variedad de alteraciones autonómicas y motoras, dando lugar a una gran diversidad de presentaciones clínicas [3,4].
Se clasifica en 2 tipos, dependiendo de si ha habido o no daño o lesión nerviosa previa. El 85% de los casos son de tipo I, donde no ha sido posible identificar una lesión nerviosa, y el resto son de tipo II [1,2].
2EPIDEMIOLOGÍA Y ETIOLOGÍASe calcula una tasa de incidencia de 0.005% habitantes/año y una tasa de prevalencia de 0.02%; la prevalencia tras una fractura varía del 0.03% al 37% [6]. Máxima afectación en la 5ª-7ª décadas de la vida, con una proporción entre mujeres y hombres de 2-3:1.
Hasta el 5-10% de los SDRC se desarrollan de forma espontánea, aproximadamente el 10% tras un trauma menor, aunque puede aparecer después de cualquier lesión. Los antecedentes más comunes son fracturas y cirugías (40%) (hasta el 30% en descompresión del nervio mediano), lesiones radiculares (9%), lesiones medulares (6%), lesiones por aplastamiento, esguinces o contractura de Dupuytren. No existe clara correlación entre la gravedad de los síntomas y el tipo de lesión inicial [6,7].
El SDRC tipo I es un síndrome doloroso que aparece tras un evento nocivo, con dolor espontáneo, alodinia y/o hiperalgesia, edema, alteración del flujo sanguíneo cutáneo o alteraciones sudomotoras sin lesión nerviosa evidente. El SDRC tipo II es similar, pero en él existe una lesión nerviosa total o parcial previa y evidente [7,8].
3FISIOPATOLOGÍASe han propuesto varios mecanismos fisiopatológicos para el SDRC: uno debido a cambios producidos tras la inflamación postraumática; un segundo que propone una disfunción vasomotora periférica; el tercero se debería al fenómeno de sensibilización central, con cambios funcionales y estructurales en el sistema nervioso central (SNC) secundarios a un mal ajuste al dolor crónico [4,9]; y un último mecanismo sería debido a una alteración del sistema inmunitario, que provocaría una activación excesiva y patológica de las células dendríticas tras la lesión inicial [10].
Inflamación postraumática: Aumenta la concentración del gen de la calcitonina (CGRP) y la sustancia P (contribuye a la inflamación, extravasación y edema de las extremidades, aumentando la expresión de citoquinas inflamatorias), aumentando la hiperexcitabilidad neuronal. Incluso traumatismos leves pueden amplificar la señalización de dichas citoquinas, excitando los nociceptores e induciendo la sensibilización periférica a largo plazo [9,11].
El aumento del factor de necrosis tumoral alfa y de inteleukin-6 en las biopsias de la piel de la extremidad afectada, se ha asociado a una respuesta exagerada al dolor causado por la presión o hiperalgesia mecánica, presente en la sensibilización central.
Disfunción vasomotora: los cambios de temperatura en la extremidad afectada indican que se producen cambios en las neuronas vasoconstrictoras con el paso tiempo. Se han identificado tres patrones diferentes de temperatura en el SDRC: un “patrón de temperatura cálida”, debido a la imposibilidad de activar las neuronas vasoconstrictoras; un patrón de temperatura intermedia; y un patrón de frío, con la temperatura y la perfusión de la extremidad afectada inferior a la de la contralateral (posiblemente debido a la inhibición unilateral de las neuronas vasoconstrictoras simpáticas cutáneas). También se altera la función endotelial, con reducción de la liberación de óxido nítrico, causando vasoconstricción sostenida [12].
Sensibilización central (disfunción del SNC): El SNC experimenta cambios estructurales y funcionales que hacen que aumente la excitabilidad de las neuronas nociceptivas en la médula espinal, volviéndose más sensibles a los estímulos periféricos, llegando a activarse en ausencia de dichos estímulos, lo que explicaría que la sensibilización central pueda causar dolor crónico, hiperalgesia, alodinia, y la diseminación del dolor a áreas adyacentes no lesionadas [9,13]. Se producen cambios en las estructuras implicadas en los aspectos emocionales del dolor (amígdala, giro cingulado anterior, corteza prefrontal) apareciendo cambios cognitivos y anímicos a largo plazo relacionados con el dolor [9]. Otra manifestación de la disfunción del SNC en el SDRC es la alteración de la función motora, causando trastornos del movimiento como la distonía [14], debida al deterioro de los circuitos interneuronales GABAérgicos medulares, ya que se ha comprobado que la administración intratecal de baclofeno, agonista de los receptores inhibitorios GABA-B, mejora la distonía [9,14,15]. En los casos de SDRC de larga evolución pueden aparecer alteraciones de la representación cognitiva, con distorsión de la imagen mental de la extremidad (sentir la ausencia de partes de la extremidad, alteraciones de la forma, tamaño, postura o temperatura) [16].
Alteración del sistema inmunitario, con activación de células dendríticas que interactúan con las células gliales en el nervio periférico local, el ganglio de la raíz dorsal, la médula espinal y la corteza cerebral para producir la activación de las células gliales, con cambios en la función neural que conducen a hiperalgesia y alodinia [17,18].
3.1Factores genéticosEl papel de los factores genéticos en el SDRC es poco conocido. Podrían estar implicados los genes que codifican los receptores adrenérgicos α1a y el sistema Antígenos Leucocitarios Humanos (HLA) [19,20].
3.2Factores psicológicosMuchos estudios sugieren que los pacientes con SDRC no son psicológicamente diferentes de otros pacientes con dolor crónico y que los factores psicológicos por sí solos no causan SDRC [21].
4CLÍNICALos síntomas en el SDRC son desproporcionados a la lesión inicial. La localización de la lesión en la extremidad afectada no determina la localización de los síntomas. En el 95% de los pacientes, los síntomas afectan a tejidos no dañados por la lesión inicial. Los signos y síntomas en el SDRC no se limitan a la zona de inervación de un solo nervio y muestran una distribución generalizada distalmente, y en algunos casos pueden manifestarse proximalmente o afectar a toda la extremidad.
- -
SDRC I: El dolor se expande a lo largo de la extremidad o migra a otras partes del cuerpo en casi el 70% de los pacientes. Se vuelve bilateral y produce una “imagen de espejo” del dolor en hasta el 50% de los casos. Bonica describió 3 etapas del SDRC I. Primera etapa o aguda, con dolor, edema, piel caliente e hiperhidrosis, disminución del movimiento y la fuerza. Radiografía normal y gammagrafía con hipercaptación. Segunda etapa o distrófica, con piel fría, seca, cambios tróficos, dolor severo, disminución del crecimiento del vello, hiperhidrosis persistente, debilidad muscular y limitación del movimiento de las articulaciones afectadas. Tercera etapa o atrófica, caracterizada por piel atrófica, seca, fría, moteada o cianótica, atrofia muscular, contracturas articulares, temblores y distonía, con pérdida progresiva de la función y dolor persistente que mejora con el descanso y empeora con los movimientos pasivos. La radiografía muestra una osteoporosis regional no homogénea. Estas etapas no son necesariamente sucesivas, ya que la clínica puede comenzar por cualquiera de ellas.
- -
SDRC II (causalgia): Los síntomas típicos son ardor espontáneo, hiperalgesia y alodinia mecánica y fría; más intensos en el territorio del nervio periférico afectado, con menos tendencia a diseminarse que en el SDRC I. Cambios inflamatorios y distróficos, y deterioro de la función motora, pero más leves que en el SDRC I.
El dolor puede localizarse en el área de la lesión inicial incluso antes de diagnosticarse el SDRC. Cuando comienzan los signos el dolor pasa a ser difuso y profundo, y la inflamación se generaliza por la extremidad. Los factores agravantes suelen incluir la carga física, los estímulos dolorosos, el movimiento (por ejemplo, la terapia física), los cambios de temperatura ambientales o locales, y los aumentos en la presión hidrostática (cambios ortostáticos).
En el 90% de los casos aparece una triada de síntomas sensoriales, motores y autonómicos, aunque no hay combinaciones fijas (Tabla 1) [22].
Características clínicas del SDRC (modificado de Schott 1999) [3]
| •Alodinia. |
| •Sudoración alterada (ausente, excesiva o reducida). |
| •Atrofia de la piel con pérdida de arrugas (brillo de la piel). |
| •Cambios de color de la piel (cianótica, eritematosa, pálida o con manchas). |
| •Disfunción del detrusor y del esfínter urinario. |
| •Dupuytren y otras contracturas. |
| •Cambios en el cabello (crecimiento excesivo o reducido, cabello fino). |
| •Calor o frialdad inapropiados. |
| •Movimientos involuntarios: temblor, distonía, espasmos. |
| •Rigidez articular (cambios artríticos agudos o crónicos). |
| •Pérdida y/o debilidad muscular. |
| •Uñas (quebradizas, curvadas, delgadas, estriadas). |
| •Osteoporosis: parcheada, localizada o generalizada. |
| •Atrofia o engrosamiento subcutáneo. |
| •Hinchazón. |
Los síntomas iniciales son dolor espontáneo, edema y diferencia de temperatura de la piel con la extremidad contralateral, a menudo en áreas distintas a la afectada por la lesión inicial.
El dolor espontáneo suele ser difuso, no relacionado con el territorio inervado por un solo nervio, suele disminuir con la elevación de la extremidad y empeorar al bajarla. Se puede acompañar de alodinia (sensación dolorosa ante estímulos no dolorosos), hiperpatía (dolor provocado por estímulos dolorosos que aparece con retraso, supera al estímulo y se extiende más allá del área del estímulo), hiperalgesia (respuesta dolorosa exagerada frente a un estímulo normalmente doloroso), hipoalgesia (dolor disminuido en respuesta a un estímulo normalmente doloroso), hiperestesia (sensibilidad aumentada a un estímulo no doloroso -incluyendo el tacto y la sensación térmica no dolorosa-) o hipoestesia (sensibilidad disminuida a un estímulo no doloroso).
4.2Síntomas y signos autonómicos en SDRCEl flujo anormal de sangre a la piel hace que ésta aparezca rojiza, azulada o pálida. Aparecen diferencias de temperatura, hiper o hipohidrosis en palmas/plantas de manos o pies. Suele presentarse edema cutáneo y subcutáneo con piel brillante y desaparición de pliegues cutáneos.
4.3Síntomas motoresEn el 90% de los casos la fuerza de la extremidad afectada disminuye, más en los músculos involucrados en el cierre del puño. Esto contribuye a que los movimientos complejos del extremo distal del miembro afectado sean más torpes, como la capacidad para cerrar el puño o aproximar las puntas del pulgar y el quinto dedo. Entre los trastornos del movimiento más frecuentes está la distonía, con posturas de flexión de dedos y muñeca, o flexión-inversión plantar del pie con o sin dedos en garra [14]. En el 50% de los casos aparece temblor postural o de acción (Figura 1).
Clínica del SDRC.
A. Manos de una paciente afectada por SDRC en mano derecha. Se puede observar la falta de cierre completo del puño.
B. Edema de dedos, piel brillante y disminución de pliegues cutáneos en dedos.
C. Mano sana. Las fotografías e imágenes han sido tomadas con el consentimiento de los pacientes.
Afectan a más del 30% de los pacientes, no suelen aparecer en las primeras fases del síndrome. Incluyen alteraciones en el crecimiento de las uñas, aumento o disminución del crecimiento del vello, fibrosis palmar/plantar, piel brillante y adelgazada e hiperqueratosis. Es frecuente que aparezca rigidez articular, que puede estar relacionada con cambios tróficos en las articulaciones o tendones [2] (Figura 2).
5DIAGNÓSTICOEl diagnóstico se basa en la clínica y en la exploración. Se utilizan los criterios de Budapest, aprobados y codificados por la IASP, con alta sensibilidad y baja especificidad (los criterios modificados según Harden y Bruehl son más específicos) (Tablas 2 y 3) [8,23].
Criterios diagnósticos de Budapest para el SDRC [25]
| 1. Dolor continuo, desproporcionado para el evento causante. |
| 2. Debe cumplir al menos un síntoma, en tres de las cuatro categorías siguientes: |
| •Sensorial: hiperestesia y/o alodinia |
| •Vasomotor: asimetría de la temperatura cutánea y/o cambios en el color de la piel y/o asimetría color de la piel |
| •Sudomotor: edema y/o cambios de sudoración y/o sudoración asimétrica |
| •Motor: disminución del rango de movilidad y/o disfunción motora (temblor, distonía, debilidad) y/o cambios tróficos (piel, pelo, uñas) |
| 3. Debe cumplir al menos un signo en dos o más de las cuatro categorías siguientes: |
| •Sensorial: evidencia de hiperalgesia (al pinchazo) y/o alodinia (al tacto/térmica/presión profunda/movimiento articular) |
| •Vasomotor: evidencia de asimetría de la temperatura cutánea>1°C y/o asimetría del color cutáneo y/o cambios de color cutáneo |
| •Sudomotor: evidencia de edema y/o cambios de sudoración |
| •asimétrica |
| •Motor: evidencia de disminución del rango de movilidad y/o disfunción motora (temblor, distonía, debilidad) y/o cambios tróficos (piel, pelo, uñas) |
| 4. Descartar otras patologías que puedan explicar los síntomas y signos previos |
Criterios diagnósticos modificados (Harden, 2007)
| 1. Dolor continuo, desproporcionado para el factor desencadenante. |
| 2. Los pacientes deben tener al menos 1 síntoma en cada una de los siguientes categorías y 1 signo en 2 o más categorías. |
| Categorías: |
| Sensorial (alodinia, hiperalgesia, hipoestesia). |
| Vasomotor (alteraciones en la temperatura o el color de la piel). |
| Sudomotor (edema o alteraciones de la sudoración). |
| Motor/trófico (debilidad muscular, temblor, alteraciones en cabello, uñas o piel) |
Pruebas diagnósticas:
- -
-Radiografías simples: Pueden revelar osteoporosis avanzada (distribución distal e irregular de la desmineralización en los huesos pequeños y periarticular en los huesos más largos) (Figura 3) o fracturas en la extremidad sintomática con SDRC (aunque el 30% de los pacientes no tienen alteraciones radiográficas).
- -
-Resonancia magnética: Evalúa las lesiones en tejidos blandos y el edema óseo.
- -
-Gammagrafía ósea de triple fase: Se pueden observar cambios tempranos en el metabolismo óseo en el SDRC con alta especificidad y sensibilidad, encontrándose un aumento difuso del marcador en el tejido blando periarticular alrededor de las articulaciones distales en el lado afectado (Figura 4).
Figura 4.Gammagrafía con 22 mCi de 99mTc-Hidroximetilen-di-fosfonato en 3 fases.
Se aprecia moderado incremento de la vascularización en mano derecha con respecto a la izquierda, no así en la región de la muñeca (A, fase vascular y B, fase tisular). Intenso aumento de reacción osteogénica de carácter focal proximal a la base de primero y segundo metacarpianos (región teórica de trapecio y escafoides) y en todas las articulaciones metacarpofalángicas e interfalángicas (C, fase ósea).
(0.22MB). - -
-SPECT: Suele mostrar cambios de perfusión en el tálamo contralateral en pacientes con SDRC.
- -
-Capilaroscopia: Puede medir un flujo sanguíneo nutricional disminuido en el pliegue ungueal de la mano o del pie [24].
- -
-Medición de la producción de sudor en reposo: Puede utilizarse para evaluar la función pseudomotora de forma cuantitativa y cualitativa [24].
- -
-Bloqueos simpáticos: Se realizan mediante la inyección de anestésicos locales en el ganglio estrellado o en los ganglios simpáticos lumbares (Figura 4). Se ha obtenido un bloqueo completo cuando la temperatura del dedo, de la mano o del pie, aumenta por encima de 35°C. El alivio temporal del dolor indica que la actividad simpática está involucrada en la generación de dolor.
Se debe realizar diagnóstico diferencial con artritis infecciosas y reumáticas, artropatía inflamatoria, arteriopatía periférica y trombosis venosa profunda. En fase crónica (con secuelas), con enfermedad de Dupuytren, esclerodermia y fascitis plantar. En afectaciones de la cadera conviene descartar coxitis y osteonecrosis. Si existe desmineralización ósea, con fracturas de estrés, osteoporosis y tumores óseos benignos y malignos (Tabla 4).
Diagnóstico diferencial del SDRC [4]
| 1. Síndromes dolorosos neuropáticos. |
| a. Neuropatía periférica |
| b. Atrapamiento nervioso |
| c. Radiculopatía |
| d. Neuralgia postherpética |
| e. Dolor por desaferenciación |
| f. Plexopatía |
| g. Enfermedad de la motoneurona |
| 2. Enfermedades vasculares. |
| h. Trombosis |
| i. Acrocianosis |
| j. Aterosclerosis |
| k. Eritromelalgia |
| l. Enfermedad de Raynaud |
| 3. Procesos inflamatorios |
| m. Bursitis |
| n. Erisipela |
| o. Artritis seronegativa |
| p. Enfermedades reumáticas |
| 4. Dolor miofascial |
| q. Dolor por sobreuso |
| r. Dolor por infrauso |
| s. Epicondilitis |
| t. Fibromialgia |
| u. Epitrocleitis |
| 5. Procesos psiquiátricos |
| v. Desórdenes somatomorfos |
| w. Síndrome de Munchausen |
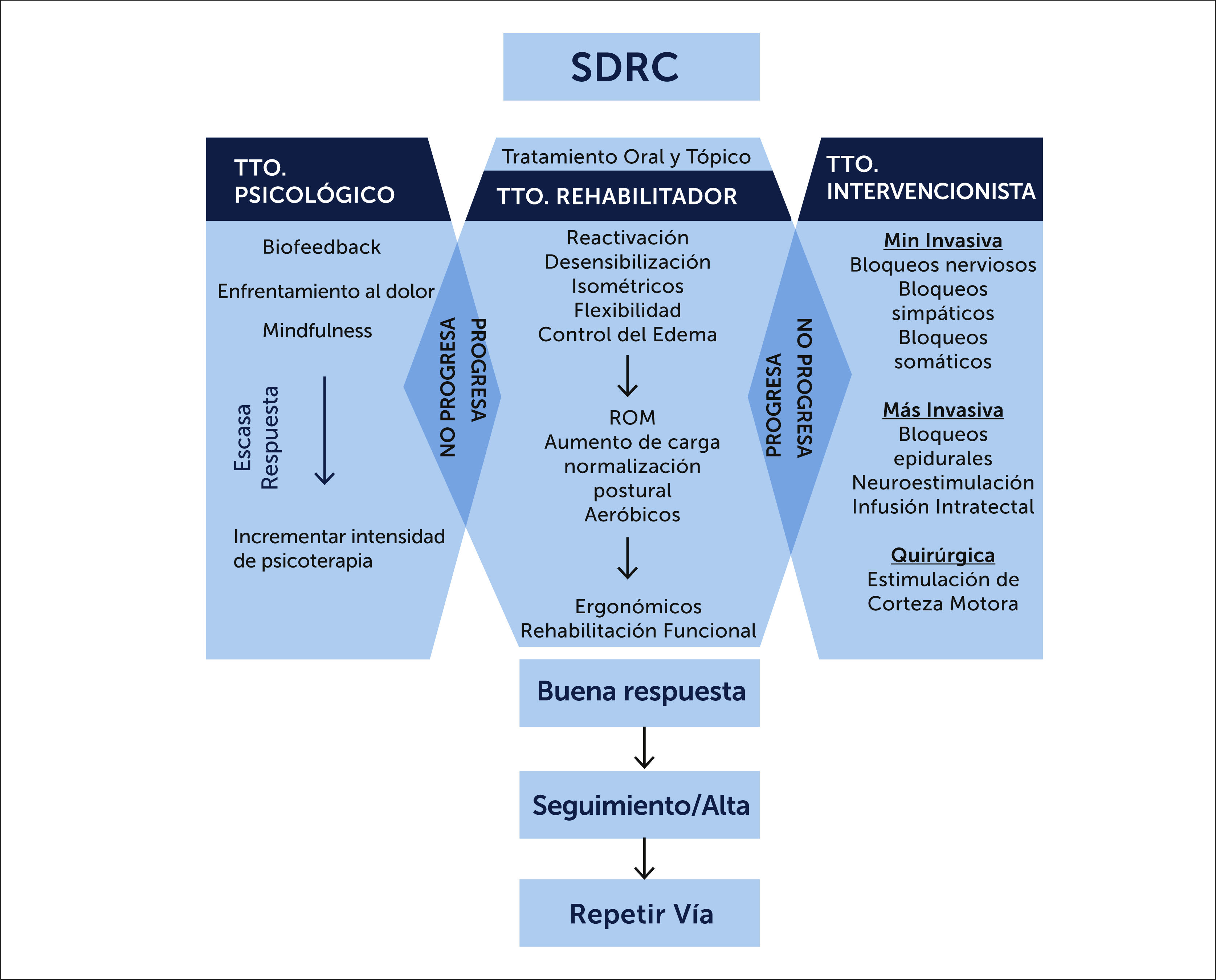
Es difícil establecer un consenso sobre el abordaje del tratamiento del SDRC. El tratamiento debe comenzar lo antes posible por terapias conservadoras y, si estas fracasan, pasar a tratamientos intervencionistas con fisioterapia. En la figura 5 se muestra un Algoritmo tratamiento del SRDC [23] (Figuras 6 y 7).
A. TRATAMIENTO CONSERVADOR
- Tratamiento rehabilitador. (Figura 8)
Tratamiento rehabilitador del SDRC.
Debe ser el tratamiento de primera elección. Consta de varios tipos de terapia como es la terapia ocupacional y la fisioterapia (incluye imaginería motora graduada y terapia en espejo). Con ellas se pretende disminuir el dolor y el edema, ganar movilidad y flexibilidad de los tejidos para alcanzar una funcionalidad lo más normal posible del miembro afectado.
La fisioterapia (incluyendo imaginería motora graduada y terapia en espejo) y la terapia ocupacional deben ser los tratamientos de primera elección [25]. Ambas disminuyen el dolor y mejoran la movilidad en pacientes con SDRC, siendo más efectivas cuando se combinan [26–28]. La terapia física incluye elevación de la extremidad, masoterapia, baños de contraste, estimulación nerviosa eléctrica transcutánea, movilizaciones suaves, ejercicios de fortalecimiento isométricos y ejercicios de carga de la extremidad afectada [7].
La imaginería motora graduada es un programa de rehabilitación integral para activar de forma secuencial las redes corticales motoras y mejorar la organización cortical. Se realiza en tres etapas: en la primera etapa, restauración de la lateralidad, el paciente debe identificar correctamente las posiciones de extremidades, cuello y hombros, derechos e izquierdos en varias posiciones y situaciones. En la segunda etapa, imaginería motora, el paciente debe visualizar posturas y movimientos de la extremidad afectada sin moverla, cuando lo consiga sin producir dolor deberá imaginar el movimiento de la extremidad sin dolor. Este ejercicio activa la corteza cerebral igual que si se realizan los movimientos. En la tercera etapa, terapia en espejo, se trabaja con feedback visual, la extremidad afectada se coloca fuera de la vista del paciente y del reflejo del espejo, y es la extremidad sana la que se coloca en frente del espejo y la que moverá, creando la ilusión de que la extremidad afectada se mueve sin dolor. Cuando lo consigue se pasará a realizar y visualizar movimientos con la extremidad afectada al mismo tiempo que con la sana en el espejo, produciendo un feedback positivo en la corteza cerebral [25,29].
- Tratamiento psicológico
Debido a que el dolor crónico afecta a la calidad de vida y causa alteraciones emocionales, es importante que los pacientes diagnosticados de SDRC tengan la atención psicológica adecuada [24].
Se pueden utilizar técnicas de relajación y retroalimentación para facilitar la rehabilitación, disminuir el dolor y proporcionar a los pacientes un mayor control.
Es importante evaluar y tratar a los pacientes con trastornos concomitantes como depresión mayor, trastorno de ansiedad generalizada y trastorno de estrés postraumático, ya que pueden dificultar el tratamiento rehabilitador [7].
- Tratamiento farmacológico. (Figura 9)
Corticoides: Únicos antiinflamatorios que han demostrado que pueden mejorar los síntomas [24].
Anticonvulsivantes: La gabapentina es recomendada en varias revisiones para el tratamiento del SDRC. La carbamazepina también ha demostrado disminuir el dolor en comparación con placebo [25].
Dimetilsulfóxido: Agente eliminador de radicales libres que, en aplicación local en crema al 50% durante 2 meses, ha demostrado una reducción significativa del dolor en comparación con placebo [25].
Bifosfonatos: Como clodronato 300mg vo, pamidronato 60mg vo, alendronato 7.5mg iv, y alendronato 40mg vo. Han demostrado disminución del dolor [30–33].
Antidepresivos tricíclicos: El más utilizado es la amitriptilina. Su efecto analgésico se basa en la inhibición de la recaptación de serotonina y noradrenalina a nivel central, en el bloqueo de los receptores de N-metil-D-aspartato (NMDA) en la médula espinal y en el bloqueo de los canales de sodio de los axones lesionados [34].
Análogos de NMDA: Tanto la memantina (40mg vo), como la ketamina (100mg iv, 7.2μg/kg/min) mejoran los síntomas en el SDRC [35,36].
Vasodilatadores: (tadalafilo 16mg vo). Han demostrado mejoría del dolor frente a placebo [37].
Antihipertensivos: La clonidina transdérmica puede mejorar la hiperalgesia y la alodinia [25].
Vitamina C: En dosis altas (500mg vo) puede disminuir la incidencia de SDRC tras traumatismos o cirugía, probablemente por la reducción del estrés oxidativo a través de los radicales libres [27,38].
Algunos autores han propuesto como guía inicial comenzar el tratamiento con anticonvulsivantes, antidepresivos, y en casos de hiperalgesia con clonidina transdérmica.
En la literatura no se describe un tiempo de espera óptimo antes de derivar al paciente al especialista y la derivación a una unidad multidisciplinar se recomienda que sea lo más precoz posible.
B. TRATAMIENTO INTERVENCIONISTA
Las técnicas intervencionistas, incluidos los bloqueos nerviosos, las infusiones de medicamentos y los dispositivos implantables para el tratamiento del dolor, se han recomendado para el tratamiento del SDRC [25].
6.1Bloqueos regionales (intravenosa)Ketorolaco y lidocaína o lidocaína sola proporcionan alivio a corto plazo [39].
6.2Bloqueos del sistema nervioso simpático.- -
-Bloqueo del ganglio estrellado (Figuras 10 y 11): Estructura de aproximadamente 1-2,5cm de largo, 1cm de ancho y 0,5cm de grosor, fusión del ganglio cervical inferior y el primer ganglio torácico en el 80% de la población. Medial a los músculos escalenos y al plexo braquial; lateral al músculo longus coli, la tráquea, el esófago, la glándula tiroides y el nervio laríngeo recurrente; anterior al proceso transverso y fascia prevertebral a nivel C7; inferomedial a arteria carótida interna y vena yugular interna y posterior a los vasos vertebrales. Se bloquea en pacientes con SDRC con afectación de miembro superior.
- -
-Bloqueo de la cadena simpática lumbar: Formada por dos cadenas ganglionares que se extienden retroperitonealmente a ambos lados de la columna vertebral desde L1 a L5. Se sitúa en el borde anterolateral de los cuerpos vertebrales lumbares, en la región interna de la inserción del músculo psóas. A medida que va descendiendo se coloca delante de los cuerpos vertebrales. Se bloquea en pacientes con SDRC con afectación de miembro inferior.
El papel de estos bloqueos en el tratamiento es importante, ya que reduce el dolor y mejora la función de cara a realizar el tratamiento rehabilitador.
En comparación con placebo, los bloqueos con anestésico local han demostrado una duración del efecto analgésico significativamente mayor. Los criterios para un bloqueo simpático positivo son:
- •
Aparición de síndrome de Horner
- •
Aumento de la temperatura de la piel >34°C
- •
Aumento del flujo sanguíneo de la piel >50%, medido con flujometría doppler
- •
Abolición de la respuesta de resistencia de la piel cubital
- •
Desaparición de la respuesta de resistencia de la piel radial [25]
Se puede realizar en pacientes con un bloqueo simpático lumbar positivo, consiguiendo un alivio del dolor superior a 6 meses de duración. También ha demostrado resultados similares a la simpatectomía lumbar con fenol [40,41].
6.4Bloqueos del plexo braquialSe implanta un catéter que se puede mantener hasta 3 semanas. Se realiza una infusión continua de anestésico local, opioide, clonidina u otros fármacos durante 2-3 semanas [25]. Las complicaciones incluyen sangrado, infección, inyección intravascular, inyección intratecal, neumotórax y parálisis del nervio frénico.
6.5Catéteres epidurales (Figura 12)La analgesia epidural se realiza con la inyección de medicación en el espacio epidural (área inmediatamente por fuera de la columna vertebral). La medicación, por lo general, se administra a través de una bomba programable que la inyecta a través de un catéter colocado en el espacio epidural. La combinación de medicamentos epidurales más utilizada hoy en día es clonidina con/sin bupivacaína, a veces se asocian opioides si no se controla el dolor. La medicación se puede administrar de forma continua o programar para que el paciente se autoadministre bolos pequeños para una analgesia óptima, según lo exijan los niveles de dolor. La complicación más frecuente es la infección del catéter.
Se han realizado estudios con clonidina frente a placebo con mejoría a favor de la primera. También la bupivacaína con opioide en infusión epidural ha demostrado alivio del dolor y mejoría en el movimiento [25].
6.6Bloqueos neurolíticos con alcohol o fenolIndicados principalmente en pacientes oncológicos [25] (Figura 13).
6.7Baclofeno intratecale puede considerar la primera opción para el tratamiento de la distonía en el SDRC y tiene efectos analgésicos independientes de los efectos sobre la contracción muscular. Estimula el receptor de ácido gammaaminobutírico (GABA) en las fibras aferentes primarias y actúa sobre el asta dorsal para inhibir la transmisión neuronal [42]. Reduce el dolor y mejora la distonía y la calidad de vida [14,43].
6.8NeuroestimulaciónLa estimulación eléctrica medular es una técnica que se realiza en dos tiempos; en el primero se realiza el implante del electrodo y el segundo el implante definitivo del generador con internalización de todo el sistema. Entre ambas intervenciones se encuentra el periodo de prueba, para confirmar la eficacia de la técnica antes de internalizar el sistema. Es necesario realizar un estudio psicológico específico del paciente antes de indicar la técnica. Con la neuroestimulación de la médula espinal, se han conseguido mejorías en el dolor estadísticamente significativas en varios estudios, reduciendo el dolor y mejorando la calidad de vida [44,45]. La estimulación mediante un único electrodo en el ganglio de la raíz dorsal también ha demostrado mejoría en pacientes con síndrome de espalda fallida [46,47].
6.9AcupunturaSe ha comprobado que el tratamiento con electroacupuntura produce una inhibición de la hiperalgesia mecánica y por frío y del edema en un modelo animal de dolor crónico (ratones) [48].
7ConclusionesEl SDRC es una enfermedad con una fisiopatología no clara y un curso clínico impredecible que en muchas ocasiones es desfavorable y puede ser refractario al tratamiento. El diagnóstico de SDRC se basa en los signos y síntomas derivados de la historia clínica y el examen físico. La rehabilitación y el manejo farmacológico del dolor son los pilares principales de la terapia y deben iniciarse lo antes posible. Sin embargo, si no hay una mejoría de la función de la extremidad y el dolor persiste, se debe comenzar el manejo con técnicas intervencionistas del dolor.
Declaración conflictos de interés.
Los autores declaran no tener conflictos de interés.
Referencia no citada[5].