Los analgésicos opioides son eficaces en el alivio del dolor crónico no oncológico (DCNO). Sin embargo, en tratamiento a largo plazo genera tolerancia, dependencia física y riesgo de desarrollar adicción. Estos fenómenos son causados por el efecto agonista en los receptores opioides que modulan las vías del dolor y producen un efecto hedónico intenso en el sistema de recompensa cerebral. La exposición repetida a opioides produce neuroadaptación que disminuye el efecto analgésico, produce anhedonia, aparición síntomas de abstinencia y cambios conductuales que pueden gatillar abuso y dependencia.
El conocimiento actual nos permite entender la dependencia a opioides como una enfermedad cerebral de origen multifactorial. En pacientes con DCNO se ha podido establecer que el riesgo a desarrollar una adicción a opioides aumenta cuando hay antecedentes de abuso y dependencia a sustancias, presencia de psicomorbilidades, un ambiente social favorecedor al consumo, y cuando se prescriben dosis superiores a 120mg de morfina equivalente al día (MME). Por otra parte, el aumento de la prescripción indiscriminada de estos fármacos ha causado graves consecuencias en la población general en muchos países, incrementando la poblacion dependiente, la mortalidad por sobredosis de opioides y el tráfico a nivel mundial. Guías clínicas basadas en la evidencia y consenso de expertos recomiendan que los opioides en DCNO deben ser parte de un manejo multidisciplinario, ponderando la presencia de factores de riesgo y el beneficio esperado. Aunque es difícil demostrar con evidencia que estas recomendaciones tengan impacto en reducir el riesgo, todas dan énfasis en estrategias de prevención, pesquisa precoz y seguimiento específico para el uso de estos fármacos.
Opioids on long-term therapy are effective in chronic non-cancer pain(CNCP) relief. However, they generate tolerance, physical dependence and risk of developing addiction. These phenomena are produced by agonist effect on opioid receptors of pain pathways and a hedonic stimulation on brain reward circuitry. Neuroadaptations to long-term opioids exposure results in reduction analgesic effects, anhedonia, withdrawal symptoms and could trigger behaviors for abuse and dependence. Current knowledge let us understanding opioids addiction as a multifactorial brain disorder. History of substance abuse and dependence, mental health disorders, permissive social environment for drugs consumption, and higher than 120mg morphine equivalent diary doses, have been found as risk factors for developing opioids prescription dependence. Furtheremore uncontrolled rise of indiscriminated opioids prescriptions has caused serious consequences in general population, raising addiction prevalence, overdose deaths and traffic worldwide. Evidence-based Guidelines and Consensus-based Treatments recommend that opioids must be part of a multidisciplinary management and balance risk factors with benefits. Altought the lacking evidence of reducing risk, these guidelines enfatize on specifics prevention, monitoring and follow-up strategies for long-term opioids prescribing.
El desarrollo de una adicción a analgésicos opioides es un evento catastrófico que todo médico quiere evitar cuando indica este tipo de fármacos a largo plazo. Cuando ocurre, trae consecuencias en la salud mental, empeora el control del dolor y se deteriora la calidad de vida del paciente.
Esta revisión busca entregar conocimientos que permitan al equipo de salud entender la etiopatogenia de la dependencia a opioides, detectar factores de riesgo, pesquisar su ocurrencia y finalmente esbozar estrategias de mitigación de riesgo recomendadas en el tratamiento integral del dolor crónico no oncológico (DCNO). No está en el foco de esta comunicación el tratamiento del dolor en pacientes dependientes de sustancias.
Los opioides son empleados en una amplia variedad de tipos de dolor. Dos estudios clásicos de DCNO en población europea mostraron que 28% a 38% de los individuos con dolor persistente usaban opioides débiles o potentes [1,2].
La potencia de los opioides y su techo analgésico más alto que otros fármacos son ventajas, pero sus reacciones adversas obligan a tener en cuenta los efectos sistémicos. En el sistema nervioso central (SNC) la exposición crónica produce rápida reducción de los efectos de elación y normotimizante, este fenómeno es central en el desarrollo de dependencia especialmente en población de riesgo [3].
En los años 80-90 se publicaron estudios y series clínicas que mostraban eficacia analgésica de los opioides en distintos tipos de DCNO y con bajo riesgo de dependencia [4]. Sin embargo, eran trabajos con errores metodológicos y que a pesar de su debilidad, concluían tener buenos resultados en control del dolor y bajo riesgo de dependencia [5]. Esto fomentó, especialmente en países desarrollados, una indicación menos restrictiva que consideraba dosis altas de opioide sobre 200mg/día de morfina equivalente (MME corresponde a la dosis de un opioide específico expresada en mg de morfina que igualan el efecto analgésico de ese opioide). Recomendaciones actuales advierten el aumento significativo del riesgo de dependencia cuando la dosis diaria supera los 90 MME [6].
Con el objeto de dar contexto al tema central mostraremos las consecuencias que ha traído la prescripción indiscriminada de opioides y los graves problemas de salud que afectan a la población general no portadora de dolor crónico.
2Magnitud del problemaHay estudios, de buena calidad metodológica, que han evaluado el riesgo de desarrollar una adicción a opioides en el tratamiento del DCNO. Fishbain realizó una revisión sistemática de publicaciones sobre desarrollo de adicción, comportamiento aberrante a opioides de prescripción, o test positivos en orina para alcohol y drogas ilícitas. En 24 estudios (2507 pacientes), con un tratamiento promedio de 26.2 meses, encontró una tasa global de adicción de 3.27% y en individuos sin antecedentes de abuso o adicción a sustancias la tasa fue 0.19%. En 17 publicaciones (2466 pacientes) la tasa global de comportamiento aberrante frente a opioides fue 11.5% y 0.59% en quienes no tenían antecedente de dependencia. En otros 5 trabajos (1965 pacientes), que sólo se evaluaban test de orina, 14.5% de los individuos tenían test positivos para drogas ilegales. Esta revisión sistemática les permitió concluir que el antecedente de abuso o adicción a sustancias es un factor de riesgo para desarrollo de dependencia en esta población [7]. Trabajos actuales realizados en pacientes con DCNO tratados con opioides, han mostrado que la prevalencia de abuso de opioides se ha triplicado en las últimas tres décadas, llegando a valores del 12% a 15% [8–10]. Además, hay autores que cuestionan la débil evidencia que respalda el uso de opioides a largo plazo en DCNO y comentan las dificultades para evaluar el riesgo de dependencia al que se exponen los pacientes [11].
Los resultados descritos más arriba corresponden a individuos tratados, seguidos y controlados por DCNO, sin embargo, no es posible separar del análisis las consecuencias que ha traído la prescripción indiscriminada de opioides y el mal seguimiento en la población general durante los últimos 20 años.
La Organización Mundial de la Salud (OMS) comunica continuamente en su reporte anual WDR (World Drug Report), su preocupación por que el mayor acceso a analgésicos opioides no ha sido balanceado con una prescripción segura. El informe WDR de 2019 concluye que el aumento de disponibilidad y sobreprescripción, el tráfico de opioides sintéticos y análogos de producción farmacéutica e ilegal, han fomentado un incremento global epidémico de las prevalencias de abuso, dependencia y muertes asociadas a opioides [12]. Las situaciones más críticas están en América del Norte (EE.UU. y Canadá), Sudeste Asiático y África Central.
Otras organizaciones internacionales como la Organización para la Cooperación y el Desarrollo Económico (OCDE) han mostrado interés en el problema y sus consecuencias. Recomiendan a los países asociados diseñar estrategias gubernamentales con medidas eficaces para mitigar el riesgo y reducir los efectos en la salud pública y su carga económica [13].
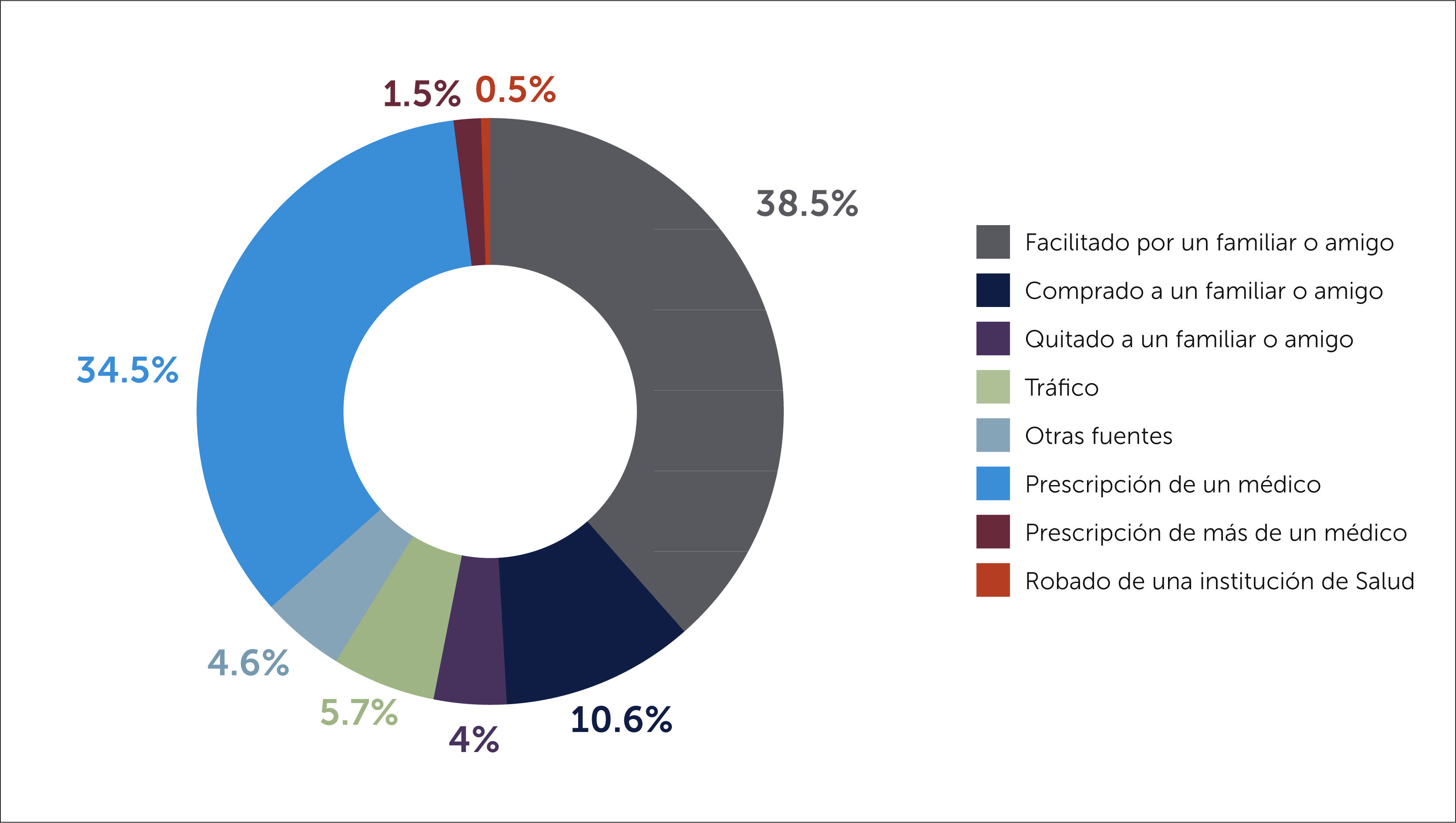
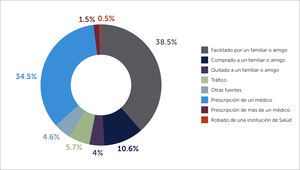
EE.UU. es el país desarrollado con mayor consumo de opioides de prescripción por habitante del mundo, con las cifras más altas de abuso, dependencia y muerte por sobredosis de opioides [14]. Estos hechos conforman una crisis de dimensión epidémica y la principal fuente de obtención de opioides para abuso es la prescripción médica y el desvío de estos fármacos hacia familiares o personas relacionadas al individuo que se le indicó (Figura 1).
A pesar del mayor control de estos fármacos la mortalidad por sobredosis de opioides se mantiene alta y se piensa que la medidas de control más estrictas, han obligado a los afectados a utilizar heroína y análogos del fentanilo de producción ilegal altamente potentes [15].
3Mecanismo de acción de opioidesLos receptores opioides están mayormente concentrados en el SNC y en menor proporción en el aparato gastrointestinal, sistema cardiovascular y sistema nervioso periférico [16].
Por convención se agrupan en cuatro familias: μ (mu, OP3), κ (kappa, OP2) y δ (delta, OP1) y el receptor de nociceptina (NOP, OP4) [17]. Los efectos de la estimulación del receptor tienen variaciones de acuerdo a la familia que pertenecen.
1. Analgesia mediada por opioides es por efecto agonista en su receptor: En la segunda neurona aferente de la vía del dolor, la estimulación del receptor post-sináptico causa por medio de la proteína G, hiperpolarización de la membrana por facilitación de salida de K+ y además por inhibición de la vía del AMPc. El efecto pre-sináptico ocurre en receptores de las terminales de fibras A y C por inhibición de canales de calcio voltaje dependientes. Esta acción también disminuye el AMPc y bloquea la liberación de neurotransmisores excitatorios de la vía ascendente del dolor (sustancia P, glutamato y el péptido relacionado al gen de calcitonina).
Los opioides además modulan la vía nociceptiva por su acción en la sustancia gris periacueductal (SGPA) y la médula rostral ventromedial. Aquí inhiben neuronas gabaérgicas que bloquean la vía descendente inhibitoria del dolor (serotoninérgica y adrenérgica). Además de lo anterior, lo opioides producen inhibición directa en neuronas descendentes facilitadoras de la vía nociceptiva [16,18].
2. Tolerancia analgésica e hiperalgesia por opioides
La estimulación agonista del receptor opioide, repetida y mantenida en el tiempo, genera tolerancia para los efectos analgésicos, colaterales y psicomiméticos [19]. En el SNC la tolerancia al efecto analgésico puede asociarse a hiperalgesia que es causada por apoptosis de células gabaérgicas del asta dorsal y también por efecto agonista de metabolitos de los opioides en el receptor glutamatérgico de N-metil-D-aspartato (NMDA). La frecuencia con que ocurren estos efectos varía de acuerdo a la población de pacientes y al opioide utilizado [20–22].
Datos clave: epidemia de abuso y dependencia a opioides
| OMS, WDR 2019 [12] |
| •76% de las muertes por sobredosis de sustancias en el mundo, son causadas por opioides (sintéticos y naturales). |
| •69% de las muertes por opioides son por fentanilo o análogos, de prescripción o fabricación ilegal. |
| •América del Norte (EEUU y Canadá) y África Central son las regiones con más prevalencia de abuso de opioides, 4% y 4.7% de la población respectivamente. |
| •Tramadol es el opioide de más abuso en África. |
| •Tráfico de Tramadol: en 2010 fueron incautados 10kg y en el 2017 125 toneladas. |
| •En Europa el consumo per cápita de opioides de prescripción es alto pero el abuso no se ha incrementado. |
| Informe referido a países miembros de la OCDE [13] |
| •La sobreprescripción médica es la principal causa de la crisis epidémica de opioides. |
| •La disponibilidad de opioides de prescripción aumento 58% entre 2002 y 2007. |
| •En 2015 hubo 240 millones de prescripciones (1 de cada 5 adultos). |
| •Países Europeos con mayor regulación y control tienen menos prevalencia de abuso y menor mortalidad por sobredosis de opioides. |
| •Desde 1999 a 2017 ocurrieron 399.230 muertes por sobredosis de opioides en EEEUU y esto causó una baja en la expectativa de vida desde el 2015 al 2017. |
| Datos EEUU de CDC y SAMHSA [14,15] |
| •Desde 1999 a 2017ha aumentado 6 veces el número anual de muertes asociadas a opioides. |
| •En 2017, de las muertes por sobredosis de sustancias, el 68% (47.200) fueron por opioides, 130 muertes diarias. |
| •9.9 millones de habitantes en 2017 abusaron de opioides de prescripción. 5.5 millones de ellos utilizaron hydrocodona. |
| •Desde 2016 a 2017 aumentó un 45.2% muertes por opioides sintéticos de prescripción y análogos de fentanilo de fabricación ilegal. |
OMS: Organización Mundial de la Salud; WDR: World Drug Report; OCDE: Organización para la Cooperación y el Desarrollo Económico; CDC: Center for Disease Control; SAMHSA: Substance Abuse and Mental Health Services Administration.
Referencias (12-15).
El manual de enfermedades psiquiátricas de la Sociedad Americana de Psiquiatría versión DSM IV, define como entidades separadas el abuso y la adicción o dependencia a sustancias. El DSM V [23] funde los conceptos abuso y adicción, considerándolos etapas de un proceso continuo denominado Trastorno por Consumo de Sustancias. Esta nueva definición y sus criterios diagnósticos constituyen un cambio conceptual que plantea un desafío respecto de como debe ser evaluado un paciente que está en tratamiento con una sustancia altamente adictiva para tratar su dolor crónico. La dificultad está en poder distinguir estos nuevos criterios diagnósticos del DSM V de los trastornos del ánimo, conductas aberrantes y la forma de relacionarse con la prescripción de fármacos que alivian el dolor del individuo. Esta dificultad es posiblemente la razón por la cual solo la guía de EE.UU. para la prescripción de opioides en DCNO de 2016, utilizan la nueva definición del DSM V [24]. Para facilitar la comprensión de este artículo, utilizaremos las definiciones clásicas del DSM IV (Tabla 2).
Definiciones clásicas del DSM IV
| Abuso |
| Uso indebido y repetido de una sustancia adictiva con consecuencias sociales, laborales y a veces legales, pero sin presentar dependencia física ni compulsión por el consumo. El abuso puede ser esporádico o interrumpido voluntariamente. |
| Adicción o Dependencia a Sustancias |
| Usados en forma indistinta, es una conducta de consumo crónico, continuo o periódico, sin la capacidad para interrumpirlo voluntariamente. Hay desarrollo de tolerancia, dependencia física, progresión de dosis y conducta compulsiva con consecuencias sociales, laborales y legales graves. |
| Tolerancia |
| Es la reducción en la intensidad de los efectos producidos por exposición repetida a una sustancia. Por diferentes mecanismos se hace necesario incrementar la dosis para lograr la misma respuesta. |
| Dependencia Física o Fisiológica |
| Fenómeno de adaptación fisiológica a la exposición crónica a una sustancia y gatillante del síndrome de abstinencia. Es normal en el tratamiento de DCNO con opioides a largo plazo y su sola presencia no cumple los criterios de adicción. |
| Síndrome de Abstinencia |
| Son los síntomas y signos que aparecen en el contexto de una dependencia física a una sustancia cuando se suspende bruscamente su uso, se reduce la dosis o se usa un antagonista específico. Las características del síndrome dependerán del tipo de sustancia. |
| Dependencia Psicológica |
| Es el componente psicológico del síndrome de abstinencia (anhedonia, disforia) y los efectos motivacionales por el consumo (compulsión). Estos síntomas pueden iniciarse durante el uso problemático de opioides y continuar en la adicción. |
Definición obtenida de Cami J, Farré M. Drugs Addiction. N Engl J Med. 2003; 349: p. 975-86; y Ref (26) Koob G. Neurobiology of Addiction. The Journal of Lifelong Learning in Psychiatry. 2011 Winter; Vol 9(1): p. 55-65.
En condiciones normales un estímulo con efecto hedónico activa al circuito de recompensa, se procesa la calidad del estímulo y luego se gatilla la conducta por repetir el estímulo [25]. El Área Ventral Tegmental (AVT) en el mesencéfalo y el Núcleo Accumbens (NAC) en el encéfalo, poseen receptores opioides. En estos sitios el opioide inhibe neuronas gabaérgicas lo que desinhibe neuronas dopaminérgicas con proyecciones excitatorias hacia la amígdala (AMG) y la corteza prefrontal (CprF). En la AMG se evalúa el efecto hedónico o anhedónico y su contexto emocional/ambiental, y en la CprF la estimulación dopaminérgica gatilla la conducta que busca repetir el estímulo. También son parte del circuito el Núcleo del Rafe (NRF), con proyecciones serotoninérgicas implicadas en el efecto normotimizante de los opioides; y el Locus Cerúleo (LC) ubicado en el tronco, con alta concentración de neuronas noradrenérgicas que se activan en la privación de sustancia y causan síndrome de abstinencia.
Hoy en día la adicción es descrita como una condición originada en una disfunción pre-existente o secundaria del sistema de recompensa cerebral [26,27]. La estimulación repetida por un agente adictivo desencadena fenómenos de neuroadaptación que reducirán la intensidad de la activación dopaminérgica y serotoninérgica, y además se incrementará de la actividad noradrenérgica. Estos cambios causan un refuerzo anhedónico caracterizado por la pérdida del control del consumo de la sustancia [19,28].
5.2Dolor crónico y circuito de recompensaIndividuos dependientes de sustancias y sujetos con dolor crónico comparten alteraciones en el funcionamiento de recompensa, sin embargo, hay diferencias. En el paciente con DCNO hay un estado hipodopaminérgico que se manifiesta por anhedonia y depresión que afecta el aspecto motivacional de sus conductas habituales, en cambio en el individuo con adicción se gatilla la conducta de búsqueda compulsiva del consumo de sustancia. A pesar de esta diferencia, no es posible descartar que esta disfunción compartida influya en una mayor suceptibilidad de los individuos dependientes a sustancias a desarrollar dolor crónico y viceversa [29,30]. La reducción del efecto hedónico a los opioides se produciría por la tolerancia psicológica, fenómeno de adaptación asociativa o aprendida. La disminución del efecto analgésico es más lenta y se produce por la tolerancia farmacológica (no asociativa). Esta diferencia explica la precoz reducción del efecto hedónico a opioides y la mayor estabilidad del efecto analgésico [19,28].
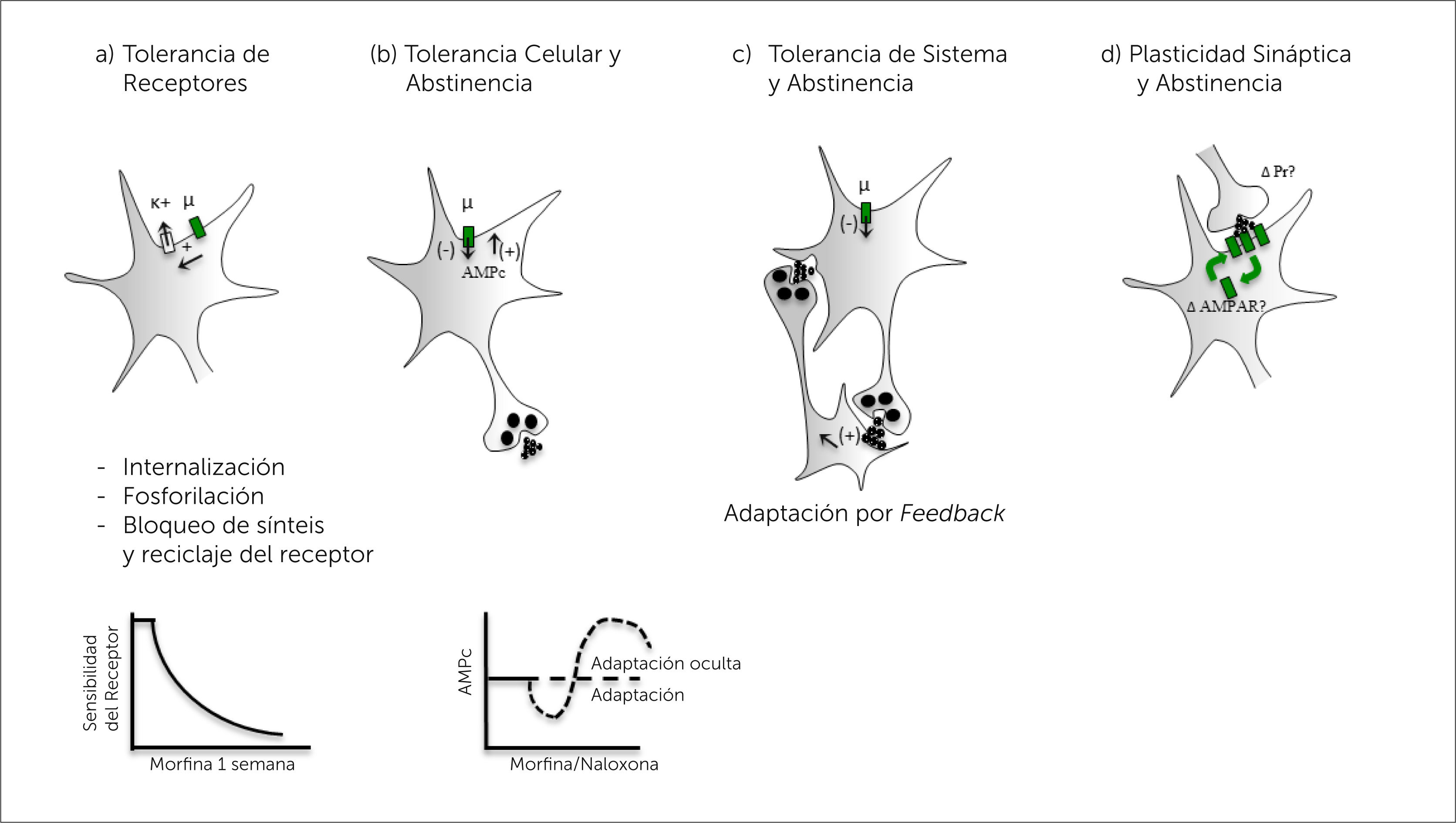
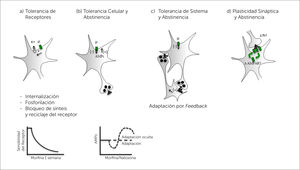
5.3NeuroadaptaciónOcurre en dos fases, de tolerancia aguda y de tolerancia a largo plazo. La primera corresponde a desensibilización del receptor opioide y la segunda por efecto en la transcripción genética, funcionales y estructurales de los neurocircuitos que aumentan el riesgo de recaída [19,31,32] (Figura 2).a) Desensibilización del receptor opioide. La morfina estimula y desensibiliza agudamente el receptor (3 a 5 minutos) que al acoplarse a la proteína G, aumenta su afinidad por la β-arrestina que bloquea su actividad y favorece su endocitosis. Luego el receptor es reciclado, re-sensibilizado y expuesto después de 30 a 60 minutos. Cuando hay exposición crónica a morfina el receptor se mantiene bloqueado por el mismo mecanismo, pero no puede ser internalizado ni reciclado, esto produce desensibilización a largo plazo [28].b) Efectos en la transcripción genética
Neuroadaptación.
Mecanismos de Neuroadaptación Celular y de Reorganización de Circuitos.
(a) El cambio más importante es la Tolerancia de Receptores que disminuye la sensibilidad de la neurona al opioide es por mecanismos de internalización, fosforilación, bloqueo de la síntesis y reciclaje de receptores. Gráfico muestra reducción de la sensibilidad del receptor a la morfina dentro de la primera semana de exposición.
(b) La Tolerancia Celular causa acumulación de AMPc en la neurona que se enmascara mientras persiste la explosión a opioides pero se hace manifiesta en la abtinencia o el uso de naloxona como antagonista. Gráfico muestra efectos de la acululación de AMPc al usar naloxona.
(c) La Tolerancia por adaptación de neuronas gliales estimuladas por neuronas opioides sensibles, genera feedback excitatorio en la abstinencia.
(d) Plasticidad Sináptica por expresión de receptores AMPA en sinapsis GABAérgicas sensibles a los opioides, es un cambio de adaptación a largo plazo secundario a la exposición crónica a opioides.
Adaptado de Ref. Dang V, Christie M. Mechanisms of rapid opioid receptor desensitization, resensitization and tolerance in brain neurons. British Journal of Pharmacology. 2012; 165(6): p. 1704–16.
La estimulación mantenida del receptor opioide, a través de segundos mensajeros y factores de transcripción genética (CREB y ΔFosB), genera síntesis de moléculas y cambios estructurales ligados a fenómenos que refuerzan a largo plazo la dependencia (anhedonia, compulsión por el consumo y síntomas de abstinencia).
El CREB (Cyclic AMP Responsive Element Binding protein) fosforilado se fija a secuencias del ADN que gatillan expresión génica que culmina en un aumento del AMPc intracelular y en neuronas del NAC, el CREB también activa transcripción de genes implicados en la síntesis de dinorfinas [31].
El aumento del ΔFosB (proteína perteneciente a los factores de transcripción genética Fos), en neuronas del NAC, activa expresión de genes que reducen su sensibilidad al glutamato. Este cambio favorece la síntesis de proteínas relacionadas con la formación de nuevas dendritas y cambios estructurales que pueden perdurar hasta 5 años después de interrumpido el consumo de opioide [31,32].c) Síndrome de abstinencia
En condiciones normales el LC tiene un tono adrenérgico homogéneo mantenido por el factor liberador de corticotrofina (FLC) y escontrabalanceado por opioides endógenos. En situaciones de estrés el LC incrementa su tono y el estado de alerta del individuo. En la exposición crónica a opioides exógenos el tono adrenérgico es mayor y se pierde el mecanismo de contra regulación natural. De esta forma en una abstinencia aguda o uso de antagonistas, se libera gran cantidad de noradrenalina que produce el síndrome característico [33] (Tabla 3).
Síndrome abstinencia a opioides
| Signos Vitales | PA↑ o↔FC↑ o↔FR↑ o↔T°↔ |
| Nariz y ojos | Midriasis, lagrimeo y rinorrea |
| Sistema Nervioso Central | Normal, irritable, inquietudconvulsiones, temblor, calambres |
| Sistema Gastrointestinal | Náuseas y vómitos, diarrea |
| Piel | Piloerección y sudoración |
PA: presión arterial; FC: frecuencia cardíaca; FR: frecuencia respiratoria; T°: temperatura; aumentada; disminuida; estable.
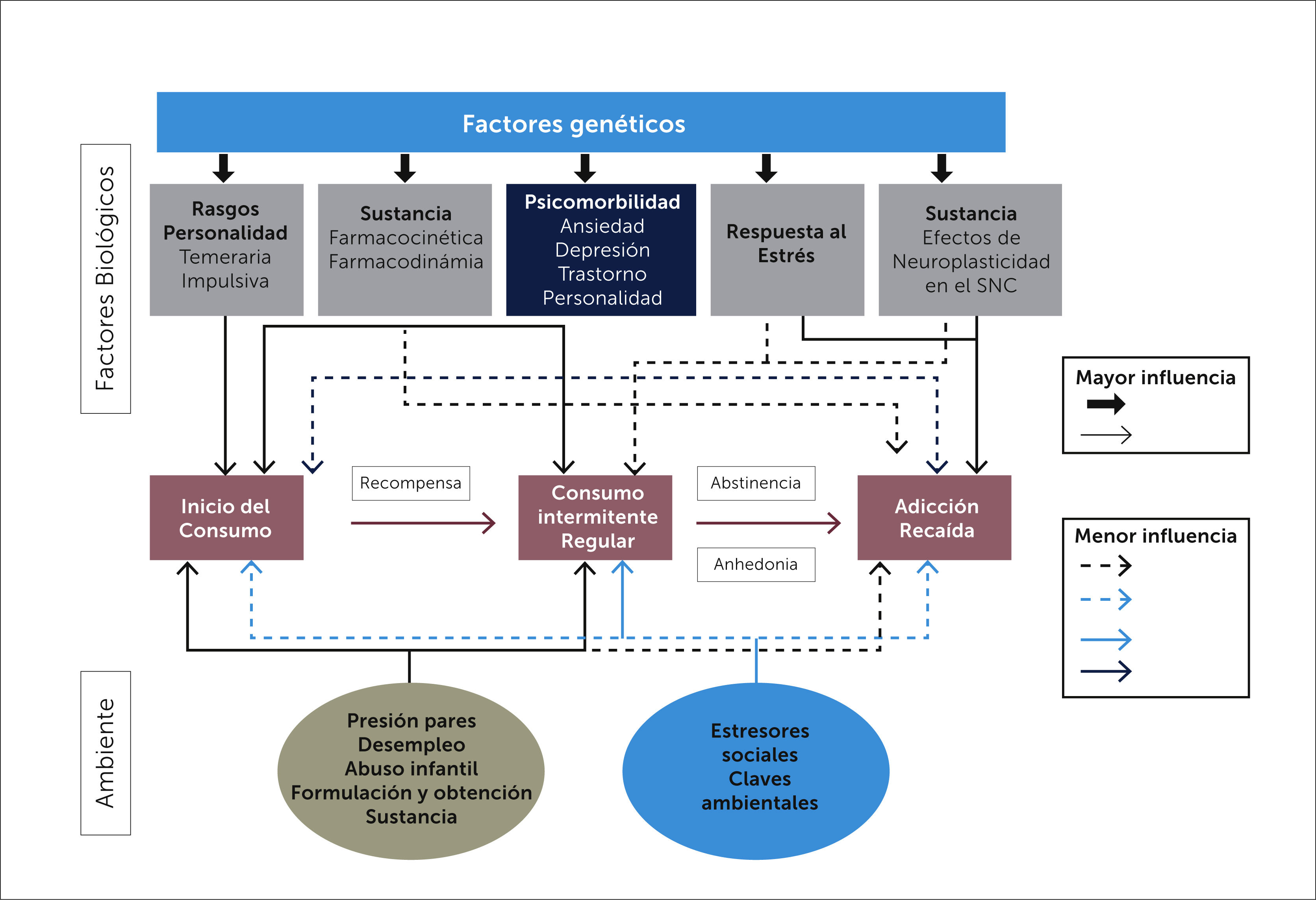
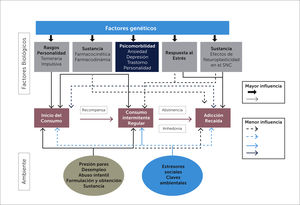
La génesis de una dependencia a opioides es multifactorial. Se requiere que la sustancia genere un estímulo hedónico intenso, un consumo repetido y prolongado, factores de riesgo biológico individual, antecedente de dependencia a otras sustancias, contexto familiar facilitador, fácil disposición de sustancias, y situaciones de estrés emocional [34] (Figura 3).
El componente genético condiciona la vulnerabilidad del individuo a desarrollar dependencia. Influye en la presencia de diferencias en el metabolismo de la sustancia, en sus efectos en el individuo, en respuestas patológicas al estrés, falta de control del impulso y presencia de psicomorbilidades. En gemelos y en animales, se han identificado áreas cromosómicas asociadas a mayor riesgo de adicción al alcohol, a opioides, a cocaína, a nicotina y marihuana [32,35]. El factor genético explica que individuos con conducta impulsiva y personalidad temeraria, presenten con más frecuencia variaciones en los sistemas dopaminérgico, serotoninérgico y gabaérgico. El individuo vulnerable tendrá una actitud más proclive a iniciar el consumo de la droga, a desarrollar una dependencia y a tener mayor riesgo de recaída [34].
Se ha demostrado que una variantes genéticas de los alelos 118G y CIVS1-T17286C, están asociadas a mayor riesgo de alcoholismo, dependencia a opioides y respuestas alteradas al estrés [36,37]. No obstante, no es posible utilizar la detección de estos como predictores de riesgo de aplicación clínica, pues no existen test de rutina que lo permitan.
6.2Factores psicosociales y ambientalesUn ambiente familiar y social favorecedor al consumo de sustancias facilitan el inicio y mantención. Estresores emocionales como abuso sexual, violencia intrafamiliar en la niñez, situaciones de guerra, son claves ambientales que influyen en la memoria emocional del circuito de recompensa y se encuentran frecuentemente en portadores de dependencias [34].
6.3Psicomorbilidad y abuso de sustanciasDado que algunas psicomorbilidades aumentan el riesgo de presentar DCNO y también el riesgo de desarrollar una adicción, se podría suponer que ambas entidades comparten la misma vulnerabilidad biológica [38].
En un estudio en 15160 veteranos de guerra con DCNO tratados con opioides, seguidos a 5 años, Edlund demostró que el antecedente de enfermedad mental y de abuso o dependencia a sustancias no opioides son predictores de riesgo para el desarrollo de dependencia a opioides de prescripción. Sus autores concluyeron que estos antecedentes deben ser escrutados antes del inicio de una terapia con opioides y debidamente tratados durante el manejo del dolor [39]. Otro estudio demostró que el antecedente de abuso de sustancias aumentaba significativamente el riesgo de adicción, especialmente cuando la dosis de opioide superaba los 100 MME/día [40].
6.4Factores relacionados al opioide y su formulaciónCon instrumentos de evaluación del comportamiento y síntomas se ha podido demostrar, que pacientes tratados a largo plazo con opioides, en dosis >120 MME/día, presentan con más frecuencia síntomas de compulsión por la ingesta y escalamiento de dosis. Las formulaciones de liberación sostenida con alta dosis por unidad, son más utilizadas para abuso mediante la adulteración de su presentación para aumentar su biodisponibilidad [41].
No se considera que exista una mayor o menor potencia adictiva de un tipo especial de opioide, en cambio es importante decir que el riesgo aumenta cuando la dosis diaria supera los 120 MME.
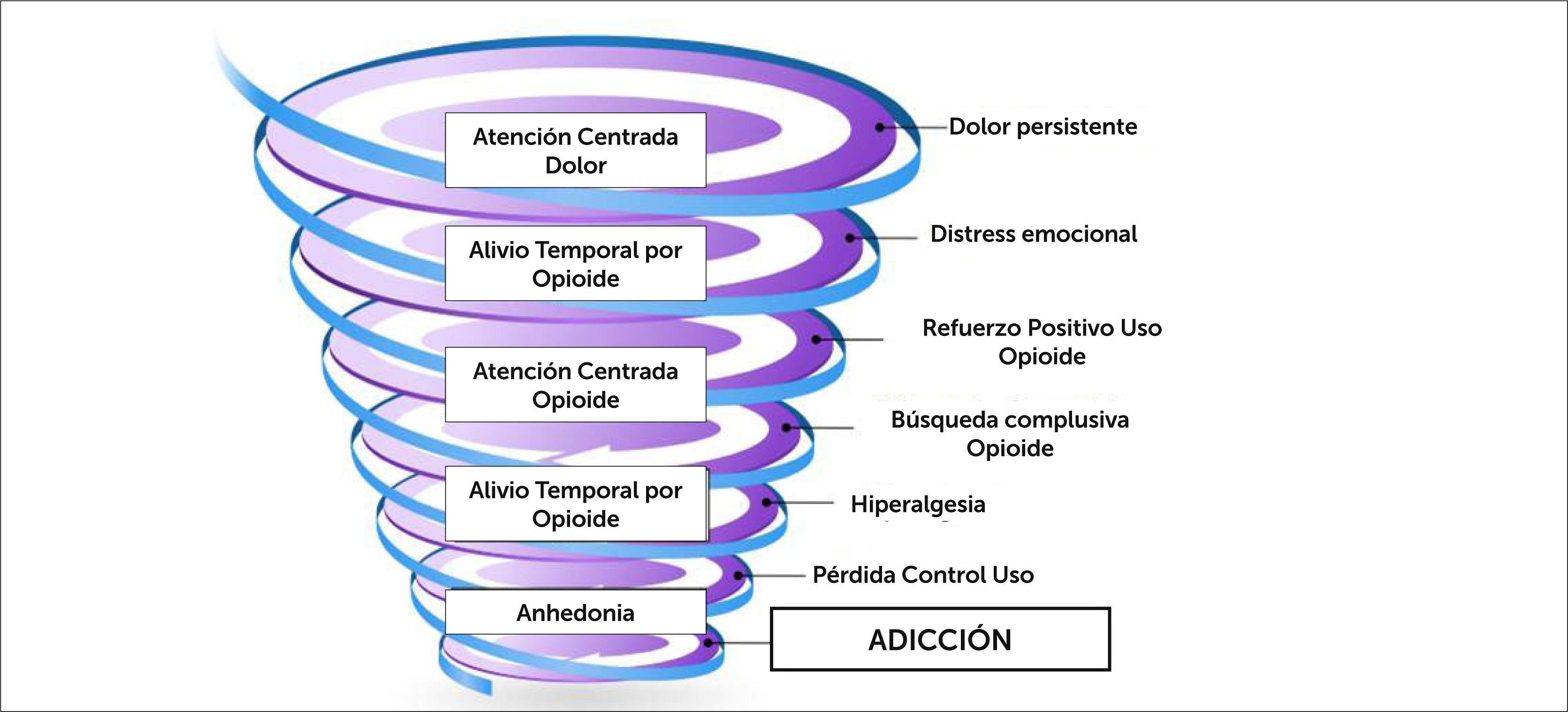
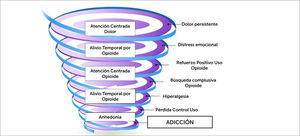
7Desarrollo de Adicción en el Paciente con DCNOAunque se halla hecho un adecuada selección y prescripción, en el paciente tratado con opioides potentes a largo plazo, se producen todas las alteraciones ya descritas en el sistema de recompensa cerebral y también los cambios duraderos de neuroadaptación fisiológica y estructural. En este contexto el DCNO insuficientemente aliviado, la reducción de la funcionalidad física y cognitiva, los trastornos del ánimo y del sueño pueden llegar constituir el refuerzo negativo de la conducta de consumo del opioide indicado (anhedonia) y por otra parte el alivio del dolor por efecto del opioide, el refuerzo positivo. Las claves contextuales como la repetición del hábito de prescripción, la forma de obtención del opioide y los agentes estresores ambientales (sociales y/o familiares) constituyen refuerzos motivacionales de la misma conducta.
Garland et al describe que los efectos de un tratamiento prolongado con opioides, aún sin ser percibidos, pueden llegar a potenciar el desarrollo de una adicción a estos fármacos [42]. Señala que, a pesar de los efectos colaterales desagradables de los opioides, los refuerzos negativos terminan por comandar el proceso patológico. Así el paciente presenta insuficiente alivio del dolor, centra su mente y su vida continuamente en su sufrimiento y los aumentos de dosis causan alivios solo transitorios del dolor y el estrés emocional. El escalamiento sucesivo va causando un refuerzo condicionado de la conducta y del compromiso emocional. El desarrollo de compulsión y la hiperalgesia, preceden a la pérdida del control del uso del fármaco cuando ya se establece la dependencia a la sustancia (Figura 4).
Desarrollo de dependencia a opioides en pacientes con DCNO.
Adaptado de: Garland EL, Froeliger B. The Downward Spiral of Chronic Pain, Prescription Opioid Misuse, and Addiction: Cognitive, Affective, and Neuropsychopharmacologic Pathways. Neurosci Biobehav Rev. 2013 December 1; 37(1002): p. 2597-2607.
En términos prácticos hay conductas características descritas, como uso problemático de opioides o comportamientos aberrantes frente al uso. Chabal describió este comportamiento como patrones de conducta que sugieren que el individuo podría estar usando estos fármacos con fines diferentes al alivio del dolor [43]. Estas conductas no son diagnósticas de adicción, pero tampoco la descartan Su presencia debe ser discutida en el equipo tratante y objetivada en registros, luego deben ser conversadas con el paciente respecto de su origen. Después de aclarado el contexto se debe ajustar integralmente el manejo (Tabla 4).
Criterios de uso problemático de opioides o comportamiento aberrante
| Durante la consulta de dolor, el paciente muestra un enfoque abrumador en temas relacionados al opioide, ocupando gran parte del tiempo en ello, lo que impide tratar temas relacionados al dolor. Este comportamiento debe persistir más allá de la tercera sesión. |
| El paciente reiteradamente (tres o más veces) solicita recetas antes del tiempo de renovación, refiriendo mayor necesidad por escalamiento de dosis, en ausencia de cambios agudos del dolor o de su condición de salud que lo justifiquen. |
| El paciente hace múltiples llamados telefónicos o visita la unidad o consulta de dolor, solicitando adelanto de recetas al personal no médico. También es criterio si en solo una visita genera un problema grave (causa disturbio o conducta agresiva). |
| Frecuentes problemas con la prescripción refiriendo pérdida de fármacos y recetas o robo de los mismos. |
| Obtención de opioides de fuentes externas al centro donde trata su dolor, Servicios de Urgencia, otras unidades de dolor o de forma ilegal. |
Comportamientos observados que se sugieren que el paciente está utilizando los opioides con un fin distinto del tratamiento de su dolor.
Chabal C. Prescription Opiate Abuse in Chronic Pain Patients: Clinical Criteria, Incidence and Predictors. Clin J Pain 1997;13:150–5.
En una comunicación de la IASP (International Association for the Study of Pain), Ballantyne comenta que la nueva definición de criterios del DSM V para Trastorno de uso de sustancias o adicción no puede ser aplicada en forma literal en el paciente con DCNO [44] (Tabla 5). Esto porque las conductas aberrantes no son siempre causadas por el desarrollo de una adicción y es necesario interpretarlas en el contexto del paciente. Aunque exista compulsividad, el gatillo puede ser la dependencia física asociada al tratamiento, el insuficiente alivio del dolor o alteraciones conductuales que no provienen de una adicción. Estas conductas se encuentran en un área gris entre lo que es un paciente con dolor crónico con adecuado comportamiento respecto del uso de opioides y en el otro extremo el paciente que ha desarrollado una adicción a opioides con curso independiente del grado de control del dolor (Tabla 5).
Patrón de conducta del trastorno de consumo de sustancias DSM-V
| Requiere dos o tres de las formas expuestas a continuación para hacer diagnóstico: |
| Incumplimiento de las obligaciones principales en el trabajo, clases o en casa. |
| Consumo continuado en situaciones físicamente peligrosas (ej. conducción). |
| Problemas sociales o interpersonales persistentes o recurrentes. |
| Ingesta de sustancias en cantidades mayores o durante más tiempo de lo establecido. |
| Deseo persistente o esfuerzos sin éxito por reducir el consumo. |
| Inversión de mucho tiempo en actividades necesarias para obtener sustancias, consumirlas o recuperarse tras su consumo. |
| Renuncia o reducción de actividades sociales, ocupacionales o recreativas importantes. |
| Consumo continuado a pesar de conocer el peligro. |
| Ansiedad extrema por el consumo. |
Criterios diagnósticos utilizados para los trastornos del consumo de sustancias, Manual diagnóstico y estadístico de los trastornos mentales. DSM-V.
Existen pruebas y cuestionarios para estimar el riesgo de abuso de opioides antes de indicarlos y otros para detectar conductas aberrantes durante el tratamiento. Los formularios de autoreporte son el Pain Medication Questionnaire (PMQ) [45], Screener and Opioid Assesment for Patients with pain Revised (SOAPP-R) [46], Opioid Risk Tool(ORT) [47], y el Current Opioid Misuse Measure (COMM) [48]. Estas pruebas pesquisan alteraciones del ánimo y comportamientos aberrantes. La debilidad del autoreporte es que puede ser manipulado para ocultar comportamientos aberrantes. El SOAPP-R es el único cuestionario traducido al español pero su valor predictor no ha sido validado en hispano parlantes [49]. Tampoco es posible comparar estos instrumentos, poseen disparidad de criterios y variabilidad de los puntos de corte que determinan positividad del test [45,50,51].
Otros instrumentos son completados por el médico: Prescription Abuse Checklist; Prescription Drug Use Questionaire; Screening Tool for Addiction; Screening Tool for Abuse; Pain Assesment and Documentation Tool; Addiction Behaviors Checklist. Estos no tienen versiones en español y difieren en las definiciones de lo que consideran conducta aberrante, por lo tanto, no pueden ser comparadas ni validadas [50].
A pesar de estas observaciones el SOAPP-R y COMM son los test mejor calificados y por esto han sido incluidos en recomendaciones y guías para el uso de opioides en DCNO (Tabla 5).
8.2Test de sustancias en orinaLa observación del comportamiento no es suficiente para detectar abuso de opioides o consumo de sustancias ilícitas. Se ha descrito que 1 de cada 5 pacientes sin comportamiento aberrante da test de orina positivo [52].
Son de fácil aplicación, bajo costo y con valor objetivo para evaluar el cumplimiento de la terapia, detectar otro opioide y drogas ilícitas. Hay guías que incluyen el test de orina en el plan de tratamiento. Su uso requiere entrenamiento para interpretarlos, por la posibilidad de falsos positivos y falsos negativos. Por ejemplo, la detección de hydromorfona en orina puede ser normal en un paciente que está en tratamiento con morfina, codeína o hydrocodona, pero también en individuos en consumo activo de heroína [53–55].
8.3Programas de monitoreo de la prescripción (PMP)En EE.UU. se desarrolló un plan para evitar doble prescripción usada por individuos con dependencia a opioides o que buscan traficar el fármaco. El Prescription Monitoring Programs (PMPs) es un programa de vigilancia en línea que centraliza computacionalmente la información de prescripción de cada individuo y obliga al médico a realizar una mejor evaluación del paciente y juiciosa indicación del opioide. Sin embargo, estos programas no han tenido impacto en reducir el abuso de opioides de prescripción, ni en las cifras de sobredosis en la población general. Se desconoce si tiene impacto en pacientes con DCNO [56,57].
8.4Consentimiento informadoEl consentimiento informado tiene como objetivo que el médico explique al paciente los beneficios de un adecuado control del dolor y los eventuales riesgos asociados al uso prolongado de opioides; que el paciente pueda expresar sus inquietudes y sean contestadas; que entregue toda la información relevante que requiera el médico y que se comprometa con los deberes de adherencia, cumplimiento de indicaciones, evaluaciones de psicomorbilidad y test de orina, antes y durante el tratamiento. En el consentimiento el paciente reconoce haber sido adecuadamente informado y autoriza al médico a realizar la prescripción aceptando todas las medidas descritas.
Se recomienda que quede explícito que el paciente toma conocimiento y entiende los riesgos más graves asociados a la ingesta simultánea de alcohol, sedantes y otros psicotrópicos, y los riesgos de alterar la forma farmacológica o la vía de administración.
Es una medida recomendada por expertos en guías de tratamiento, pero hay débil evidencia del impacto en adherencia a tratamiento o reducción del abuso [41,58,59].
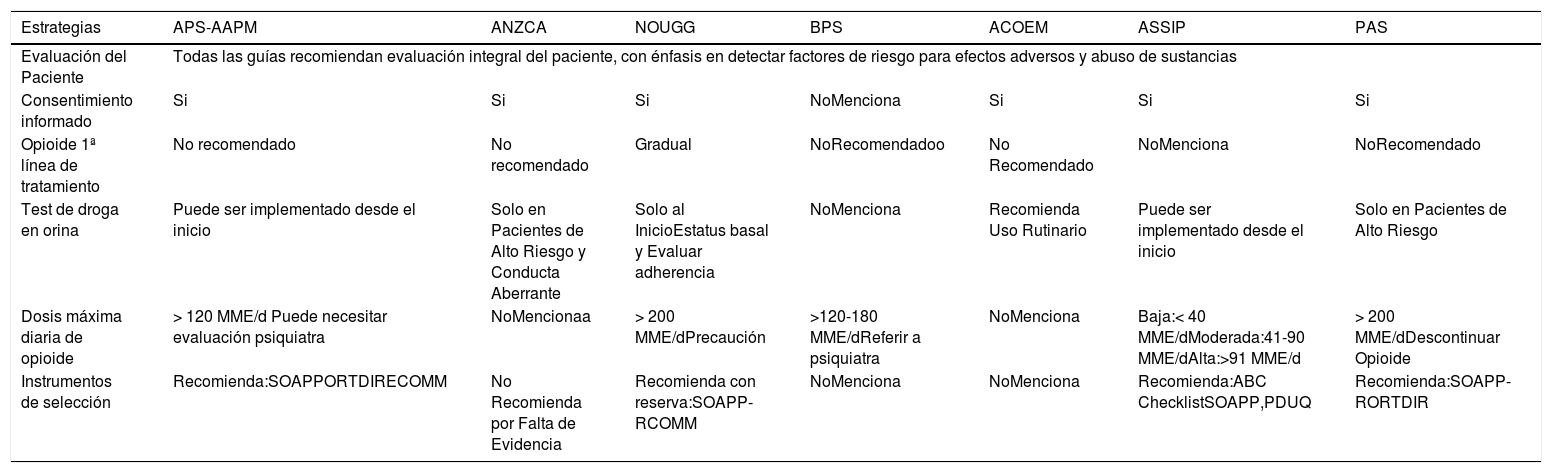
8.5Guías clínicas de tratamiento de DCNO con opioidesLas guías clínicas de tratamiento con opioides en DCNO tienen el objetivo de dar recomendaciones para un eficaz alivio del dolor, reducción de los riesgos asociados a sus efectos colaterales, de abuso y desarrollo de dependencia al opioide. Una revisión de guías evaluó comparativamente la importancia que da cada una de ellas a las estrategias de reducción de riesgo recién descritas [60] (Tabla 6).
Guías Clínicas de tratamiento con opioides en dolor crónico no oncológico
| Estrategias | APS-AAPM | ANZCA | NOUGG | BPS | ACOEM | ASSIP | PAS |
|---|---|---|---|---|---|---|---|
| Evaluación del Paciente | Todas las guías recomiendan evaluación integral del paciente, con énfasis en detectar factores de riesgo para efectos adversos y abuso de sustancias | ||||||
| Consentimiento informado | Si | Si | Si | NoMenciona | Si | Si | Si |
| Opioide 1ª línea de tratamiento | No recomendado | No recomendado | Gradual | NoRecomendadoo | No Recomendado | NoMenciona | NoRecomendado |
| Test de droga en orina | Puede ser implementado desde el inicio | Solo en Pacientes de Alto Riesgo y Conducta Aberrante | Solo al InicioEstatus basal y Evaluar adherencia | NoMenciona | Recomienda Uso Rutinario | Puede ser implementado desde el inicio | Solo en Pacientes de Alto Riesgo |
| Dosis máxima diaria de opioide | > 120 MME/d Puede necesitar evaluación psiquiatra | NoMencionaa | > 200 MME/dPrecaución | >120-180 MME/dReferir a psiquiatra | NoMenciona | Baja:< 40 MME/dModerada:41-90 MME/dAlta:>91 MME/d | > 200 MME/dDescontinuar Opioide |
| Instrumentos de selección | Recomienda:SOAPPORTDIRECOMM | No Recomienda por Falta de Evidencia | Recomienda con reserva:SOAPP-RCOMM | NoMenciona | NoMenciona | Recomienda:ABC ChecklistSOAPP,PDUQ | Recomienda:SOAPP-RORTDIR |
APS - AAPM= American Pain Society - American Academy of Pain; ANZCA=Australian and New Zealand College of Anaesthetists; NOUGG=National Opioid Use Guideline Group, Canada; BPS=British Pain Society; ACOEM=American College of Occupational and Enviromental Medicine; ASSIP American Society of Interventional Pain Physicians; PAS=Pain Association of Singapore; ME/d=dosis morfina equivalente día; SOAPP-R=Screener and Opioid Assesment for Patients with pain Revised; COMM=Current Opioid Misuse Measure; PDUQ=Prescription Drug Use Questionaire; ABC=Addiction Behaviors Checklist; ORT=Opioid Risk Tool; DIRE=Diagnosis Intractability, Risk, Efficacy.
Ref. Cheung C et al. Chronic Opioid Therapy for Chronic Non-Cancer Pain: A Review and Comparison of Treatment Guidelines Pain Physician 2014; 17:401-414.
Todas enfatizan en una evaluación integral del paciente, considerando la búsqueda de factores de riesgo de efectos adversos y desarrollo de dependencia. Salvo la guía de Singapur, todas las otras sociedades recomiendan explícitamente la necesidad de un consentimiento firmado antes del inicio del tratamiento [61].
Respecto de usar test en orina existe mayor uniformidad en su indicación en las guías de países con más alto consumo de opioides per cápita, lo que es una medida lógica respecto de la realidad en esos países [62–65]. También en esos países coinciden en recomendar, aunque con poca evidencia, el uso de test de evaluación de riesgo en la selección y énfasis en la tendencia o presencia de comportamientos aberrantes.
9Estrategias de reducción de riesgo recomendadasBasándose en guías clínicas, recomendaciones apoyadas en evidencia [6,24,59] y opiniones de expertos [58], es posible recopilar las siguientes estrategias de reducción del riesgo de abuso al prescribir a largo plazo opioides en DCNO:
9.1Evaluación inicial- a.
Evaluación integral del paciente, precisando el diagnóstico etiológico.
- b.
Documentar tipo y severidad del dolor.
- c.
Antes de indicar opioides, optimizar y preferir un tratamiento multimodal sin opioide y terapias intervencionales del dolor.
- d.
Evaluar estatus físico y mental para prever complicaciones del uso de opioides:
- i.
Tránsito intestinal y enfermedades respiratorios severas.
- ii.
Evaluación psicológica para detectar alteraciones del ánimo y de personalidad. En caso necesario optimizar tratamiento antes de iniciar opioides.
- e.
Pesquisar abuso o dependencia a sustancias.
- i.
Preguntar al paciente por abuso o dependencia a sustancias de prescripción o ilegales y registrar información.
- ii.
Descartar doble prescripción.
- iii.
Test de orina para opioides y sustancias ilegales.
- iv.
En caso de detectar abuso o dependencia de opioides, sustancias ilegales o alcohol, test de orina positivos o doble prescripción, no indicar opioides y derivar para tratamiento de la dependencia.
- a.
Objetivos de alivio del dolor y recuperación de funcionalidad acordados con el paciente.
- b.
Riesgo de complicaciones médicas y desarrollo de dependencia. Informar los riesgos más comunes y graves. El paciente debe tener la oportunidad aclarar dudas.
- c.
Informar riesgo de toxicidad de opioides por consumo concomitante de alcohol y benzodiacepinas.
- d.
Monitoreo del cumplimiento de la prescripción (test de orina, evaluaciones psicológicas). Se debe informar la justificación de estas medidas de control y las condiciones para ser solicitadas.
- e.
Circunstancias que justifiquen suspender la prescripción de opioides.
- f.
El paciente debe aceptar todas las condiciones, dar información veraz, consignar que ha sido informado y firmar el consentimiento antes de iniciar la prescripción.
- a.
Inicialmente utilizar opioides de acción corta y en la dosis efectiva más baja y con efectos adversos tolerables. Evitar formulaciones de efecto prolongado.
- b.
Evaluación periódica del alivio del dolor y mejoría de la funcionalidad que deben ser mayor al 30% en ambos aspectos.
- c.
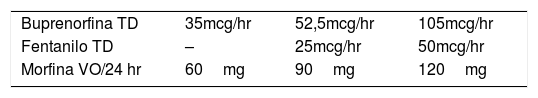
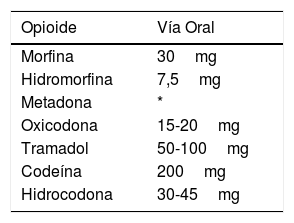
Considerar dosis baja hasta 40 MME por día, moderada 41 a 90 MME y dosis alta desde 91 MME. Usar tablas de equipotencia validadas para este cálculo (Tabla 7 y Tabla 8).
Tabla 7.Conversión de parches de administración transdérmica
Buprenorfina TD 35mcg/hr 52,5mcg/hr 105mcg/hr Fentanilo TD – 25mcg/hr 50mcg/hr Morfina VO/24 hr 60mg 90mg 120mg TD: transdémico; VO/24hr: dosis diaria vía oral. Nota: Conversiones referenciales en valores aproximados extraídos y adaptados de diferentes fuentes. No deben ser usados como guía terapéutica.
- d.
En individuos sin uso actual de opioides, iniciar dosis menor de 40 MME día y en caso necesario incrementar dosis sin sobrepasar 90 MME. En caso que ya estén con tratamiento y requieran dosis mayor de 90 MME derivar para segunda evaluación del caso.
- a.
Evaluar cumplimiento de controles, de la prescripción y test de orina.
- b.
Monitoreo de efectos colaterales requieran suspender tratamiento.
- c.
Fijar límite de tiempo para decidir mantención o retirada.
- d.
Discontinuar opioides por ineficacia, efectos colaterales y presencia de abuso con necesidad de rehabilitación.
- a.
Revisar con el paciente el consentimiento y condiciones de tratamiento acordadas.
- b.
Solicitar test de orina para opioides y sustancias ilegales, fijar periodicidad de pruebas.
- c.
Acortar intervalo entre controles.
- d.
Conteo de pastillas y prescripción (semanal, bimensual).
- e.
Reevaluar la terapia con opioides y alternativas de tratamiento del dolor.
- f.
En caso de persistir patrón aberrante:
- i.
Derivar a salud mental y descartar desarrollo de adicción.
- ii.
Retirada planificada del opioide.
La necesidad de indicar un analgésico opioide a un paciente con DCNO es una decisión compleja. El tratante debe poseer conocimientos que le permitan discernir si los beneficios que se obtendrían, en analgesia y recuperación de la funcionalidad, compensan el riesgo de desarrollar una adicción.
Hoy en día se conocen los efectos de estos fármacos en el cerebro humano, especialmente los que modulan y afectan el circuito de recompensa cerebral. También conocemos los factores bio-psico-sociales que aumentan la vulnerabilidad para desarrollar una dependencia a estas sustancias y en particular en el paciente con DCNO (psicomorbilidad, antecedente de abuso de drogas). Sin embargo, sigue siendo un desafío indicar un opioide a largo plazo en condiciones de seguridad ya que, independiente de factores individuales, la prescripción indiscriminada, la falta de seguimiento y educación al paciente, han causado graves problemas en la población general producto de la crisis epidémica por abuso de opioides.
Existen varios instrumentos de autoevaluación y de observación de la conducta, algunos de ellos validados, no obstante, estos no reemplazan la estrecha vigilancia de un equipo entrenado, el manejo integral del paciente y de la prescripción segura.
En este artículo hemos querido entregar conocimientos profundos al equipo de salud que fundamenten sus decisiones, que le permitan entender los cambios conductuales que podrían observarse y planificar una estrategia para mitigar el riesgo de desarrollar una adicción a opioides.
Concluimos que es recomendable tener estrategias protocolizadas que eviten la variabilidad de criterios entre profesionales, que favorezcan el control uniforme y periódico de los objetivos de alivio del dolor, mejoría de la funcionalidad y reducción de riesgos.
Declaración conflictos de interés.
Este autor declara no tener conflictos de interés.