El monitoreo intraoperatorio en cirugías de neuro- oncología se ha desarrollado extensamente durante las últimas décadas. Este artículo tiene como objetivo revisar aspectos técnicos de la ecografía intraoperatoria, sus indicaciones para cirugía neuro-oncológica intracerebral y espinal y también revisar sus limitaciones. La ecografía intraoperatoria sigue teniendo un rol complementario a las excelentes imágenes obtenidas por la neuronavegación, ya que no está afectada por el fenómeno conocido como “brain shift”. La ecografía intraoperatoria tiene una alta sensibilidad y especificidad para definir una lesión intracerebral versus parénquima cerebral normal y permite planificar el acceso quirúrgico de la lesión y evaluar la presencia de posible tumor residual posterior a la resección quirúrgica.
Intraoperative monitoring during neuro-oncology surgery has had an extensive development during the past decades. This article reviews the principles of intraoperative ultrasound, its indications for brain and spine tumor surgery and reviews its principal limitations. Intraoperative ultrasound continues to have a complementary role to the excellent images obtained from neuronavigation which are limited by the brain shift phenomena that occurs during surgery. It has a high sensibility and specifity to detect pathologic intracerebral lesions versus normal brain tissue and permits intraoperative planification of the surgical access and evaluation of possible residual tumor after the tumor resection.
Las alternativas de monitoreo intraoperatorio en cirugías de neuro-oncología han aumentado durante las últimas décadas, especialmente en comparación a la era de pre-resonancia magnética 1–3. Este monitoreo tiene el propósito de mejorar la seguridad quirúrgica, limitando la morbilidad de la resección tumoral y también optimizando los resultados de la resección tumoral. El monitoreo intraoperatorio ha incorporado múltiples modalidades que incluyen las neuroimágenes, el monitoreo neurofisiológico y el monitoreo clínico funcional de la cirugía vigil. Las opciones de neuroimágenes disponibles incluyendo la técnica de neuronavegación por imágenes de resonancia magnética o tomografía computada cerebral, técnicas ópticas como la flurescencia tumoral, la radiología convencional, la tomografía y resonancia magnética intraoperatoria y la ecografía intraoperatoria 4. Este artículo tiene como objetivo revisar aspectos técnicos de la ecografía intraoperatoria, sus indicaciones tanto para cirugía neuro-oncológica intracerebral como espinal y también revisar sus limitaciones.
La ecografía intraoperatoria sigue teniendo un rol complementario a las excelentes imágenes obtenidas por la neuronavegación, y su uso está indicado para cirugía de todo tumor cerebral intra-axial supra e infratentorial y en cirugía de tumores intraespinal intradural. Las imágenes ecográficas son capaces de diferenciar tejido normal versus tejido patológico en un 80 a 88% de las veces y su uso aumenta la resección tumoral en un 55% 5–7, particularmente si el tumor tiene tejido heterogéneo con componentes quísticos. Además, la ecografía intraoperatoria permite visualizar mejor el acceso quirúrgico de la lesión y obtiene también un mapeo vascular, particularmente arterial, del tejido perilesional e intralesional, más importante para patología no tumoral como son las malformaciones vasculares cerebrales. Luego, posterior a la resección tumoral, es posible evaluar la presencia de posible tumor residual en el lecho quirúrgico.
También la ecografía intraoperatoria busca complementar las imágenes de neuronavegación cuya validez disminuye cuando ocurre un desplazamiento del tejido cerebral durante la resección tumoral, fenómeno conocido como “brain shift”. Esta limitación de la neuronavegación ocurre particularmente en tumores con una ubicación supratentorial y más aún si tienen un componente quístico 8. La ecografía intraoperatoria, al ser un estudio por imágenes obtenidas en tiempo real, se actualiza con cada nuevo control, entregando información anatómica precisa, no afectada por algún desplazamiento del tejido cerebral que pueda ocurrir durante la cirugía. Cada evaluación ecográfica debiera tomar solo minutos en ejecutar y por lo tanto, no debiera retrasar los tiempos quirúrgicos habituales. El hecho de detectar durante la cirugía un posible remanente tumoral puede significar un significativo ahorro de tiempo y costos para el paciente, evitando una posible re-intervención quirúrgica.
Por último, la ecografía intraoperatoria es una tecnología que tiene menores costos en comparación a otros estudios como la resonancia magnética intraoperatoria. El valor de una unidad de resonancia magnética intraoperatoria varía entre US$3 millones a US$7 millones dependiendo de las especificaciones del equipo y el valor de una unidad de tomografía computada intraoperatoria varía entre US$1.5 millones y US$3 millones también dependiendo de sus especificaciones técnica 9. El valor de una unidad de ecografía comúnmente utilizada en los pabellones varía entre US$25000 y US$55000 10. Además, esta tecnología es segura ya que no utiliza radiación inonizante y la incidencia de otros posibles tipos de complicaciones como infección o daño cerebral por compresión no es mayor que la misma intervención quirúrgica.
PRINCIPIOS GENERALES ECOGRÁFICOSPara poder generar imágenes ecográficas diagnósticas y efectuar su adecuada interpretación es imprescindible comprender los principios generales de la ecografía cerebral 11–14.
La ecografía genera una imagen diagnóstica utilizando la emisión y recepción de ondas de ultrasonido (US) que se reflejan en los tejidos blandos evaluados. Las ondas de US utiliza frecuencias superiores a las audibles por el oído humano, mayor a los 20000 ciclos/segundo o 20 kilohertzios (KHz). Las frecuencias que se utilizan comúnmente en radiología varían entre 2 y 60 millones de hertzios o Megahertzios (MHz). Estos ecos solo se propagan en tejidos blandos o líquidos. No hay propagación de ecos a través de aire, o estructuras que contengan calcio, metal, o materiales usualmente utilizados en cirugía como cotones, surgicel hemostático, o cualquier instrumento metálico o plástico.
Las imágenes se producen por la reflexión de las ondas de US que ocurren cuando éstas pasan de un tejido con una determinada densidad a uno de otra densidad o impedancia acústica. Cuando la diferencia de densidad de los tejidos es muy marcada, ésta bloquea el paso de las ondas de US como ocurre con el gas, hueso, u otro elemento como metal o plástico. Además, la mejor definición ecográfica se obtiene cuando las ondas de US inciden de forma perpendicular a las interfaces de los tejidos.
Las ondas de US son generadas en un dispositivo llamado transductor, el cual contiene uno o más cristales con propiedades piezoeléctricas. Esto ocurre cuando el cristal es expuesto a una corriente eléctrica alterna provocando que este vibre y emita un haz de US en una frecuencia característica. Al ser aplicado sobre una superficie de tejidos blandos, las ondas de US se propagan por los tejidos y estas se reflejan en forma de ecos que interactúan con los cristales del transductor produciendo una señal eléctrica que se transforma en punto de luz en el monitor. El porcentaje de haz de US que es reflejado se determina mediante a la diferencia de la impedancia acústica entre los dos tejidos. La propiedad del cristal de transformar energía eléctrica en un pulso de US y luego transformar el eco recepcionado nuevamente en señal eléctrica se denomina efecto piezoeléctrico.
Patrones ecográficos. La imagen ecográfica está formada por una matriz de elementos fotográficos llamados píxeles variando en brillo representados en escala de grises según la proporción de intensidad del eco. La intensidad de brillo de la imagen ecográfica está representada en una escala de gris y es denominada “ecogenicidad”.
Una imagen hiperecogénica se produce cuando ocurre una gran reflexión de ondas de US en tejidos de mayor densidad como un tumor hipercelular, o un foco de hemorragia. Un tumor hipercelular, como un tumor de alto grado histológico, tiene una representación alta ecogenicidad o hiperecogénica y un tumor menos celular como un tumor de bajo grado histológico, tiene una baja ecogenicidad o hipoecogénica. El edema cerebral tiene habitualmente una representación leve hiperecogénico difuso en comparación al parénquima cerebral. Una imagen de brillo máximo se produce por gas o hueso.
El parénquima cerebral tiene una representación de ecogenicidad intermedia, siendo posible diferenciar la sustancia gris y blanca.
Una imagen hipoecogénica se produce cuando hay una reflexión intermedia de ondas de US como por ejemplo puede ocurrir en un contenido líquido hemorrágico o con alto contenido de proteína o en lesiones sólida con baja celularidad.
Una imagen anecogénica se produce cuando no ocurre una reflexión de las ondas de US y hay una transmisión completa de estas. Este tejido produce una imagen de color negro y comúnmente representa líquidos como líquido cefalorraquídeo.
Es importante entender que los términos de “ecogenicidad” se utilizan solo en términos comparativos, es decir, un tejido puede ser hiper, hipo o isoecogénico en comparación a otro tejido.
ArtefactoLos artefactos ecográficos son frecuentes hallazgos observados durante un examen y son imágenes que no representan estructuras reales. Los artefactos más importantes son los siguientes:
- 1.
Sombra acústica. Se observa una anecogenicidad por detrás de una estructura con densidad marcadamente distinta como es gas, hueso, o un instrumento quirúrgico incluyendo un cotón o semejante. Éste bloquea las ondas de US. En el monitor se observa una línea hiperecogénica representando la superficie de la estructura reflectante y detrás una sombre anecogénica.
- 2.
Sombra lateral. Se observa una anecogenicidad lateral y distal a una estructura llena de líquido que se produce por un cambio de dirección de la onda de US que no produce ecos que vuelvan al transductor.
- 3.
Refuerzo posterior. Se observan una imagen hiperecogénica por detrás de una estructura líquida. Esto ocurre ya que en la estructura líquida no hay atenuación de las ondas de US en comparación a los tejidos blandos adyacentes. Este es un común hallazgo que se observa en la evaluación del lecho quirúrgico que está lleno de suero fisiológico y no debe ser confundido por la presencia de tumor residual.
- 4.
Reverberación. Se observan líneas hiperecogénicas paralelas que van disminuyendo en intensidad a medida que se alejan del transductor. Se producen en interfaces de tejidos blandos y gas.
A medida que las ondas de US se propagan por los tejidos, la energía ultrasónica pierde potencia y su intensidad disminuye progresivamente por un fenómeno que se llama atenuación secundaria a la absorción y dispersión de los ecos. La imagen se mejora adecuando la ganancia o la energía de las ondas de US para contra-restar el fenómeno de atenuación y dispersión de las ondas de US. Esto también se corrige adecuando la ganancia de los ecos según la profundidad del tejido de interés en la evaluación ecográfica.
Ventana ecográficaLa ventana ecográfica es un término que se utiliza cuando es posible obtener satisfactorias imágenes ecográficas a través de estructuras de tejidos blandos. Para obtener esto se requiere remover todos los elementos quirúrgicos como surgicel, cotones, lauchas entre otras cosas, así como también cualquier componente de sangre que pueda haber en el lecho quirúrgico. Además, normalmente se requiere llenar con suero fisiológico la superficie cerebral o en casos de control post-resección hay que llenar el lecho quirúrgico de similar forma ya que la presencia de aire también limita la visualización ecográfica del tejido.
Frecuencia del transductorPara explorar adecuadamente un tejido es necesario elegir un adecuado tipo transductor y su frecuencia dependiendo del volumen del tejido. Generalmente las frecuencias más utilizadas son 2MHz para tejidos muy grandes o cuando se requiere cruzar una estructura ósea, como es el caso en una ecografía transcraneal. La frecuencia de 5MHz–7.5MHz se utiliza para volúmenes de tejido medianos entre 2 a 8cm de diámetro. Una frecuencia ya más alta como 10MHz se utiliza para evaluar estructuras más superficiales.
TIPOS DE TRANSDUCTOR- A.
Lineales: Tienen los cristales que emiten US en línea por lo tanto producen una imagen rectangular. Tienen la ventaja que producen una imagen ampliada de un campo cercano. Las desventajas es que requieren una gran área de contacto para obtener la imagen.
- B.
Curvos lineales: Son una variante del transductor lineal. También tienen los cristales en línea sobre una superficie convexa, por lo cual es más sencillo obtener una superficie de contacto.
- C.
Sectorial: Emiten US de forma divergente, obteniendo una imagen en forma de abanico. La ventaja es que la superficie de contacto es mínima y la desventaja es que el campo evaluado es reducido.
EcografíaDoppler. El Doppler es un tipo de ecografía donde se crea una imagen a color según como las ondas de US se alteran cuando se encuentran con un objeto en movimiento. El Doppler color expresa la información relacionada con la velocidad y la dirección del flujo. Por convención el color rojo se refiere a flujo en dirección al transductor y el color azul un flujo que se aleja del transductor. Además, se puede codificar la velocidad del flujo de forma espectral diferenciando un flujo de velocidad constante como de origen venoso versus un flujo pulsátil donde se distingue una curva con pico sistólico y otro diastólico como de origen arterial.
MÉTODO- 1.
El procedimiento de la ecografía intraoperatoria
- •
La metodología de la ecografía intraoperatoria requiere de una curva de aprendizaje no demasiado larga.
- •
Se requiere primero que el radiólogo revise todas las neuroimágenes del paciente previo a la intervención y que se analicen los requerimientos del neurocirujano caso a caso.
- •
Se requiere también tener un conocimiento de los principios ecográfico básicos para optimizar las imágenes obtenidas y poder interpretar éstas de forma adecuada diferenciando ecos reales y los artefactos ya descritos.
- •
Es absolutamente esencial seguir una estricta técnica estéril. El transductor y su cable conector deben permanecer en todo momento en condición estéril. Esto se logra colocando una bolsa plástica estéril sobre el transductor y su cable, idealmente de por lo menos 3 metros de largo. Previamente se ha colocado gel estéril sobre la cabeza del transductor antes de colocar la cubierta plástica. Esta última se fija a la cabeza del transductor por medio de un elástico.
- •
Seleccionar el tipo de transductor más adecuado caso a caso, considerando las circunstancias de la craneotomía y del lecho quirúrgico y la ubicación del tumor. Hay que orientarse anatómicamente con la imagen ecográfica, ubicando con seguridad la correcta lateralización de la imagen, ubicando el marcador del transductor en relación a la imagen que aparece en el monitor.
- •
También hay que ubicarse en relación al tipo de plano, ya sea axial o coronal reconociendo las estructuras anatómicas correspondientes, tomando en cuenta la posición del paciente. A veces puede tomar algunos minutos lograr esta orientación radiológica y solo cuando se han observado los hallazgos patológicos en una estructura, se puede proceder al siguiente paso.
- •
Siempre se obtiene una completa evaluación de todo el lecho quirúrgico, particularmente cuando se efectúa un control posterior a la resección. El lecho quirúrgico normalmente tiene un fino margen hiperecogénico en todo su entorno. Esto se tiene que diferenciar de una lesión nodular hiperecográfica que puede sugerir un remanente tumoral. También es necesario distinguir algún contenido hemático que frecuentemente está presente en el fondo del lecho quirúrgico. Éste tiene una apariencia hiperecogénica con presencia de un nivel líquido.
- •
Se requiere una fluida comunicación entre el radiólogo y el neurocirujano que pueda trasmitir los resultados de forma correcta, precisa y en el momento adecuado. Algunas veces es necesario que el radiólogo solicite al neurocirujano marcar con algún instrumento alguna área de interés, identificando así el marcador junto a la lesión en duda.
- •
- 2.
Optimizar la imagen obtenida
Para visualizar lesiones cerebrales superficiales se requiere utilizar un transductor de alta frecuencia, ya sea uno lineal o curvo lineal. También se puede utilizar un transductor con penetración intermedia usando adicionalmente una pequeña bolsa con suero que permita una buena ventana acústica y aleje el transductor de la superficie cerebral. Hay que ajustar la ganancia para que el parénquima cerebral normal tenga un nivel de ecogenicidad intermedia habitual. Además, se puede ajustar la profundidad de foco y números de focos para que cubran adecuadamente el segmento de tejido siendo evaluado.
Para visualizar lesiones residuales dentro del lecho quirúrgico se puede utilizar nuevamente una pequeña bolsa con suero que se ubica dentro del lecho quirúrgico y se efectúa la ecografía a través de esta. Es importante evaluar todas las paredes de la cavidad, tanto los márgenes profundos como superficiales. El fondo del lecho quirúrgico tiene una particular dificultad por la presencia del artefacto de “refuerzo posterior” hiperecogénico. Este artefacto se puede minimizar efectuando también la ecografía con un acceso transcortical inmediatamente adyacente al lecho quirúrgico, angulando el transductor para visualizar el fondo del lecho quirúrgico a través del parénquima cerebral y a través del lecho quirúrgico mismo. También hay que poner particular atención en la evaluación de posible remanente tumoral en los aspectos más superficiales del lecho quirúrgico que sólo se puede pesquisar con ecografía transparenquimatosa adyacente al lecho.
- 3.
Primer control ecográfico - caracterización de la lesión
Luego de la craneotomía es más aconsejable efectuar el primer control ecográfico de forma transdural versus transcortical transcerebral que sin duda da una imagen de mayor definición, pero, dado que requiere colocación del transductor directamente sobre el cerebro, tiene riesgos innecesarios. En esta evaluación se busca la localización de la lesión, la profundidad desde la corteza cerebral, la orientación de abordaje, si la lesión es sólida o sólida/quística, la ecogenicidad de la lesión y si sus márgenes están bien definidos. También se evalúa si hay edema perilesional y cómo se distingue éste en comparación a la lesión tumoral (Figura 1 y Figura 2). Además se evalúa por medio de la función de doppler a color si el tumor está relacionado a significativas estructuras vasculares perilesional o intralesional.
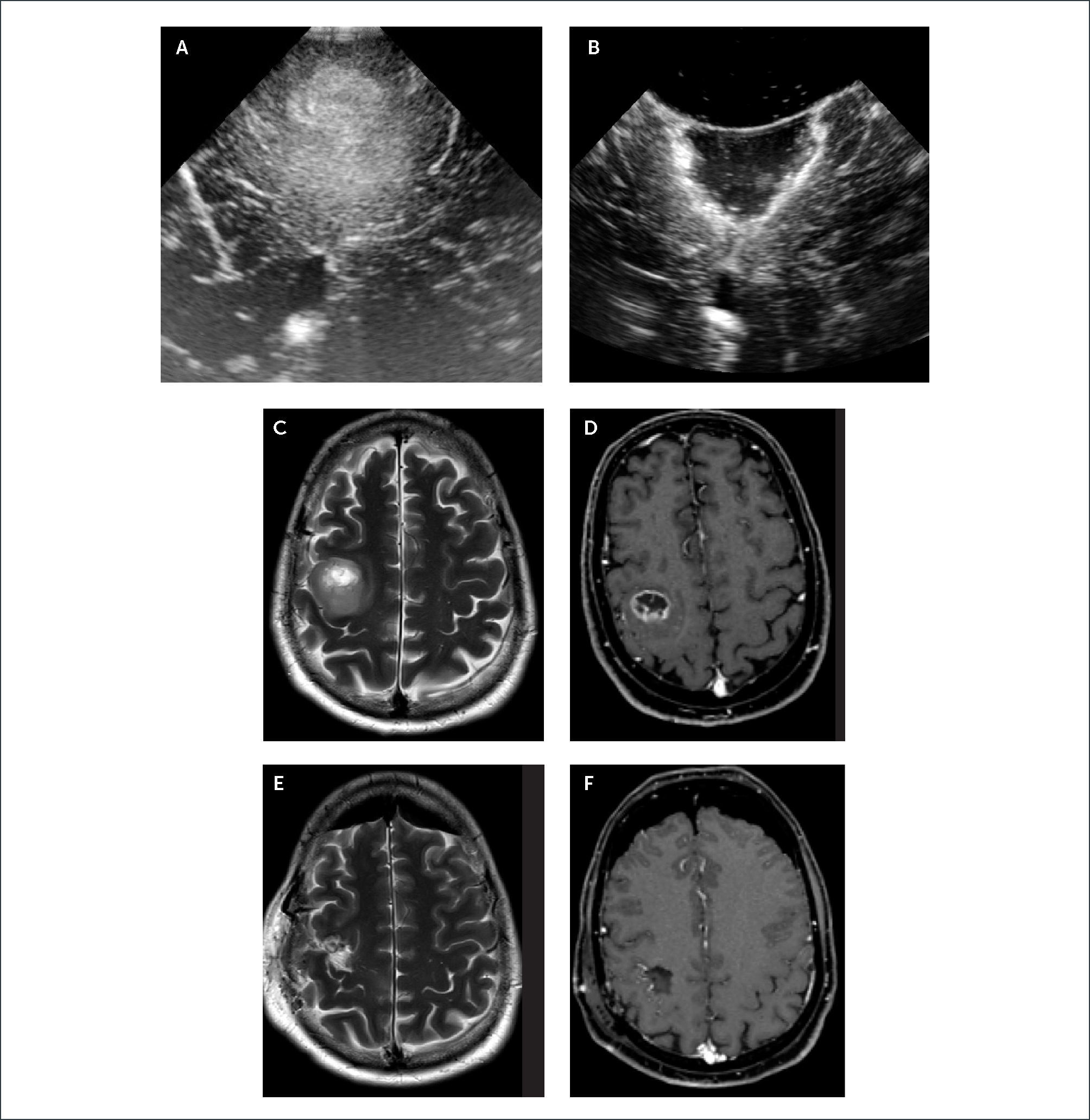
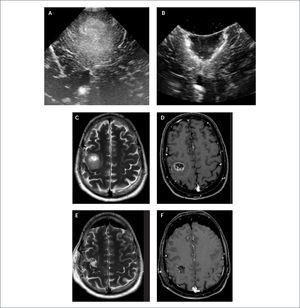
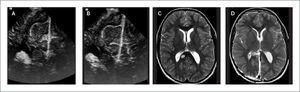
FIGURA 1.PACIENTE CON UN GLIOMA FRONTAL DERECHO. IMAGEN INICIAL DE ECOGRAFÍA CEREBRAL INTRA-OPERATORIA
(A) En el plano coronal muestra una lesión intra-axial hiperecogénica heterogénea que se diferencia perfectamente de la ecotextura normal más hipogénica del cerebro normal que lo rodea. Se pueden observar también los cuernos frontales de los ventrículos laterales. En imagen post-resección (B) hay una resección radical del tumor sin aparente lesión residual nodular hiperecogénica. Esto se puede corroborar bien cuando se observan las imágenes de Resonancia Magnética cerebral pre-operatoria, en secuencia T2 (C), y en secuencia T1 post-contraste (D) y similar imágenes post-operatorias (E) y (F).
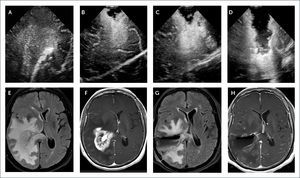
(0.35MB).FIGURA 2.PACIENTE CON UN GLIOMA DE ALTO GRADO PARIETAL DERECHO PROFUNDO QUE SE EXTIENDE AL ESPLENEO DEL CUERPO CALLOSO. IMAGEN INICIAL DE ECOGRAFÍA CEREBRAL INTRA-OPERATORIA
(A) En plano coronal muestra una lesión intra-axial hiperecogénica heterogénea con una ubicación profunda y edema perilesional. En imágenes progresivas post-resección (B), (C) y (D) hay una resección progresiva del tumor, observándose aún hiperecogenicidad en las paredes del lecho quirúrgico sugerente de tumor residual. Imágenes de Resonancia Magnética cerebral en secuencia FLAIR pre-resección (E), y post-contraste pre-resección (f) muestra el tumor y el edema perilesional. En imágenes post-resección (G) y (H) se observa una resección radical por pequeños focos de refuerzo alrededor del lecho quirúrgico.
(0.34MB). - 4.
Segundo control ecográfico - evaluación de resección tumoral
Es importante maximizar el grado de resección tumoral considerando que la magnitud de resección tumoral es significativo para el pronóstico del paciente. Esta segunda ecografía puede ser muchas veces más desafiante que la primera, ya que a veces es difícil obtener una satisfactoria ventana ecográfica dentro del lecho quirúrgico. Hay que remover todo elemento de hemostasia como cotones y surgicel que pudiera dar una falsa imagen hiperecográfica. También hay asegurarse que no haya hemorragia en el lecho quirúrgica, que puede confundirse y dar una imagen pseudo-tumoral hiperecogénica (Figura 3). Además, hay que cuidar de remover con suero fisiológico la presencia de aire en el lecho quirúrgico que también pudiera perjudicar una adecuada imagen ecográfica.
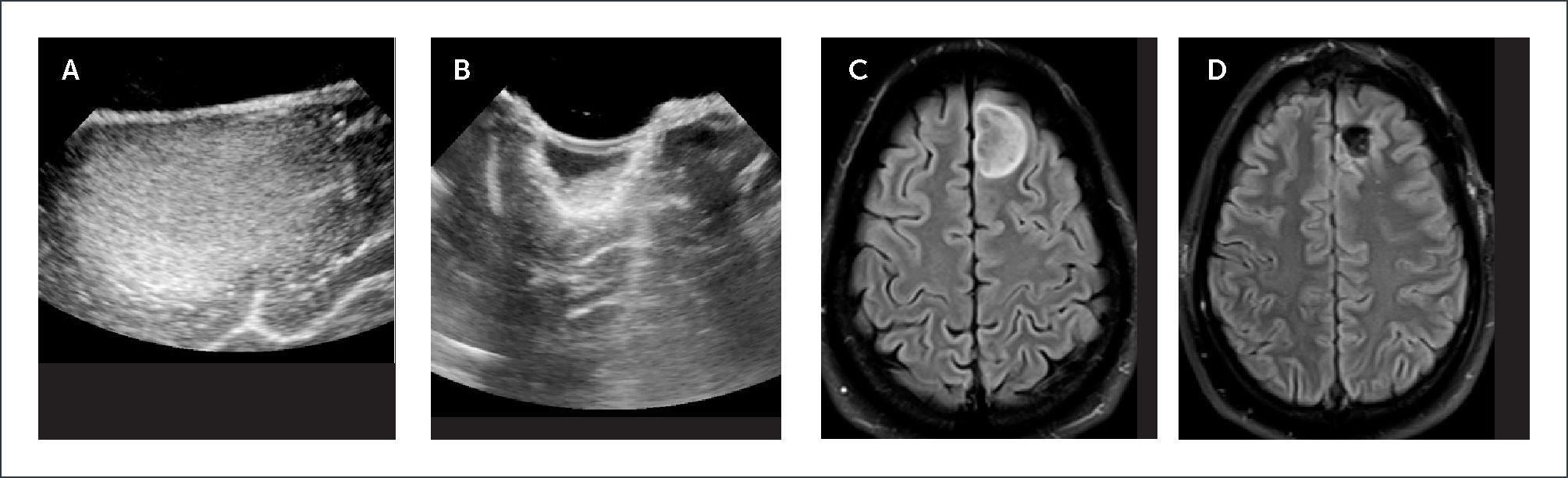
PACIENTE CON UN GLIOMA SUBCORTICAL FRONTAL IZQUIERDO. IMAGEN INICIAL ECOGRAFÍA CEREBRAL INTRAOPERATORIA
(A) Muestra una lesión superficial intra-axial hiperecogénica. Para obtener la imagen post-resección (B) requiere medidas para llenar con suero esteril el lecho quirúrgico. Se aprecia una hiperecogénica con un nivel sugerente de colección de hemorragia en el lecho quirúrgico y no una lesión de tumor residual. Imágenes de Resonancia Magnética cerebral en secuencia FLAIR pre-resección (C), y post-resección (D).
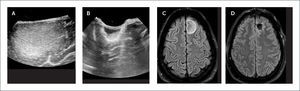
Para lesiones espinales se efectúa el primer control ecográfico inmediatamente posterior a la laminectomía y antes de la durotomía para certificar que el tumor está completamente dentro del lecho quirúrgico (Figura 4). Para lesiones intradurales intramedulares también se efectúa comúnmente un control posterior a la resección tumoral, así como en lesiones cerebrales, con el principal propósito de identificar tumor residual que se visualiza de forma similar a las lesiones cerebrales.
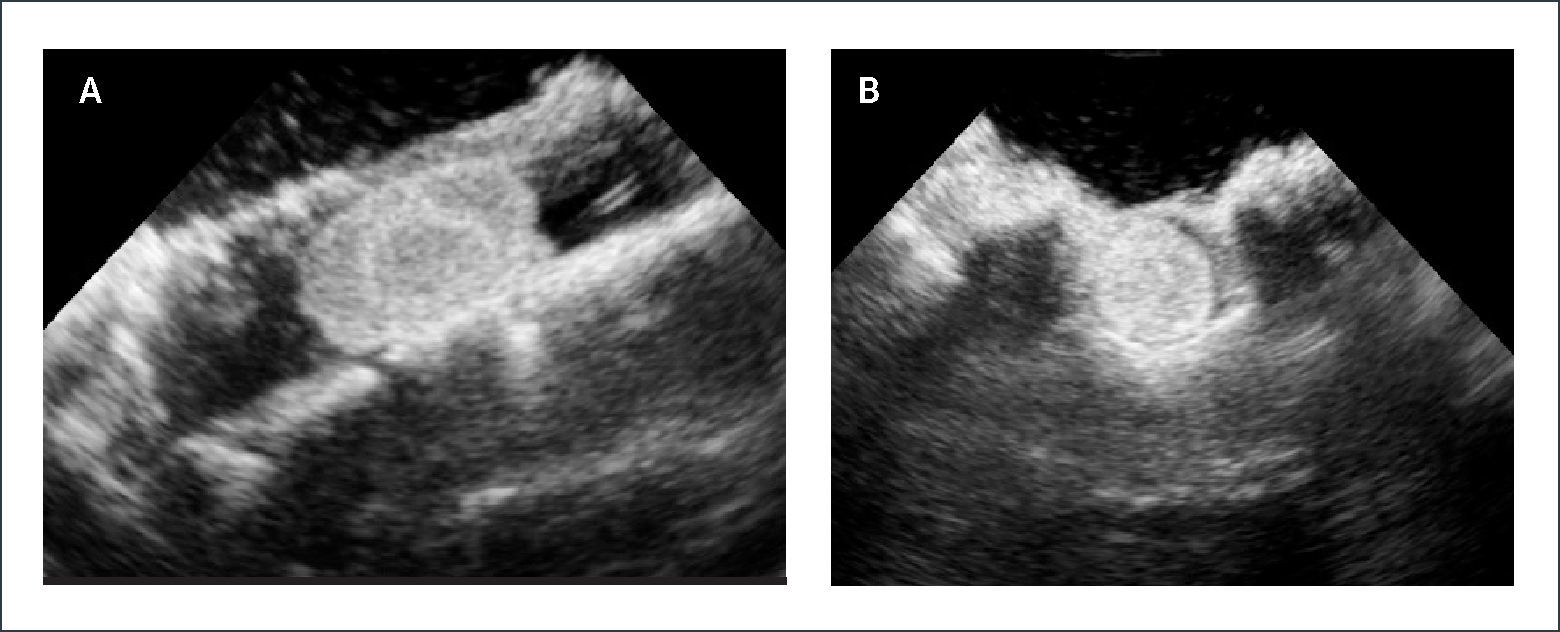
PACIENTE CON UN TUMOR INTRAESPINAL LUMBAR POST LAMINECTOMÍAS-CONTROL ECOGRÁFICO INTRAOPERATORIO
Plano sagital.
Imagen ecográfica intra-operatoria en plano sagital. (A) muestra una lesión hiperecogénica intradural extramedular completamente visualizada dentro de laminectomías. Imagen en plano axial. (B) muestra la misma lesión en relación a las racies de cola de caballo.
Las principales limitaciones de la ecografía intraoperatoria están relacionadas a la curva de aprendizaje del operador. Se requiere tiempo y experiencia para ambientarse al pabellón, aprender los tiempos de cada cirugía como también para desarrollar la facilidad para obtener imágenes de buena calidad e interpretarlas adecuadamente. En particular, a veces es difícil obtener una satisfactoria ventana ecográfica, especialmente posterior a una gran resección tumoral o en lesiones tumorales muy profundas como en lesiones ubicadas en el tronco cerebral y en la cisterna supraselar. También se dificulta a veces distinguir los contornos de una lesión tumoral de algo grado histológico versus edema perilesional que frecuentemente acompañan estas lesiones ya que ambas tienen una apariencia hiperecogénico (Figura 2). Lesiones tumorales de bajo grado histológico a veces tienen un aspecto poco definido ya que tiene una ecogenicidad intermedia, similar a la del parénquima cerebral (Figura 5).
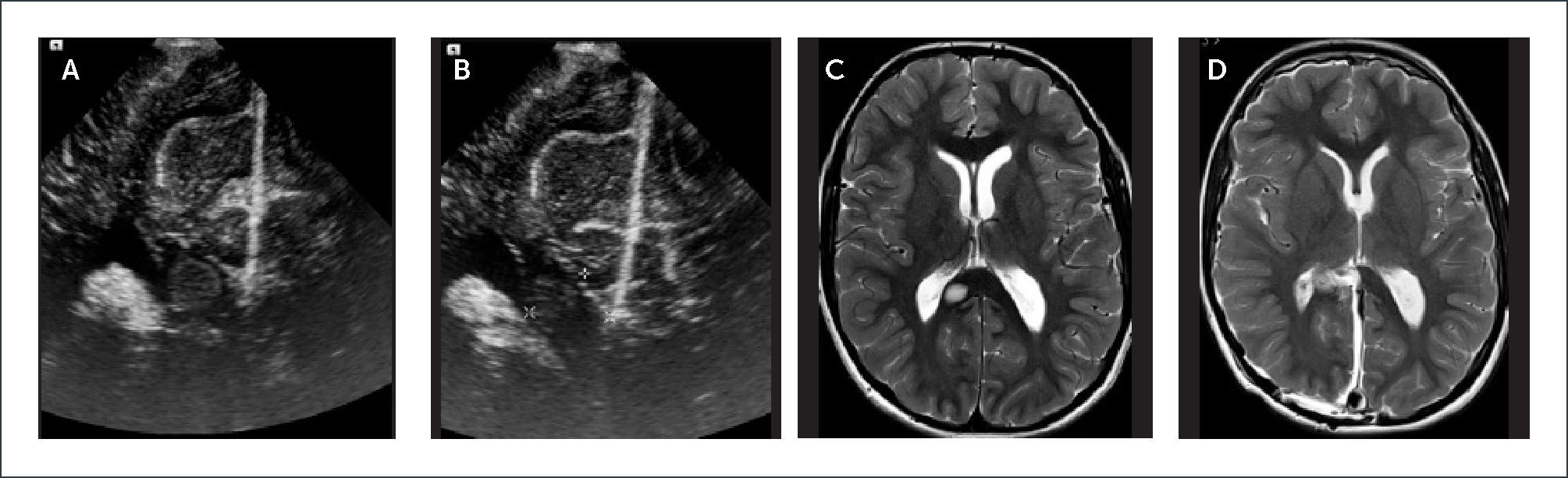
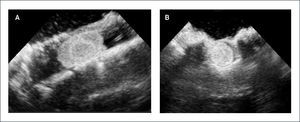
PACIENTE CON UN TUMOR FOCAL PEQUEÑO DE BAJO GRADO HISTOLÓGICO UBICADO EN EL ESPLENIO DEL CUERPO CALLOSO. IMÁGENES ECOGRÁFICAS INTRAOPERATORIAS
Plano coronal (A) y (B) muestran una lesión tenuemente hiperecogénica, bien circunscrita, ubicada en el esplenio del cuerpo calloso. Se toman las medidas pertinentes de tamaño y ubicación de la lesión. Imágenes de Resonancia Magnética cerebral, en secuencia T2, en plano axial, muestran la lesión focal ya descrita en controles pre y post operatorio respectivamente (C) y (D).
La ecografía cerebral intraoperatoria es una importante herramienta utilizada por los neurocirujanos durante la reseción tumoral. Requiere de una buena comprensión de los fundamentos de la ecografía y una adecuada curva de aprendizaje para obtener e interpretar con precisión las imágenes. Su principal ventaja sobre la neuronavegación es que esta no está afectada por el fenómeno de“brain shift” que habitualmente occure durante la resección tumoral, ya que las imágenes de la ecografía se van actualizando durante la cirugía. Sus principales limitaciones tienen que ver con la adecuada caracterización de lesiones con ubicación profunda, tumores de bajo grado histológico que pueden tener una ecogenicidad intermedia no bien distinguible del parénquima cerebral normal y para lesiones de alto grado histológico versus prominente edema perilesional.
El autor declara no tener conflictos de interés, en relación a este artículo.