Las metástasis cerebrales son los tumores cerebrales más frecuentes y son un desafío médico. Los tumores tienen una capacidad diferente de metastatizarse en el cerebro y deben tener la capacidad de penetrar la barrera hematoencefálica, interactuar con las células residentes y sobrevivir. La clínica es variada dependiendo del sitio afectado, así como los riesgos asociados de convulsión.
Genómicamente se ha documentado cada vez más que las metástasis cerebrales cambian la expresión de sus mutaciones.
Por lo tanto, la elección del tratamiento es compleja, considerando la primaria, el número de metástasis y los sitios afectados. La radioterapia ha sido durante mucho tiempo la elección de los pacientes que no son candidatos a la cirugía, y se espera que los avances reduzcan especialmente la toxicidad cognitiva. El conocimiento genómico de las metástasis cerebrales y la presencia de terapias dirigidas e inmunoterapias modificadas que penetran la barrera hematoencefálica han sido clave, se espera que en el futuro se realicen más estudios de combinaciones de tratamientos de radioterapia con terapias de inmunoterapia y dirigidas.
Brain metastases are the most frequent brain tumors and are a medical challenge. Tumors have a different ability to metastasize to the brain and must have the ability to penetrate the blood-brain barrier, interact with resident cells, and survive. The clinic is varied depending on the site affected, as well as the associated risks of seizure.Genomically it has been increasingly documented that brain metastases change the expression of their mutations.
Thus, the choice of treatment is complex, considering the primary, the number of metastases and affected sites. Radiation therapy has long been the choice for patients who are not candidates for surgery, and advances are expected to reduce especially cognitive toxicity. The genomic knowledge of metastasis to the brain and the presence of target therapies and modified immunotherapies penetrating the blood-brain barrier have been key, it is hoped in the future to have more studies of combinations of radiotherapy treatments with target and immunotherapy therapies.
Las metástasis cerebrales son los tumores cerebrales más frecuentes, correspondiendo cerca del 90% del total de éstos. Se estima que entre el 10 y 40% de los pacientes con cáncer presenta metástasis cerebrales 1, su incidencia va en aumento dada la mayor sobrevida media de los pacientes con las terapias actuales.
CÁNCER PRIMARIOSi bien casi cualquier tumor puede potencialmente causar metástasis cerebrales, el cáncer pulmonar el tumor primario más frecuente 39-56% del total de los casos, de los cuales la mayoría son cáncer pulmonar de células no pequeñas, NSCLC), seguido por mama (13-19%), melanoma (6-11%), tumores del tracto gastrointestinal (6-9%), renal (2-6%) y otro/desconocido (4-12%) 1–3. Estos porcentajes coinciden con lo publicado a nivel nacional 4. Entre el 60 y 80% de los pacientes que presentan una metástasis cerebral tendrán al diagnóstico otra metástasis sistémica sincrónica.
FISIOPATOLOGÍALas metástasis cerebrales ocurren en su gran mayoría por diseminación hematógena, siendo la invasión por contigüidad menos común. Es interesante observar que la distribución de las metástasis cerebrales es proporcional al flujo sanguíneo de la zona en cuestión, ubicándose 80% de las lesiones en cerebro, 15% en el cerebelo y 5% en el tronco cerebral 5.
El primer paso para que pueda ocurrir diseminación hematógena es la invasión de la pared arterial a nivel del tumor primario, permitiendo de esta forma que algunas células neoplásicas se desprendan y entren al torrente sanguíneo. Luego esta célula debe ser capaz de adherirse a la vasculatura cerebral; este proceso depende de una serie de mediadores 6. Una vez adherido a la pared vascular, las células neoplásicas deben cruzar la barrera hematoencefálica, la cual está compuesta de un endotelio no fenestrado con uniones intercelulares de oclusión (tight junctions), que recubre la microvasculatura del cerebro y limita la entrada de macromoléculas y células al parénquima encefálico 7. La barrera hematoencefálica y la ausencia de un sistema linfático le confieren al cerebro protección significativa a la entrada de muchas drogas y microorganismos, pero eventualmente no es capaz de impedir la entrada de las células neoplásicas 8.
Los mecanismos utilizados por las células neoplásicas para atravesar la barrera hematoencefálica son motivo de estudio, pero ya se ha demostrado que existen al menos dos mecanismos: atravesando de manera para-celular (entre las células de la barrera) y trans-celular, causando la muerte directa de células de la barrera 9. En el caso de la entrada para-celular, las células neoplásicas deben destruir las uniones de oclusión existentes entre las células del endotelio; para esto deben tener la capacidad de expresar proteasas y mediadores inflamatorios 6,10,11.
Una vez que se ha atravesado la barrera hematoencefálica, las células neoplásicas pasan a la microvasculatura del cerebro y desde ahí se extravasan al tejido. La supervivencia y proliferación desde ese momento en adelante es altamente dependiente de la capacidad de mantener un adecuado suministro de oxígeno y nutrientes, lo cual explica que las células neoplásicas se mantienen muy próximas a la vasculatura, proliferando inicialmente a lo largo de las paredes vasculares 12, lo cual lleva a remodelación y cooptación de la vasculatura preexistente 13. Este proceso ha sido recientemente estudiado en modelos animales de adenocarcinoma pulmonar y de mama, observando que las células metastásicas cooptan a los vasos del cerebro mediante la expresión de la proteína neuroserpina, que bloquea la generación de plasmina, la cual protege al cerebro de metástasis mediante la promoción de la apoptosis de las células neoplásicas e inhibe su propagación a lo largo de la vasculatura 14. También algunos tumores son capaces de gatillar la formación de nuevos vasos sanguíneos (angiogénesis) mediada principalmente por VEGF-A, el cual es expresado de forma constitutiva por algunas células neoplásicas, como por ejemplo las del adenocarcinoma pulmonar.
Es importante notar que, a nivel genómico, las metástasis pueden tener diferencias significativas con el tumor primario. Por ejemplo, un reporte reciente de Brastianos et al. 15 comparando las mutaciones presentes en pacientes con adenocarcinoma pulmonar y metástasis cerebrales asociadas muestra que estas son ricas en mutaciones que involucran las vías de quinasas dependientes de ciclinas y el eje PI3K/AKT/mTOR. Avances en la genómica tendrán impacto significativo sobre el desarrollo de nuevas terapias para el manejo de las metástasis cerebrales.
MANIFESTACIONES CLÍNICASCada día es más frecuente que el diagnóstico se establezca en pacientes en ausencia de síntomas neurológicos, como hallazgo dentro del estudio de etapificación o diseminación, mediante el uso de técnicas de imágenes.
En los casos que existen manifestaciones clínicas, éstas van a depender de la localización, tamaño y edema perilesional que generen las metástasis. Aquellas de gran tamaño y edema generalmente se manifiestan con cefalea como síntoma principal, debido a la hipertensión endocraneana que se produce. Algo similar ocurre en los casos donde la metástasis obstruye el flujo del líquido cefalorraquídeo, con la consiguiente hidrocefalia asociada. En el caso de metástasis ubicadas cercanas a la corteza; las crisis convulsivas y fenómenos ictales son manifestaciones frecuentes. Cuando el tumor se localiza en una zona funcional específica dará origen a las alteraciones correspondientes de ella: paresia, afasia, diplopía, entre otras.
DIAGNÓSTICO POR IMÁGENESHabitualmente se utiliza la tomografía computada sin contraste como método de screening dada su amplia disponibilidad, rapidez, bajo costo y la capacidad de identificar complicaciones como la hemorragia cerebral. Sin embargo, si existe una alta sospecha clínica de la presencia de metástasis cerebrales, la resonancia magnética contrastada con gadolinio es lo recomendable como estudio de primera línea 16,17.
Un 11% de las lesiones cerebrales identificadas como hallazgo en TAC de cerebro en pacientes con cáncer no corresponden a metástasis cerebrales; por lo que se deben considerar los diagnósticos diferenciales: absceso, granuloma, necrosis por radiación y patologías desmielinizantes aguda, y en pacientes con inmunosuprimidos como el VIH considerar linfomas y patología infecciosa como toxoplasma entre otras. La RM y el PET son útiles para diferenciar estas lesiones.
PRONÓSTICOUna vez establecido el diagnóstico, el pronóstico es sombrío, con sobrevida de 1-2 meses 18; si no se realiza ninguna intervención y 6-12 meses con el apoyo de las terapias disponibles 19. A la mortalidad de las metástasis cerebrales, sigue al deterioro severo de la calidad de vida y los síntomas pueden incluir dolores de cabeza, convulsiones, disfunción cognitiva o motora y coma 20,21.
La sobrevida se ve influenciada por múltiples factores, de los cuales se han identificado como de buen pronóstico: edad <65 años, control del tumor primario, ausencia de compromiso extra craneal, Karnofsky Performance Status (KPS) elevado, histología favorable del tumor, buena respuesta a tratamiento esteroidal y ausencia de sintomatología neurológica 22. El peso de éstos y otros factores es distinto para cada tipo de cáncer, por ejemplo, para cáncer de mama, el subtipo de tumor basado en el status de receptores HER2, estrógeno y progesterona, es un factor pronóstico para sobrevida global 23; y en el caso del cáncer pulmonar de células no pequeñas, la mutación de EGFR y translocación EML4-ALK se ha indicado que representan genotipos más radiosensibles, mientras que aquellos con mutación KRAS logran peor control de la enfermedad local 24. Como otra modalidad de valoración pronóstica, Sperduto et al. 25 en 2008, propusieron la Evaluación Pronóstica Graduada (GPA), determinada mediante el análisis de los resultados de RTOG 9508. Los factores que incluyen son: edad, KPS, presencia o ausencia de metástasis extracraneales, y el número de lesiones cerebrales.
Independientemente del sistema de pronóstico utilizado, se reserva las modalidades de tratamiento más agresivas para pacientes más jóvenes y en buenas condiciones generales, especialmente aquellos con lesiones cerebrales únicas. Estos pacientes, con altas puntuaciones de GPA, pueden sobrevivir de 1 a 2 años dependiendo de la malignidad primaria y de las terapias sistémicas disponibles. Bajo DS-GPA puntuaciones confieren una esperanza de vida de 3 meses, independientemente de la histología y puede sugerir que la terapia más conservadora está indicada.
MANEJODentro del manejo general, si existen síntomas como cefalea debe realizarse estudio de imágenes para descartar complicaciones que requieran intervención quirúrgica (hidrocefalia, hemorragia intracraneal). El edema cerebral también es frecuente en estos pacientes, su mecanismo es principalmente vasogénico y puede causar deterioro cognitivo y déficits motores o sensitivos; el tratamiento de elección en estos casos es dexametasona, dado su escaso efecto mineralocorticoide. Otro elemento importante de manejar son las convulsiones, que afectan a un 30-40% de los pacientes con metástasis cerebrales. Los anticonvulsivantes se reservan para pacientes que han presentado crisis clínicas, no se recomienda el uso profiláctico; los fármacos comúnmente utilizados son fenitoina, ácido valproico y levetiracetam.
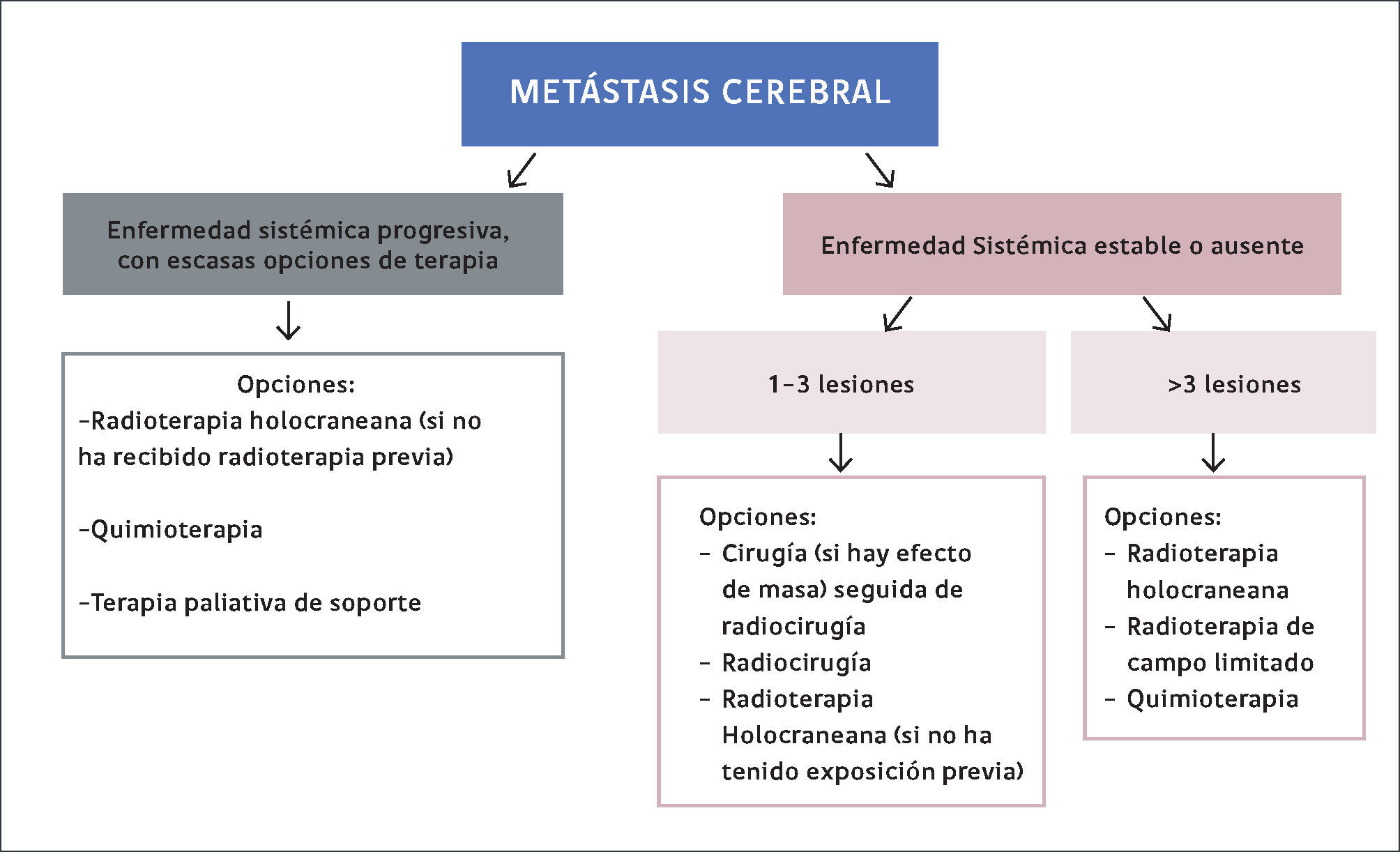
En cuanto al tratamiento específico de las metástasis cerebrales, las opciones actualmente disponibles incluyen la resección quirúrgica, radioterapia holocraneana, radiocirugía estereotáxica, y quimioterapia. Una recomendación simplificada del manejo se puede ver en figura 1.
- a.
Resección quirúrgica
La resección es una alternativa con diversos beneficios: remueve el efecto de masa, elimina la fuente de edema perifocal, y además ha demostrado beneficios en sobrevida global en dos estudios prospectivos comparando resección de metástasis única seguida de radioterapia holocraneana versus radioterapia holocraneana por sí sola 26,27. La evidencia en casos de lesiones múltiples no es tan robusta, pero existe un estudio retrospectivo que sugiere que pacientes con lesiones múltiples (en su mayoría con dos lesiones) tienen mayor sobrevida si son sometidos a resección que aquellos que no 28. Además de la limitante de la cantidad de lesiones, existen otros factores que pueden determinar que el paciente no sea candidato a cirugía, como localización del tumor y condición clínica del paciente.
- b.
Radioterapia Holocraneana
La radioterapia holocraneana históricamente ha sido considerada el tratamiento de elección cuando la carga tumoral es elevada 26,29. También ha demostrado utilidad como adyuvante al tratamiento quirúrgico, disminuyendo de forma significativa la incidencia de recurrencias después de una resección. Los efectos secundarios más frecuentes son alopecia, fatiga cefalea, eritema cutáneo y en el largo plazo puede asociarse a pérdidas de memoria y leucoencefalopatía. Las alteraciones cognitivas secundarias a esta terapia son leves a moderadas, pero son las más preocupantes para la mayoría de los pacientes y existe un intenso debate respecto al real costo/beneficio y cuando estaría indicado su uso en el manejo de las metástasis cerebrales. Los avances en los métodos utilizados para suministrar radiación han permitido mejores resultados y menor toxicidad neurocognitiva en ciertas neoplasias malignas 30,31. Se ha reportado que el uso de memantina ayuda retrasar y disminuir los efectos cognitivos mencionados 32. Se cree que los efectos neurocognitivos están en relación a la radiación en giro dentado hipocampal, de manera que hoy se busca analizar la efectividad de radioterapia modulada con reducción de dosis en hipocampo 30.
- c.
Radiocirugía Estereostáctica
Este procedimiento involucra la entrega de una elevada cantidad de radiación de manera focal al tumor, habitualmente en una sola fracción, disminuyendo los efectos deletéreos potenciales de la radiación 33. Es un tratamiento ambulatorio, no requiere anestesia general y ha ido creciendo la frecuencia con la que se utiliza en el manejo de las metástasis cerebrales. Su eficacia fue evaluada en múltiples estudios retrospectivos y posteriormente un estudio prospectivo (RTOG 9508), comparó radioterapia holocraneana+radiocirugía estereostáctica versus radioterapia holocraneana por sí sola en pacientes con 1-3 lesiones y KPS >70. Mostró mejor sobrevida y menor recurrencia en aquellos pacientes con 1 lesión y mejor control local, pero sin diferencia estadísticamente significativa en sobrevida en aquellos pacientes con 2 o 3 lesiones 34 y así como con menor deterioro cognitivo que las terapias de radiación holocraneana tradicional 35.
- d.
Quimioterapia
Las metástasis cerebrales son de manera casi universal- refractarias a la quimioterapia, por lo que, clásicamente sólo se ha utilizado como terapia de rescate o dentro del esquema de tratamiento de metástasis sistémicas que crecen de forma sincrónica con las metástasis cerebrales 36,37. Sin embargo, la integración de nuevas alternativas terapéuticas como los agentes target y los inhibidores de puntos de control inmunitario han intensificado la investigación en esta área.
- e.
AgentesTarget
Una clase de terapias que está revolucionando el tratamiento del cáncer es la de las terapias target que consisten en inhibidores moleculares y anticuerpos monoclonales, en vías de crecimiento, proliferación y apoptosis.
Algunos tumores primarios son más sensibles a agentes target. NSCLC con frecuencia expresa mutaciones de EGFR 38 y reorganizaciones de ALK 39, melanoma frecuentemente se presenta con mutaciones BRAF V600 40 y cáncer de mama puede ser impulsado por HER2 41.
Los agentes target pueden combinarse con la radioterapia de dos maneras con ventajas en cada uno. Con radioterapia holocranea aprovecha las propiedades radiosensibilizantes de un agente dado. Existe evidencia de que combinar radioterapia holocraneana con agentes target en el manejo de metástasis cerebrales puede ser bien tolerado y logra mejor control de enfermedad. Específicamente se ha estudiado el uso de inhibidores de EGFR e inhibidores de tirosina quinasa con resultados promisorios 42–44, pero estos estudios son en su mayoría Fase II, con escasa cantidad de pacientes, y sus resultados deben ser confirmados en estudios de mayor escala.
- f.
Inhibidores de Puntos de Control Inmunitario
La inmunidad de las células T puede manipularse por vacunas tumorales o mediante inmunoterapia adoptiva con células T inmunes, por ejemplo, el antígeno citotóxico asociado a linfocitos T 4 (CTLA-4), o la acción anti PDL-1, evitando la señal de muerte de los linfocitos, aumentando su sobrevida.
Su utilización en pacientes con metástasis cerebrales hasta el momento sólo ha sido reportada en estudios retrospectivos, lo cuales muestran resultados prometedores con ipilimumab (anti-CTLA-4) 45, nivolumab (anti-PD1) 46. Existen estudios prospectivos en curso que debiesen dar cuenta de la real utilidad de estas terapias en los próximos años.
La mayoría de los estudios en curso implican el uso de terapias dirigidas en combinación con radioterapia en especial con bloqueo de control inmunológico. Estas terapias pueden actuar tanto como sensibilizadores de radiación contra células tumorales como radioprotectores para células normales para aumentar el índice terapéutico de radiación 33. Algunos pueden reducir el porcentaje de células en la fase S resistentes a la radiación, para un efecto antitumoral más sinérgico con radioterapia 47. Se cree que hay un efecto antitumoral inmunológico, mejorando en un sitio cerebral distante de la lesión irradiada objetivo, denominado efecto abscopal, pudiendo potenciar el efecto de las inmunoterapias y controlar tanto las enfermedades micro como macroscópicas 48,49. La radioterapia parece activar a su vez la muerte celular del tumor, por medio de linfocitos T, por aumento de la presentación de antígenos dentro del tumor 50. Puesto que las terapias dirigidas modifican las funciones celulares específicas en lugar de los procesos genéricos de división celular, sus toxicidades son distintas de las de la radioterapia, por lo que una combinación de ambas puede ser mejor tolerada.
DESARROLLO DE NUEVAS TERAPIAS EN TUMORES ESPECÍFICOS- 1.
CÁNCER DE PULMÓN
30-50% de NSCLC desarrollará metástasis a cerebro durante el curso de su enfermedad 51,52.
- a.
NSCLC EGFR mutado
10 a 15% de NSCLC en Estados Unidos son EGFR positivos, los cuales tienen posibilidad de recibir tratamiento con inhibidores de tirosina kinasa (TKI). Los datos actualmente disponibles sugieren que los TKI tienen actividad clínica sobre las matástasis cerebrales de este tipo de tumores. Entre la evidencia encontramos un estudio fase 2 prospectivo con tasa de respuesta objetiva (ORR) de 83% en 28 pacientes con metástasis cerebrales tratado con gefitinib o erlotinib 53, aunque se sabe que la concentración de erlotinib y gefitinib en líquido cefaloraquideo es significativamente menor que en plasma (5% y 2.5% respectivamente) 54–56. Fase II demostró que gefitinib en 41 pacientes con metástasis cerebrales con ORR 87.8%, sobrevida libre de progresión (PFS) de 14.5 meses (IC del 95%, 10.2-18.3 meses) y sobrevida media de 21.9 meses (IC del 95%, 18.5-30.1 meses) 57.
Afatinib, un TKI de segunda generación quien también inhibe a HER2 y ERBB4, en estudios LUX-Lung 3 y LUX-Lung 6 el subgrupo de metástasis cerebrales informó un ORR de 82% 58. En un análisis combinado de estos estudios, en comparación con la quimioterapia, el tratamiento con afatinib mejoró PFS de 5.4 meses a 8.2 meses y el tiempo hasta la progresión del SNC de 7 meses a 15.2 meses, respectivamente. Afatinib es activo en pacientes pre tratados con metástasis cerebrales, en efecto se ha observado un 35% de ORR intracraneal y un 66% de tasa de control de la enfermedad intracraneal 59, sin comparación en SNC entre afatinib vs erlotinib o gefitinib.
El uso de los TKI tercera generación para mutación T790M de EGFR, han generado respuestas sistémicas duraderas para pacientes que han experimentado progresión de la enfermedad en TKI de EGFR de primera y segunda generación 60. Entre estos se encuentran; osimertinib quien tiene actividad metástasis cerebrales y para pacientes con NSCLC con metástasis cerebrales con mutación T790M 61.
- b.
NSCLC ALK+
3-7% de los pacientes con NSCLC tendrán una fusión aberrante que involucra a los genes de los microtúbulos similares a los microtúbulos 4 (EML4) y anaplásicos de linfoma quinasa (ALK), resultando en una proteína quimérica con actividad quinasa constitutiva generando actividad en fosfoinositol 3-quinasa y las vías RAS 62–65. A pesar de las respuestas clínicamente significativas de ALK con el uso de TKI, la mayoría tendrá progresión de la enfermedad en el plazo de un año y el SNC es un sitio común de progresión de la enfermedad.
Crizotinib, TKI ALK de primera generación, que tiene actividad contra quinasa ROS1 y MET en subanálisis de estudios PROFILE 1005 y 1007 informó una tasa de control de la enfermedad intracraneal de 56% a las 12 semanas en pacientes no tratados 66. El tiempo medio intracraneal para la progresión de los datos agrupados fue de 7 meses para metástasis cerebrales no tratadas y 13.2 meses con metástasis cerebrales tratadas.
ALK TKI de nuevas generaciones tienen actividad del SNC. Alectinib en estudio fase 2 mostró una tasa de respuesta intracraneal informada de 75% y la duración intracraneal media de respuesta fue de 10 a 11 Meses 67–70. El ensayo fase I de ceritinib (ASCEND-1) acumuló 14 pacientes con metástasis cerebrales medibles, 7 pacientes mostraron una respuesta intracraneal y 3 pacientes tenían enfermedad estable. A diferencia del crizotinib y el ceritinib, el alectinib no es un sustrato para las bombas de eflujo de glicoproteína P (P-gp), lo que puede resultar en una mayor concentración de alectinib en el cerebro a plasma 71, de manera que se sugiere que alectinib puede ser particularmente eficaz en pacientes con carcinomatosis leptomeníngea.Otra fase I/II de alectinib en pacientes que progresaron o fueron intolerantes al crizotinib 72, tuvo 21 pacientes con metástasis cerebrales asintomáticas, 11 respondieron objetivamente (6 respuestas completas, 5 respuestas parciales).
- c.
Cáncer pulmonar de células pequeñas
15% de los cánceres de pulmón, está marcado por una rápida proliferación, diseminación temprana y predisposición a metástasis cerebrales. 66% de SCLC se presentará en estadio extenso (es decir, una enfermedad que se extiende más allá de un hemitórax) al diagnóstico.
Dado el éxito limitado de los agentes quimioterapéuticos en pacientes resistente al platino, se están explorando otras estrategias para tratar el SCLC, incluyendo inhibidores del punto de control. Por ejemplo, en el estudio de fase I/II Checkmate 032 se observaron ORRs sistémicos del 10% y hasta el 33% con nivolumab o la combinación de nivolumab e ipilimumab, respectivamente, en SCLC resistente a platino 73. Aunque los pacientes con metástasis cerebrales activas fueron excluidos de este ensayo, la actividad de agentes similares en NSCLC es alentadora 74.
El uso profiláctico de radioterapia en pacientes sin metástasis cerebrales ha sido ampliamente estudiado como una estrategia para reducir la incidencia de metástasis cerebrales. En etapas iniciales que responden a terapia inicial, los estudios demuestran que radioterapia profiláctica aumenta sobrevida (5.4% a 3 años) y disminuye incidencia de metástasis cerebrales en 50% 75, siendo controversial en etapa avanzada, en términos de sobrevida, con efecto de reducción de incidencia de metástasis cerebral para esta etapa al año entre 15-40% 76.
- a.
- 2.
CÁNCER DE MAMA
El segundo cáncer más común para metastatizar al cerebro 77. La incidencia estimada de metástasis cerebrales: estadio 4 está entre el 10 y el 16% basado en varias series de casos 78,79 y por autopsia son del 30% 78,80,81. En mujeres con cáncer resecable localizado, la incidencia acumulada total de recaída en SNC en 10 años es del 5% 82.
Los factores de riesgo para metástasis cerebrales son: ganglios linfáticos positivos, grado histológico elevado, receptores hormonales negativos, expresión de HER2, edad más temprana al diagnóstico, metástasis pulmonar y tumores grandes en la presentación 82–85. El cáncer de mama triple triple (TNBC), el subtipo basal de cáncer de mama y los cánceres de mama enriquecidos con HER2 se asocian con una predisposición a metastizar a cerebro en la recurrencia 86,87.
Existe abundante literatura que apoya la diferencia de expresión entre los receptores hormonales del primario y a metástasis cerebral. Se revela en estudios retrospectivo la pérdida de expresión de receptores hormonales en las metástasis cerebrales 88,89.
- a.
Cáncer de mama HER2+
En el cáncer de mama HER2+ localizado y localmente avanzado, la incidencia acumulada de metástasis cerebrales a los 10 y 15 años se estima 11.8 y 14.3%, respectivamente 82,86.
Trastuzumab, un anticuerpo monoclonal dirigido contra el dominio extracelular de HER2, ha llevado a mejoras significativas en PFS y sobrevida como terapia adyuvante en pacientes con cáncer de mama en estadio temprano 90,91. Los estudios retrospectivos informan una incidencia general de metástasis cerebrales en mujeres que recibieron trastuzumab adyuvante hasta un 35% 85,92–95. Se cree que la propensión hacia las metástasis cerebrales con el cáncer de mama HER2+ está relacionada tanto con la biología del tumor así como con la escasa penetración del sistema nervioso central del trastuzumab 96,97.
La experiencia con otros agentes HER2+ ha sido prometedora. Un fase 2 de 242 mujeres con metástasis cerebrales que habían recibido radioterapia previa, tratadas con lapatinib, un inhibidor doble de HER2+ y EGFR, informó un ORR del 6%; con el 21% de los pacientes observaron tener al menos 20% de reducción en las metástasis cerebrales 98.
También se ha explorado la combinación de lapatinib con capecitabina, con ORR de 20% en 50 pacientes evaluables tratados con esta combinación 98. La ORR para pacientes que recibieron radioterapia previa a la combinación de capecitabina y lapatinib fue de 21 y el 38% en estudios subsiguientes 99,100. En el estudio LANDSCAPE, fase 2 de 45 mujeres con metástasis cerebrales sin radioterapia o lapatinib previa, con seguimiento de 21.2 meses, el ORR con la combinación de lapatinib y capecitabina fue del 65.9% y sólo respuestas parciales 101.
Pertuzumab, un anticuerpo monoclonal contra HER2 que inhibe la dimerización de HER2 con otros receptores, tiene actividad en metástasis cerebral. Estudio CLEOPATRA, fase 3 que pertuzumab puede retrasar el desarrollo de metástasis cerebrales 102. Se ha demostrado que pertuzumab, aumenta su eficacia cuando se utiliza con trastuzumab y docetaxel entre pacientes con cáncer de mama metastásico HER+ 103 y hay demostración de actividad intracraneal de la combinación 104.
Otra fase 2 de pacientes con cáncer de mama HER2+ con metástasis cerebrales, 38 recibieron afatinib y vinorelbina y otros 43 con régimen de elección de los investigadores 105, donde los más elegidos fueron trastuzumab y vinorelbina (11 de 43 pacientes) y lapatinib más capecitabina (8 pacientes). El outcome primario compuesto (ausencia de progresión del SNC o de la enfermedad extracraneal, nuevos síntomas neurológicos o uso de nuevos corticosteroides [denominado como beneficio para el paciente]) a las 12 semanas, se observó en 12 de 40 pacientes (30%) con afatinib, 13 de 38 (34%) afatinib más vinorelbina y 18 de 43 pacientes (42%) en la rama de elección de tratamiento por equipo investigador.
Neratinib, inhibidor irreversible TKI transmembrana EGFR, HER2 y ERBB4, en fase 2 con una sola rama en cáncer de mama HER+ con metástasis cerebrales 106, la tasa de respuesta intracraneal de los pacientes incluidos en el estudio fue del 8%, cabe destacar la valoración como outcomes los aspectos cognitivos y la calidad de vida.
- b.
Cáncer de Mama Triple Negativo (TNBC)
Sobrevida media de cinco meses después de metástasis cerebrales y las mujeres con TNBC que desarrollan metástasis cerebrales tienen peor sobrevida que sus pares HER2+107,108. En un estudio retrospectivo de 679 mujeres con TNBC no metastásico, la incidencia acumulada de metástasis cerebrales fue de 5.6% a los 2 años y 9.6% a 5 años 108. Mientras más avanzada es la etapa, mayor es el riesgo de desarrollar una recurrencia a nivel cerebral 108,109. Debido a que la mayoría de los pacientes con TNBC con metástasis cerebrales tienen enfermedad metastásica extracraneal, el alto riesgo de metástasis cerebrales en TNBC se debe esencialmente a la falta de terapias sistémicas efectivas, en lugar de un efecto de un santuario en cerebro 110. Los regímenes más antiguos y menos usados, son activos en metástasis cerebrales implican combinaciones de metotrexato 111. Eribulin, un inhibidor de la dinámica de los microtúbulos aprobado por la FDA para el tratamiento del cáncer de mama, mostró actividad contra metástasis cerebrales y protege contra el desarrollo de metástasis cerebrales nuevas en una serie de casos 112.
- c.
Cáncer luminal
Tipo histológico más frecuente de cáncer de mama, en general tienen una menor frecuencia de metástasis cerebrales 82. Se ha sugerido que los receptores hormonales se pierden o se alteran durante el proceso de adquirir metástasis cerebrales 113. Los agentes más recientes, como los inhibidores de mTOR y CDK4/6, han mostrado actividad extracraneal en cáncer de mama luminal avanzado. Sin embargo, su papel en el tratamiento de pacientes con metástasis cerebrales está aún por definir.
- a.
- 3.
MELANOMA
Se estima que al menos el 50% de los pacientes con melanoma metastásico desarrollará metástasis cerebrales. 50% de los melanomas metastásicos tendrán una mutación activadora en el oncogén BRAF que conduce a la activación de la ruta de señalización MAPK 114,115. Los pacientes con melanoma BRAF mutado tienen un peor pronóstico en ausencia de tratamiento con inhibidores BRAF 114. Se ha observado una mayor prevalencia de metástasis cerebrales de melanoma en el melanoma BRAF y NRAS mutados (24% y 23%, respectivamente) en comparación con el tipo wild type (12%) 116.
La tasa de respuesta intracraneal con inhibidores de BRAF oscila entre el 30 y el 50% en los estudios publicados, con mayor probabilidad de respuesta en pacientes asintomáticos y aquellos que no han recibido previamente terapias locales para su metástasis cerebrales 117. PFS y sobrevida en un estudio con vemurafenib en pacientes con metástasis cerebrales sintomática se reportaron como 3.9 meses y 5.3 meses, respectivamente 118. Un estudio clínico multicéntrico abierto fase 2 con dabrafenib informó un PFS 16 semanas y una sobrevida de 31 semanas en pacientes con metástasis cerebrales 119.
Respecto a inmunoterapia, aún faltan ensayos prospectivos que evalúen a pacientes con metástasis cerebrales. Se sabe que ipilimumab para melanoma avanzado, tiene una tasa de respuesta sistémica en torno a 11%. Las tasas de respuesta mejoran hasta 21% en pacientes con tumores de tipo BRAF wild type (no mutado) que expresan el punto de control inmune PD-L1 120,121. La tasa global de control de la enfermedad con ipilimumab en pacientes con metástasis cerebrales es 18-27%. Las tasas de control de la enfermedad intracraneal son 24% para asintomáticos y 10% metástasis estables tratados con esteroides 122,123. En forma de terapia combinada con radioterapia, en una revisión 77 pacientes que recibieron ipilimumab después de la radiocirugía para las metástasis cerebrales indicó que había un aumento de sobrevida media de 4.9 a 21.3 meses, con una tasa de supervivencia de 2 años de 20 frente a 47% en comparación con la radiocirugía sola.
- 4.
CÁNCER RENAL DE CÉLULAS CLARAS
La incidencia reportada de metástasis cerebrales al momento del diagnóstico oscila entre 3.5 y 17% 124–127 y sobrevida media después del diagnóstico de metástasis cerebrales en estudios retrospectivos entre 4.1 meses y 15 meses, siendo menores si hay evidencia de metástasis extracraneales 127–130.
Desafortunadamente, los estudios de terapia dirigida a la angiogénesis y señalización de mTOR en su mayoría han excluído a los pacientes con metástasis cerebrales. Sin embargo se ha visto que los pacientes con metástasis cerebrales, han mostrado la mutación en la vía PI3K-mTOR pueden encontrarse en estas metástasis 15.
El tratamiento con TKI puede proteger contra el desarrollo de metástasis cerebrales en pacientes con carcinoma de células renales 131–133. Un estudio retrospectivo informó una disminución en el riesgo a cinco años de desarrollar metástasis de 40% a 17% con el uso de TKI en pacientes con cáncer renal metastásico 133. El uso de estos agentes dirigidos también está asociado con mejoras en la sobrevida de los pacientes con metástasis cerebrales 133,134. Otro estudio retrospectivo, informó de una mejoría de la sobrevida media de 12.1 a 25 meses y una mejoría de la sobrevida media desde el momento del diagnóstico con metástasis cerebral de 4.41 meses a 23.6 meses para los pacientes con TKI después del diagnóstico de metástasis cerebrales 134. Sin embargo, en los ensayos prospectivos la respuesta TKI en cáncer renal ha sido más modesta. La ORR en pacientes con metástasis cerebrales tratados con sunitinib fue de sólo 12% 135,136 y sobrevida fue de sólo 5.3 meses en pacientes con metástasis cerebrales 136.
La combinación de terapia estereotáctica y terapia dirigida parece ser eficaz, un estudio mostró una tasa de respuesta completa del 12%, una tasa de respuesta parcial del 39% y una tasa de enfermedad estable del 24% con terapia secuencial 137. La terapia antiangiogénica sistémica simultánea y radioterapia estereotáxica se encuentra aún en investigación 138.
CONCLUSIONESLa metástasis cerebral son un problema médico importante, pues su incidencia es elevada y el pronóstico sigue siendo pobre. La barrera hematoencefálica junto a una serie de mecanismos le confieren características especiales de protección. Si bien estos mecanismos pueden ser efectivos, también resultan ser una complejidad adicional al momento de seleccionar una terapia adecuada.
Es así que el manejo de las metástasis cerebrales sigue siendo un importante desafío de la oncología actual. La cirugía y radioterapia han mejorado de forma significativa la evolución de los pacientes candidatos a estos procedimientos, especialmente cuando la carga tumoral es limitada. A pesar de estos la sobrevida promedio es en torno a un año con las mejores herramientas disponibles actualmente. En este contexto, se hace indispensable el manejo interdisciplinario de esta patología, incluyendo a oncólogos, radioterapeutas y neurocirujanos, para definir de mejor manera el manejo óptimo para cada paciente en particular.
Las terapias target han mejorado la sobrevida en un subconjunto de pacientes con NSCLC, cáncer de mama y melanoma con mutaciones activas. Para los pacientes con metástasis cerebrales, estos agentes proporcionan no sólo el control intracraneal de la enfermedad, sino que también ayudan a controlar el cáncer sistémico. La clínica y la fisiopatología de las metástasis cerebrales en pacientes con mutaciones como el EGFR pueden diferir de otros pacientes con NSCLC sin estas mutaciones 139. Algunos de las terapias target han mostrado resultados prometedores en el tratamiento de metástasis cerebrales, a pesar de las limitaciones en barrera hematoencefálica y bombas de eflujo.
Actualmente hay un creciente reconocimiento de la heterogeneidad genómica y la discordancia molecular entre los tumores primarios y las metástasis cerebrales 15,113,140. Esto sugiere que las modificaciones en el diseño de fármacos y el uso de la terapia multimodal para mejorar la penetración del sistema nervioso central sólo pueden conducir a ganancias modestas. Es esencial invertir en la caracterización molecular de las metástasis cerebrales y al conocer la experiencia con terapias target en pacientes con metástasis cerebrales se enfatiza las implicaciones pronósticas y predictivas de la definición de subgrupos molecularmente distintos de pacientes.
De esta forma, la mejor comprensión biológica con avances en genómica de las metástasis cerebrales y el desarrollo de biomarcadores predictores de respuesta, el tratamiento multimodal, el desarrollo innovador de fármacos, permitirán mejorar el manejo de metástasis cerebrales llegando a terapias racionales, individualizadas y con un impacto significativo en la calidad de vida y pronóstico de los pacientes en el mediano plazo.
Los autores declaran no tener conflictos de interés, en relación a este artículo.