El ronquido en los niños es el signo más frecuente de trastorno respiratorio del sueño (TROS). La importancia de estos trastornos reside en su alta prevalencia y las morbilidades asociadas, como trastornos neurocognitivos, rendimiento escolar deficiente, disfunción conductual, complicaciones cardiovasculares, consecuencias metabólicas y mala calidad de vida relacionada con la salud. La sospecha clínica se basa en una buena anamnesis y examen físico, aunque en muchos casos es insuficiente para afirmar o descartar la existencia de un TROS; por esta razón es importante contar con pruebas específicas, entre las cuales la polisomnografía es el estándar de oro, pero es necesario establecer criterios para indicar estos exámenes debido a su disponibilidad limitada y a su elevado costo. La adenotonsilectomía es el tratamiento más común de TROS en los niños, sin embargo, el grupo de pacientes con comorbilidad de mayor complejidad requiere un estudio más completo y un tratamiento multidisciplinario. En esta revisión se actualizan los conocimientos acerca de los TROS y su manejo. Se propone un diagrama de flujo para el estudio y manejo de un niño que ronca.
The snoring in children is the most frequent sign of sleep disordered breathing (SDB). The importance of these disorders lies in its high prevalence and the associated morbidities, as neurocognitive disorders, poor school performance, behavioral dysfunction, cardiovascular complications, metabolic consequences and poor health-related quality of life. The clinical suspicion is based on a good anamnesis and physical examination, although in many cases this is not enough to ensure or rule out the existence of a SDB; for this reason it is important to have specific tests, among which the polysomnography is the gold standard, but it is necessary to establish a criteria to request these tests due to its limited availability and high cost. The adenotonsillectomy is the most common treatment of SDB in children, however, the group of patients with comorbidities of greater complexity requires a more complete study and a multidisciplinary treatment. This review updates the knowledge about SDB and its management. A flow diagram is proposed in order to study and manage a child who snores.
El ronquido durante el sueño refleja una resistencia aumentada al flujo inspiratorio, consecuencia de algún grado de obstrucción de la vía aérea superior, y constituye el síntoma y signo más común del trastorno respiratorio obstructivo de sueño (TROS). En diferentes estudios epidemiológicos se ha establecido una prevalencia de ronquido habitual (ronquido 3> noches/semana), hasta en un 12% de los niños, cifra que cambia según la definición que se utilice de ronquido habitual y el grupo etario al que se refiera 1,2.
Existe un espectro de severidad de los TROS, reconociéndose cuatro categorías:
- 1.
Ronquido primario: el niño ronca más de 3 noches por semana, sin presentar apneas o hipoapneas, ni fragmentación del sueño ni alteración en el intercambio gaseoso. La prevalencia estimada es de 7.45% 3,4.
- 2.
Síndrome de resistencia de vía aérea superior, en el cual se puede observar, además del ronquido, una fragmentación del sueño (secundario a aumento del trabajo respiratorio), con respiración paradojal, en ausencia de apneas o hipoapneas aumentadas o alteración en el intercambio gaseoso 5.
- 3.
Hipoventilación obstructiva: se observa ronquido, respiración paradojal, con retención de CO2 o desaturación, por períodos prolongados, sin constatarse la presencia de apneas obstructivas o hipoapneas. Esta condición se puede observar en lactantes pequeños 6.
- 4.
Síndrome de Apnea-Hipopnea Obstructiva de Sueño (SAOS): es la expresión más grave del TROS, y se caracteriza por episodios recurrentes de obstrucción parcial o completa de la vía aérea superior, expresados en apneas e hipoapneas, con alteración del intercambio gaseoso y fragmentación del sueño. Se puede encontrar entre 1% y 4% de la población pediátrica 2.
En la etiopatogenia de los TROS en el niño se reconocen 3 tipos de factores:
- a)
Factores anatómicos, dentro de los cuales el más común es la hipertrofia adeno-tonsilar (HAT) 7,8. Otras condiciones anatómicas que pueden condicionar un TROS son la retrognatia, hipertrofia de lengua, e hipoplasia mediofacial, como se pueden encontrar en diferentes malformaciones cráneo faciales (Secuencia de Pierre Robin, Trisomía 21, Síndrome de Treacher Collins, Acondroplasia, Síndrome de Crouzon, Síndrome de Apertentre otras) 9
- b)
Colapsabilidad aumentada en la vía aérea superior (VAS), que se puede explicar mejor a través del modelo resistor de Starling. Este comprende un tubo rígido con un segmento colapsable, que en este caso corresponde a la faringe, la cual se colapsa cuando la presión en el segmento superior (nariz) supera la presión crítica de cierre del segmento colapsable 10. Los niños con SAOS presentan mayor colapsabilidad de su VAS durante el sueño, comparado con los niños sin esa condición 11. Factor más relevante aún en pacientes con enfermedades neuromusculares. También se ha encontrado mayor colapsabilidad en pacientes obesos que presentan SAOS comparado con obesos sin SAOS 12.
- c)
Regulación neural anormal, como ocurre en pacientes con daño neurológico o malformaciones del sistema nervioso central, como la de Chiari. En estos pacientes se alteran las respuestas de protección frente a la hipoxemia o al aumento del CO2 consistentes en estimulación de los músculos dilatadores de la laringe y respuestas de despertar o cambios en estadio de sueño, lo que determina apneas más graves y prolongadas 13,14.
La prevalencia de los TROS supera el 50% en pacientes portadores de una enfermedad de base condicionante de las alteraciones obstructivas del sueño descritas, y el enfrentamiento de estos pacientes es diferente de aquellos con TROS atribuibles a una HAT, requiriendo un mayor estudio y un manejo multidisciplinario 15,16. Mención especial merecen los niños obesos, debido a la prevalencia creciente de tal condición. En este grupo, casi el 50% presenta un índice de apnea-hipoapnea, >1/hora de tiempo de sueño 17.
MORBILIDAD ASOCIADA A LOS TRASTORNOS RESPIRATORIOS DEL SUEÑOTrastornos conductuales y neurocognitivosExiste mucha información acerca del impacto de los TROS en el área cognitiva y conductual de los niños, habiéndose documentado un efecto deletéreo en áreas como la inteligencia general, desempeño escolar, en las habilidades matemáticas, funciones ejecutivas, capacidad de aprendizaje, procesamiento de la información, memoria, habilidades visuo-espaciales, habilidades en lenguaje verbal y capacidad de atención entre otras 18–23. Las funciones ejecutivas son fundamentales para un buen desempeño escolar y se adquieren durante el desarrollo del niño. Se han medido por métodos objetivos y a través de cuestionarios a los padres. Dentro de las alteraciones conductuales, la hiperactividad es la alteración que se ha reportado con mayor frecuencia y la sola presencia de ronquido frecuente puede predecir el comportamiento hiperactivo de unos años después 24.
No siempre se ha demostrado una buena correlación entre la severidad del TROS y la magnitud de las alteraciones neurocognitivas, lo cual puede deberse a diferentes razones: no hay un criterio homogéneo para definir SAOS, y se utilizan diferentes niveles de corte para el índice de apnea-hipopnea. Además no se consideran otros factores que influyen fuertemente en la severidad de las OSAS y en la morbilidad asociada como el nivel socio económico de los pacientes y la presencia cada vez más frecuente de obesidad 23.
En el niño, a diferencia de los adultos con TROS, se observa más frecuentemente comportamiento hiperactivo, asociado a déficit en la concentración y menores habilidades sociales con problemas de conducta y de rendimiento escolar. La Academia Americana de Pediatría recomienda investigar la presencia de TROS si se trata de un niño roncador con hiperactividad y que no cumple los criterios para el trastorno de déficit atencional con hiperactividad 25. En una completa revisión y metaanálisis que incluyó 61 estudios, Beebe correlacionó los trastornos respiratorios en niños con trastornos de conducta, agresividad, labilidad emocional, comportamiento escolar inadecuado, déficit en atención selectiva, atención sostenida y mantenimiento de alerta 22. Se ha planteado que la fragmentación del sueño y los episodios hipóxicos del SAOS, afectarían el funcionamiento del área cortical prefrontal, lo que está estrechamente relacionado con las funciones ejecutivas 26. Un estudio prospectivo de casos y controles de niños entre 3 y 12 años demostró compromiso frecuente en la atención, memoria, estructuración espacial y ansiedad y los Test Psicológicos demostraron mayor sensibilidad para detectar esas diferencias, comparado con cuestionarios aplicados a los padres 27. Integrando muchos de los efectos negativos que tienen los TROS, los niños que padecen de esta condición, exhiben un peor desempeño social, mayor prevalencia de síntomas depresivos, peor calidad de vida y mayor utilización de los servicios de salud 28.
Estado pro-inflamatorioEn pacientes con SAOS e incluso en niños con TROS tan leves como ronquido primario se ha objetivado la presencia de parámetros de inflamación crónica, encontrándose un aumento del óxido nítrico exhalado a nivel nasal y de varias citoquinas pro-inflamatorias, como factor de necrosis tumoral α, interleuquinas 6 y 8 y un predominio de linfocitos Th17 respecto a Linfocitos T reguladores, correlacionado con la severidad de SAOS 29,30. Interesantemente este desbalance se ve revertido posterior a adenotonsilectomía en niños con SAOS 31. También los valores séricos de Proteína C reactiva ultrasensible están aumentados, al igual que moléculas de adhesión y el factor inhibitorio de la migración de macrófagos, citoquina pro-inflamatoria implicada en variados trastornos inflamatorios incluyendo enfermedades cardiovasculares. Estas alteraciones gatillan una cascada de citoquinas, facilitan la apoptosis de células endoteliales, la activación de plaquetas y de macrófagos, la proliferación de células musculares lisas en pared vascular y daño endotelial, fundamento del inicio y progresión de la variada morbilidad asociada a SAOS 32,33.
Adicionalmente existe variada evidencia de aumento del estrés oxidativo, aún en los casos más leves de TROS de niños, como la elevación de H2O2 en el aire exhalado 34, aumento de niveles séricos de un marcador de estrés oxidativo de lípidos, como isoprostanos (8-iso-prostaglandina F2-alfa) y una de las isoformas de la enzima NADPH oxidasa, soluble (sNOX2-dp), correlacionadas con evidencia de una disfunción endotelial que se refleja en una restricción de la dilatación vascular mediada por flujo 35.
Efectos cardiovascularesLos reiterados episodios de hipoxia, hipercapnia y cambios abruptos en la presión intratorácica pueden inducir alteraciones autonómicas, habiéndose detectado una disfunción del sistema nervioso autonómico en niños con SAOS, elevación de las cifras de presión arterial, mayor variabilidad de ellas durante la vigilia y el sueño, y una mayor diferencia de la presión arterial sistólica entre el día y la noche 36. También se han objetivado elementos ecográficos e histopatológicos de una remodelación ventricular 36. En los casos más severos y no tratados a lo largo del tiempo, se verifica un aumento de la resistencia vascular pulmonar pudiendo llegar a un cor pulmonale 37.
Alteraciones metabólicasTal como ocurre en adultos con SAOS, en niños con SAOS y especialmente en niños y adolescentes que además son obesos, se producen diferentes alteraciones metabólicas como resistencia a la insulina, dislipidemias con aumento de colesterol LDL y reducción de colesterol HDL 33,38,39, y disminución de niveles de Vitamina D 40, alteraciones que tienden a mejorar con el tratamiento del SAOS 38–40. También se han encontrado tendencia a hígado graso e infiltración leucocitaria intrahepática, células de Kupffer activadas y aumento de la apoptosis de hepatocitos, en relación con la gravedad de la desaturación nocturna 41.
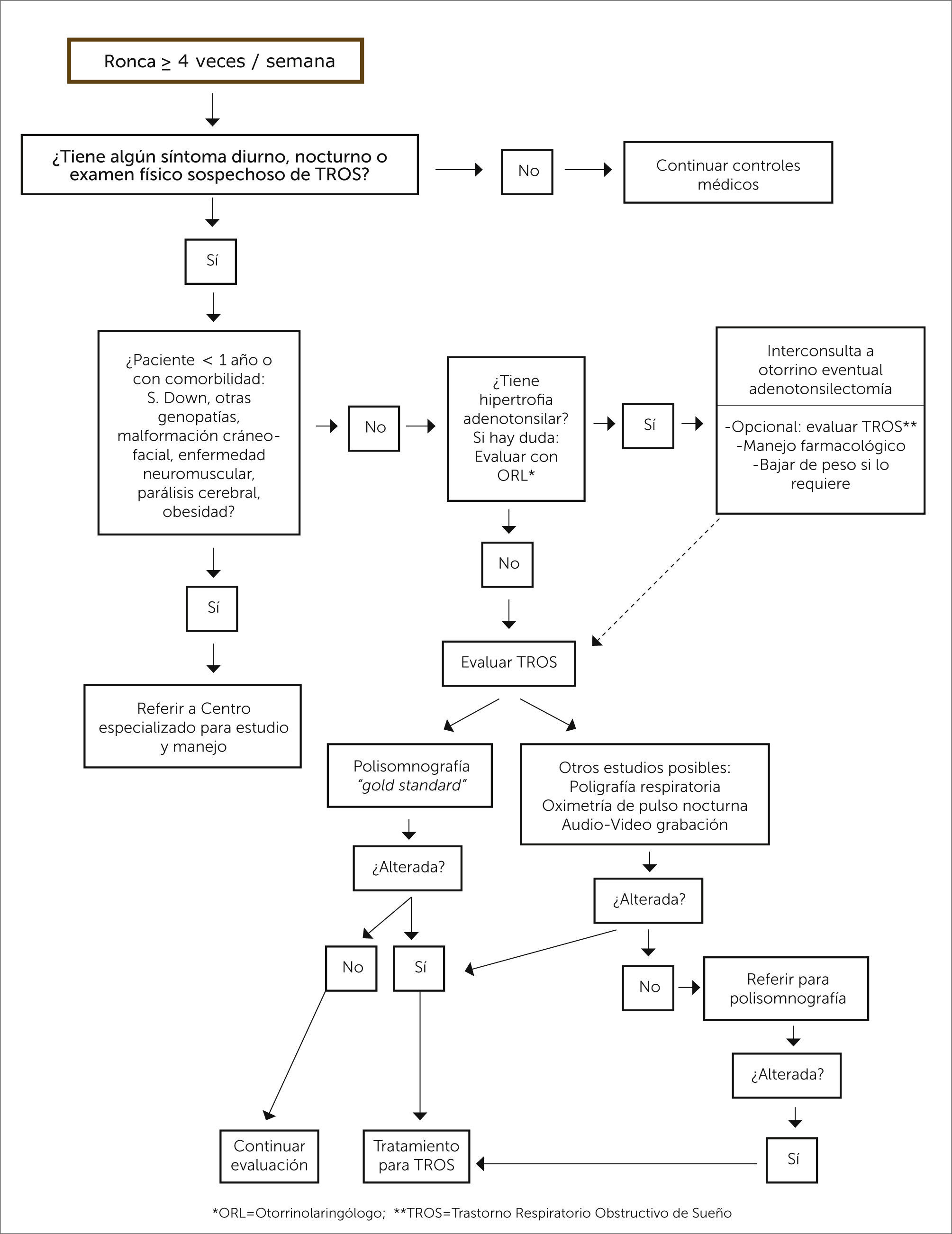
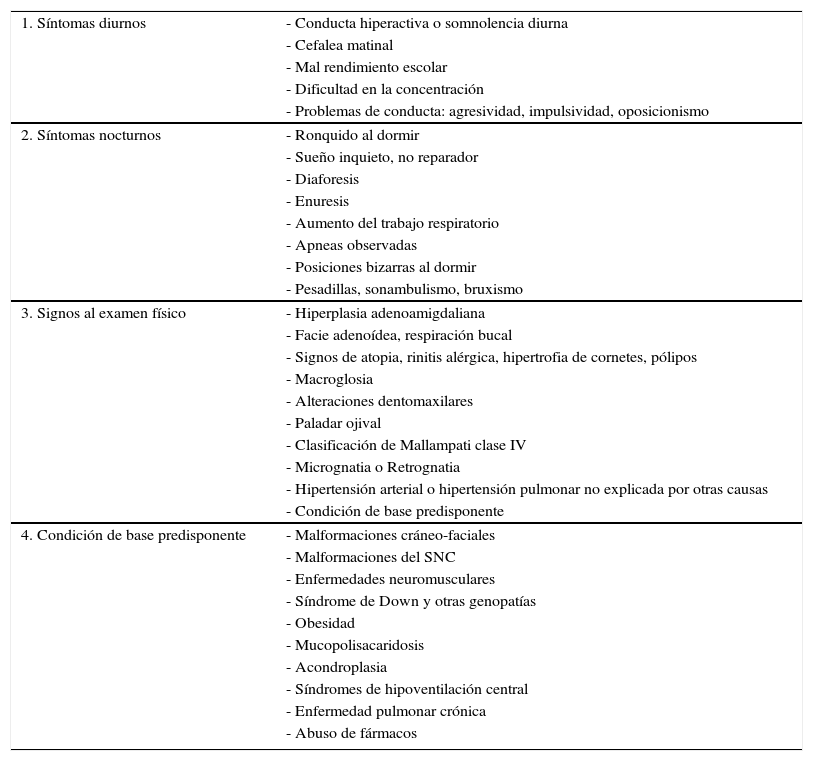
MANEJO DEL NIÑO QUE RONCAEl ronquido en un niño es el elemento semiológico más habitual para sospechar la existencia de un TROS. Lo primero es seleccionar a los pacientes que roncan 4 o más noches por semana. Es muy importante obtener una completa anamnesis y examen físico orientados a este tipo de trastornos: síntomas diurnos, síntomas nocturnos, signos al examen físico que se asocian a TROS y presencia de una condición de base predisponente (Tabla 1). Sin embargo, en muchos casos estos elementos son insuficientes para asegurar o descartar la presencia de un TROS (valor predictivo positivo 40-60%) 42, por lo que, especialmente en presencia de una condición de base predisponente, estos pacientes deben ser derivados a un centro especializado para su estudio y manejo multidisciplinario. Dentro de los estudios posibles de los TROS se cuentan los cuestionarios de síntomas, las grabaciones de video, la saturometría nocturna continua, la poligrafía respiratoria (PR) y la polisomnografía (PSG), siendo esta última considerada el “estándar de oro”.
SOSPECHA CLÍNICA DE UN TRASTORNO RESPIRATORIO OBSTRUCTIVO DEL SUEÑO
| 1. Síntomas diurnos | - Conducta hiperactiva o somnolencia diurna |
| - Cefalea matinal | |
| - Mal rendimiento escolar | |
| - Dificultad en la concentración | |
| - Problemas de conducta: agresividad, impulsividad, oposicionismo | |
| 2. Síntomas nocturnos | - Ronquido al dormir |
| - Sueño inquieto, no reparador | |
| - Diaforesis | |
| - Enuresis | |
| - Aumento del trabajo respiratorio | |
| - Apneas observadas | |
| - Posiciones bizarras al dormir | |
| - Pesadillas, sonambulismo, bruxismo | |
| 3. Signos al examen físico | - Hiperplasia adenoamigdaliana |
| - Facie adenoídea, respiración bucal | |
| - Signos de atopia, rinitis alérgica, hipertrofia de cornetes, pólipos | |
| - Macroglosia | |
| - Alteraciones dentomaxilares | |
| - Paladar ojival | |
| - Clasificación de Mallampati clase IV | |
| - Micrognatia o Retrognatia | |
| - Hipertensión arterial o hipertensión pulmonar no explicada por otras causas | |
| - Condición de base predisponente | |
| 4. Condición de base predisponente | - Malformaciones cráneo-faciales |
| - Malformaciones del SNC | |
| - Enfermedades neuromusculares | |
| - Síndrome de Down y otras genopatías | |
| - Obesidad | |
| - Mucopolisacaridosis | |
| - Acondroplasia | |
| - Síndromes de hipoventilación central | |
| - Enfermedad pulmonar crónica | |
| - Abuso de fármacos |
Cuestionarios de síntomas: uno de los más conocidos en pediatría es el desarrollado por Chervin 43, recientemente validado en su versión en Español 44. Aunque no se ha demostrado una correlación suficiente con la PSG, pueden ser útiles como método de tamizaje 45.
Grabación de video casero: puede ser útil para valorar la intensidad del ronquido y el grado de esfuerzo respiratorio del niño durante el sueño. También se ha utilizado como tamizaje con una sensibilidad de 94% y especificidad de 68%, comparado con PSG 46.
Saturometría nocturna continua: en pacientes con elevada sospecha de presentar un TROS, si resulta alterada, se puede considerar diagnóstica de un SAOS, aunque un resultado normal no descarta un TROS y no logra distinguir eventos obstructivos de los centrales 47. Tres o más bloques de desaturación de al menos 4% o 3 o más desaturaciones bajo 90% se considera alterada. En países con recursos limitados permitiría priorizar a los pacientes que deben ser tratados.
Poligrafía respiratoria: consiste en el registro simultáneo de variables fisiológicas respiratorias, como el flujo aéreo, con doble sistema de registro (termistor y cánula nasal con transductor de presión), movimientos del tórax y abdomen, oximetría de pulso con registro de la onda de pulso, sensor de posición y detección de ronquido. Es posible adicionar registro de electrocardiograma y actímetro y se puede realizar en hospital o en domicilio, obteniéndose en este último caso resultados validados 48. La PR en domicilio no cuenta con supervisión técnica durante el registro, subestima el índice de apnea-hipopnea ya que no puede detectar las hipoapneas asociadas a microdespertares y que no se acompañan de caídas en la saturación de oxígeno(SaO2), aunque en los casos severos, los resultados son igualmente útiles que los obtenidos mediante PSG 49. Tiene la ventaja de ser de menor costo y lograr un sueño más fisiológico en el propio dormitorio del niño.
Polisomnografía: este examen se realiza con paciente hospitalizado y requiere supervisión técnica durante la noche. Además de las variables fisiológicas que registra la PR se incluyen otras como electroencefalograma, electrooculograma, electromiograma submentoniano y tibial anterior, CO2 espirado o transcutáneo, electrocardiograma y video-monitorización (Tabla 2), lo que permite: etapificar los estadios de sueño, detectar microdespertares (arousal) y las hipopneas asociadas a estos que no se acompañan de caídas en la SaO2, sospechar el diagnóstico de síndrome de resistencia de vía aérea superior, obtener una mejor evaluación del intercambio gaseoso con detección de hipoventilación, registrar movimientos anormales y algunas parasomnias y sospechar la presencia de elementos paroxísticos en el EEG.
VARIABLES FISIOLÓGICAS DE LA POLISOMNOGRAFÍA
| -Electroencefalograma: al menos 3 canales |
| -Electrooculograma: 2 canales |
| -Electromiograma submentoniano |
| -Flujo oro-nasal: mediante termistor y mediante cánula nasal (transductor de presión) |
| -Esfuerzo respiratorio: bandas piezoeléctricas torácica y abdominal o pletismografía de impedancia |
| -Evaluación del intercambio gaseoso: saturometría nocturna (oximetría de pulso) y CO2 espirado o transcutáneo |
| -Electrocardiograma y frecuencia cardiaca |
| -Ronquido |
| -Posición corporal |
| -Actímetro |
| -Electromiograma tibial anterior (2 extremidades) |
| -Video monitorización (infrarrojo o ultra sensible) |
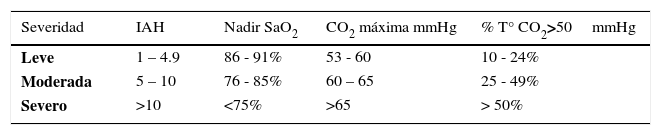
Se cuantifica el número de apneas e hipopneas por hora de sueño (Índice de apnea-hipopnea) (IAH), que constituye el mejor parámetro para expresar la gravedad del TROS. Idealmente debe separarse el IAH de tipo central del tipo obstructivo-mixto, por las diferentes implicancias que tiene 6. En el caso del SAOS se clasifica su gravedad en categorías de leve, moderado y severo, con valores de IAH de 1-5, 5-10 y > 10 respectivamente 50. También se considera, para evaluar la severidad del SAOS, el nadir de SaO2, y si se cuenta con Capnografía, el peak de este parámetro y el% de tiempo con CO2 >50mmHg (Tabla 3). Los criterios para aceptar un evento como apnea central, obstructiva o mixta, hipopnea, respiración periódica, caída en la SaO2, microdespertar (arousal) y la etapificación del sueño, así como los requisitos técnicos de la PSG, se encuentran ampliamente expuestos en el manual de la Academia Americana de Medicina del Sueño 51. Dado el elevado costo de este examen y el no contar con el mismo en todos los centros hospitalarios debe hacerse una selección de casos para su realización que contemple la disponibilidad de recursos en el país correspondiente. Más adelante propondremos un flujograma para la toma de decisiones.
CRITERIO DE SEVERIDAD DEL SÍNDROME DE APNEA-HIPOPNEA OBSTRUCTIVO DEL SUEÑO
| Severidad | IAH | Nadir SaO2 | CO2 máxima mmHg | % T° CO2>50mmHg |
|---|---|---|---|---|
| Leve | 1 – 4.9 | 86 - 91% | 53 - 60 | 10 - 24% |
| Moderada | 5 – 10 | 76 - 85% | 60 – 65 | 25 - 49% |
| Severo | >10 | <75% | >65 | > 50% |
Abreviaciones: IAH: índice de Apnea –Hipopnea; SaO2: saturación de oxígeno; CO2: anhídrido carbónico; %T°: % de tiempo; mmHg: milímetros de mercurio.
Tratamiento farmacológico: se puede intentar en pacientes que no exhiban comorbilidades ni un SAOS grave. El uso de corticoides nasales puede reducir la inflamación de la mucosa nasal, especialmente en presencia de rinitis alérgica. También se ha demostrado una reducción del tamaño del tejido adenoideo, disminuyendo la severidad del TROS 52, independiente de si el niño es alérgico u obeso. Utilizado por 4 semanas su efecto puede perdurar hasta 8 semanas posterior a su interrupción 53. También existen reportes favorables al uso de montelukast usado 12 semanas, logrando mejorar los índices de la PSG, los síntomas y el tamaño de las adenoides 54. Se ha encontrado una expresión aumentada de enzimas biosintéticas para Leucotrienos en niños con SAOS: tienen aumentada la expresión de Leucotrieno C4-sintetasa y del receptor 1 y 2 en linfocitos de las amígdalas, comparado con controles 55. No está claro aún si estas medidas farmacológicas pueden aminorar la morbilidad asociada a los TROS que hemos descrito previamente.
Adenotonsilectomía (AT): es el tratamiento más habitual para los TROS en pediatría, asociados a HAT, con una tasa de éxito de 75%. Sin embargo, esta cifra se reduce sustancialmente en pacientes obesos o en aquellos con comorbilidades como Síndrome de Down, enfermedades neuromusculares, mucopolisacaridosis o malformaciones cráneo-faciales. El estudio multicéntrico, randomizado y controlado “CHAT” en niños con SAOS leves a moderado, demuestra que la AT mejora la calidad de vida, las alteraciones en el comportamiento y los parámetros de la PSG, pero no demuestra una mejoría en la atención ni en las funciones ejecutivas 56. Se ha especulado que una intervención más precoz podría obtener mejores resultados. Falta investigación al respecto.
Dispositivos ortodóncicos y expansión maxilar rápida: deben considerarse estas terapias en pacientes seleccionados, evaluados por un especialista maxilofacial, que presentan un TROS asociado a una estrechez maxilar y/o mandibular u otras anomalías ortodóncicas. El uso de dispositivos ortodóncicos, deben ser considerados como una terapia complementaria, y aún faltan criterios más objetivos para su indicación y contraindicaciones. No se ha establecido el potencial beneficio en los aspectos neurocognitivos y cardiovasculares 57. Los niños con TROS y restricción maxilar, en sentido transverso, que se presentan con una mordida cruzada, se benefician con un procedimiento de expansión maxilar rápida que logra una reducción muy significativa del IAH 58 y estos resultados se mantuvieron después de 2 años de seguimiento 59. Tampoco se ha evaluado el impacto de este tratamiento en la morbilidad asociada a los TROS.
Ventilación no Invasiva: En pacientes con SAOS asociado a obesidad, malformaciones cráneo-faciales, pacientes con SAOS no asociado a HAT o aquellos con SAOS residual significativo post AT, debe considerarse un tratamiento con CPAP. En pacientes neuromusculares o en niños con hipoventilación durante el sueño, congénita o adquirida, debe indicarse un dispositivo bi-nivel (BiPap). Es fundamental un manejo en equipo de estos pacientes, realizar acciones educativas a los padres y cuidadores, seleccionar las mejores interfaces, adecuadas a cada paciente, y monitorizar la adherencia al tratamiento 60.
Distracción mandibular: esta intervención ha sido exitosa reduciendo dramáticamente el IAH y mejorando la saturometría nocturna, en pacientes con micrognatia o retrognatia, como los que padecen una Secuencia de Pierre Robin 61, logrando en muchos casos evitar una traqueostomía o logrando decanular a los pacientes traqueostomizados.
Traqueostomía (TQ): debe considerarse la TQ en SAOS graves, habitualmente asociados a comorbilidades severas y con imposibilidad de aplicar otros tratamientos o falla de los mismos. Se considera el último recurso a aplicar debido a sus complicaciones y al impacto negativo en la calidad de vida del paciente 62.
Manejo nutricional: en pacientes obesos la reducción de peso puede reducir la severidad del TROS, especialmente en adolescentes obesos 63. Este tipo de manejo tendrá un impacto positivo en muchas otras comorbilidades asociadas a la obesidad.
DIAGRAMA DE FLUJOComo ya se ha dicho, no se dispone de PSG ni de PR en todos los centros de atención médica en nuestro medio, por lo que no sería posible realizar estos exámenes a todo paciente que ronca. Se propone un diagrama de decisiones para seleccionar a los pacientes que deben ser derivados a un Centro de Sueño, para su estudio y manejo multidisciplinario y aquellos que pueden ser derivados a un otorrinolaringólogo para una AT (Figura 1).
El autor declara no tener conflictos de interés, en relación a este artículo.