El desarrollo normal del sistema nervioso central (SNC) se compone de varias etapas que son controladas e influenciadas por la interacción entre los genes y el ambiente. El genoma humano contiene entre 20.000-25.000 genes 1, a pesar de lo impresionante del número, es poco probable que puedan por sí solos controlar la organización de 100 billones de neuronas y trillones de sinapsis. La expresión normal de estos genes requiere de un ambiente propicio. Este ambiente puede influir de manera postnatal o prenatal. Es en este desarrollo prenatal en el que queremos centrarnos en este artículo, revisando las corrientes de investigación más recientes al respecto.
The normal development of the central nervous system (CNS) consists of several stages that are controlled and influenced by the interaction between genes and the environment. The human genome contains between 20,000-25,000 genes 1, despite the impressive number, it is unlikely that they alone control the organization of 100 billion neurons and trillions of synapses. The normal expression of these genes requires an enabling environment. This environment can affect prenatal or postnatal way. It is in this prenatal development that we want to focus in this article, reviewing the latest research about it.
En el transcurso de los últimos años, se han publicado varios artículos que muestran la influencia del estrés prenatal y su efecto en el medio intrauterino, sobre el neurodesarrollo posterior de los niños, se han descrito tanto alteraciones cognitivas como conductuales.
El mecanismo subyacente no está del todo dilucidado y las investigaciones experimentales llevadas a cabo en animales no han mostrado resultados categóricos, pero sin duda no parece ser uno solo.
Destacan como posibles actores involucrados:
- 1.
La placenta, parece estar relacionada en más de un nivel y tener un rol fundamental para lograr entender la relación de las condiciones prenatales y el neurodesarrollo a futuro. Esto se aleja de la visión de sólo realizar transporte pasivo de nutrientes, factores de crecimiento y hormonas, convirtiéndose en clave para lograr la adaptación al medio intrauterino, necesaria para el desarrollo normal del SNC.
- 2.
La relación del sistema nervioso en desarrollo, con los sistemas inmune y endocrino, que juegan un papel de especial importancia durante el desarrollo embrionario en la adaptación al medio por parte del embrión. Esta ventaja de adaptación ofrece obvios beneficios, pero trae consigo la posibilidad de desarrollar efectos no deseados y con influencia a largo plazo, configurándose la difundida teoría de la programación fetal o el origen prenatal de las enfermedades.
- 3.
La exposición a infección e inflamación prenatal son factores reconocidamente relacionados a daño cerebral2–4 con asociaciones que se remontan a 1955, momento en el que se reportó que la fiebre materna intraparto se asociaba a un incremento en 7 veces en desarrollar parálisis cerebral 5. Posteriormente se ha desarrollado la teoría del síndrome de respuesta inflamatoria fetal6–8, la cual se revisará más adelante en este texto.
El cerebro humano se desarrolla a partir de unas pocas células embrionarias hasta convertirse en sólo 280 días en un complejo sistema interconectado. En el proceso se superponen factores genéticos y epigenéticos, estrechamente relacionados en espacio y tiempo. Este desarrollo secuencial transforma un delgado disco de tejido indiferenciado en un sistema multicapas, que logra almacenar y procesar grandes cantidades de información sensorial y regular la conducta, la comunicación y la emoción humana. Debido a esto, las alteraciones que afecten las diferentes etapas de este desarrollo pueden provocar daños tanto en forma aguda como a largo plazo del sistema nervioso central.
A continuación se muestra un resumen de las etapas del neurodesarrollo junto a las posibles patologías derivadas al sufrir injurias en ese momento.
ETAPAS DEL NEURODESARROLLO Y POSIBLE ALTERACIÓN ASOCIADANeurulación primaria y secundaria (3-4 sem)
Pueden aparecer anenecefalia-encefalocele-mielome-ningocele. Escisión del prosencéfalo (5-6 sem): Holo-prosencéfalia-agenesia cuerpo calloso- displasia septo-óptica.
Proliferación neuronal
- -
Cerebral (2-4 meses): Microcefalia- esclerosis tuberosa.
- -
Cerebelar (2 meses-postnatal): Dandy Walker-hipoplasia cerebelar.
Migración neuronal
- -
Cerebral (3-5 meses): esquizencefalia-lisencefalia- polimicrogiria.
- -
Cerebelar (4 meses-post natal): sindrome Joubert.
Diferenciación neuronal
- -
Desarrollo axonal (3 meses-nacimiento): Agenesia cuerpo calloso
- -
Desarrollo dendrítico y formación de sinapsis (6 meses-1 año post natal): Autismo–sindrome de Angelman
- -
Reordenamiento sináptico (nacimiento–años post natal): Sindrome de Rett–X frágil.
- -
Mielinización (nacimiento-años post natal): Leucomalacia periventricular-hipoplasia de la sustancia blanca-alteraciones nutricionales y metabólicas 9.
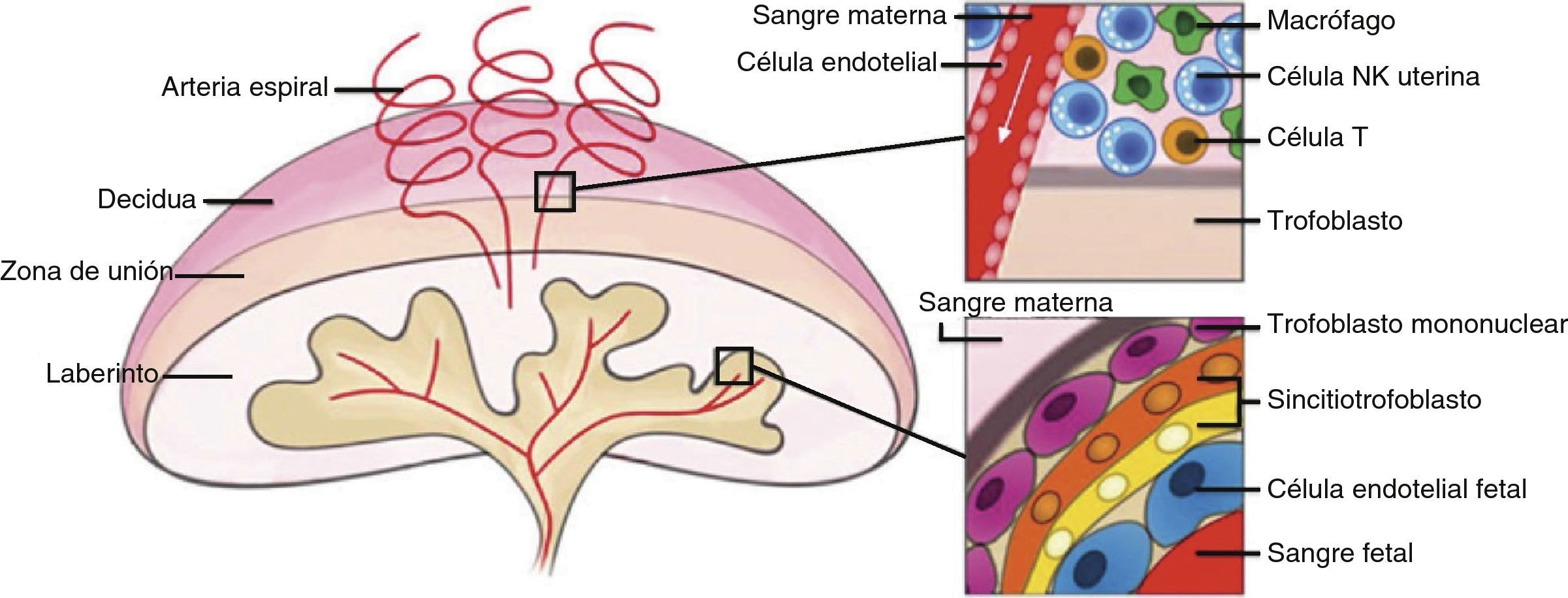
La placenta tiene un origen derivado tanto de células maternas como fetales. Por el lado materno se encuentra la decidua, capa superficial que rodea la placenta y en el que se concentran células inmunes maternas. Bajo esta, se encuentra una capa de células de origen fetal que conforman el trofoblasto con un importante rol hormonal. Finalmente en las vellosidades coriónicas se produce la convergencia de la sangre materna con la fetal separadas por 2 capas de células trofoblásticas llamadas sincitiotrofoblasto que será clave en la regulación de la entrega de nutrientes y oxígeno a la circulación fetal (Figura 1).
Alteraciones placentarias con influencia en el neurodesarrolloActivación inmune materna
Mientras en un embarazo normal se reconocen mecanismos que promueven la inmunosupresión que permiten mantener estable la interfase materno-fetal, la placenta mantiene su capacidad para responder a la infección e inflamación mediante receptores que se han encontrado tanto en las células inmunes de la placenta como en el trofoblasto 10.
En modelos animales una infección respiratoria o la administración de patógenos asociados a patrones moleculares tales como los lipopolisacaridos (LPS) que componen la pared celular bacteriana pueden gatillar una respuesta inflamatoria materna que podría provocar patología placentaria con el subsecuente daño fetal.
Por ejemplo, la administración de LPS en ratas preñadas ha resultado en una aguda depresión cardiovascular 11 o la inhibición del desarrollo distal del pulmón 12. En relación al neurodesarrollo, bajas dosis de LPS que no han provocado trastornos en la gestación han aumentado el daño cerebral secundario a una injuria hipóxica en período de recién nacido 13 o han desarrollado trastornos tipo esquizofrenia o autismo 14. En esa misma línea de investigación se cree que en el daño en la sustancia blanca de los recién nacidos tiene un importante rol la activación de TLR4 (Tool like receptor) en la vida fetal, lo cual es compatible con los hallazgos clínicos en el que la exposición a infecciones bacterianas en la embarazada no sólo puede llevar a parto prematuro sino también a daño en la sustancia blanca.
Otro punto importante es el momento de la gestación en el que se desencadene la respuesta inmune, en modelos desarrollados en ratas la inyección de LPS en las primeras etapas de gestación desencadenó falla en la implantación o la resorción fetal, mientras que en etapas posteriores se desencadenó el parto prematuro 15.
Esta respuesta estimula la producción de factores pro-inflamatorios que acceden a la placenta vía sangre materna lo cual puede traer consigo la activación de la respuesta inmune con producción de citoquinas pro-inflamatorias por macrófagos y granulocitos16–18 lo que puede llevar a alteraciones placentarias en su citoarquitectura, circulación y tolerancia inmunológica.
En un estudio se encontró un aumento de las inclusiones trofoblásticas en el tejido placentario de los recién nacidos que posteriormente desarrollaron trastornos del espectro autista 19 en otro estudio corioamnionitis y alteraciones en las membranas placentarias se asoció con dificultades en la interacción social y comunicación en niños autistas 20.
OTRAS ALTERACIONES PLACENTARIASPatologías maternas que alteran la función placentaria como desnutrición e infecciones incrementan la posibilidad de desarrollar restricción de crecimiento intrauterino (RCIU) y estos mismos factores están epidemiológicamente ligados a la aparición de esquizofrenia, autismo y parálisis cerebral en la descendencia21–24.
Las alteraciones vasculares de la placenta como trombosis de las vellosidades coriónicas, edema y necrosis vascular de las vellosidades son más frecuentes de encontrar en recién nacidos que presentan parálisis cerebral 25.
Se ha mostrado en forma reciente el rol que juega la placenta en la regulación de la síntesis de factores que influyen en el normal desarrollo del cerebro. Hallazgos en ratas han mostrado a la placenta como una fuente importante de serotonina para el desarrollo del prosencéfalo fetal 26. La entrega de triptófano (precursor de serotonina) a través de las arterias uterinas produce aumento de síntesis de serotonina por parte de la placenta y su aumento en la circulación fetal; por el contrario al administrar un antagonista a la triptófano hidroxilasa produjo una disminución de los niveles de serotonina en el prosencéfalo de los embriones afectados, lo cual da una nueva pista sobre el rol de la placenta en el neurodesarrollo, teniendo en cuenta además que las infecciones placentarias se asocian a alteraciones en la vía de síntesis de la serotonina podría asociarse a alteraciones del desarrollo cerebral.
Los déficits inmunológicos se relacionan de manera frecuente a trastornos del neurodesarrollo, existe evidencia que la placenta actúa como un reservorio de células hematopoyéticas e incluso en la producción de estas células tanto de las líneas mieloide, eritroide y linfoide 27. Es por este motivo que enfermedades de la placenta pueden afectar el desarrollo de estas células precursoras con efectos en la inmunidad post natal con un posible efecto en el desarrollo cerebral.
El estrés materno, no sólo el gatillado por infecciones, sino además el causado por eventos situacionales como problemas interpersonales, desastres naturales y trastornos ansiosos, se ha asociado a un neurodesarrollo alterado con problemas tanto cognitivos como conductuales; estas situaciones estresantes generan altos niveles de cortisol materno. El aumento de cortisol en la madre, provoca que en la placenta se produzca una “downregulation” de la enzima 11B hidroxiesteroide deshidrogenasa tipo II, encargada de convertir el cortisol en cortisona inactiva. Esta enzima se ubica en el sinciciotrofoblasto y previene que niveles altos de cortisol circulante en la madre no pasen a la circulación fetal. Se cree que estos niveles elevados de cortisol afectarían la adecuada expresión de genes en la células cerebrales fetales. A pesar de que la evidencia en humanos aún es débil, hay respaldo experimental en roedores y primates28,29.
Estas asociaciones de enfermedad placentaria con daño cerebral y alteraciones conductuales sugieren que la disfunción de la interfaz materno-fetal puede contri-buir a la patogénesis de trastornos del neurodesarrollo (Tabla 1).
ROL DE LA PLACENTA EN PATOLOGÍA DEL NEURODESARROLLO
| CIRCULACIÓN MATERNA |
|---|
| Patología materna: activación inmune-desnutrición-estrés |
| PATOLOGÍA PLACENTARIA (LADO MATERNO) |
| Alteraciones placentarias: activación citoquinas- factores hormonales y endocrinos- expresión de genes |
| PATOLOGÍA PLACENTARIA (LADO FETAL) |
| Alteración de las funciones: tolerancia inmune (inflamación, infiltración leucocitaria) |
| - Invasión trofoblástica y modificación de las arterias espirales (déficit en el transporte de nutrientes, insuficiencia placentaria |
| - Producción de factores neuroactivos (serotonina) |
| EFECTOS EN LA DESCENDENCIA |
| - Autoinmunidad-inmunodeficiencia |
| - RCIU-desnutrición |
| - Hipoxia- isquemia |
| - Alteraciones en el desarrollo neuronal y formación de circuitos |
| AUMENTO DE LA SUSCEPTIBILIDAD A TRASTORNOS DEL NEURODESARROLLO |
La invasión microbiana fetal es la etapa final de la infección intrauterina ascendente. La evidencia ha demostrado que los fetos expuestos a microorganismos o sus toxinas dentro de la cavidad amniótica son capaces de montar una respuesta inmune tanto celular como humoral6–8,30. Esta reacción puede resultar en una respuesta inflamatoria sistémica fetal (FIRS) que puede progresar a falla orgánica múltiple, shock séptico y eventualmente la muerte de no mediar el nacimiento. La citoquina que se ha seleccionado como marcador de esta respuesta es la interleuquina 6 (IL 6) definiéndose que un valor mayor a 11pg/ml en el plasma fetal es marcador de FIRS31,32. Se han propuesto diferentes mecanismos por los cuales las citoquinas provocan daño cerebral, específicamente leucomalacia periventricular, dentro de estos, destacan:
- 1)
Inducción de hipotensión fetal con isquemia cerebral 33.
- 2)
Activación de sistema hemostático por parte del factor tisular, provocando necrosis de la sustancia blanca 34.
- 3)
Inducción a la liberación de factor activador plaquetario, lo cual podría dañar membranas 35.
- 4)
Efecto citotóxico del factor de necrosis tumoral alfa sobre oligodendrocitos y mielina 36.
- 5)
Invasión microbiana de la cavidad amniótica que mediante citoquinas producen un aumento de la permeabilidad de barrera hematoencefálica 4.
La evidencia sobre estrés prenatal y su relación con el neurodesarrollo es creciente y en algunos puntos sustancial. La definición exacta de los mecanismos causantes está aún lejos de ser dilucidada del todo y es campo abierto para los actuales y futuros investigadores tanto de las ciencias básicas como en el área clínica. La patología del neurodesarrollo, puede ser causante de enfermedades agudas, pero principalmente puede causar graves trastornos a largo plazo. La posibilidad de prevenir o proteger de estas injurias con estrategias como el uso de sulfato de magnesio 37 o N acetilcisteína38,39 debería ser estímulo para lograr el entendimiento exacto de todos los mecanismos implicados.
Los autores declaran no tener conflictos de interés, en relación a este artículo.