El 3 a 4% de todos los recién nacidos presentan una malformación congénita importante al nacer, siendo las cardiopatías las más frecuentes en diferentes países y constituyen una de las primeras causas de mortalidad infantil. Para poder prevenir o disminuir estas cifras es relevante la detección oportuna, incluso antes del nacimiento. Según las estadísticas, en los niños portadores de alguna cardiopatía, el 10-15% tendrá algún factor de riesgo para sospecharlo, sin embargo el diagnóstico y atención de los que no son portadores, llevará a una detección oportuna. Ahí radica la importancia de contar con las herramientas necesarias para el diagnóstico prenatal y poder ofrecer cirugía neonatal precoz de estas malformaciones. En este artículo se revisarán los aspectos más relevantes del tamizaje y diagnóstico de las cardiopatías congénitas.
The three to four percent of all newborns have a major congenital malformation at birth, being heart disease the most common in different countries, and an important cause of infant mortality. According to statistics, heart disease can be suspected in children with risk factor, but constituted just 10-15% of all the patients. The diagnosis of the rest, depends of timely diagnosis, hence the importance of having the necessary tools for prenatal diagnosis and offer early neonatal surgery. In this article we will review the most important aspects of screening and prenatal diagnosis of congenital cardiac malformations.
Las alteraciones cardíacas congénitas son el tipo de malformación más frecuente, con una incidencia entre 4 y 13 por cada 1000 recién nacidos vivos1, dan cuenta de un 20% de las muertes neonatales y cerca de un 50% de la mortalidad infantil debido a malformaciones1–9. Un estudio realizado en Bélgica describió una incidencia de 8,3% en los recién nacidos vivos y nacidos muertos de más de 26 semanas de gestación sin relación con alguna anomalía cromosómica. Sin embargo, es probable que exista aún una mayor incidencia en las gestaciones tempranas en las que existen mayor número de pérdidas ya sea de manera espontánea o interrupción electiva del embarazo10.
La tasa de detección prenatal varía ampliamente de acuerdo al tipo de malformación cardíaca, así pues, las más frecuentes son las comunicaciones interventriculares e interauriculares, que representan entre un 20 y un 8%, respectivamente11,12, que si bien tienen un bajo impacto hemodinámico, actualmente tienen utilidad en el tamizaje de aneuploidías. La ecocardiografía fetal en manos experimentadas puede detectar hasta 90% de las cardiopatías congénitas (CC) graves en la población. Así, en la rutina de la ecografía obstétrica, la incorporación del corte de 4 cámaras teóricamente detecta más del 50% de las malformaciones cardíacas graves cuando se realiza a la mitad de la gestación y si a ello se agrega el corte de los tractos de salida y 3 vasos con tráquea, esta detección aumenta su sensibilidad hasta un 90%13.
El ecocardiograma fetal representa la principal herramienta para el diagnóstico y evaluación detallada del sistema cardiovascular fetal, es útil desde finales del primer trimestre de gestación y hasta el término. Desde hace más de dos décadas el uso de la ecocardiografía fetal ha sido un tema polémico, cuestionando muchas veces la técnica idónea, la definición exacta y el alcance que puede llegar a tener. Actualmente gracias a los avances tecnológicos, se busca incluir no sólo una evaluación estructural detallada, si no también funcional.
Este artículo revisará el tamizaje, diagnóstico y manejo de las cardiopatías congénitas más frecuentes.
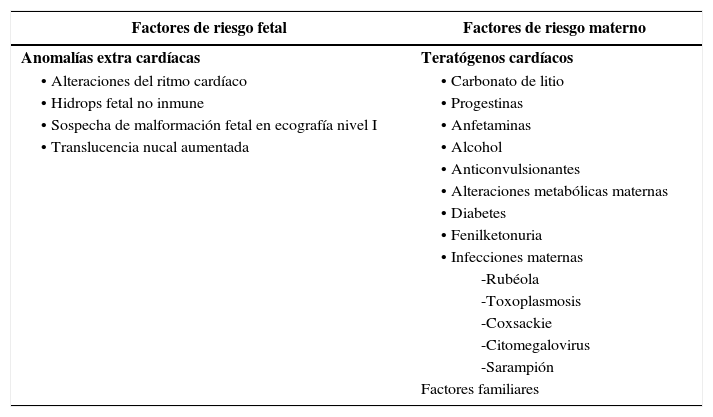
INDICACIONESLa población considerada de riesgo representa las indicaciones clásicas de la ecocardiografía fetal y las podemos agrupar en indicaciones maternas y fetales (Tabla I).
INDICACIONES DE ECOCARDIOGRAFÍA FETAL
| Factores de riesgo fetal | Factores de riesgo materno |
|---|---|
| Anomalías extra cardíacas | Teratógenos cardíacos |
| • Alteraciones del ritmo cardíaco | • Carbonato de litio |
| • Hidrops fetal no inmune | • Progestinas |
| • Sospecha de malformación fetal en ecografía nivel I | • Anfetaminas |
| • Translucencia nucal aumentada | • Alcohol |
| • Anticonvulsionantes | |
| • Alteraciones metabólicas maternas | |
| • Diabetes | |
| • Fenilketonuria | |
| • Infecciones maternas | |
| -Rubéola | |
| -Toxoplasmosis | |
| -Coxsackie | |
| -Citomegalovirus | |
| -Sarampión | |
| Factores familiares |
Sin embargo, entre los recién nacidos cardiópatas solo el 5 a 20% presenta alguna de estas indicaciones durante su vida intrauterina, el otro 80 a 95% de los recién nacidos cardiópatas se encuentra en la población general14–17. Además, las anomalías estructurales cardíacas son el principal hallazgo de la ultrasonografía prenatal11, por ello diferentes países y organizaciones han propuesto el “tamizaje de cardiopatías congénitas”, con el fin de abarcar toda la población, entre 20 y 24 semanas e incorporarlo a la rutina del ultrasonido en el embarazo1–3.
TÉCNICALas técnicas que se utilizan incluyen los modos B, modo M, modo Doppler en todas sus modalidades y ultrasonido 3D, especialmente con la incorporación de STIC (spatio temporal image correlation). La técnica de STIC nos entrega la posibilidad de obtener un volumen del corazón en movimiento. Esto representa, en manos de expertos una ventaja diagnóstica significativa, sin embargo para el no experto, representa la posibilidad de derivar, en forma virtual a la paciente, a un hospital, país o continente vecino, para que el volumen del corazón sea reexaminado, en forma virtual, por un experto en ecocardiografia fetal18,19. Es considerado también de gran importancia en el entrenamiento de nuevas generaciones de ecocardiografistas, ya que posibilitan la realización de exámenes virtuales de una gran variedad de malformaciones cardíacas.
A continuación describiremos en detalle la metodología del examen del corazón fetal por ultrasonido, indicando la utilidad específica de cada uno de los modos utilizados en la evaluación del corazón normal y patológico.
EXAMEN DEL CORAZÓN FETALDistinguiremos un examen de tamizaje1–3,20, y un examen diagnóstico, detallado de las estructuras cardíacas fetales. El primero, de acuerdo a las nuevas recomendaciones de la ISUOG, incluye además del corte superior del abdomen y la visión de cuatro cámaras, a los tractos de salida1. El segundo, la ecocardiografía fetal diagnóstica, corresponde a los mismos planos de sección utilizados en la ecocardiografía de adultos e infantil.
TAMIZAJE DE CARDIOPATÍASEste examen se debe realizar en toda la población entre las 20 a 24 semanas de gestación y forma parte integral del examen del segundo trimestre.
Los requisitos técnicos incluyen transductor de la mayor frecuencia posible, sólo una zona focal, persistencia baja y rango dinámico de modo de obtener el máximo número de cuadros por segundo, desactivar harmónicas y filtros de color si están disponibles. El tamaño del corazón en la pantalla debe ocupar al menos el 30 a 50%1–3. La opción de cine es de gran utilidad para la revisión de un evento que ocurre en un órgano que se mueve muchas veces por minuto Tabla 2.
TAMIZAJE DE CARDIOPATÍAS CONGÉNITAS
| ESTRUCTURAS ANALIZADAS EN CUATRO CÁMARAS Y TRACTOS DE SALIDA |
|---|
| SITUS Y VISIÓN GENERAL |
| • Posición fetal |
| • Estómago y corazón a izquierda |
| • Área cardiaca un tercio del tórax |
| • Corazón a izquierda |
| • Eje cardiaco 45°±20° |
| • Cuatro cámaras |
| • Ritmo regular |
| • Sin hidropericardio |
| AURÍCULAS |
| • Dos aurículas de tamaño similar |
| • Flap de forámen oval abre a izquierda |
| • Septum primum |
| • Al menos dos venas pulmonares en aurícula izquierda |
| VENTRÍCULOS |
| • Dos ventrículos de tamaño similar |
| • Banda moderadora en ventrículo derecho |
| • Septum interventricular |
| UNIÓN ATRIOVENTRICULAR Y VÁLVULAS |
| • Cruz del corazón |
| • Dos válvulas AV que abren libres |
| • Válvula tricúspide más apical que mitral |
| GRANDES VASOS |
| • Aorta tiene un arco del cual salen ramas, generalmente sale de VI |
| • Pulmonar Un tronco que se divide en dos, generalmente sale de VD |
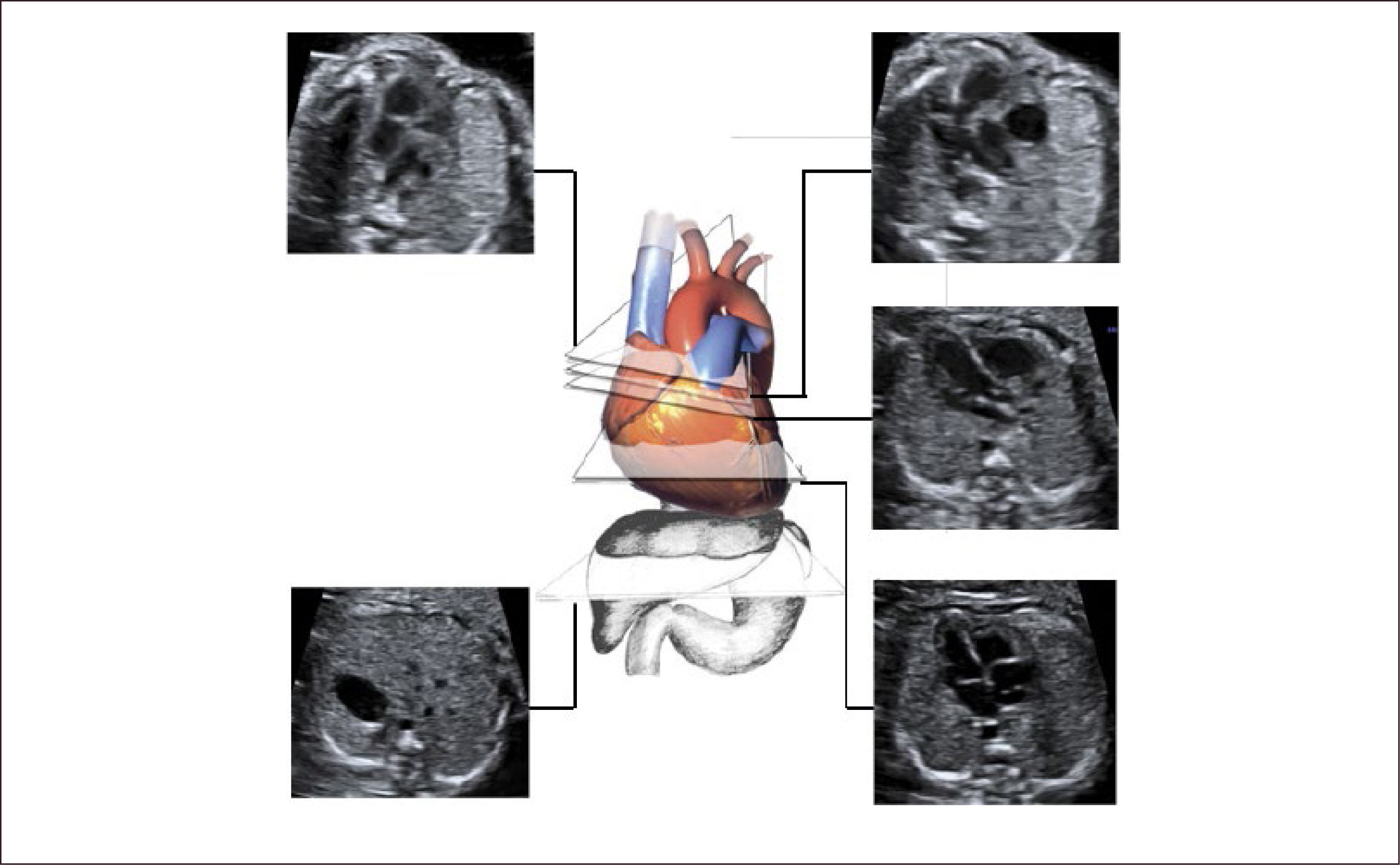
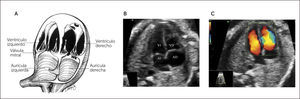
Técnica. En el examen se debe identificar la presentación y posición del feto in utero. El examen comienza con un plano axial en el abdomen, mostrando la sombra gástrica a la izquierda y también con la identificación de aorta abdominal y vena cava inferior (Figura 1). Luego se asciende el plano de sección hacia cefálico del feto hasta obtener la visión de las cuatro cámaras, observando la punta del corazón hacia la izquierda con un área cardiaca cercana al 30% (Figura 1). El eje que forma el septum interventricular con el diámetro ántero-posterior del tórax debe ser de 45° ± 20°. La combinación de estos dos planos de sección permite el diagnóstico de alteraciones del situs, alteraciones del área cardiaca y de aquellas que serán descritas en la imagen de cuatro cámaras1–3.
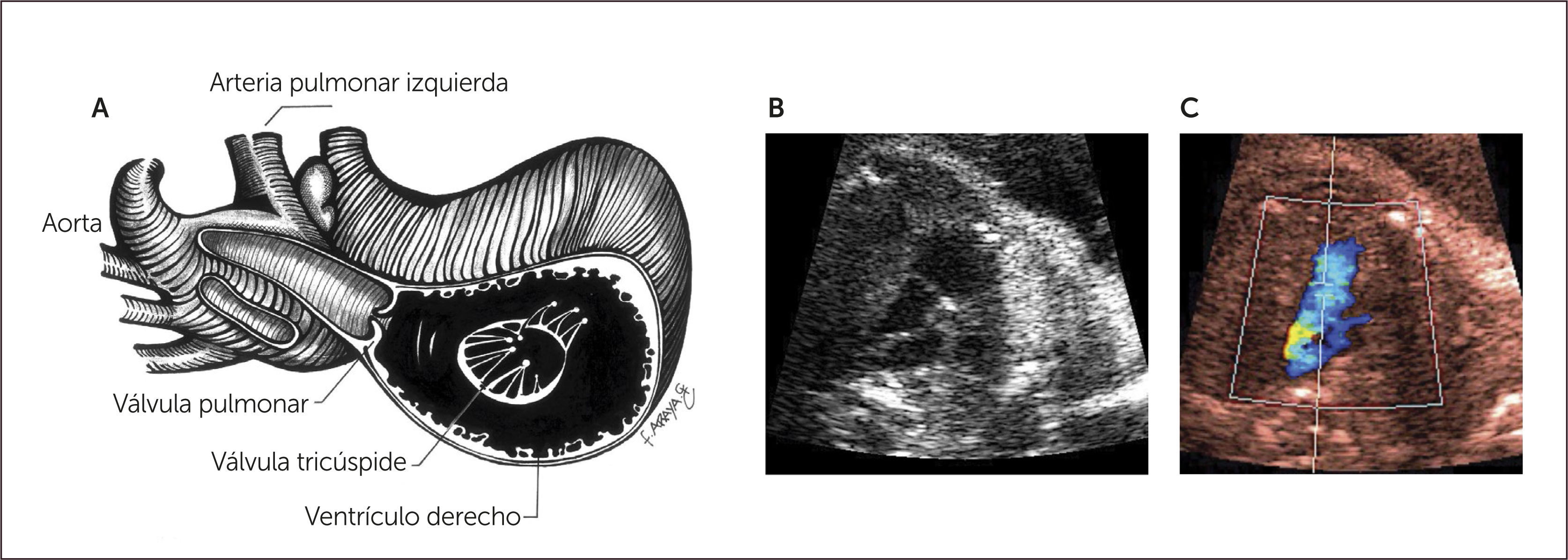
Ascendiendo hacia un plano de sección más hacia cefálico se observa primero el tracto de salida de la arteria aorta y luego más hacia cefálico el tracto de salida de la arteria pulmonar (Figura 1). Al continuar el ascenso paralelo hacia el mediastino superior se evidencia el denominado plano de sección de los tres vasos y tres vasos tráquea (Figura 1)1–3. El ascenso de los planos se puede realizar en forma de planos paralelos sucesivos o angulando levemente el transductor hacia cefálico del feto1–3. La utilidad diagnóstica de cada uno de estos planos será descrita después.
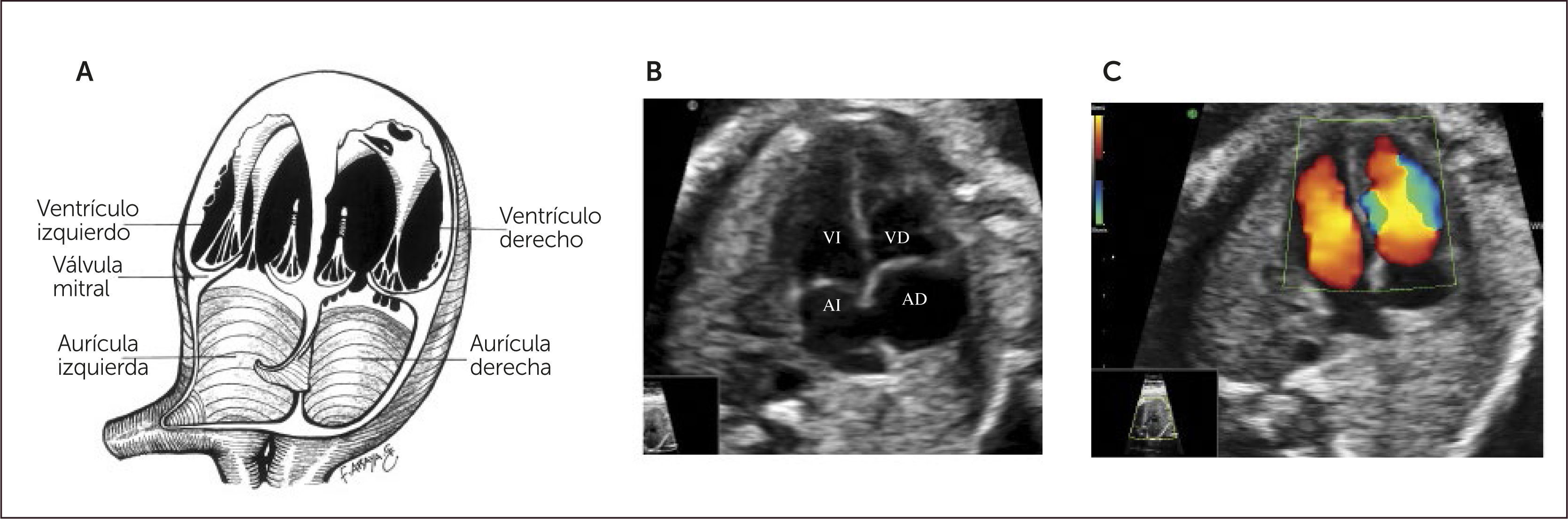
Imagen de cuatro cámaras. Se deben observar en primera instancia el situs cardíaco, área que ocupa el corazón y eje del mismo. El ritmo y la frecuencia cardíaca también deben ser confirmados.
El ápex está hacia la pared anterior del tórax, el ventrículo derecho es más anterior, el ventrículo izquierdo está más cerca de la columna. Ambas aurículas tienen apariencia y tamaños similares. El foramen oval abre hacia el atrio derecho. La “cruz del corazón” está formada por la parte más baja del tabique interauricular, la porción más alta del tabique interventricular, y lateralmente por el sitio de inserción de ambas válvulas aurículo ventriculares. Se deben observar al menos dos venas pulmonares drenando en la aurícula izquierda, por lo que no basta con la observación en modo B, sino que es necesario también evidenciar el flujo de entrada hacia la cámara auricular izquierda por medio del Doppler color.
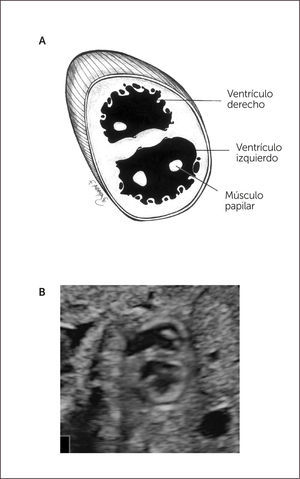
Ambos ventrículos tienen tamaño similar por lo que para distinguirlos es necesario conocer características que los hacen particulares desde el punto de vista ecográfico, tales como: el ventrículo derecho es levemente más grande que el izquierdo, presenta además un engrosamiento en la punta denominado banda moderadora, la inserción de la válvula tricúspide es levemente más apical que la mitral, debido a la distribución muscular impresiona que el ápex está formado solo por el ventrículo izquierdo (Figura 2). El septum interventricular ha de ser examinado con especial atención, ya que sus defectos no siempre son fáciles de evidenciar, por lo tanto, se debe insonar en un ángulo completamente perpendicular al septum, abarcando desde la cruz hasta la punta cardíaca, recorriendo desde la porción más anterior hacia lo posterior, y siempre se ha de complementar esta evaluación con Doppler color. Debemos también observar dos válvulas aurículo-ventriculares distintas, que abren separada y libremente.
Este plano de las cuatro cámaras permite pesquisar alteraciones de las cámaras, de los septum, y de los aparatos valvulares20,1–3. Sin embargo muchas de las alteraciones denominadas ductus dependiente no es posible diagnosticarlas en este plano.
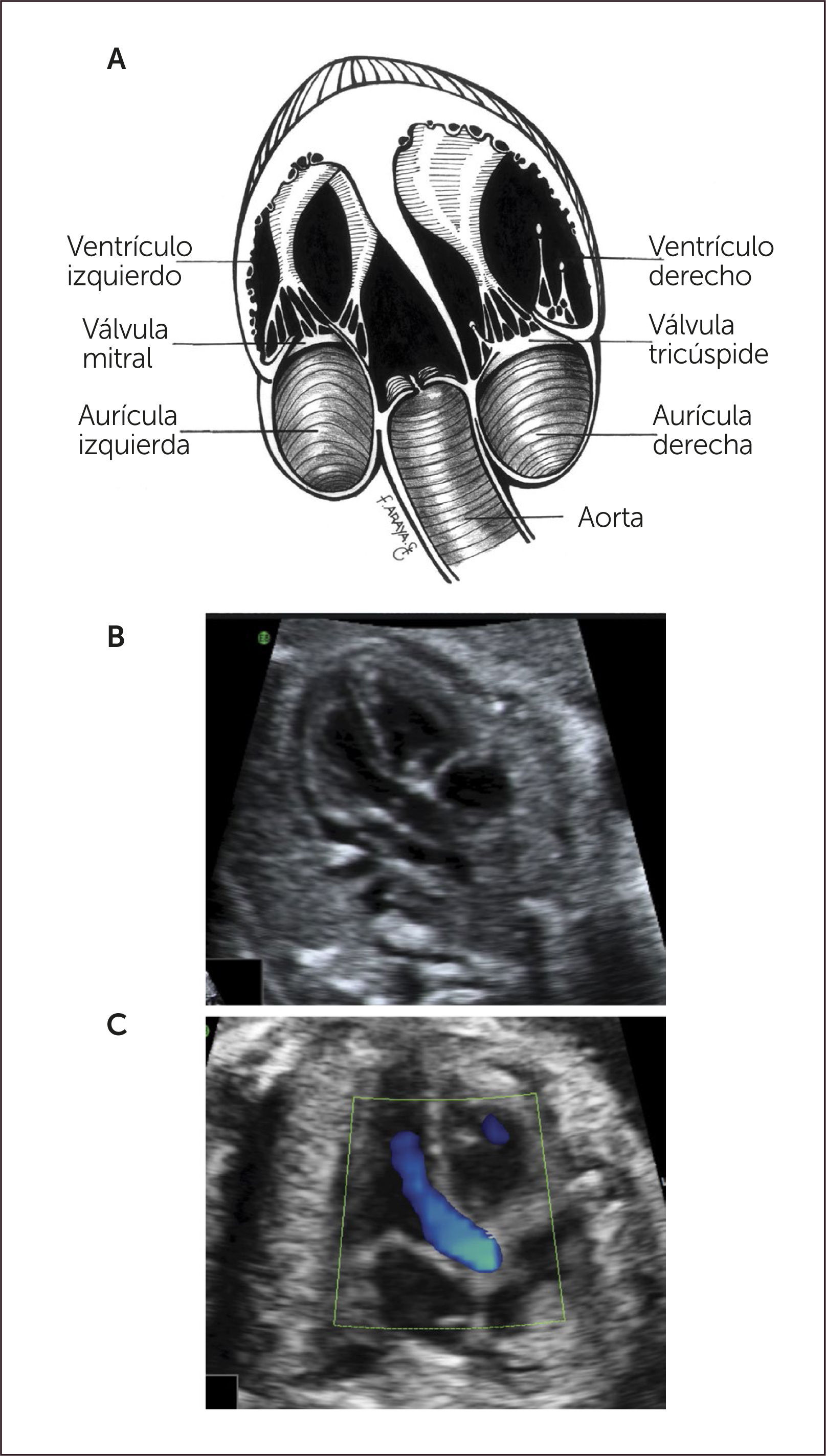
Imagen de tractos de salida. La última publicación de la ISOUG (International Society of Ultrasound in Obstetrics and Ginecology) considera estas imágenes como parte integral del tamizaje de malformaciones cardíacas. Entre las recomendaciones destaca determinar la normalidad de ambos vasos al observar: tamaño similar, la adecuada conexión ventrículo-arterial, cruce posterior a la salida de su ventrículo correspondiente y adecuada apertura valvular arterial.
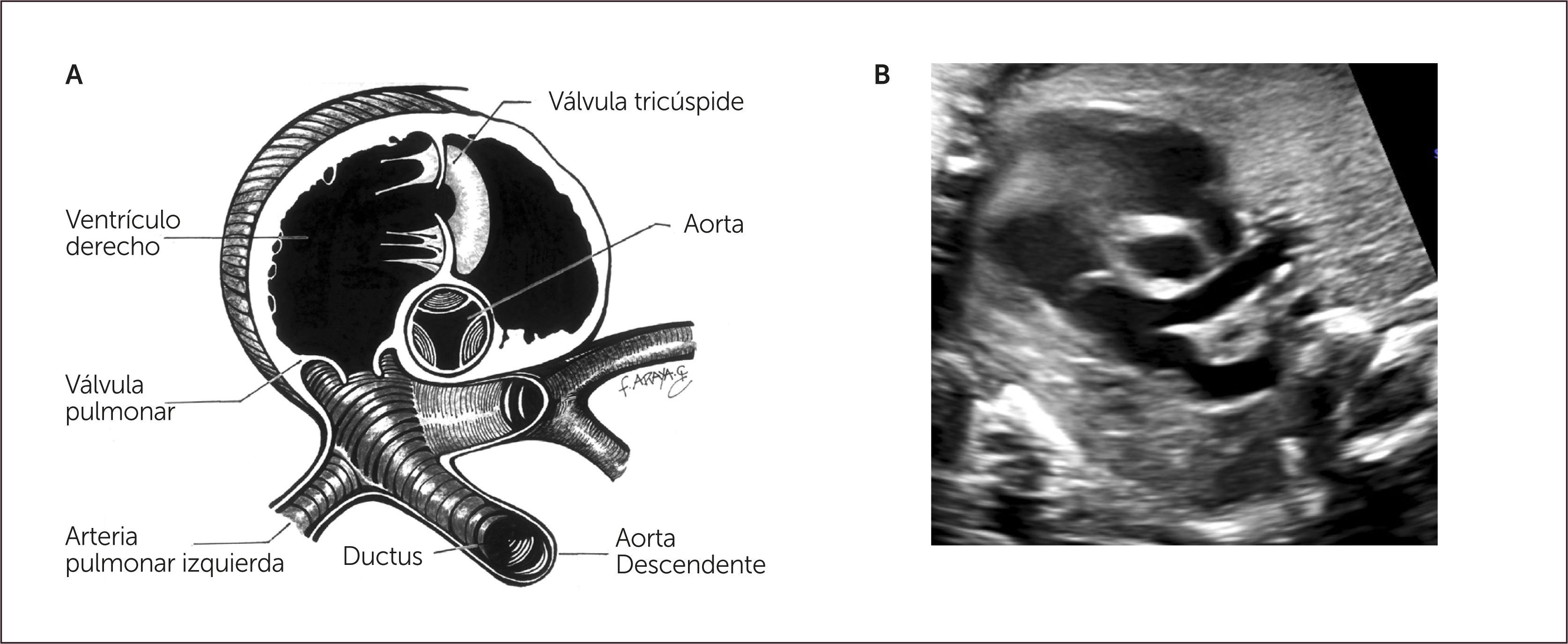
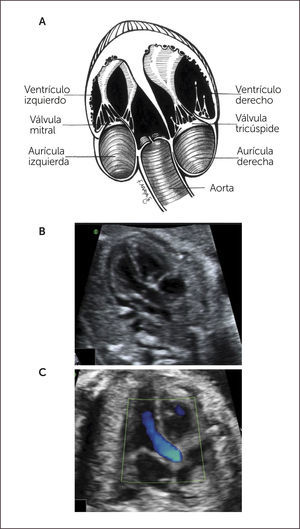
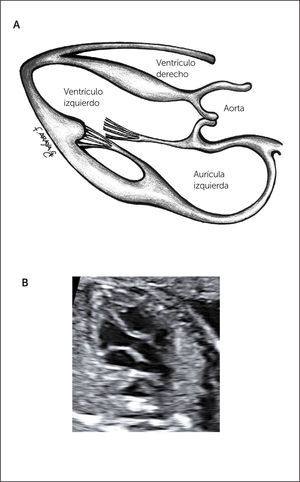
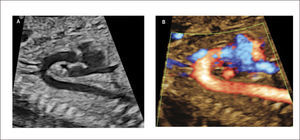
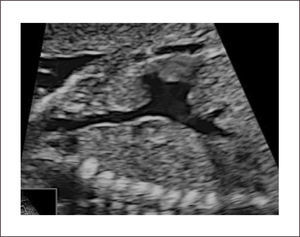
Imagen de cinco cámaras y tracto de salida izquierdo. Es una modificación de la imagen de cuatro cámaras y se obtiene inclinando el plano de sección más hacia cefálico. Permite la visualización del tracto de salida de la arteria aorta entre aurículas y ventrículos, y se puede visualizar la válvula sigmoidea aórtica1–3 (Figura 3).
La visión del tracto de salida izquierdo se obtiene rotando el transductor, desde el corte anterior, de modo que el plano de sección esté ubicado entre la cadera izquierda y el hombro derecho del feto. Esta imagen muestra a la arteria aorta saliendo desde el ventrículo izquierdo. La pared anterior de la aorta aparece en un continuo con el septum interventricular, por lo que este plano de sección permite el diagnóstico de defectos ventriculares septales, que pasan desapercibidos en el corte de cuatro cámaras. La válvula mitral aparece continuándose con la pared posterior de la arteria aorta1–3 (Figura 4). Las válvulas sigmoideas aórticas deben moverse libremente.
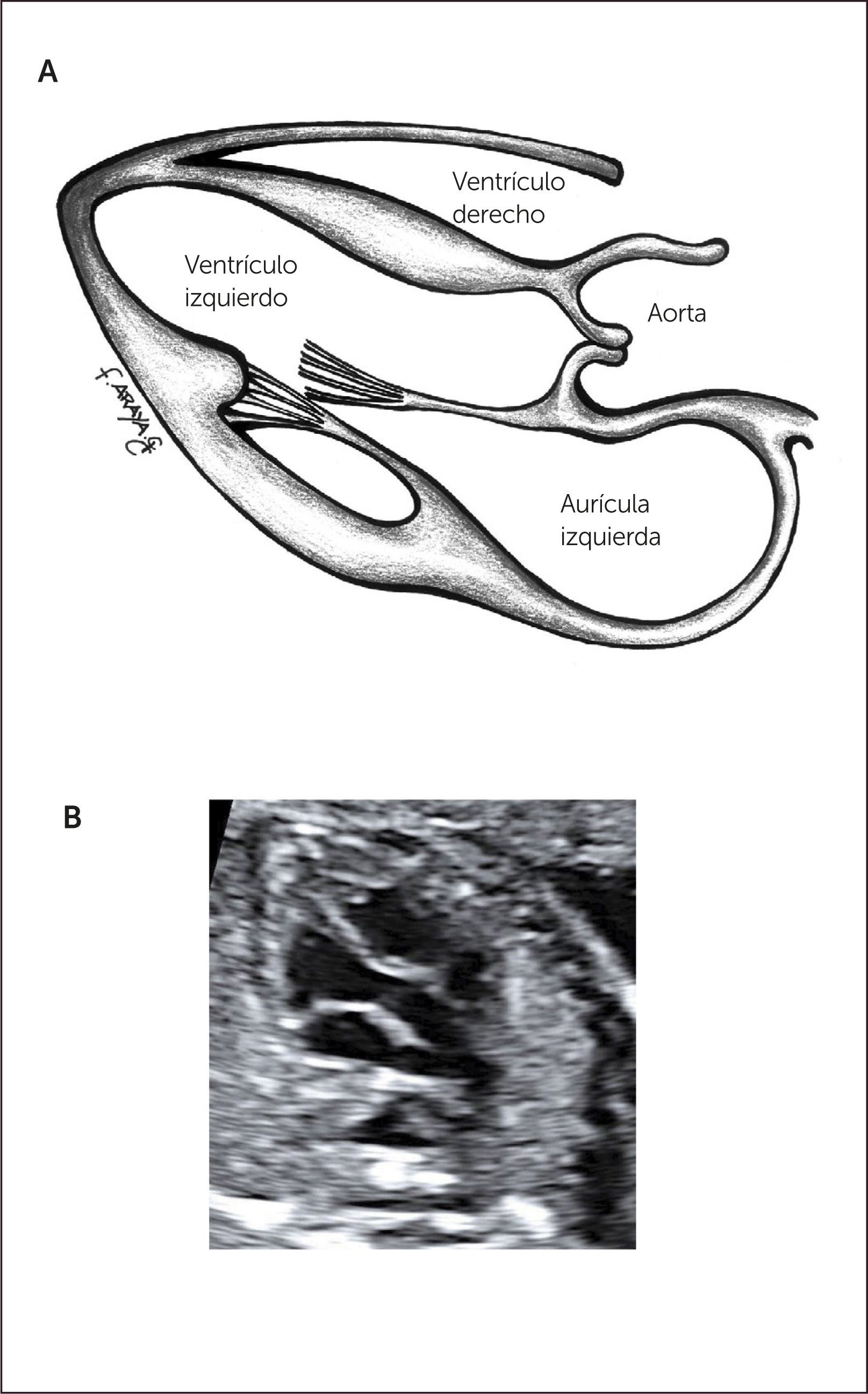
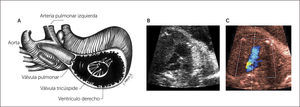
Imagen de arteria pulmonar y tracto de salida derecho. Al ascender en forma paralela desde cuatro cámaras visualizamos la arteria aorta y luego la arteria pulmonar dividiéndose en sus dos ramas.
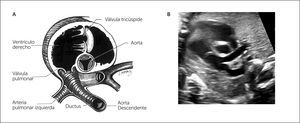
A partir del plano del tracto de salida izquierdo se puede obtener el tracto de salida de la cavidad ventricular derecha, para lo cual se desplaza levemente el transductor hacia la derecha y hacia cefálico del feto, obteniendo la visualización de la arteria pulmonar y su válvula sigmoidea, saliendo desde el ventrículo derecho, se dirige hacia la izquierda y más posterior que la aorta ascendente, para bifurcarse luego en sus ramas y su continuidad con el ductus arterioso que la conecta con la aorta descendente1–3 (Figura 5).
Las imágenes de eje largo izquierdo y derecho son de gran utilidad en patologías como tetralogía de Fallot y transposición de los grandes vasos, entre otras.
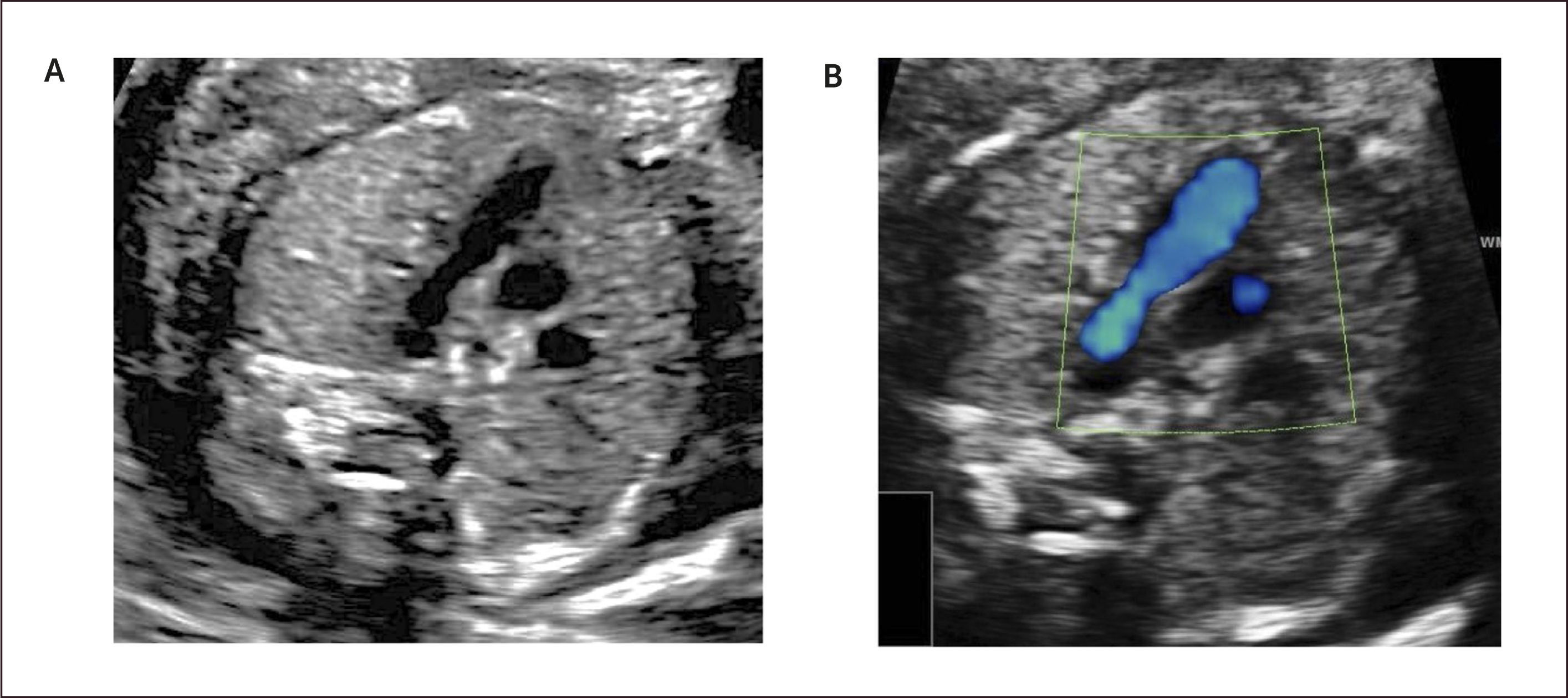
Imagen de los tres vasos y tres vasos tráquea. Este plano se obtiene ascendiendo el plano de sección hacia el mediastino superior en forma paralela al plano de las cuatro cámaras pasando por aorta y pulmonar. En este corte se mostrará la arteria pulmonar a izquierda la región ístmica de la arteria aorta y la vena cava superior a derecha, se debe evaluar su relación entre sí, la relación con la tráquea, tamaño, alineamiento y disposición (Figura 6). Este plano fácil de realizar es de gran importancia en el diagnóstico de las lesiones obstructivas de los grandes vasos así como en defectos de conexión de los grandes vasos1–3,21–24.
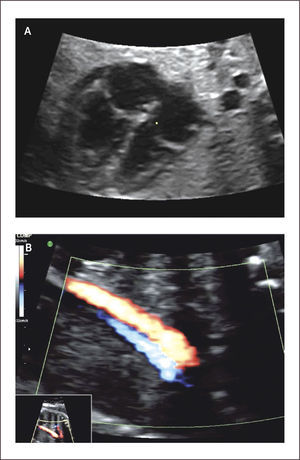
Doppler color. Si bien la utilización del Doppler color nos es imprescindible en el tamizaje de cardiopatías congénitas, es altamente recomendable su uso1–3. Desde el punto de vista técnico debemos utilizar una caja de color lo más pequeña posible que permita ver la estructura deseada. Permite la observación de estructuras normales, venas pulmonares, arterias aorta y pulmonar, así como la visualización de defectos septales y estenosis o insuficiencias valvulares, por lo que es parte integral de la ecocardiografía fetal cumpliendo un rol diagnóstico que no debe ser desestimado1 (Figuras 3 a 6).
ECOCARDIOGRAFÍA FETALEl examen ecocardiográfico se realiza por especialistas en medicina materno fetal, pediatras cardiólogos o especialistas en cardiología fetal3. El examen puede ser realizado a cualquier edad gestacional después de las 12 semanas, siendo la mejor edad entre las 25 y 30 semanas de gestación. En el examen se realizan los mismos planos de sección del examen del recién nacido y del adulto. La metodología de examen comienza con una identificación adecuada tanto de la presentación como de la posición fetal al igual que en el tamizaje, sin embargo a los planos de sección descritos en el mismo se adicionan los ejes corto de la punta y de la base, así como la visión de arcos aórtico ductal y de venas cavas. En este estudio se evalúa y diagnostican patologías del ritmo y la hemodinámica fetal.
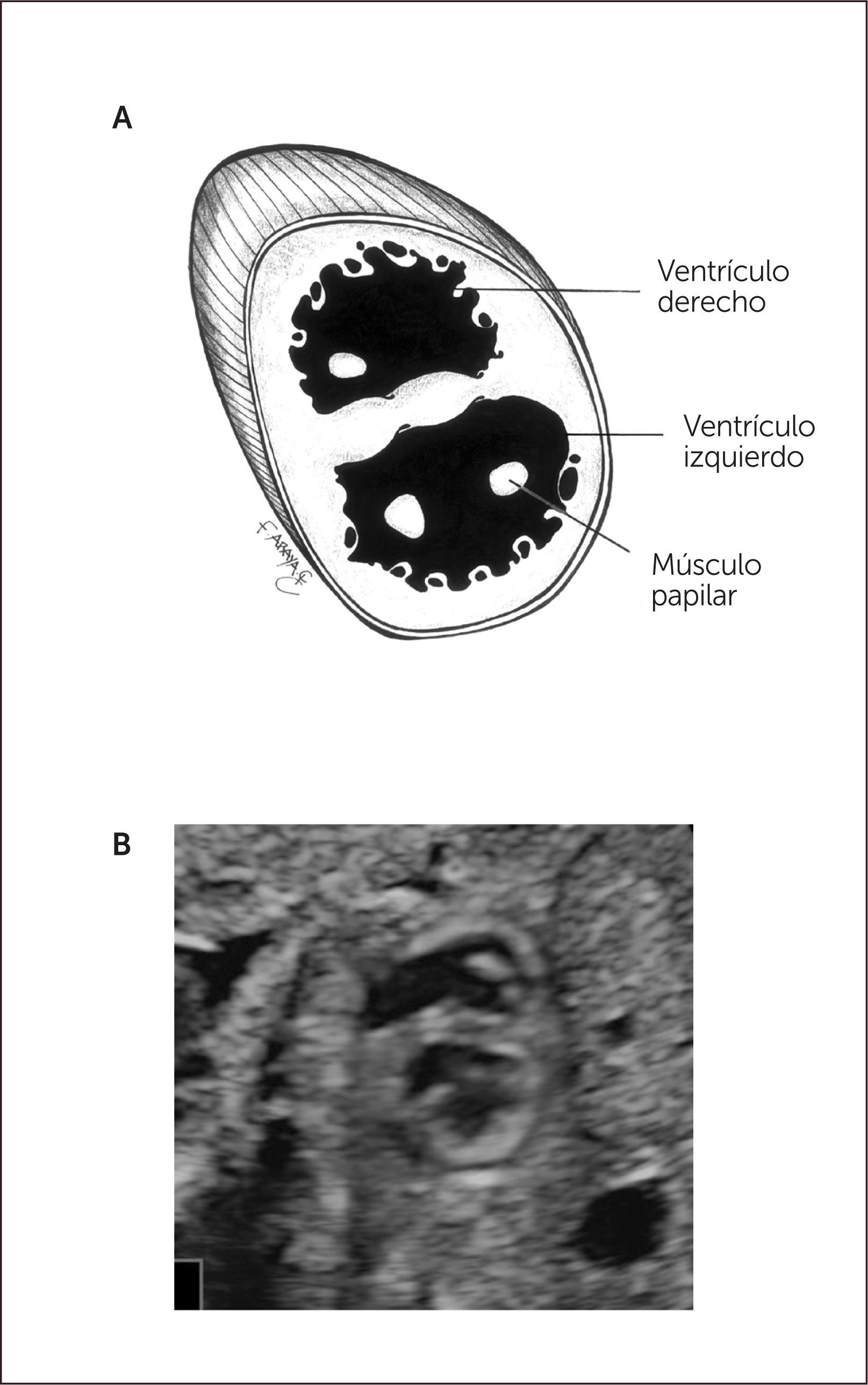
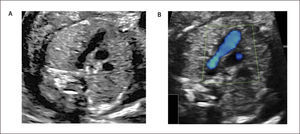
Eje corto. Se obtiene rotando el transductor en 90 grados, a partir de los planos de eje largo, de modo que el plano de sección sea perpendicular a éste. Permite la visualización de un corte de sección transversal de las cavidades ventriculares hacia la punta del corazón. Es posible en este corte identificar los músculos papilares del ventrículo izquierdo y, más hacia cefálico, las válvulas aurículo-ventriculares (Figura 7).
Eje corto de grandes vasos. Es el mismo plano de sección del corte anterior, pero más hacia cefálico y hacia la base del corazón. Se visualiza la arteria aorta en un plano transversal, el ventrículo derecho con su tracto de salida que se continúa con la arteria pulmonar, la que se bifurca en sus ramas, incluido el ductus arterioso. (Figura 8). Este plano de sección es de gran utilidad en el diagnóstico de lesiones obstructivas del tracto de salida derecho.
Arco aórtico. No corresponde a un plano ecotomográfico clásico. Se obtiene realizando un plano de sección longitudinal del feto hacia la izquierda de la columna vertebral. Se observa parte de la aurícula derecha, aorta ascendente, cayado y aorta torácica. Se visualizan también las arterias subclavia, carótida común izquierda y tronco braquiocefálico (Figura 9). Esta imagen es de utilidad en el diagnóstico de transposición de grandes vasos y coartación aórtica.
Arco ductal. Desde el plano anterior se desplaza el transductor a derecha obteniendo el tracto de salida del ventrículo derecho con la arteria pulmonar que se continúa con la arteria aorta ístmica a través del ductus arterioso. Este plano tomográfico es de utilidad en las lesiones obstructivas del ventrículo derecho y en los casos de constricción del ductus arterioso (Figura 10 a, b)
Eje largo vena cava. Esta imagen tampoco corresponde a un corte ecotogomográfico clásico. Se obtiene haciendo un corte longitudinal del feto y desplazando el transductor a derecha de la columna. Se observa la aurícula derecha donde llegan las venas cava inferior y superior. Una modificación de este plano permite visualizar en sentido longitudinal la vena umbilical intrahepática el ductus venoso y vena cava inferior en un plano (Figura 11). Este plano de sección es de gran utilidad en el diagnóstico de síndromes de isomerismo cardíaco. También evaluamos la velocimetría Doppler de ductus venoso y vena umbilical.
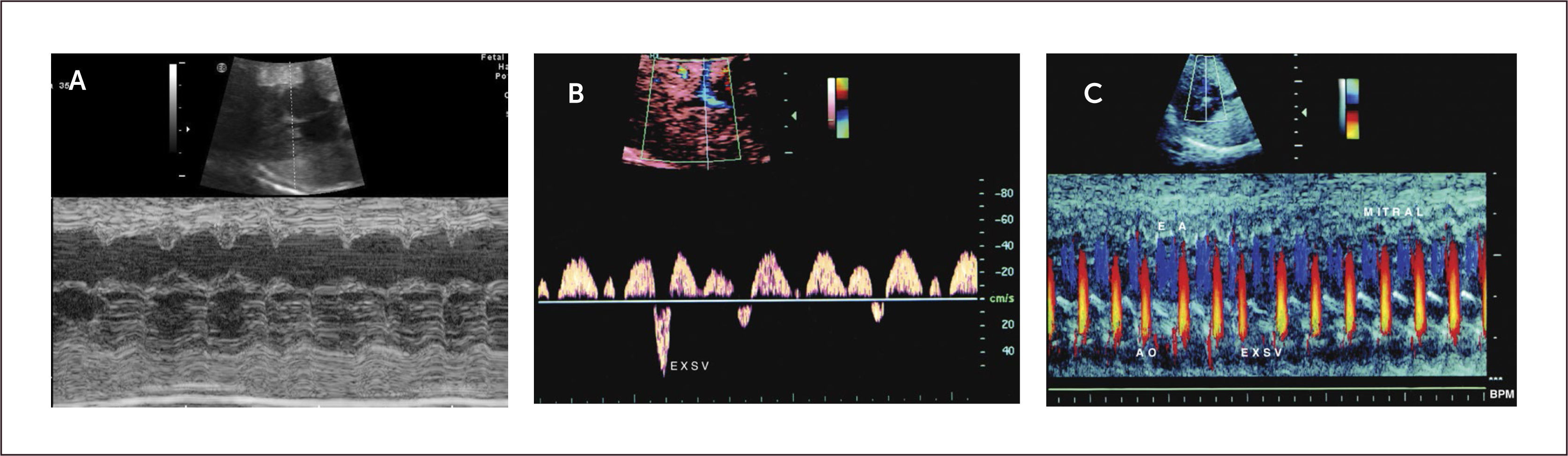
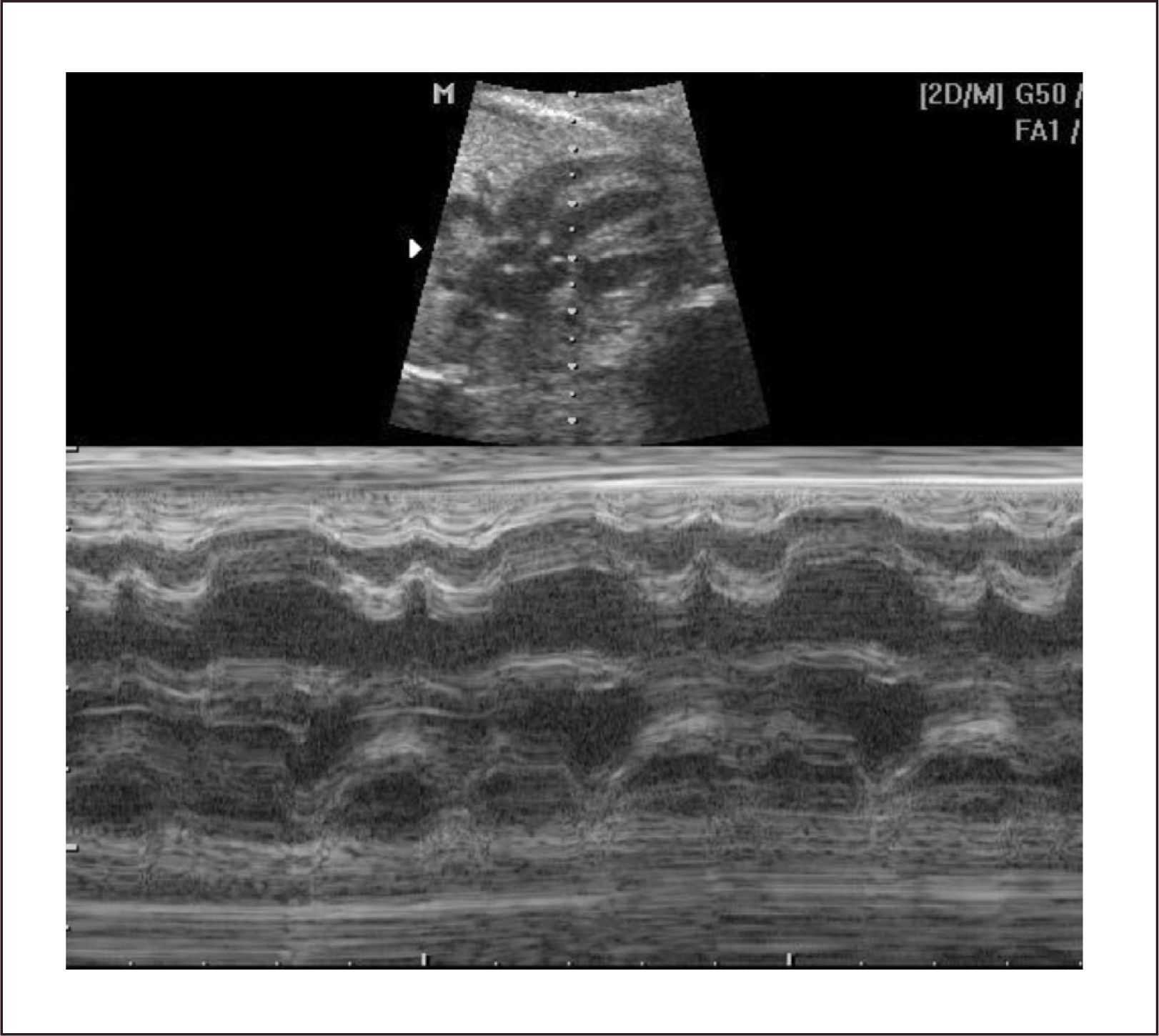
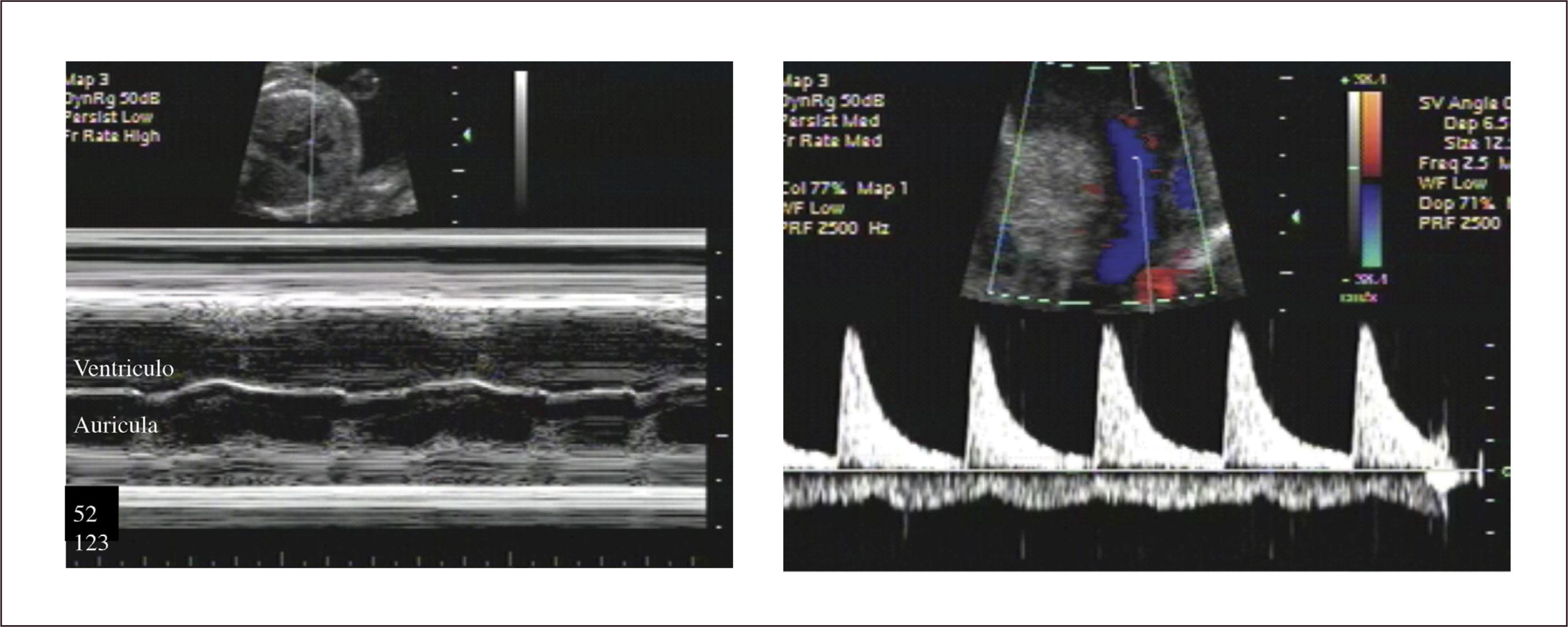
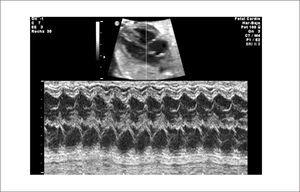
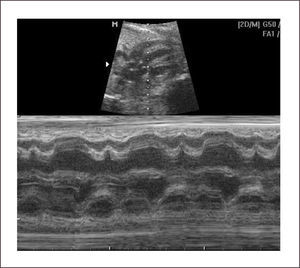
Ritmo normal y diagnóstico de arritmias. El ciclo cardíaco normal se inicia con la despolarización del nódulo sinusal, al que siguen las aurículas, nódulo aurículo-ventricular y por último ventrículos, con un ciclo mecánico en la secuencia auricular y ventricular. De esta forma los eventos eléctricos son sucedidos por los eventos mecánicos en la misma secuencia. Estos acortamientos de las fibras miocárdicas son registrados por el modo M. Al realizar un plano de corte, generalmente de cuatro cavidades en que el plano del modo M registre simultáneamente aurículas y ventrículos, permite establecer un ritmo normal, en que cada contracción ventricular esté precedida de una contracción auricular (Figura 12).
Otra alternativa para ritmo, es registrando simultáneamente con Doppler pulsado, eventos producidos por aurículas y ventrículos. Estos sitios incluyen tracto de salida izquierdo y entrada de válvula mitral, ramas de arteria y venas pulmonares, aorta descendente y cava inferior25. Estas técnicas permiten diagnosticar con gran exactitud los diferentes tipos de arritmias, ya sea de baja o alta frecuencia.
CARDIOPATÍAS CONGÉNITASLa presencia de enfermedades cardíacas congénitas en el feto es el resultado del desarrollo anormal del corazón fetal, que sufre cambios complejos en las primeras ocho semanas de vida embrionaria. La mitad de los casos de cardiopatía congénita son menores y se corrigen fácilmente mediante cirugía, la otra mitad representa más de la mitad de las muertes por anomalías congénitas en el resto la infancia.
Existen diferentes clasificaciones para las cardiopatías cardiacas, estan son: las basadas en el origen embrionario, las que se dividen según las características anatómicas del corazón, valorando las características fisiopatológicas, las basadas en la repercusión clínica al nacimiento o evaluando el pronóstico a largo plazo de las mismas.
Los defectos estructurales como grupo, tienen una frecuencia menor que las alteraciones del ritmo. Por lo que en este caso, se decidieron dividir las cardiopatías desde el punto de vista topográfico en alteraciones de la visión de cuatro cámaras y de los tractos de salida y posteriormente se abordarán alteraciones en el ritmo cardiaco.
Alteraciones de la visión de cuatro cámaras. Corresponde a un grupo heterogéneo de malformaciones, algunas de las cuales pueden ser malformaciones extracardíacas, que afectan la posición o eje del corazón fetal, como son los isomerismos. Es importante definir que cuando la punta del corazón está sobre el estómago y ambos a la izquierda se denomina situs solitus. Cuando solo la punta del corazón está a la derecha se denomina dextroposición, generalmente secundario a lesiones que ocupan el hemitórax izquierdo. Y cuando el estómago y corazón está a la derecha se denomina situs inverso y corresponde al grupo de enfermedades denominadas isomerismo. Las dextroposiciones tienen una frecuencia de 3 a 5 en 1000 recién nacidos. Las causas más frecuentes son hernia diafragmática, malformación adenomatosa quística, y otro tumores mediastínicos o de menor frecuencia.
Alteraciones del tamaño y eje del corazón fetal. El aumento global del tamaño del corazón fetal se define como un incremento del área cardíaca por sobre el 50% del área torácica en el plano de las cuatro cámaras. Estas son aproximadamente el 8% de las malformaciones cardiacas26. Las podemos dividir en causas extrínsecas e intrínsecas. Las extrínsecas generalmente se deben a infecciones, hipervolemia y menos frecuentemente a daño miocárdico por anticuerpos Ro SSa o SSb como lo describiremos en el bloqueo AV completo. En los casos de infección, los virus de la rubéola, citomegalovirus, herpes y parvovirus B19 son los más frecuentemente identificados26. Entre las causas intrínsecas observamos las miocardiopatías. En estos casos también se observa el corazón aumentado de volumen pero con una función contráctil alterada incluso con zonas aquinéticas. Las más frecuentes son la miocardiopatía dilatada y la falta de compactación del miocardio.
Las alteraciones del eje cardíaco son generalmente con un aumento por sobre los 60°. Las causas más frecuente son alteraciones de los tractos de salida o eventualmente compresiones extrínsecas. Al examen observamos un corazón “recostado” en el tórax con un ángulo mayor de 90°. El pronóstico va a depender de la causa por la cual el eje está alterado.
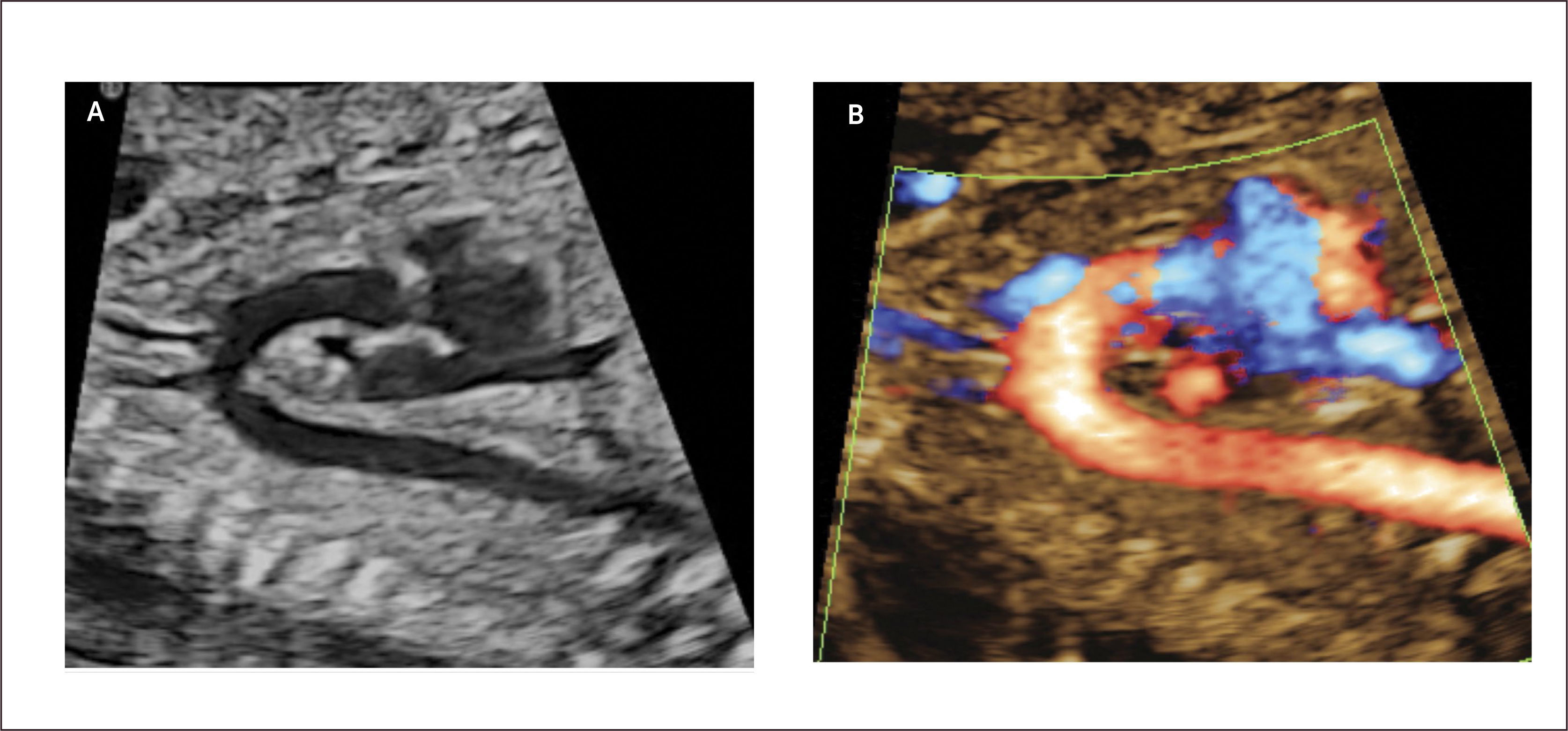
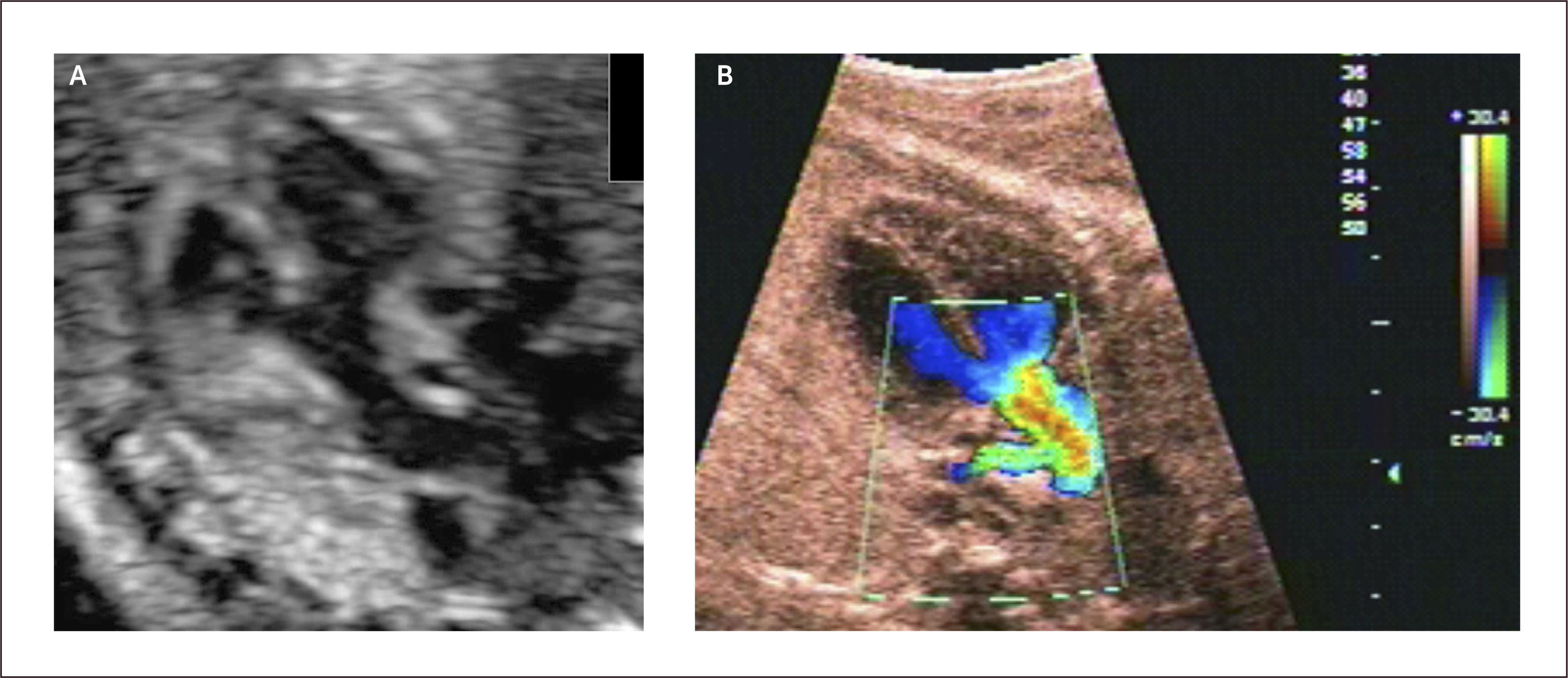
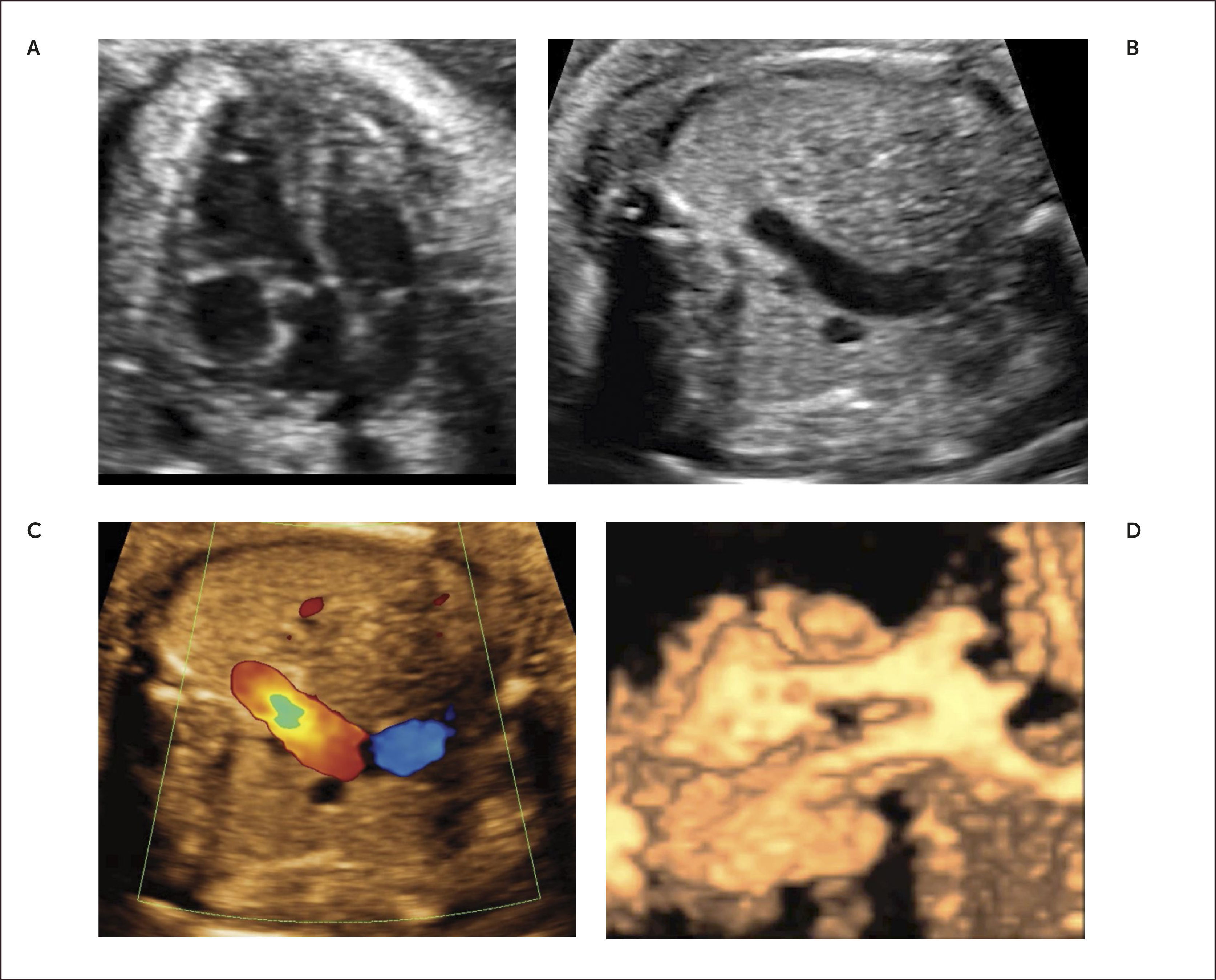
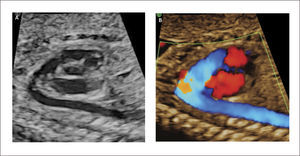
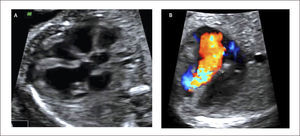
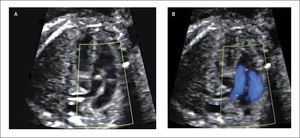
Defectos septales auriculares. El defecto tipo septum primum es el más frecuentemente diagnosticado en la vida intrauterina y corresponde a grados variables de canal atrio-ventricular, el doppler color permite identificar la zona de defecto (Figura 13). El defecto tipo septum secundum es menos frecuente y forma parte el síndrome de Holt-Oram27.
Debido a las características de la circulación fetal, en que la presencia del foramen oval impide la identificación adecuada del septum interauricular, se debe sospechar de comunicación interauricular en el corte de 4 cámaras al identificarse una ausencia completa o parcial del septum primum y una inserción septal anómala de las válvulas AV (inserción en línea). El diagnóstico antenatal de los defectos tipo septum secundum son extremadamente infrecuentes28.
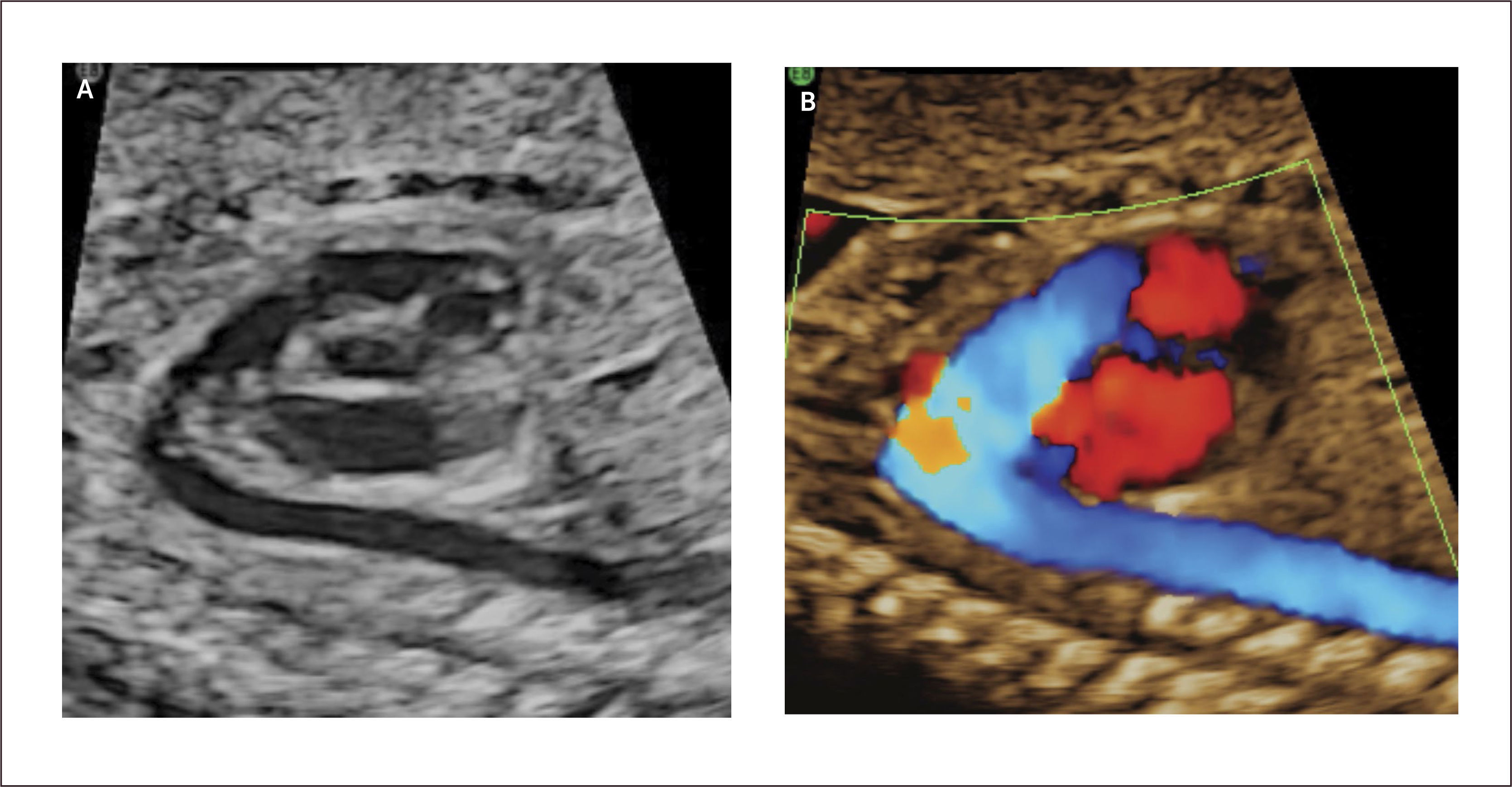
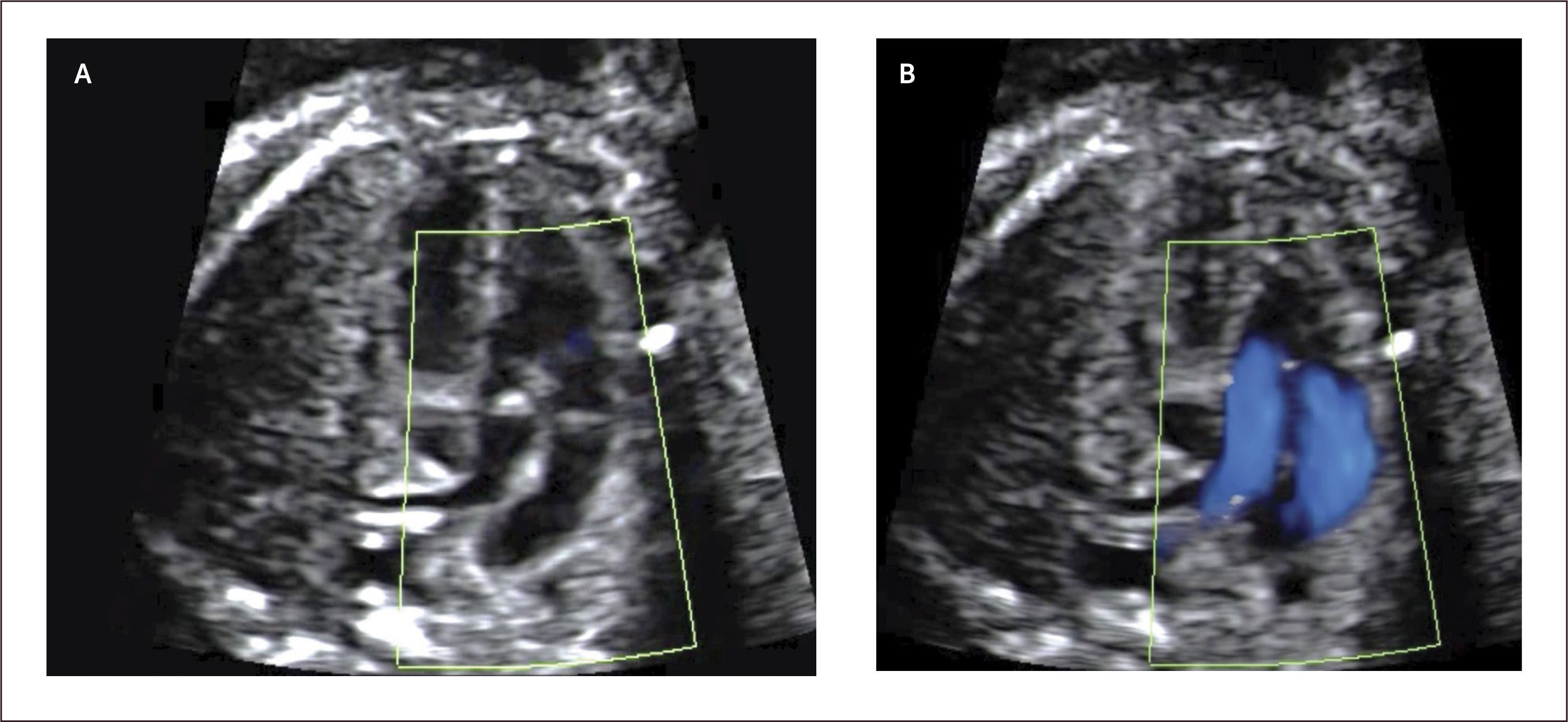
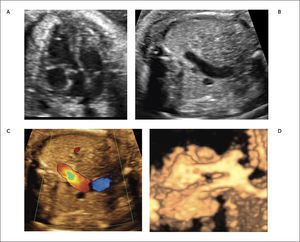
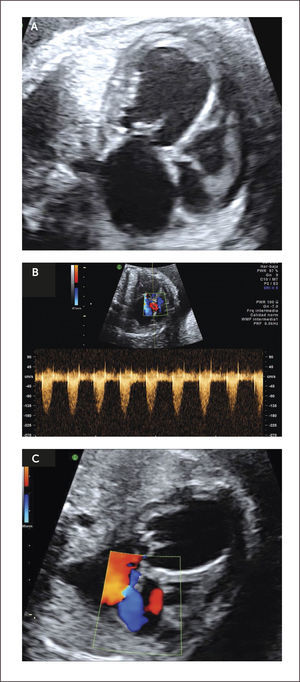
Defectos septales ventriculares. La comunicación interventricular (CIV) es frecuentemente diagnosticada en el neonato al igual que en el feto, con una incidencia estimada de 0.38/1000 recién nacidos vivos29. Son clasificados de acuerdo a su ubicación en subpulmonar, perimembranoso (Figura 14a), que son los más frecuentes (80%) y están ubicados bajo la válvula aórtica; en el tracto de entrada del ventrículo derecho y, por tanto, pueden comprometer la inserción de las cuerdas tendinosas de la válvula tricúspide; y trabecular, localizado en la porción muscular del septum. Estos defectos son generalmente asintomáticos en la vida intrauterina y neonatal.
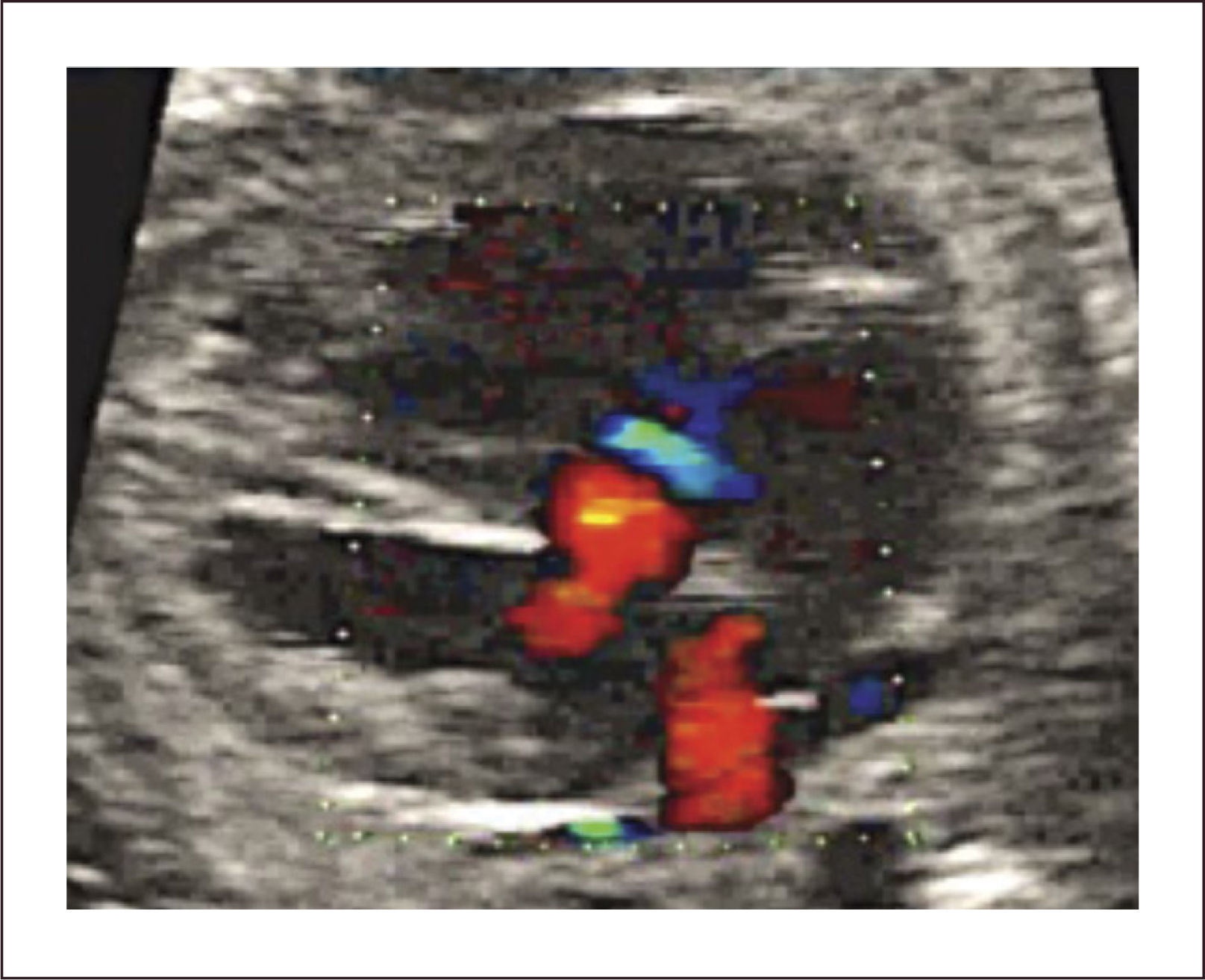
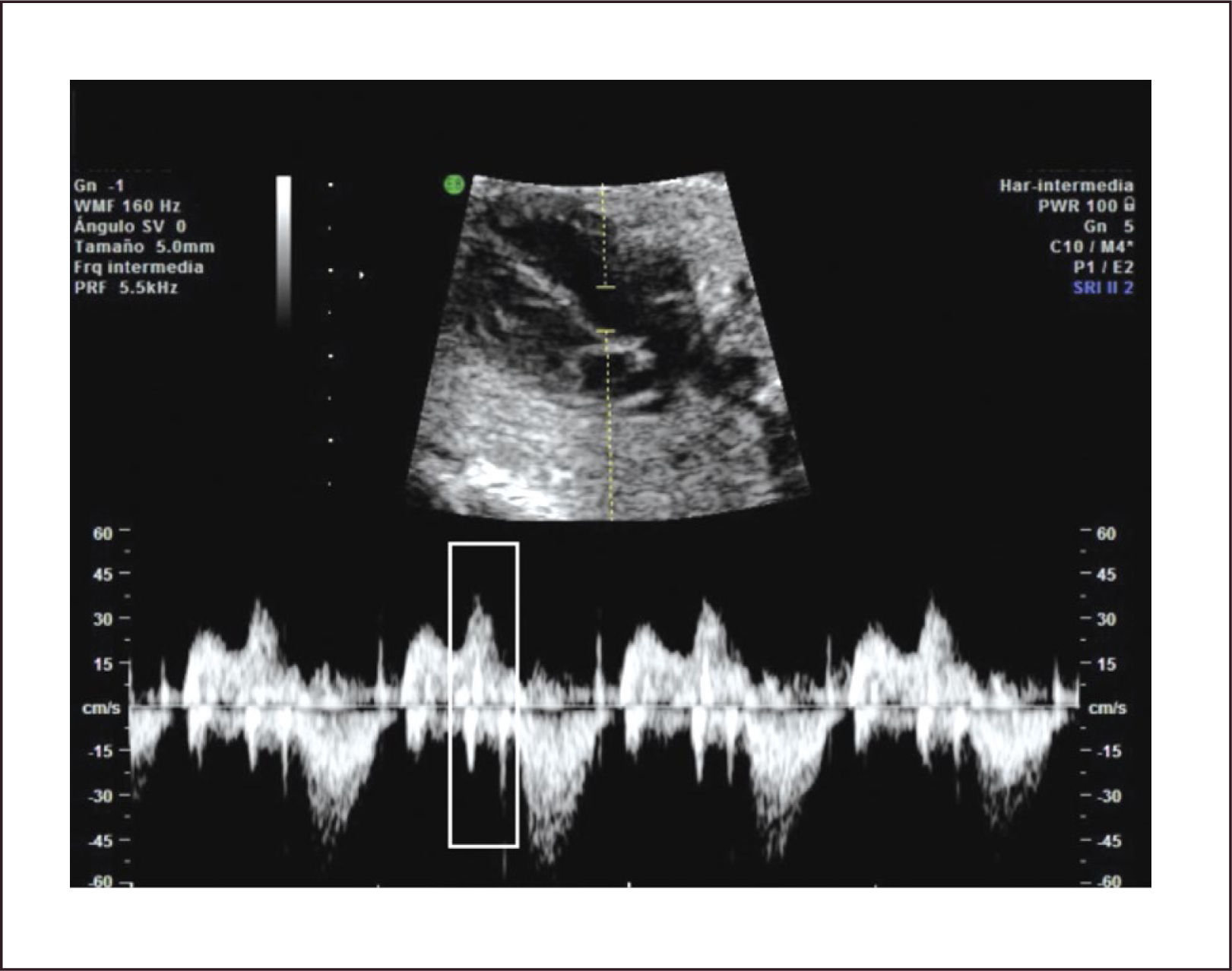
El diagnóstico antenatal está basado en la identificación de un defecto del septum interventricular, con modo B30 que tiene una sensibilidad limitada la que mejora significativamente utilizando Doppler color o de amplitud (Figura 14b). La mayoría de los defectos se pueden visualizar en el corte de cuatro cámaras y el corte de 5 cámaras ayuda para identificar las comunicaciones interventriculares perimembranosas de salida y definir el grado de cabalgamiento de la aorta sobre la parte superior del tabique interventricular. La presencia de un flujo bidireccional por el defecto nos indica que existe un gradiente de presiones relativamente similares entre ambos ventrículos30. La presencia de flujo unidireccional indica la existencia de una malformación en los tractos de salida. Debemos tener en cuenta que para una visualización adecuada con modo B o Doppler color debemos realizar una aproximación lateral y recorrer el septum en toda su extensión, en busca de la zona con defecto. El eje corto también ayuda a corroborar la localización más específica de la comunicación. (Figura 14c). La visualización de los defectos en 3D también es posible y evidencia la condición espacial de los defectos (Figura 14d). La CIV en vida fetal tiene una asociación a otras malformaciones (especialmente otras cardiopatías CC), a cromosomopatías (mayor riesgo de en CIV perimembranosas) y a síndromes génicos. Ante el hallazgo prenatal de CIV se debe realizar un estudio anatómico detallado, una ecografía avanzada y en función de los hallazgos sugerir un cariotipo. Se sugiere seguimiento ecográfico cada 4-6 semanas para evaluar el tamaño y flujo a nivel del defecto, así como la potencial aparición de alguna otra CC.
El pronóstico de una CIV aislada se puede considerar excelente y existe una alta probabilidad de cierre espontáneo del defecto (especialmente para CIV pequeñas musculares), las CIV de mayor tamaño pueden requerir tratamiento médico si son sintomáticas y eventualmente cirugía durante el primer año de vida28.
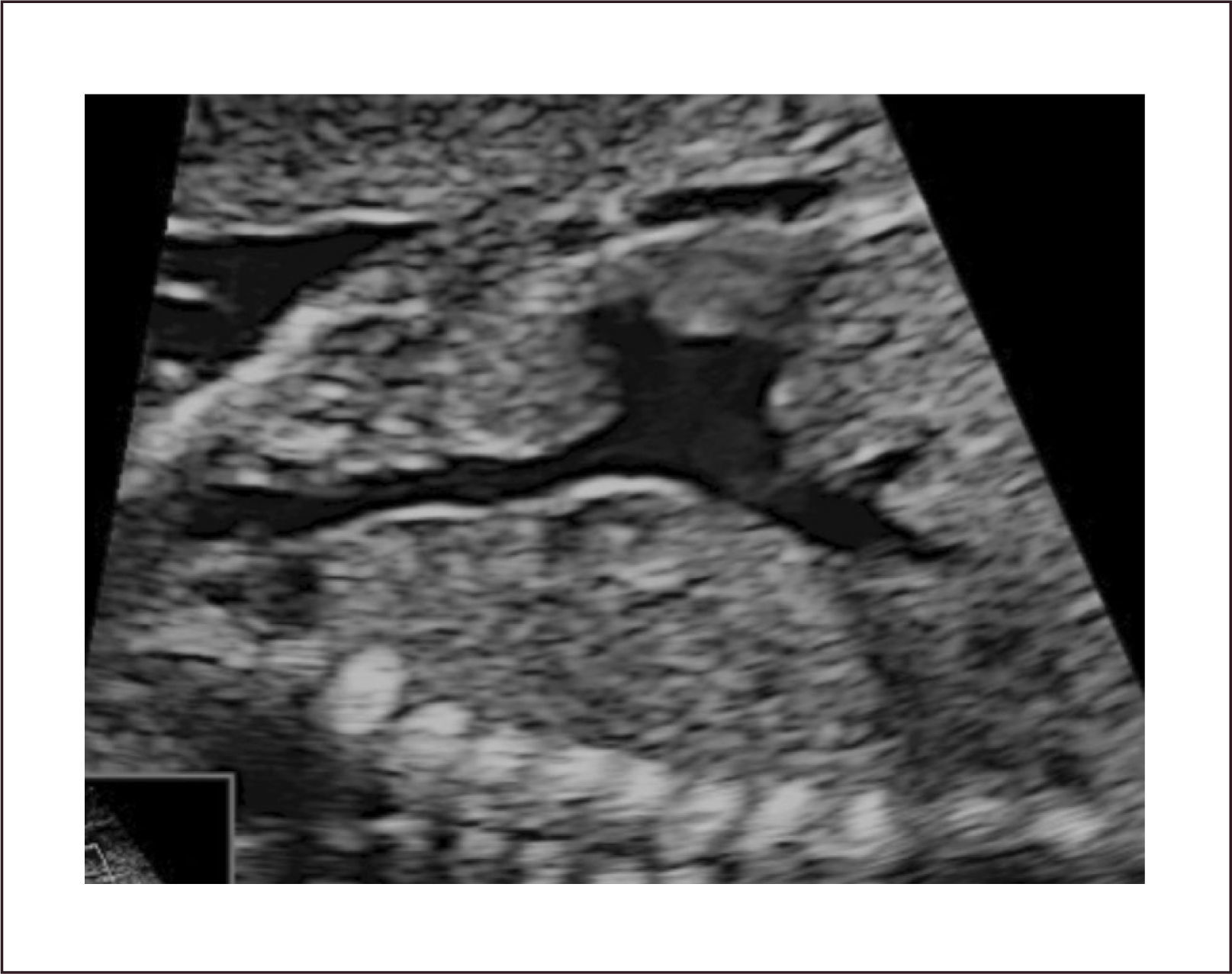
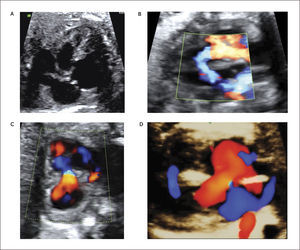
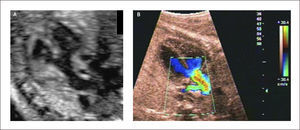
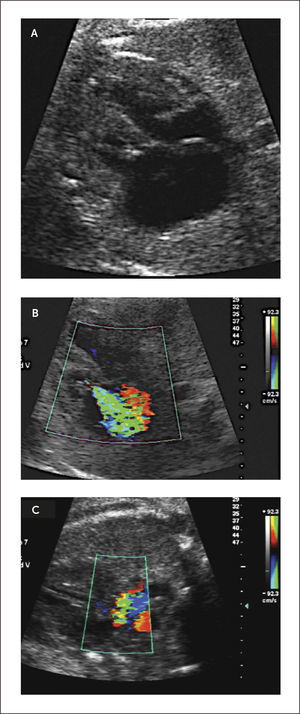
Canal Atrio-ventricular. El canal atrio-ventricular está asociado a un deficiente desarrollo de los cojinetes endocárdicos y corresponde a un defecto del septum atrio-ventricular asociado a defectos del septum interauricular del tipo septum primum y un defecto interventricular alto, sumado a válvulas aurículo-ventriculares desplazadas hacia el ápex a un mismo nivel y la válvula aórtica es más alta y el tracto de salida izquierdo es más largo. Su incidencia es de 0.12 por 1000 recién nacidos vivos29. La asociación de esta patología con Trisomía 21ha sido descrita más del 50% de los casos31.
Son clasificados en parciales o completos de acuerdo al compromiso de los septum interauricular, ventricular o ambos. Y de acuerdo al tamaño de los ventrículos se clasifican en bien compartidos (o balanceado), de preponderancia izquierda o derecha. Los defectos más severos pueden estar asociados a alteraciones del ritmo del tipo bloqueo A-V.
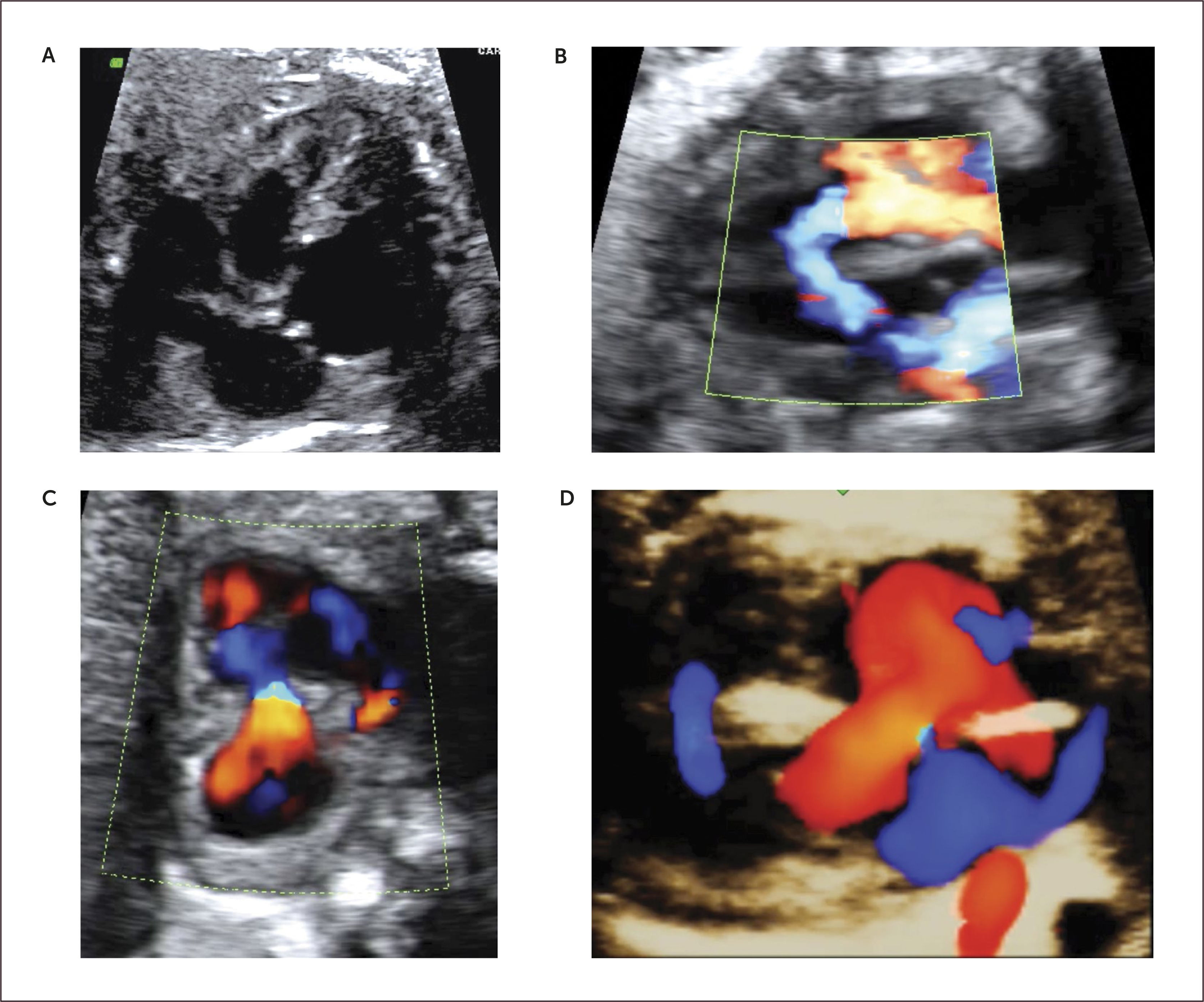
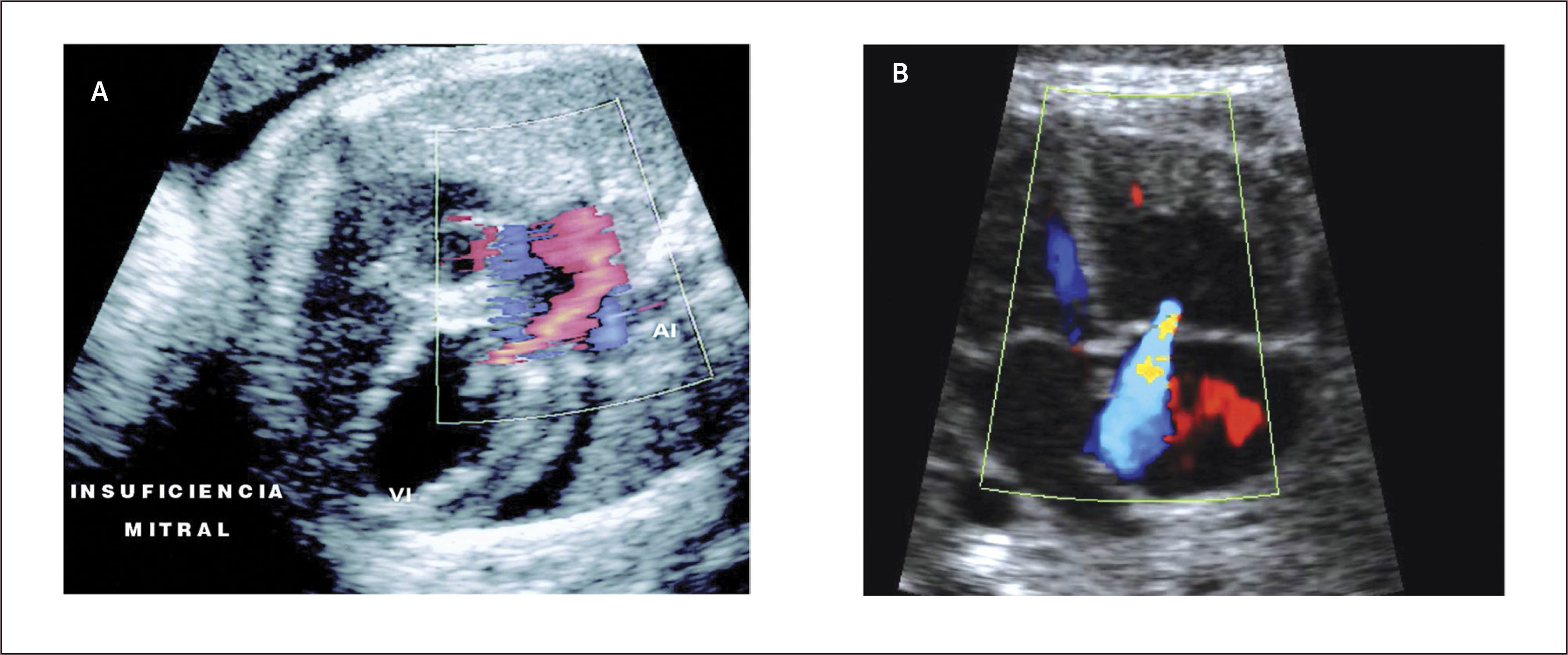
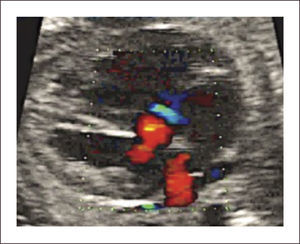
En el examen observamos un defecto auricular y/o defecto ventricular con una válvula AV única o al menos al mismo nivel (Figura 15 a,b). Con Doppler color de esta válvula, se revela generalmente la existencia de una válvula insuficiente (Figura 15c). Las imágenes 3D en superficie nos permiten visualizar la extensión del defecto y además nos permiten examinar la arquitectura de la válvula aurícula ventricular (Figura 15d).
Generalmente no presentan alteraciones hemodinámicas in útero, pero, en los casos severos, la insuficiencia valvular puede producir falla cardíaca.
Por lo que el objetivo del diagnóstico prenatal de este defecto consiste en:
- 1.
Identificar el canal AV y grado de extensión.
- 2.
Evaluar la relación de la válvula AV común con los ventrículos.
- 3.
Evaluar el tamaño ventricular.
- 4.
Evaluar el grado de insuficiencia de la válvula AV común.
- 5.
Identificar anomalías asociadas.
En la mayoría de los casos con canal AV se podrá realizar una corrección quirúrgica completa. Sin embargo las complicaciones posoperatorias y la necesidad de reintervención no son infrecuentes (10-25%)28.
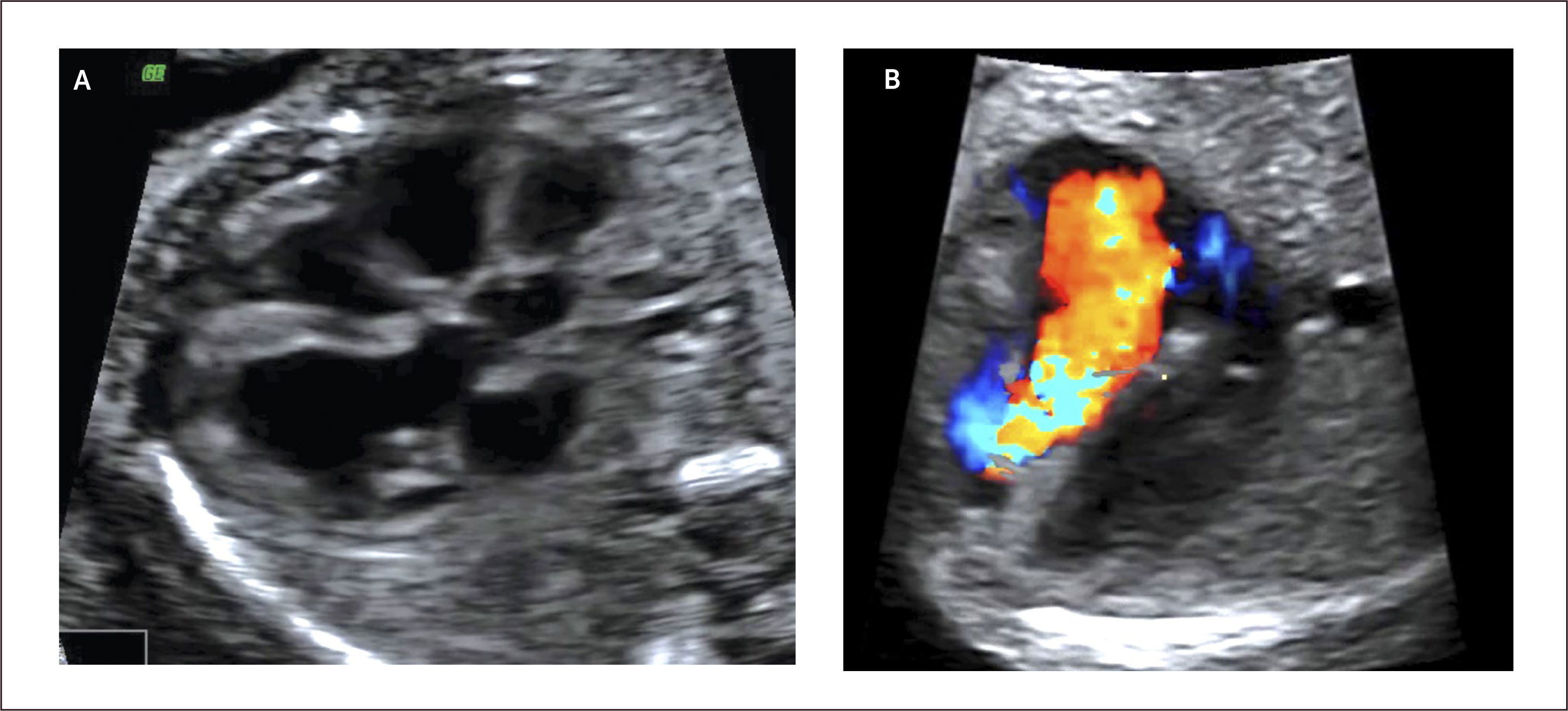
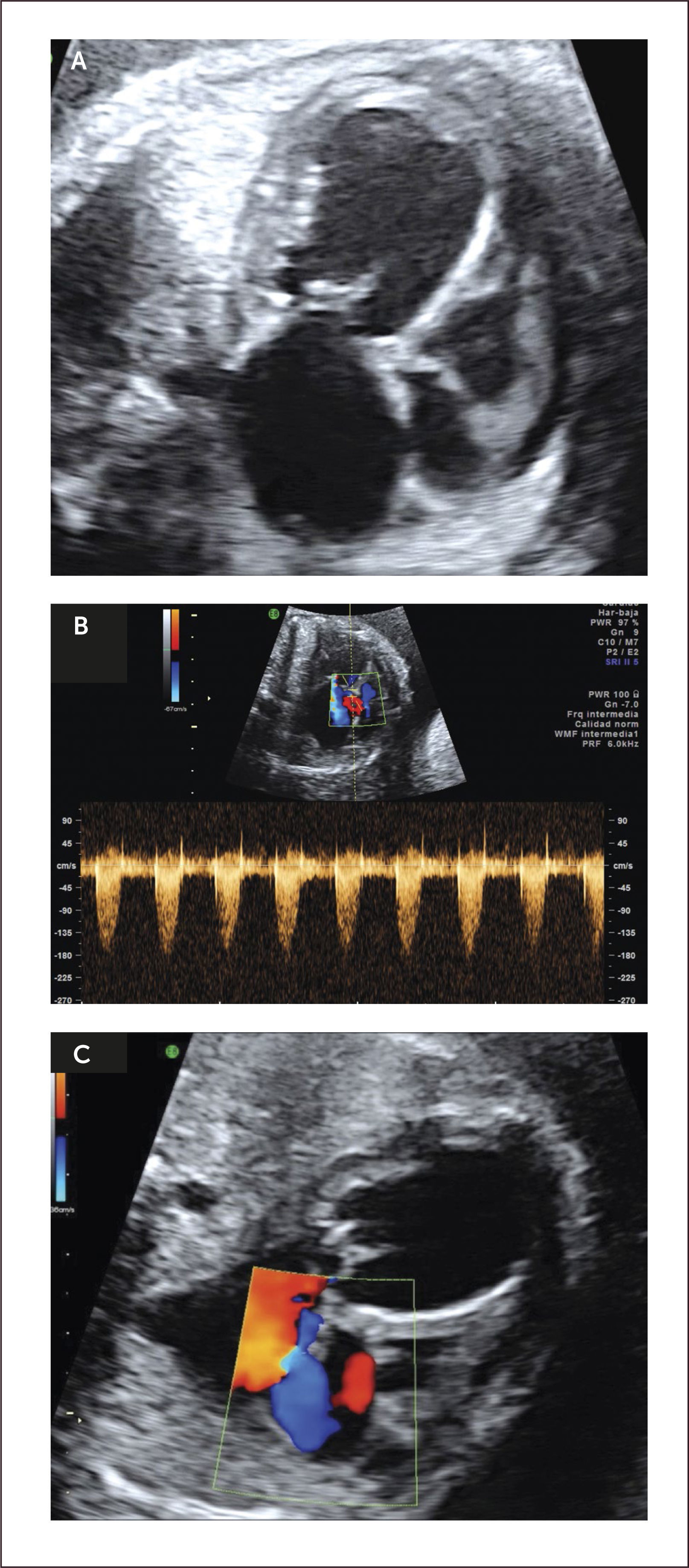
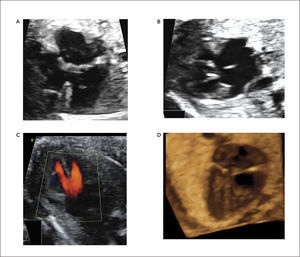
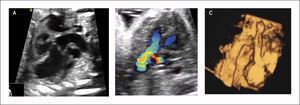
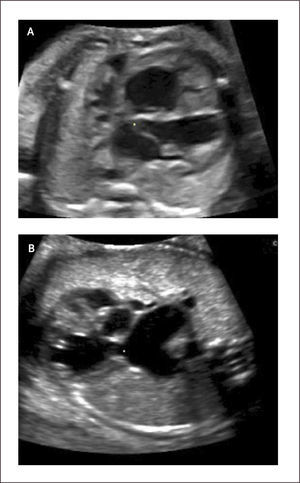
Síndrome de hipoplasia de corazón izquierdo (SHVI). El síndrome de hipoplasia de corazón izquierdo se caracteriza por un ventrículo izquierdo pequeño secundario a una atresia de la válvula mitral o aórtica. Se describen dos formas clásicas de SHVI que son la atresia mitro-aórtica y la atresia aórtica con o sin estenosis mitral primaria asociada. El flujo hacia el cuello, cabeza y coronarias se realiza vía ductus arterioso en forma retrógrada. La incidencia de esta malformación es de 0.16 por 1000 recién nacidos vivos29. Se asocia a insuficiencia cardíaca in útero en aquellos casos con insuficiencia de las válvulas aurículo-ventriculares.
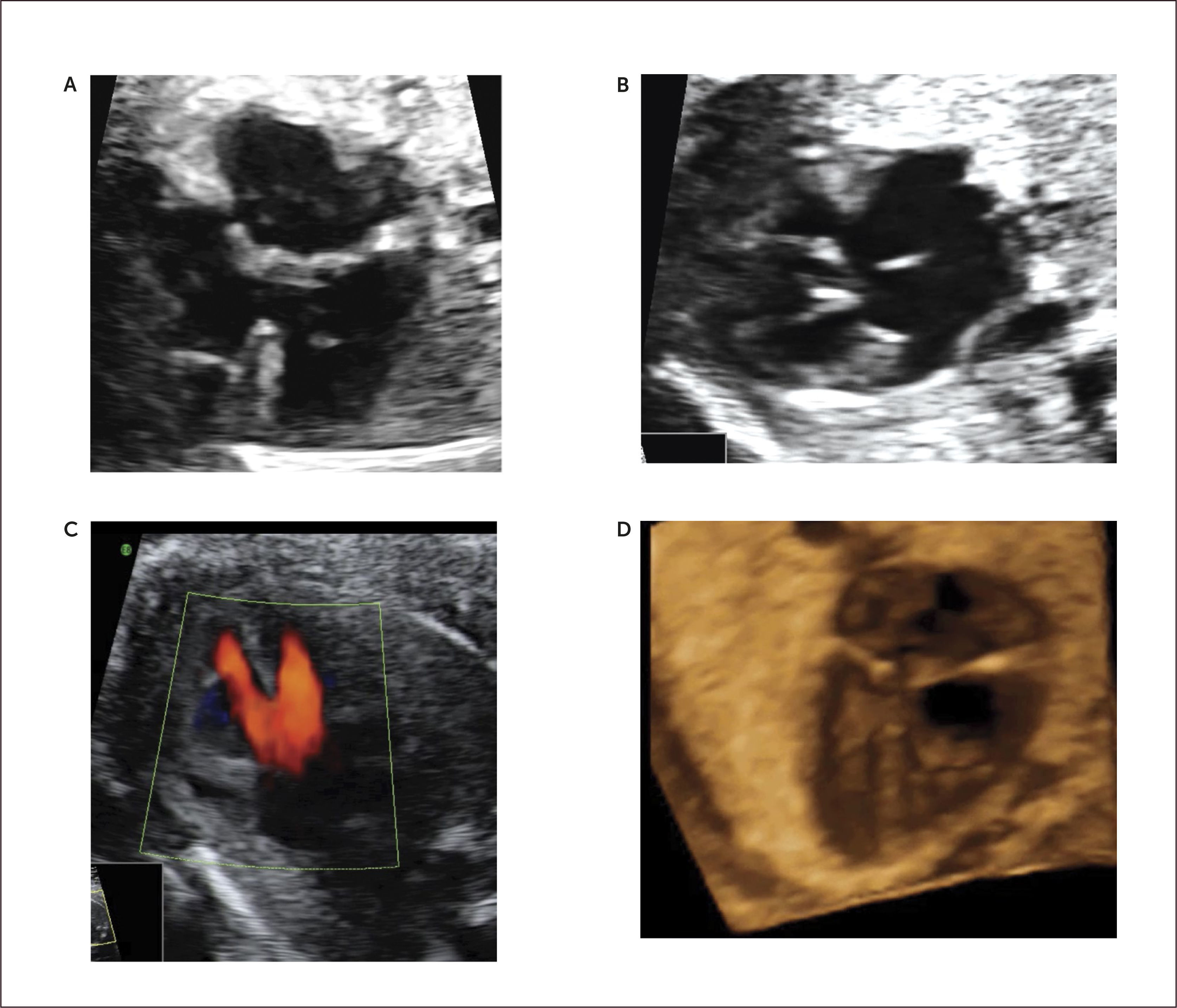
Al examen ecocardiográfico observamos un ventrículo izquierdo disminuido de tamaño32 con flujo de entrada univalvular (Figura 16 a, b), con una aorta ascendente hipoplásica. El corazón derecho (aurícula y ventrículo) y arteria pulmonar están generalmente aumentados de tamaño. Con la técnica de Doppler color es posible demostrar flujo reverso en la aorta ascendente proveniente del ductus arterioso en el plano de arco ductal o más fácilmente en plano de los tres vasos (Figura 16c). Permite además mostrar flujo aurículo ventricular sólo por la válvula tricúspide.
Su asociación con otras malformaciones es alta, principalmente a otras malformaciones cardiacas como la coartación de la aorta, anomalías del retorno venoso o CIV. Las malformaciones extra cardiacas se asocian en un 15-20% de los casos principalmente a alteraciones gastrointestinales, urinarias, del sistema nervioso central y músculo-esqueléticas. La asociación prenatal con cromosomopatías es de un 10% y de ellas la más relacionada es con monosomía 45, X0, trisomía 18, trisomía 13 y algunas deleciones parciales.
El pronóstico es siempre muy ominoso y los recién nacidos mueren en los primeros días de vida. El tratamiento quirúrgico paliativo o trasplante cardíaco representan la única opción de sobrevida33,34.
Es la cardiopatía congénita con mayor mortalidad neonatal, representa el 13-16% del total de las cardiopatías congénitas diagnosticadas de manera prenatal, y postnatal supone el 1-3%, la diferencia radica en la propia mortalidad in utero del SHVI28.
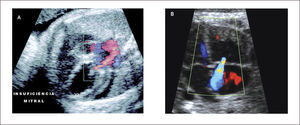
Enfermedad de Ebstein e insuficiencias valvulares. Las insuficiencias valvulares congénitas son muy infrecuentes en el neonato y excepcionalmente diagnosticadas in útero. Las insuficiencias de las válvulas aurículo-ventriculares son más frecuentemente identificadas in utero. Estas pueden ser secundarias a una dilatación del anillo valvular, como ocurre en casos de hidrops fetal, o a una estenosis pulmonar o aórtica (Figura 17 a y b). También ocurren como consecuencia de un defecto primario del aparato valvular, como en los casos de canal atrio-ventricular o en la enfermedad de Ebstein.
La enfermedad de Ebstein se caracteriza por una inserción anómala de las valvas septal y posterior del anillo de la tricúspide en el ventrículo derecho, con un desplazamiento apical de las mismas que condiciona un grado variable de displasia valvular y una atrialización de ventrículo derecho36. La severidad de la enfermedad depende del grado de desplazamiento de la válvula que puede ser mínimo hasta severo. Este desplazamiento del velo produce grados variables de insuficiencia, la que puede provocar una alteración hemodinámica mínima, hasta una gran dilatación de la aurícula derecha con insuficiencia cardíaca.
El diagnóstico se realiza, en los casos severos, por una gran asimetría de las cavidades cardíacas producida por una dilatación de la aurícula derecha y el desplazamiento apical del velo valvular tricuspídeo que provoca atrialización de un segmento variable del ventrículo derecho (Figura 18a). La evaluación con Doppler color revela una insuficiencia aurículo-ventricular masiva (Figura 18b).
El pronóstico de la enfermedad de Ebstein depende del grado de severidad de la lesión, pudiendo requerir sólo terapia médica en los casos más leves, siendo, en los casos severos, irremediablemente letal36. La anomalía de Ebstein es una de las pocas CC que puede causar una disfunción cardiaca in utero, con cardiomegalia severa, hidrops fetal y taquiarritmias, por lo que deben realizarse controles periódicos cada 2-4 semanas para monitorizar la evolución debiendo prestar especial atención al tamaño de la aurícula derecha y la severidad de la insuficiencia tricuspídea, así como el grado de cortocircuito a través del foramen oval.
Alteración de los tractos de salidaDefectos conotruncalesEs un grupo heterogéneo de malformaciones que comprometen la región conotroncal y parte de los ventrículos. Corresponden al 20 a 30% de las cardiopatías congénitas29. En general son bien toleradas in utero, pero en la vida extrauterina corresponden a la principal causa de cianosis de origen cardíaco. El diagnóstico prenatal de este grupo de malformaciones generalmente presenta una imagen de cuatro cámaras normal y requiere un examen detallado de los tractos de salida, idealmente utilizando Doppler color. Tienen también una alta asociación con la micro deleción del 22q 11, de hasta 50%37.
Tetralogía de Fallot. Es la CC conotruncal más frecuente y la primera causa de cianosis durante la infancia por CC. Posnatalmente representa 8-12% del total de las CC. Tiene una prevalencia de 1 de cada 1000-2000 recién nacidos vivos, sin embargo, la tasa de detección prenatal es baja, representando únicamente el 3-7% de las CC diagnosticadas prenatalmente28. Los defectos presentes en la Tetralogía de Fallot son: comunicación interventricular, estenosis pulmonar infundibular, aorta que cabalga sobre el septum interventricular e hipertrofia del ventrículo derecho38. La Tetralogía de Fallot puede estar asociada a otras malformaciones cardíacas. El seguimiento de los casos con Tetralogía de Fallot diagnosticados in utero ha permitido comprobar que la hipertrofia del ventrículo derecho está siempre ausente en el período fetal y que se desarrolla después del nacimiento39.
Frecuentemente el corte de 4 cámaras se observa normal, tal vez con discreta desviación del eje cardiaco a la izquierda, el diagnóstico ecocardiográfico de la Tetralogía de Fallot se realiza identificando en el corte de 5 cámaras un defecto interventricular, generalmente perimembranosos, y de la arteria aorta que cabalga sobre el septum interventricular38 (Figura 19a). La velocimetría Doppler color es de gran utilidad en el diagnóstico del defecto del septum interventricular y en la evaluación del flujo por la arteria pulmonar, de gran importancia en la evaluación de la severidad y pronóstico de la Tetralogía de Fallot (Figura 19b). Es importante visualizar los tractos de salida de las grandes arterias y observar que estén bien relacionados y cruzados, lo que ayuda a realizar el diagnóstico diferencial con otras CC. En el corte de tres vasos tráquea se suele dar el diagnóstico diferencial de la tetralogía de Fallot con estenosis, atresia o ausencia de la válvula pulmonar. El grado de estenosis pulmonar puede ser evolutivo durante la gestación, incluso hasta el grado de atresia.
De las tetralogía de Fallot diagnosticadas de manera prenatal el 30-40% de los casos se asocia con alteraciones cromosómicas, y la relación 22q11p- es más prevalente en los casos severos28.
En términos generales tiene buen pronóstico, y requiere una cirugía reparadora con muy buenos resultados con sobrevidas superiores al 90% a los 20 años38. En los casos complejos asociados a atresia de la válvula pulmonar el pronóstico es reservado.
Tronco arterioso. Tiene una prevalencia de 1 a 2 en 10000 recién nacidos vivos y corresponde a cerca del 10% de las anomalías conotroncales. Se asocia en cerca de un 20% con aneuploidía29. Se clasifica en cuatro tipos de acuerdo al modo de emergencia de las arterias pulmonares, existiendo la clasificación de Collet y Edwards y la clasificación de Van Praagh40.
En el diagnóstico prenatal observamos una arteria única o tracto de salida único de gran tamaño que sale del corazón y de la cual se origina las arterias pulmonar y aorta. Este tronco es de mayor diámetro que la aorta normal y cabalga sobre el septum interventricular (Figura 20a). La velocimetría Doppler color y ecografía 3D nos permite una identificación precisa de la división del tronco común (Figura 20b y c). La válvula truncal generalmente es displásica. Al corte de tres vasos tráquea se observan únicamente dos vasos (el tronco común y la VCS). El diagnóstico diferencial se realiza con Tetralogía de Fallot y atresia pulmonar.
Tiene una elevada asociación a anomalías cromosómicas y estructurales, así como a otras anomalías cardiacas. El riesgo de hidrops ocurre sólo en caso de insuficiencia severa de la válvula truncal28.
No hay compromiso hemodinámico durante la vida fetal. Desde el punto de vista hemodinámico no es una cardiopatía ductus dependiente, pero sin embargo, el recién nacido cae en insuficiencia cardiaca en las primeras semanas de vida. Por lo tanto, requiere corrección quirúrgica en el recién nacido. Si el tronco arterioso es aislado, el pronóstico posquirúrgico es bueno, con supervivencia a largo plazo alrededor del 80%, la tasa de re-intervenciones es alta, principalmente por disfunción de la conexión entre el ventrículo derecho y la arteria pulmonar28.
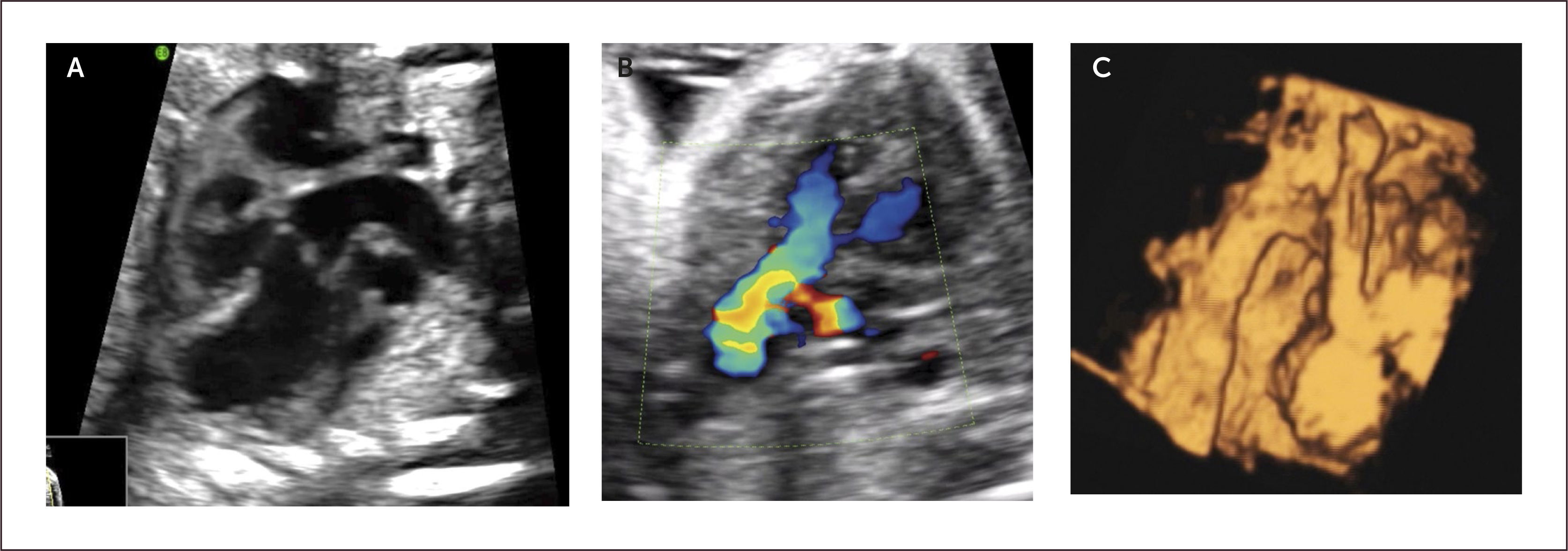
Transposición de los grandes vasos (TGV). La transposición de los grandes vasos tiene una incidencia de 2 por 10000 recién nacidos vivos29 y en el 50% de los casos presenta otras anomalías cardíacas asociadas siendo las comunicaciones interventriculares las más frecuentes. La TGV es una de las CC que más frecuentemente pasa desapercibida en la vida prenatal, con una tasa diagnóstica que no supera el 20%. Se clasifica en transposición completa y corregida. La forma completa se caracteriza por una concordancia atrio-ventricular con una discordancia ventrículo-arterial. De esta forma la arteria aorta sale desde el ventrículo derecho y la arteria pulmonar desde el ventrículo izquierdo. De acuerdo a Becker y Anderson41 tres son las variantes: TGV con septum interventricular indemne (con o sin estenosis pulmonar); TGV con comunicación interventricular; TGV con comunicación interventricular y estenosis pulmonar.
La transposición corregida de los grandes vasos involucra una discordancia atrio-ventricular y ventrículo-arterial. La aurícula derecha está conectada al ventrículo izquierdo y éste conectado a la arteria pulmonar. La aurícula izquierda conectada al ventrículo derecho y éste a la arteria aorta.
El examen ecocardiográfico de ambas formas de TGV demuestra a los dos grandes vasos saliendo en forma paralela de la base del corazón, y aorta desde el ventrículo derecho y arteria pulmonar desde el ventrículo izquierdo (Figura 21a). En el plano de los tres vasos observamos sólo aorta en una gran extensión y vena cava superior, ya que la arteria pulmonar está más posterior y baja (Figura 21b)42. El ultrasonido 3D Doppler color, nos permite una orientación volumétrica de la alteración de los vasos de salida (Figura 21c). La identificación de la concordancia atrio-ventricular debe ser realizada por los reparos anatómicos de los ventrículos (banda moderadora, inserción de los velos valvulares, etc.)
In utero ambos tipos de TGV no presentan alteraciones hemodinámicas a menos que presenten otra anomalía cardíaca mayor asociada. Los recién nacidos con TGV completa dependen de la persistencia de la circulación fetal ya sea por el ductus arterioso o por el foramen oval para su supervivencia. En los casos de TGV corregida las alteraciones hemodinámicas no existen ya que la sangre de la aurícula derecha sale finalmente por la arteria pulmonar y la de la aurícula izquierda por la arteria aorta.
Desde el punto de vista hemodinámico no presenta alteraciones en la vida fetal, pero en el recién nacido la dependencia ductal es total. Requiere cirugía correctora con sobrevida superior al 90%.
Doble tracto de salida del ventrículo derecho. La incidencia de esta malformación es de 1 por 10000 recién nacidos vivos29, y corresponde a un tercio de las anomalías conotruncales. La estenosis de la arteria pulmonar es la malformación más frecuentemente asociada, sin embargo es posible encontrar también estenosis de la arteria aorta43. En el doble tracto de salida del ventrículo derecho las válvulas aórtica y pulmonar salen completa o mayoritariamente del ventrículo derecho y siempre está presente una comunicación interventricular. La relación de los vasos puede variar y por tanto puede estar asociada a Tetralogía de Fallot, Transposición de los grandes vasos o ventrículo único.
Esta CC tiene una alta asociación a anomalías cromosómicas y estructurales, cardiacas y extra cardiacas.
En el examen ecocardiográfico destaca cuatro cámaras normal con CIV peri membranosa de salida mal alineada sobre el tabique interventricular (el grado de cabalgamiento es superior al 50%), y en la visión de tractos de salida ambos vasos salen desde el ventrículo derecho (Figura 22a). El Doppler color nos permite visualizar la relación de los grandes con el ventrículos derecho y la presencia o no de insuficiencias o estenosis (Figura 22b).
Las alteraciones hemodinámicas del doble tracto de salida del ventrículo derecho dependen de la malformación asociada. Sin embargo en el recién nacido es también dependiente de la persistencia del ductus arterioso, y requiere corrección quirúrgica, las tasas de sobrevida superan el 80% generalmente.
Lesiones valvularesEstenosis aórtica. Esta malformación tiene una incidencia de 0.4 por 10000 recién nacidos vivos y es clasificada en: valvular (60-75%), supravalvular (8-20%) y subvalvular29. La forma subvalvular puede ser de tipo fijo, a consecuencia de una obstrucción fibrosa o fibromuscular, o de tipo dinámico con obstrucción del tracto de salida por engrosamiento del septum interventricular (como en el caso de hijos de madres diabéticas)41. Se estima que hasta un 1.3% de la población puede tener válvula aórtica bicúspide.
Dependiendo del grado de severidad de la obstrucción valvular, la alteración hemodinámica asociada provoca una dilatación del ventrículo izquierdo y, en los casos más severos, la sobrecarga del ventrículo puede provocar una isquemia sub endocardiaca y deteriorar la función cardíaca y ser responsable de la fibroelastosis sub endocárdica, característica de esta lesión. Existe una gran asociación de esta enfermedad con retardo de crecimiento intrauterino debido, probablemente, a las alteraciones hemodinámicas descritas.
En el examen ecocardiográfico podemos observar un ventrículo izquierdo dilatado, de paredes gruesas, endocardio ecorrefringente, arteria aorta disminuida de diámetro con velocidades aumentadas y flujo turbulento, asociado a insuficiencia mitral y flujo reverso por el foramen ovale (Figura 23 a, b, c).
La estenosis del tipo supra valvular y sub aórtica por lo general no provocan sintomatología en el recién nacido o en el feto. El diagnóstico prenatal es vital en esta CC porque permite la transferencia neonatal o programar el nacimiento en un centro de tercer nivel. En algunos casos, se ha sugerido el intervencionismo cardiaco fetal, sin embargo, queda reservado para los casos más severos y que cumplan con los criterios establecidos con el fin de poder ofrecer al recién nacido estrategias terapéuticas más favorables (posibilidad de desarrollo de circulación bi ventricular)44.
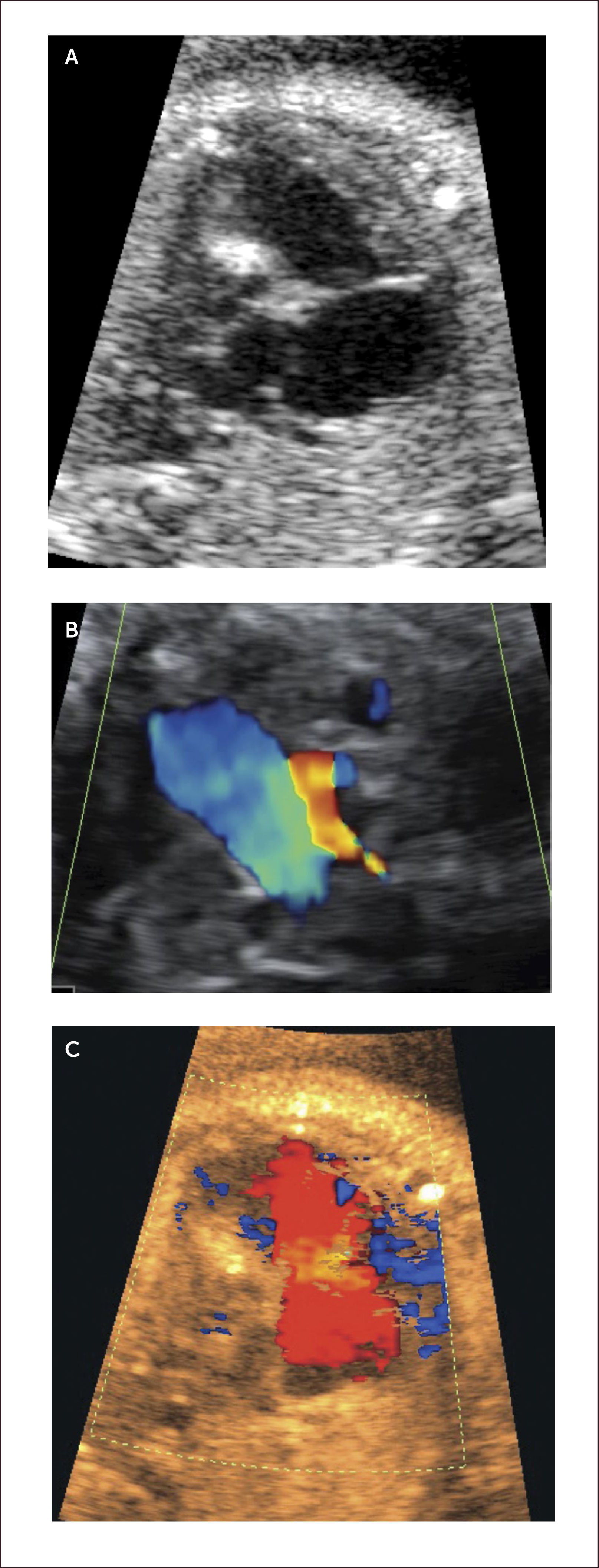
Estenosis pulmonar. Representa el 2 al 5% de las cardiopatías congénitas. La más común de las formas de estenosis pulmonar es la valvular debido a la fusión de los velos. Las alteraciones hemodinámicas, al igual que en la estenosis aórtica, dependen del grado de severidad de la lesión. La obstrucción al flujo impone una sobrecarga del ventrículo derecho y provoca una dilatación de éste; y, en los casos más severos, regurgitación tricuspídea y dilatación de la aurícula derecha, pudiendo llegar a una insuficiencia cardíaca45 (Figura 24 a, b).
Al nacer, el flujo pulmonar es dependiente de la permeabilidad del ductus arterioso y de la severidad de la estenosis. En los casos de estenosis leve y moderada no existe una obstrucción severa la flujo, a diferencia de los casos severos, especialmente con septum intacto donde el flujo pulmonar está severamente restringido, y por tanto la cirugía neonatal es urgente, ya sea con balón o cirugía abierta46.
En las formas leves-moderadas, existe poca expresividad ecográfica, el corte de 4 cámaras se observa prácticamente normal, la aurícula derecha puede encontrarse discretamente dilatada, llama la atención una válvula pulmonar displásica, engrosada, hiperecogénica e hipoquinética, puede haber una dilatación post estenótica del tronco pulmonar, con flujo turbulento a través del anillo pulmonar, con aceleración del pico sistólico de la pulmonar. En cuanto a las formas severas su comportamiento dependerá del comportamiento de la válvula tricúspide pero en general es similar al de la atresia pulmonar con septum íntegro que se aboradará más adelante.
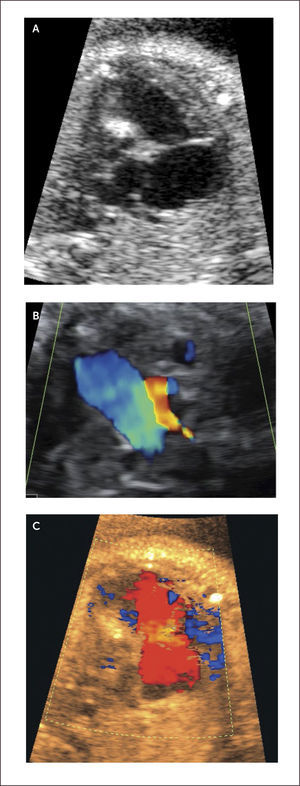
Agenesia de la válvula pulmonar. Es una infrecuente malformación y consiste en la ausencia o existencia de una rudimentaria válvula pulmonar, y generalmente coexisten insuficiencias severas y grados variables de estenosis47. Se asocia en gran cantidad de los caso a Tetralogía de Fallot, malformaciones extra cardícas y alteraciones cromosómicas o microdeleciones del 22q11 en el 25% de los casos48. Desde el punto de vista hemodinámico produce una gran regurgitación desde la arteria pulmonar al ventrículo derecho lo que produce sobrecarga con dilatación e hipertrofia secundaria (Figura 25a, b). Esta sobrecarga ventricular produce aumento del volumen diastólico final y del volumen de eyección, lo que produce una gran dilatación de la arteria pulmonar y sus ramas (Figura 25 b). Esta dilatación de la pulmonar y sus ramas produce compresión y broncomalasia secundaria de los bronquios principales48. Debido a estos fenómenos y a la asociación con otras malformaciones su letalidad es muy elevada48.
Síndromes cardioesplénicos. En estos síndromes, el feto tiene dos lados derechos. Constituyen los llamados isomerismos izquierdos o derechos, o asplenia poliesplenia.
La poliesplenia es definida también como isomerismo izquierdo. El estómago y la aorta están en el lado derecho del feto. Las anomalías cardíacas asociadas incluyen: interrupción de la vena cava inferior con retorno vía ácigos (75%), retorno venoso anómalo parcial, cava superior bilateral, transposición de grandes vasos o doble tracto de salida, defectos septales variados, y estenosis de la arteria aorta49–51. Generalmente hay varios bazos, a veces bilaterales, siendo muy difícil visualizarlos in utero. El hígado es generalmente central y tiene lóbulos simétricos.
La metodología más utilizada para la identificación de estos segmentos se basa en el análisis segmentario del corazón. Esto consiste en analizar las aurículas, ventrículos, arterias y sus relaciones51.
En nuestros casos el hallazgo más frecuente, ha sido la ausencia de vena cava inferior con retorno vía vena ácigos que se observa, con Doppler color, en el tórax posterior a la arteria aorta en los planos axial y coronal (Figura 26 a y b).
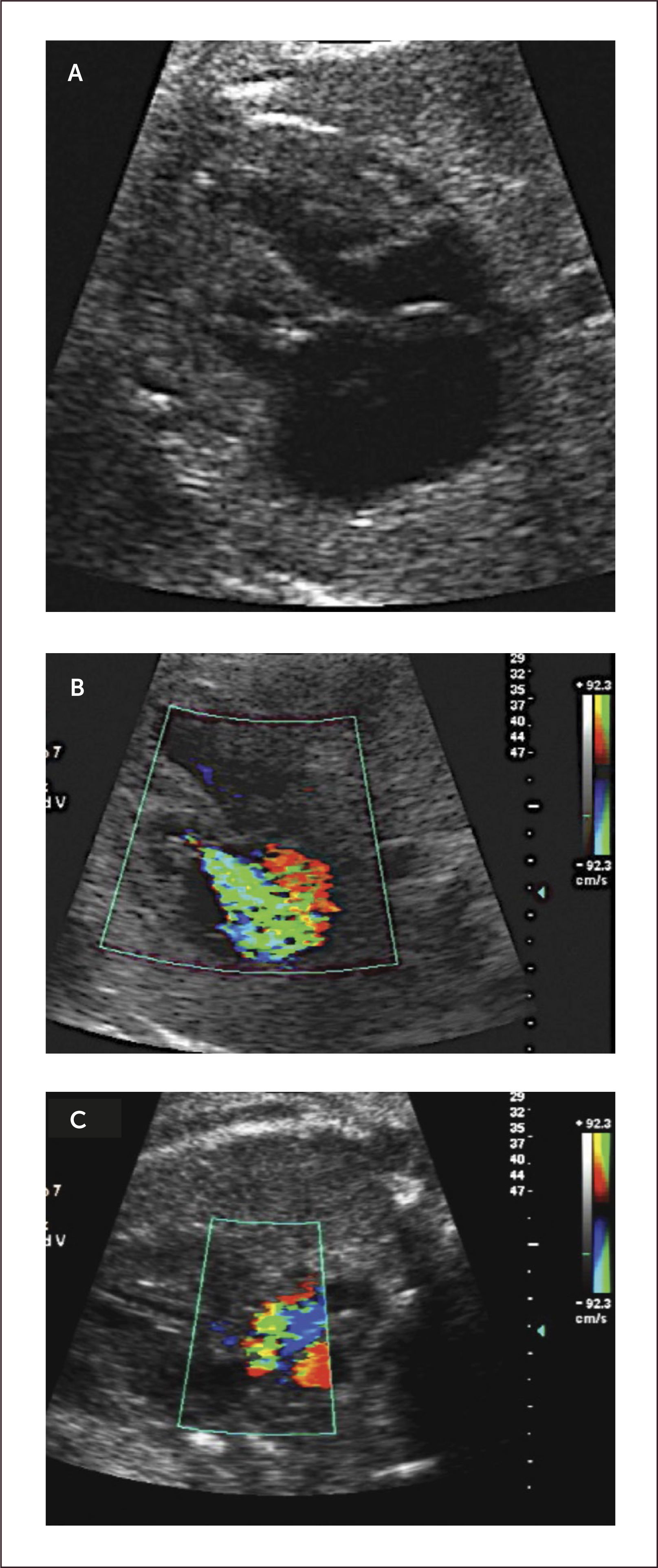
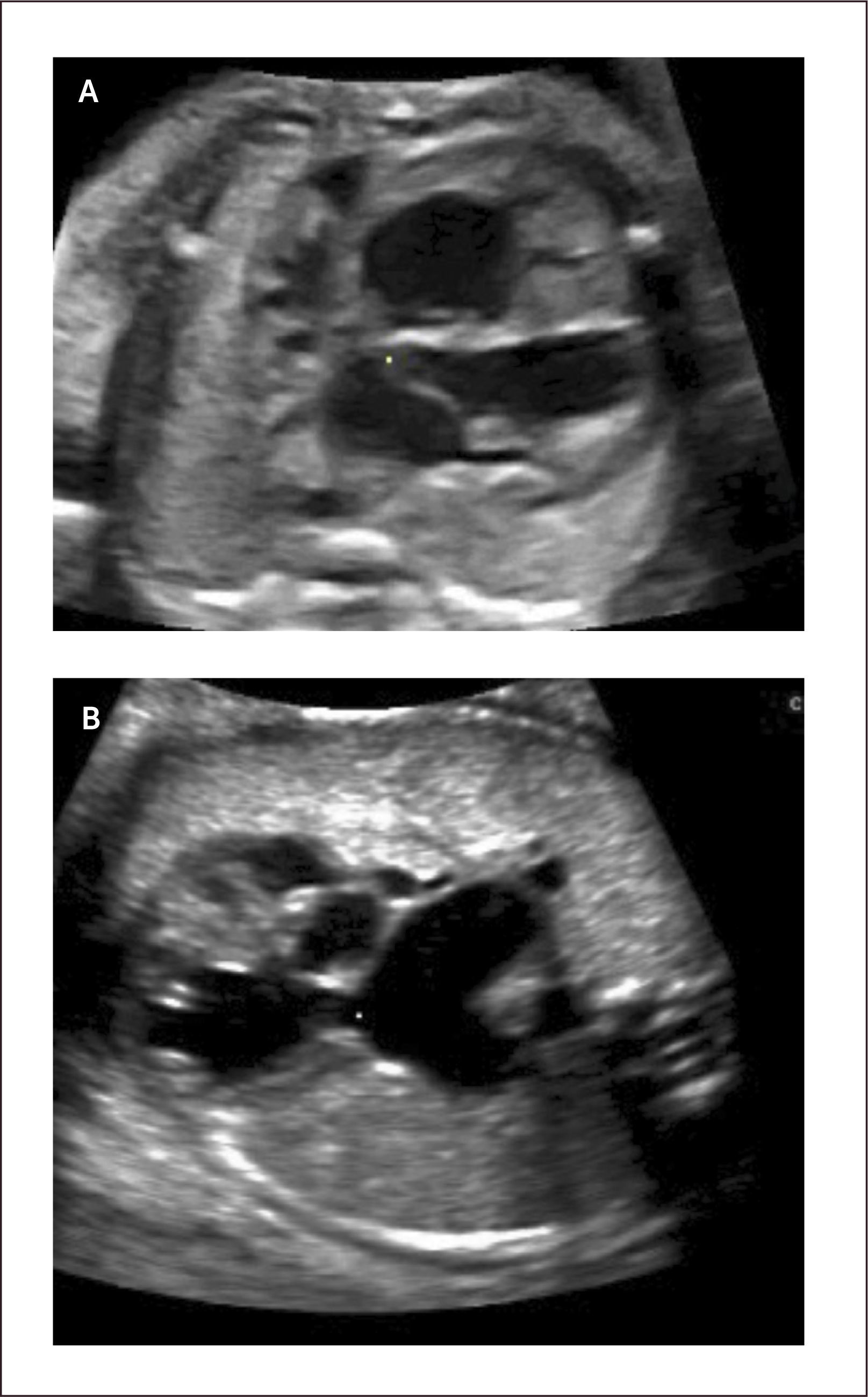
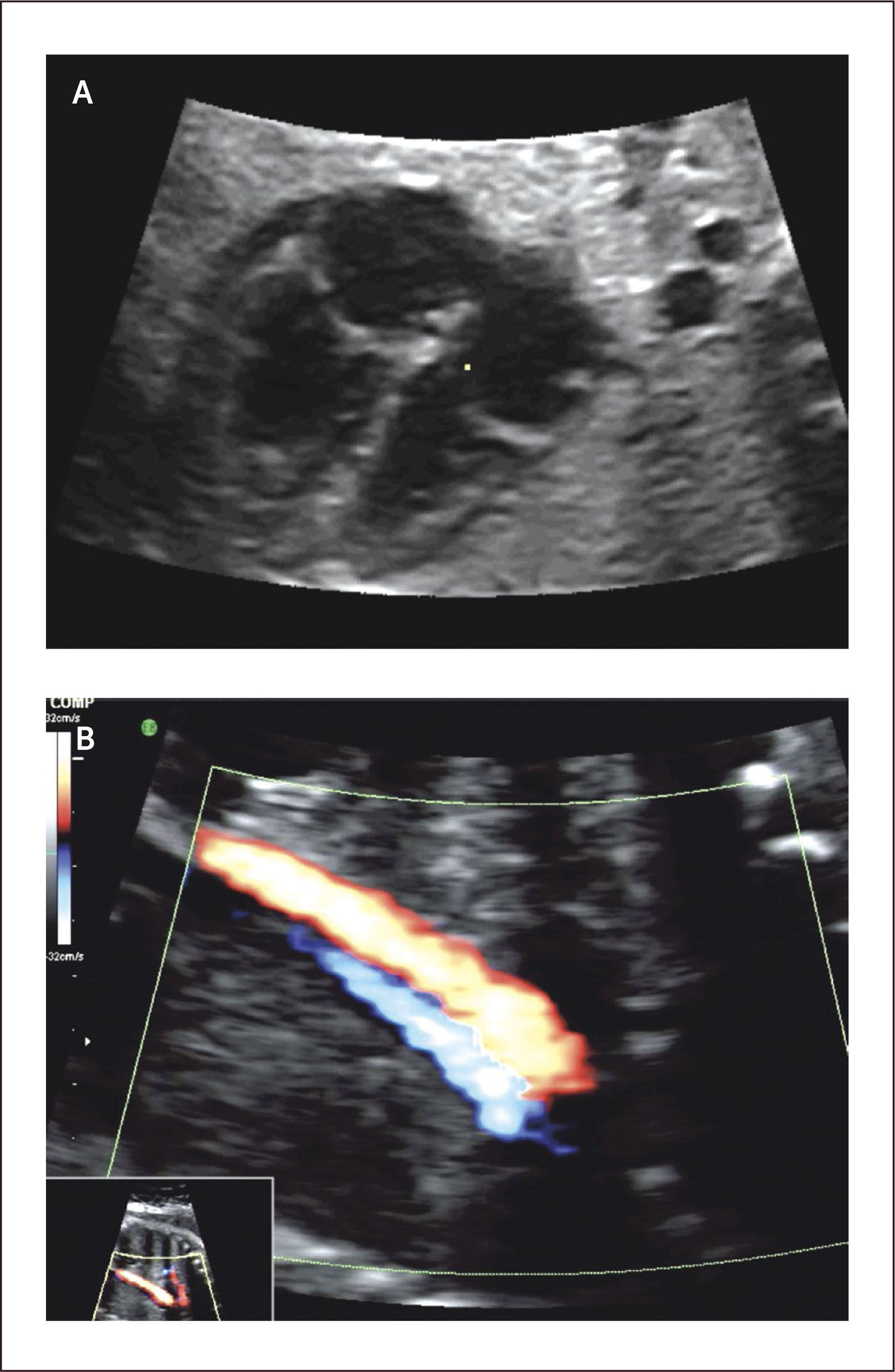
Tumores cardíacos. Los tumores cardíacos durante el período fetal son extremadamente infrecuentes, con una incidencia que no supera el 0,5% de las malformaciones cardíacas congénitas52. Estos tumores pueden ser pericárdicos, intramurales o cavitarios. El 70% de los tumores cardíacos congénitos son rabdomiomas, provienen del miocardio pudiendo ser múltiples y estar asociados a esclerosis tuberosa en un 60 a 90%28. Su evolución es generalmente a una disminución progresiva de su tamaño, siendo excepcional el tratamiento quirúrgico53. Los teratomas son el segundo en frecuencia con un 25% de los casos. Los fibromas son el 12% de los tumores del corazón, son intramurales y se localizan en la pared ventricular o en septum interventricular. A diferencia de los rabdomiomas, su evolución es continuar creciendo53.
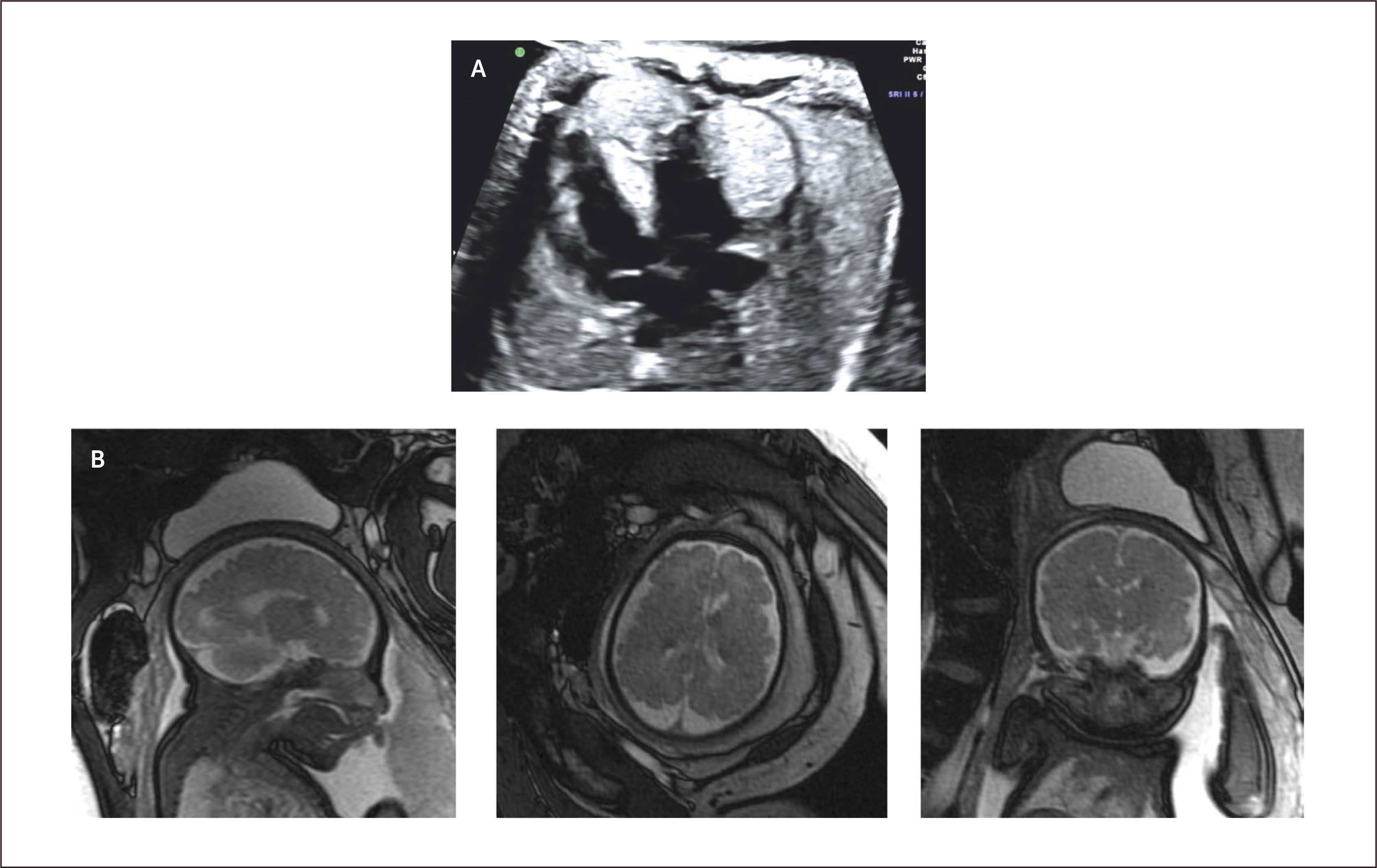
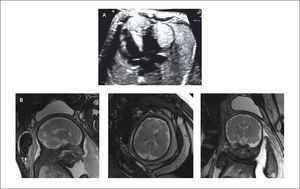
Su pronóstico depende de la eventual obstrucción de las entradas o tractos de salida, o si producen taquicardias fetales54. Sin embargo la más temida asociación corresponde a la esclerosis tuberosa, la que llega a 51 a 91% de los casos de rabdomiomas cardíacos55,56. Para el diagnóstico de estos tuberos en el cerebro es necesaria la resonancia magnética25,32.
El diagnóstico ecocardiográfico de los tumores cardíacos se efectúa mediante la identificación de una masa ecorrefringente intramural o cavitaria en la visión de cuatro cámaras (Figura 27 a). De gran importancia en el pronóstico y manejo perinatal es la evaluación del grado de obstrucción del tumor de los tractos de entrada o salida de la cavidad cardíaca comprometida. En esta evaluación es de gran utilidad la técnica de velocimetría Doppler color. Debemos destacar que desde la incorporación de la resonancia magnética en la búsqueda del compromiso cerebral de la esclerosis tuberosa, la hemos encontrado en dos tercios de los casos (Figura 27 b)25.
Alteraciones del ritmo. Si bien es cierto, la sospecha diagnóstica de anomalías del ritmo cardíaco fetal se plantea con la auscultación realizada al feto, es la ecocardiografía el procedimiento de elección para precisar la alteración del ritmo cardíaco fetal58–60.
Los trastornos del ritmo pueden estar con relativa frecuencia asociados a cardiopatías congénitas complejas, comprometiendo por lo general, severamente la situación hemodinámica del feto. Las arritmias se pueden presentar como un ritmo cardíaco irregular, como un ritmo cardíaco lento o rápido, o como una combinación de ritmo anormal y la proporción. Las causas pueden ser por anormalidades en la generación y o la propagación de impulsos eléctricos60.
La arritmia sinusal, la taquicardia y bradicardia sinusal, aún siendo situaciones de origen fisiológico, suelen ser motivo de derivación para evaluación ecocardiográfica, pero rara vez constituyen un real problema. Los trastornos propiamente patológicos, identificables en edad fetal, se pueden agrupar fundamentalmente en tres entidades: las extrasístoles, las taquicardias y los bloqueos aurículo-ventriculares25.
Extrasístoles. El diagnóstico de las extrasístoles se realiza fundamentalmente mediante el modo M, al apreciar contracciones auriculares o ventriculares prematuras, seguidas de una pausa compensatoria (Figura 28 a). El registro Doppler, a nivel de las válvulas aurículo-ventriculares, muestra ondas de contracción auricular (Figura 28 b, c).
Las extrasístoles supra ventriculares constituyen cerca del 80 a 85% de los trastornos del ritmo, en edad fetal61 (Figura 29). Lo habitual es que no comprometan la hemodinamia fetal, y tienen una evolución satisfactoria, permitiendo una evolución normal del crecimiento fetal y del embarazo. Prácticamente todas ellas desaparecen en forma espontánea durante las primeras semanas de vida. Debemos tener en cuenta que las extrasistolías se presentan en forma más frecuente asociadas a malformaciones que dilatan la aurícula derecha, y también son las que gatillan las taquicardias por reentrada en aquellos pacientes portadores de el síndrome de Wolff -Parkinson -White, que corresponden al 1 a 5 por 1000 recién nacidos vivos25.
La mayoría de los fetos, incluyendo los portadores de extrasistolía ventricular, tuvieron una evolución favorable sin trastorno hemodinámico, llegando a un embarazo de término y desapareciendo la extrasístole dentro del transcurso de los primeros días de vida.
Taquiarritmias. La taquicardia fetal se refiere a la frecuencia cardiaca fetal por arriba de 180 latidos por minuto, en un tiempo o condición limitada. La incidencia es de aproximadamente 1 en 3000 recién nacidos, 70% son taquicardias supraventriculares y el 30% flutter auricular. El incremento en la frecuencia cardiaca compromete el llenado ventricular. Con frecuencias mayores de 240 latidos por minuto se compromete el llenado rápido, produciendo insuficiencia cardíaca, incluso hidrops y muerte fetal.
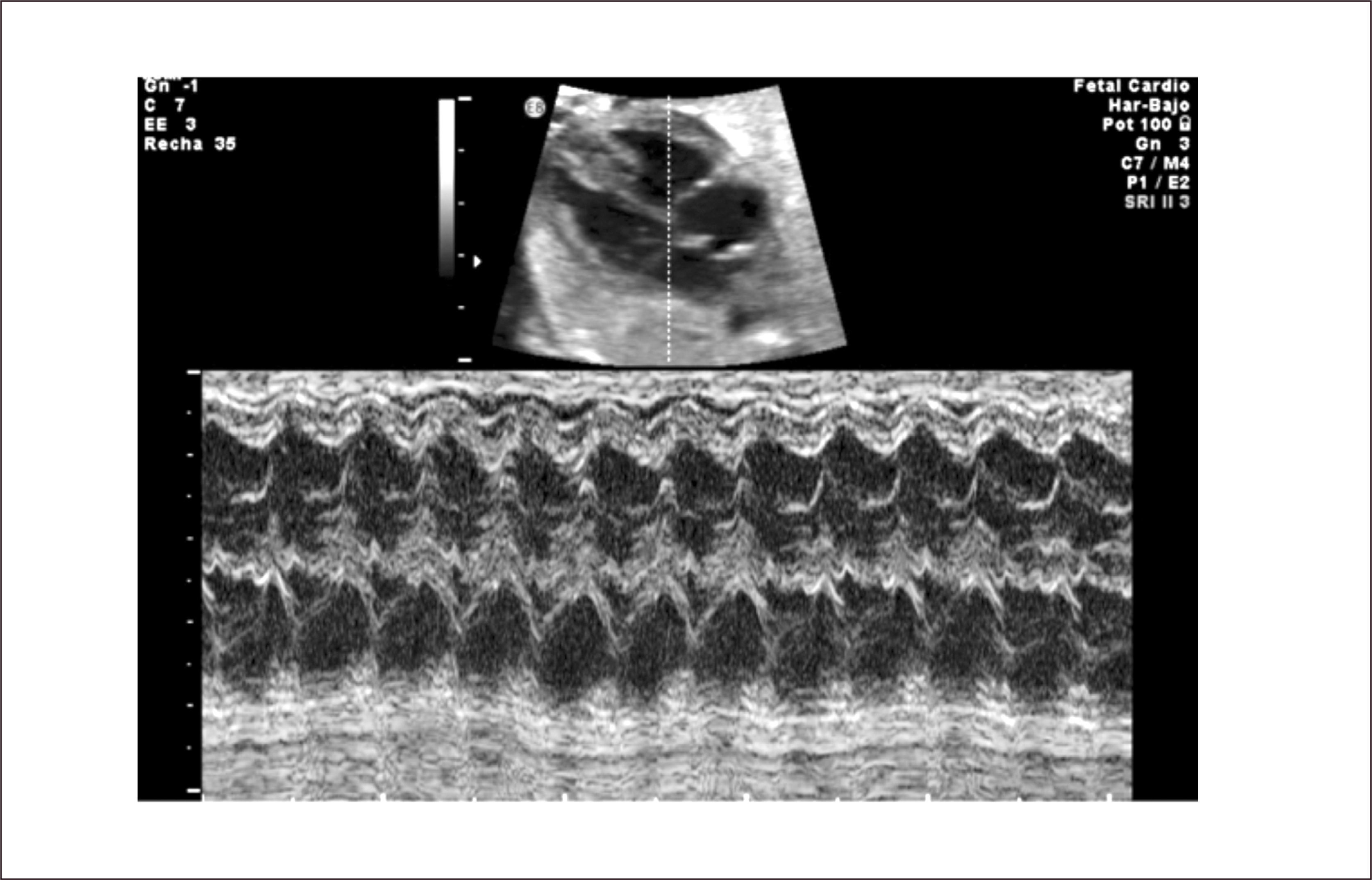
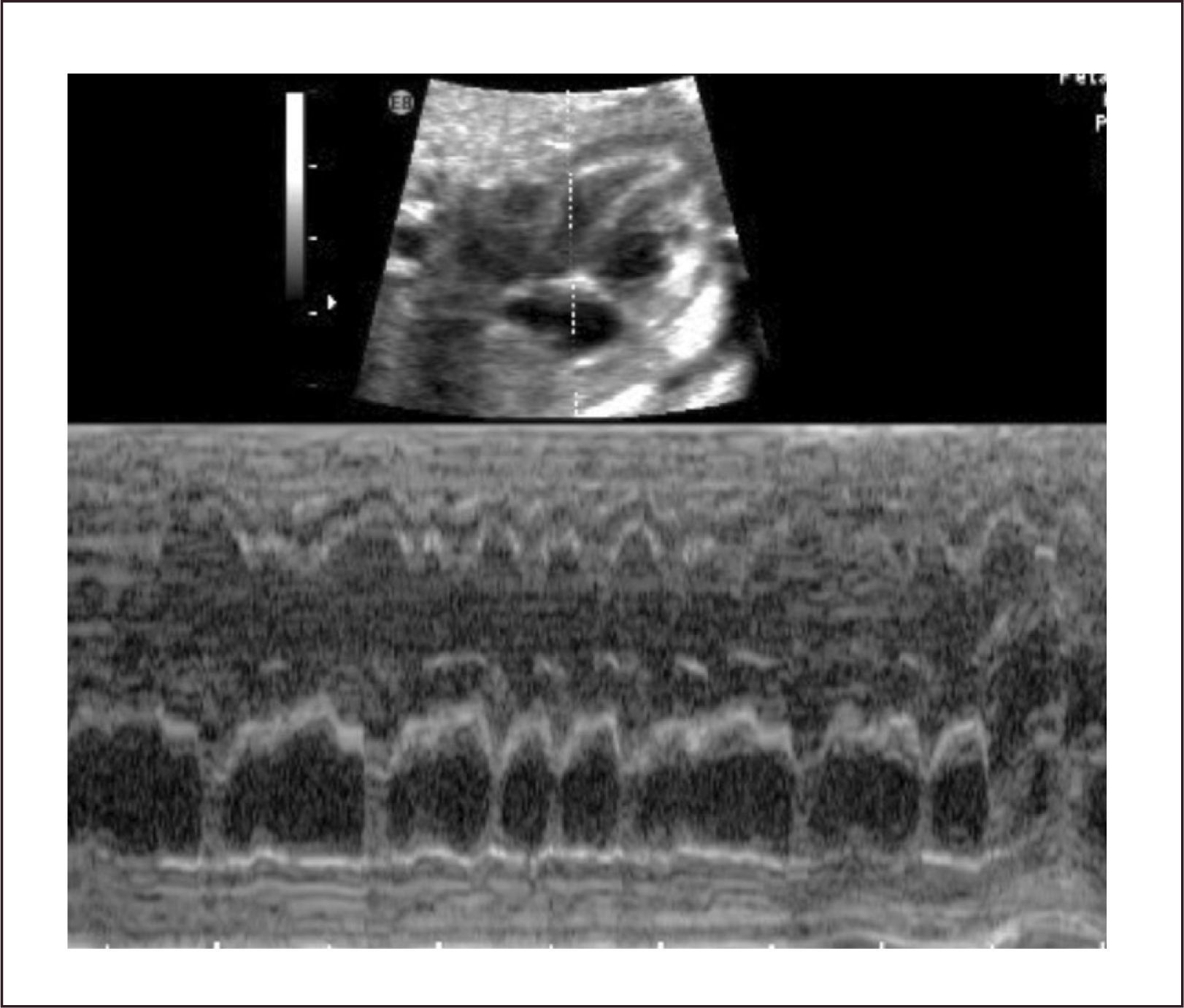
El diagnóstico se hace mediante modo M en corte de cuatro cámaras, con el plano de sección que pase por aurículas y ventrículos. En este plano las contracciones auriculares corresponden a la onda p del electrocardiograma y la contracción ventricular al complejo QRS. También es posible hacerlo con Doppler simultáneo de eventos auriculares y ventriculares, pero su interpretación es más compleja.
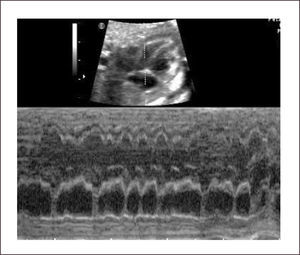
En la taquicardia supra ventricular la frecuencia auricular tiene una conducción 1:1 y las frecuencias van entre 210 a 250 latidos por minuto (Figura 30). En el flutter auricular la frecuencia cardiaca auricular es rápida, tanto como 400-500 latidos por minuto, con una conducción habitual A-V de 2:1 (ocasionalmente 3:1 o 4:1) (Figura 31). La suficiencia cardíaca va a depender de la frecuencia ventricular.
En embarazos pretérmino se puede hospitalizar a la paciente y observar por 12-24 horas, si las arritmias intermitentes son menores al 50% del tiempo y el feto no presenta complicaciones, se puede controlar en forma ambulatoria una a dos veces por semana con control ecocardiográfico de ritmo y evaluación de bienestar fetal.
Si requiere terapia transplacentaria, el medicamento de elección es el digital. Previo al inicio de digoxina se debe hacer un ECG a la madre para descartar bloqueos. Semanalmente se debe controlar a la madre con digoxinemia y electrocardiograma materno. La dosis a emplear de Digoxina es de 0.25 a 0.5mg vía oral 3 veces al día, logrando niveles terapéutico de entre 0.8 a 2.5ng/ml. En los casos en que no hay respuesta o existe hidrops fetal se debe asociar Flecainide y/o Sotalol. Ambos fármacos deben ser administrados con la paciente hospitalizado y con supervisión de un cardiólogo de adulto, por el riesgo de arritmias maternas. La Flecainida se indica en dosis de 100 a 150mg oral dos veces al día. Sotalol se utiliza vía oral 80mg cada 12 horas. En ambos fármacos la dosis se puede duplicar cada 24 a 48 has si no hay respuesta hasta alcanzar la dosis máxima. En embarazos de término se debe evaluar la posibilidad de interrumpir el embarazo62–65.
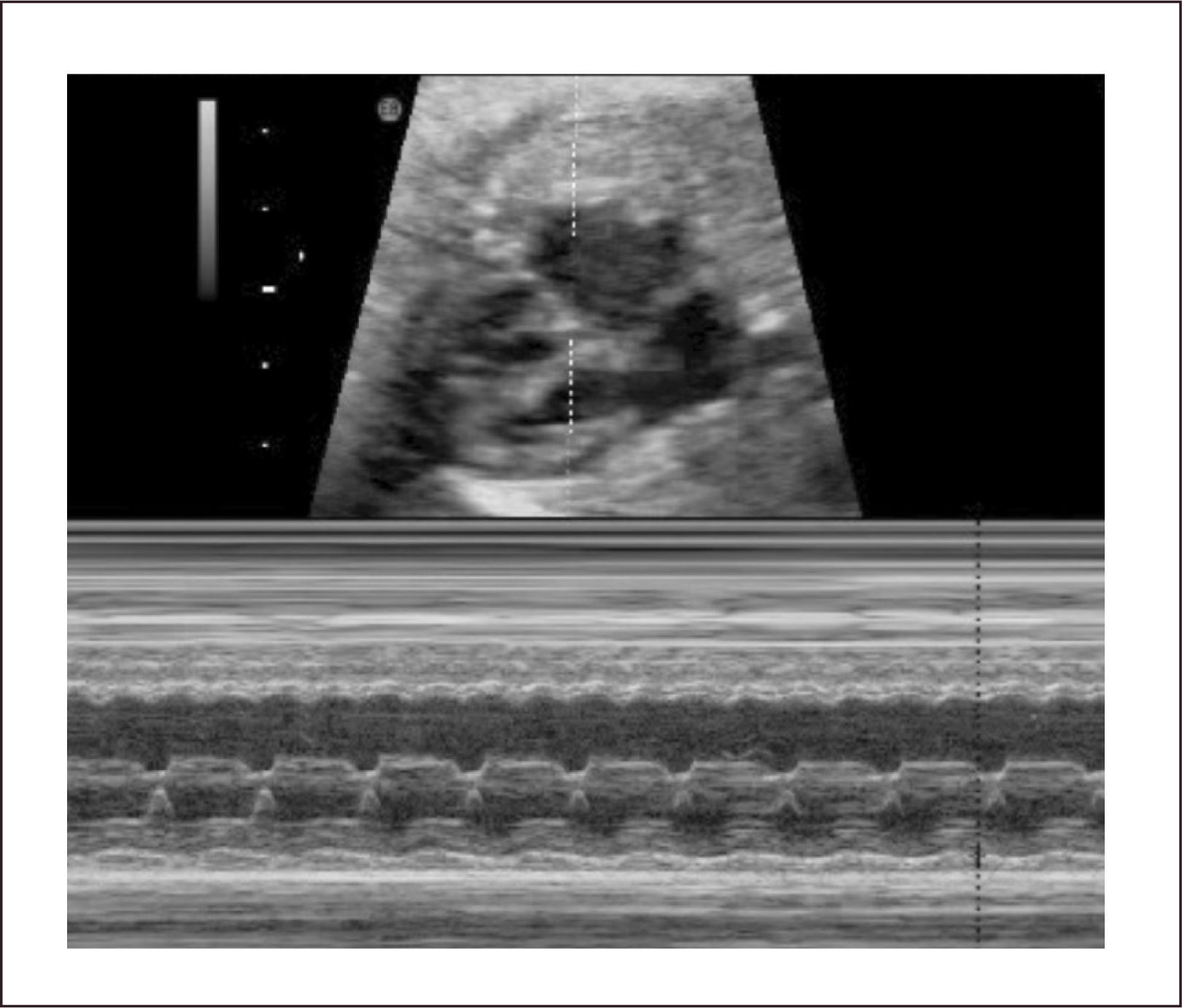
BradiarritmiasLas bradiarritmias se pueden dividir en bradicardia sinusal y bloqueos cardiacos los cuales hacen referencia a la disociación completa o incompleta de las contracciones auriculares y ventriculares debido a alteraciones en la conducción. Dentro de los bloqueos se encuentran el de primer o segundo grado y completo. La prolongación del intervalo PR integra al bloqueo de primer grado, que es muy raro de presentarse y diagnosticarse en la vida fetal (Figura 32). El bloqueo de segundo grado puede ser una prolongación progresiva del intervalo PR, (fenómeno de Wenckebach) hasta que una onda “P” no se conduce, o una prolongación del PR fija pero con una relación de dos “P” por un QRS (2 contracciones auriculares por una ventricular) (Figura 33).
Nos centraremos en el bloqueo aurículo-ventricular completo congénito, del cual no se conoce con exactitud su incidencia, pero se ha establecido en 1 de 20000 recién nacidos. Es una completa disociación entre la contractilidad auricular y la contractilidad ventricular con un latido atrial a una frecuencia normal o alta y un latido ventricular regular con frecuencias bajas (cercanas a 70 LPM). Existen dos formas de presentación: asociado a cardiopatías congénitas y aquella en que el corazón es estructuralmente normal. En este último grupo se produce por anticuerpos Ro Ssa y Ro Ssb que atraviesan la placenta y van a comprometer directamente el nódulo aurículo ventricular y el sistema éxito-conductor, produciendo una desconexión eléctrica entre el nivel superior y el inferior del sistema66–68
La evolución de los casos donde existen bloqueos asociados con cardiopatías congénitas complejas tiene una mortalidad cercana a 100%. Los de origen inmunológico tienen una evolución favorable con una sobrevida general cercana al 90%. Son elementos de mal pronóstico el que los fetos presenten frecuencias auriculares igual o menor a 120 latidos por minutos, frecuencias ventriculares menores a 55 latidos por minuto y aquellos que presenten hidrops. El diagnóstico también se realiza con ecocardiograma bidimensional, el modo M y el Doppler pulsado, descartando malformaciones anatómicas. El modo M muestra la disociación A-V (Figura 34a). El Doppler pulsado nos muestra la válvula mitral con flujo rápido que es reflejo de la contracción atrial y a nivel de la salida de la aorta se observa un flujo lento, reflejo de la bradicardia ventricular. También se puede registrar ritmo auricular y ventricular en forma simultánea en vena y arteria umbilical (Figura 34b), o en aorta y vena cava inferior. La aurícula tiene una contracción regular; si es muy rápida o irregular se debe sospechar de una taquiarritmia auricular asociada a un bloqueo completo. La frecuencia atrial se ha descrito que puede estar entre 96 a 400 lat/min y la ventricular entre 40 a 80 lat/min.
El diagnóstico diferencial debe ser realizado con bradicardia sinusal y sufrimiento fetal agudo. En los casos de bradicardia sinusal, el rimo auricular y ventricular son en secuencia de uno es a uno en el modo M. Una alternativa es ver sólo el ritmo auricular, si es bajo, se trata de una bradicardia sinusal. En el diagnóstico diferencial con sufrimiento fetal, los movimientos fetales, cantidad de líquido amniótico y PBF nos ayudan a identificar hipoxia. En la velocimetría Doppler, arteria umbilical está generalmente alterada, debido a la prolongación de la diástole. La arteria cerebral media es fundamental para el diagnóstico de hipoxia en estos casos, la presencia de vaso dilatación nos indicara hipoxia fetal. Es difícil la remisión una vez que se ha producido el bloqueo AV completo, posiblemente porque el daño anatómico ya está presente. Los corticoides han sido utilizados por sus efectos antiinflamatorio e inmunomodulador. Los medicamentos que se pueden utilizar son la betametasona y dexametasona, ambas capaces de pasar la barrera placentaria. Las dosis sugeridas son de 4-9mg/día de dexametasona por 3 a 19 semanas, betametasona 12-24mg/semana por mínimo de 6 semanas, o prednisona 10-40mg/día. Su efecto seria disminuyendo el compromiso inflamatorio del miocardio contráctil. No tiene efecto sobre el ritmo. En aquellos fetos en los que la frecuencia cardiaca esta bajo los 55 lpm, el riesgo de insuficiencia cardiaca, hidrops y muerte fetal es alta. En estos pacientes usamos fármacos B estimulantes, o gamaglobulina hiperinmune69,70.
UTILIDAD DEL EXAMEN DEL CORAZÓN FETALEn la población general el diagnóstico de cardiopatías se ha basado principalmente en la visualización del corte de cuatro cámaras. Los resultados en este grupo son poco alentadores y el diagnóstico antenatal no sobrepasa al 20% de las cardiopatías75,76. Es por este motivo que el tamizaje de cardiopatías congénitas debe incluir cuatro cámaras y tractos de salida3.
En el grupo de alto riesgo estos resultados mejoran significativamente y la detección de malformaciones cardíacas congénitas por la visión de cuatro cámaras fue de hasta un 96% en las primeras comunicaciones, con especificidad mayor de un 99%20,77. Sin embargo, estos resultados se basaron principalmente en el seguimiento de los pacientes diagnosticados como anormales y no en aquellos diagnosticados como normales.
Recientes investigaciones, en centros especializados a población de alto riesgo, demuestran que el diagnóstico antenatal de malformaciones cardíacas tiene una sensibilidad de alrededor del 70%78,79, existiendo cardiopatías de difícil diagnóstico, ya sea por su evolutividad, tamaño o que simplemente son estructuras normales durante la vida fetal. Nuestra experiencia muestra que identificamos adecuadamente el 83% de las cardiopatías congénitas mayores80.
Desde el punto de vista clínico, las preguntas más importantes son ¿Cuál es el pronóstico de la lesión?, y ¿Requiere un tratamiento neonatal inmediato? La respuesta a estas preguntas dependen de si el corazón está normalmente desarrollado y si no es así, ¿Cuán comprometido está el flujo pulmonar o sistémico? Por este motivo, en el examen del corazón fetal la visión detallada de las cuatro cámaras es necesaria, pero la visualización de los grandes vasos es imprescindible en la evaluación antenatal del corazón fetal.
Por otra parte la evaluación de la translucencia nucal entre las 11 y 14 semanas ha demostrado ser capaz de identificar hasta un 50% de las cardiopatías mayores82–85. La asociación de la velocimetría Doppler del ductus venoso ha permitido, en recientes comunicaciones, mejorar esta sensibilidad hasta un 83%86. Varios estudios han demostrado que es posible hacer, en población general, tamizaje de cardiopatías en el examen de 11 a 14 semanas utilizando el mismo esquema del segundo trimestre con la visualización de 4 cámaras y tractos de salida, la mayoría de ellos con sensibilidades por sobre el 80%87.
En un futuro inmediato el diagnóstico de CC se trasladará al primer trimestre, con alta resolución o mediante el análisis remoto por un especialista altamente entrenado en ecocardiografía fetal, off line, del volumen de información capturado por un médico obstetra ginecólogo general. El análisis de este volumen de información está disponible en un número creciente de máquinas de ultrasonido de tres dimensiones y permite en más de un 97% de los casos examinados la visualización adecuada de todas las estructuras del corazón fetal19,21,42. Finalmente, otras técnicas de imagen así como las de biología molecular posibilitarán diagnósticos más precoces y precisos que permitirán tratar en mejor forma a los pacientes no nacidos, portadores de cardiopatías congénitas.
Los autores declaran no tener conflictos de interés, en relación a este artículo.