La ciencia llamada farmacología pediátrica estudia los fármacos usados en estas poblaciones etarias, donde se observan diferencias importantes con los adultos en la farmacocinética (FC) y la farmacodinamia (FD). Otros problemas habituales de la pediatría son el uso de formulaciones no aptas para niños, la falta de evidencia científica en cuanto a eficacia/seguridad para muchos medicamentos, el uso de medicamentos no aprobados por autoridades regulatorias y la influencia de otras patologías sobre el comportamiento FC. Estas condicionantes hacen que encontrar la dosis óptima de un medicamento en un niño, sea un reto en muchas terapias. Es fundamental conocer el comportamiento de los medicamentos en un organismo en constante desarrollo y maduración para lograr una terapéutica efectiva, segura y racional. Algunas herramientas como la farmacovigilancia y el monitoreo terapéutico de fármacos podrían ayudar a optimizar terapias en este escenario de incertidumbre.
Pediatric pharmacology studies the drugs used in children, where significant differences are observed with adults in the pharmacokinetics (PK) and pharmacodynamics (FD). Other common problems of pediatrics are the use of unsuitable formulations, the lack of scientific evidence for efficacy/safety for many drugs, the use of drugs not approved by regulatory authorities and the influence of other pathologies on PK. These conditions make hard to find the optimal dose of a drug in a child. It is essential to learn how drugs behave in an organism in constant development and maturation for effective, safe and rational therapy. Some tools such as pharmacovigilance and therapeutic drug monitoring could help optimize therapies in this scenario of uncertainty.
En el último siglo nuestro país redujo en forma importante la tasa de mortalidad infantil, mediante un cúmulo de acciones que han ido fortaleciendo nuestra salud pública1. Si bien se han producido muchos avances en el conocimiento del funcionamiento de los medicamentos en el paciente pediátrico, aún existen brechas en relación a los adultos. La farmacología pediátrica es una ciencia que estudia los fármacos usados en pediatría y abarca aspectos relacionados con su acción, forma de administración, indicaciones terapéuticas y acciones tóxicas2. A pesar de los avances en farmacología pediátrica ocurridos en los últimos años los niños siguen siendo “huérfanos terapéuticos”, expresión utilizada en los años 60’ por el Dr. Harry Shirkey para referirse a la falta de recursos terapéuticos en esta población3. El objetivo de este artículo es introducir a nuestros lectores en la farmacología pediátrica, enfatizando la problemática desde una perspectiva práctica.
EDAD PEDIÁTRICALos niños conforman una población única, con diferencias fisiológicas y de desarrollo definidas con respecto a los adultos. Además, no son un grupo homogéneo, ya que estas mismas características son muy diferentes en distintos tramos de la edad pediátrica4:
Neonatos: es el recién nacido hasta la 4° semana de vida.
Lactante: desde el mes de vida hasta los 2 años.
Preescolar: desde los 2 años hasta 6 años.
Escolar: desde los 6 años hasta los 12 años.
Adolescente: desde los 12 años hasta los 18 años.
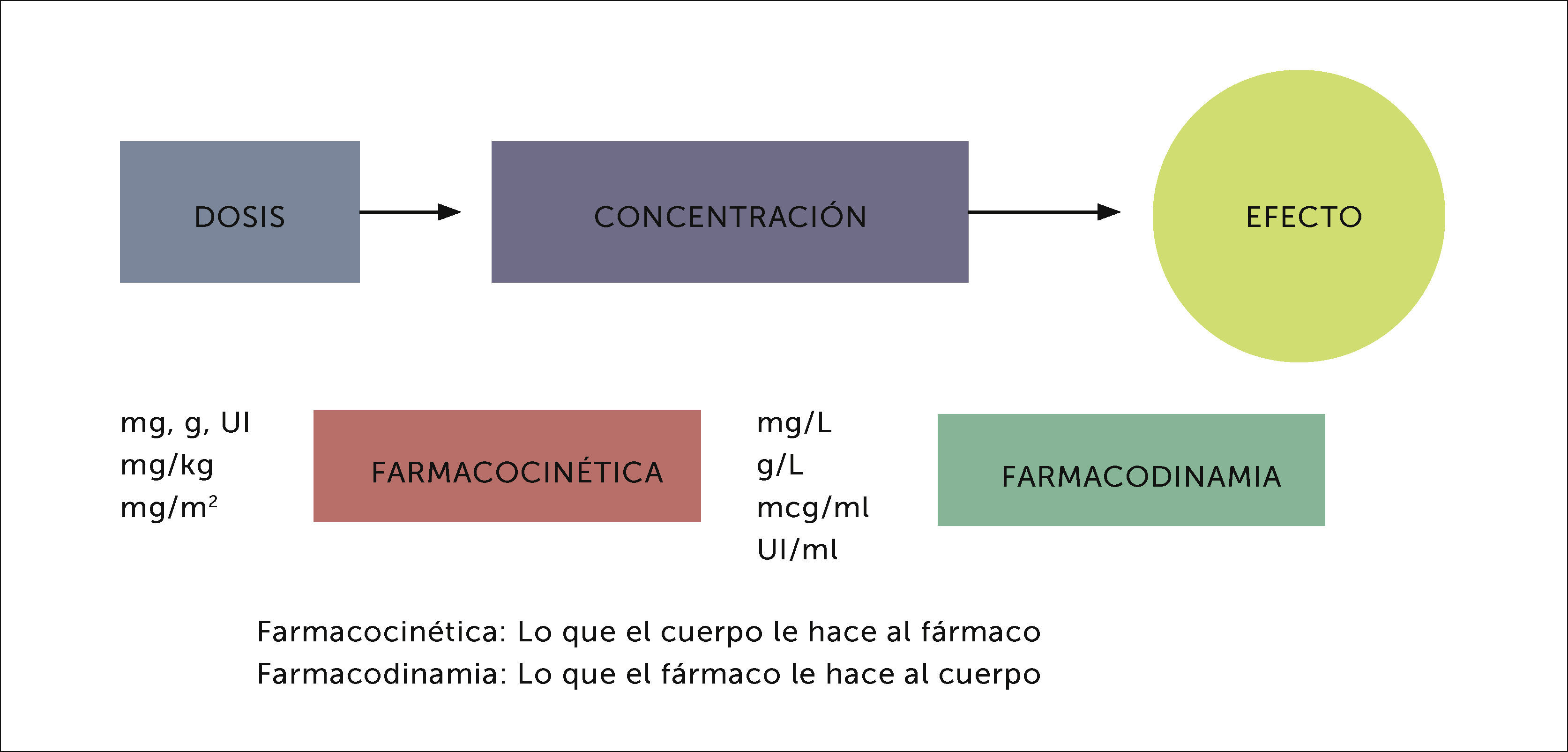
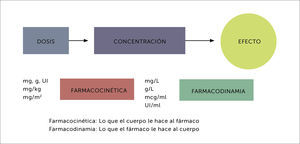
En pediatría no se trata de prescribir ajustando proporcionalmente las dosis del adulto según el peso o la superficie corporal del niño; se requiere del conocimiento de la farmacocinética y la farmacodinamia en un organismo en constante desarrollo y maduración para una terapéutica efectiva, segura y racional5. Por ello es importante entender la relación entre dosis, concentración y efecto, y cómo se afectan durante la edad pediátrica (Figura 1).
FARMACOCINÉTICA EN POBLACIÓN PEDIÁTRICAEl constante desarrollo del organismo a través de las edades pediátricas impacta en la disposición de los fármacos. Estos eventos están relacionado con los cambios en la composición del cuerpo y la función de los órganos más importantes en el metabolismo y la excreción6. Durante la primera década de vida, estos cambios son dinámicos y pueden no ser lineales, haciendo que la estandarización de dosis, mediante los mg/kg/dosis o la superficie corporal, sea inadecuada para asegurar la efectividad y seguridad de un fármaco en la infancia [4]. Históricamente el uso de dosis similares, en mg/kg, para distintas edades pediátricas ha estado asociado a algunas tragedias, como por ejemplo el síndrome del “bebé gris” por cloranfenicol en 19597. En dicha instancia, los niños al poco tiempo de haber iniciado una terapia con cloranfenicol comenzaron a desarrollar distensión abdominal, vómitos, cianosis, colapso cardiovascular y finalmente la muerte. Tiempo después, estudios farmacocinéticos en el neonato mostraron la acumulación tóxica de cloranfenicol en el plasma, debido a una inmadurez de la actividad de la enzima glucoroniltransferasa, que impedía que el fármaco fuera metabolizado. Debido a esta situación se determinaron requerimientos de dosis edad-dependientes para cloranfenicol en infantes8.
Para entender cómo el desarrollo afecta la farmacocinética de los medicamentos es necesario conocer la influencia de la edad pediátrica en los procesos de absorción, distribución, metabolismo y excreción (ADME).
Absorción: La absorción de un fármaco hacia el organismo depende en gran medida de la vía de administración. En pediatría la mayoría de los fármacos son administrados por vía oral, por lo que es necesario considerar cómo cambian distintos elementos de la absorción oral de acuerdo a la edad pediátrica, los cuales podemos apreciar en la Tabla 19,10.
CAMBIOS EDAD-DEPENDIENTES RELACIONADOS A LA ABSORCIÓN ORAL DE MEDICAMENTOS
| DIFERENCIAS OBSERVADAS | DESCRIPCIÓN |
|---|---|
| Cambios en el pH intraluminal gástrico | En los primeros momentos después del nacimiento se produce falta de ácido clorhídrico, que mantiene el pH estomacal en rangos de 6 a 7. A medida que se van pasando los días el pH va normalizándose. |
| Vaciamiento gástrico más lento | El vaciamiento es errático y prolongado durante el período neonatal, alcanzando los valores del adulto a los 6-8 meses. En muchos casos la velocidad de absorción de los medicamentos es más lenta en neonatos y lactantes, que en niños más grandes, es decir para algunos medicamentos mientras menor sea la edad los tiempos necesarios para alcanzar niveles plasmáticos máximos van a ser más extensos. |
| Cambios en la flora bacteriana del intestino | El tracto gastrointestinal es estéril durante la vida fetal y tras el nacimiento se produce la colonización bacteriana a las pocas horas de vida. La flora bacteriana metaboliza algunos fármacos y puede influir en su absorción; por ejemplo, los lactantes tienen problemas para biotransformar la digoxina a nivel intestinal, ya que su flora no está desarrollada completamente y recién en la adolescencia se alcanzan los niveles metabólicos del adulto. |
| Cambios en la función biliar | La función biliar es inmadura en el neonato con escasa secreción biliar, lo que podría producir alteración en la absorción de medicamentos liposolubles. |
Algunos medicamentos interaccionan con los componentes de los alimentos11, por ello es necesario tener presente la influencia de la nutrición enteral sobre la absorción de medicamentos en la edad pediátrica.
La administración por piel provee de mayor absorción en las primeras edades de la infancia, en comparación a los adultos, lo que puede ser explicado por la presencia de un estrato corneo más delgado y por el mayor grado de difusión cutánea e hidratación de la epidermis12. Por ejemplo, la exposición sistémica de corticoides o antisépticos tópicos en niños podría ser más alta que los adultos13.
En el caso de la absorción por vía intramuscular se considera variable y, en general pobre, debido a un flujo sanguíneo relativamente bajo y por la poca masa muscular que presentan los niños pequeños14.
Otra vía de administración utilizada habitualmente en pediatría es la rectal, sin embargo no hay estudios que manifiesten diferencias importantes en la absorción por esta vía en los niños respecto al adulto.
Distribución: Luego de que el fármaco ingresa a la sangre, una parte se une a proteínas y el resto circula en forma libre, esta última fracción es la que llega al sitio de acción donde producirá el efecto farmacológico.
En el proceso de distribución, cambios edad-dependientes en la composición corporal alteran los espacios fisiológicos en los que un fármaco puede ser distribuido15. Para muchos fármacos el valor del volumen aparente de distribución (Vd) difiere significativamente entre la población pediátrica y la adulta. Estas diferencias se deben a las modificaciones que se producen con la edad en:
- a)
Contenido corporal de agua: La fracción de agua corporal total es muy alta en el feto y se va reduciendo a partir del nacimiento15,16, en paralelo al aumento del porcentaje de grasa corporal.
- b)
Concentración de proteínas plasmáticas: La unión a proteínas se encuentra reducida en neonatos porque la concentración total de proteínas es menor y adicionalmente se observa una menor capacidad de unión a fármacos17. Esto se podría traducir en un aumento de los volúmenes de distribución de los medicamentos con alta unión a proteínas y subsecuentemente una reducción de las concentraciones plasmáticas.
- c)
Permeabilidad de las membranas: La barrera hematoencefálica, que determina la distribución del fármaco en el cerebro, se considera más permeable en recién nacidos que en niños mayores18, lo que genera un espacio adicional para distribuirse.
El incremento en la composición acuosa observada en la edad pediátrica afecta el comportamiento de los medicamentos solubles en agua. Por ejemplo, la gentamicina (un antibiótico hidrosoluble) se distribuye ampliamente en el agua corporal, por lo que es posible observar concentraciones máximas más bajas en los neonatos en comparación a niños más grandes19,20. La situación se complica por las variaciones propias del paciente en su balance hídrico, como por ejemplo en sepsis21, lo que se traduce en alta variabilidad observada para las concentraciones máximas alcanzadas para el grupo de los aminoglicósidos. La problemática del volumen de distribución es de una de las razones que argumentan el uso de monitoreo terapéutico de aminoglicósidos en la pediatría22,23.
Metabolismo: Los fármacos para ser eliminados del organismo deben ser transformados en compuestos más polares e hidrosolubles, los que llamamos metabolitos. Aunque este proceso puede ocurrir en una diversidad de tejidos, la mayor parte de las biotransformaciones se producen en el hígado24. Las reacciones de transformación metabólica pueden dividirse en dos grupos25: reacciones de fase I, en las cuales se introducen grupos polares en las moléculas mediante reacciones de oxidación, reducción e hidrólisis; y reacciones de fase II o de conjugación por medio de las cuales el fármaco se une de manera covalente con una sustancia de origen endógeno (ácido glucurónico, glicina, glutatión, sulfato, entre otros).
Las reacciones de fase I son realizadas por un grupo de enzimas llamadas citocromos P450, las cuales a su vez se subdividen en isoformas. La isoforma más importante dentro de los citocromos es la CYP3A4, seguida por CYP2D6. La capacidad metabólica de los citocromos se va desarrollando en forma lenta a partir del nacimiento y por ello está reducida en el recién nacido. En la edad preescolar algunas isoformas de citocromo incrementan su capacidad metabólica, en relación a otras edades pediátricas, fenómeno que se va atenuando a medida que se alcanza la pubertad26. Con respecto a las reacciones de fase II, como la sulfatación, existe un buen desarrollo en el recién nacido; sin embargo, las de conjugación con glucurónido alcanzan valores de adulto cerca de los 2 a 4 años, por ello las drogas que necesitan este proceso tienden a acumularse en los primeros meses de vida26.
Excreción: Los fármacos deben ser eliminados del organismo, siendo el principal órgano excretor el riñón. En los procesos de eliminación de medicamentos juega un rol clave la filtración del medicamento a través del glomérulo, y los procesos que ocurren en el túbulo: reabsorcion y secreción. La maduración de la función renal es un proceso dinámico que comienza durante la organogénesis fetal y se completa en la infancia. La taza de filtración glomerular y el flujo sanguíneo renal son más bajos en el recién nacido en comparación a niños más grandes27, y alcanzan los valores del adulto entre los 6 meses y el año de vida17. Por esta razón, la capacidad de eliminación renal de medicamentos, que está relacionada con la capacidad de filtración glomerular, va estar afectada en neonatos, sobre todo en los prematuros13. Los procesos de secreción tubular también podrían estar inmaduros y normalizarse recién al año de vida13.
FARMACODINAMIA EN POBLACIÓN PEDIÁTRICALa farmacodinamia, definida como lo que el fármaco le hace al organismo, debe ser considerada en el escenario cambiante del paciente pediátrico. Sin embargo, a pesar de la importancia del comportamiento farmacodinámico de los fármacos en niños, los datos son escasos. En la edad pediátrica algunos medicamentos tienen un comportamiento farmacodinámico distinto a los adultos, lo que determina particularidades en sus efectos terapéuticos, como por ejemplo los sedantes28 y los anticoagulantes29. Además, las reacciones adversas sobre el crecimiento ocurren en esta edad, como por ejemplo los efectos deletéreos de los corticoides sobre el crecimiento30, las alteraciones en el crecimiento óseo por las tetraciclinas31 o sobre el cartílago por fluoroquinolonas32.
DOSIS EN PEDIATRÍALa farmacoterapia logra sus resultados a través de una selección idónea de la dosis para el paciente. Un método habitual para seleccionar la dosis pediátrica de un nuevo medicamento es la normalización de la dosis de adulto a peso corporal (mg/kg peso), asumiendo una relación lineal entre peso y dosis. Otra forma de dosificar es por edad, dividiendo a la población pediátrica en subcategorías (por ejemplo prescolares, escolares, adolescentes, etc.) y usando una dosis determinada de acuerdo al rango de edad. Ambos métodos tienen sus problemas, usar una estimación de mg/kg para todas las edades pediátricas o usar una dosis para todo un rango etario nos privan de asumir que las propiedades farmacocinéticas – farmacodinámicas de un medicamento en pediatría cambian de forma continua, y no escalonadamente, a través de las distintas edades pediátricas. Podríamos estar dosificando un paciente de 10 años con dosis de mg/kg y estar frente a un comportamiento farmacocinético de un adulto, lo que produciría quizás altas concentraciones y toxicidades en ese niño. A otro paciente de 2 meses le iniciaremos la misma dosis de un medicamento A, en mg/kg, que a otro niño de 6 meses, ya que el rango etario para la dosificación es de 1 mes a 1 año nos sugiere similar dosis. Resulta que el paciente de 2 meses tiene una actividad metabólica reducida, por lo que acumulará más medicamento que el paciente de 6 meses, y probablemente ese pequeño paciente se nos intoxique.
Además de la imprecisión entregada por los cambios farmacocinéticos observados en la población pediátrica, la influencia de la patología de base produce un mayor riesgo de no seleccionar la dosis adecuada. Por ello debemos tener en cuenta otras covariables relacionadas a las características fisiopatológicas de los pacientes. Entre ellas la presencia de:
Sepsis/schock séptico: El uso de fluidos para la resucitación predispone al aumento del volumen de distribución para medicamentos hidrosolubles33. Otro fenómeno observado es un aumento en el aclaramiento de medicamentos durante la fase hiperdinámica de la sepsis, en un fenómeno que se conoce como Augmented Renal Clearance34.
Cáncer: Para algunos medicamento se observan aclaramientos más rápidos y volúmenes de distribución más grandes35.
Fibrosis quística: En esta patología se observan altos volumen de distribución y aclaramientos aumentados en varios medicamentos36.
Insuficiencia renal: Para medicamentos con aclaramiento renal importante debemos esperar acumulación y necesidad de ajustar dosis37.
Adicionalmente, es necesario considerar otras situaciones como la presencia de obesidad38, interacciones medicamento-medicamento39, entre otras. La complejidad aumenta en el caso de combinaciones de estas condiciones, lo que nos brinda incertidumbre adicional si dejamos dosis habituales para la pediatría.
MONITOREO TERAPÉUTICO DE FÁRMACOS: UNA HERRAMIENTA ÚTIL PARA REDUCIR LA IMPRECISIÓNEl monitoreo terapéutico de fármacos (TDM, por su significado en inglés, Therapeutic drug Monitoring), es una práctica en la que se miden las concentraciones de fármacos con el objetivo de optimizar la farmacoterapia, maximizando la eficacia terapéutica, y minimizando la ocurrencia de reacciones adversas, permitiendo a la vez individualizar la terapia de cada paciente. Por las particularidades propias de la pediatría es recomendado el uso de TDM para fármacos seleccionados14 y puede ser una herramienta útil para reducir la variabilidad en determinadas situaciones clínicas14,40,41.
FALTA DE INVESTIGACIÓN: UN PROBLEMA PARA OBTENER DOSIS EFECTIVAS Y SEGURAS EN PEDIATRÍA.En muchos de los medicamentos disponibles para la pediatría, razones éticas y legales explican la falta de ensayos clínicos, pero también existen razones económicas, ya que los niños implica una cuota de mercado pequeña para la mayor parte de los medicamentos42. En muchos casos, los resultados obtenidos en investigaciones con adultos no son extrapolables a niños y jóvenes, o algunas enfermedades ocurren sólo en la infancia por lo que fármacos específicos para dichas enfermedades no pueden ser ensayados. A pesar de las ventajas que pueda ofrecer una investigación clínica para estudiar la eficacia y seguridad de un medicamento en niños, resulta inevitable la exposición a sufrir algún daño como consecuencia de su participación en el estudio, aun cuando sus resultados sean beneficiosos43.
En las últimas décadas los países desarrollados han introducido cambios legislativos para favorecer la investigación de medicamentos en niños. Por ejemplo en EE.UU, la Food and Drug Administration (FDA) premia a laboratorios con la prolongación de la patente si promueven ensayos en población pediátrica para ciertos medicamentos44. Esto da una luz de esperanza y ha contribuido a mejorar el conocimiento y la dosificación de muchos nuevos fármacos45. Lamentablemente, la mayor cantidad de fármacos son aquellos que ya fueron introducidos hace muchos años y la información disponible es variable y en su mayor parte, escasa.
La próxima vez que esté frente a un paciente pediátrico y deba seleccionar una dosis, intente hacer un pequeño ejercicio: busque la evidencia científica detrás de la dosificación seleccionada, puede que tenga suerte y exista un gran peso de la evidencia, pero lo más probable es que se decepcione y se dé cuenta que su dosificación es más empírica que científica.
USO NO AUTORIZADO DE FÁRMACOS EN PEDIATRÍAComo se ha planteado a la largo del texto, la poca evaluación científica de los fármacos habitualmente usados en pediatría es un problema frecuente. Como consecuencia, quienes administran o prescriben fármacos en niños se ven obligados a utilizar medicamentos en condiciones que no están aprobadas por las autoridades sanitarias. Estas condiciones se conocen como uso “off-label”, término utilizado para la utilización de fármacos en casos específicos, al margen de un ensayo clínico, especialmente formas farmacéuticas para indicaciones o condiciones de uso distintas de las autorizadas por agencias regulatorias de medicamentos46,47. Existen distintas categorías de uso off-label48, algunas de las cuales se aprecian en la Tabla 2. Para obtener resultados terapéuticos adecuados en pediatría es necesario acceder a medicamentos con formulaciones estables, apropiadas para cada edad, efectivas y bien toleradas49. Muchas veces esto no es posible y por ello un uso off-label habitual en pediatría es la producción de preparaciones extemporáneas, definidas como aquella que se lleva a cabo en el momento exacto de su uso50. Por ejemplo, la manipulación de un comprimido de sildenafil 50mg para obtener una dosis de 3mg, a falta de una suspensión o solución magistral, no nos deja más opción que disolver el comprimido en agua y extraer el volumen que corresponde; práctica que por más aberrante que parezca, es el día a día en el mundo pediátrico hospitalario. El uso bajo estas condiciones requiere de especial vigilancia en busca de efectos adversos o falta de efectividad, ya que si la dosificación del medicamento original tenía poco respaldo, el uso de esta formulación extemporánea lo tendrá mucho menos.
CATEGORÍAS DE USO OFF-LABEL
| CATEGORÍA | DESCRIPCIÓN |
|---|---|
| Edad | Uso de fármaco no recomendado en el FIP bajo una edad determinada |
| Peso | Uso de fármaco no recomendado en el FIP bajo un cierto peso |
| Ausencia/Deficiencia de información pediátrica | Uso de fármaco con muy poca información pediátrica o sin mención de datos en el FIP |
| Contraindicación | Uso de fármaco con contraindicación en el FIP |
| Indicaciones | Uso de fármaco prescrito para indicaciones fuera del FIP |
| Ruta de administración | Uso de fármaco para rutas no autorizadas en el FIP |
FIP: folleto de información al profesional
El propósito de autorizar el uso en niños de un fármaco es para asegurar que los medicamentos sean eficaces, seguros y de calidad. Por lo tanto, se podría esperar que el uso Off-Label pudiera estar asociado a un mayor riesgo de complicaciones. Aunque no se ha establecido una relación clara, hay estudios que muestran que los pacientes pediátricos que ocupan fármacos Off-Label tienen mayor riesgo de aparición de reacciones adversas a medicamentos (RAM)51,52. Por otro lado, las consecuencias sobre la efectividad o el incremento de errores de medicación, o los aspectos judiciales del uso Off-Label han sido poco abordadas.
FARMACOVIGILANCIA EN PEDIATRÍALa farmacovigilancia (FV) es la ciencia y las actividades relativas a la detección, evaluación, comprensión y prevención de los efectos adversos de los medicamentos o cualquier otro problema de salud relacionado con ellos. Si bien las actividades de FV son similares, independiente de la edad de los pacientes estudiados, es preciso centrar la atención en la epidemiología de las RAM en la población infantil, ya que por un lado, la infancia constituye un grupo heterogéneo de edades que determina comportamiento farmacocinético impredecible a veces y por otra parte, sólo un pequeño porcentaje de medicamentos usados en niños han sido objeto de estudios clínicos rigurosos53,54.
Un metaanálisis realizado por Impicciatore y cols.55 determinó una incidencia de RAM en pacientes pediátricos hospitalizados de 9.5%, mientras que Aagaard y cols. encontraron una prevalencia promedio de 24.0% (rango: 1-72%)56. Asimismo, Smyth y cols. encontraron una tasa de incidencia entre 0.6 y 16.8% en niños expuestos a un fármaco durante la hospitalización57. Estos datos revelan que las RAM son un problema habitual en la pediatría y por ello a nivel mundial se han establecido varias iniciativas para promover y mejorar la seguridad de los medicamentos en niños58.
En Chile los datos sobre RAM en niños son escasos. En uno de los pocos estudios nacionales publicados, González-Martin y cols. realizaron un estudio prospectivo para determinar la frecuencia de RAM en 219 pacientes pediátricos hospitalizados, obteniendo una incidencia de RAM en estos pacientes de 13.7%59. Ante la escasa posibilidad de investigación de seguridad en nuestro país, es necesario promover la farmacovigilancia a nivel nacional, en las farmacias comunitarias, la atención primaria y los centros de atención cerrada, de forma de generar datos locales que nos permitan optimizar la seguridad de medicamentos en nuestra población.
CONCLUSIONESA pesar de los avances en materia de farmacología pediátrica, los pacientes pediátricos siguen siendo “huérfanos terapéuticos”. Claramente los pacientes pediátricos son distintos a los adultos, en su comportamiento farmacocinético y farmacodinámico, lo que determina que encontrar la dosis exacta de un medicamento en un niño sea un reto, actuar que es complicado aún más por la presencia de covariables adicionales que alteran aún más la respuesta. A la espera de que la investigación científica promueva que varios medicamentos utilizados en pediatría no tengan la condición Off-Label, es necesario utilizar herramientas como el uso de TDM o farmacovigilancia; y conocer las diferencias farmacológicas entre niños de los adultos para buscar una terapia efectiva y segura.
Los autores declaran no tener conflictos de interés, en relación a este artículo.