Las Enfermedades Inflamatorias Intestinales (EII) son entidades crónicas del tracto digestivo, que afectan frecuentemente a pacientes en edad reproductiva. Debido a las características de estas enfermedades y su tratamiento, existen múltiples desafíos. En este artículo, revisamos la evidencia más reciente con respecto a fertilidad y embarazo en pacientes con EII. En general, existe evidencia de que pacientes con EII tienen una mayor tasa de complicaciones durante el embarazo con respecto a pacientes sin EII. Sin embargo, esta diferencia está directamente asociada al grado de actividad de la enfermedad. La mayor parte de los fármacos hoy usados en el tratamiento de EII son considerados seguros durante el embarazo y se recomienda continuarlos, sobre todo considerando que el mayor riesgo de complicaciones está asociado a una enfermedad activa. Sin embargo es importante considerar las opciones caso a caso. Las dos grandes excepciones son metotrexato y talidomida que están completamente contraindicadas. La recomendación más importante es educar a toda paciente con EII en edad reproductiva, explicando que el embarazo debe llevarse a cabo cuando la enfermedad esté controlada y que la probabilidad de complicaciones está relacionada con el grado de actividad y severidad de la EII. Los médicos tratantes deben educar a las pacientes, enfatizando el seguimiento de los controles y tratamiento.
Inflammatory bowel diseases (IBD) are chronic conditions of the gastrointestinal tract that can affect patients during their childbearing years. Considering the characteristics of disease and the medications used to treat it, several issues arise in the care of these patients when they attempt or achieve conception. We review the most current evidence concerning fertility and pregnancy outcomes in patients with IBD. With the exception of those women who undergo pelvic surgery, patients with IBD have no decreased fertility. Overall, when looking at obstetrical outcomes, patients with IBD have worse outcomes when compared to controls, but this is usually driven by disease activity at conception. While most medications used to treat IBD are low risk, some precautions need to be taken and the risk-to-benefit ratio needs to be considered on a case-to-case basis. In general, aminosalicylates and thiopurines should be continued, but methotrexate and thalidomide are contraindicated. Anti-tumor necrosis factor agents are considered safe to continue but full monoclonal antibodies do cross the placenta. As a general rule, it is important to counsel women that conception is optimal when disease is in remission, as adverse obstetrical outcomes are directly associated with disease activity. Clinicians need to educate patients before, during and after conception, emphasizing treatment compliance.
Las enfermedades inflamatorias intestinales son un grupo de entidades caracterizadas por inflamación en el tracto digestivo. Las dos entidades más reconocidas son la Enfermedad de Crohn (EC) y la Colitis Ulcerosa (CU). La etiopatogenia no es clara, pero se cree que es secundaria a una respuesta inmune aberrante hacia bacterias del tracto digestivo.
La mayor parte de los pacientes con EII desarrollan la enfermedad entre la segunda y la cuarta década de vida, afectando a pacientes en edad reproductiva1. El embarazo representa una preocupación mayor en mujeres con EII debido a potenciales problemas de fertilidad, aprehensión del potencial efecto que la enfermedad puede tener en el embarazo y el feto, el posible efecto teratogénico de los medicamentos usados y el conocimiento limitado de los efectos que a largo plazo puedan tener los agentes introducidos al mercado más recientemente. Un estudio mostró que entre mujeres nulíparas con EII, las principales preocupaciones son el efecto que la enfermedad pueda tener en la fertilidad y gestación, y en los efectos que los medicamentos puedan tener sobre el feto2.
Estos factores llevaban a pacientes a evitar el embarazo o a descontinuar tratamientos después de que se logra la concepción. Afortunadamente, nuevos agentes terapéuticos han revolucionado el tratamiento de las EII y esto ha llevado a la mejoría en el pronóstico y a la reducción de la tasa de cirugías en esta población3. Como resultado, las mujeres con EII están más abiertas a considerar el embarazo y una gestación sin complicaciones es una expectativa realista. Es importante establecer cuidados y controles esenciales antes de planear el embarazo. Esto incluye inmunizaciones y otros procedimientos preventivos como la detección de displasia y/o carcinoma cérvico-uterino y del colon (cuando está indicado). Es también importante asegurar que no existan déficits de macro o micronutrientes incluyendo vitamina B12, ácido fólico y hierro.
Otro tema que es frecuentemente fuente de discusión con las pacientes, es el riesgo que sus progenitores desarrollen la enfermedad. Estudios han demostrado que el riesgo es de entre 1.6 a 5.2% si un padre tiene EII, mientras que si ambos padres tienen la enfermedad, éste aumenta a 33%4. Un equipo multidisciplinario, incluyendo obstetras, pediatras, gastroenterólogos y cirujanos deben tomar la responsabilidad conjunta del cuidado de estos pacientes. En esta revisión, describiremos la evidencia más reciente con respecto a fertilidad y embarazo en pacientes con EII.
EII, FERTILIDAD Y FECUNDIDADLa literatura obstétrica define infertilidad como la incapacidad de concebir tras un año de relaciones sexuales regulares en la fase fértil del ciclo menstrual sin uso de métodos anticonceptivo5. Fecundabilidad es la posibilidad que una mujer tiene de embarazarse en un ciclo menstrual y fecundidad es la probabilidad de la conducción efectiva de un embarazo a término en un ciclo reproductivo6.
El concepto de fertilidad concierne al hombre y a la mujer con EII. La mayor parte de los estudios han demostrado que las tasas de infertilidad en pacientes con EC son similares a las reportadas en la población general, aunque algunos estudios muestran datos contradictorios7,8. En general, el consenso es que el grado de actividad de la EII, la historia de una cirugía relacionada con la EC y la localización en el colon han sido asociados con menores tasas de concepción8.
Pacientes mujeres con CU que no se han sometido a una colectomía no tienen una menor tasa de fecundidad. Sin embargo, aquellas que han requerido una proctocolectomía con reservorio íleo-anal presentan una reducción significativa de la fecundidad9,10. Dos meta-análisis han confirmado estos datos11,12. Considerando que las mujeres sometidas a una colectomía con ileostomía y preservación rectal conservan su fertilidad, el mecanismo fisiopatológico de este fenómeno pareciera ser las adherencias formadas en las pelvis y una disfunción de las trompas de Falopio después de la creación del reservorio íleo-anal13,14. Esto ha llevado a mucho clínicos a recomendar procedimientos de menor complejidad (y con menos tasas de complicaciones intra-pélvicas) en pacientes que quieren tener descendencia (como una colectomía con ileostomía y preservación rectal), para luego proceder a hacer una proctectomía y crear un reservorio y anastomosis íleo-anal después de que la paciente haya tenido hijos. Es importante mencionar que en aquellas pacientes con un reservorio íleo-anal que presentan problemas de fecundidad, la fertilización in vitro es una posibilidad a considerar y el procedimiento tiene tasas de embarazo similares en pacientes con un diagnóstico de CU con o sin reservorio15.
Resultados de la gestación en pacientes con EIILa mayoría de los estudios ha mostrado que las mujeres embarazadas con EC o CU tienen una mayor tasa de parto prematuro y un mayor riesgo de tener hijos con bajo peso al nacer16. También se ha visto que tienen un mayor riesgo de parto por cesárea17. Un estudio hecho en Japón observó una serie de variables en embarazos previos al diagnóstico de la enfermedad y los comparó con embarazos después que la enfermedad se desarrolló en la paciente. Los autores reportaron que la evolución del embarazo fue similar antes y después de que la paciente desarrollara CU18. Sin embargo, también encontraron que la tasa de abortos espontáneos era mayor en pacientes después de desarrollar EC18. Otro estudio realizado en Dinamarca y Suecia tampoco encontró una mayor tasa de complicaciones en el embarazo en pacientes con CU16. En Israel, otro estudio investigó la evolución y desarrollo de hijos de madres con EII en el largo plazo y los comparó con otro grupo con madres sin EII (grupo control). El grupo con madres afectadas con una EII fue observado por una media de 14 años, mientras que el grupo control fue observado por una media de 12 años. El equipo de investigadores encontró que aquellos hijos de madres con EII tenían una mayor tasa de anormalidades congénitas y de desarrollo del sistema nervioso19.
La experiencia publicada en Chile es limitada. Existe un reporte de casos incluyendo 17 pacientes. Del grupo estudiado, la mayoría de las pacientes se encontraba en remisión, 88% de las madres tuvo partos de término y complicaciones significativas solo ocurrieron en pacientes con EII activa20.
A pesar de que la evidencia muestra una tendencia hacia un mayor riesgo de complicaciones, este fenómeno está relacionado principalmente al grado de actividad de la EII. Cuando el embarazo se desarrolla mientras la paciente está en remisión, no existe diferencias con aquellas mujeres sin la enfermedad21.
ACTIVIDAD DE LA EII EN EL EMBARAZOEn CU, el consenso es que el embarazo no afecta la evolución de la enfermedad, a pesar de que descontinuar el tratamiento farmacológico y dejar de fumar pueden gatillar una crisis22. Un estudio en Chile mostró resultados similares6. En pacientes que se hayan sometido a una colectomía con creación de un reservorio y anastomosis íleo-anal, es recomendable evitar partos vaginales a pesar de que la literatura no ha descrito un mayor riesgo de complicaciones23.
En pacientes con EC, la influencia que el embarazo tiene en la evolución de la enfermedad ha sido fuente de debate. Un estudio realizado en Francia mostró que un grupo de pacientes con EC presentó mayores índices de actividad el año antes y posterior al embarazo24. Es importante mencionar de que este estudio no consideró el uso de tabaco, el cual puede afectar el grado de actividad inflamatoria. Otro estudio describió que pacientes con EC que habían tenido un embarazo previo tenían una menor tasa de resecciones intestinales cuando fueron comparadas a otro grupo de pacientes con EII sin historia previa de embarazo25. En otro estudio europeo, los autores no encontraron ninguna diferencia al comparar tasas de estenosis o resecciones intestinales. Sin embargo, al comparar las tasas de crisis, los investigadores encontraron que las mujeres con EC tenían una menor cantidad de exacerbaciones de la enfermedad después del embarazo26. Kane et al. investigó el rol de la discordancia materno-fetal de HLA como mecanismo biológico y su potencial influencia en el grado de actividad en la enfermedad. El estudio demostró que una discordancia en el loci DRB1 y DQ estaba asociado con un grado de enfermedad leve y con una mejoría de los síntomas a largo plazo27. El tipo de parto recomendado varía según la presencia de enfermedad peri-anal. En aquellas pacientes con compromiso peri-anal, se recomienda un parto por cesárea28.
Otro importante tópico que debe ser considerado por el equipo clínico, es la evaluación endoscópica en pacientes embarazadas. Cuando sea posible, estos procedimientos deben ser diferidos al segundo trimestre o al posparto. El equipo obstétrico debe estar involucrado en la evaluación y en la decisión de efectuar el procedimiento, tomando en cuenta los riesgos y beneficios, y la frecuencia cardíaca fetal debe monitorizarse durante el procedimiento. La experiencia efectuando colonoscopias es limitada, pero es factible realizarlas en forma segura siempre y cuando el escenario clínico sea apropiado29,30. Las dos variables críticas son la posición de la paciente durante el procedimiento, la cual tiene que realizarse en decúbito lateral izquierdo, pero para evitar compresión vascular, se debe ubicar una almohada bajo la cadera derecha31. Si se precisa limpieza colónica, se prefiere el uso de polietilenglicol ya que es considerado de bajo riesgo. Si es posible, sigmoidoscopías deben realizarse sin sedación. Cuando se necesitan fármacos para sedar a la paciente (como en una colonoscopía), propofol es el agente preferido, siempre con un equipo de anestesia y obstétrico presente y monitorización fetal. Si propofol no se encuentra disponible, se puede utilizar meperidina (grupo B de la FDA), evitando el uso de otros opioides como la morfina o el fentanilo. Las benzodiacepinas deben evitarse ya que pertenecen al grupo D y existe evidencia de que su uso está asociado a teratogenicidad32.
Otro potencial escenario, es la necesidad de una intervención quirúrgica para el tratamiento de la enfermedad intestinal o una de sus complicaciones. En general, las indicaciones para cirugía son las mismas que en pacientes no embarazadas. Desafortunadamente, la morbilidad maternal y fetal es alta, y si es posible, el procedimiento debe posponerse al segundo o tercer trimestre. Es importante mencionar que si se lleva acabo la intervención quirúrgica, debe hacerse en la forma menos invasiva posible. Por ejemplo, en casos de CU fulminante en donde una colectomía está indicada, se puede realizar una descompresión colónica, seguida de una colectomía total después del parto. Este procedimiento se conoce como colostomía en “Turnbull blowhold” y consiste en primero realizar una incisión de entre 7 y 10 CM en la línea media abdominal. Se realiza una exploración de la cavidad peritoneal para descartar una perforación intestinal. Un asa de ileo terminal se usa para crear una ileostomía en asa en el cuadrante superior derecho del abdomen y luego se realiza una colostomía a nivel del colon transverso, descomprimiendo el resto del colon33.
Muchas madres con EII evitan la lactancia por miedo a los potenciales efectos secundarios que los medicamentos puedan tener sobre sus hijos. Un estudio mostró que las madres con EII que no amamantaban a sus hijos tenían un mayor riesgo de presentar con una exacerbación de la enfermedad, pero esto fue atribuido al hecho que aquellas pacientes que estaban amamantando habían discontinuado los medicamentos34. Otro estudio realizado en Canadá no mostró diferencias en los patrones de lactancia entre madres con y sin EII35. En conclusión, no existe evidencia que la lactancia tenga un efecto biológico sobre la enfermedad inflamatoria.
MEDICAMENTOSDebido a múltiples causas, la adherencia al tratamiento farmacológico durante el embarazo es bajo36. Afortunadamente, intervenciones dirigidas a educar a las madres tiene el potencial de revertir este efecto37. A pesar de que la evidencia ha mostrado que la variable que más influencia la evolución del embarazo es el grado de control de la EII, muchos clínicos y/o pacientes discontinúan una o mas fármacos al momento que el embarazo es detectado. Una de las explicaciones es el miedo al potencial riesgo de teratogenicidad. Discontinuar medicamentos puede tener efectos detrimentales para la madre y el feto, especialmente en aquellos casos en que la EII es severa38.
La evaluación de los efectos que un medicamento tiene sobre el embarazo es extremadamente difícil debido a que un gran número de pacientes es necesario para probar una asociación con eventos poco frecuentes. A mismo tiempo, no es ético realizar un estudio randomizado para evaluar efectos secundarios. El tópico se complica aun mas cuando consideramos que la farmacocinética del medicamento está usualmente alterada durante el embarazo, afectando la dosis requerida y la medición de los niveles.
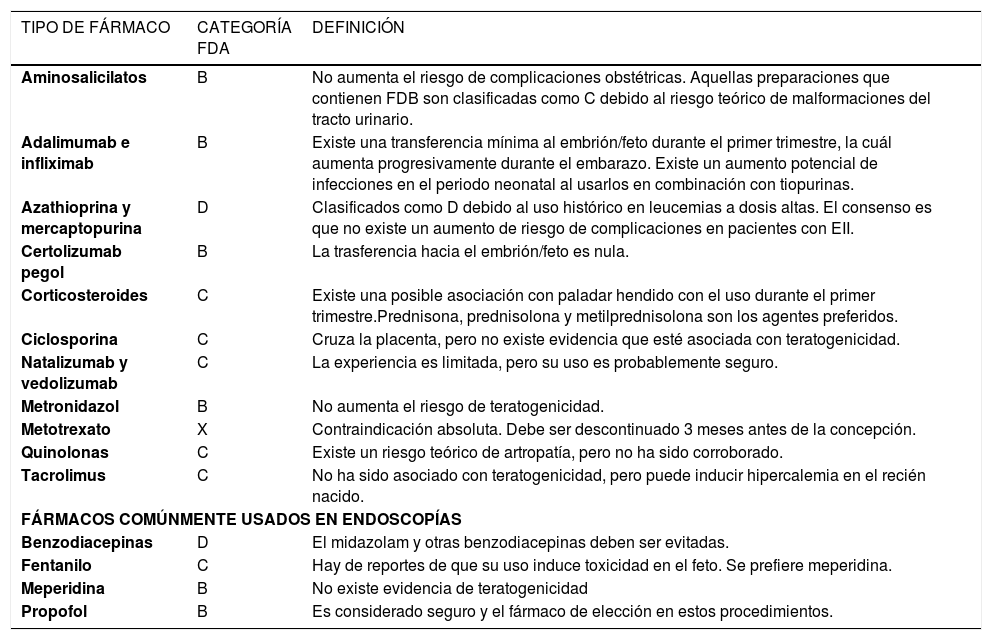
AminosalicilatosNo existe evidencia de que la sulfasalazina (Azulfidine®) o la mesalazina (Mecolzine®, Mesax®, Pentasa®, Salofalk®) aumenten el riesgo de malformaciones congénitas39–41. En mayo de 2010, la “Food and Drug Administration” (FDA) anunció una advertencia involucrando dos preparaciones de mesalazina disponibles en algunos países (Asacol® y Asacol HD®), debido a que están recubiertas con un preparado que contiene Ftalato de dibutilo, el cual ha sido asociado a malformaciones esqueléticas, del tracto urológico y del sistema reproductivo al ser administrado a animales en dosis muy altas42. Es por esto que Asacol® fue reclasificado como un medicamento clase C (Tabla 1) mientras que otras preparaciones conteniendo mesalazina están clasificadas como clase B. Es importante mencionar de que pacientes en sulfasalazina requieren un suplemento diario de ácido fólico ya que la sulfasalazina inhibe la dihidrofolato reductasa, disminuyendo el reservorio de ácido fólico en el organismo. Se ha demostrado que la suplementación con ácido fólico disminuye el riesgo de paladar hendido y la incidencia de malformaciones del sistema cardiovascular43. La cantidad de productos metabólicos excretados en la leche materna es mínimo y se considera de bajo riesgo44.
CATEGORÍAS EN QUE LA FOOD AND DRUG ADMINISTRATION (FDA) CLASIFICA LOS FÁRMACOS EN RELACIÓN CON SU POSIBLE EFECTO EN EL EMBARAZO
| CATEGORÍA FDA | DEFINICIÓN |
|---|---|
| A | Estudios controlados en animales y mujeres embarazadas no muestran riesgo en el primer trimestre y la posibilidad de daño fetal es muy baja. |
| B | Estudios en animales no muestran riesgos fetales pero no hay estudios controlados en humanos o en los estudios de animales se han observado efectos adversos, pero no se han confirmado en estudios controlados en mujeres en el primer trimestre. |
| C | Los estudios en animales han demostrado que el fármaco ejerce efectos teratogénicos o embriocidas, pero no existen estudios controlados en humanos o no se dispone de estudios ni en animales ni en humanos. |
| D | Existe evidencia positiva de riesgo fetal, sin embargo, los beneficios pueden superar a los riesgos si existe riesgo para la vida o la enfermedad es grave. |
| X | Estudios en animales o en humanos muestran anomalías fetales (fármacos contraindicados). |
En hombres, la sulfasalazina induce oligospermia y altera la producción de espermatozoides con alternaciones morfológicas y fisiológicas. Estos cambios son reversibles al discontinuar el medicamento. En estos casos, es recomendable reemplazar la sulfasalazina por mesalazina45–47.
AntibióticosA pesar de que el tratamiento antibiótico no es de primera línea en la terapia de EII, algunos medicamentos son frecuentemente usados en EII, especialmente quinolonas y nitro-imidazoles48. Estos antibióticos cumplen un rol en el tratamiento de enfermedad peri-anal, fístulas y previniendo el recurrencia de la EC en pacientes sometidos a una resección intestinal (nitro-imidazoles)49. Un curso limitado de metronidazol (Flagyl®) es considerado seguro y no aumenta el riesgo de teratogenicidad. Actualmente, es un medicamento categoría B50–52. El metronidazol es detectable en leche de madres recibiendo la droga, y a pesar de que no se ha encontrado que en el corto plazo pueda ejercer un efecto en el neonato, no se recomienda la exposición prolongada debido a que no existen estudios al respecto53.
Las quinolonas también son frecuentemente usadas en el tratamiento de la EC. Debido a que tienen una alta afinidad por el tejido óseo y el cartílago, teóricamente podrían aumentar el riesgo de artropatías. A pesar de este factor, no existe evidencia de este riesgo en humanos pero considerando que existen alternativas más seguras, es recomendable evitar el medicamento durante el embarazo54,55. Rifaximina (Normix®, Ribolac®) es otro antibiótico con uso potencial en la EC. Estudios clínicos han demostrado que es eficaz en el tratamiento de la EC56. Debido a que es un medicamento relativamente nuevo, no existen estudios del impacto que pueda tener en el feto, y es clasificado dentro de la categoría C. Considerando que actúa solo en el tracto digestivo (sin ser absorbido) el riesgo debiera ser nulo.
CorticosteroidesLos corticosteroides han sido extensamente usados en el tratamiento de la EII. Debido a los múltiples (y a veces severos) efectos adversos, su uso en el largo plazo es limitado. La mayor parte de trabajos en humanos, incluido un estudio prospectivo, han concluido que no aumentan el riesgo de teratogenicidad57,58. Sin embargo, otros trabajos han descrito un aumento en la incidencia de paladar hendido59,60. Es importante mencionar de que la dosis usada también debe ser considerada al analizar el riesgo de un afecto adverso. Por ejemplo, un estudio realizado en pacientes con artritis reumatoidea demostró que la dosis de prednisona (Bersenm®, Cortiprex®, Procion®) igual o mayor a 15mg diarios aumentan significativamente el riesgo de infección intra-uterina y parto prematuro61. Otra potencial complicación del uso de corticosteroides durante el embarazo es el efecto supresor que la droga pueda ejercer sobre el feto, pero esto no se ha observado en la práctica clínica. Adicionalmente, existe un mayor riesgo de desarrollar diabetes gestacional62.
El uso de budesonida (Entocort®, Budenofalk®) en formulaciones orales han sido utilizada como alternativas a los corticoides orales, pero la experiencia en su uso durante el embarazo es limitada. En un reporte de casos incluyendo ocho pacientes recibiendo budesonida, no hubo complicaciones peri-natales. Sin embargo, se necesitan estudios incluyendo a un mayor número de pacientes es necesario antes de considerar la budesonida segura durante el embarazo63.
Los corticoides se encuentran dentro de la categoría C, y su uso debe de ser considerado en cada caso dependiendo de los riesgos y beneficios. En aquellos casos en que corticoides deben ser administrados, se debiera usar prednisona, prednisolona o metil-prednisolona ya que su metabolización en la placenta es mayor que otras formas farmacéuticas. Existen estudios hechos en madres recibiendo prednisona o prednisolona y se ha encontrado que la concentración en leche materna que estas drogas alcanzan es baja y amamantar durante el tratamiento con estos fármacos es considerado seguro64.
InmunomoduladoresAzatioprina y mercaptopurinaLa azatioprina (AZA) (Imuran®), y mercaptopurina (MP) (Purinethol®) han sido utilizadas en el tratamiento de la EII como monoterapia o en combinación con agentes biológicos. El metabolismo de estas drogas es bastante complejo ya que el fármaco es una pro-droga que puede ser metabolizada hacia distintos metabolitos dependiendo de múltiples factores, incluyendo variaciones genéticas entre pacientes. La AZA y MP pertenecen a la categoría D debido a que estudios en animales recibiendo AZA parenteral encontraron que la exposición a la droga aumenta el riesgo de varias malformaciones, incluyendo paladar hendido, malformaciones del sistema óseo, un sub-desarrollo del timo, alteraciones del sistema límbico, oftalmológico y urológico65,66. Sin embargo, es importante mencionar que en estos estudios se utilizaron dosis altas del fármaco y fueron administradas parenteralmente (intra-peritoneal y subcutáneo). Estudios en humanos han comprobado que estas drogas no imponen un riesgo para el feto. Considerando la evidencia en cuanto a la seguridad de la madre y el feto, y el hecho de que el factor más peligroso es la reactivación (o empeoramiento) de la EII de la madre. Se recomienda continuar el medicamento durante el embarazo.
La lactancia durante el uso de tiopurinas es también una fuente de debate. Un estudio hecho en Dinamarca incluyendo ocho pacientes encontró que la excreción de MP en la leche materna es extremadamente baja (<0.008mg por kg de peso en 24 hr) y solo es detectable dentro de las cuatro primeras horas después de ingerido el medicamento. Otro estudio realizado en Austria encontró que los hijos de madres recibiendo AZA no presentaron un aumento de la incidencia de infecciones67. En el mismo estudio, los autores reportaron que el desarrollo infantil y la incidencia de hospitalizaciones no se veía afectado en el grupo de pacientes recibiendo leche de madres recibiendo la droga. La recomendación actual es que madres recibiendo tiopurinas pueden amamantar a sus hijos, minimizando la exposición a la leche producida dentro de las primeras cuatro horas de recibido el medicamento. Las tiopurinas no parecen afectar la fertilidad del hombre68.
MetotrexatoEl efecto teratogénico del metotrexato (MTX) ha sido bien descrito y se encuentra dentro de la categoría X de la FDA. La exposición prenatal en el primer trimestre aumenta el riesgo de retraso en el crecimiento intrauterino, la hipoplasia de las crestas supraorbitarias, anormalidades cerebrales, malformaciones del sistema esquelético, defectos en las extremidades y retraso mental69. La exposición fetal en el segundo y/o tercer trimestre puede inducir retardo del crecimiento intra-uterino69. Las mujeres recibiendo MTX deben estar bajo un régimen anticonceptivo confiable y antes de embarazarse, deben haber discontinuado el fármaco por tres meses. El MTX es excretado en la leche materna y no debe ser usado durante la lactancia70.
Como con las tiopurinas, también existe preocupación con respecto a la fertilidad y riesgo de teratogenicidad que el MTX pueda inducir en hombres recibiendo la droga y con deseos de concebir. Actualmente, no existe evidencia que esto pueda suceder, a pesar de que existen reportes de casos en que pacientes han desarrollado oligospermia después de comenzar MTX, la cual es reversible después de que se descontinúa71. Debido a la escasa evidencia, se recomienda que los pacientes hombres discontinúen el MTX tres meses antes de concebir.
Ciclosporina y tacrolimusLa ciclosporina (Equoral®, Restasis®, Sandimmun®, Sandimmun Neoral®) y el tacrolimus (Cidimus®, T-Inmun®) son inhibidores de la calcineurina ampliamente usados para evitar el rechazo de injertos después de un trasplante. Ambos fármacos pueden tener un rol en el tratamiento de las EII y se encuentran dentro de la categoría C de la FDA. La ciclosporina atraviesa la placenta, y los niveles en la circulación fetal varían entre 10 y 50% de la materna72. Estudios no han demostrado un aumento en el riesgo de malformaciones, aunque existen reportes de un posible aumento de la incidencia de bajo peso al nacer73. El tratamiento con ciclosporina en una paciente embarazada con EII tiene indicación en casos excepcionales debido a los efectos adversos que la droga podría tener sobre la madre, incluyendo hipertensión arterial y nefropatía. Una posible indicación sería el tratamiento de una CU fulminante refractaria a corticosteroides, la cual podría incluso evitar un aborto74,75. Los niveles de ciclosporina en leche materna son equivalentes a los niveles en la circulación materna, y la lactancia no es recomendada por los potenciales efectos inmunosupresores y tóxicos en el feto76.
El uso de tacrolimus es considerado una opción para el tratamiento de EII en algunos casos. Tal como con la ciclosporina, la experiencia es mayormente en pacientes post-trasplante y los estudios no han demostrado que su uso afecte el pronóstico obstétrico. Un meta-análisis de estudios realizados en pacientes recibiendo tacrolimus como inmunosupresión después de un trasplante concluyó que no existía un mayor riesgo de malformaciones congénitas77. El crecimiento pre y post-natal no se ve afectado y es similar al de la población general78, pero el uso de tacrolimus durante el embarazo ha sido asociado con hipercalemia en el recién nacido. El tacrolimus es detectable en leche materna, pero los niveles son extremadamente bajos (alrededor de 0.06μg por kg de peso en 24 hr.79. A pesar de que teóricamente la lactancia debiera ser posible, la experiencia es muy limitada y no es recomendada, sobre todo considerando que tacrolimus es un fármaco usado como inducción y no tanto como un agente de mantención.
Agentes biológicosInfliximab y adalimumabInfliximab (Remicade®) y adalimumab (Humira®) son anti-cuerpos monoclonales de tipo IgG1 que bloquean el efecto pro-inflamatorio del factor de necrosis tumoral alfa (FNT). Su uso está aprobado para el tratamiento de la EC y CU. Ambos agentes biológicos están clasificados dentro del grupo B de la FDA80. Debido a que son fármacos relativamente nuevos, no existe una gran cantidad de información con respecto a los potenciales efectos adversos que puedan tener en el feto o el recién nacido. Es sabido que existe una gran concentración de FNT y su receptor en múltiples tejidos del sistema reproductivo, incluida la decidua, placenta y tejido endometrial81. Interesantemente, estudios en animales han revelado que el FNT protege el embrión de teratogenicidad82. Al mismo tiempo, existe evidencia que la sobre-expresión de FNT (como durante una infección durante el embarazo) puede inducir daño de la placenta, abortos y retraso del crecimiento83,84. En general, la IgG es transportada a través de la placenta desde la circulación materna a la fetal. El análisis de niveles de IgG a través del embarazo han demostrado que el transporte de IgG aumenta proporcionalmente a la edad gestacional. Durante las primeras semanas de gestación, el transporte es prácticamente nulo, pero va aumentando progresivamente a medida que avanza el embarazo85. Las IgG son transportadas a través de la placenta activamente y mediado por el receptor fetal Fc del sinciciotrofoblasto86. Estudios han revelado que los niveles de infliximab y adalimumab son mayores en los recién nacidos que en sus respectivas madres y pueden ser detectados hasta seis meses después del parto87,88. En un reporte de casos, los autores encontraron que cuando infliximab se discontinúa antes de las 30 semanas de embarazo, los niveles en el recién nacido son indetectables89.
Estudios en animales han revelado que no existe un riesgo de malformaciones o alteraciones del desarrollo del sistema inmunológico90,91. Los estudios en humanos sugieren (como en otros medicamentos usados en EII) que la enfermedad como tal (y no el tratamiento) es responsable del aumento en complicaciones obstétricas y peri-natales.
La mayor parte de los estudios de fármaco-vigilancia han demostrado que infliximab y adalimumab no aumentan el riesgo de malformaciones o de complicaciones peri-natales92,93. El registro PIANO (“Pregnancy in Inflammatory bowel diseases And Neonatal Outcomes”) es una iniciativa reciente que tiene como objetivo determinar si los inmunosupresores usados en el tratamiento de las EII (incluidos los anti-FNT) afectan el pronóstico del embarazo o si aumentan el riesgo de enfermedad peri-natal. En un informe preliminar, los autores reportaron que no existió un mayor riesgo de malformaciones congénitas en recién nacidos de madres recibiendo tiopurinas o agentes biológicos. Sin embargo, aquellos recién nacidos de madres recibiendo terapia con infliximab o adalimumab en combinación con una tiopurina tienen un 35% mayor riesgo de infecciones entre los 9 y 12 meses de edad cuando son comparados con aquellos recién nacidos de pacientes recibiendo solo un medicamento. No se encontró una diferencia en cuanto a desarrollo físico o psicomotor.
A pesar de que la mayor parte de los estudios no han mostrado una asociación entre los anti-FNT y complicaciones del embarazo o malformaciones congénitas, una revisión de reportes enviados a la FDA encontró una gran cantidad de casos de malformaciones en hijos de madres expuestas a infliximab o ertanecept. Los autores reportaron que la mayoría de estas malformaciones congénitas pertenecen al síndrome VACTERL (defectos vertebrales, ano imperforado, polidactilia, malformaciones cardiacas y renales, atresia esofágica con fístula traqueo-esofágica e hidrocefalia)94. Estos resultados deben ser interpretados con sumo cuidado debido a existe un sesgo relacionado al reporte de casos y a que las malformaciones cardiacas son relativamente comunes. Un estudio poblacional realizado en Europa no replicó estos resultados95.
Un aspecto importante relacionado con el uso de agentes biológicos en la embarazada es la administración de vacunas vivas atenuadas en los recién nacidos. Como fue mencionado anteriormente, es posible detectar niveles de infliximab y adalimumab hasta seis meses después del parto88, y el uso de vacunas vivas (sarampión, parotiditis, rubéola, polio, fiebre amarilla, varicela, Bacillus Calmette-Guérin [BCG] y tifoidea oral) está contraindicado. Un reporte de caso describió un recién nacido sin morbilidad expuesto a infliximab durante su vida intrauterina que no fue amamantado y recibió la BCG a los tres meses. El paciente desarrolló una infección diseminada por BCG, la que eventualmente fue fatal96. Un tema de debate es cómo administrar estos anti-FNT durante el embarazo. El paso de IgG es proporcional con la edad gestacional y estudios clínicos han demostrado la transferencia de anticuerpos monoclonales desde las 26 semanas de gestación. Adicionalmente, el receptor FcRn en la placenta es funcional a las 13 semanas de embarazo, por lo tanto el paso de IgG podría darse antes. En pacientes recibiendo infliximab, lo ideal es administrar la última dosis a la semana 30 o 32 de embarazo y después administrar una nueva infusión inmediatamente después del parto. A pesar de que teóricamente esta estrategia disminuiría la exposición del feto al infliximab administrado a la madre, las repercusiones clínicas son poco claras y se debe considerar que retrasar una dosis de infliximab aumenta el riesgo de desarrollar inmunogenicidad contra el fármaco, lo que podría tener repercusiones negativas en el corto y largo plazo. Con adalimumab, la situación es diferente ya que este fármaco se administra cada una o dos semanas (dependiendo del paciente). La demora en días o pocas semanas en la administración del medicamento pueden no solo inducir inmunogenicidad hacia la droga, sino que también una crisis. Es por esto que se recomienda continuar con el adalimumab sin alteraciones en el intervalo de administración de dosis.
La información disponible en cuanto a la presencia de agentes biológicos en la leche materna es limitada. Algunos estudios no han encontrado niveles detectables de anti-FNT, a pesar de que otros si lo han hecho97. La recomendación actual es que el riesgo de lactancia en madres recibiendo anti-FNT es baja.
No existe evidencia de que infliximab o adalimumab afecten la fertilidad masculina a pesar de que un estudio realizado en 10 hombres encontró que la motilidad y morfología de espermios se veía afectada después de una infusión de infliximab98. Contrariamente, otros estudios han mostrado una mejoría en la motilidad de los espermatozoides99. Este fenómeno podría ser explicado por una mejoría de la actividad inflamatoria inducida por la EII.
Certolizumab pegolCertolizumab pegol (Cimzia®) es un anticuerpo monoclonal humanizado. El fragmento Fab está unido a una molécula de polietilenglicol y al igual que infliximab y adalimumab, neutraliza el efecto del FNT100. A diferencia de infliximab y adalimumab, certolizumab pegol carece de la región Fc de la inmunoglobulina, lo que teóricamente impediría el transporte a través de la placenta. Un estudio realizado en pacientes embarazadas en tratamiento con certolizumab pegol demostró que los niveles del fármaco eran indetectables (<2μg/ml) en los 10 recién nacidos estudiados101.
En reportes preliminares del registro PIANO, el uso de certolizumab pegol no fue asociado con un aumento en el riesgo de malformaciones congénitas ni tampoco con un aumento en las infecciones en el recién nacido, aún cuando se usó combinado con tiopurinas102. Debido a esta evidencia clínica, se recomienda seguir con el fármaco durante la lactancia, sin interrumpir el tratamiento. Certolizumab pegol es considerado un agente seguro en la lactancia.
Natalizumab y vedolizumabNatalizumab (Tysabri®) es un anticuerpo monocloncal del tipo IgG 4 que actúa bloqueando integrinas (integrina alfa-4/beta-1 e integrina alfa-4/beta-7), modulando el tráfico de linfocitos en el sistema nervioso e intestino. Su uso ha sido aprobado para el tratamiento de la EC, pero debido al aumento en el riesgo de leucoencefalopatía multifocal progresiva su uso ha sido limitado a casos refractarios a otros medicamentos. Natalizumab es clasificado dentro de la categoría C. En modelos animales, no se ha encontrado que el uso de natalizumab aumente el riesgo de abortos espontáneos o teratogenicidad103. Estudios realizados para analizar el potencial efecto de natalizumab en la fertilidad revelaron que el fármaco no afecta la fertilidad en el hombre, pero que a dosis muy altas (30mg/kg), puede reducir la tasa de embarazos104. La mayor parte de la experiencia en humanos es en pacientes recibiendo natalizumab para el tratamiento de la esclerosis múltiple. Un estudio realizado en Alemania mostró que en 29 pacientes, 28 recién nacidos fueron absolutamente sanos y solo uno presentó una malformación menor en una mano105. Debido a que no existen datos al respecto, la lactancia no es recomendada.
Vedolizumab (Entyvio®) es un anticuerpo monoclonal IgG1 que solo bloquea la integrina alfa-4/beta-7, modulando el tráfico de linfocitos solo en el intestino (y no en el sistema nervioso). Estudios clínicos mostraron su eficacia en el tratamiento de la EC y CU no ha habido reportes de leucoencefalopatía multifocal progresiva106,107. Fue recientemente aprobado por la FDA y clasificado como una droga tipo B. Debido a que ha estado disponible por poco tiempo, no existe experiencia en pacientes embarazadas, pero teóricamente y en base su mecanismo de acción y especificidad por el sistema digestivo debiera ser seguro.
CONCLUSIONESFertilidad y embarazo en pacientes con EII es un tópico sumamente importante. Los planes de embarazo deben ser analizados en toda paciente en edad reproductiva con el fin de proveer la información y educación adecuada. La mayor parte de los embarazos en pacientes con EII son exitosos y exentos de complicaciones. Sin embargo, es importante planearlo con cuidado y ambos padres deben ser educados y guiados comenzando antes de la concepción. Este cuidado requiere de un equipo multidisciplinario y el monitoreo de la madre y el feto. Pacientes con EII inactiva pueden embarazarse, pero deben ser educadas y controladas durante el embarazo por un obstetra con experiencia en embarazos de alto riesgo y el recién nacido debe ser evaluado y controlado por un pediatra capacitado. El mensaje principal es que un embarazo sin complicaciones es posible, pero debe ser planeado cuando la enfermedad esté en remisión. El equipo médico debe explicar el hecho que el mayor riesgo para la madre y el feto es la actividad de la enfermedad y que descontinuar el o los medicamentos puede ser más perjudicial que los potenciales efectos adversos, sobretodo considerando que la mayoría de los fármacos usados en la actualidad son considerados seguros en el embarazo y durante la lactancia (Tablas 2 y 3). Debido a conflictos éticos, no existen estudios controlados, pero es siempre importante considerar los riesgos y beneficios de cada terapia, siempre tomando en cuenta que la variable que impone el mayor riesgo para el embarazo es una EII activa.
FÁRMACOS USADOS EN EL TRATAMIENTO DE ENFERMEDADES INFLAMATORIAS INTESTINALES Y SUS POTENCIALES RIESGOS DE USO DURANTE EL EMBARAZO
| TIPO DE FÁRMACO | CATEGORÍA FDA | DEFINICIÓN |
|---|---|---|
| Aminosalicilatos | B | No aumenta el riesgo de complicaciones obstétricas. Aquellas preparaciones que contienen FDB son clasificadas como C debido al riesgo teórico de malformaciones del tracto urinario. |
| Adalimumab e infliximab | B | Existe una transferencia mínima al embrión/feto durante el primer trimestre, la cuál aumenta progresivamente durante el embarazo. Existe un aumento potencial de infecciones en el periodo neonatal al usarlos en combinación con tiopurinas. |
| Azathioprina y mercaptopurina | D | Clasificados como D debido al uso histórico en leucemias a dosis altas. El consenso es que no existe un aumento de riesgo de complicaciones en pacientes con EII. |
| Certolizumab pegol | B | La trasferencia hacia el embrión/feto es nula. |
| Corticosteroides | C | Existe una posible asociación con paladar hendido con el uso durante el primer trimestre.Prednisona, prednisolona y metilprednisolona son los agentes preferidos. |
| Ciclosporina | C | Cruza la placenta, pero no existe evidencia que esté asociada con teratogenicidad. |
| Natalizumab y vedolizumab | C | La experiencia es limitada, pero su uso es probablemente seguro. |
| Metronidazol | B | No aumenta el riesgo de teratogenicidad. |
| Metotrexato | X | Contraindicación absoluta. Debe ser descontinuado 3 meses antes de la concepción. |
| Quinolonas | C | Existe un riesgo teórico de artropatía, pero no ha sido corroborado. |
| Tacrolimus | C | No ha sido asociado con teratogenicidad, pero puede inducir hipercalemia en el recién nacido. |
| FÁRMACOS COMÚNMENTE USADOS EN ENDOSCOPÍAS | ||
| Benzodiacepinas | D | El midazolam y otras benzodiacepinas deben ser evitadas. |
| Fentanilo | C | Hay de reportes de que su uso induce toxicidad en el feto. Se prefiere meperidina. |
| Meperidina | B | No existe evidencia de teratogenicidad |
| Propofol | B | Es considerado seguro y el fármaco de elección en estos procedimientos. |
Abreviaciones; EII: enfermedades inflamatorias intestinales, FDB: Ftalato de dibutilo. FDA: Food and Drug Administration.
FÁRMACOS USADOS EN EL TRATAMIENTO DE ENFERMEDADES INFLAMATORIAS INTESTINALES Y SUS POTENCIALES RIESGOS DE USO DURANTE LA LACTANCIA
| TIPO DE DROGA | RECOMENDACIÓN EN LA LACTANCIA |
|---|---|
| Aminosalicilatos | La excreción de aminosalicilatos en la leche materna es mínima y la lactancia está permitida. |
| Adalimumab e infliximab | Puede ser detectada en bajas concentraciones en la leche materna, pero su uso es probablemente seguro. |
| Azatioprina y mercaptopurina | Se encuentra en niveles muy bajos si es medido después de 4 horas de ingerido el medicamento. |
| Certolizumab pegol | Probablemente seguro. |
| Corticosteroides | Los niveles en leche materna son muy bajos y la lactancia es generalmente permitida |
| Ciclosporina | La lactancia está contraindicada ya que el fármaco se encuentra en niveles altos en la leche materna. |
| Natalizumab y vedolizumab | No existe información. No se recomienda su uso aunque en el caso de vedolizumab, debiera ser seguro. |
| Metronidazol | Puede ser detectado en la leche materna por lo que la lactancia con su uso prolongado no es recomendable. |
| Metotrexato | Es excretado en leche materna y la lactancia está contraindicada. |
| Quinolonas | No existen suficientes datos y uso debe ser evitado durante la lactancia. |
| Tacrolimus | Es detectable en la leche materna en bajas concentraciones. |
El autor declara no tener conflictos de interés, en relación a este artículo.