El ultrasonido endoscópico (EUS) ha revolucionado el diagnóstico y el manejo de muchas patologías de la vía digestiva, particularmente la patología pancreática, convirtiéndose en un examen prácticamente imprescindible en el abordaje diagnóstico y terapéutico de un paciente con un problema de páncreas.
Es necesario dejar en claro que el método no es único y que para lograr una sensibilidad alta y cumplir el objetivo de realizar lo más adecuado, debe sumarse a otros métodos de acuerdo a cada caso, como la ecografía, la tomografía axial computarizada (TAC), la resonancia magnética (MRI) en sus diferentes modalidades, y las pruebas del laboratorio clínico microbiológico y patología.
En este artículo se revisarán algunos casos de enfermedades evaluadas con este método, que muestran por qué el EUS, es una herramienta clave para el médico de urgencias y de consulta externa, el internista, el cirujano, el médico del servicio hospitalario y el personal de salud en general, al momento de definir, clasificar y orientar el manejo de determinadas patologías en el tubo digestivo. El EUS es una importante ayuda y no debe ser extraña al personal médico, debe tenerla presente junto a las demás pruebas diagnósticas en patología pancreática. Se señalarán los aspectos más relevantes en cada caso y las indicaciones del EUS.
Endoscopic ultrasound (EUS) has revolutionized the diagnosis and management of many diseases of the digestive tract, particularly the pancreatic ones, becoming a practically essential test in the diagnosis and therapeutic management of a patient with a pancreatic problem.
It́s necessary to establish the final diagnosis are necesary many tests to achive high sensitivity. It should join with other methods according to each case, such as ultrasound, computed tomography (CT), magnetic resonance imaging (MRI) in its various forms, and chemical, microbiological and pathology tests.
In this article we reviewed some cases of pathologies evaluated by this diagnosis test, which demonstrate why the EUS, is a key for the emergency and outpatient physician, internist, surgeon, doctor of the hospital service and staff health in general, when defining, classifying and guide the management of certain diseases in the digestive tract. The EUS is an important tool and should not be foreign to the medical staff, who must consider it, with other diagnostic tests for pancreatic disease. This article point out the most important aspects in each case and indications of EUS.
Existen dos tipos de endosonógrafos: lineales y radiales. Tradicionalmente hay una mayor experiencia con el radial, pues quienes hicieron su entrenamiento cuando apenas comenzaba la era de la endosonografía -hace más de 30 años- aprendieron con este tipo de equipo. Éste permite una visión en 360 grados y es comparable con la TAC, tiene un canal por el que se puede introducir una pinza para tomar biopsias, pero tiene la limitación de no poderse utilizar en terapéutica (Figura 1). Por otro lado, los endosonógrafos lineales permiten una visión de 170 grados y su gran cualidad técnica es que cuentan con un canal de trabajo que permite usar instrumentos para punción, drenajes, y colocación de stents (Figura 2).
ENDONOSOGRAFÍA (EUS) EN PANCREATITIS Y PATOLOGÍA LITIÁSICA DEL CONDUCTO BILIARLa mayor utilidad de la endosonografía (EUS) en la fase aguda de la pancreatitis, está en determinar si el origen es o no por cálculos biliares, ya que de ser litiásica, parte del manejo es mediante la realización de una Colangiopancreatografía Retrógrada Endoscópica (CPRE) 1-3. Tradicionalmente, la CPRE se ha realizado en pacientes con pancreatitis que tienen además de su cuadro típico de dolor, elevación de amilasas, lipasas y bilirrubinas. Sabemos que la CPRE incluso en manos expertas, puede acarrear complicaciones como perforación y desencadenar o agravar la misma pancreatitis. En el siglo XXI no se justifica acceder por medio de CPRE al conducto biliar o al páncreas con fines diagnósticos, existiendo técnicas menos invasivas como la endosonografía (EUS) o la resonancia magnética (MRI) 5, las cuales tienen una alta confiabilidad sin someterlos a los riesgos de la radiación y de la invasión de la CPRE 5.
En un estudio de la Universidad de Temple en Filadelfia, Estados Unidos, se encontró que en los pacientes en los que clínicamente se sospecha pancreatitis de origen biliar (por elevación de enzimas y bilirrubinas altas), si se realizan CPRE directamente, en el 57% de ellos ya los cálculos habían pasado a la luz intestinal. La mayoría de los cálculos que causan pancreatitis son menores de 3mm y estos son poco visibles por resonancia. Es por este motivo que en este estudio se recomendó la realización de EUS cuando se sospeche pancreatitis de origen biliar, antes de la CPRE, evitando así procedimientos innecesarios 6.
En las pancreatitis en pacientes mayores de 40 años, sin factores de riesgo metabólico o biliar, es fundamental la realización de EUS para descartar neoplasia 8.
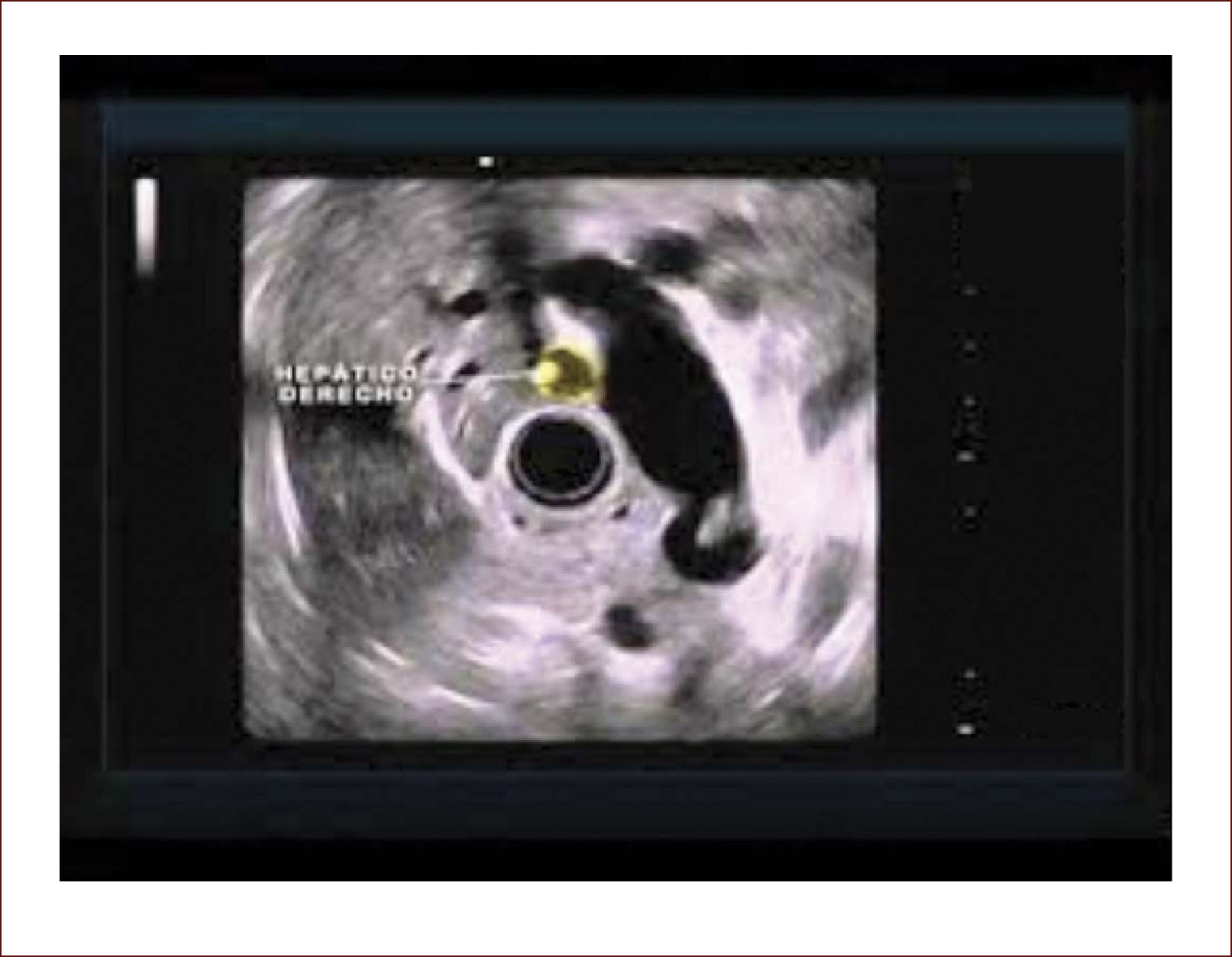
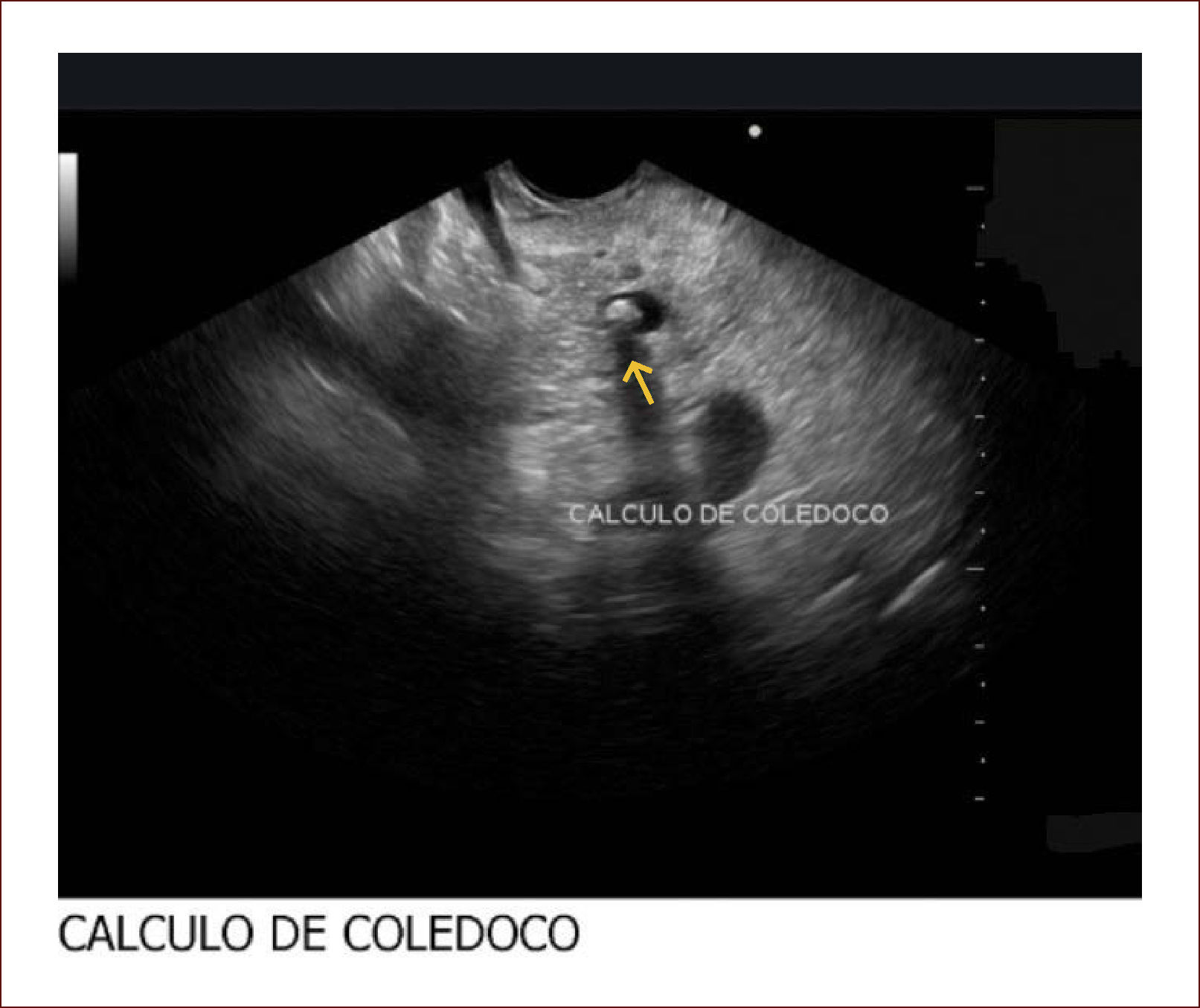
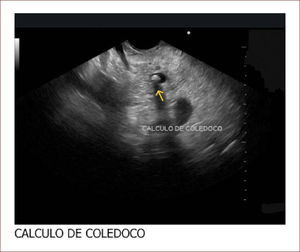
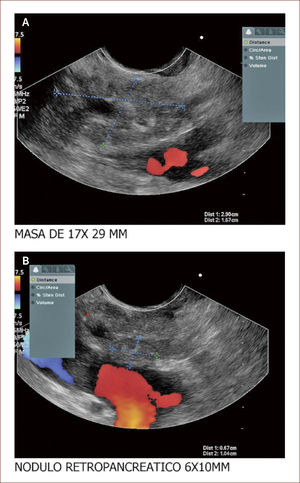
El 60% de las endosonografías remitidas a nuestro servicio, corresponde a pacientes con ictericia y sospecha de coledocolitiasis. En esta patología, la sensibilidad del EUS es mayor del 95%, como concluimos en un estudio próximo a publicarse, en el que los criterios de inclusión fueron pacientes con sospecha de cálculos del colédoco, EUS positivo para esta etiología y que nosotros mismos realizáramos la CPRE. Como se mencionó, en el 95% de los pacientes en los que el EUS mostró la presencia de cálculos en la vía biliar, coincidió con los hallazgos de la CPRE. Llamativamente, hubo 13 pacientes con MRI previa negativa para cálculos y que se remitieron por la persistencia de signos y síntomas sugestivos de cuadro litiásico, que solo pudieron ser demostrados con el EUS. El 5% restante de los pacientes diagnosticados por EUS como positivos para cálculos y sin correspondencia con los hallazgos de la CPRE, obedece posiblemente a la interpretación equívoca de imágenes o porque al momento de la CPRE, los cálculos ya hubieran salido espontáneamente a la luz intestinal. Figuras 3 y 4.
Paciente con cuadro de pancreatitis aguda
El paciente con ecografia y además imágenes que no mostraban compromiso de la vía biliar, ni de la vesícula. La resonancia magnética mostró vía biliar normal y descartó cálculos. El EUS mostró un cálculo pequeño menor de 3mm. Fue llevado a CPRE en forma temprana y el cuadro mejoró muchísimo. Hay que notar que la Resonancia a veces no detecta cálculos menores de 3mm.
Conclusión: El EUS en pancreatitis aguda tiene relevancia cuando se sospecha que la etiología es por cálculos biliares, pues su sensibilidad a este respecto es mucho mayor que la colangiorresonancia, detectando cálculos menores de 3mm. Por esta razón, como protocolo de nuestro servicio, los pacientes con pancreatitis, ictericia o colangitis, en los que otras imágenes diagnósticas no mostraron la posible causa del cuadro, se realizó una endosonografía bilio-pancreática y en caso de comprobar cálculos, lo hizo a una CPRE, en forma inmediata (solo basta cambiar el instrumento de trabajo). Con esta conducta, se optimizó la calidad del servicio prestado a nuestros pacientes, el tiempo de recuperación y de hospitalización se redujeron y el pronóstico mejoró.
ENDOSONGRAFÍA EN PANCREATITIS CRÓNICALa prevalencia de la pancreatitis crónica (PC), al menos en nuestra región ha aumentado. Este diagnóstico de por sí, es difícil y generalmente se llega a él por descarte de otras patologías. Es muy importante la epidemiología de la enfermedad y la historia de ingesta alcohólica y de consumo de cigarrillo. Esta patología es de difícil manejo y seguimiento, con periodos de exacerbación sintomática, pancreatitis agudas sobre agregadas y que puede evolucionar hacia un cuadro de dolor inmanejable, complicaciones como seudoquistes de páncreas, obstrucción del colédoco pancreático y cáncer.
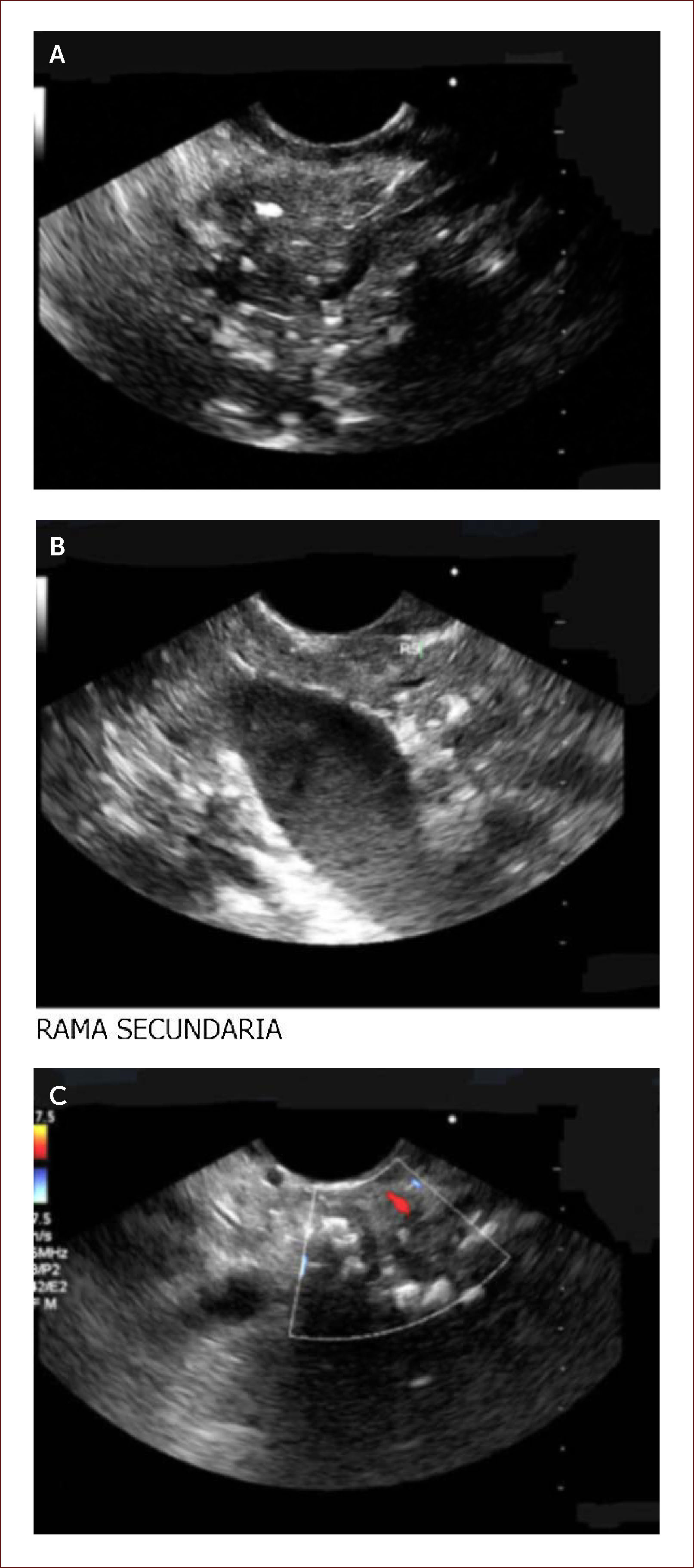
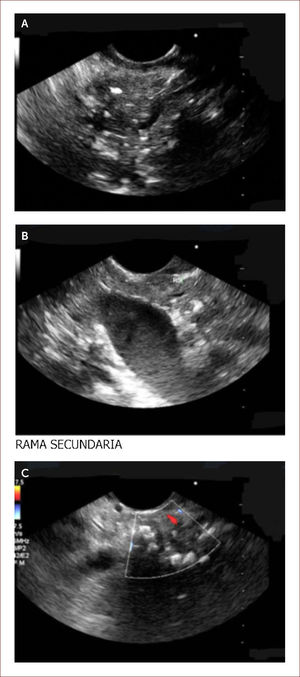
Ha sido difícil establecer por imágenes criterios claros de diagnóstico. Es en este punto donde el EUS del páncreas cobra su valor. Existen unos criterios estándar y otros llamados de Rossemont 8. Las características del parénquima pancreático en PC a evaluar son: la presencia de focos y bandas hiper-ecoicos, presencia de lóbulos y quistes. Y las características dependientes del ducto son: dilatación del conducto principal, irregularidad, realce, ramas secundarias visibles y cálculos 8. Figura 5.
Paciente de 29 años. Debutó con diabetes y dolor de abdomen. Historia de alcoholismo y tabaquismo. Dentro de los estudios le envían para EUS y vemos lo siguiente. En la imagen A se observan calcificaciones y bandas fibrosas del parénquima del páncreas. Un páncreas que es irregular. En la B se ven las misma calcificaciones y ramas secundarias. En la C se ve un conducto de Wirsung dilatado y lleno de cálculos. Todo lo anterior lo diagnostica como una pancreatitis crónica, ya que cumple con más de 5 criterios de Rossemont. Por medio de esta imagen se decidió manejo médico con cuidado nutricional y enzimas pancreáticas a dosis adecuadas. El paciente tiene Ca 19-9 normal. Su dolor se ha controlado. En caso de reactivación de su cuadro sintomático se hará biopsia por EUS. Por la dilatación del conducto y la presencia de cálculos podría ameritar intento de manejo endoscópico o de una cirugía derivativa de su conducto principal.
Para efectos del diagnóstico, se da un punto a cada factor, con más de cinco puntos aumenta la sensibilidad de que sea una pancreatis crónica, con menos de dos es poco probable, entre dos y cuatro hay alta sospecha 8.
Muchos pacientes con dolor abdominal crónico han sido estudiados con diferentes pruebas, incluyendo pruebas radiológicas, sin encontrar la causa del dolor, lo que constituye en una indicación para realizar EUS. No es infrecuente que se encuentren imágenes y criterios para pensar en PC, que obliguen a orientar -aún sin pruebas de laboratorio específicas-, a un manejo dietético y seguimiento nutricional, realización de enzimas pancreáticas y terapia del dolor 9.
Por otro lado, la EUS es necesaria para el seguimiento anual de estos pacientes, para determinar si la enfermedad ha avanzado o está estable. Desde el punto de vista de imágenes, es la mejor alternativa que permite establecer progresión o no de la enfermedad hacia un estado neoplásico. Por esto, es importante exigir al endosonografista que en su informe se reporten:
- 1.
Las medidas del páncreas.
- 2.
El tamaño de los focos y bandas hiper-ecoicas.
- 3.
El tamaño del conducto de Wirsung.
- 4.
La presencia o no de ramas accesorias.
- 5.
La presencia de cálculos, quistes y otras alteraciones con su adecuada localización y medidas.
Estos puntos están incluidos dentro de los parámetros de alta calidad en la endosonografía y endoscopia, propuestos recientemente por ASGE (Sociedad Americana de Gastroenterólogos Endoscopistas). Es importante aclarar que la realización del EUS aumenta su sensibilidad al ser realizado en forma complementaria con la TAC y/o la Resonancia (idealmente realizada con secretina y gadolinio) 10-11.
A veces es difícil diferenciar la PC del cáncer de páncreas. La clínica en estos casos es de vital importancia y además de la endosonografía, se requiere biopsia por punción con aguja fina dentro del mismo procedimiento, ya que la TAC, la resonancia y otras ayudas tampoco podrán distinguir entre comportamiento benigno o maligno. Existen muchos casos de cirugías innecesarias en pacientes con pancreatitis crónicas, que las imágenes anteriores simularon cáncer, y los cirujanos reportan grandes masas y plastrones tumorales con hallazgos de patología negativos para malignidad. Si la sospecha diagnóstica es la de PC y se sospecha cáncer, el paciente no se debe llevar a cirugía sin un resultado positivo de biopsia previa, tomada mediante EUS 8,12.
En ambos casos (PC y cáncer de páncreas) el EUS permite la fenolización o neurolisis del plexo celiaco, para manejo de dolor intratable. Esto se logra con inyección de alcohol con o sin esteroide y anestésico. Esta técnica supera ampliamente a la misma terapia dirigida por TAC, ya que es fácil, de corta duración y con resultados similares. Es importante aclarar que son pocos los pacientes en los que desaparece por completo el dolor. Más bien, se puede decir que este disminuye y ayuda a bajar la cantidad de analgésicos que frecuentemente se aplican en estos enfermos 13,14.
ConclusionesEl EUS es fundamental para el estudio del paciente con sospecha o con diagnóstico de PC. Así como para el manejo de complicaciones como el dolor intratable. El EUS permite tomar biopsias con aguja fina en casos dudosos y así diferenciar entre esta patología y el cáncer. El EUS es una modalidad diagnóstica y terapéutica importante, que es complementaria a otros estudios como la TAC y la Resonancia. Una PC o sospecha de la misma, sin realización de EUS, es una patología mal evaluada.
ENDOSONOGRAFÍA EN QUISTES DEL PÁNCREASGracias al desarrollo y evolución de las imágenes diagnósticas, cada día se diagnostican más quistes del páncreas, lo que obliga a entender esta patología para poder abordarla con conocimiento. Es necesaria una valoración adecuada al paciente y su equipo médico, en cuanto a la necesidad de seguimiento o manejo urgente.
Su hallazgo por lo general es incidental. Se dice que los quistes del páncreas se encuentran en un porcentaje entre el 1,2 y el 24% de pacientes que se examinan por otras causas.
En un servicio de radiología se evaluaron 24.039 tomografías y resonancias, encontrando quistes pancreáticos en 290 (1,2%), mientras que paralelo a esto, en otro estudio en 300 autopsias se encontraron en 73 (24,3%). La prevalencia aumenta con la edad 15,16.
Los quistes se clasifican en neoplásicos y no neoplásicos, siendo estos últimos los más frecuentes (80%) 17,18. Sin embargo, en los últimos tiempos gracias a las nuevas tecnologías y el mayor estudio de los mismos, este porcentaje ha cambiado, aumentando la frecuencia de quistes neoplásicos, los cuales se dividen en mucinosos y no mucinosos (se ha relacionado la producción de mucina con la aparición de cáncer) 38.
Dentro de los quistes no neoplásicos el más importante es el seudoquiste. Estos generalmente se deben a un cuadro de pancreatitis aguda o crónica. Son, según la clasificación de Atlanta, una de las complicaciones de esta enfermedad. Se llaman seudoquistes, porque no son verdaderos quistes: no tienen una pared verdadera. Se delimitan por los órganos vecinos y la unión de estos órganos es la que conforma los límites del quiste, siendo la fuente misma el páncreas 19-21. Su formación es debida a una colección de líquidos, que se genera la mayoría de las veces por ruptura de un canalículo del páncreas y se dice que existe cuando en la evolución de la enfermedad de origen lleva más de seis semanas. Se inicia como una colección de líquidos dentro del páncreas, la cual no se absorbe y persiste en el tiempo. La mayoría de los casos por fortuna son leves: existe la colección, pero no está infectada, ni tiene necrosis. Pero en casos severos la colección puede infectarse, tener membranas y necrosis y todo esto lleva al paciente a empeorar su cuadro clínico.
No todo lo que parece seudoquiste lo es. Para esto es importante la existencia del antecedente de pancreatitis aguda o crónica. Si tenemos una pancreatitis de novo y las imágenes muestran un quiste, podemos pensar que la pancreatitis se debe a este y debe descartarse una neoplasia. Así mismo cuando en el contenido del quiste se ve componente sólido, se debe descartar neoplasia 22.
El tamaño de los seudoquistes es variable, pueden oscilar entre 2 y 20 o más centímetros, lo que desencadenará menor o mayor sintomatología. El síntoma primordial para decidir manejo, es el dolor. Si el paciente no tiene síntomas se puede manejar con observación, siempre y cuando el tamaño no interfiera con funciones vitales del enfermo 23. La infección también hace necesario su intervención.
Por tradición se han usado la TAC y/o MRI como los métodos diagnósticos iniciales. En ellos se ve el quiste, su localización, se supone el contenido, pero el EUS los supera en sensibilidad y permite valorar muchos más detalles del mismo. Por medio de este método puede verse la comunicación del quiste con el conducto del páncreas, así como con la resonancia con secretina (MRCP) 22-23.
Hace algunos años, los seudoquistes se manejaban por laparotomía y realización de una cisto -gastrostomía (comunicación del quiste con el estómago) 22-24. Pero a pesar de ser la laparoscopia menos invasiva, se dan complicaciones relacionadas en su mayoría con la herida quirúrgica. Con el EUS se ha revolucionado el diagnóstico y manejo de los seudoquistes.
El aporte de la endoscopia digestiva desde antes de inicios de este siglo, es el drenaje de los seudoquistes mediantes stents insertados con la ayuda de duodenoscopios o de endoscopios de visión frontal. El éxito es alto, pero la recurrencia elevada, porque los stents colocados son de teflón o plástico y diámetro muy limitado, que según el contenido del quiste pueden o no ser ocluidos. Mucha parte del éxito en estas técnicas se da por el tamaño del quiste que al empujar la pared del estómago o duodeno, se hacen visibles para hacer la incisión, colocar el stent y permitir el drenaje sin mucha dificultad 22.
Con el EUS esto ha cambiado ya que sin importar el tamaño del quiste y su impresión o no sobre la pared gástrica o duodenal, se pueden ver. Por lo tanto, se pueden puncionar y hacer drenajes dirigidos 25. Además es importante el hecho de que el EUS muestra si hay vasos sanguíneos que están entre la pared y el sitio de drenaje, evitando estos sitios y de esta manera, una de las complicaciones del procedimiento que es la hemorragia. Por medio de este método se pueden colocar stent de diferentes tamaños 25. Nuestro grupo realiza el abordaje con EUS de todos los seudoquistes que son para drenaje. Por medio de este método seguimos una secuencia que es:
- 1
-EUS diagnóstica: en esta se mide el tamaño del quiste, se caracteriza su contenido, se determina si hay vasos interpuestos entre la pared y el quiste, mide el tamaño de la pared, siendo importante que éste esté entre 5 y 10mm (pared apta para drenaje).
- 2
-Se decide drenar, se activa del EUS el vector de drenaje que permite dirigir la aguja y punciona el quiste.
- 3
La punción se hace con una aguja 19G. Esta permite pasar así una guía hidrófilica dentro del quiste. Esta maniobra abre el espacio para poder introducir diferentes aditamentos técnicos por medio de la guía.
- 4
-En esta técnica se han usado cistotomos (Instrumento que va por la guía y tiene una oliva metálica que trasmite energía y corte por medio de la unidad electro quirúrgica), o papilótomos de punta que tienen un hilo metálico al final que cumple la misma función. Así se puede abrir un orificio entre la pared gástrica o duodenal y el quiste.
- 5
-Elaborado el orificio se pasa un balón de dilatación biliar de 6mm y se dilata el trayecto.
- 6
-Luego se pone un stent, este puede ser de teflón o plástico, pero estos se ocluyen fácilmente, por lo que se prefiere un stent autoexpandible biliar de 10mm recubierto. El stent al quedar en su sitio permite el drenaje del material del quiste y los lavados diarios por medio de aditamentos como balones de oclusión biliar que se inflan dentro del stent, para pasar líquido por medio de ellos, desinflando luego y aspirando.
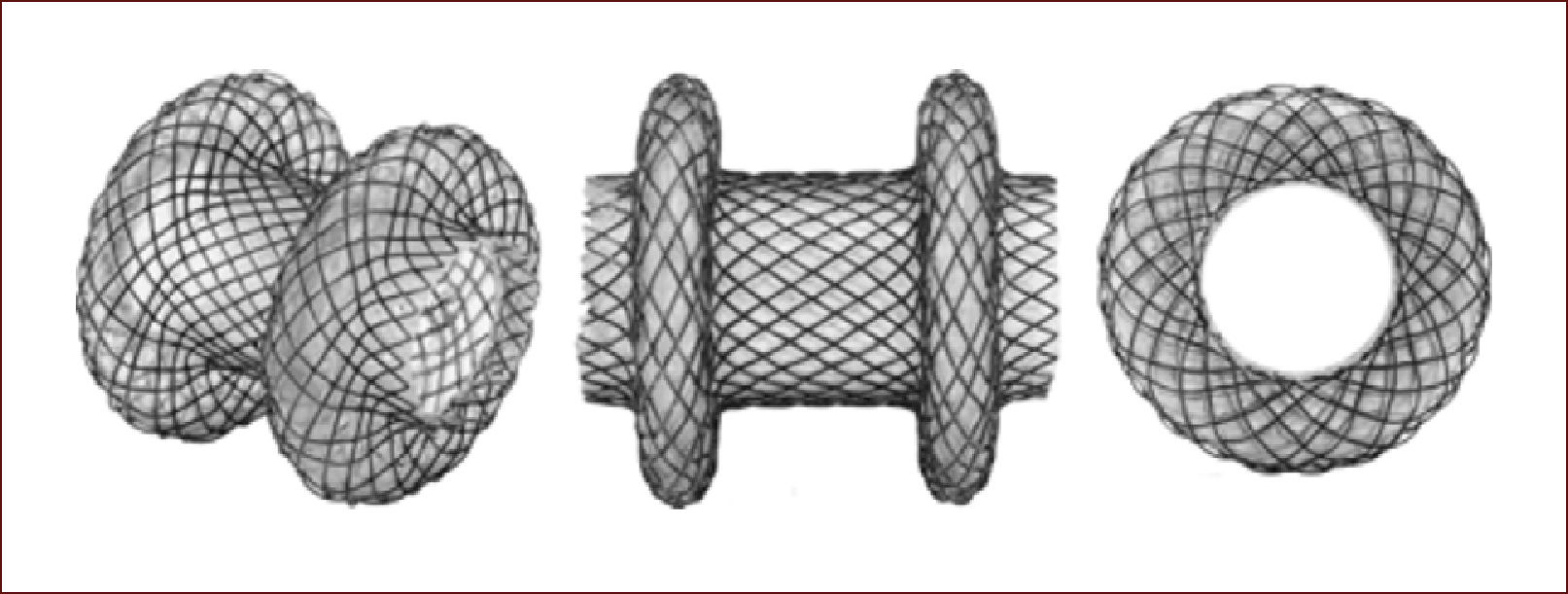
En la actualidad existen los AXIOS (que son la solución al problema): stents que se aplican entre el estómago o duodeno y el quiste y quedan anclados como un botón, a través del cual el endoscopio puede entrar y realizar el lavado directo de las secreciones y detritus26Figura 6.
Hemos tenido éxito en la mayoría de pacientes, pero también hemos tenido complicaciones. En cuatro años llevamos 11 pacientes manejados y dos complicaciones. En una de las pacientes se presentó un neumoperitoneo, que se manejó en forma conservadora y la paciente evolucionó satisfactoriamente, con resolución del quiste a los dos meses. Otra paciente presentó un sangrado intra quístico y ruptura del quiste por el sangrado, luego fue operada y manejada desde ahí por el grupo quirúrgico. Su evolución fue tórpida por complicaciones no derivadas del drenaje del quiste. Figura 7.
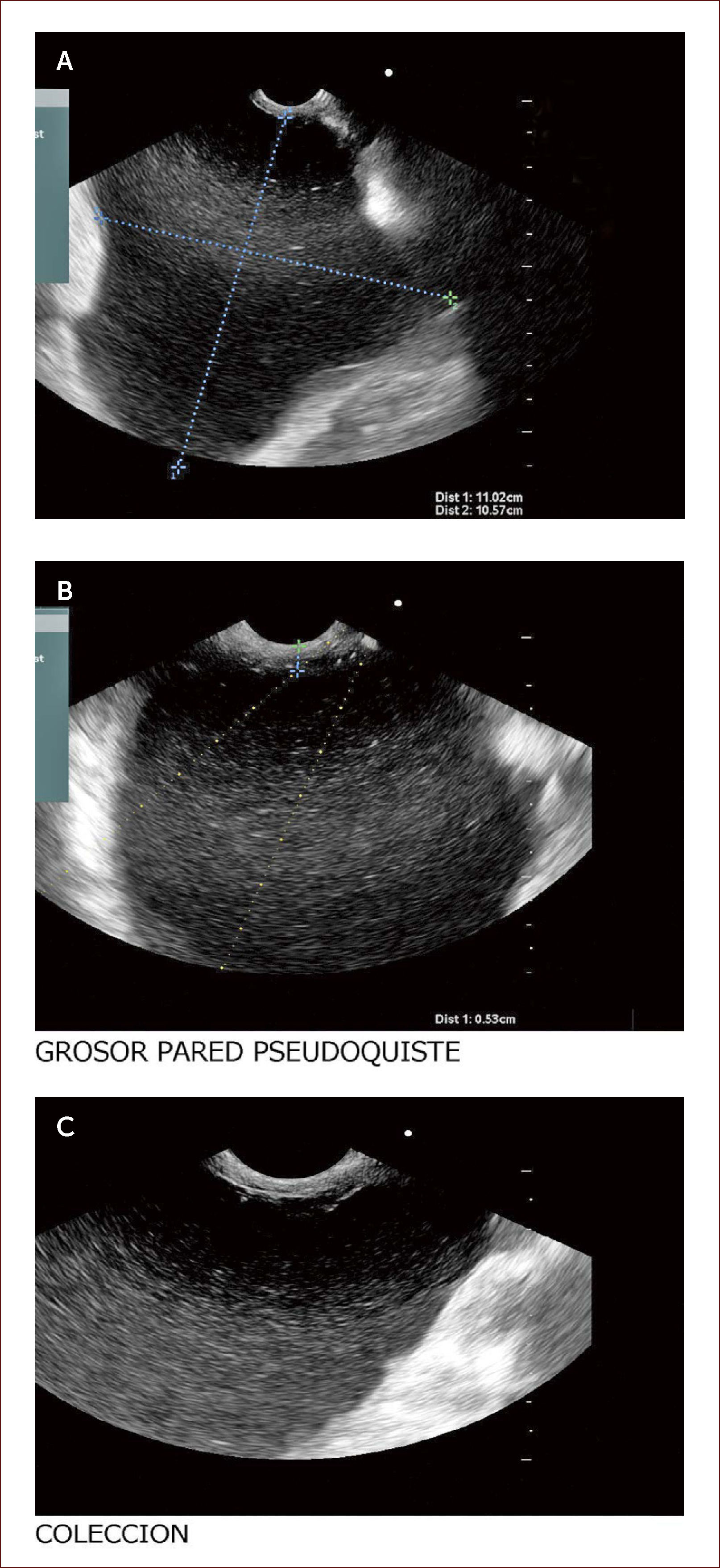
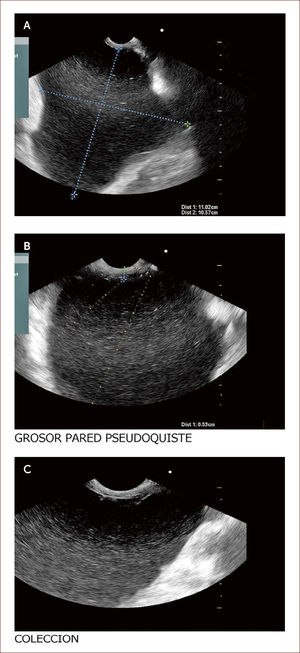
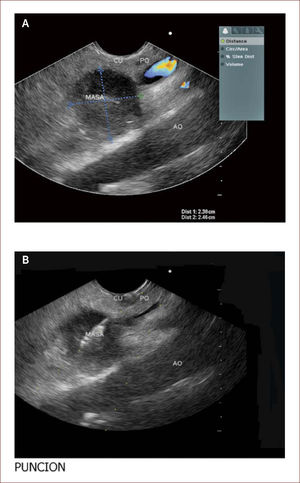
Paciente con seudoquistre del páncreas posterior a cuadro de pancreatitis aguda. La paciente tuvo dolores que no fueron rotulados como tal y los manejaron en el campo (Fundo), como algo digestivo. Al consultar en la capital a una clínica encuentran en la TAC esta lesión. En la imagen A se ve la medición del tamaño del quiste y en la imagen B el grosor de la pared de 6mm. En la C a la izquierda el contenido líquido con pocos detritus. Fue llevada a drenaje y colocacion de stent.
Los seudoquistes se presentan como una complicación de la pancreatitis y aparecen luego de seis semanas de evolución de la enfermedad. Estas colecciones son variables en cuanto a tamaño y su manejo depende de si hay síntomas o no. Si son muy sintomáticos, la endoscopia y el drenaje son la indicación primaria y el EUS es el mejor método diagnóstico, que acerca a las verdaderas características del quiste, pudiendo obtener datos de contenido, infección, ancho de la pared, componentes vasculares y por tanto, se disminuyen las complicaciones del drenaje por esta vía.
EUS E IPMN (NEOPLASIA MUCINOSAS INTRADUCTALES PAPILARES)Dentro de los quistes pancreáticos neoplásicos, vale la pena dedicar un espacio exclusivamente a las neoplasias quísticas mucinosas. En los últimos 10 años este tipo de neoplasias ha cobrado un interés muy especial, con celebración de múltiples reuniones de expertos y estudios que permite contar con información actualizada al respecto. Tanto el EUS como la aspiración con aguja fina (FNA) son básicos para definir la conducta que se debe seguir 27,38.
Este tipo de quistes son los llamados quistes no inflamatorios. La Organización Mundial de Gastroenterología divide los quistes mucinosos que producen neoplasia en dos 28:
- 1.
IPMN (Neoplasia Mucinosas Intraductales Papilares)
- 2.
MCN (Neoplasia Quísticas Mucinosas)
Ambos tipos de neoplasia pueden llevar a transformación maligna. Sin embargo dada su mayor importancia y frecuencia, se revisarán con mayor atención en este artículo los IPMN 27,38. Estas neoplasias por lo general se presentan en la séptima década de la vida 27.
Las Neoplasias Mucinosas Intraductales Papilares (IPMN) se dividen de acuerdo a su localización: Rama Principal (los que más llevan a carcinoma), ramas secundarias y mixtas 27.
Es una patología de tan reciente estudio que apenas están entendiendo y ajustando guías para el manejo adecuado de los mismos. En lo referente a este artículo debe quedar claro el potencial maligno de los IPMN, este es el principal punto a resaltar 38.
Se han identificado varios factores que pueden llevar un IPMN a ser maligno 27-38:
- 1
-Cuando el tamaño es inferior a 20mm la probabilidad de malignidad es baja. Sin embargo, si tales factores de riesgo o signos de alarma mayores asociados, como: nodulaciones del conducto, septos, irregularidad y de pronto componente sólido, se aumenta el riesgo de malignidad.
- 2
-Si el diámetro supera los 30mm, este es un factor de riesgo de malignidad independiente, aún sin signos de alarma ya mencionados.
- 3
-Que el conducto principal sea mayor de 10mm.
- 4
-Edad menor de 60 años supone un riesgo mayor, particularmente cuando se asocia a dolor, pérdida de peso y pancreatitis.
- 5
-Es altamente sospechoso un IPMN maligno cuando el tamaño de quiste es mayor de 30mm, el tamaño del Wirsung duplica el tamaño de la vía biliar y/o se ve amputación del conducto distal con dilatación proximal del mismo.
- 6
-Son factores de riesgo adicionales propuestos por Varadarajulu: la ictericia y las tumoraciones quísticas de la cabeza del páncreas, así como el componente sólido dentro del quiste.
En este tipo de patologías los apoyos diagnosticos son complementarias. La Resonancia es una de las mejores modalidades no invasivas y en nuestro concepto es junto a el EUS, la que mejor, lleva delimitar la verdadera magnitud de estas neoplasias y sus factores de riesgo intra quísticas e intra ductales 29,30. Según Varadarajulu en su orden, un servicio dedicado a páncreas debe abordar estas neoplasias con TAC con protocolo especial de páncreas, resonancias con secretina para valorar la relación de la neoplasia con el conducto principal y sus ramas secundarias. En general se hace EUS, cuando el resultado de esta puede cambiar la conducta que se vaya a tomar 31-38.
Es decir si tenemos una tumoración que por otros test diagnósticos está en la cabeza del páncreas, es mayor de 30mm, el paciente tiene ictericia y el conducto esta dilatado, el paciente es quirúrgico aun sin biopsia 38.
Sin embargo, si hay factores de riesgo no claros y se quiere detallar más la lesión, antes de decidir seguimiento o cirugía, es el EUS el examen adecuado 38.
El EUS es muy útil en este tipo de neoplasias por la cercanía del transductor y la tumoración o quiste, lo que permite determinar con más confiabilidad el tamaño y las características del mismo, así como la cercanía a estructuras vecinas, ver criterios de invasión vascular, información al cirujanos sobre criterios de resecabilidad o no, estadificar la lesión localmente (no hay otro examen que pueda ser mejor para la valoración local de los tumores del tracto digestivo y acá incluimos páncreas), podemos tomar biopsias y sacar líquido para estudio 33-35. Figura 8 y 9.
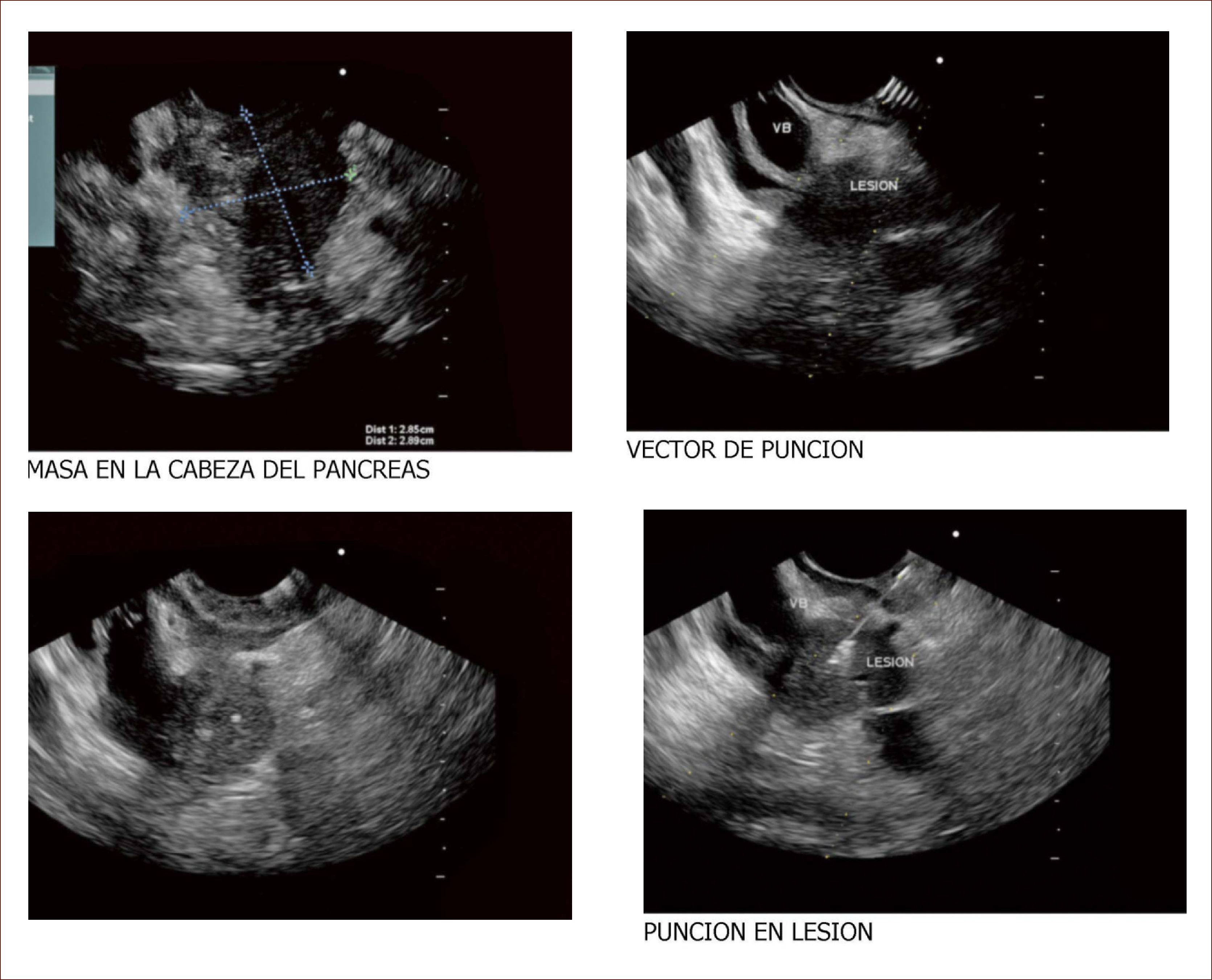
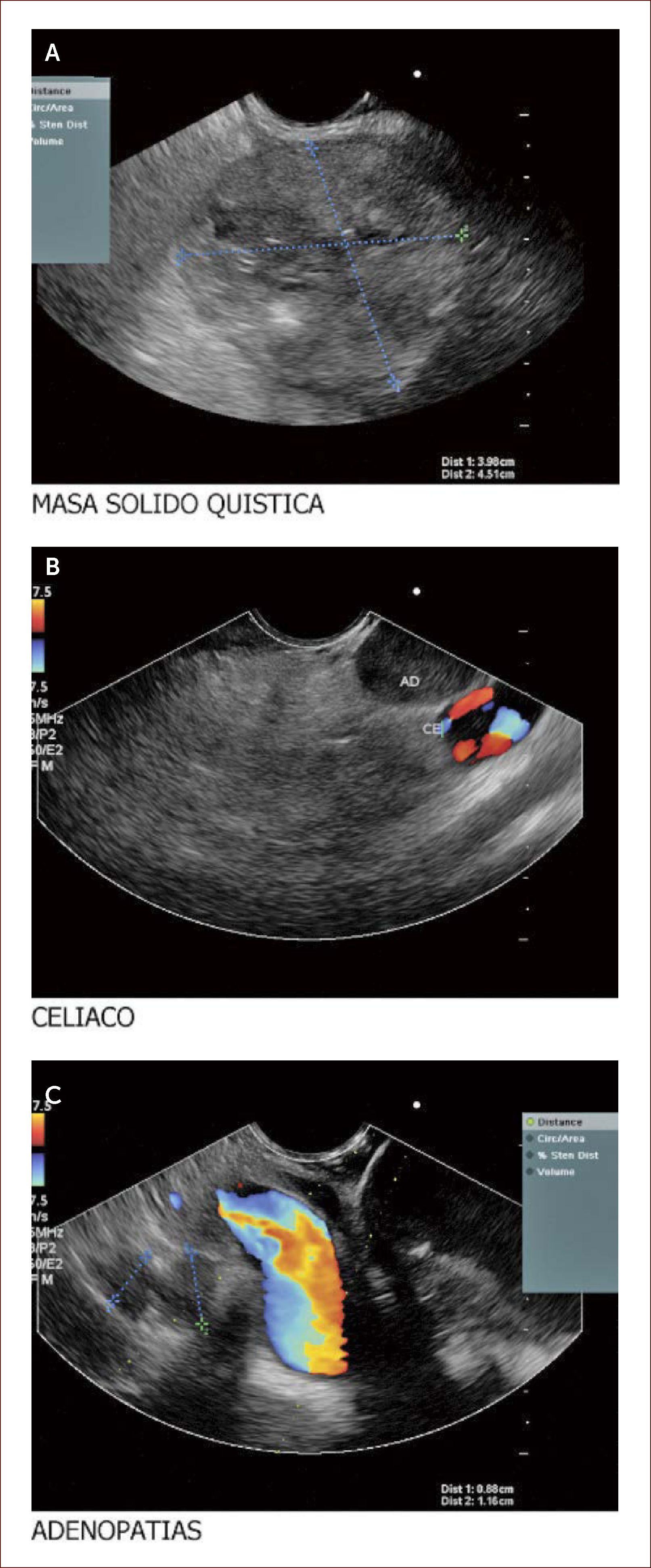
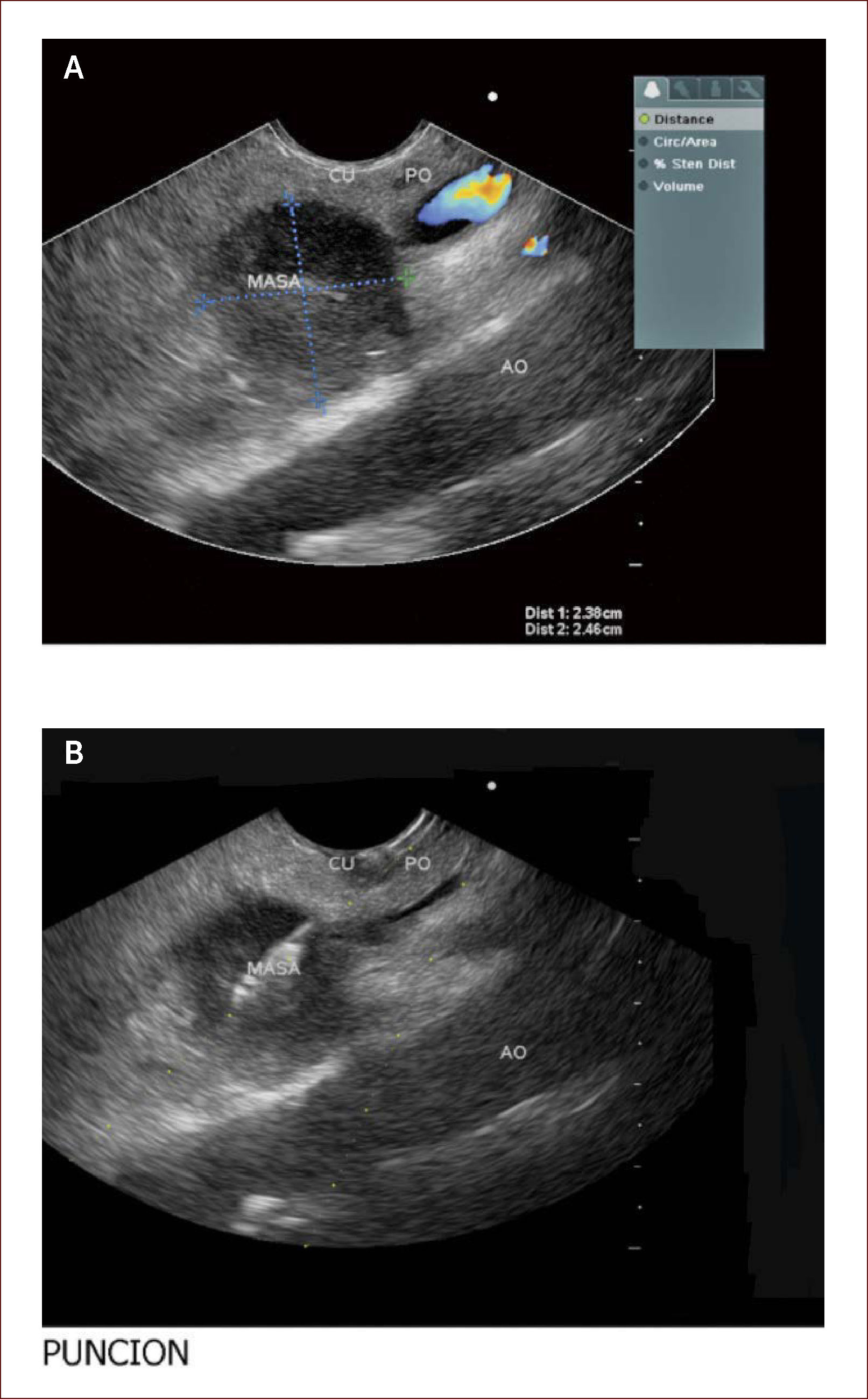
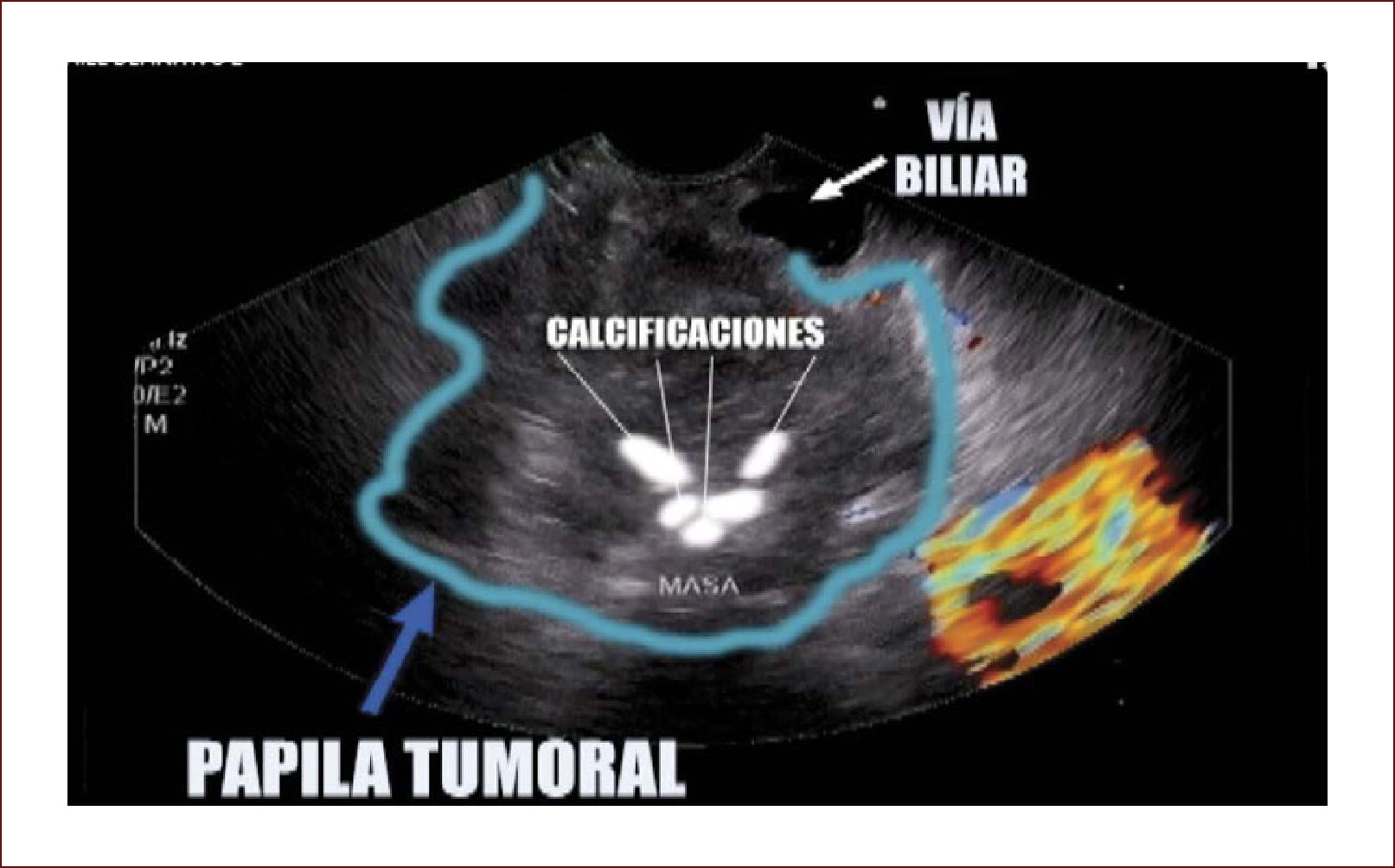
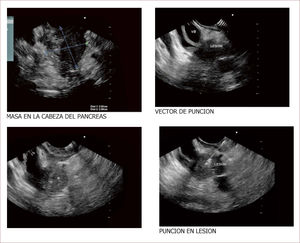
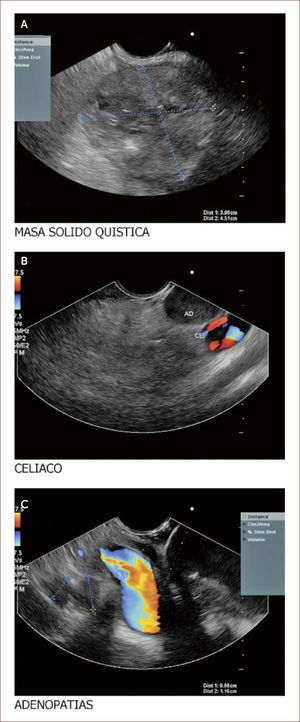
Lesión de cabeza de páncreas en un hombre de 67 años. La lesión es sólido quística. En la imagen de arriba a la izquierda se ve que la lesión mide 30mm es de ecos mixtos y con componente sólido y líquido. En la imagen de arriba a la derecha se ve la vía biliar y la lesión comprimiéndola. En la imagen de abajo a la izquierda se ve la lesión con calcificaciones, nódulos al lado. En la de abajo a la derecha se ve la punción de la que salió material mucoide y algunos fragmentos de tejido que fueron leídos como acinos normales. Por imágenes y por el tipo de lesión se pensó en IPMN. Tiene características quirúrgicas, como son componente sólido en la lesión, quiste mayor de 30mm, nódulos y como se verá en la imagen siguiente un Wirsung mayor de 10mm y tortuoso con nodulaciones.
En el momento actual se puede decir que la sensibilidad que da la punción con aguja fina en los IPMN, no es alta. Sirve mucho el aspirado para ver el tipo de material y si este es filante, hace sospechar la etiología mucinosa. Así mismo, se pueden medir antígenos tumorales como el CA 19-9 y el CAE (Antígeno carcino embrionario), siendo este último el que más va a mostrar si la neoplasia es mucinosa o no, el nivel de corte es de 192 ng/ml, si es mayor la sensibilidad es del 79%. Se pueden medir amilasas y si estas son mayores de 250 U/L se sugiere inflamación como etiología del quiste. Ninguno de los marcadores tiene sensibilidad demostrada para decir si es maligno o no. La citología si tiene células globosas es patognomónica de neoplasias mucinosas. Lamentablemente la especificidad es del 90% y la sensibilidad es apenas del 50%. En caso de mostrar atipias, inclina la balanza más hacia malignidad. No es la intención del artículo, pero se están investigando con marcadores moleculares tumorales como el K-ras, pero en todo esto (citología, antígenos, marcadores moleculares tumorales), apenas se están dando pasos que por ahora nos llevarían solo a confusión. Es nuestra opinión, los hallazgos por imágenes, más los síntomas del pacientes son al momento los principales indicadores de qué hacer con estas neoplasias.
Para resolver dudas se puede decir que un paciente va a EUS cuando hay factores preocupantes 27,36-38:
- 1.
Tamaño del quiste mayor de 30mm
- 2.
Engrosamiento de las paredes del quiste
- 3.
Nódulos de las paredes del quiste
- 4.
Cambio abrupto del tamaño del conducto con atrofia distal de la glándula
- 5.
Quistes con adenopatías asociadas.
- 6.
Cuando el diagnóstico es dudoso
Varadarajulu en su página web del Hospital de la Florida en los Estados Unidos, en el mes de mayo publicó una actualización de EUS y en el punto 7 dice: “Cuál es el papel diagnóstico del EUS con respecto a CT/ MRI?”… “Una combinación clínica de imágenes y exámenes de laboratorio da el mejor diagnóstico preoperatorio del tipo de quiste”… “La CT y la MRCP (Tomografía computarizada –Resonancia magnética con secretina), son mejores para definir la localización y la comunicación del quiste con el ducto principal”... El EUS es mejor para investigar las características de malignidad tales como nódulos e invasión. Así mismo es la mejor técnica para tomar muestras del quiste 28,38.
Conclusiones IPMN:Estas patologías de interés, se están investigando cada vez más. En la actualidad se están publicando muchas guías al respecto y son los criterios de Sendai (2006) reformados en Fukuoka en el 2012 los que están marcando el qué hacer. El problema es que no existe un método diagnóstico de alta sensibilidad. Son las características de imágenes las que nos llevaran a determinar el abordaje, así como la combinación de imágenes y pruebas diagnósticas lo que nos llevará a un trabajo multidisciplinario que aumente la sensibilidad y un manejo adecuado.
Dada la posibilidad de que algunos quistes se conviertan en malignos, es fundamental siempre explicarle al paciente su riesgo y el seguimiento que se debe o no hacer. En este punto se deben considerar especialmente dos tipos de pacientes, los que tienen quistes que pueden llegar a ser malignos, el paciente ante la explicación puede o no querer seguirse o mejor operarse. Los otros son los que teniendo quistes neoplásicos la expectativa de vida es poca por edad y no son candidatos a cirugía 38,39. En general cuando un quiste no demuestra cambios, se debe hacer seguimiento. Se ha demostrado sobre todo que cuando los quistes son incidentales (encontrados en exámenes por otros motivos), el riesgo de que se malignicen es esta entre 10-17/100.000. En este escenario un quiste menor de 30mm, que no tiene cambios que hagan pensar en malignidad o tendencia a la misma, se deben seguir con MRI o EUS, ambas modalidades son muy buenas, la primera menos invasiva, pero la segunda demuestra con más confiabilidad en el hallazgo y detección de factores de riesgo (medición del tamaño, aparición de nódulos intra quísticos, proyecciones papilares, componente solido dentro del quiste, calcificaciones dentro del mismo, septos, etc.). Ese seguimiento se hace iniciando al año y luego cada dos años. Si luego de cinco años de seguimiento los quistes continúan igual o los cambios son pocos, se debe suspender el seguimiento 39.
Muchas veces nos llega a Endoscopia para EUS quistes ya encontrados por otros exámenes, y la indicación para esa remisión según las últimas guías de la AGA (American Gastroenterological Asociation) y el grupo de Varadarajulu en Florida EE.UU., es que se encuentren signos de alarma, como tamaño mayor de 30mm, dilatación del conducto principal, aparición de componentes solidos dentro del quiste, nodulaciones del conducto, irregularidad del mismo, estos factores fueron encontrados en una revisión sistemática de la literatura como factores de riesgo para malignidad 39.
En los pacientes anteriores se recomienda EUS-FNA (Biopsia con aguja fina), pero se debe advertir que en lesiones quísticas la sensibilidad de la punción llega solo hasta el 50%. Pero no existen otros métodos distintos a la cirugía que objetivamente superen a esta biopsia. Es importante hacer notar que los hallazgos endosonográficos sobre lesiones que se sospecha son malignas, son tan claros que incluso sin biopsia, solo con el tamaño y ciertas características los pacientes, deberían ser intervenidos 38,39.
Los quistes de páncreas deben ir a cirugía cuando se comprueba de ellos la malignidad, cuando la citología elaborado con FNA a pesar de su baja sensibilidad da positiva, cuando sus características alteran la anatomía y producen complicaciones como obstrucción de la vía biliar dando ictericia, cuando tienen características a la resonancia y El EUS que hacen sospechar malignidad 38.
EUS EN MASAS DE PÁNCREASEl advenimiento y desarrollo del EUS ha tenido un impacto importantísimo como complemento indudable de la TAC y la Resonancia, para el diagnóstico y manejo de las masas tumorales del páncreas 40.
Nuestros pacientes llegan remitidos con el diagnóstico imagenológico de una tumoración y por medio del EUS, se puede determinar el tipo de masa, la localización exacta, sus diámetros, sus características internas en cuanto a sus ecos, la presencia de calcificaciones, su componente vascular, la presencia de áreas hipoecoicas que indiquen degeneración o sangrado, y todo esto, nos habla endosonográficamente de una mayor o menor probabilidad de malignidad 40,41.
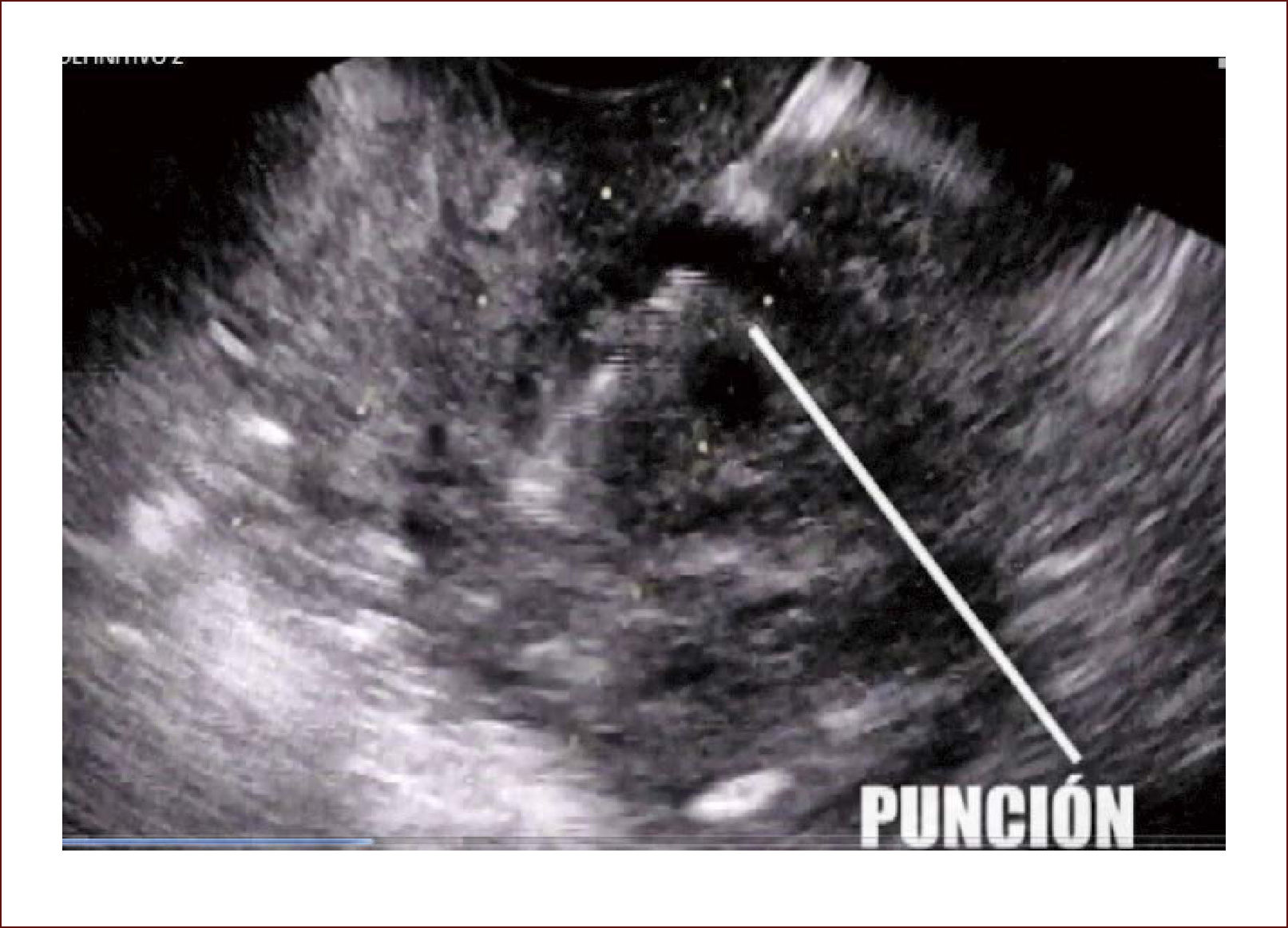
Es obvio que el cirujano y el médico tratante muchas veces quieren tener la patología en la mano para proceder, esto antes se lograba por punciones dirigidas radiológicamente o por medio de laparotomías y toma de cuñas. Ahora, se puede por medio de FNA dirigidas por endosonografía, tomar filetes de tejido y enviarlos al patólogo, todo dentro del mismo examen 41,42.
Los endosonógrafos lineales tienen canales especiales de trabajo que permiten pasar por ellos agujas e instrumentos terapéuticos. Se usan agujas de diferentes calibres: 19 G – 22 G o 25 G, la primera la más gruesa y la última la más delgada. También se pueden usar agujas tipo trucut que permiten toma de muestras más grandes. El procedimiento es sencillo, requiere de una adecuada preparación, con tiempos adecuados de coagulación y el uso de antibiótico en el momento de puncionar, ya que es un procedimiento quirúrgico. Siempre se usa un anestesiólogo para estos exámenes.
Como las muestras son tan pequeñas, existen a veces problemas en la lectura por patólogos o de parte nuestra la toma no intencional de muestra insuficiente. En este sentido, hay dos tipos de situaciones: 1. Que el centro de endosonografía esté ubicado dentro de una entidad que tenga patólogo, que pueda estar en sala y realice una citología rápida para avisar si hay muestra suficiente para estudio o no; o 2. que no se tenga patólogo (esta situación es la más frecuente ya que en muchas ciudades los centros de patología son extra institucionales o a pesar de tener patólogo, los tiempos de contratación o disponibilidad no coinciden con los horarios de toma de las muestras), en este caso se ha iniciado en algunos grupos la idea de que los endosonografistas se entrenen en citología elemental, esa citología que no pretende reemplazar al patólogo y lo único que busca es hacer una muestra rápida, coloración de la misma y lectura en la sala.
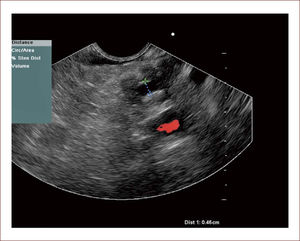
En este sentido nosotros, iniciamos un proyecto de preparación en citología elemental, pudiendo en la actualidad realizar punciones, sacar muestra y citología y una de las placas colorearla con Hematoxilina Eosina. En ese mismo momento se lee en sala, la lectura solo dice: Hay o no muestra. Mientras tanto el paciente está sedado y si hay muestra se acaba el procedimiento, si no la hay, se punciona de nuevo hasta lograr el objetivo. Esto mejora la confiabilidad del examen, disminuye futuros exámenes. Con esto, hemos logrado aumentar la sensibilidad de nuestras muestras de un 60% antes de realizado, a un 90%. De todos los pacientes tenemos placas de archivo y hacemos seguimiento con patologías. Figura 9.
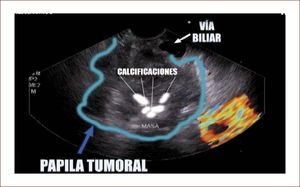
En esta se ve el Wirsung del mismo paciente dilatado y tortuoso, con nodulaciones y la masa pegada a la porta. El paciente fue llevado en otra ciudad a cirugía por un grupo de Páncreas y se confirmaron los hallazgos anteriores y tenía criterio de no resecabilidad por gran plastrón a nivel portal.
Otra cosa importante en estos casos es que el EUS, permite ver compromiso de órganos vecinos, compromiso de ganglios y así mismo ver la vía biliar, el Wirsung y los vasos, siendo el más importante la porta. Estos datos hacen que podamos hablar de resecabilidad o no y del tipo de cirugía que se tenga que realizar 40,41. Figuras (10-12).
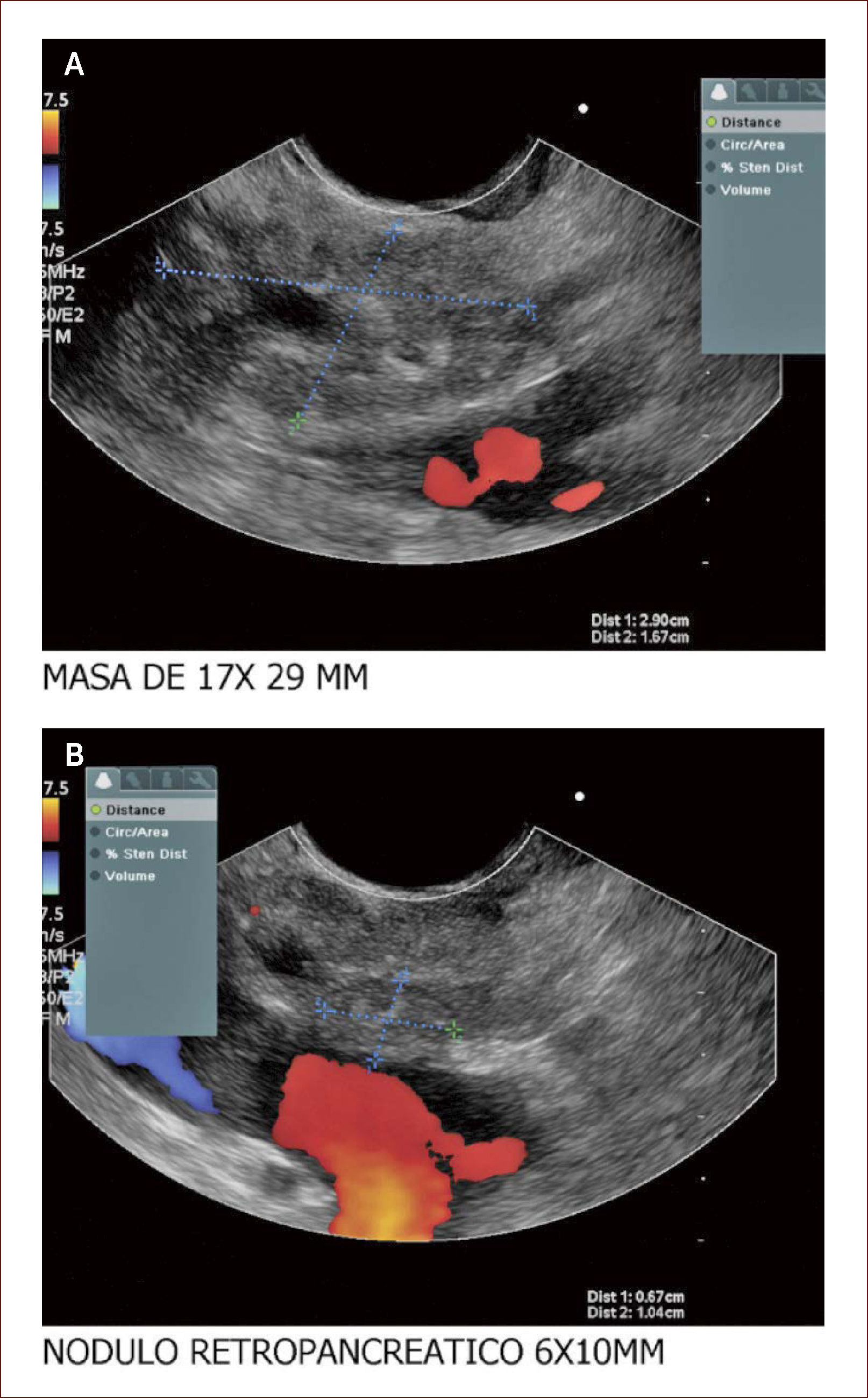
Masa de cabeza de PÁncreas en un hombre de 47 años
Compromete vía biliar y tiene múltiples adenopatías. Se ve también involucrado el Wirsung. La patología reportó un adenocarcinoma mal difereciado del páncreas. En la foto A se ve la masa y en está igual que en la de la derecha se ve que contacta e invade la porta. En la B se ve un nódulo grande entre la porta y la lesión de la cabeza. Con estos hallazgos más la clínica del paciente el grupo de cirugía decidió manejo paliativo. Colocamos en vía biliar un stent autoexpandible no recubierto. El paciente está aún en seguimiento. (imagen de Unión de Cirujanos SAS – Lázaro Arango (Autor), se publica con permiso).
Paciente de 60 años con masa que emerge de la cabeza del páncreas y llega al borde inferior del hígado. En la imagen A se ve la masa. En la B la aorta a nivel del plexo celíaco y una gran adenopatía a este nivel. En la C se ven los vasos portales y adenopatías varias a este nivel. Esta paciente se llevó a punción y se reportó un sarcoma mal diferenciado. La paciente no fue llevada a ningún procedimiento quirúrgico. (Imagen de Unión de Cirujanos SAS – Lázaro Arango (Autor), se publica con permiso).
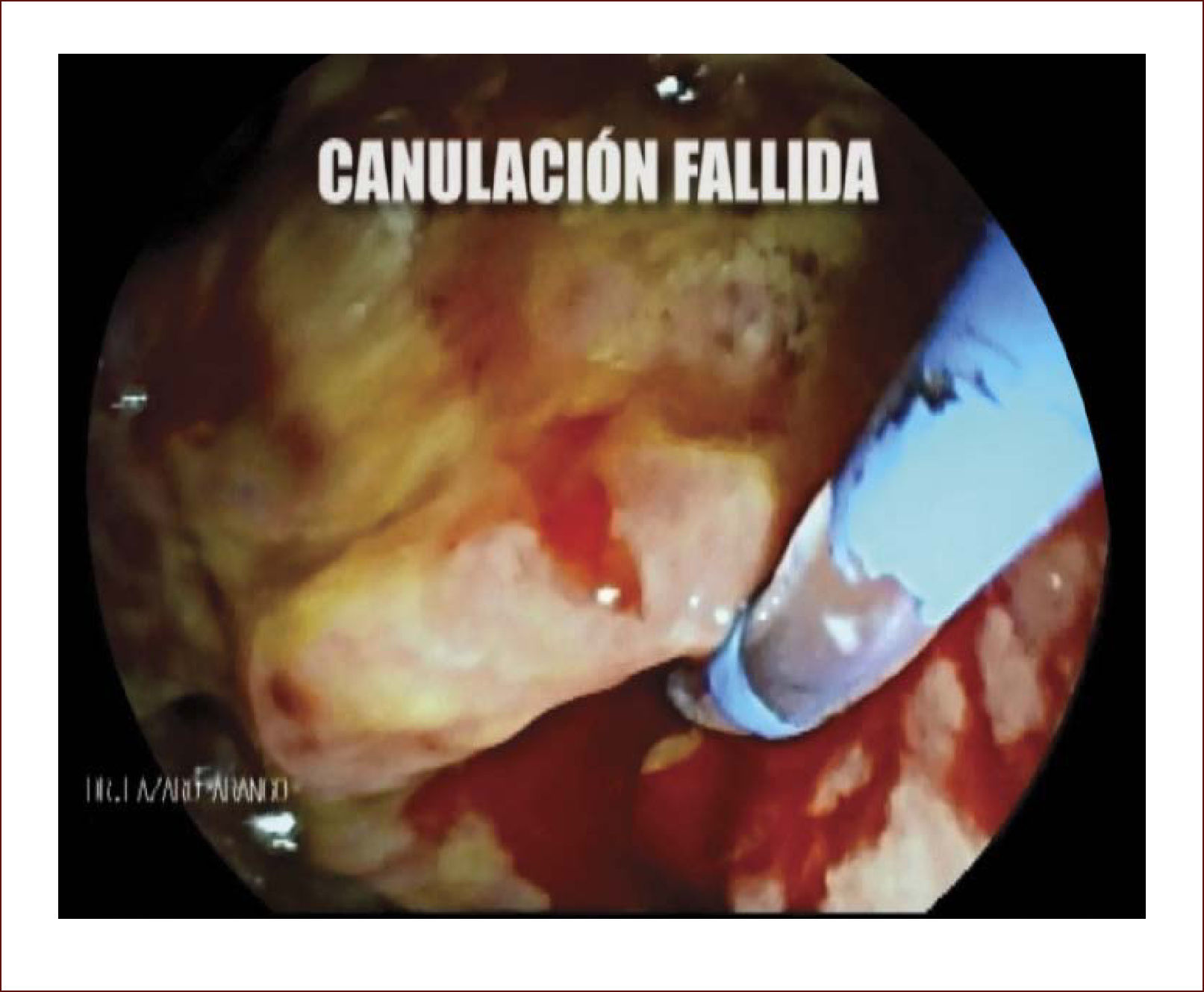
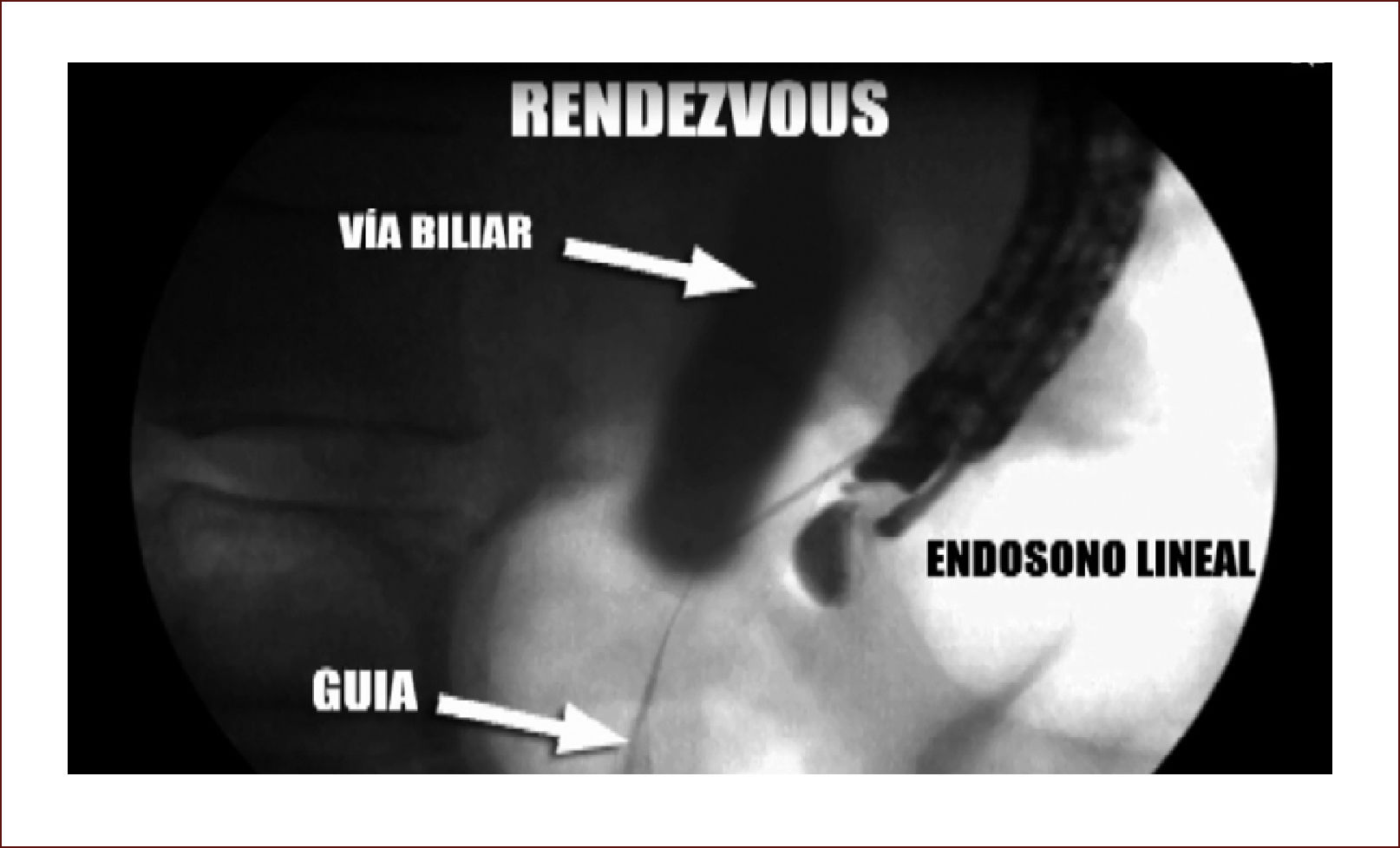
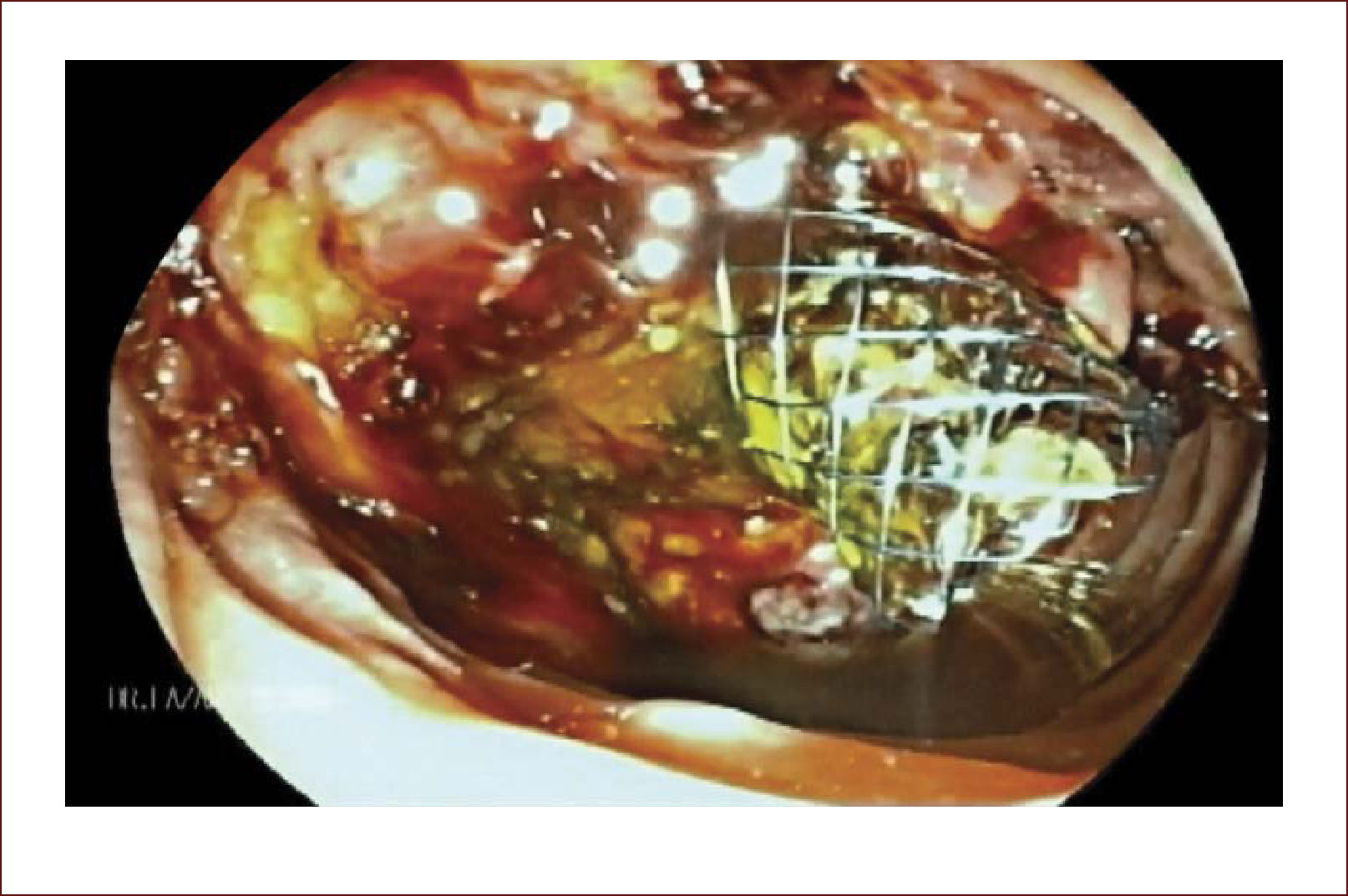
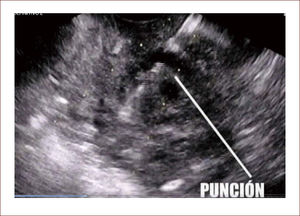
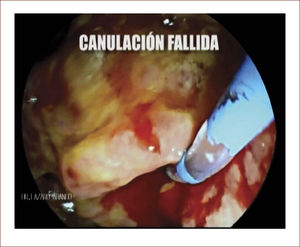
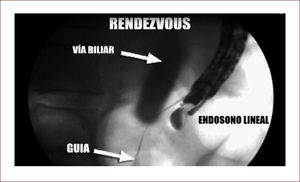
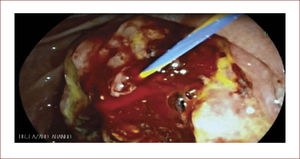
En casos de compromiso tumoral vecino de la vía biliar y si ha sido imposible manejar la ictericia por medio endoscópico, estamos realizando derivaciones tipo colédoco duodenostomias en las que visualizamos la vía biliar por EUS desde el duodeno y la puncionamos con aguja 19 G, pasamos una guía a ella y por medio de un papilotomo de punta pasado por la guía se crea una comunicación entre estas estructuras y se deja instalado allí un stent biliar auto expandible recubierto 42,43. En nuestros casos ha funcionado perfectamente como medida paliativa. Así mismo hemos realizado Rendezvouz en casos en los que no se pudo hacer la CPRE por tumor y en estos casos puncionamos la vía biliar, pero desde otra posición y pasamos una guía hacia el tumor sacándola si es posible al duodeno, pudiendo así realizar la CPRE con éxito. Uno de nuestros casos fue presentado en el campeonato mundial de endoscopia organizado por el Hospital San Borja Arriarán y la Clínica las Condes en Chile en el año 2014, sacando el tercer puesto. Esto antes solo se realizaba por intervención radiológica. Figuras 13 a 18.
En casos de dolor intratable tanto en cáncer como en pancreatitis crónica, se puede hacer la Neurolisis del plexo celíaco, este procedimiento supera de lejos otras vías como la paralela a la columna con guía radiológica, ya que en toda la unión esófago gástrica por EUS se localiza fácilmente la aorta y el tronco celiaco (sitio obligatorio de reparo dentro del examen), y es ahí exactamente donde se puede inyectar alcohol absoluto solo o una mezcla de éste y esteroide. Este método se ha visto mejora el dolor, no lo quita por completo, pero disminuye el uso de analgésicos y mejora la calidad de vida 7.
Como se puede leer El EUS se convierte así en una herramienta importante dentro del armamentario de todo grupo de páncreas y de cirugía en general y es una herramienta diagnóstica y terapéutica importante en entidades médicas.
El EUS en cáncer puede ayudar a la estadificación tumoral. Algunos la están empleando en la inyección de alcohol absoluto o agentes de quimioterapia sobre las masas. Nosotros todavía no hemos ingresado en estas dos últimas modalidades.
Conclusiones:El EUS en cáncer de páncreas en vital porque muestra en conjunto todas las características de la neoplasia, ayuda al diagnóstico histológico de la misma, contribuye a estadificar la lesión y así mismo puede ayudar con procedimientos paliativos. También se usa para el manejo del dolor intratable con resultados excelentes y mínimas complicaciones.
La EUS es un examen complementario a otras pruebas diagnósticas.
Los autores declaran no tener conflictos de interés, en relación a este artículo.
Las imágenes de este artículo han sido autorizadas por el paciente para su publicación.