La hemorragia del postparto es una de las principales emergencias obstétricas. La tasa de mortalidad materna por hemorragias oscila entre 30 y 50%. Los factores de riesgo más importantes son: edad materna avanzada y enfermedades crónicas. La etiología más frecuente es la Inercia Uterina, definida como la incapacidad del útero de retraerse luego del alumbramiento. Su prevención se basa en el manejo activo del trabajo de parto y el tratamiento va desde el uso de terapias farmacológicas con uterotónicos hasta la histerectomía de urgencia. El Acretismo es una inserción anormal de la placenta. Su diagnóstico se basa en el uso de Ecografía y Resonancia Nuclear Magnética y su tratamiento es el parto por cesárea con histerectomía. La radiología intervencionista ha contribuido a disminuir de forma importante la severidad de la hemorragia postparto. Es imprescindible contar con guías de acción protocolizadas para así evitar o disminuir su incidencia y magnitud.
The postpartum hemorrhage is one of de main causes of obstetrics emergencies. The maternal mortality rate due to hemorrhages ranges from 30% to 50%. The most important risk factors are advanced maternal age and chronic pathologies. The most common etiology is Uterine Atony defined as the failure of the uterus to contract following delivery. It can be prevented by an active mangement of the third stage of labour and its treatment goes from de use of uterotonics drugs to an emergency hysterectomy. Placental Accretism is defined as an abnormal placental adherence to the uterus. Its diagnosis is based on the use of Ecography and RNM and the treatment cesarean delivery plus hysterectomy. The interventional radiology has contributed to an important reduction of the severity of the hemorrhage. It is essential to have guidelines of action in order to avoid or reduce significantly its incidence and magnitude.
Hemorragia del parto y/o postparto es una de las principales y más importantes emergencias obstétricas, siendo la principal causa de ingreso a unidades de cuidados intensivos de las pacientes embarazadas y puérperas recientes.
La Federación Internacional de Ginecología y Obstetricia (FIGO) y la Organización Mundial de la Salud (OMS) son activos en promover la prevención de la morbimortalidad materno-fetal secundaria a hemorragias postparto. Para ello se han elaborado guías de acción, protocolos de estudio de factores de riesgo y consentimientos informados, todos basados en medicina basada en la evidencia y considerando las opiniones de expertos. El acceso a métodos diagnósticos, elementos terapéuticos, personal médico capacitado, condiciones nutricionales y de salud de la población y acceso a centros de salud calificados, varía según el país en que nos encontremos.
Las hemorragias postparto constituyen aún una importante causa de Mortalidad Materna (MM). Según la OMS, el 2005 las hemorragias graves ocuparon el primer lugar dentro de las causas de MM a nivel mundial, dando cuenta de un 25% de las muertes maternas totales (1), independiente del nivel de desarrollo y/o ingreso per cápita de cada país. Si bien el 99% de estas muertes ocurrieron en países en vías de desarrollo, es importante destacar la importancia de esta complicación, tanto por su magnitud como por la existencia actualmente de herramientas disponibles para evitar o disminuir al mínimo su ocurrencia. Por otra parte, según la FIGO la tasa de mortalidad materna por hemorragias postparto, que varía de 30% a tasas superiores al 50% en diferentes países o comunidades (2), da también cuenta de esta realidad. La meta planteada al 2015 es reducir en 75% la mortalidad materna por hemorragia postparto con medidas de prevención y tratamiento adecuadas.
En Chile, entre 2000 y 2009 la hemorragia en el postparto ocupó el quinto lugar como causa de MM, con una razón de 0.8 por cada 100.000 nacidos vivos, de una razón total de 17.8 por cada 100.000 nacidos vivos en ese período (3); cifras que se asemejan bastante a aquellas observadas en países desarrollados.
El objetivo de esta revisión es mostrar la realidad de Chile, su inserción en el continente y el resto del mundo, analizar las etiologías más frecuentes, definir los medios con los que cuenta el país para su diagnóstico y eventual prevención, mostrar cuáles son las medidas terapéuticas a nuestro alcance y enfatizar la importancia de la acción multidisciplinaria e idealmente en base a protocolos de acción ante estos eventos.
El artículo analiza la Inercia Uterina, los mecanismos de diagnóstico y prevención, las medidas terapéuticas tanto farmacológicas como quirúrgicas, conservadoras y activas y el rol de la radiología intervencionista como complemento de la terapia. Se efectúa también un análisis de la Placentación Anormal, los medios diagnósticos con que se cuenta, el rol de la Resonancia Nuclear Magnética (RNM) en el diagnóstico de esta patología, los mecanismos complementarios a la cirugía a los que podemos acceder, recalcando el posicionamiento de la radiología intervencionista dentro de ellos y la importancia de agotar las medidas profilácticas y de estabilización materna previa ante la certidumbre de requerir una cesárea-histerectomía.
Definición y clasificaciónLa Hemorragia Postparto (HPP) se define clásicamente como una pérdida de sangre mayor a 500ml en un parto por vía vaginal y mayor a 1.000ml en partos por cesárea. Dado que es difícil la medición exacta del volumen de sangre perdido en dichos procedimientos y a que en general se tiende a subestimar (4), se define de mejor manera como aquella hemorragia de una cuantía tal, que produce compromiso hemodinámico de la paciente.
Se clasifica en:
- 1.
Primaria: Es aquella que ocurre dentro de las primeras 24 horas postparto. Aproximadamente el 70% de las HPP inmediatas postparto obedecen a Inercia Uterina.
- 2.
Secundaria: Es aquella que ocurre entre las 24 horas y las 6 semanas postparto. Las que ocurren posterior a las 6 semanas se relacionan con restos de productos de la concepción, infecciones o ambos.
En la tabla 1 se resumen los principales factores de riesgo para presentar un evento hemorrágico durante el embarazo, parto y postparto. Es importante conocerlos y tenerlos presentes para así poder estar preparado ante la eventualidad de que ocurra dicho evento e incluso, en ciertas situaciones, implementar las herramientas diagnósticas que estén disponibles para llegar a un diagnóstico etiológico y así, en muchos casos, poder ofrecer un tratamiento que evite o disminuya al mínimo la probabilidad de que se produzca una hemorragia importante que comprometa tanto la vida de la madre como del feto.
Factores de riesgo para hemorragia
| Cicatrices uterinas previas |
| Edad materna mayor a 35 años |
| Polihidroamnios |
| Embarazo múltiple |
| Multiparidad |
| Malnutrición materna |
| Anemia materna |
| Legrados uterinos previos |
| Tabaquismo y consumo de drogas |
| Miomas uterinos |
| Síndromes hipertensivos del embarazo |
| Traumatismos abdominales |
| Hemorragia en embarazos previos |
| Trabajo de parto prolongado |
| Patología materna crónica (entre otros) |
Es importante además destacar el rol que juegan por un lado, las enfermedades maternas crónicas como Hipertensión Arterial (HTA), Diabetes Mellitus (DM), Lupus Eritematoso Sistémico (LES), anemias crónicas y; por otro la edad materna al momento del embarazo en la génesis de HPP, especialmente en países desarrollados en los que se ha logrado disminuir más eficientemente la MM por otras causas.
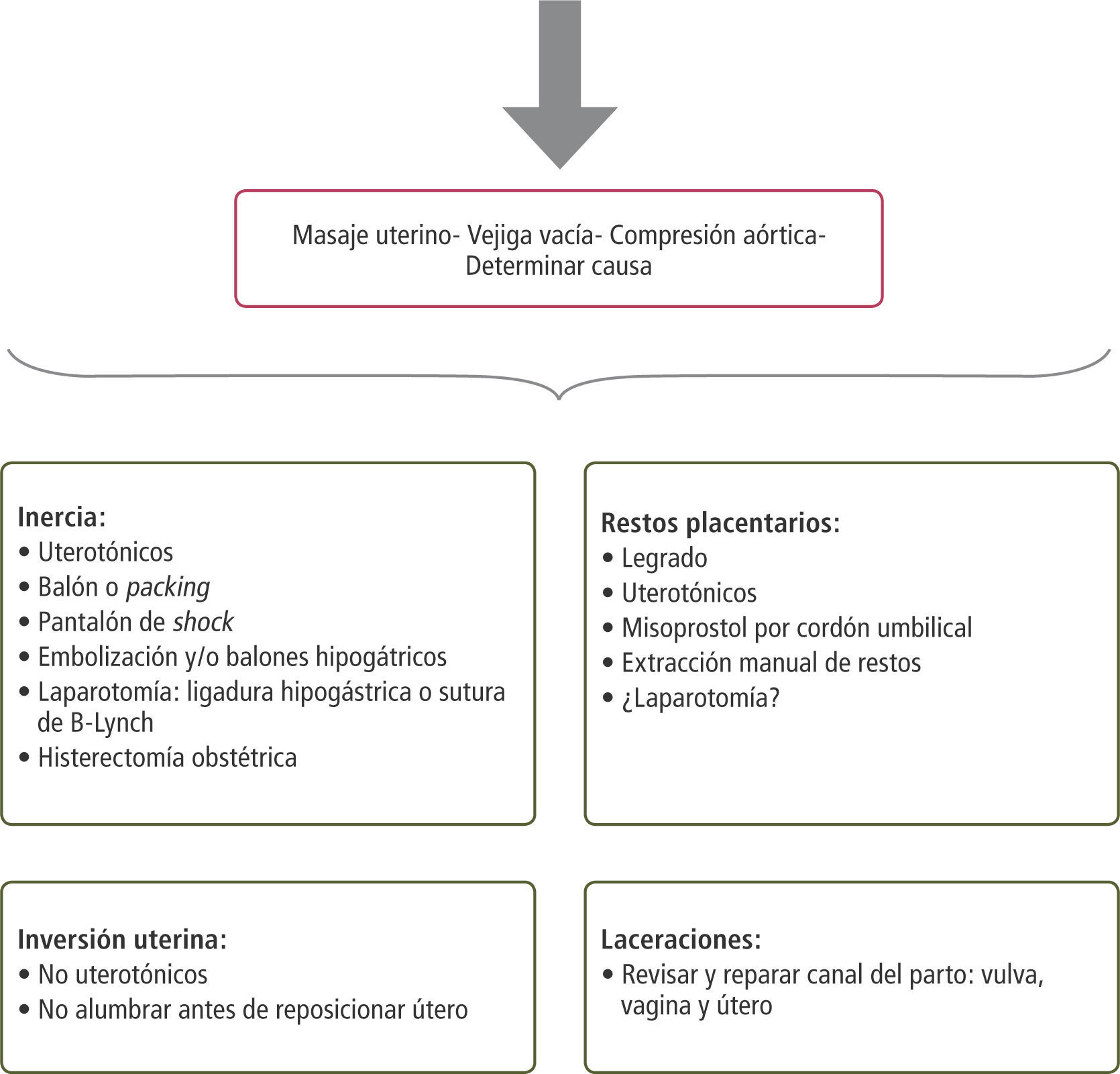
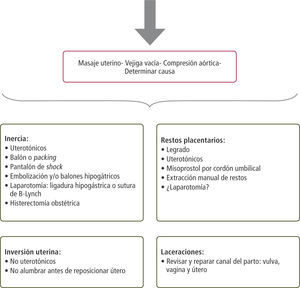
Etiologías: Aproximación diagnóstica y manejoEn el caso de sangrado genital en la segunda mitad del embarazo es importante primero, distinguir las causas ginecológicas de aquellas obstétricas propiamente tal. Dentro de las causas ginecológicas se encuentran la cervicitis o vaginitis, erosiones traumáticas por ejemplo debido a relaciones sexuales, pólipos endocervicales, cáncer cérvicouterino, várices vaginales y/o vulvares, laceraciones genitales, entre otros.
Entre las causas obstétricas de sangrado existen aquellas que se presentan antes del parto, durante trabajo de parto y posterior a éste. Éstas aparecen resumidas en la tabla 2.
En el anexo 1 se resumen las causas más frecuentes, su prevención y tratamiento.
Una manera fácil de recordar las causas de HPP es utilizando la nemotecnia de las ”4T” (2):
- 1.
Tono (70%): Incluye la atonía o inercia uterina
- 2.
Trauma (19%): Incluye trauma uterino (rotura e inversión uterina) y laceraciones de cuello y vagina
- 3.
Tejidos (10%): Incluye retención de restos placentarios y coágulos y placentación anormal
- 4.
Trombina (1%): Incluye coagulopatías congénitas o adquiridas
A continuación se exponen las causas más importantes de HPP, su definición, las aproximaciones diagnósticas para cada una y las alternativas terapéuticas.
I. Inercia uterinaEs la incapacidad del útero de contraerse adecuadamente después del alumbramiento. Hay evidencia estadísticamente significativa de que el manejo activo de la tercera etapa del parto, incluso independientemente de qué especialista lo efectúe, (médico o matrona), reduce la HPP, la necesidad de transfusión y la cuantía del sangrado (5). Los estudios de Bristol y colaboradores (6) y Hinchingbrooke y colaboradores (7) compararon el manejo activo versus la conducta expectante y mostraron diferencias estadísticamente significativas en cuanto a la reducción de HPP con el manejo activo (tabla 3).
Causas de hemorragia
| Con manejo activo | Con manejo expectante | Odds ratio | |
|---|---|---|---|
| bristol etal. | 50 HPP de 846 mujeres (5.9%) | 152 HPP de 849 mujeres (17.9%) | 3.13(2.3–4.2) |
| hinchingbrooke etal. | 51 HPP de 748 mujeres (6.8%) | 126 HPP de 764 mujeres (16.5%) | 2.42(1.78–3.3) |
- •
Uterotónicos: Administrados después del alumbramiento
- •
Occitocina (10 UI IV o 5 IM)
- •
Ergometrina o Metilergometrina (0.2mg IM). Contraindicada en pacientes cardiópatas, con preeclampsia, eclampsia o HTA
- •
Syntometrina (Occitocina 5 UI + Ergometrina 0.5ml por ampolla IM). Contraindicada en pacientes cardiópatas, con preeclampsia, eclampsia o HTA
- •
Misoprostol (400-600-800μg SL o IR). En estudios controlados que comparan uso de Misoprostol versus placebo, incluso sin tracción controlada de cordón ni masajes uterinos, se ha mostrado una reducción significativa de la HPP
- •
- •
Tracción controlada del cordón umbilical: Consiste en una tracción suave y mantenida del cordón umbilical manteniendo una compresión en el fondo uterino, que debe efectuarse durante la contracción uterina (ha mostrado ser más eficiente para prevenir HPP que su no uso). No debe efectuarse tracción del cordón sin compresión del fondo uterino ni fuera de la contracción. Ha registrado mejores resultados en los casos de hemorragias moderadas, pero sin diferencias significativas en casos de hemorragias severas (8)
- •
Masaje uterino post alumbramiento: Puede ser necesario y eficaz hasta dos horas post alumbramiento y hay que asegurarse de que no haya relajación del útero luego de detener los masajes. Si bien no se ha mostrado diferencias al compararlo con pacientes a las que no se les efectuó masaje uterino en cuanto a la cuantía del sangrado, sí disminuyó la necesidad de utilizar uterotónicos de forma adicional (9)
- •
Vaciamiento vesical
- •
Occitocina 20–40 UI por litro de suero fisiológico a 60 gotas por minuto
- •
Si el sangrado persiste a pesar del uso de Occitocina: Egometrina o Metilergromterina 0.2–0.5mg intramuscular lento y si persiste 0.2mg intramuscular cada 2 a 4 horas por máximo 5 dosis. No exceder 1mg en 24 horas por riesgo de crisis hipertensiva
- •
Syntometrina 1 ampolla IM (el uso endovenoso puede causar hipotensión brusca severa)
- •
Misoprostol 800μg rectal o sublingual
Si con el manejo farmacológico no se logra controlar la HPP, se debe:
- 1.
Efectuar compresión bimanual uterina (interna-externa)
- 2.
Compresión aórtica con control de pulso femoral
- 3.
Taponamiento intrauterino:
- a.
Packing
- b.
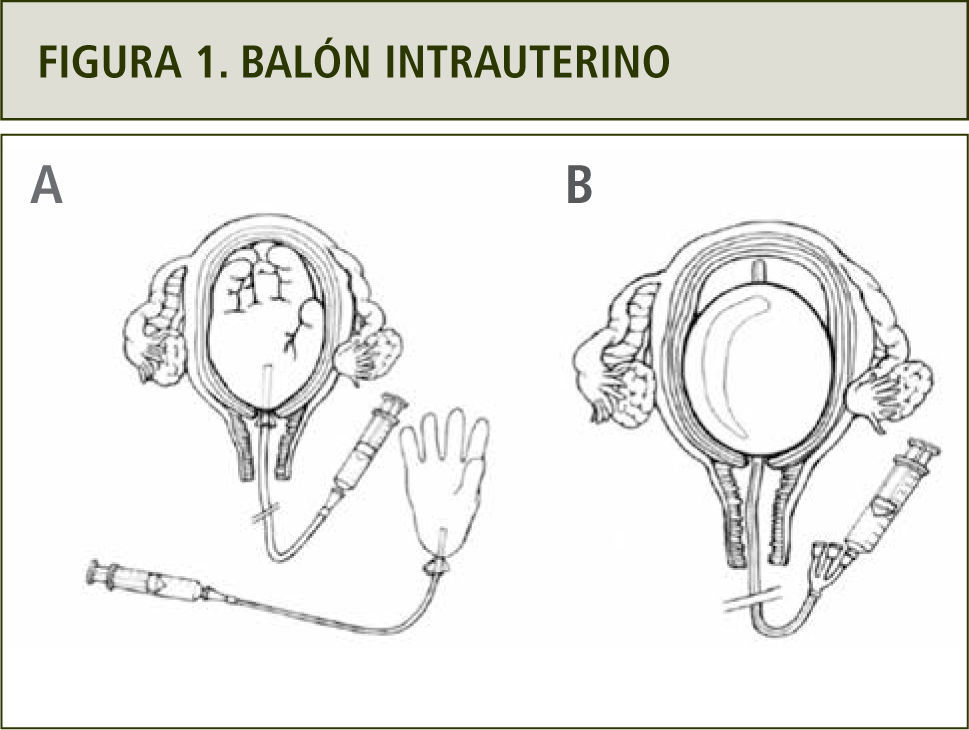
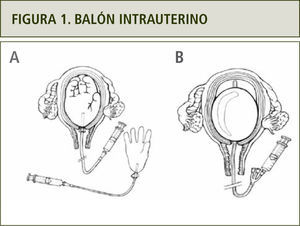
Balón intrauterino (figura1). Ha mostrado una efectividad de hasta 91.5% y por lo tanto, su uso ha sido recomendado en diferentes trabajos (10)
Figura 1.La imagen (A) muestra cómo se puede confeccionar un balón intrauterino utilizando una sonda vesical y un guante estéril en caso de no contar con Balón de Bakri (B). Extraída de FIGO Safe Motherhood and Newborn Health (SMNH) Committee: Prevention and treatment of postpartum hemorrhage in low-resource settings. International Journal of Gynecology and Obstetrics; Vol: 11, 2012. 108–118.
(0.09MB).
- a.
- 4.
Pantalones de shock (no disponible en la mayoría de los centros hospitalarios de nuestro país)
- 5.
Embolización o colocación de balones intraarteriales (en arterias hipogástricas)
- 6.
Laparotomía:
- c.
Ligadura hipogástrica
- d.
Suturas compresivas (B-Lynch)
- c.
- 7.
Histerectomía obstétrica
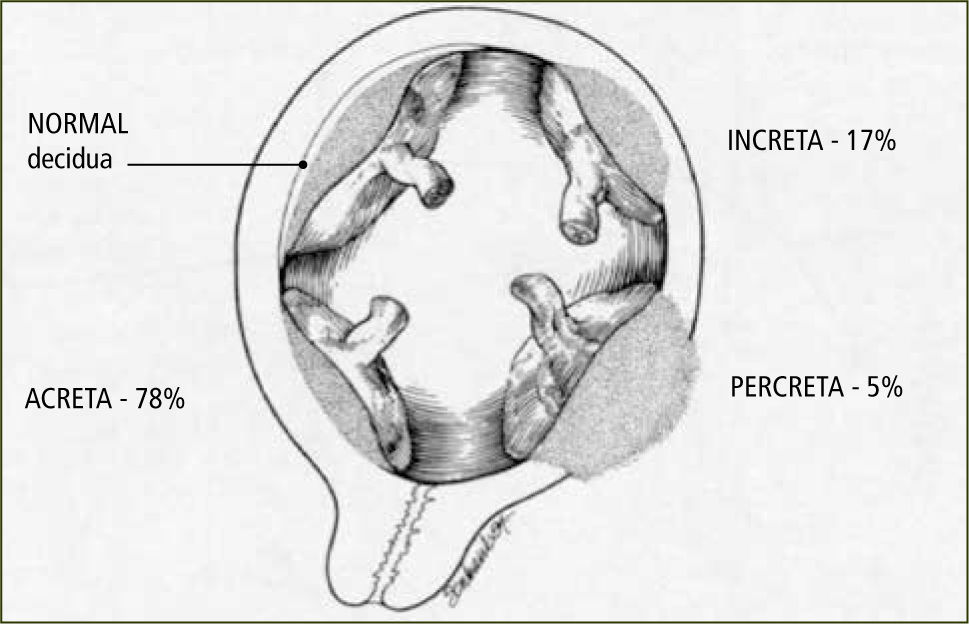
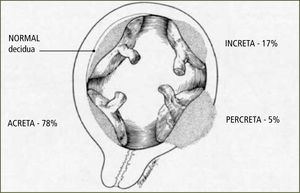
Es la inserción y adherencia anormal de la placenta al tejido uterino. Se clasifica en (figura 2):
- •
Placenta acreta: Placenta adherida firmemente a miometrio sin plano de clivaje
- •
Placenta increta: Placenta invade miometrio
- •
Placenta percreta: Placenta penetra hasta la serosa pudiendo comprometer órganos vecinos
Entre los factores de riesgo para desarrollar un Acretismo Placentario se encuentran:
- •
Riesgo moderado:
- •
Edad materna avanzada
- •
Multiparidad
- •
- •
Riesgo alto:
- •
Cicatriz de cesárea anterior
- •
Placenta previa
- •
- •
Riesgo muy alto:
El Acretismo Placentario es una patología que puede ser diagnosticada durante el embarazo y que debe ser buscada ante la existencia de los factores de riesgo antes mencionados. En el estudio por imágenes de la placenta es de primera línea el uso de ultrasonido (transabdominal o transvaginal) por su amplia disponibilidad, bajo costo, ausencia de radiación ionizante y la capacidad de evaluar la vascularización materno fetal mediante el uso de Doppler color y espectral. Según revisiones recientes tendría una sensibilidad de 90.7% y una especificidad de un 96.9% en manos de un operador entrenado (11). Los signos ecográficos más sugerentes de Acretismo Placentario son:
- -
Pérdida de la homogeneidad placentaria reemplazada por espacios hipo o anecogénicos adyacentes al miometrio contiguo
- -
Pérdida de la interfase retroplacentaria
- -
Pérdida de la interfase entre serosa uterina y vejiga
El otro método diagnóstico importante durante el embarazo es la Resonancia Nuclear Magnética, ya que también es un examen seguro para la madre y el feto, que no emite radiación ionizante.
Por su parte, la cistoscopia es un procedimiento diagnóstico relevante en el caso de sospecha de compromiso vesical, tanto en la determinación de la superficie y profundidad comprometida como en la determinación de la eventual invasión de los meatos ureterales. Es relevante que, pese a exámenes interpretados como normales, la sospecha diagnóstica es lo más importante para implementar la terapia correspondiente
Una vez efectuado el diagnóstico de Acretismo Placentario, se debe informar adecuadamente a la paciente que la conducta a seguir es la histerectomía obstétrica, debiendo durante lo que resta del embarazo lograr las mejores condiciones nutricionales y hematológicas de la paciente, manteniendo control estricto de su gestación con reposo relativo y abstinencia sexual. Si la paciente es portadora de patología no obstétrica, debe estar debidamente compensada (diabetes, HTA, anemia).
Previo a la histerectomía obstétrica, con el objetivo de disminuir el sangrado propio de esta compleja cirugía, existe la posibilidad de efectuar mediante radiología intervencionista embolización y/o colocación de balones en arterias hipogástricas. La embolización es un procedimiento aún controvertido, siendo la colocación de balones arteriales bastante más seguro y controlables sus eventuales complicaciones.
Se propone además un manejo conservador con la finalidad de preservar el útero. Eso podría efectuarse en caso de sospecha de acretismo focal, placenta acreta posterior o en fondo uterino o deseo de la paciente de preservar su fertilidad. Una revisión sistemática (12) reportó los siguientes resultados:
- -
Sangrado severo: 53%
- -
Sepsis: 6%
- -
Histerectomía secundaria: 19%
- -
Muerte: 0.3%
- -
Embarazo posterior: 67%
Además habría un efecto deletéreo sobre la fertilidad de la mujer a largo plazo, aunque los datos al respecto aún son limitados (13–15). Por lo anterior, el manejo conservador no es una aproximación que se recomiende de rutina en la actualidad.
a-. Rol de la Resonancia Nuclear Magnética en el diagnóstico de Acretismo Placentario:
Inicialmente el estudio placentario es por ultrasonido, pero si éste no es concluyente o en casos de implantación posterior de la placenta, está indicada la realización de una Resonancia Magnética para una mejor evaluación. Esto es válido en casos de enfermedad trofoblástica gestacional y especialmente en pacientes con Acretismo Placentario (16). También resulta de utilidad complementariamente al ultrasonido en los casos de compromiso parametrial y en la determinación del grado de invasión trofoblástica.
Dentro de las ventajas de la Resonancia Magnética sobre el ultrasonido se puede mencionar:
- •
Mejor resolución de contraste
- •
Amplio campo de visión
- •
Evaluación de estructuras abdómino-pelvianas fuera del útero
La Resonancia Magnética si bien es un excelente método diagnóstico tiene algunas desventajas:
- •
Alto costo
- •
Disponibilidad limitada
- •
Claustrofobia
La Resonancia Magnética puede efectuarse con medio de contraste (gadolinio), pero dada su recirculación entre el feto y el líquido amniótico y la escasa evidencia de eventuales efectos en el feto, no está aprobado por la FDA (en Europa se utiliza a partir de las 20 semanas de gestación).
En el estudio por Resonancia Magnética se utiliza un Resonador de 1.5 Tesla y las siguientes secuencias:
- •
T2 HASTE (gradiente) en los planos axial, coronal y sagital, que abarca abdomen y pelvis
- •
T2 de alta resolución TSE en los tres planos a nivel pelviano
- •
VIBE (T1 gradiente con saturación grasa) en tres planos sin contraste1
La primera secuencia permite obtener un amplio campo de visión del abdomen y pelvis en los tres planos con apneas de 12 a 24 segundos.
La segunda secuencia (T2 de alta resolución) es para ver detalle anatómico en pelvis, con un menor campo de visión y una mayor resolución en los planos axial, coronal y sagital. Estas secuencias duran tres a cuatro minutos y no dependen de la respiración por estar centradas en la pelvis. La última secuencia es muy útil para detectar productos hemáticos que tienen alta señal o ”brillo” en estas secuencias. Posteriormente las imágenes obtenidas en formato DICOM son enviadas a una estación de trabajo para el análisis en pantallas de visualización de alta resolución.
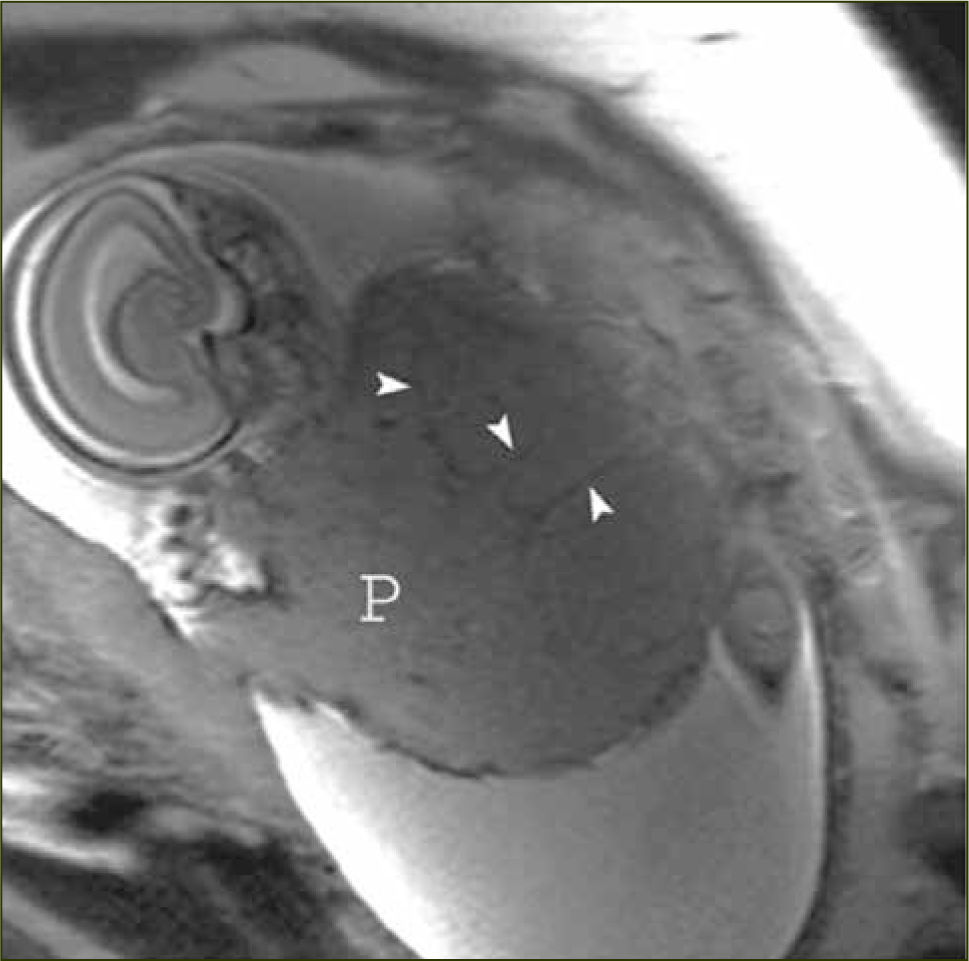
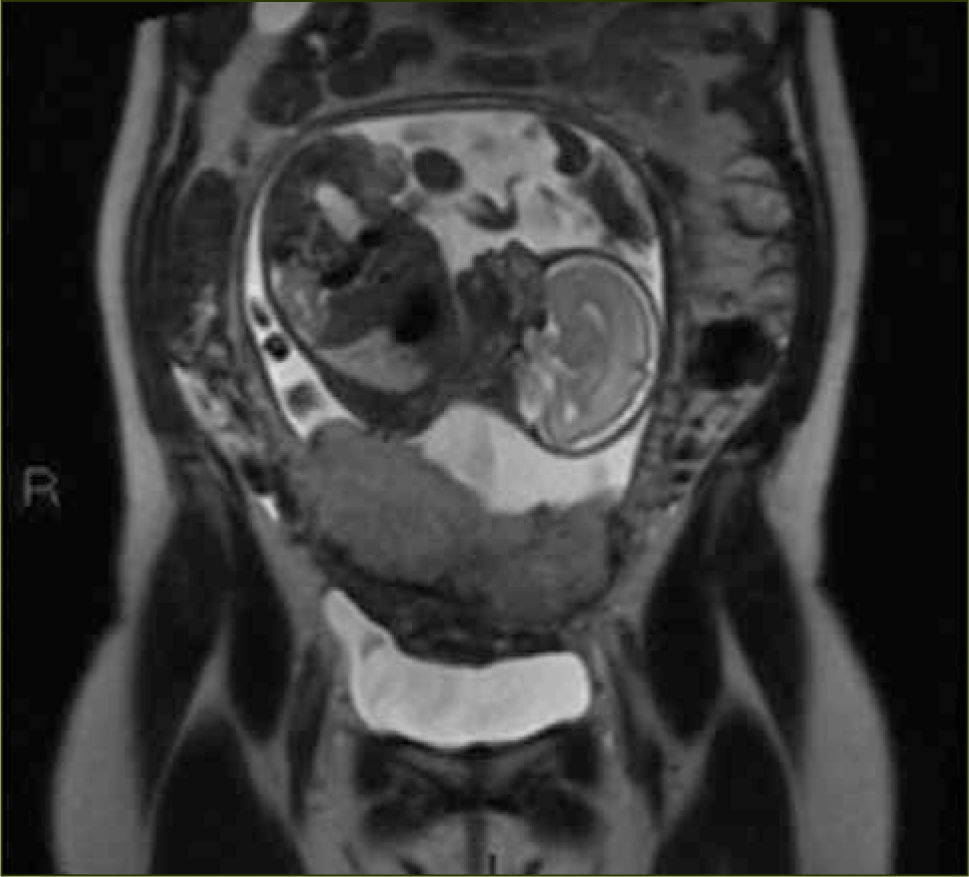
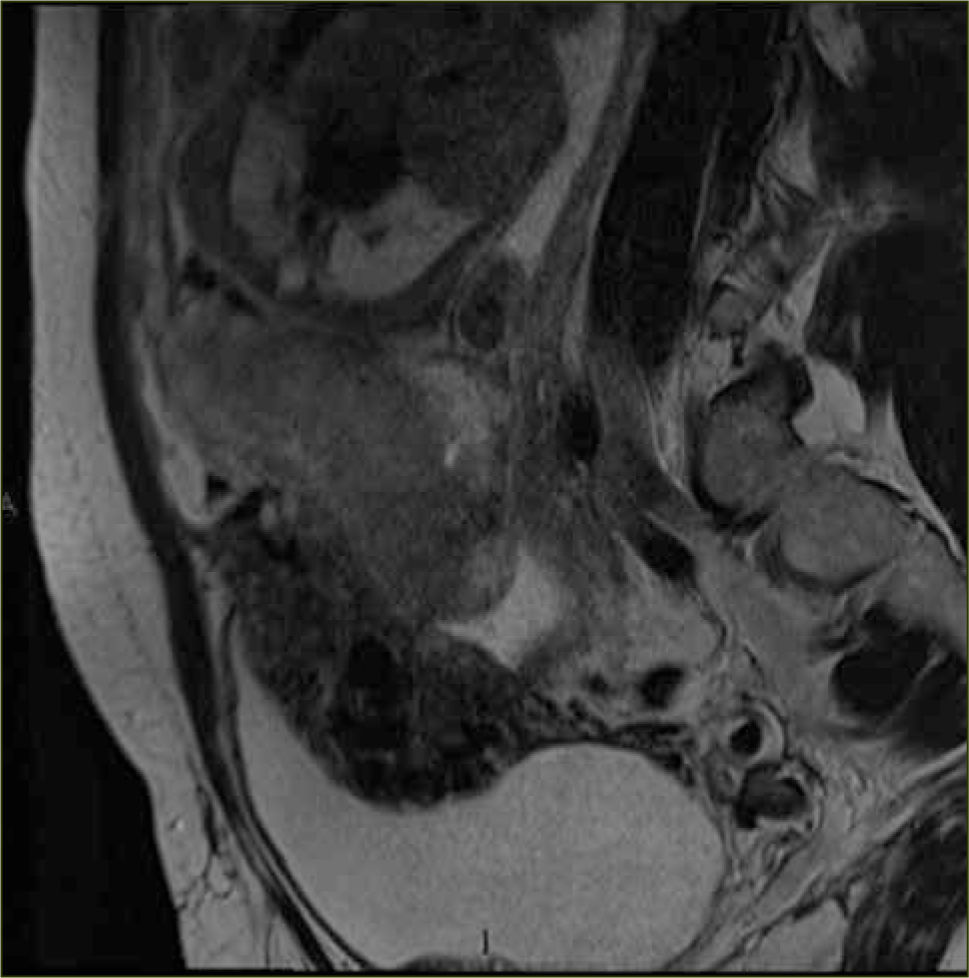
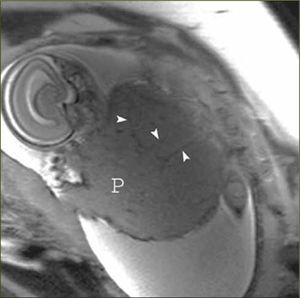
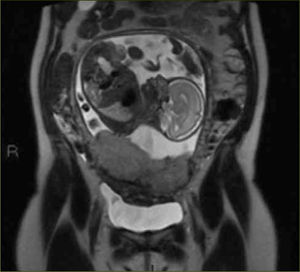
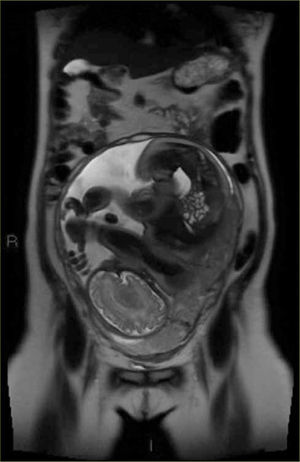
La apariencia normal de la placenta en Resonancia Magnética es de intensidad de señal intermedia, en secuencias potenciadas en T2, con septos finos hipointensos (figura 3) que no deben ser confundidos con las bandas hipointensas irregulares y más gruesas que se asocian a placenta acreta. La vascularización subplacentaria se observa como numerosos ”vacíos de señal” justo por debajo de la placenta (figura 4).
El miometrio en Resonancia Magnética se visualiza de un grosor variable dependiendo de la edad gestacional y con una intensidad de señal intermedia en secuencias potenciadas en T2, limitado por dentro y por fuera por una línea fina hipointensa (estructura en tres capas). Además se pueden visualizar múltiples vacíos de señal en el espesor del miometrio que corresponden a los vasos (figura 5).
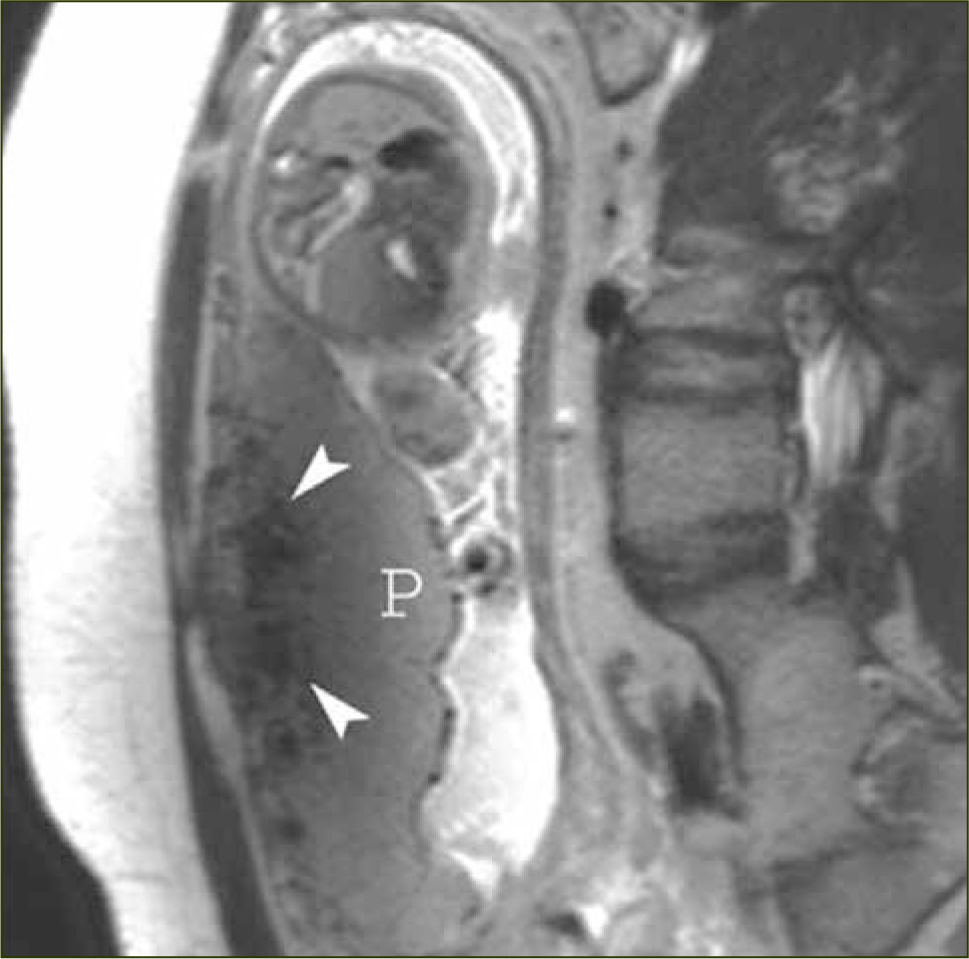
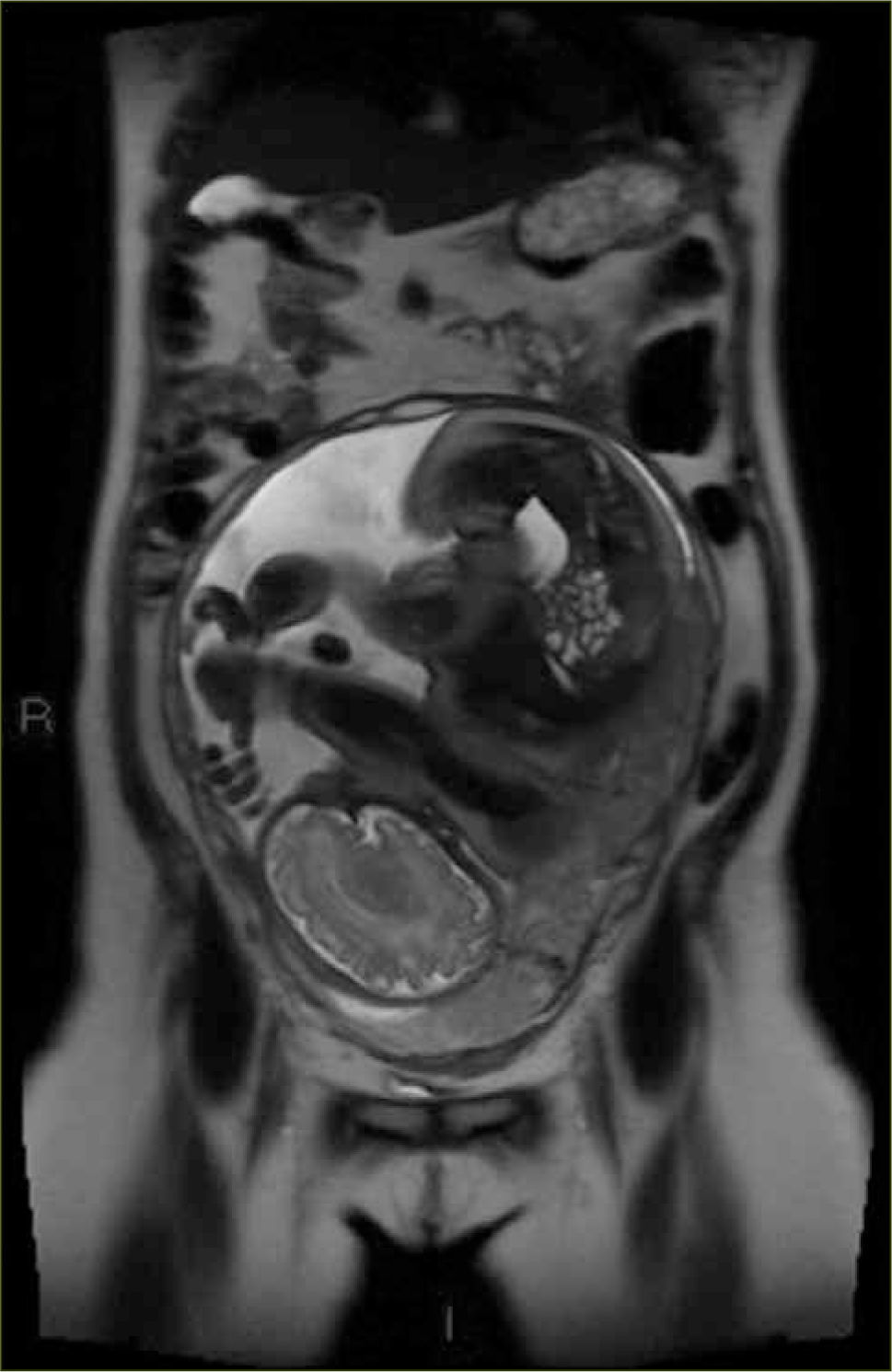
Los signos que sugieren la presencia de una placenta acreta (placenta adherida al miometrio sin invadirlo); increta (placenta invade el espesor del miometrio sin compromiso de la serosa); o percreta (el tejido placentario se extiende a la serosa o a órganos vecinos) en Resonancia Magnética son los siguientes:
Signos de Acretismo Placentario en Resonancia Magnética:
- -
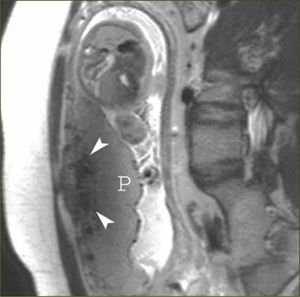
Placenta previa (figura 6)
- -
”Abultamiento uterino”, es decir, pérdida del contorno uterino suave y liso habitual
- -
Intensidad de señal heterogénea dentro de la placenta con vacío de señal que puede corresponder a hemorragia intraplacentaria
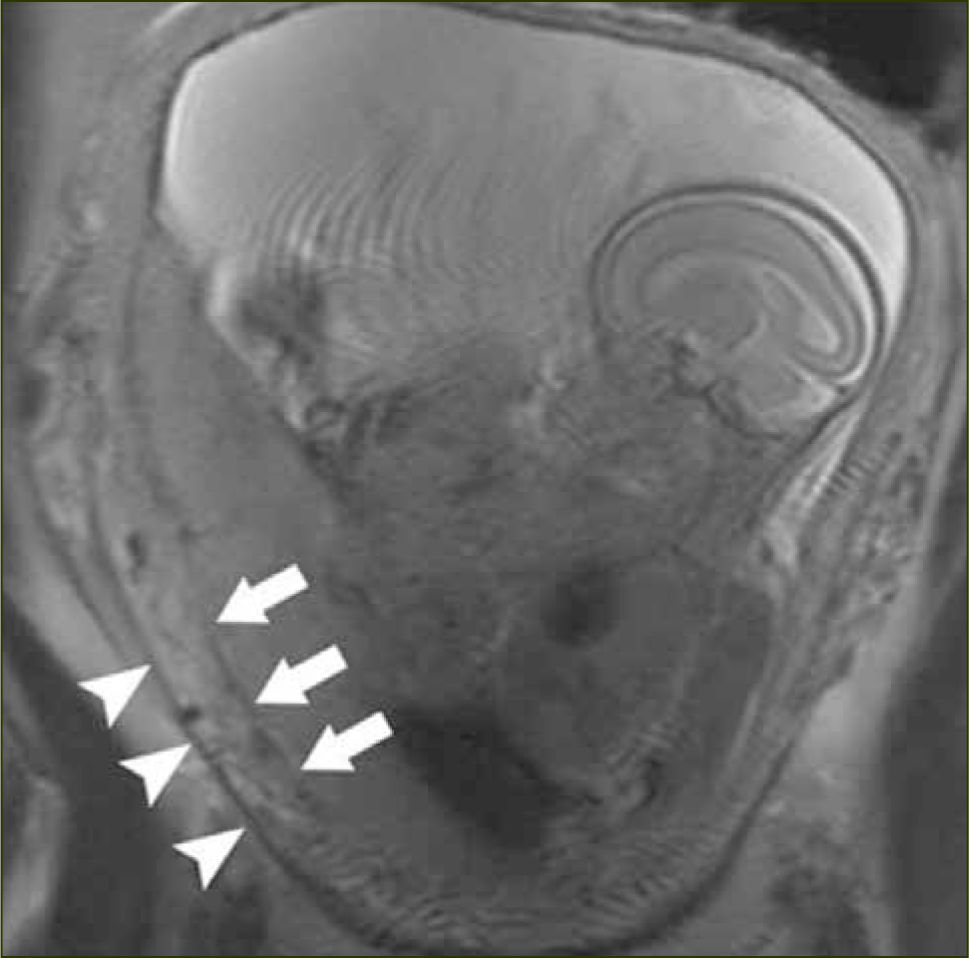
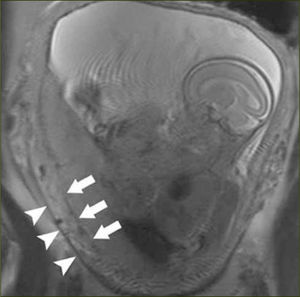
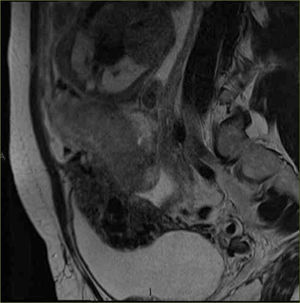
- -
Bandas hipointensas gruesas intraplacentarias que se extienden a la interfase placenta-miometrio (figuras 7 y 8)
- -
Interrupción focal de la pared miometrial (figura 6)
- -
- -
Visualización directa de invasión de estructuras pelvianas por tejido placentario (figura 7)
Considerando que la HPP es la primera causa de muerte materna en el mundo y que el 10% obedece a causas tisulares y un tercio de ellas se relaciona con Acretismo Placentario, el rol de la radiología intervencionista está ocupando un lugar cada vez más importante como complemento de la cirugía.
En los último años han aparecido publicaciones que muestran la utilidad de la tomografía computada multicorte para detectar y localizar el sitio de sangrado activo (18).
La persistencia del sangrado puede ser controlada mediante compresión intrauterina, mediante taponamiento con compresas, inserción de balones inflables (Balón de Bakri) y suturas compresivas (B-Lynch) (19–21). Si después de aplicar las medidas terapéuticas descritas el sangrado persiste, desde el punto de vista de la radiología intervencionista, se puede efectuar terapia endovascular con cateterismo y/o embolización selectiva antes de efectuar una ligadura de las arterias hipogástricas o una histerectomía o como complemento de esta última. La ligadura de las arterias hipogástricas tiene, según diferentes estudios, un 50% de efectividad e impide efectuar un cateterismo posterior (22).
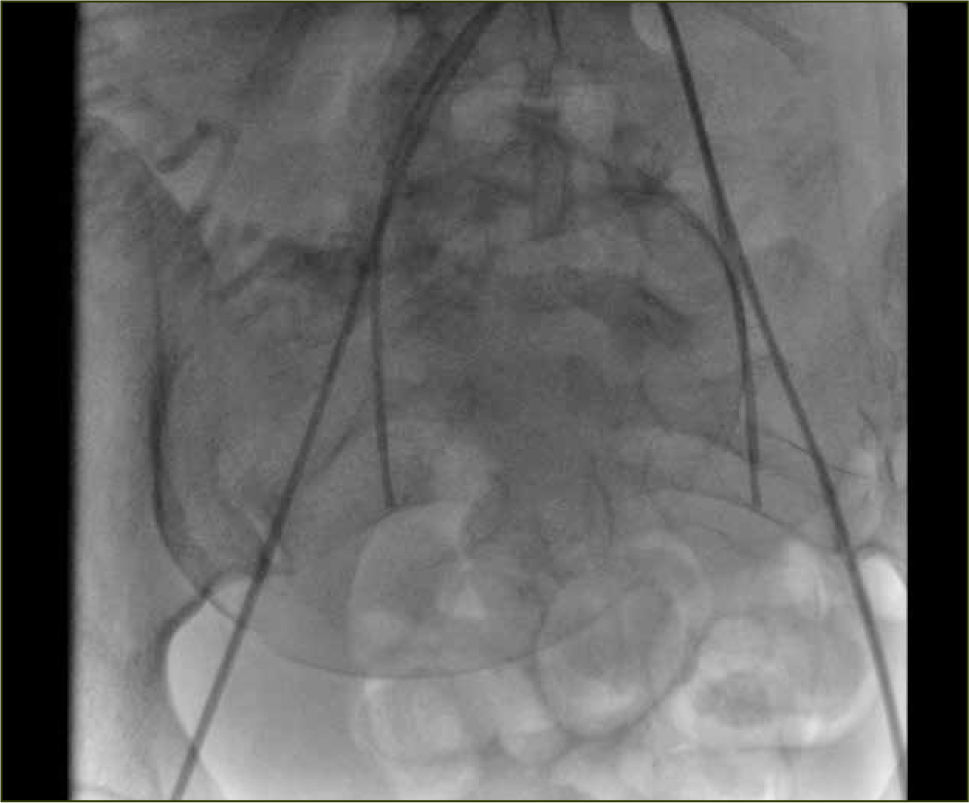
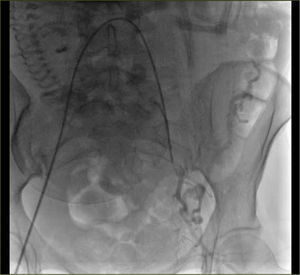
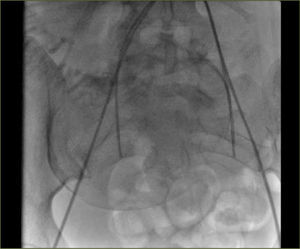
La embolización selectiva en la HPP, fue descrita por primera vez en 1979 (23). Reportes más recientes en la literatura médica presentan buenos resultados, con una efectividad entre 80 y 100% (24) y con un 9% de complicaciones como: fiebre, isquemia glútea y de extremidades inferiores transitoria, disección vascular, perforación arterial y abscesos pelvianos (figura 9).
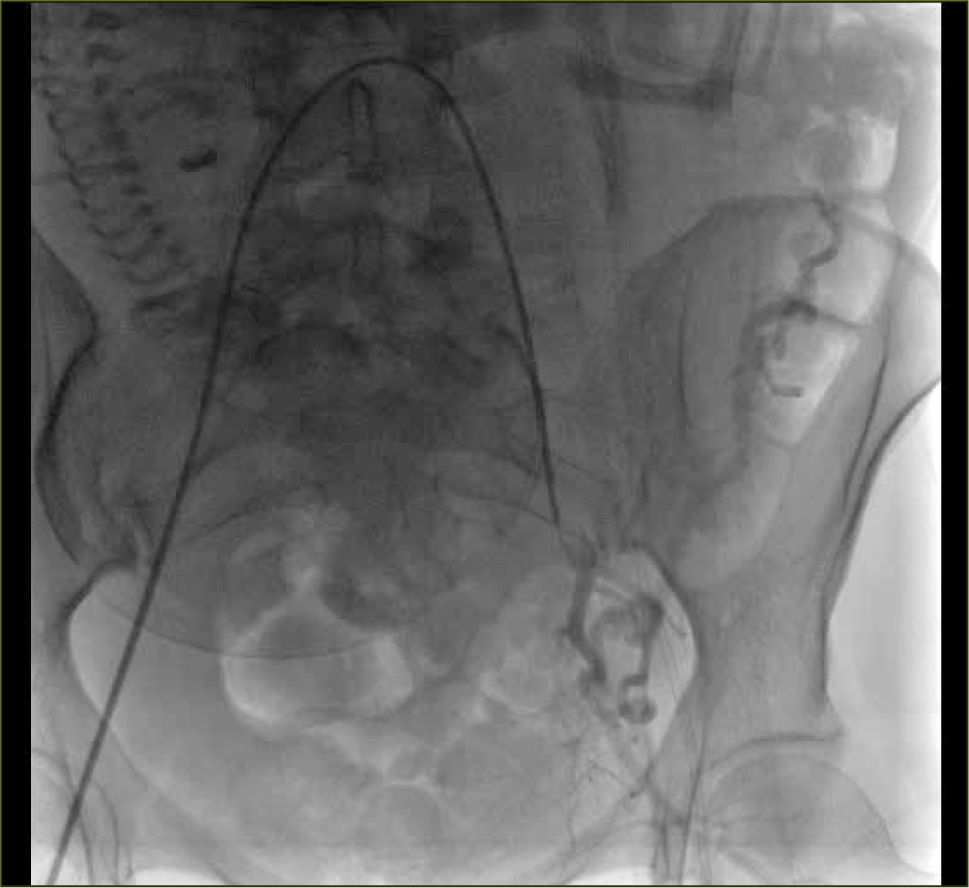
Las pacientes con anormalidades en la inserción placentaria, habitualmente son diagnosticadas con US durante el embarazo; y hoy en día también se dispone de estudios pelvianos con RNM. Ante la eventualidad de confirmarse el diagnóstico, el caso puede ser analizado con el equipo médico y así planificar antes de la cesárea-histerectomía la colocación de un cateterismo profiláctico con un Balón de Oclusión del territorio hipogástrico, con o sin embolización (figura 10).
El cateterismo se puede realizar en una sala quirúrgica híbrida, lo que permite efectuar en el mismo lugar ambos procedimientos o en una sala de hemodinamia y a continuación trasladar a la paciente al pabellón quirúrgico.
Para la instalación de los catéteres se realizan punciones de las arterias femorales comunes con técnica de Seldinger y apoyo anestésico regional (peridural), el que se mantiene durante la cirugía. Se realizan los cateterismos selectivos de las arterias hipogástricas en forma contralateral y se prueban los balones de oclusión, todo esto bajo visión radioscópica. Después de extraído el recién nacido, se inflan los balones para disminuir el sangramiento durante la cirugía y finalizada ésta, se desinflan para verificar la hemostasia. En caso de ser necesario en este momento, se puede requerir embolizar, habitualmente con Gelita (material reabsorbible). Luego se retiran los catéteres y las vainas vasculares para efectuar compresión de los sitios de punción y control de los pulsos distales de las extremidades inferiores2.
Se describe un 3% de complicaciones. Los resultados poco satisfactorios se atribuyen a diferencias técnicas, a las malas condiciones clínicas en que llegan algunas pacientes, a vasoespamo y/o a la extensa red arterial colateral pelviana.
En Clínica Las Condes se realizaron, en 2012 y 2013, tres cateterismos selectivos sin embolización, con buenos resultados, con una franca disminución en sangrado, morbimortalidad y días de hospitalización.
Terapia transfusionalDesde la aparición del Virus de la Inmunodeficiencia Humana (VIH) en la década de los 80, se incrementó el interés en todo el mundo por disminuir las transfusiones de sangre halógena y por esta razón, se desarrollaron diversas medidas para evitarlas.
En el caso específico de las pacientes obstétricas, la presencia de patologías del embarazo, las cuales aumentan el riesgo de hemorragia en el momento del parto, no se desarrollaron de manera tan masiva como en otros pacientes, las técnicas de ahorro de sangre.
Probablemente porque los métodos diagnósticos no permitían detectar los factores de riesgo hemorrágico en el parto como ocurre hoy y la circunstancia de la hemorragia postparto se producía de manera inesperada y nada se podía hacer, salvo transfundir a veces masivamente a las pacientes.
Una técnica muy popular en los años 80 y 90, fue la pre-donación de sangre, la cual consistía en enviar a los pacientes a realizar un depósito de sangre previo a la cirugía, de una a dos unidades, las cuales se utilizarían en caso necesario.
Esta técnica mostró ser poco útil, ya que en la mayoría de los casos no se utilizaban y además los pacientes llegaban anémicos a la cirugía debido a que en un plazo de dos semanas no lograban recuperar los glóbulos rojos extraídos.
La paciente obstétrica es particularmente mala candidata a someterse a estas técnicas sobre todo porque en la última fase del embarazo, cuando presentan alguna condición de riesgo como por ejemplo placenta previa, deben permanecer en reposo.
Debido a las razones expuestas, lo recomendable es optimizar la masa de glóbulos rojos previo a la cirugía y en aquellos casos en que se programa una histerectomía obstétrica, se recomienda la utilización de equipos de rescate de sangre del campo quirúrgico (Cell Salvage) (25).
Existe un fundado temor al uso de estos equipos por el riesgo de producir embolia de líquido amniótico al retransfundir sangre extraída desde el campo quirúrgico, sin embargo, hay varios reportes que avalan su utilización (26).
Las recomendaciones fundamentales es que en el momento de la extracción del feto, se utilice una aspiración distinta a la del recuperador celular para poder de esta manera eliminar el líquido amniótico.
Por otra parte, el proceso de recuperación de glóbulos rojos desde el campo quirúrgico involucra un ciclo de lavado, el cual se puede realizar con mayor cantidad de solución de lavado que la utilizada de formar habitual. Finalmente hay trabajos que sugieren la utilización de filtros leucocitarios para lograr un producto equivalente a la sangre materna (27).
Por último, es importante señalar que estas medidas son complementarias a lo ya expuesto y que una unidad de sangre ahorrada disminuirá los riesgos transfusionales, en especial en los relacionados a la transmisión de enfermedades virales cuya magnitud en Chile aún están muy lejos de aquellas obtenidas en países desarrollados (28).
SíntesisLa HPP continúa siendo una causa importante de muerte materna a nivel mundial, predominantemente en países subdesarrollados. La detección de factores de riesgo y el diagnóstico de la causa permite prevenir su incidencia.
El aporte de la radiología diagnóstica e intervencionista estos últimos años, ha permitido optimizar las medidas profilácticas y terapéuticas en pacientes con factores de riesgo.
El manejo adecuado de la patología médica asociada es vital para lograr una disminución en su incidencia.
Contar con protocolos adecuados a la situación de cada centro y/o comunidad, permite un mejor diagnóstico y una mayor eficiencia terapéutica.
Los autores declaran no tener conflictos de interés, en relación a este artículo.
Prevención:
- •
Manejo activo de la tercera etapa del parto
- •
Identificación de factores de riesgo y causas de HPP
Si la HPP está instalada:
- •
Monitorización materna
- •
Vía aerea permeable
- •
Vía venosa permeable
- •
Mantener ciclo vital estable (presiones arteriales mayores o iguales a 100/50 mmHg)
- •
Uso de uterotónicos endovenosos
- •
Eventualmente transfusión
El uso de medios de contraste paramagnéticos como el gadolinio (no aprobado por la FD.) es controvertido en el embarazo por lo incierto de sus efectos en el feto (18). En nuestro centro no lo utilizamos de rutina, ya que las secuencias empleadas nos permiten hacer un adecuado diagnóstico. El examen lo realiza el tecnólogo médico y debe ser supervisado por el médico radiólogo para determinar si es necesario repetir alguna secuencia (por ejemplo, por artefactos por movimiento fetal o respiratorio) o realizar secuencias en planos oblicuos.
En la literatura médica hay controversia respecto de la embolización y la seguridad de esta técnica, ya que faltan estudios prospectivos randomizados, para posibilitar el sugerir su uso rutinario.