La incidencia de Tromboembolismo Venoso (TEV) en el embarazo se incrementa aproximadamente de 4 a 50 veces más en comparación con mujeres no embarazadas, debido a las modificaciones que el propio embarazo produce sobre los factores de la coagulación y los sistemas fibrinolíticos. Se estima que la TEV complica entre 1 y 1,5 por cada 1.000 embarazos. Durante el embarazo la hemostasia materna se caracteriza por ser un estado protrombótico en el cual se producen cambios en el sistema hemostático, con el objetivo de prevenir una posible hemorragia durante las primeras etapas del embarazo, parto y puerperio. Sin embargo, la adaptación del sistema hemostático materno al embarazo predispone a la madre a un riesgo incrementado de TEV.
El diagnóstico de los eventos tromboembólicos en el embarazo constituye un reto para los equipos tratantes, ya que los hallazgos clínicos y de laboratorio característicos de esta enfermedad pueden estar enmascarados en los cambios fisiológicos propios de la gestación, por lo que el inicio de su evaluación suele ser complejo.
Para el correcto y oportuno diagnóstico de TVP y TEP se requiere de una combinación de varios elementos que incluye: síntomas y signos, estudios de laboratorio e imagenología.
El uso de anticoagulantes en pacientes obstétricas requiere de un plan de interrupción del embarazo lo más controlado posible. En la práctica clínica cotidiana esto no siempre es posible, debido a la incapacidad de predecir el momento de inicio del trabajo de parto. Por este motivo las recomendaciones relativas al manejo analgésico y anestésico del parto están basadas en el conocimiento de los cambios fisiológicos, farmacocinético y farmacodinámico de los anticoagulantes utilizados, lo que se analiza en extenso en esta revisión.
The incidence of venous thromboembolism (VTE) in pregnancy is increased approximately 4 to 50 times compared to nonpregnant women, due to the changes that pregnancy itself produces in the coagulation and fibrinolytic systems. It is estimated that VTE complicates between 1 and 1.5 per 1,000 pregnancies.
During pregnancy maternal hemostasis is characterized by a prothrombotic state in which changes are produced in the hemostatic system in order to prevent possible bleeding during early pregnancy, childbirth and postpartum. Moreover, the maternal hemostatic system adaptation to pregnancy predisposes the mother to an increased risk of VTE.
The diagnosis of thromboembolic events in pregnancy is a challenge for the Maternal fetal specialists as clinical and laboratory findings that are a characteristic of this disease, may be masked on own physiological changes of pregnancy, making the startup of the evaluation often complex.
For the proper and timely diagnosis of DVT and PE, a combination of several elements is required, including: symptoms and signs, laboratory and imaging studies.
The use of anticoagulants in obstetric patients requires a controlled plan for the moment of labor and delivery. In everyday clinical practice, this is not always possible due to the inability to predict the time of onset of labor. For this reason, the recommendations relating to the analgesic and anesthetic management of labor are based on knowledge of the physiological, pharmacokinetic and pharmacodynamics changes of anticoagulant used, which is discussed at length in this review.
El embarazo y el puerperio son factores de riesgo bien establecidos para el Tromboembolismo Venoso (TEV), que ocurre con una prevalencia de 1 en 1600 (1–6).
El TEV puede manifestarse durante el embarazo como Trombosis Venosa Profunda aislada de las extremidades inferiores (TVP) o como una Embolia Pulmonar (EP) (7,8). EP es la séptima causa de mortalidad materna, responsable del 20 a 30 por ciento de las muertes maternas (9,10).
EpidemiologíaEl embarazo, en sí mismo, es un factor de riesgo para el desarrollo de TEV con una incidencia que es de 4 a 50 veces mayor en comparación con las mujeres no embarazadas. La mayoría de los estudios reportan una distribución equitativa de TEV en los distintos trimestres del embarazo (11–13). Sin embargo, dos grandes estudios retrospectivos reportan un predominio de eventos trombóticos en el primer trimestre (50% antes de las 15 semanas) y en el tercer trimestre (60%) (14,15).
En Estados Unidos, TEV se diagnostica 1 cada 500 a 2.000 embarazos. En un estudio de casos y controles retrospectivo de 395.335 mujeres embarazadas a las 24 semanas de gestación, la incidencia de TEV fue de 85 por cada 100.000 embarazos (11). Un estudio de cohorte poblacional durante un período de 30 años detectó una incidencia global de TEV de 200 por 100.000 años-mujer. TVP es tres veces más frecuente que EP (4).
Tasas similares se observan en Europa (2,4). En un estudio retrospectivo de más de 72.000 partos, la incidencia de TVP fue de 0,71 por cada 1.000 partos (95% IC 0,5–0,9). La incidencia de EP fue de 0,15 por cada 1.000 partos (95% IC 0,06 - 0,24). En Gran Bretaña es la segunda causa más frecuente de mortalidad materna.
En Chile, la mortalidad materna se ha mantenido estable en los últimos 15 años, alrededor de 18 a 20 por cien mil nacidos vivos y en el decenio 2000–09, embolia fue la cuarta causa de muerte, responsable del 5% del total de ellas (16).
Factores de riesgoDurante el embarazo- •
Embarazo múltiple
- •
Várices
- •
Enfermedad inflamatoria intestinal
- •
Infección del tracto urinario
- •
Diabetes
- •
Hospitalización por razones no obstétricas (> 3 días)
- •
Índice de Masa Corporal (IMC) ≥ 30kg/m2
- •
Edad materna ≥ 35 años
En comparación con el período anteparto, el TEV es dos a cinco veces más frecuente en este período. El riesgo es mayor en las primeras seis semanas postparto, luego disminuye a tasas similares a las de la población general (17).
Los factores que aumentan el riesgo de TEV en el período postparto son:
- •
Parto por cesárea
- •
Comorbilidades médicas (por ejemplo várices, enfermedad cardíaca, enfermedad inflamatoria intestinal)
- •
Índice de Masa Corporal (IMC) > 25kg/m2
- •
Parto prematuro <36 semanas
- •
Hemorragia obstétrica
- •
Muerte fetal
- •
Edad materna ≥ 35 años
- •
Hipertensión arterial crónica
- •
Tabaco
- •
Eclampsia o preeclampsia
La mayoría de las trombosis venosas profundas de las extremidades inferiores durante el embarazo son preferentemente al lado izquierdo. Esta distribución se ha atribuido a un aumento del estasis venoso en la pierna izquierda en relación a la compresión de la vena ilíaca izquierda por la arteria ilíaca derecha, junto con la compresión de la vena cava inferior por el útero grávido.
TrombofiliasEl riesgo de TEV se magnifica en las embarazadas que han heredado alguna trombofilia (3,18,19).
Aunque colectivamente la prevalencia es de aproximadamente el 10% de la población caucásica, los datos sugieren que al menos el 50% de las mujeres con TVP durante el embarazo han adquirido o heredado una trombofilia (1).
Las trombofilias hereditarias incrementan el riesgo de trombosis materna y se ha planteado la hipótesis de que pueden causar trombosis en la interfase materno-placentaria que resulta finalmente en complicaciones placentarias, como aborto espontáneo, deterioro del crecimiento fetal, preeclampsia, desprendimiento prematuro de placenta normo-inserta y muerte fetal.
La revisión reciente de la literatura sugiere sin embargo, que el síndrome antifosfolípidos es la única trombofilia que puede asociarse a efectos adversos en el embarazo y las guías existentes recomiendan el uso de dosis bajas de aspirina y/o heparinas de bajo peso molecular (12) en estos casos.
La realización entonces, del estudio de trombofilias en mujeres con antecedentes de aborto recurrente, desprendimiento prematuro de placenta, restricción del crecimiento fetal y preeclampsia, no se recomienda debido a la falta de evidencia de una asociación causal y/o la falta de evidencia de que la administración de medicamentos anticoagulantes sean eficaces para mejorar el resultado perinatal.
Una revisión sistemática encontró que el uso de Heparina de Bajo Peso Molecular (HBPM) para prevenir la recurrencia de un aborto en pacientes con historia de abortos recurrentes, mostró una tendencia hacia el aumento de las tasas de nacidos vivos con el tratamiento (rango de nacidos vivos con HBPM 81–95%; y sin HBPM de 29–88%) (15). Sin embargo, la heterogeneidad estadística y clínica observada entre los estudios llevó a los autores a concluir que no había evidencia suficiente como para apoyar el uso rutinario de la HBPM en mujeres con trombofilia hereditaria y aborto.
Otros dos grandes ensayos randomizados encontraron que ni la aspirina ni la aspirina más heparina mejoraron la tasa de nacidos vivos de las mujeres con pérdida gestacional recurrente inexplicable antes de las 20 o 24 semanas de gestación (3,26). Algunas de estas mujeres (6% en un estudio y 13% en el otro) tenían una o más trombofilias hereditarias.
PatogeniaEl embarazo y el puerperio se caracterizan por la presencia de los tres componentes de la tríada de Virchow: estasis venoso, lesión endotelial e hipercoagulabilidad (2).
Estasia venosaLa estasia venosa de las extremidades inferiores se produce durante el embarazo debido a dos factores: los cambios asociados con el embarazo en la capacitancia venosa y la compresión de las grandes venas por el útero grávido.
Aunque el volumen de sangre y el retorno venoso total están aumentados en el embarazo, la velocidad de flujo lineal en las venas de las extremidades inferiores se reduce debido a la dilatación inducida hormonalmente, lo que lleva a estasia e incompetencia valvular. Estos cambios tempranos son amplificados por la compresión de la vena cava inferior y de la vena ilíaca por el útero grávido.
Daño endotelialEl parto produce lesión vascular y cambios en la superficie útero-placentaria, lo que probablemente contribuye al aumento del riesgo de TEV en el postparto inmediato. La cesárea puede aumentar aún más las lesiones de la íntima vascular y amplificar este fenómeno.
HipercoagulabilidadEl embarazo es un estado de hipercoagulabilidad asociado con aumentos progresivos de varios factores de la coagulación, incluyendo los factores I, II, VII, VIII, IX y X, junto con una disminución de la proteína S (1,20). Un aumento progresivo de la resistencia a la proteína C activada se observa normalmente en el segundo y tercer trimestre. La actividad de los inhibidores fibrinolíticos PAI-1 y PAI-2 se incrementa durante el embarazo, aunque la actividad fibrinolítica total no se ve afectada (21).
La hipercoagulabilidad del embarazo tiene un sentido evolutivo ya que este estado protege a la mujer de las hemorragias de abortos y partos.
Presentación clínicaAproximadamente 80% de los eventos tromboembólicos durante el embarazo corresponde a trombosis venosas profundas y 20% a embolias pulmonares.
Los signos y síntomas sugestivos de trombosis venosa son dolor difuso e inflamación, que puede o no estar asociada con eritema, calor y dolor en la extremidad inferior. Los signos o síntomas de trombosis de la vena ilíaca incluyen aumento de volumen de la pierna, zona baja del abdomen, glúteos o dolor lumbar.
DiagnósticoEl diagnóstico de Trombosis Venosa Profunda en el embarazo se realiza mediante la demostración de la ausencia de la capacidad compresiva de las venas proximales en la ecografía (trombosis venosa femoral) o alteración del flujo mediante Doppler de la vena ilíaca (trombosis venosa ilíaca).
Dímero-DEl Dímero-D es un producto de degradación de la fibrina, que ha sido ampliamente estudiado para su uso en el diagnóstico de la TVP. En pacientes no embarazadas, el valor predictivo negativo del Dímero-D para descartar TVP es alto; sin embargo, en el embarazo, aunque el valor predictivo negativo sigue siendo alto, no es tan útil debido al aumento de sus niveles durante la gestación.
ImágenesGran parte de los datos para apoyar los estudios de imagen para el diagnóstico de Trombosis Venosa Profunda en el embarazo se extrapolan a partir de grandes estudios en población no embarazada, que sugieren eficacia similar en el embarazo. El diagnóstico de TVP durante el embarazo se realiza demostrando una alteración en la compresibilidad de las venas proximales en la Ecografía de Compresión (CUS).
- •
Compresión Ultrasonográfica: En pacientes embarazadas, una pobre compresibilidad de una vena al ultrasonido es altamente sensible (95%) y específica (>95%) para el diagnóstico de trombosis venosa proximal sintomática (22). Cuando este examen resulta positivo se debe instaurar anticoagulación inmediata.
En los casos donde el estudio Doppler es negativo, la trombosis venosa pélvica puede sospecharse cuando la vena visualizada es compresible, pero hay ausencia de los cambios fisiológicos del flujo durante la respiración o con maniobra de Valsalva.
- •
Venografía por Resonancia Nuclear Magnética: Es una modalidad que puede detectar Trombosis Venosa Profunda en muslo y venas pélvicas con una sensibilidad cercana al 100% de la población no embarazada. Los datos son limitados en el embarazo.
- •
Venografía por contraste ascendente: La visualización de un defecto de llenado por medio del uso de medio de contraste ascendente se considera el estándar de oro para el diagnóstico de Trombosis Venosa Profunda de las extremidades inferiores en la población no embarazada (23). Los estudios que miden la sensibilidad y especificidad de la venografía por contraste en el embarazo son escasos. Además, la venografía expone al feto a radiación ionizante, el útero grávido supone dificultades técnicas para canular la vena femoral y disminuye la sensibilidad para el diagnóstico de trombosis iliofemoral debido al blindaje-abdominal pélvico.
El diagnóstico acertado de TVP en el embarazo y el puerperio requiere que los médicos tengan un alto índice de sospecha clínica, para así solicitar exámenes de laboratorio o imagenología que confirmen o descarten el diagnóstico (24).
El acrónimo de predicción clínica LEFt se desarrolló por el razonamiento de que la TVP en el embarazo es predominantemente unilateral e izquierda. Un estudio transversal evaluó la utilidad de este acrónimo como predictor clínico de Trombosis Venosa Profunda sospechada por primera vez en 194 mujeres embarazadas (25). Tres variables objetivas fueron altamente predictivas de TVP:
- •
Síntomas clínicos en pierna izquierda (L para la izquierda)
- •
Diferencia del diámetro de la pantorrilla ≥ 2cm (E para edema)
- •
Presentación clínica en el primer trimestre (Ft. de primer trimestre)
Al menos una de estas variables estuvo presente en todas las mujeres con TVP (8,8%). Entre las pacientes que se presentaron con ninguna, una, o dos a tres de estas variables, la TVP fue diagnosticada en 0, 16 y 58%, respectivamente. Este acrónimo como predictor clínico fue validado en una cohorte independiente de 157 embarazadas con sospecha de TVP. En esta población, mostró un excelente valor predictivo negativo (identificó al 100% de pacientes sin trombosis venosa).
- •
Cuando la sospecha clínica es alta, es preferible utilizar algún estudio de imágenes para confirmar el diagnóstico por medio del ultrasonido Doppler dirigido a las venas ilíacas, venografía por resonancia magnética o venografía por contraste ascendente, según sea necesario. Para estas pacientes, se sugiere anticoagulación empírica de entrada.
- •
Para pacientes en quienes la sospecha clínica es baja, es preferible utilizar la ecografía Doppler para descartar o confirmar el diagnóstico, sin anticoagulación empírica y con seguimiento clínico durante todo el embarazo.
La tromboprofilaxis puede ser farmacológica (anticoagulación) o mecánica (dispositivos de compresión neumática intermitente o medias de compresión graduada). Previo a indicar tromboprofilaxis es necesario realizar una evaluación de riesgo para determinar el manejo prenatal durante el parto o cesárea y postnatal. En las figuras 1 y 2 se muestran los algoritmos de manejo y toma de decisión según la evaluación de riesgo, que debe ser realizada por el médico obstetra tratante durante el control del embarazo.
Existen también tablas que determinan un puntaje de riesgo de TEV, las cuales permiten definir si se realizará tromboprofilaxis, cuándo iniciarla y cuánto tiempo debe perdurar (tabla 1). En la evaluación de riesgo es importante identificar factores de riesgo de hemorragia y así tomar las precauciones (tabla 2).
Riesgo de tromboembolismo venoso (TEV)
| Factores de riesgo pre existentes | Puntaje |
|---|---|
| TEV previo recurrente | 3 |
| TEV previo (sin factores de riesgo con estrógenos) | 3 |
| TEV previo con factores de riesgo | 2 |
| Historia familiar de TVE | 1 |
| Trombofilia conocida | 2 |
| Patología médica asociada | 2 |
| Edad (>35 años) | 1 |
| Obesidad | ½ (1 p, imc >30Kg/m2; 2 p, imc >40 |
| Paridad ≥3 | 1 |
| Fumador | 1 |
| Várices | 1 |
| Factores de riesgo obstétricos | |
| Preelampsia | 1 |
| Deshidratación/hiperemesis/ovarios hiperestimu lados | 1 |
| Embarazo múltiple oART | 1 |
| Cesárea en trabajo de parto | 2 |
| Cesárea electiva | 1 |
| Fórceps | 1 |
| Trabajo de parto prolongado (>24 horas) | 1 |
| Hemorragia postparto (>1 litro o transfusión) | 1 |
| Infección sistémica actual | 1 |
| Inmovilidad | 1 |
| Intervención quirúrgica en el embarazo o <6 semanas postparto | 1 |
| TOTAL |
Tromboprofilaxis con HBPM
• ≥3 antenatal y ambulatorio
• ≥2 antenatal y hospitalizada o postparto hasta 6 semanas
Riesgo de hemorragia
| Hemofilia o enfermedades semejantes (ej. Von Willebrand) |
| Hemorragia ante o postparto |
| Mujer considerada con alto riesgo de hemorragia mayor (ej. placenta previa) |
| Trombocitopenia (recuento de plaquetas <75×109) |
| Accidente vascular 4 semanas antes (hemorrágico o isquémico) |
| Enfermedad renal grave (filtración glomerular <30ml/min) |
| Enfermedad hepática grave |
| Hipertensión descompensada |
| (PA sistólica >200mmHg o PA diastólica >120mmHg) |
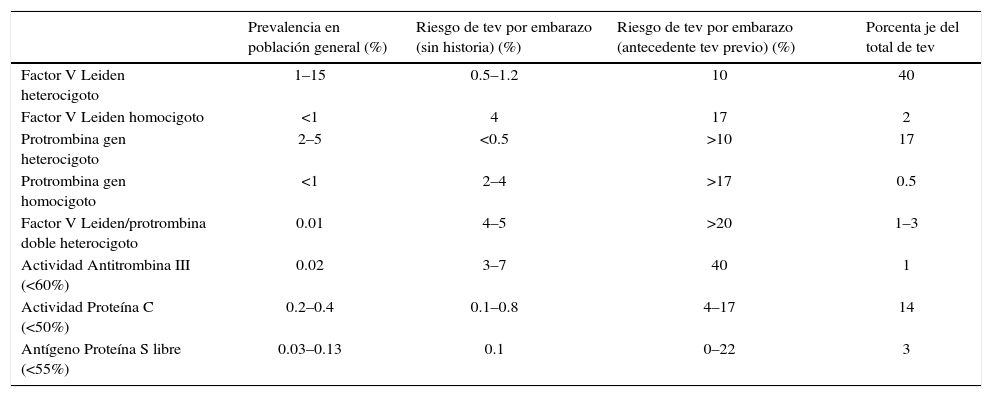
Otro factor de riesgo que debe ser considerado y que determinará la probabilidad de sufrir un TEV durante el embarazo, el parto o en el puerperio, es el tipo de trombofilia (tabla 3).
Riesgo de TEV con diferentes Trombofilias
| Prevalencia en población general (%) | Riesgo de tev por embarazo (sin historia) (%) | Riesgo de tev por embarazo (antecedente tev previo) (%) | Porcenta je del total de tev | |
|---|---|---|---|---|
| Factor V Leiden heterocigoto | 1–15 | 0.5–1.2 | 10 | 40 |
| Factor V Leiden homocigoto | <1 | 4 | 17 | 2 |
| Protrombina gen heterocigoto | 2–5 | <0.5 | >10 | 17 |
| Protrombina gen homocigoto | <1 | 2–4 | >17 | 0.5 |
| Factor V Leiden/protrombina doble heterocigoto | 0.01 | 4–5 | >20 | 1–3 |
| Actividad Antitrombina III (<60%) | 0.02 | 3–7 | 40 | 1 |
| Actividad Proteína C (<50%) | 0.2–0.4 | 0.1–0.8 | 4–17 | 14 |
| Antígeno Proteína S libre (<55%) | 0.03–0.13 | 0.1 | 0–22 | 3 |
TEV: Tromboembolismo Venoso.
Practice Bulletin. Inherited thrombophilias in Pregnancy ObstGinec. 122(3) September 2013 p.707.
Dentro de las trombofilias está el síndrome antifosfolípidos, donde existen criterios de laboratorio y clínicos para su diagnóstico, que se muestran en las tablas 4 y 5.
Criterios de laboratorio para diagnóstico síndrome antifosfolípidos
| 1. Lupus anticoagulante presente en plasma, en dos o más ocasiones al menos 12 semanas aparte. Se interpreta como presente o ausente. Idealmente realizar antes que el paciente esté anticoagualado, o |
| 2. Anticuerpos anticardiolipina de inmunoglobulina G (IgG) y/o inmunoglobulina M en suero o plasma, presentes en títulos medios o altos (mayor de 40 GPL or MPL, o mayor que percentil 99th) en dos o más ocasiones, al menos 12 semanas aparte, o |
| 3. Anti β2 -glycoproteina de inmunoglobulina G (IgG) y/o inmunoglobulina M en suero o plasma (títulos mayores del percentil 99th para población normal definida por el laboratorio que realiza la prueba), presente en dos o más ocasiones, al menos 12 semanas aparte. |
Criterios clínicos para el diagnóstico de síndrome antifosfolípidos
| 1. Trombosis vascular |
| Uno o más episodios clínicos de trombosis arterial, venosa, o de pequeños vasos, en cualquier tejido u órgano, o |
| 2. Morbilidad del embarazo |
| a) Una o más muertes inexplicables de un feto morfológicamente normal de 10 semanas o más de embarazo, con morfología fetal normal documentada por ultrasonido o por examen directo del feto, o |
| b) Uno o más partos prematuros de recién nacido morfológicamente normal antes de las 34 semanas de gestación por eclampsia o preeclampsia severa, o manifestaciones compatibles con insuficiencia placentaria, o |
| c) Tres o más pérdidas reproductivas espontáneas consecutivas antes de las 10 semanas de embarazo, excluidas anomalías maternas anatómicas u hormonales y causas cromosómicas paternas y maternas. |
- •
Tromboprofilaxis farmacológica es administrada a una población seleccionada considerada de alto riesgo para desarrollar eventos trombóticos. Los criterios de selección para inicio de profilaxis farmacológica durante el embarazo, se encuentran en los consensos del American College of Chest Physicians (ACCP) de 2012 y del Colegio Americano de Obstetras y Ginecólogos (ACOG) de 2013 (27,28).
- •
Pacientes con Trombosis Venosa Profunda durante el embarazo tienen un riego de recurrencia de alrededor del 5.6% (33).
- •
No se recomienda el uso rutinario de tromboprofilaxis farmacológica en pacientes en reposo prolongado, ya que varios análisis retrospectivos han mostrado que el riesgo de Trombosis Venosa Profunda en esos casos es menor al 1%, mientras que el riesgo de complicaciones potenciales es de al menos un 1% (29%).
- •
La profilaxis farmacológica puede ser considerada en pacientes con historia de un episodio de TVP idiopático, asociado con el embarazo o con el uso de estrógenos y en aquellos con un historial de múltiples TVP, independientemente de la causa. También es recomendada para las pacientes que tienen una trombofilia conocida y en aquellas con factores de riesgo persistentes y con antecedentes de TEV.
- •
La evidencia para apoyar la tromboprofilaxis farmacológica en las poblaciones indicadas es indirecta, en gran parte basadas en estudios epidemiológicos, pequeños estudios retrospectivos de tromboprofilaxis en poblaciones de alto riesgo y en la experiencia clínica (27,31).
- •
Aquellas mujeres en las que se identifica un factor de riesgo transitorio de TVP (por ejemplo traumatismo, inmovilidad o cirugía), la probabilidad de recurrencia se presume que es inferior. Por lo tanto, se prefiere la vigilancia clínica sobre la tromboprofilaxis farmacológica para los que no tienen factores de riesgo persistentes, a menos que hayan presentado múltiples cuadros deTVP.
- •
Las mujeres que ya reciben tratamiento anticoagulante antes de embarazarse, deben ser reevaluadas al inicio de la gestación. Si se determina que la anticoagulación terapéutica es necesaria, las mujeres que están recibiendo anticoagulantes orales deben suspenderlo e iniciar esquema anticoagulante basado en heparina.
- •
En pacientes usuarias de válvulas cardiacas artificiales existe controversia en relación al uso de anticoagulación basada en heparina, ya que no existen estudios randomizados y las opiniones de expertos varían entre sí. Existen reportes de trombosis a pesar del uso de HBPM, lo que ha planteado dudas respecto a la eficacia de ellas en este grupo de pacientes, haciendo preferir la mantención de los anticoagulanes orales tipo warfarina (30).
- •
La decisión de usar anticoagulación durante el período postparto es más fácil, debido a que el riesgo de TVP es mayor y los posibles efectos adversos más graves de la anticoagulación, incluyendo hemorragia placentaria, hematoma espinal y hemorragia fetal, ya no son una consideración. En el postparto, el riesgo de eventos trombóticos, especialmente la embolia pulmonar, es de dos a cinco veces más frecuente en esta etapa, persistiendo este riesgo mas allá de las seis semanas postparto (1,32).
- •
Las embarazadas consideradas de riesgo moderado y alto para TVP durante la hospitalización son aquellas ingresadas por razones médicas quirúrgicas (neumonía, sepsis, lesión ortopédica); las pacientes en reposo en cama prolongado (>3 días) y las que tienen otros factores de riesgo (obesidad, edad materna, enfermedad crítica, neoplasia, hiperestimulación ovárica, multiparidad, entre otras).
- •
El riesgo de sangrado en pacientes usuarias de profilaxis farmacológica aumenta en pacientes con riesgo de sangrado, sea por causas ajenas al embarazo como por parto inminente vía vaginal o cesárea, o causas relacionadas con la gestación (desprendimiento prematuro de placenta normoinserta, placenta previa, hematoma subcorial).
- •
El método óptimo de tromboprofilaxis en embarazadas hospitalizadas no se conoce. Las opciones incluyen la deambulación precoz, métodos mecánicos y/o agentes farmacológicos.
- •
Las medias de compresión graduada y los dispositivos de compresión intermitente han mostrado disminuir la incidencia de eventos tromboembólicos en población quirúrgica en al menos 50%.
- •
Evidencia a favor del uso de tromboprofilaxis en embarazadas hospitalizadas proviene del conocido aumento del riesgo de Tromboembolismo Venoso durante el embarazo, así como del riesgo establecido de TVP durante la hospitalización para pacientes no embarazadas. El riesgo deTVP en embarazadas hospitalizadas sin trabajo de parto fue evaluado en una cohorte de más de 200.000 mujeres de 15 a 44 años que tenían uno o más embarazos entre 1997 y 2010 (33). El riesgo de TVP fue 18 veces mayor durante la hospitalización (tasa absoluta de 1752 por 100,00 años-persona) y seis veces mayor durante los 28 días después del alta (676 por 100,00 personas-año) en comparación con pacientes no hospitalizadas. Las tasas más altas se observaron en las embarazadas con IMC>30kg/m2, edad materna >35 años, tercer trimestre y una estancia hospitalaria mayor de tres días. Este estudio sugiere que el riesgo de TEV en mujeres embarazadas hospitalizadas es similar al de pacientes hospitalizados de alto riesgo en la población general en los que la tromboprofilaxis se prescribe con frecuencia.
La cesárea (CS) se asocia con un mayor riesgo de TVP, especialmente cuando se realiza de forma no electiva. A pesar de un aumento en el riesgo relativo, se cree que el aumento absoluto en la incidencia deTVP es bajo. Los datos observacionales sugieren que el riesgo de eventos clínicamente importantes es similar al observado en pacientes quirúrgicos de bajo riesgo para los que no se recomienda tromboprofilaxis de rutina, sino sólo la deambulación precoz.
Profilaxis farmacológicaLa heparina se utiliza en la mayoría de las mujeres embarazadas, ya que no atraviesa la placenta y por lo tanto, no anticoagula al feto. Las Heparinas de Bajo Peso Molecular (HBPM) en general son las de primera elección. Se prefiere la Heparina No Fraccionada por sobre la HBPM en pacientes con insuficiencia renal grave (clearance de creatinina <30ml/min), ya que el metabolismo de la HBPM es exclusivamente renal, mientras que el metabolismo de la Heparina No Fraccionada es renal y hepático.
Las heparinas pueden administrarse durante el embarazo en diferentes dosis, dependiendo del riesgo de tromboembolismo y el grado deseado de anticoagulación. En general, se aplica lo siguiente:
Profilaxis con heparinas de bajo peso molecularLa heparina de BPM se utiliza en dosis fija (por ejemplo, dalteparina 5.000 unidades por vía subcutánea cada 24 horas; enoxaparina 40mg por vía subcutánea cada 24 horas) con ajuste para condiciones extremas de peso corporal.
Debido a las aprensiones de que la heparina de BPM en dosis profiláctica pudiese no prevenir adecuadamente los eventos tromboembólicos en mujeres con alto riesgo, a menudo se aumenta la dosis al progresar el embarazo, llegando a una dosis máxima de enoxaparina de 1mg/kg una vez al día (“dosis intermedia”). Este aumento de la dosis se basa en resultados de estudios farmacocinéticos que sugieren un mayor requerimiento en la mayoría de las mujeres después de las 20 semanas de gestación. La dosis intermedia proporciona una dosis superior a los regímenes profilácticos estándar de heparina de BPM, pero con sólo una inyección diaria, que es mejor tolerada que dos inyecciones al día. No es necesario supervisar las dosis de heparina de BPM en esquemas tanto profiláctico como intermedio.
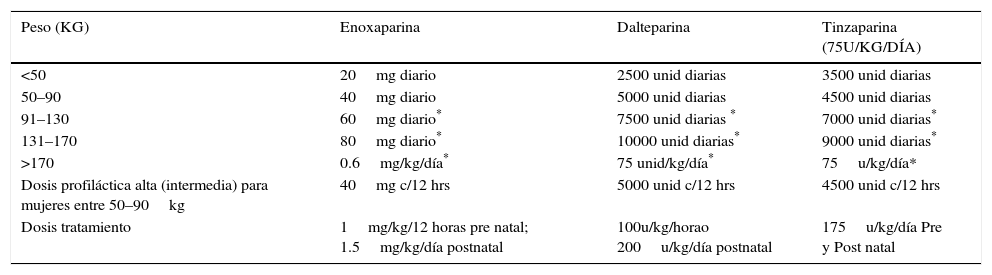
Profilaxis con Heparina No FraccionadaLa Heparina No Fraccionada es administrada por vía subcutánea cada 12 horas, con dosis crecientes a medida que el embarazo progresa, desde 5.000 hasta 7.500 unidades en el primer trimestre; 7.500 a 10.000 unidades en el segundo trimestre y 10.000 unidades en el tercer trimestre (reducir si el tiempo de Tromboplastina Parcial Activada [TTPA] es elevado) (33). Algunos médicos usan 5.000 unidades por vía subcutánea cada 12 horas durante todo el embarazo, pero los estudios han sugerido que esta dosis es probablemente insuficiente en algunas pacientes sobre la base de los niveles de heparina en el plasma. El monitoreo de la dosis profiláctica de Heparina No Fraccionada generalmente no es necesario. En la tabla 6 se muestran las dosis de tromboprofilaxis para HBPM prenatal.
Dosis de tromboprofilaxis para hbpm antenatal
| Peso (KG) | Enoxaparina | Dalteparina | Tinzaparina (75U/KG/DÍA) |
|---|---|---|---|
| <50 | 20mg diario | 2500 unid diarias | 3500 unid diarias |
| 50–90 | 40mg diario | 5000 unid diarias | 4500 unid diarias |
| 91–130 | 60mg diario* | 7500 unid diarias * | 7000 unid diarias* |
| 131–170 | 80mg diario* | 10000 unid diarias* | 9000 unid diarias* |
| >170 | 0.6mg/kg/día* | 75 unid/kg/día* | 75u/kg/día* |
| Dosis profiláctica alta (intermedia) para mujeres entre 50–90kg | 40mg c/12 hrs | 5000 unid c/12 hrs | 4500 unid c/12 hrs |
| Dosis tratamiento | 1mg/kg/12 horas pre natal; 1.5mg/kg/día postnatal | 100u/kg/horao 200u/kg/día postnatal | 175u/kg/día Pre y Post natal |
La eficacia de la tromboprofilaxis mecánica (medias elásticas de compresión y dispositivos de compresión neumática) durante el embarazo o puerperio es desconocida, por no existir estudios adecuados que evalúen la eficacia de estas medidas por sí solas.
Duración de la profilaxisLa tromboprofilaxis farmacológica debe ser recomendada durante todo el embarazo en pacientes seleccionadas mediante los criterios antes mencionados.
La duración óptima de la tromboprofilaxis en el período postparto es desconocida. Sobre la base de la experiencia clínica y el riesgo estimado, las guías de 2012 de la ACCP (Clinical Practice Guidelines) sugieren al menos su uso por las primeras seis semanas y una duración mayor en las pacientes en quienes los factores de riesgo de eventos tromboembólicos persisten en el tiempo (27).
Cuando se administra la tromboprofilaxis durante la hospitalización (por ejemplo, enfermedad aguda o cesárea), ésta debe continuar hasta que la paciente es dada de alta, siempre y cuando no exista indicación de tromboprofilaxis en la paciente ambulatoria.
Tratamiento anticoagulante durante embarazo y parto- •
Cuando hay una alta sospecha clínica deTEP, la terapia anticoagulante empírica está indicada antes de la evaluación diagnóstica basada en imágenes. La terapia anticoagulante se suspende si se excluye TEV.
- •
Cuando hay baja o moderada sospecha clínica de TEP, la terapia anticoagulante empírica antes de la evaluación por imágenes se determina caso a caso.
- •
Para aquellas pacientes en quienes se sospecha TEP, pero la terapia anticoagulante está contraindicada, la evaluación diagnóstica debe ser acelerada. Terapia de anticoagulación no farmacológica (por ejemplo, filtro de vena cava inferior) se indica si se confirma una TVP.
- •
Cuando hay sospecha de TVP (sin evidencia clínica o sospecha de TEP agudo), la terapia anticoagulante es indicada cuando la TVP es confirmada por medio de estudio imagenológico, siempre que este estudio pueda realizarse en el momento oportuno.
La elección del anticoagulante durante el embarazo debe tener en cuenta las condiciones maternas periparto (inicio imprevisto de trabajo de parto, uso de anestesia regional y seguridad del feto).
La heparina es utilizada en la mayoría de las mujeres embarazadas, ya que no atraviesa la placenta y no tiene entonces efectos fetales. Dentro de los distintos grupos de heparina, se recomiendan las de Bajo Peso Molecular (BPM) por sobre la Heparina No Fraccionada ya que son de fácil administración, eficacia demostrada, eficacia anticuagulante más predecible que las fraccionadas y no requiere control de laboratorio (34,35). La Heparina No Fraccionada es una alternativa razonable a la heparina de BPM cuando el costo o la necesidad de una rápida reversión del efecto anticoagulante (parto inminente o perioperatorio) es importante.
Las pacientes con insuficiencia renal tienen riesgos adicionales asociados con el reducido metabolismo renal de los anticoagulantes. Se prefiere Heparina No Fraccionada sobre heparina de BPM en pacientes con insuficiencia renal (clearance de creatinina <30ml/min) debido a que el metabolismo de Heparina de Bajo Peso Molecular es exclusivamente renal, mientras que el metabolismo de la Heparina No Fraccionada es renal y hepática.
No existe mucha información acerca de los efectos fetales de danaparoide, fondaparinux y argatroban, pero la evidencia disponible sugiere que son opciones razonables para las mujeres embarazadas que requieren anticoagulación y no pueden usar heparinas.
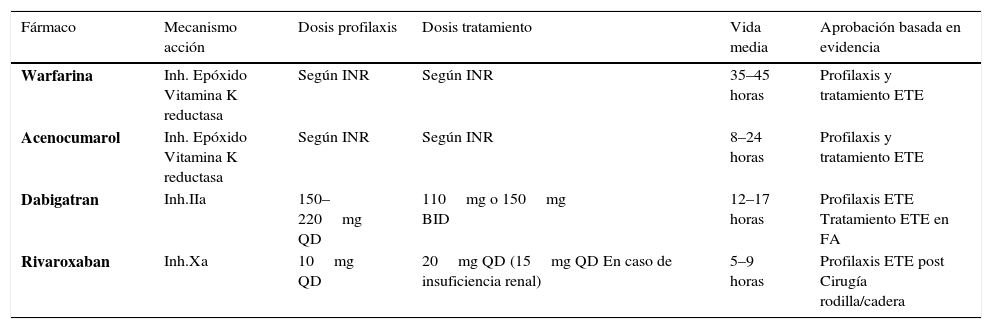
En la tabla 7 se muestra el uso de la heparina durante el embarazo, el tipo y las dosis correspondientes, estratificadas según el objetivo de la terapia anticoagulante. En la tabla 8 una comparación de los nuevos anticoagulantes.
Uso de heparinas durante el embarazo
| Tipo de anticoagulación | Dosis |
|---|---|
| Profiláctica HBPM* | Enoxaparina, 40mg SC diaria Dalteparina, 5000 unidades SC diaria Tinzaparina, 4500 unidades SC diaria |
| Terapéutica HBPM† | Enoxaparina, 1mg/kg c/12 horas Dalteparina, 200 unidades/kg diaria Tinzaparina, 175 unidades/kg diaria Dalteparina, 100 unidades/kg cada 12 horas |
| Mini dosis profiláctica UFH | UFH, 5000 unidades SC cada 12 horas |
| UFH Profiláctica | UFH, 5000–10000 unidades SC cada 12 horas UFH, 5000–7500 unidades SC cada 12 horas en el primer trimestre UFH, 7500–10000 unidades SC cada 12 horas en el segundo trimestre UFH, 10000 unidades SC cada 12 horas en el tercer trimestre, a menos queTTPa esté elevado |
| UFHt Terapéutica | UFH, 10000 unidades o más SC cada 12 horas in dosis ajustadas para lograr TTPa en rango terapéutico (1.5–2.5) 6 horas después de la inyección |
| Anticoagulación postparto | Profilaxis con HBPM/UFH por 4–6 semanas o antagonistas de vitamina K por 4–6 semanas para lograr INR de 2.3–3.0, con terapia inicial con UFH o HBPM superpuestas hasta tener INR de 2.0 o más por 2 días |
| Vigilancia | Vigilancia clínica e investigación objetiva de mujeres con síntomas sospechosos de TVP oTEP |
TTPa: Tiempo Tromboplastina Parcial Activado; INR: International Normalized Ratio; HBPM: Heparina Bajo Peso Molecular; SC: Subcutáneo; UFH: Unfractionated Heparin.
Tabla comparativa de nuevos anticoagulantes
| Fármaco | Mecanismo acción | Dosis profilaxis | Dosis tratamiento | Vida media | Aprobación basada en evidencia |
|---|---|---|---|---|---|
| Warfarina | Inh. Epóxido Vitamina K reductasa | Según INR | Según INR | 35–45 horas | Profilaxis y tratamiento ETE |
| Acenocumarol | Inh. Epóxido Vitamina K reductasa | Según INR | Según INR | 8–24 horas | Profilaxis y tratamiento ETE |
| Dabigatran | Inh.IIa | 150–220mg QD | 110mg o 150mg BID | 12–17 horas | Profilaxis ETE Tratamiento ETE en FA |
| Rivaroxaban | Inh.Xa | 10mg QD | 20mg QD (15mg QD En caso de insuficiencia renal) | 5–9 horas | Profilaxis ETE post Cirugía rodilla/cadera |
La warfarina debe ser evitada en la mujer embarazada, excepto en las que se consideran de muy alto riesgo (por ejemplo, usuaria de una válvula cardíaca mecánica). Warfarina y otros antagonistas de la vitamina K cruzan libremente la placenta y son teratogénicos, especialmente cuando es administrada entre las 6 y 12 semanas de gestación. Estos agentes también pueden causar sangrado del feto en cualquier etapa del embarazo.
La warfarina también se ha asociado a un aumento de la tasa de abortos espontáneos en el primer trimestre, aunque la incidencia es desconocida y no está claro si el aumento de la tasa de abortos espontáneos es debido al uso de warfarina o a las condiciones subyacentes por las cuales se administró ese anticoagulante. La warfarina se ha utilizado durante el segundo trimestre del embarazo, cuando la organogénesis se ha completado pero el riesgo de hemorragia fetal es un problema comparado con otros agentes.
Los inhibidores orales de la trombina (dabigatran) y del factor Xa (rivaroxaban, apixaban y edoxaban) no se han utilizado en el embarazo porque no existe información respecto a su eficacia y seguridad en ese contexto.
Heparina de Bajo Peso Molecular (BPM)Se prefiere el uso de la HBPM subcutánea sobre las otras heparinas en la mayoría de pacientes ya que es de fácil administración, parece ser más eficaz y posee un mejor perfil de seguridad. Estas afirmaciones se han extrapolado de ensayos clínicos en pacientes no embarazadas. En un metaanálisis de 22 ensayos aleatorios (8.867 pacientes), la HBPM redujo la mortalidad (OR 0,76, IC del 95%: 0,62 a 0,92) y trombosis recurrente (OR 0,68, IC del 95%: 0,55 a 0,84) (36). Además disminuyó la probabilidad de causar hemorragia grave (OR 0,5, IC del 95%: 0,39 a 0,83).
Una revisión sistemática (64 estudios, 2.777 embarazos) sobre el uso de la heparina de BPM para la prevención o el tratamiento de la TVP en el embarazo, concluyó que la heparina de BPM fue la más segura y efectiva (37). Las tasas de trombosis venosa y arterial fueron de 0,8 y 0,5% respectivamente; las tasas de sangrado significativo de sólo un 2%; reacciones cutáneas de un 1,8%; y las fracturas osteoporóticas de sólo un 0,04%. No hubo muertes maternas y ningún caso de trombocitopenia inducida por heparina.
Heparina No Fraccionada (HNF)La Heparina No Fraccionada es una alternativa aceptable y menos costosa que la heparina de BPM. Puede ser más apropiada que la heparina de BPM durante las etapas del embarazo en donde se requiere un rápido control de la anticoagulación como por ejemplo, cercano al momento del parto o si la paciente requiere cirugía.
La Heparina No Fraccionada no atraviesa la placenta y la evidencia disponible no ha indicado ningún efecto perjudicial sobre el feto (38).
DosisLas dosis recomendadas según el tipo de heparina que se utilice y según el objetivo planteado (profilaxis o terapéutico), son indicadas en las tablas 9 y 10.
Esquema de tratamiento con heparina no fraccionada
| Dosis inicial | 80U/KG en bolo, seguir infusión a 18U/KG/HORA |
|---|---|
| PTT <35 seg (<1.2 control) | 80U/kg en bolo, aumentar infusión a 4U/kg/hora |
| PTT 35–45 seg (1.2–1.5 control) | 80U/kg en bolo, aumentar infusión a 2U/kg/hora |
| PTT 46–70 seg (1.5–2.3 control) | Dosis igual |
| PTT 71–90 seg (2.3–3.0 control) | Disminuir infusión en 2U/kg/hora |
| PTT >90 seg (>3.0 control) | Suspender 1 hora, reiniciar disminuyendo 3U/kg/hora |
Los filtros de Vena Cava Inferior (VCI) han sido utilizados durante el embarazo. Las indicaciones para la inserción de un filtro de VCI son los mismos en las pacientes embarazadas y no embarazadas:
- •
Contraindicación de anticoagulación convencional, como por ejemplo durante un sangrado activo, después de una cirugía reciente, o después de un accidente cerebrovascular hemorrágico.
- •
Anticoagulación convencional ineficaz, como en pacientes que desarrollen nuevos episodios deTVP a pesar de estar anticoagulados.
- •
Complicación de la anticoagulación (por ejemplo, sangrado significativo), que prohíbe la continuación de la terapia anticoagulante.
- •
Lecho vascular pulmonar comprometido significativamente (embolia pulmonar masiva, hipertensión pulmonar tromboembólica crónica) y con escasas probabilidades de tolerar otro evento trombótico.
- •
Alergia a heparina
El sulfato de protamina se puede utilizar para revertir rápidamente los efectos de la Heparina No Fraccionada en pacientes con hemorragia grave relacionadas al embarazo; pacientes con riesgo de hemorragia grave secundario a unpartovaginalocesáreade urgencia, o pacientes con riesgo de hemorragia grave debido a complicaciones ante-parto (desprendimiento de placenta, placenta previa sintomática, hematoma subcorial expansivo). Pequeñas dosis repetidas de protamina pueden ser necesarias debido a la absorción continua de heparina a partir del tejido subcutáneo.
La HBPM no puede ser completamente revertida por protamina pero la protamina puede reducir la cuantía de la hemorragia y se debe utilizar si la hemorragia es grave.
Trombocitopenia Inducida por HeparinaLa Trombocitopenia Inducida por Heparina (TIE) es una reacción adversa a la heparina en el que un anticuerpo plaquetario es inducido por el fármaco. Puede ocurrir en cualquier paciente que reciba heparina sin importar la dosis; sin embargo, la incidencia en las mujeres embarazadas es muy baja. Esto fue mostrado en un metaanálisis de 2777 embarazos en los que se administró heparina de BPM; no hubo casos de TIE (35).
Pérdida óseaEl uso prolongado de Heparina No Fraccionada (más de dos semanas) se asocia con una disminución en la Densidad Mineral Ósea (DMO). Las mujeres que utilizan Heparina No Fraccionada durante más de un par de semanas deben tener una ingesta adecuada de calcio y vitamina D.
No está claro si la pérdida de la densidad ósea pueda reducirse o evitarse mediante el uso de heparina de BPM en lugar de Heparina No Fraccionada.
Trabajo de parto y partoLa mayoría de los obstetras prefiere que la HBPM sea sustituida por la Heparina No Fraccionada a las 36–37 semanas de gestación, o antes en caso de riesgo de parto prematuro. Al cambiar a Heparina No Fraccionada aumenta la probabilidad de que al momento del parto pueda recibir anestesia regional además de disminuir el riesgo de hemorragia severa asociada al parto. La Heparina No Fraccionada subcutánea es suspendida al momento de iniciar el trabajo de parto espontáneo, o 24 horas antes de la inducción planificada del trabajo de parto o cesárea (36,37). No se debe administrar agentes para revertir los efectos anticoagulantes (protamina en pacientes con Heparina No Fraccionada) a menos que exista un sangrado excesivo o inesperado debido al anticoagulante.
Las mujeres que están anticoaguladas con heparina hasta el inicio del trabajo de parto en general no tienen una mayor pérdida de sangre que las mujeres no anticoaguladas. Sin embargo, el parto por cesárea en pacientes con heparina puede estar acompañado de pérdidas de sangre aumentadas en relación a las mujeres sin anticoagulante (38).
Si ocurre trabajo de parto en una paciente que está recibiendo warfarina, debe considerarse la práctica de una operación cesárea y la administración de vitamina K y de plasma fresco congelado al recién nacido.
Anestesia regionalUn catéter espinal no se puede insertar si una paciente está anticoagulada, debido al riesgo de hematoma. La administración de anestesia espinal o epidural es generalmente después de que haya transcurrido el tiempo suficiente para que el efecto anticoagulante sea revertido:
- •
Heparina de BPM en dosis profiláctica: Después de por lo menos 12 horas de la última dosis.
- •
Heparina BPM en dosis intermedias o terapéuticas: Después de por lo menos 24 horas desde la última dosis.
- •
Heparina No Fraccionada en dosis profiláctica y terapéutica: Una vez que el tiempo de Tromboplastina Parcial Activada (TTPa) se ha normalizado luego de la última dosis (ese tiempo depende de la dosis ocupada, que habitualmente es dentro de 6 horas para dosis profilácticas y 12 horas para dosis terapéuticas).
La anticoagulación puede reanudarse cuatro horas después del retiro del catéter.
Período postparto y puerperioLa profilaxis con Heparina No Fraccionada o heparina de BPM debe ser reiniciada 6 a 12 horas después del parto vaginal y 12 a 24 horas después de un parto por cesárea. Si se elige la anticoagulación oral para continuar la profilaxis de trombosis en el puerperio, la warfarina puede iniciarse inmediatamente después del parto.
Duración de la terapiaLa duración óptima de la anticoagulación es desconocida y debe ser individualizada caso a caso. Sin embargo, si uno extrapola datos de la población general, así como la experiencia clínica, la duración total de la terapia anticoagulante (período prenatal más el período de postparto) debe ser por lo menos de tres a seis meses para las mujeres que hayan tenido factores de riesgo transitorios de trombosis (por ejemplo, el embarazo o cesárea). La terapia anticoagulante generalmente se prolonga durante al menos seis semanas después del parto (17).
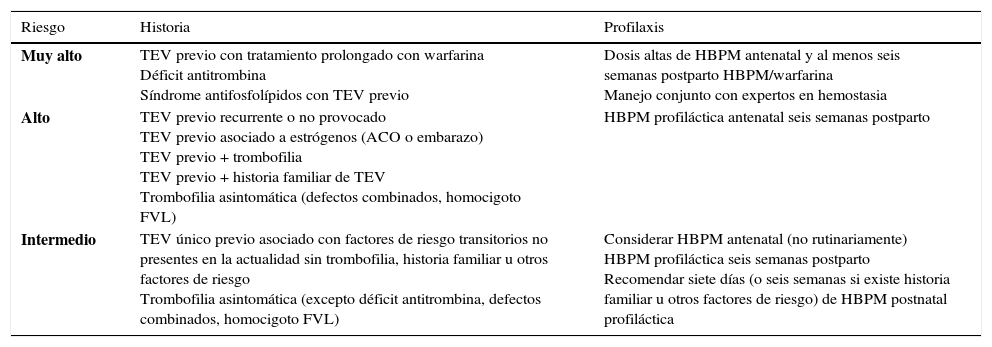
Para finalizar se presenta en la tabla 11 las guías para tromboprofilaxis en mujeres con TEV previo y/o trombofilia.
Guías para tromboprofilaxis en mujeres con tev previo y/o trombofilia
| Riesgo | Historia | Profilaxis |
|---|---|---|
| Muy alto | TEV previo con tratamiento prolongado con warfarina Déficit antitrombina Síndrome antifosfolípidos con TEV previo | Dosis altas de HBPM antenatal y al menos seis semanas postparto HBPM/warfarina Manejo conjunto con expertos en hemostasia |
| Alto | TEV previo recurrente o no provocado TEV previo asociado a estrógenos (ACO o embarazo) TEV previo + trombofilia TEV previo + historia familiar de TEV Trombofilia asintomática (defectos combinados, homocigoto FVL) | HBPM profiláctica antenatal seis semanas postparto |
| Intermedio | TEV único previo asociado con factores de riesgo transitorios no presentes en la actualidad sin trombofilia, historia familiar u otros factores de riesgo Trombofilia asintomática (excepto déficit antitrombina, defectos combinados, homocigoto FVL) | Considerar HBPM antenatal (no rutinariamente) HBPM profiláctica seis semanas postparto Recomendar siete días (o seis semanas si existe historia familiar u otros factores de riesgo) de HBPM postnatal profiláctica |
FVL: Factor V Leiden; HBPM: Heparina Bajo Peso Molecular.
La enfermedad tromboembólica es relativamente frecuente en la población obstétrica, con una significativa morbimortalidad tanto materna como perinatal, por lo que el objetivo fundamental está en identificar a las pacientes de riesgo e indicar tromboprofilaxis durante el embarazo y puerperio, siendo este último el momento de mayor riesgo de ocurrencia. A pesar del mayor riesgo de trombosis en el embarazo, los anticoagulantes no se indican rutinariamente, ya que generalmente los riesgos superan sus ventajas. La excepción a esto, son las mujeres que tienen indicación de anticoagulación de por vida y/o mujeres con historia de trombosis o de trombofilia. En estas últimas, la literatura sugiere que los anticoagulantes, además de disminuir el riesgo de trombosis, podrían reducir el riesgo de un mal resultado obstétrico.
De ocurrir el evento tromboembólico, tanto la sospecha como el diagnóstico precoz basado en elementos clínicos, de laboratorio e imagenológico, es de suma relevancia ya que esto unido a la anticoagulación terapéutica son los pilares esenciales para disminuir la morbimortalidad materna.
Ensayos controlados randomizados analizados por Cochrane que comparan diferentes combinaciones de warfarina, Heparina No Fraccionada, Heparina de Bajo Peso Molecular y placebo en embarazadas, no han evidenciado la superioridad de un esquema en particular para el tratamiento de la Trombosis Venosa Profunda durante el embarazo, por lo que se necesitan estudios adicionales.
En resumen, el Tromboembolismo Venoso es una de las posibles emergencias obstétricas con las que puede tener que enfrentarse un ginecólogo-obstetra y por lo tanto, resulta esencial el conocimiento de la fisiología, fisiopatología de la hemostasia y de la trombosis en el embarazo. Ello permitirá detectar a las pacientes de mayor riesgo y realizar un diagnóstico temprano, así como un apropiado tratamiento, esencial para reducir la morbilidad y mortalidad tanto materna como perinatal.
Las tablas y figuras fueron extraídas y modificadas a partir de las que aparecen en las siguientes referencias:
- 1)
Berkovits, Alejandro et al Nuevos anticoagulantes orales. Rev Med Chie, oct 2011, vol 139, n10, p 1347–1355
- 2)
SOGC Clinical Practice Guideline N 308. June 2014, J Obstet Gynaecol Can 2014; 36 (6): 527–553
- 3)
Thrombosis and embolism during pregnancy and the puerperium, reducing the risk and treatment. Green top Guideline N 37a (18 nov 2009)y N 37b (1 febr 2007)
- 4)
Up to Date, 2014. Chapters thrombosis and pregnancy
- 5)
ACOG Practice Bulletin N 138. Thromboembolism in pregnancy. Obstet Gynecol 2013; 122:706
Los autores declaran no tener conflictos de interés, en relación a este artículo.