Los pacientes inmunosuprimidos presentan un riesgo mayor de infecciones, debido a sus disfunciones inmunes, producto de la actividad de su enfermedad y la terapia inmunosupresora. El uso de vacunas disminuye este riesgo, otorgando protección directa e indirecta, a través de la vacunación del paciente y sus contactos. Las vacunas inactivadas han demostrado un perfil de seguridad adecuado en estos pacientes, por lo que no están contraindicadas, aunque su respuesta inmune puede ser inadecuada. Las vacunas vivas atenuadas, formalmente contraindicadas, poseen una información creciente que permite evaluar su riesgo/beneficio de manera individual. Por este motivo es necesario procurar mantener el calendario de vacunas actualizado y complementado, evitando el retraso en esquemas de vacunación y poniéndolo al día lo antes posible, con estrategias basadas en el individuo. Para llevar a cabo esto, se debe conocer y considerar los intervalos entre las vacunas, los esquemas acelerados, la solicitud de vacunas especiales, las aprobaciones vigentes y, finalmente, sus contraindicaciones.
Immunecompromised patients are at higher risk of infections due to their immune dysfunction caused by ongoing disease processes and immunosuppressive therapy.
Patient vaccination or vaccination of the people in contact with patients diminishes their risk of infection. Although the immune response of immunocompromised patients might be impaired, the use of inactivated vaccines is safe and it is not contraindicated in these patients. Formerly, live attenuated vaccines were contraindicated in immunecompromised patients, but recently more data supports their use when evaluating case by case the risks and benefits of their application. Thus, it is important to keep and up-to-date, taylor-based and enhanced vaccination schedule in these cases. For this, specialists need to be informed about the availability of regular and special vaccines, their current approvals, vaccine administration protocols under specific situations and vaccine contraindications.
Los pacientes con alteración del sistema inmunológico poseen una mayor susceptibilidad a adquirir infecciones1-4, por lo que diversas guías recomiendan esquemas de vacunas complementarios en estos grupos y en sus contactos cercanos. Se debe poner énfasis en la importancia de tener al día el esquema establecido en el programa nacional de inmunizaciones (PNI) respectivo y sus recomendaciones para situaciones especiales, además de los beneficios incluidos en las canastas de garantías explícitas de salud (GES) y a través de la Ley Ricarte Soto5-13. Las recomendaciones generales deben concretarse con una evaluación personalizada a cada caso, considerando el historial del paciente y sus riesgos potenciales14-18. Para ello, es muy importante el evitar retrasos en la vacunación, poniéndolas al día antes de iniciar la inmunosupresión, y no suspenderlas por riesgo a rechazo de órganos o exacerbación de la enfermedad de base. Dentro de las problemáticas de las recomendaciones de vacunas para estos grupos de riesgo se encuentran el que se carecen de estudios con tamaños muestrales adecuados, con evidencia de eficacia y seguridad, en los distintos grupos de inmunosuprimidos, sobretodo en los estudios conducentes a las licencias de las vacunas, por lo que habitualmente no aparecen dentro de sus indicaciones. Por otro lado, en varios equipos existe la percepción de que la inmunosupresión hace infructuosa la respuesta inmune a la vacuna, subestimándose sus beneficios. Sin embargo, la evidencia actual ha demostrado que es preferible la protección parcial versus la ausencia de protección10,11,17,18. Todas estas limitaciones se deben considerar al interpretar las recomendaciones, por lo que se debe ser muy cauto y flexible a la vez, para establecer estrategias de vacunación en pacientes inmunocomprometidos. El objetivo de este manuscrito es entregar información y la orientación respecto de las recomendaciones actuales para estos grupos de riesgo acorde a su nivel de inmunosupresión.
NIVEL DE INMUNOSUPRESIÓNEs muy relevante conocer el nivel de inmunosupresión de los pacientes, el cual ha sido establecido como alto o bajo, acorde a condiciones específicas. Por ejemplo, un alto nivel de inmunosupresión es considerado en aquellos pacientes con inmunodeficiencia primaria combinada, quimioterapia contra cáncer, hasta dos meses post trasplante de órgano sólido, infección por virus de inmunodeficiencia humana (VIH) con CD4 <200 cel/mm3 o <15% en niños, terapia corticoidal diaria equivalente a ≥20mg de prednisona por >14 días, y terapia biológica inmunomoduladora (anti-TNF-α, anti-CD20). Bajo nivel de inmunosupresión se considera a pacientes VIH asintomáticos con CD4 200-499 cel/mm3 adultos o 15-24% en niños, uso de dosis de corticoides baja por >14 días o terapia en días alternados, terapia con metrotrexato <0,4mg/kg/semana, azatriopina <3mg/k/día o 6-mercaptopurina <1,5mg/k/día8.
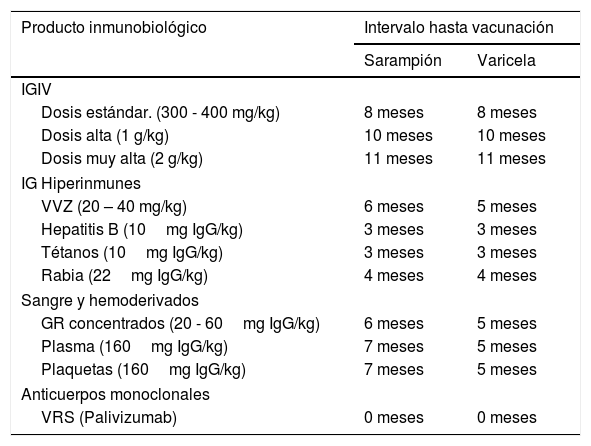
¿CUÁNDO VACUNAR Y CUÁL ESQUEMA USAR EN INMUNOSUPRIMIDOS?Idealmente las vacunas se debieran administrar antes del inicio de la terapia inmunosupresora, al menos 4 semanas antes para las vacunas vivas atenuadas, y dos semanas antes para las vacunas inactivadas (tabla 1). Sin embargo, para ajustarse a estos plazos se deben considerar diversos factores, como la enfermedad de base, el tipo de inmunosupresión y su duración, tipo de vacunas a utilizar y sus intervalos recomendados, entre otros, por lo que el esquema deberá diseñarse “a la medida del paciente”8-13. Las interrupciones del programa de vacunación no requieren reiniciar la pauta completa, sino que solo completar las dosis faltantes, acorde a lo establecido inicialmente. La administración de vacunas a intervalos de tiempo menores del mínimo recomendado pueden afectar la inmunogenicidad, sin embargo, existen esquemas acelerados e intervalos mínimos aceptados que pueden ser utilizados en pacientes en los que se requiera mayor premura, como lo es antes de iniciar una terapia inmunosupresora19. Las vacunas vivas atenuadas, en general, no se deben administrar simultáneamente con inmunoglobulinas (IG) ya que pueden ver su inmunogenicidad disminuida cuando se administran dentro de dos semanas antes o hasta 11 meses después de recibir algún preparado de IG, ya sea estándar o hiperinmune, por vía intramuscular, intravenosa o subcutánea (tabla 2)20.
Recomendaciones de vacunas para pacientes con terapia inmunosupresora planificada o iniciada §
| Vacunas | Pacientes con IS planificada | Pacientes con bajo nivel de IS | Pacientes con alto nivel de IS | Comentarios |
|---|---|---|---|---|
| BCG | NR | NR | NR | Sin indicación en inmunocomprometidos. |
| Polio inactivada | Si | Si | Si | En pacientes pediátricos, o sin vacunación previa.Formulación oral viva atenuada no puede ser utilizada en inmunocomprometidos, no disponible actualmente. |
| Pertussis, toxoide diftérico y tetánico | Si | Si | Si | Formulación combinada hexavalente puede usarse hasta los 6 años 11 meses (DTPa).Formulación dTpa aprobada para uso en adultos y niños desde los 4 años. |
| H influenza tipo b | Si | Si | Si | Debe considerarse su uso en pacientes asplénicos anatómicos o funcionales. |
| Virus hepatitis B | Si | Si | Si | Administrar en pacientes seronegativos. Se sugiere medir título de anticuerpos anti-HBs 1 a 2 meses post vacunación, si es que esta se completa durante inmunosupresión. Considerar en adultos el uso de vacuna de dosis reforzada (40μg). |
| Neumococo | Si | Si | Si | Se recomienda esquema secuencial con vacuna conjugada 13 valente y 8 semanas después vacuna polisacárida 23 valente.Considere medir inmunogenicidad en pacientes pediátricos si vacunación se concreta durante inmunosupresión.Considerar refuerzo a los 5 años con vacuna polisacárida por 1 vez en casos de asplenia funcional o anatómica, o en pacientes inmunosuprimidos. |
| Meningococo | Si | Si | Si | Considerar uso de vacuna conjugada tetravalente ACWY y recombinante contra serogrupo B.Considerar refuerzos en casos de asplenia funcional o anatómica cada 3-5 años. |
| Sarampión, Rubéóla, Parotiditis | Si | NR& | NR | Vacuna viva atenuada; considerar en casos de falta de antecedentes de vacunación, vacunación incompleta o contexto de brote epidemiológico, en sujetos sin alta inmunosupresión. |
| Hepatitis A | Si | Si | Si | Puede usarse desde los 12 meses de vida.Pacientes seronegativos, en esquema de 2 dosis, separadas por 6 meses. |
| Virus Papiloma Humano | Si | Si | Si | Formulaciones tetra y nonavalente disponibles desde los 9 años.Utilizar esquemas de 3 dosis 0, 2 y 6 meses. |
| Influenza | Si | Si | Si | Utilizar vacunas inactivadas. Según disponibilidad considerar uso de formulaciones tetravalentes, adyuvantadas y/o reforzadas. |
| Varicela | Si | NR& | NR | Utilizar en individuos seronegativos, sin compromiso inmunológico severo, 2 dosis, separadas por 3 meses en <13 años, por 1 mes en >13 años. |
| Herpes Zoster | Si | NR (atenuada)Si (inactiva) | NR (atenuada)Si (inactiva) | Existen 2 vacunas licenciadas; ambas aprobadas desde los 50 años:Vacuna viva atenuada, debe considerarse el nivel de inmunosupresión antes de vacunar.Vacuna inactiva, es segura en inmunosuprimidos, por lo que no tiene contraindicación. Aún no disponible en Chile. |
| Rabia | Si | Si | Si | Sin contraindicaciones para su uso. Indicada en caso de viajeros. |
| Rotavirus | Si | NR& | NR | Las 2 formulaciones orales se pueden utilizar desde las 6 semanas de vida, completando el esquema a los 6 meses (monovalente) u 8 meses (pentavalente). No usar en pacientes con alta inmusupresión. |
| Fiebre amarilla | Si | NR& | NR | Vacuna viva atenuada, debe ser considerada si exposición es inminente, e impostergable. Considerar dosis de refuerzo después de 10 años en caso de viaje a área con brote. |
BCG: bacilo Calmette-Guerin; NR: no recomendada; NR&: formalmente contraindicada, pero acorde a la evidencia actual y contexto epidemiológico podría evaluarse el riesgo beneficio en cada caso
Alto nivel de inmunosupresión se considera en aquellos pacientes con inmunodeficiencia primaria combinada, quimioterapia contra cáncer, hasta 2 meses post trasplante de órgano sólido, infeccion por virus de inmunodeficiencia humana (VIH) con CD4 <200 cel/mm3 en adultos o < 15% en niños, terapia corticoidal diaria equivalente a 20mg de prednisona por >14 días (o 2mg/kg/día en pacientes con peso menor a 10kg), y terapia biológica inmunomoduladora. Bajo nivel de inmunosupresión se considera a pacientes VIH asintomáticos con CD4 200-499 cel/mm3 adultos o 15-24% en niños, uso de dosis de corticoides baja por >14 días o terapia en días alternados, terapia con metrotrexato <0,4mg/kg/semana, azatriopina < 3mg/kg/día o 6-mercaptopurina 1,5mg/kg/día.
§Adaptado desde; Rubin LG, et al. Clin Infect Dis. 2014;58; Mellado Peña MJ, et al An Pediatr. 2012;77(3): 220–1; Villena R Rev chil reumatol 2018; 34(2): 53-65; y Lopez A, et al. Journal of Autoimmunity 2017;80.
Intervalos de tiempo recomendados entre la administración de productos con inmunoglobulinas y la posterior administración de vacunas vivas atenuadas contra sarampión y varicela§
| Producto inmunobiológico | Intervalo hasta vacunación | |
|---|---|---|
| Sarampión | Varicela | |
| IGIV | ||
| Dosis estándar. (300 - 400 mg/kg) | 8 meses | 8 meses |
| Dosis alta (1 g/kg) | 10 meses | 10 meses |
| Dosis muy alta (2 g/kg) | 11 meses | 11 meses |
| IG Hiperinmunes | ||
| VVZ (20 – 40 mg/kg) | 6 meses | 5 meses |
| Hepatitis B (10mg IgG/kg) | 3 meses | 3 meses |
| Tétanos (10mg IgG/kg) | 3 meses | 3 meses |
| Rabia (22mg IgG/kg) | 4 meses | 4 meses |
| Sangre y hemoderivados | ||
| GR concentrados (20 - 60mg IgG/kg) | 6 meses | 5 meses |
| Plasma (160mg IgG/kg) | 7 meses | 5 meses |
| Plaquetas (160mg IgG/kg) | 7 meses | 5 meses |
| Anticuerpos monoclonales | ||
| VRS (Palivizumab) | 0 meses | 0 meses |
IGIV: inmunoglobulina intravenosa polivalente; IG: inmunoglobulina; VVZ: virus varicella zoster; GR: glóbulos rojos; VRS: virus respiratorio sincicial.
§ Adaptado desde Vanadia P. Intervalo de administracion entre vacunas y otros productos inmunobiológicos. Manual de vacunas de América Latina ed. 2014 p. 47–53. Sociedad Latinoamericana de Infectología Pediátrica; Villena R Rev chil reumatol 2018; 34(2): 53-65
Existen pocas contraindicaciones para vacunar a un paciente inmunocomprometido, siendo estas muy específicas y de baja frecuencia, por lo que el no vacunar debiera ser la excepción a la regla. Las vacunas inactivadas son seguras y no están contraindicadas, independiente del nivel de inmunosupresión, sin embargo su inmunogenicidad pudiese verse afectada, lo que amerita evaluarlas caso a caso, para eventuales controles de respuesta inmune específica o dosis de refuerzo21-23. Por su parte, las vacunas vivas atenuadas están formalmente contraindicadas, sin embargo, dependerá del nivel de inmunosupresión y escenario epidemiológico, no existiendo mayor evidencia de que sean responsables de gatillar exacerbaciones de la enfermedad de base u otras complicaciones posteriores a su uso, por lo que se recomienda evaluar su riesgo/beneficio caso a caso7,10,24,25 (tabla 1). La única contraindicación absoluta aplicable a todas las vacunas es la historia de anafilaxia a algún componente de ella. Otras contraindicaciones, como enfermedad aguda febril severa, o transfusión reciente de sangre o plasma, y uso de inmunoglobulinas podrían soslayarse difiriendo la vacunación para disminuir el impacto en la inmunogenicidad (tabla 2).
GESTIÓN DE VACUNAS ATRASADAS, POR GES, LEY RICARTE SOTO O ESPECIALESLas vacunas que cumplan estas condiciones son gratuitas para los pacientes, independiente de su previsión de salud, pública o privada6. Si un paciente requiere actualizar su calendario PNI, se requiere conocer su edad, cuáles vacunas tiene, cuáles le faltan, en qué condición de salud está para vacunarse, cuánto tiempo se tiene para vacunarlo antes del inicio o no de la inmunosupresión, cuáles son las aprobaciones vigentes al momento de la actualización del calendario y, finalmente, si existen contraindicaciones para poder vacunarlo. Estas vacunas no requieren aprobación a nivel central por parte del PNI y pueden ser administradas en los vacunatorios del Ministerio de Salud o en aquellos asociados a él. Es recomendable que el especialista se contacte con el equipo vacunador y sugiera el esquema acorde a las necesidades del paciente y su tratamiento. Lo mismo aplica para las vacunas incorporadas en las canastas GES o por Ley Ricarte Soto, según patologías6. En caso de que se requieran vacunas acorde a recomendaciones específicas para la situación de un paciente, estas pueden ser gestionadas mediante indicación con receta médica, relleno de formulario ad hoc y tramitadas a nivel central con los delegados del PNI5,14,26.
VACUNAS EN SITUACIONES ESPECÍFICASa) Vacunas en pacientes con cáncerEn pacientes con cáncer tanto la enfermedad como el tratamiento afectan la respuesta inmune frente a infecciones y también efectividad de las vacunas administradas durante este periodo. Como concepto general, la respuesta a vacunas está severamente afectada en quimioterapias de inducción o consolidación de leucemia, o terapias que incluyan un anti-CD20, por esto los pacientes no se benefician de la vacunación y no se consideran dosis válidas administradas, excepto se hayan demostrado niveles protectores de anticuerpos8. Por otro lado, las vacunas vivas atenuadas (sarampión, rubéola, parotiditis; varicela, rotavirus, fiebre amarilla) están contraindicadas durante el tratamiento con quimioterapia, por el riesgo de reactivación de la infección al que se expone el paciente. En la medida de lo posible, las vacunas inactivadas debieran administrarse al menos 3 semanas antes de la quimioterapia, excepto la vacuna contra influenza, la cual es recomendada transversalmente durante el tratamiento de quimioterapia5,8,11. Una vez terminado el tratamiento, al menos 3 meses después, puede reanudarse el calendario de vacunación, y se debe revacunar en caso de dosis administradas por una situación de riesgo epidemiológico durante el tratamiento5,8,11 (tablas 3 y 4).
Vacunación en pacientes pediátricos con cáncer§
| Vacuna | Número de dosis | Esquema | Comentarios |
|---|---|---|---|
| Influenza | 1 o 2 | 0 y 1 mes en primovacunación en pacientes < 9 años1 dosis | Utilizar formulación inactivada, anualmente. La primovacunación efectiva requiere 2 dosis, separadas por, al menos, 4 semanas. Posteriormente se utiliza dosis única, independiente de la edad. Se recomienda el uso de dosis plena (0.5ml) desde los 6 meses. Esquemas equivalentes entre formulaciones de vacunas tri y tetravalentes. |
| Neumocócica | 2 | 0 y 2 meses | En sujetos > 2 años se recomienda esquema secuencial con vacuna polisacárida 23 valente, 12 meses después del refuerzo de la vacuna conjugada, independiente de que tenga esquema vacunal completo en la etapa de lactante. |
| Meningocócica conjugada 4 valente (ACWY) y recombinante (B) | 4 (<1 año)2 (≥ 1 año) | 2, 4, 6 y 12 meses0 y 2 meses | Revacunar 3 a 5 años posterior a última dosis. Vacuna recombinante de 4 componentes es la única actualmente aprobada para uso en < 1 año. |
| Hepatitis B | 5 | RN, 2, 4, 6 y 18 meses | En lactantes se utiliza la formulación combinada hexavalente. Completar dosis faltantes en caso de que haya iniciado vacunación. Si paciente no ha iniciado vacunación y es > 1 año, usar esquema 0, 1 y 6 meses. Si requiere dosis dosis de refuerzo, administrar formulación de 20μg. Considerar medición de títulos 1 o 2 meses después de la última dosis. Si este valor es <10 mUI, se recomienda revacunar, con 3 dosis y repetir medición de títulos 1 o 2 meses después de la última dosis. |
| Hepatitis A | 2 | 0 y 6 meses | Se recomienda en fase de remisión (> 3 meses post QT). Se utiliza desde los 12 meses de vida. |
| Sarampión, rubéola, paperas | 1 | Dosis única | Evitar su uso durante inmunosupresión de alto grado y QT. Se recomienda dosis de refuerzo 3 a 6 meses post QT. |
| Varicela | 2 | 0 y 3 meses | Se utiliza habitualmente a partir de los 12 meses de vida, hasta los 15 años. Se recomienda desde los 6 meses post QT. |
RN: recién nacido QT: quimioterapia
§ Adaptado desde Recomendaciones para la vacunación de pacientes con necesidades especiales por patologías o situaciones de riesgo.
Vacunas recomendadas en adultos con cáncer hematológico o tumores sólidos§
| Vacuna | Número de dosis | Esquema | Observaciones |
|---|---|---|---|
| Influenza | 1 (2ª dosis es opcional) | Dosis única o 0 y 1 mes | Utilizar formulación inactivada, anualmente. Durante QT y en 6 meses siguientes (2a dosis opcional al vacunar al inicio de la epidemia). Esquemas equivalentes entre formulaciones de vacunas tri y tetravalentes. |
| Neumocócica | 2 | 0 y 2 meses | Dos semanas previo a QT, o en fase remisión. Se recomienda esquema secuencial con vacuna 13-valente, seguido a las 8 semanas de vacuna 23-valente. |
| Hepatitis B | 3 | 0, 1 y 6 meses | Administrar en pacientes seronegativos. Usar dosis reforzadas, de 40μg cada una, 6 meses post QT. Completar dosis faltantes en caso de que haya iniciado vacunación. Considerar medición de títulos 1 o 2 meses después de la última dosis. Si este valor es <10 mUI, se recomienda revacunar, con 3 dosis y repetir medición de títulos 1 o 2 meses después de la última dosis. |
| Hepatitis A | 2 | 0 y 6 meses | Administrar en pacientes seronegativos. Completar dosis faltante en caso de que haya iniciado vacunación. En caso de uso de formulación combinada con hepatitis B, se administrarán 3 dosis: 0, 1 y 6 meses. |
QT: quimioterapia.
§ Adaptado desde Recomendaciones para la vacunación de pacientes con necesidades especiales por patologías o situaciones de riesgo; Lopez A, al. Vaccination recommendations for the adult immunosuppressed patient: A systematic review and comprehensive field synopsis. Journal of Autoimmunity 2017;80: 10-27.
Para pacientes adultos con cáncer, en especial aquellos que requieren quimioterapia, existe consenso global respecto a la recomendación de la vacuna inactivada influenza. Por otro lado, la mayoría recomienda además, las vacunas anti-neumocócicas, y sólo la guía francesa y la nacional recomiendan la vacunación hepatitis B en población susceptible5,11. Vacunas vivas atenuadas no se recomiendan (fiebre amarilla; varicela zoster atenuada; sarampión, rubeóla, parotiditis), pero en caso necesario requieren al menos 3 meses, e idealmente 6 meses de espera posterior a finalizada la quimioterapia5,8,11 (tabla 4).
b) Vacunas en trasplantes de órgano sólidos y precursores hematopoyéticosLos pacientes trasplantados o candidatos a trasplante de órganos sólidos habitualmente poseen calendarios incompletos de vacunaciones, como consecuencia de hospitalizaciones y descompensaciones de su enfermedad10,18. Por este motivo es relevante evaluar sus calendarios y ponerlos al día lo antes posible, con sus dosis de refuerzo, antes de someterse a trasplante, utilizando esquemas acelerados si es necesario (tabla 5), procurando no administrar vacunas vivas atenuadas en el mes previo a recibir un trasplante. La administración de vacunas en el periodo postrasplante se difiere, como norma general, 6 a 12 meses después del procedimiento, una vez que la inmunosupresión asociada ha disminuido significativamente. Sin embargo, actualmente se recomienda que las vacunas inactivadas se reinicien desde los 2 meses postrasplante, sin suspenderlas por el temor a rechazo de órganos5,8,10,11.
Vacunas en pacientes candidatos y/o receptores de trasplante de órganos sólidos
| Vacuna | Número de dosis | Esquema | Esquema acelerado | Comentarios |
|---|---|---|---|---|
| Polio inactivada | 4 | 2, 4, 6 y 18 meses | 0, 1 y 2 meses, con refuerzo a los 12 meses; pudiendo comenzar desde recién nacido | En adultos no vacunados se puede utilizar esquema de 3 dosis: 0, 1 y 6 meses, en formulación monovalente. No utilizar formulación combinada hexavalente en > 7 años. |
| Difteria, pertussis, tétanos, | 4 | 2, 4, 6 y 18 meses | 6, 10, 14 semanas, con refuerzo a los 4 años | En adultos no vacunados se puede utilizar esquema de 3 dosis: 0, 1 y 6 meses, en formulación triple. No utilizar formulación combinada hexavalente en > 7 años. |
| H influenzae tipo b | 4 | 2, 4, 6 y 18 meses | 6, 10, 14 semanas o 0, 1 y 2 meses, con refuerzo a los 6 o 12 meses | En adultos no vacunados se puede utilizar esquema de 1 dosis, en formulación monovalente. No utilizar formulación combinada hexavalente en > 7 años. |
| Hepatitis B | 3 | 0, 1 y 6 meses | 0, 7 o 14, 21 o 60 días y refuerzo a los 12 meses; pudiendo comenzar desde recién nacido | Administrar en pacientes seronegativos. Considerar medición de títulos 1 o 2 meses después de la última dosis. En lactantes se utiliza la formulación combinada hexavalente. |
| Rotavirus | 2 o 3 | 2, 4 (y 6) meses de vida | 4 semanas entre cada dosis, pudiendo comenzar desde las 6 semanas de vida | Segunda dosis de la vacuna monovalente puede ser administrada hasta los 6 meses de vida. La tercera dosis de la vacuna pentavalente puede ser administrada hasta los 8 meses de vida. Evitar su uso en la etapa postrasplante |
| Neumocócica | 3 + 1 | 2, 4, 6 y 12 meses | 6, 10, 14 semanas o 0, 1 y 2 meses, con refuerzo a los 12 meses; pudiendo comenzar desde las 6 semanas de vida | Esquema vacunal en base a vacuna conjugada. En sujetos > 2 años se recomienda esquema secuencial con vacuna polisacárida 23 valente, 8 semanas después del refuerzo de la conjugada. |
| Meningocócica conjugada 4 valente (ACWY) y recombinante (B) | 3 + 1 | 2, 4, 6 y 12 meses | 6, 10, 14 semanas o 0, 1 y 2 meses, con refuerzo a los 12 meses; pudiendo comenzar desde las 6 semanas de vida | Considerar su uso en caso de uso de eculizumab y asplenia funcional o anatómica. Esquema acelerado para vacuna recombinante contra meningococo B no está establecido. En adultos se pueden usar esquemas de 1 o 2 dosis para la vacuna conjugada 4 valente y de 2 dosis para la vacuna recombinante contra serogrupo B |
| Hepatitis A | 2 | A partir de los 12 meses de vida | 0 y 4 meses | Esquema de 2 dosis, con intervalo de 6 meses. Son intercambiables. Administrarla en pacientes seronegativos con hepatopatías. |
| Sarampión, Rubéola, paperas | 2 | 12 meses y refuerzo en 1o básico | 0 y 1 mes. Posible de administrar desde los 6 meses de edad | Esquema de 2 dos dosis, separadas por 1 mes en primovacunación. Evitar su uso en la etapa postrasplante e inmunosupresión de alto grado |
| Varicela | 2 | 0 y 3 meses | 0 y 1 mes. Posible de administrar desde los 6 meses de edad | Administrarla mínimo 1 mes antes del trasplante en pacientes seronegativos. Evitar su uso en la etapa postrasplante. Se utiliza habitualmente a partir de los 12 meses de vida |
| Zoster | 1 | 1 dosis (vacuna viva atenuada) | No aplicable | Existen 2 vacunas licenciadas; ambas aprobadas desde los 50 años: Vacuna viva atenuada, debe considerarse el nivel de inmunosupresión antes de vacunar, Evitar su uso en la etapa postrasplante; Vacuna inactiva, es segura en inmunosuprimidos, por lo que no tiene contraindicación, sin embargo, aún no está disponible en Chile |
| Virus Papiloma Humano | 3 | A partir 9 años de vida | Intervalos mínimos entre dosis:Dosis 1 y 2: 4 semanas; Dosis 2 y 3: 12 semanas; Dosis 1 y 3: 5 meses | Esquema 3 dosis: 0, 2 y 6 meses para vacunas tetra o nonavalentes, para hombres y mujeres |
| Influenza | 1 o 2 | A partir de los 6 meses de edad | En caso de 2 dosis, intervalo mínimo son 4 semanas | Se recomienda vacunación anual. Si no existen antecedente de vacunación en niños entre 6 meses a 9 años se requieren 2 dosis. Esquemas equivalentes entre formulaciones de vacunas tri y tetravalentes. |
§Adaptado desde Recomendaciones para la vacunación de pacientes con necesidades especiales por patologías o situaciones de riesgo; Lopez A, al. Vaccination recommendations for the adult immunosuppressed patient: A systematic review and comprehensive field synopsis. Journal of Autoimmunity 2017;80: 10-27; Rubin LG, et al. Clin Infect Dis. 2014;58.
En el caso de los pacientes que reciben un trasplante de precursores hematopoyéticos (TPH), estos se asemejan a una médula ósea de recién nacido, por lo que desaparece la inmunidad inducida por infecciones o vacunas administradas previo al trasplante. En consecuencia, una vez que el paciente alcanza su reconstitución inmune, habitualmente no antes de 6 a 12 meses post trasplante, todos los pacientes, incluso los que tienen enfermedad de injerto contra huésped (EICH) crónico, debe recibir todas las vacunas programáticas inactivadas, en esquema semejante al de los lactantes (tabla 6). Los requisitos inmunológicos que debe cumplir el receptor de TPH para recibir vacunas son:
- -
Tener un recuento absoluto de LT CD4 mayor de 400/mm3.
- -
Recuento absoluto de LT CD19 mayor de 200/mm3.
- -
Recuento absoluto de linfocitos mayor de 1.000/mm3.
- -
Concentración plasmática de IgG normales para la edad5.
Vacunas para pacientes receptores de trasplante de precursores hematopoyéticos
| Vacuna | Tiempo pos TPH | Número de dosis | Comentarios |
|---|---|---|---|
| BCG | NR | NR | Contraindicada |
| Rotavirus | NR | NR | Contraindicada |
| Polio inactivada, difteria, pertussis, tétanos, H influenzae tipo b, hepatitis B | 6 - 12 meses | 4 dosis | Esquema de 4 dosis: 0, 2, 4 y 18 meses. Formulación hexavalente puede utilizarse hasta los 6 años 11 meses. Formulación triple, dTpa, está aprobada desde los 4 años |
| Neumocócica conjugada 13 valente | 6 - 12 meses | 4 dosis | Esquema de 4 dosis: 0, 2, 4 y 12 meses. En sujetos > 2 años se recomienda esquema secuencial con vacuna polisacárida 23 valente, 12 meses después del refuerzo de la vacuna conjugada |
| Meningocócica conjugada 4 valente (ACWY) | 6 - 12 meses | 2 dosis | Esquema de 2 dosis: 0 y 2 meses para vacunas tetravalentes conjugadas. |
| Meningocócica recombinante (B) | 12 meses | 2 dosis | Esquema de 2 dosis: 0 y 2 meses para vacuna recombinante de 4 componentes. Vacuna recombinante de 4 componentes es la única actualmente aprobada para uso en < 1 año |
| Sarampión, rubéola, paperas | 12 - 24 meses | 2 dosis | Esquema de 2 dosis, separadas por 1 mes. Administrar en ausencia de EICH, inmunosupresores y luego de que hayan transcurrido al menos 8 meses desde la última dosis de IGIV |
| Hepatitis A | 6 – 12 meses | 2 dosis | Esquema de 2 dosis, separadas por 6 meses |
| Varicela | 24 meses | 2 dosis | Esquema de 2 dosis, separadas por 3 meses. Administrar en ausencia de EICH, inmunosupresores y luego de que hayan transcurrido al menos 8 meses desde la última dosis de IGIV y en estos, idealmente con CD4>200 e Ig normales. |
| Zoster | NR | NR | Vacuna viva atenuada está contraindicada. Vacuna inactivada, no disponible en Chile, podría utilizarse en 2 dosis, separadas por 2 meses, desde los 3 meses post TPH. |
| Virus Papiloma Humano | 6 – 12 meses | 3 dosis | Esquema 3 dosis 0, 2 y 6 meses para hombres y mujeres. Formulaciones tetra y nonavalente disponibles desde los 9 años |
| Influenza | 6 meses | 1 | Formulación inactivada. Si se utiliza desde el 4to mes posTPH requiere 2 dosis. Esquemas equivalentes entre formulaciones de vacunas tri y tetravalentes. |
| Fiebre amarilla | 24 meses | 1 | Vacuna viva atenuada. Se dispone de escasa información sobre su uso en TPH. Existen reportes de inmunogenicidad y seguridad en uso en TPH alogénicos si exposición es inminente. Administrar en ausencia de EICH e inmunosupresores. Considerar dosis de refuerzo 10 años, en caso de que exista riesgo de exposición |
NR: no recomendada; TPH: trasplante de precursores hematopoyéticos; EICH: enfermedad de injerto contra huésped; IGIV: inmunoglobulina intravenosa.
Los requisitos inmunológicos que debe cumplir el receptor de TPH para recibir vacunas son: recuento absoluto de LT CD4 mayor de 400/mm3, recuento absoluto de LT CD19 mayor de 200/mm3, recuento absoluto de linfocitos mayor de 1.000/mm3, y concentración plasmática de IgG normales para la edad.
§Adaptado desde Recomendaciones para la vacunación de pacientes con necesidades especiales por patologías o situaciones de riesgo; Lopez A, al. Vaccination recommendations for the adult immunosuppressed patient: A systematic review and comprehensive field synopsis. Journal of Autoimmunity 2017;80: 10-27; Rubin LG, et al. Clin Infect Dis. 2014;58;
En situaciones epidemiológicas de riesgo, como influenza o enfermedad meningocóccica, la exposición a un caso índice, como hepatitis A o difteria, o de heridas accidentales contaminadas, como tétanos, podría indicarse la vacunación antes, a partir de los 3 meses post trasplante, aunque no pueda asegurarse su beneficio protector3,5,8,16.
Las vacunas vivas atenuadas tales como BCG, vacuna polio oral, vacuna intranasal contra la influenza, vacuna contra el cólera, vacuna oral contra la fiebre tifoidea, vacuna atenuada contra el zoster y la vacuna contra el rotavirus están contraindicadas. Otras vacunas vivas atenuadas, como sarampión, rubéola, parotiditis y varicela, deben ser postergadas hasta cumplirse un mínimo de 24 meses de efectuado el TPH, pudiendo administrarse en ausencia de EICH, inmunosupresores y hayan transcurrido al menos 8 meses desde la última dosis de IGIV5,8,16. Existe escasa información sobre el uso de vacuna de fiebre amarilla en pacientes con TPH, sin embargo, reportes de inmunogenicidad y seguridad en uso en TPH alogénicos en caso de que exista exposición inminente, pudiéndose administrar en ausencia de EICH e inmunosupresores27 (tabla 6).
c) Vacunas en asplenia o hipoespleniaEl bazo actúa como filtro mecánico de los microorganismos y produce sustancias opsonizantes que favorecen la fagocitosis. Por ello, los pacientes con asplenia anatómica (congénita o quirúrgica) o funcional (por irradiación esplénica, infiltración por enfermedades de depósito o malignas, anemia de células falciformes, talasemia mayor, síndrome de asplenia o poliesplenia) favorecen las infecciones fulminantes por bacterias capsuladas, como Streptococcus pneumoniae, Haemophilus influenzae tipo b y Neisseria meningitidis; y otros organismos gramnegativos como Salmonella spp., entre otras. Si bien la frecuencia de sepsis fatal post esplenectomía es baja, oscilando alrededor de 1-1,2/1.000 personas-año en adultos y 3/1.000 personas-año en niños, representa entre 12 a 50 veces mayor riesgo respecto de la población general. Este riesgo se presenta principalmente durante los cinco primeros años de vida o siguientes a la esplenectomía, pero, es posible que se mantenga durante toda la vida.
La vacunación contra Streptococcus pneumoniae, Haemophilus influenzae tipo b y Neisseria meningitidis disminuye en forma significativa el riesgo de sepsis fulminante por estas tres especies bacterianas. Además, se recomienda vacunación antigripal anual5,8,28-30(tabla 7). La vacunación por sí sola no es suficiente protección para estos pacientes, por lo que se recomienda profilaxis antimicrobiana diaria en todos los pacientes desde los 3 meses hasta los 5 años de edad, independiente de su estado de inmunización28-30.
Vacunas para pacientes con asplenia y/o hipoesplenia funcional o anatómica
| Vacuna | Serie Primaria | Refuerzo | Comentarios |
|---|---|---|---|
| H influenzae tipo b | Lactantes: 3 dosis: 2, 4 y 6 meses | 1 dosis: 18 meses | Utilizar formulación hexavalente. |
| > 5 años: 1 dosis | NR | Formulación hexavalente puede utilizarse hasta los 6 años 11 meses. | |
| Previo a esplenectomía: 1 dosis, 2 semanas previo a cirugía | NR | Usar formulaciones conjugadas monovalentes para mayores 7 años. Uso de una dosis post esplenectomía en caso de ausencia de vacunación pre quirúrgica. | |
| Meningocócica conjugada 4 valente (ACWY) | Lactantes: 3 dosis: 2, 4 y 6 meses | 1 dosis: 12 meses; luego cada 3-5 años | En caso de iniciarse la vacunación durante el primer año de vida, el segundo refuerzo se indica a los 3 años del primero y posteriormente cada 5 años. |
| > 1 año: 2 dosis | 1 dosis, cada 5 años | No existen estudios respecto de intercambiabilidad entre vacunas conjugadas tetravalentes. | |
| Previo a esplenectomía, sin dosis previas: 2 dosis, 2 semanas previo a cirugía | 1 dosis, cada 5 años | Esquema de 2 dosis: 0 y 2 meses. En caso de esplenectomía con antecedente de vacunas previas sólo se requiere de refuerzos cada 5 años. | |
| Meningocócica recombinante (B) | Lactantes: 3 dosis: 2, 4 y 6 meses | 1 dosis: 12 meses | Vacuna recombinante de 4 componentes es la única actualmente aprobada para uso en < 1 año. |
| > 2 años: 2 dosis | No establecida su necesidad | Esquema de 2 dosis, 0 y 2 meses para vacuna recombinante de 4 componentes, única actualmente aprobada para uso en > 1 año.Vacuna recombinante rLP2086 está aprobada entre 10 a 25 años, aún no comercializada en nuestro país | |
| Previo a esplenectomía, sin dosis previas: 2 dosis, partiendo 2 semanas previo a cirugía | No establecida su necesidad | No está establecida su utilidad en refuerzos cada 5 años, sin embargo, podría considerarse según el contexto epidemiológico. Uso de una dosis post esplenectomía en caso de ausencia de vacunación pre quirúrgica. | |
| Neumocócica conjugada 13 valente | 2 a 6 meses: 2, 4 y 6 meses | 1 dosis: 12 meses o al menos 2 meses después de haber finalizado el esquema primario7 a 11 meses: 2 dosis, separadas por 2 meses | Esquema de 4 dosis: 0, 2, 4 y 12 meses. En sujetos > 2 años se recomienda esquema secuencial con vacuna polisacárida 23 valente, 12 meses después del refuerzo de la conjugada. |
| 1 a 2 años: 1 dosis | 1 dosis, 2 meses después de la primera vacunación | Esquema de 2 dosis: 0 y 2 meses. | |
| > 2 años, sin vacunas previas: 1 dosis | 1 dosis 5 años después de dosis primaria con polisacárida 23 valente | Si tenía antecedentes de vacunación previa, no requiere repetir vacunas conjugadas, sino que solo refuerzos con polisacárida 23 valente. | |
| Previo a esplenectomía: 1 dosis, 2 semanas previo a cirugía | Esquema secuencial con polisacárida 23 valente | En esquema secuencial debe ir siempre primero la vacuna conjugada, seguida por la polisacárida, al menos 8 semanas después y un refuerzo único de esta última 5 años después. | |
| Neumocócica polisacárida 23 valente | 1 dosis: desde los 2 años de vida | 1 dosis única 5 años después | Algunos autores recomiendan el primer refuerzo a los 3 años después de la primera dosis en caso de anemia de células falciformes. |
| Influenza | 1 o 2 dosis | 1 dosis anual | Formulación inactivada. Si se utiliza por primera vez antes de los 9 años requiere 2 dosis. |
§Adaptado desde Recomendaciones para la vacunación de pacientes con necesidades especiales por patologías o situaciones de riesgo
NR: no recomendada.
Los pacientes en tratamiento con corticoides ven afectada su respuesta a vacunas inactivadas y está el riesgo de seguridad, en el caso de las vacunas vivas atenuadas. El punto de controversia es cuál es la dosis umbral de corticoides que determinará ese cambio de respuesta a la vacunación. Se ha consensuado como “alto nivel de inmunosupresión” una dosis de corticoides diaria equivalente ≥20mg de prednisona por >14 días ó ≥2mg/kg/día durante ≥14 días ó ≥1mg/kg/día durante ≥28 días, en niños con pesos mayores de 10kg4,8,11. Estas dosis contraindican la administración de vacunas vivas atenuadas. En cambio, las dosis de sustitución fisiológica no son un impedimento para la vacunación. Al suspender el tratamiento, se recomienda esperar al menos un mes para la administración de vacunas inactivadas y de uno a tres meses para vacunas vivas atenuadas. En caso que no pueda suspenderse el tratamiento, se puede considerar la vacunación con la menor dosis tolerable de corticoides5.
e) Vacunas en pacientes con terapias biológicasLas terapias biológicas tanto para enfermedades autoinmunes o inmunomediadas, como en terapia onco-hematológica han tenido un rápido y continuo desarrollo en las últimas décadas. Si bien, ha cambiado el pronóstico de las enfermedades en las que se aplican, no están exentas de riesgos asociados, entre ellos el de infecciones. La mejor respuesta a las vacunas recomendadas se obtendrá si se vacuna previo al inicio de la terapia, recomendándose idealmente, un plazo de al menos un mes en caso de vacunas vivas atenuadas4,7,8,12-14,31. En aquellos pacientes que ya iniciaron su terapia biológica y tienen vacunas pendientes, el mayor riesgo en el caso de las inactivadas es la insuficiente inmunogenicidad y en el de las atenuadas la reactivación del virus vaccinal. En pacientes en tratamiento con anticuepros anti-CD20, se recomienda diferir la vacunación al menos 6 meses12.
A modo global, la recomendación internacional es la vacunación anti-neumoccócica y anti-influenza. En los pacientes seronegativos se recomienda además la vacunación hepatitis A y hepatitis B, considerando la posibilidad de uso de doble dosis y control de anti-HBs al mes de completado el esquema. También se recomienda la vacunación contra el virus del papiloma humano y considerar la vacuna difteria-tétanos-pertussis en caso de ausencia de refuerzo en los últimos 10 años8,11. Respecto a la vacunación anti-neumoccócica se recomienda respetar el esquema de vacunación habitual hasta los 2 años con vacuna neumocócica conjugada 13 valente (VNC-13). En pacientes de 2 o más años, se recomienda una dosis de vacuna neumocócica polisacárida 23 valente (VNP-23) al menos 8 semanas después de la VNC-13, con un refuerzo de VNP-23 a los 5 años7,8. La vacunación anti-meningococo considera la vacuna conjugada tetravalente (ACWY) y la vacuna recombinante monovalente (B), según la situación epidemiológica local5,7,14 y según el anticuerpo monoclonal indicado, como el eculizumab que ha demostrado un aumento de las infecciones por bacterias capsuladas, entre otras7. La vacuna varicela se recomienda en pacientes susceptibles, respetando al menos 4 semanas de intervalo previo al inicio de la terapia biológica. La vacuna contra el herpes zoster está indicada en pacientes con historia de varicela, mayores de 50 años, respetando también el plazo de al menos 4 semanas previo al inicio de su terapia7,8. Ambas vacunas están recomendadas en especial en pacientes que recibirán fingolimod o bortezomib/carfilzomib/ixazomib. En estos últimos también está recomendada la vacunación anti-neumoccócica, en la secuencia comentada previamente13.
f) Vacunas en inmunodeficiencias primariasLas inmunodeficiencias primarias (IDPs) corresponden a un grupo heterogéneo de defectos congénitos del sistema inmune, que comprometen su respuesta, ya sea innata o adaptativa. Estos defectos se manifiestan por una susceptibilidad aumentada a infecciones recurrentes, neoplasias de predominio linfoproliferativas, atopía, autoinmunidad, autoinflamación y procesos granulomatosos5,32. En el 2017, la “Unión internacional de sociedades de Inmunología” las clasificó en 9 grupos:
- 1.
Inmunodeficiencias que afectan la inmunidad celular y humoral.
- 2.
Inmunodeficiencias combinadas con características específicas o relacionadas a un síndrome.
- 3.
Inmunodeficiencias predominantemente de anticuerpos; enfermedades de disregulación inmune.
- 4.
Defectos congénitos en el número.
- 5.
Función o ambas de fagocitos.
- 6.
Defectos de la inmunidad innata e intrínseca.
- 7.
Trastornos autoinflamatorios.
- 8.
Deficiencias del complemento.
- 9.
Fenocopias de IDPs32.
En el contexto de IDPs, las vacunaciones además de indicación terapéutica son una herramienta diagnóstica. Una respuesta de anticuerpo disminuida, que se define como la proporción de individuos inmunocompetentes que alcanzan un título de anticuerpo denominado como protector, se puede utilizar como herramienta y es uno de los criterios diagnósticos en IDPs con compromiso de la inmunidad humoral33. La respuesta a vacunas en pacientes con deficiencia de anticuerpos se encuentra generalmente disminuida. La eficacia o utilidad de la administración de inmunizaciones en pacientes en suplementación con IG y defectos mayores de anticuerpos, como la inmunodeficiencia común variable, no ha sido establecida33,34.
Las guías en IDPs recomiendan esquemas similiares a la población general. Las vacunas inactivadas no presentan problemas de seguridad, pudiendo ser usadas rutinariamente, sin embargo, su inmunogenicidad puede verse afectada, por lo que debe ser evaluada cuando sea posible, incluyendo refuerzos si es necesario. Además, es recomendable administrarlas los días previos a recibir sus dosis de inmunoglobulina. Los pacientes en suplementación con IG endovenosa o subcutánea, de manera permanente y en dosis apropiadas, poseen niveles protectores de anticuerpos de la mayoría de las vacunas utilizadas, excepto contra la cepa de influenza de cada temporada específica, por lo que tienen indicación perentoria de vacunarse contra la influenza cada año, independiente de que estén recibiendo IG32-34.
En algunos defectos hay recomendaciones en particular o exclusión de vacunas por riesgo de seguridad. Debido a la heterogeneidad de las IDPs, las vacunas vivas atenuadas deben ser consideradas según cada condición (tabla 8). Por ejemplo, el grupo de defectos predominantemente de anticuerpos se divide en defectos mayores (Agamaglobulinemia ligada al X, inmunodeficiencia común variable) y menores (déficit selectivo de IgA, déficit de subclases de IgG, deficiencias de anticuerpos específicos). En el subgrupo de defectos mayores se contraindican las vacunas vivas atenuadas, lo que no ocurre en las deficiencias menores. En los defectos congénitos de los fagocitos sólo se contraindican vacunas bacterianas atenuadas. En deficiencias combinadas o relacionadas a un síndrome específico, las recomendaciones varían según el defecto en particular. En pacientes, incluyendo recién nacidos, con antecedentes familiares de primer grado de IDP diagnosticada o sospecha de inmunodeficiencia combinada severa (SCID) debería dilatarse la vacunación con BCG y otras vacunas vivas atenuadas, hasta realizar el diagnóstico o descarte de manera apropiada5,32-34. Las vacunas contra sarampión, rubéola, parotiditis y varicela pueden administrarse a niños con síndrome de DiGeorge si cumplen con linfocitos T CD3 ≥500/ml, linfocitos CD4+ ≥ 200/ml y respuesta linfocitaria normal a mitógenos (fitohemaglutinina- PHA)1,5.
Vacunas recomendadas en niños con inmunodeficiencias primarias§
| Vacuna | Tipo de inmunodeficiencia primaria | Comentarios | |||
|---|---|---|---|---|---|
| Déficit de células B* | Déficit de células T y mixtas | Trastorno de neutrófilos y fagocitosis | Alteración del complemento | ||
| Polio inactivada, difteria, pertussis, tétanos, H influenzae tipo b, hepatitis B | Según esquema rutinario | Según esquema rutinario | Según esquema rutinario | Según esquema rutinario | Considerar dosis de refuerzo de Hib conjugada si asplenia funcional |
| Neumocócica conjugada 13 valente | Esquema 3 + 1 | Esquema 3 + 1 | Esquema 3 + 1 | Esquema 3 + 1 | Considerar 1 dosis de vacuna neumocócica polisacárida a los 2 años de vida, con 1 dosis única de refuerzo 5 años después |
| Meningocócica conjugada 4 valente (ACWY) y recombinante (B)@ | Esquema 3 + 1 | Esquema 3 + 1 | Esquema 3 + 1 | Esquema 3 + 1 | Considerar su uso, principalmente en pacientes con déficit de complemento, con refuerzos cada 3-5 años. |
| Rotavirus | NR | NR | Esquema 2 ó 3 dosis | Esquema 2 ó 3 dosis | Contraindicada en pacientes con agammaglobulinemia e IDCV. Esquema de 2 dosis para vacuna monovalente y 3 dosis en caso de vacuna pentavalente |
| Sarampión, rubéola, paperas | NR# | NR | Según esquema rutinario | Según esquema rutinario | Considerar uso en IDCV |
| Hepatitis A | Esquema 2 dosis | Esquema 2 dosis | Esquema 2 dosis | Esquema 2 dosis | Esquema de 2 dosis: 0 y 6 meses |
| Varicela | NR& | NR | 2 dosis | 2 dosis | Esquema de 2 dosis: 0 y 3 meses a partir de los 12 meses de vida |
| Virus Papiloma Humano | Esquema 2 + 1 | Esquema 2 + 1 | Esquema 2 + 1 | Esquema 2 + 1 | Esquema 0, 2 y 6 mesesFormulaciones tetra y nonavalente disponibles desde los 9 años |
| Fiebre Amarilla | NR | NR | 1 dosis | 1 dosis | Considerar dosis de refuerzo si es que ocurrirá una re-exposición |
§ Adaptado desde Recomendaciones para la vacunación de pacientes con necesidades especiales por patologías o situaciones de riesgo.
* Los pacientes agamaglobulinémicos podrían presentar respuesta inmune inadecuada; @ Considerar vacuna recombinante contra meningococo B de cuatro componentes (4CMenB), dado que es la única licenciada para uso en menores de 5 años; IDCV: inmunodeficiencia común variable; NR: No Recomendada; NR#: formalmente contraindicada, pero acorde al context o epidemiológico podría evaluarse el riesgo beneficio en cada caso de IDCV, según recomendación del Minsal; NR&: formalmente contraindicada, pero acorde al contexto epidemiológico podría evaluarse el riesgo beneficio en cada caso de Agamaglobulinemia e IDCV, según recomendación del Minsal.
Los individuos que conviven con inmunocomprometidos deben estar al día con todas sus inmunizaciones rutinarias y recomendadas, sean inactivadas o vivas atenuadas, debiendo vacunarse anualmente contra la influenza. Las vacunas contra varicela se recomiendan para los susceptibles, mayores de 1 año de vida, y en el caso de que desarrolle lesiones cutáneas se debe evitar el contacto con inmunosuprimidos hasta que las lesiones desaparezcan1,5,8,14,16.
DISCUSIÓNLos pacientes inmunocomprometidos poseen un riesgo mayor de presentar infecciones inmunoprevenibles, por lo que debemos mantener su calendario vacunal actualizado y complementado, acorde a recomendaciones específicas, de manera dinámica y proactiva. Es de suma relevancia evitar retrasos en esquemas de vacunación, ponerlos al día lo antes posible, idealmente 4 semanas antes de iniciar la terapia inmunosupresora, con estrategias basadas en el individuo, considerando medición de títulos de anticuerpos inducidos por vacunas y/o dosis adicionales, si correspondiese7,14,16. En Chile, el PNI da la posibilidad de complementar el esquema de vacunación de los pacientes según sus condiciones de riesgo, a través de solicitud de vacunas especiales5,14,26. Las vacunas inactivadas pueden administrarse de manera segura, aunque su respuesta inmune pueda ser inadecuada, es preferible vacunar y no postergarlas demasiado esperando intervalos sin terapia1,8-11,17. En el caso de las vacunas vivas atenuadas, que habitualmente se encuentran contraindicadas en estos pacientes, cada vez existe más información favorable a su uso, lo que permitirá evaluar su riesgo-beneficio de manera individual, evitando su uso en las fases severas de inmunosupresión8,14,24,25. Para organizar el esquema de vacunación, se deben considerar los intervalos entre ellas, los esquemas acelerados autorizados, la coordinación con el vacunatorio, la solicitud de vacunas especiales, las aprobaciones vigentes, sus contraindicaciones y reportar los efectos adversos si correspondiese, de manera de proveer una vacunación segura optimizando los resultados de inmunogenicidad14,26.
CONCLUSIONESLos pacientes inmunocomprometidos presentan un riesgo mayor de infecciones, por lo que administrar oportunamente las vacunas a ellos y a su entorno otorga protección directa e indirecta, mejorando sus pronósticos. Las vacunas inactivadas no están contraindicadas en estos pacientes, por lo que deben ser administradas lo antes posible o durante la terapia inmunosupresora. El uso de vacunas vivas atenuadas debe evaluarse según riesgo-beneficio, de manera individual. Por estos motivos debemos considerar proactivamente el uso de vacunas en estos pacientes, acorde a las directrices nacionales e internacionales, de manera de optimizar los esfuerzos que se realizan para evitar complicaciones y mejorar la calidad de vida de nuestros pacientes.
Declaración de conflicto de interésRodolfo Villena ha participado en proyectos de investigación en vacunas para GSK y consultorías para Pfizer y Sanofi Pasteur.
Luisa Durán no tiene conflictos de interés con el artículo.