Los defectos de pared abdominal son un grupo de malformaciones congénitas que representan defectos heterogéneos y comparten una característica en común, que es la herniación o evisceración de uno o más órganos de la cavidad abdominal, debido a un defecto en la formación de la pared abdominal. Las patologías más frecuentes de este grupo son la gastrosquisis y el onfalocele, sin embargo, existen más patologías que se incluyen en este grupo como la Pentalogía de Cantrell, complejo miembro pared, extrofia vesical y cloacal.
En este artículo revisaremos el examen normal y las malformaciones más frecuentes de la pared abdominal, su diagnóstico y manejo.
The abdominal wall defects are a group of congenital malformations that represent heterogeneous defects and share a common characteristic, which is the herniation or evisceration of one or more organs of the abdominal cavity due to a defect in the formation of the abdominal wall. The most frequent pathologies of this group are gastroschisis and omphalocele, however, there are more diseases that are included in this group as Pentalogy of Cantrell, member complex wall, bladder and cloacal exstrophy.
In this article we review the normal examination and the most frequent abdominal Wall defects, its diagnosis and management.
Los defectos de pared abdominal son un grupo de malformaciones congénitas que representan defectos heterogéneos y comparten una característica en común, que es la herniación o evisceración de uno o más órganos de la cavidad abdominal, debido a un defecto en la formación de la pared abdominal. Las patologías más frecuentes de este grupo son la gastrosquisis y el onfalocele, sin embargo, existen más patologías que se incluyen en este grupo como la Pentalogía de Cantrell, complejo miembro pared, extrofia vesical y cloacal.
Todas estas patologías (excepto el onfalocele) guardan un origen embriológico en común que es la falla en el cierre de los pliegues laterales de la pared abdominal durante la cuarta semana del desarrollo embriológico1. En este articulo revisaremos el examen normal y las malformaciones mas frecuentes de la pared abdominal, su diagnóstico y manejo.
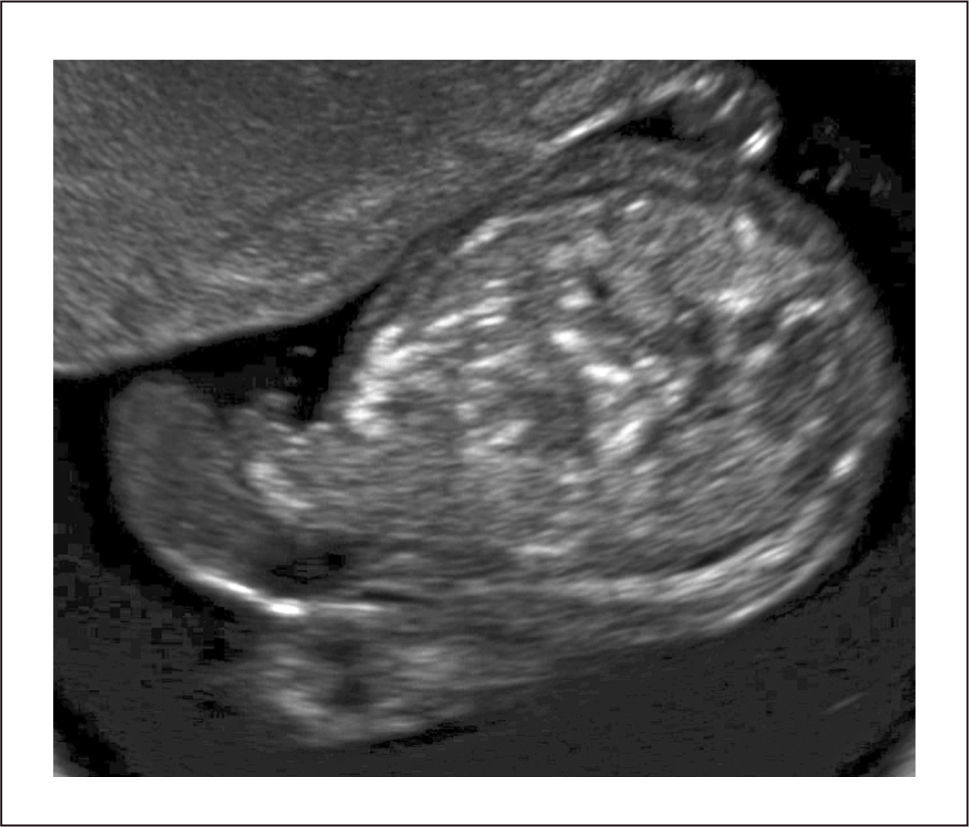
Examen normal. En el primer trimestre, antes de las 12 semanas, es posible observar, en planos axiales y coronales el onfalocele fisiológico, donde identificamos asas intestinales que protruyen en la inserción abdominal del cordón umbilical (Figura 1). Estas asas son generalmente mínimas y deben regresar a la cavidad abdominal después de la semana 12.
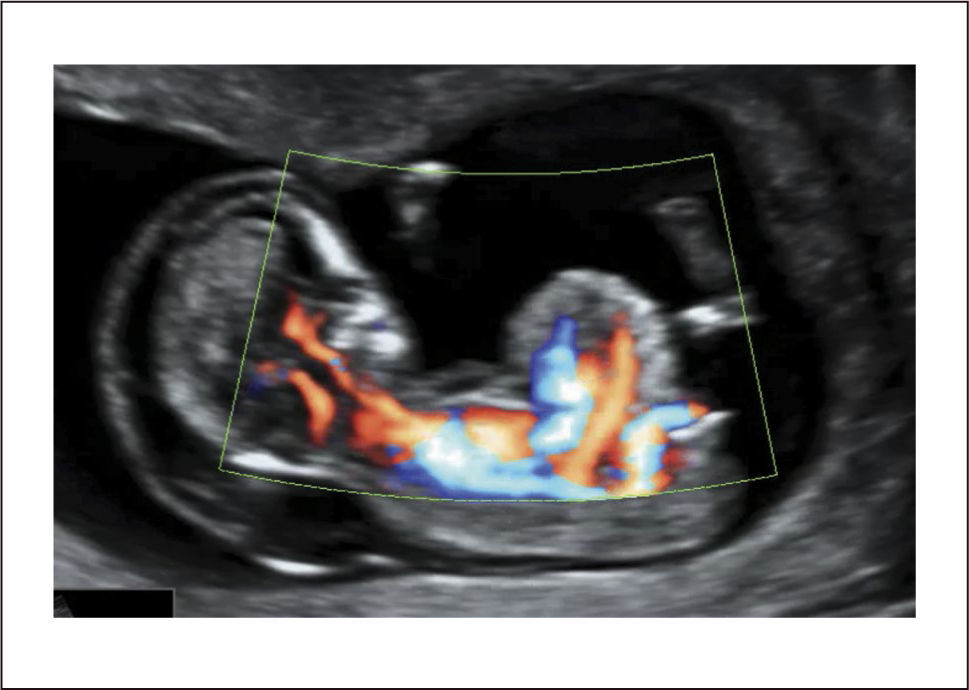
En el examen de las 20 a 24 semanas y en segundo trimestre, el examen del abdomen y su pared se realiza recorriendo desde cefálico a caudal el abdomen y ponemos atención tanto en su contenido como en la indemnidad de su pared para descartar defectos de ésta. Observamos la presencia de la sombra gástrica a izquierda y hacia derecha el hígado ecorrefringente con la vena umbilical, econegativa y con flujo al Doppler color, en dirección oblicua de izquierda a derecha y desde podálico a caudal (Figura 2). También hacia el tercer trimestre es posible observar la vesícula biliar. Más hacia podálico observamos las glándulas suprarrenales y los riñones a ambos lados de la columna. Hacia delante observamos la emergencia del cordón umbilical, sitio de asiento para defecto de la pared. Al dirigirnos más hacia caudal observamos como una sombra econegativa, a la vejiga urinaria, circundada por dos estructuras vasculares, las arterias umbilicales (Figura 3). Las asas de intestino delgado generalmente no son identificables en el examen normal del segundo trimestre ya que su lumen es virtual. Hacia el tercer trimestre el contenido incrementa y es posible identificarlas.
Embriológicamente existe un onfalocele fisiológico hasta las 11 semanas de gestación, luego de lo cual su persistencia es patológica. Se asocia a cromosomopatías (Trisomía 18 y 13)2,3, siendo este riesgo mayor a menor edad gestacional (50% a las 12 semanas y 15% a término) debido a la letalidad de las patologías anteriormente señaladas. La asociación con otras malformaciones alcanza el 65% de los casos3,4.
La etiología del onfalocele no es del todo conocida, aunque existen diversas teorías que se han propuesto, incluyendo la falla en el retorno del intestino medio a la cavidad abdominal después de las 10-12 semanas, el fracaso en el cierre de la región mesodérmica lateral que impide un plegamiento central y la persistencia del cuerpo tallo más allá de 12 semanas.
Incidencia. La incidencia del onfalocele es de uno cada 4000 recién nacidos vivos.
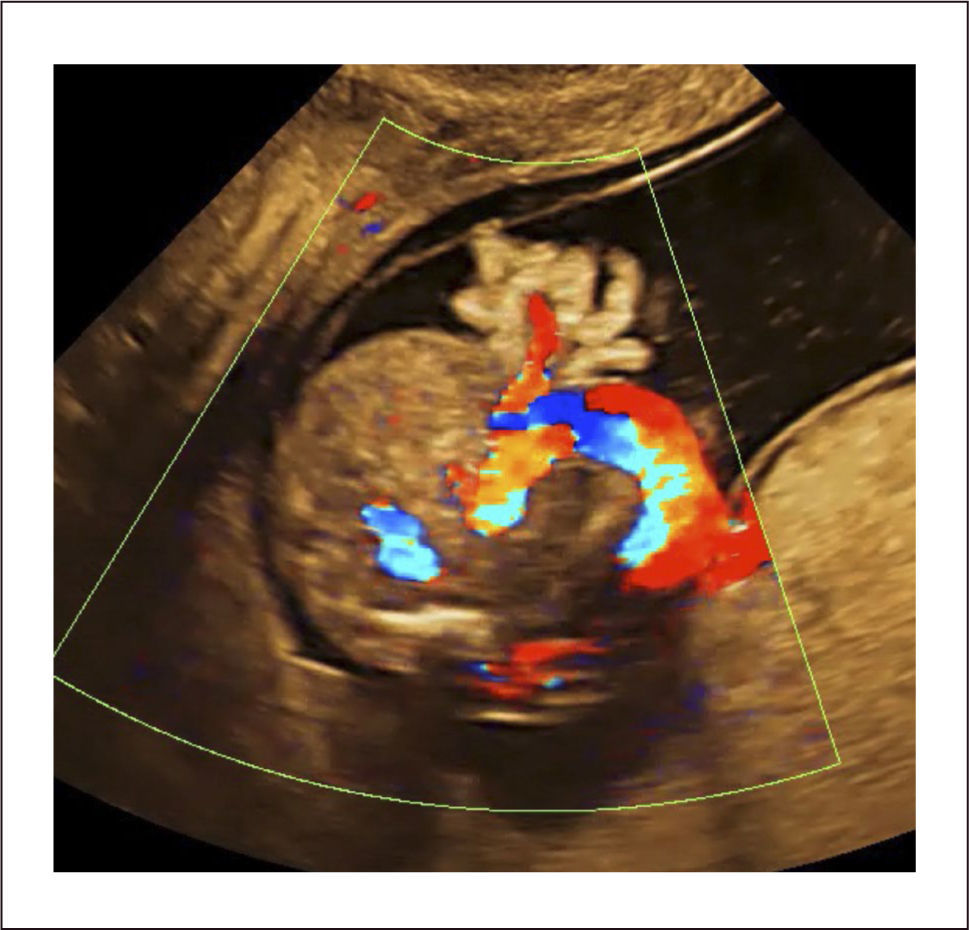
Diagnóstico. El diagnóstico por ultrasonido se realiza por la persistencia de la herniación umbilical después de las 12 semanas de gestación. Se observa la presencia de una herniación central con la inserción del cordón umbilical en su ápice y está cubierta por una membrana de peritoneo5. El contenido puede ser intestinal (Figura 4) y/o hepático (Figura 5). Se sugiere correlacionar el tamaño del defecto midiendo la relación del diámetro transversal del onfalocele y el diámetro transversal del abdomen y en teoría si esta relación es más del 60% se puede entender que el hígado está contenido, si es menor el contenido sería sólo intestinos. El uso de Doppler color ayuda a la identificación de los vasos hepáticos en el interior del saco herniario. Cuando el hígado esté contenido en el saco herniario se considerara grande y en su ausencia pequeño.
Diagnóstico diferencial: El diagnóstico diferencial se debe realizar con otros defectos mayores de la pared abdominal y/o torácico: Pentalogía de Cantrell (onfalocele alto, hernia diafragmática anterior, hendidura esternal, ectopia cordis, defecto cardíaco); extrofia vesical o cloaca, ano imperforado, atresia colónica y defectos de las vértebras sacras6,7. También se debe pensar en el Síndrome de Beckwith-Wiedemann (prevalencia 1:14000) si se está en presencia de onfalocele asociado a macrosomía fetal y macroglosia; estos recién nacidos presentan hipoglicemia y 5% de ellos desarrollan nefroblastomas y hepatoblastomas8.
Es más probable que el onfalocele esté asociado con otras anomalías e incluso puede tener más relación con otros síndromes cromosómicos o genéticos, en comparación con otros defectos de la pared abdominal como la gastrosquisis. Hasta en un 45-88% se puede asociar con diferentes anomalías como cardíacas, genitourinario, gastrointestinal, musculoesqueléticos, del tubo neural y cuello cabeza defectos. Las anomalías cromosómicas están presentes en el 40-60% de los fetos con onfalocele e incluyen trisomías 18, 13 y 21, Turner, Klinefelter y síndromes con triploidía. En los defectos pequeños las alteraciones cromosómicas llegan al 60%, en los defectos grandes solo el 5%.
Pronóstico. La sobrevida de estos casos depende de la patología asociada, en aquellos con defecto aislado la sobrevida es de alrededor de 90%9.
GASTROSQUISISSe caracteriza por la presencia de un pequeño defecto de la pared abdominal, para-umbilical, habitualmente derecho y generalmente pequeño, menos de 4cm. La característica de este defecto es la herniación de asas intestinales directamente en la cavidad amniótica a través de la pared abdominal, sin la participación del cordón umbilical. La palabra gastrosquisis proviene del griego que significa “hendidura de estómago”.
Las gastrosquisis se considera un evento disruptivo y existen varias teorías que explican su origen, entre ellas que es producida por alteraciones vasculares como la involución anormal de la vena umbilical derecha o isquemia de la arteria onfalomesentérica con ello necrosis de la pared. Otra es que podría ser el resultado de daño amniótico, posiblemente secundario a alguna toxina aún no identificada. Hasta hoy ninguna de estas teorías ha sido aceptada. Aunque la patogénesis es aún desconocida, existen factores de riesgo claramente asociados, como el tabaco, la cocaína, fármacos vaso activos, analgésicos, alcohol y radiación; sin embargo, la asociación más fuerte se relaciona con la edad materna joven (menor de 20 años), así como un índice de masa corporal bajo, dieta materna insuficiente y estrato socioeconómico bajo.
Por otra parte la gastrosquisis izquierda es una entidad rara y sólo se han reportado 17 casos a nivel mundial. La etiología también es desconocida, sin embargo, se asocia más a defectos extraintestinales y se ha encontrado predominantemente en mujeres10.
Incidencia. La incidencia de gastrosquisis es de 1:4000 recién nacidos.
Diagnóstico. El diagnóstico de gastrosquisis se realiza cuando observamos asas intestinales libres, no cubiertas por peritoneo, flotando en el líquido amniótico. Protruyen por una zona de defecto baja paramedial, generalmente derecha, con la inserción umbilical indemne11 (Figura 6). El defecto es posible identificarlo en el examen de las 11 a 14 semanas (Figura 7)12.
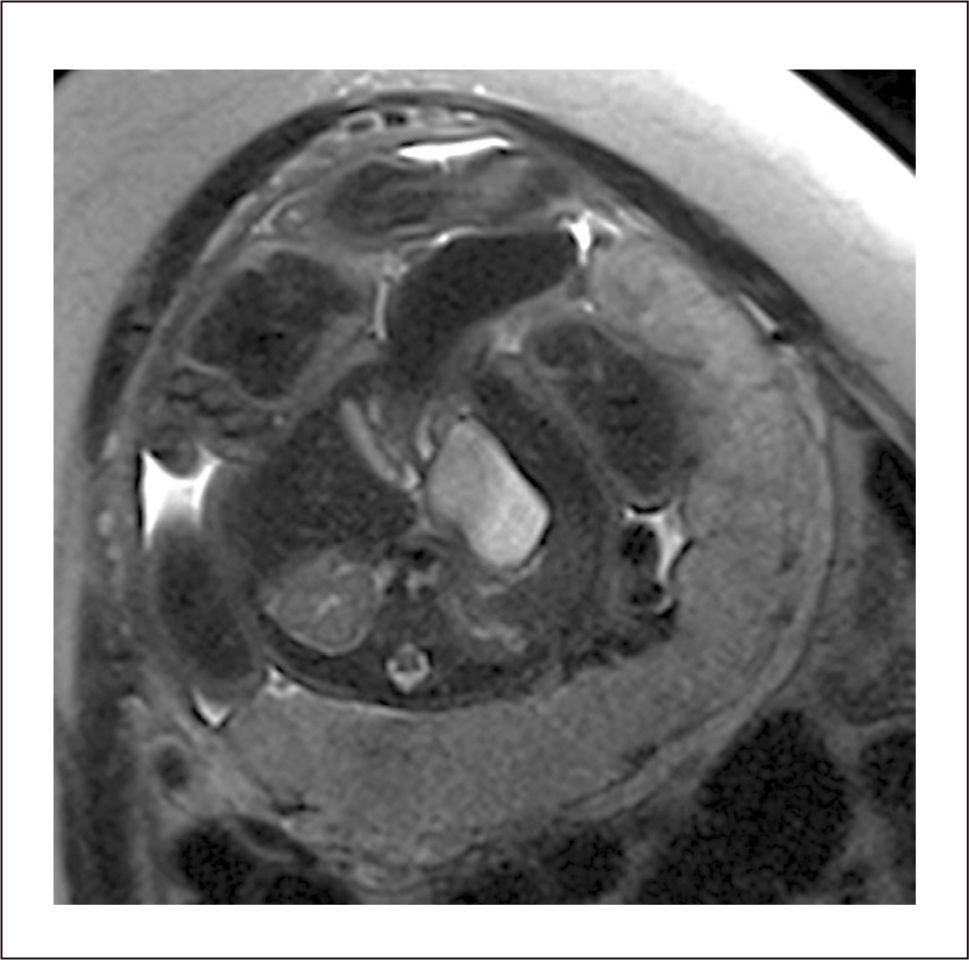
Pronóstico. Una de las complicaciones que ocurre es la isquemia de las asas intestinales extra abdominales. El mecanismo no es del todo conocido, pero sería secundario a la compresión del anillo del defecto sobre las asas intestinales. Estas asas isquémicas se dilatan, su pared es edematosas y podrían necrosarse13. Recomendamos un seguimiento estricto de estos casos desde la semana 30 con el fin de identificar estos signos, algunos autores consideran que una dilatación de asas intestinales mayor a 14mm o una pared intestinal con un grosor de 3mm es una indicio de mayores complicaciones postnatales como atresia intestinal, aumento en los días de hospitalización en terapia neonatal, deterioro en la recuperación postquirúrgica (Figura 8)14. La resonancia magnética ha resultado de gran utilidad para identificar si el asa dilatada efectivamente es intestino delgado isquémico o asa de intestino grueso con la dilatación que normalmente ocurre a término (Figura 9).
Dentro de las complicaciones gastrointestinales en la gastrosquisis está el intestino corto, rotación de intestino patológica, pueden producir vólvulo, obstrucción, isquemia o atresia intestinal. Es rara la asociación con otras anomalías estructurales.
Una de las complicaciones perinatales que más se ha asociado a gastrosquisis es el nacimiento prematuro secundario a complicaciones intestinales, pero también asociado a restricción del crecimiento intrauterino. En el año 2013, South y sus colaboradores realizaron un metanálisis con el objetivo de examinar la relación del riesgo de muerte fetal intrauterina en fetos con gastrosquisis, la conclusión fue que incidencia global es mucho menor que la publicada y el mayor riesgo se produce por los nacimientos pretérmino con la relación de cesáreas electivas, por lo que el riesgo o temor de muerte intrauterina no debe ser la principal indicación para un nacimiento electivo pretérmino en los embarazos que se ven afectados por gastrosquisis15.
EXTROFIA VESICAL Y CLOACALLa extrofia vesical es un defecto en el plegamiento caudal de la pared abdominal que tiene un rango de alteraciones desde la epispadia hasta la exposición de la pared posterior de la vejiga a la cavidad amniótica16.
Incidencia. La incidencia de la extrofia vesical es de 1: 30000 recién nacidos.
Diagnóstico. Su diagnóstico ecográfico es en base a visualizar una inserción del cordón umbilical más baja de lo habitual, la ausencia persistente de la vejiga en la región pélvica pero con un volumen normal de líquido amniótico y asociado a una masa hipogástrica con protrusión de asas. Los riñones generalmente se observan sin alteraciones, puede observarse un pene pequeño17 (Figura 10). Los hallazgos asociados incluyen alteraciones genitourinarias con extensión del defecto de la vejiga hasta la uretra, descenso incompleto de los testículos y hernia inguinal bilateral.
Por otro lado, encontramos la extrofia cloacal (prevalencia 1:200000, también conocida como complejo OEIS) es la asociación de un defecto urinario y gastrointestinal caracterizado por la presencia de onfalocele, extrofia vesical, ano imperforado, espina bífida. El diagnóstico de extrofia cloacal es a menudo difícil, pero puede hacerse principalmente cuando es una anomalía compleja que afecta al tracto gastrointestinal y la columna vertebral.
Diagnóstico diferencial: Incluye todos los demás defectos de pared abdominal anterior como onfalocele, gastrosquisis y extrofia cloacal.
Pronóstico. La sobrevida, luego de complejas cirugías reparativas, es alrededor de 80%, con la intervención quirúrgica necesaria para el cierre primario o escisión con derivación urinaria18.
PENTALOGÍA DE CANTRELLTambién conocida como ectopia cordis toracoabdominal, síndrome de Cantrell-Heller-Ravitch, síndrome de pentalogía y hernia diafragmática peritoneo-pericárdica. Incluye la variedad toracoabdominal de la ectopia cordis y en la que se asocian cinco anomalías: defecto epigástrico de la línea media abdominal supraumbilical, defecto del tercio inferior del esternón, deficiencia del segmento anterior del diafragma, defectos pericárdicos y malformaciones cardíacas congénitas. Sin embargo, no todos los casos expresan las cinco características por lo que en 1972, Toyama sugirió la siguiente clasificación, que depende de los hallazgos clínicos de la pentalogía y que tiene que ver con el pronóstico y el tratamiento de la enfermedad.
Clase 1: diagnóstico exacto; se aprecian los cinco defectos descritos por Cantrell.
Clase 2: diagnóstico probable, con cuatro defectos (que incluyen las anomalías intracardiacas y de la pared abdominal).
Clase 3: diagnóstico incompleto, combinaciones variables de los defectos (siempre incluyendo las anomalías esternales)19.
Incidencia: En países desarrollados es de 5.5 por un millón de recién nacidos vivos. El sexo masculino es el más afectado (2:1). La mayoría de los casos son esporádicos, aunque se ha encontrado asociación con herencia familiar, herencia dominante ligada al cromosoma X, diferentes aneuploidías como trisomía 18 y 21, infección viral, exposición a sustancias tóxicas como amino-propionitrilo y teratógenos como la quinidina, warfarina, talidomida e incluso a la deficiencia de vitamina A.
Etiopatogenia: La teoría más aceptada es un fallo en el desarrollo embrionario de un segmento del mesodermo lateral entre los 14-18 días de gestación. Por lo que el septo transverso del diafragma no se desarrolla y las columnas bilaterales mesodérmicas del abdomen superior no migran ventromedialmente y así los órganos de las cavidades torácica y abdominal, se evisceran20.
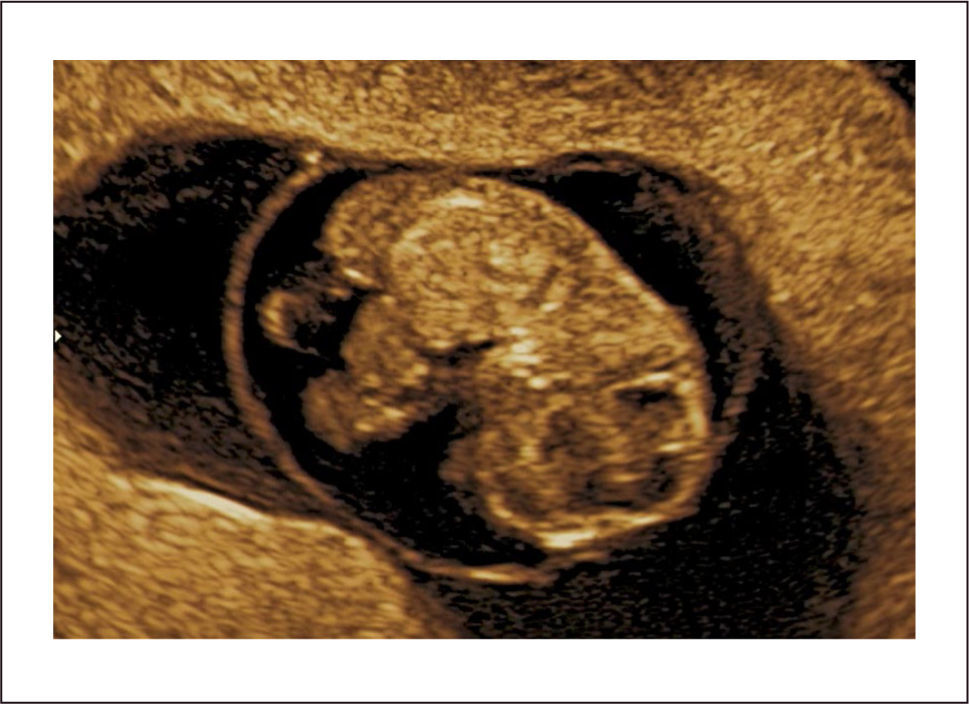
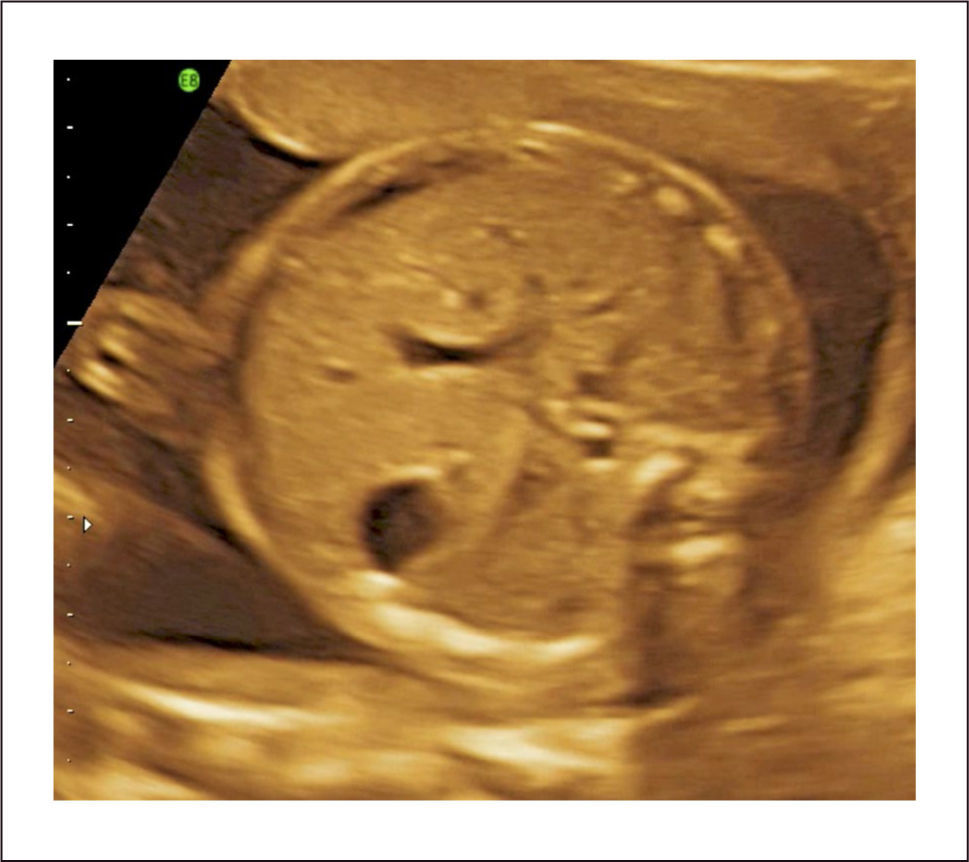
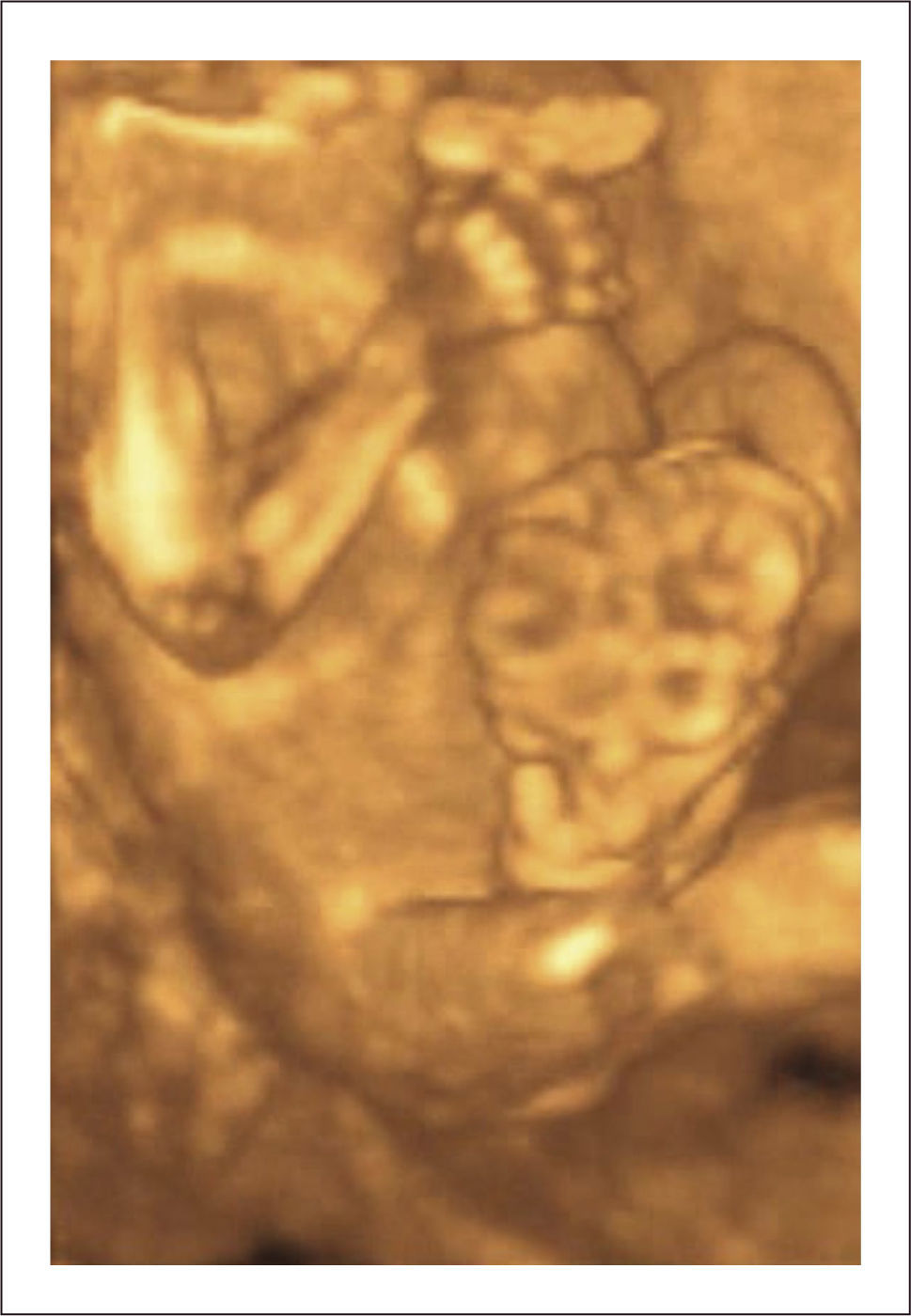
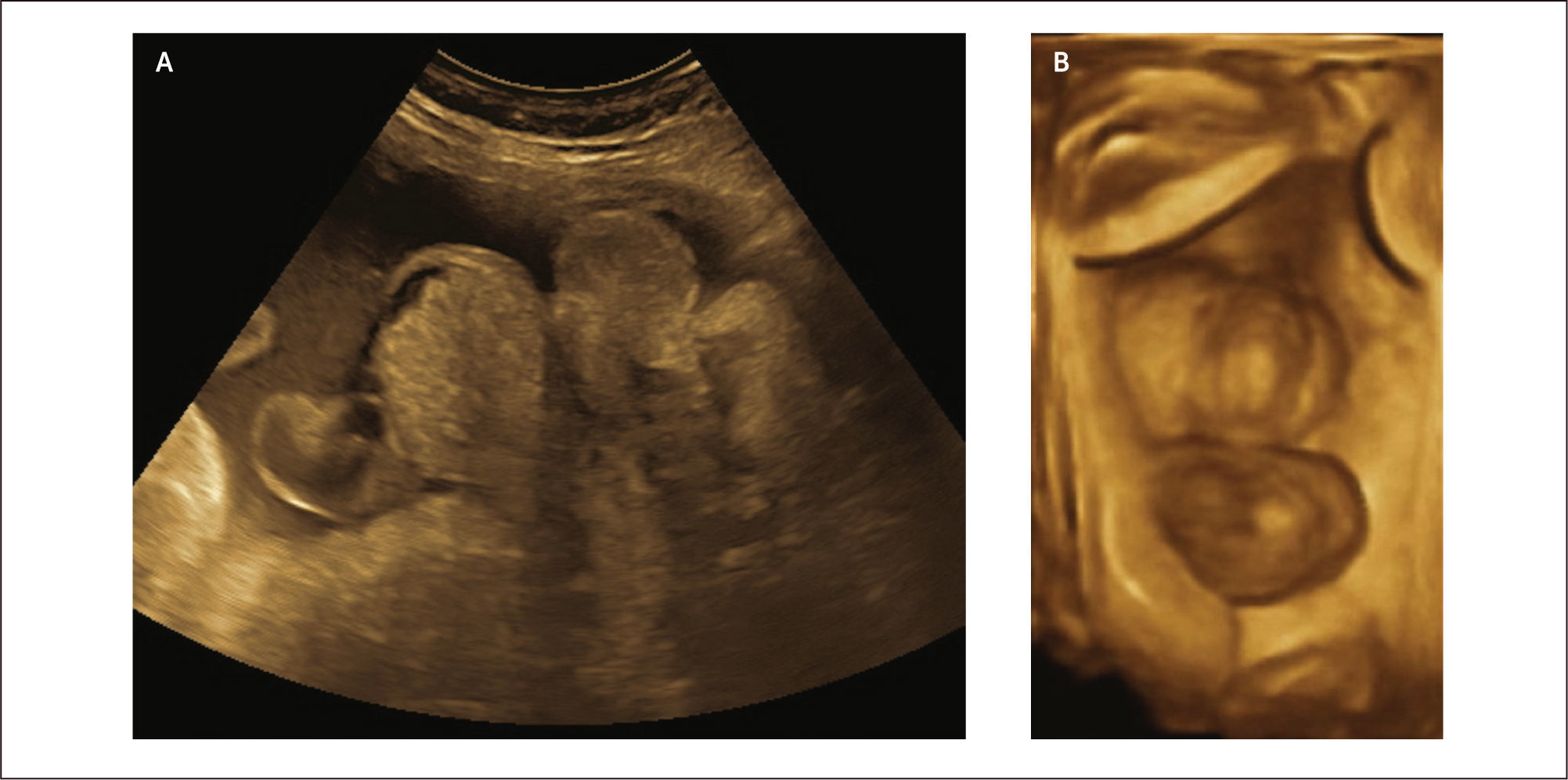
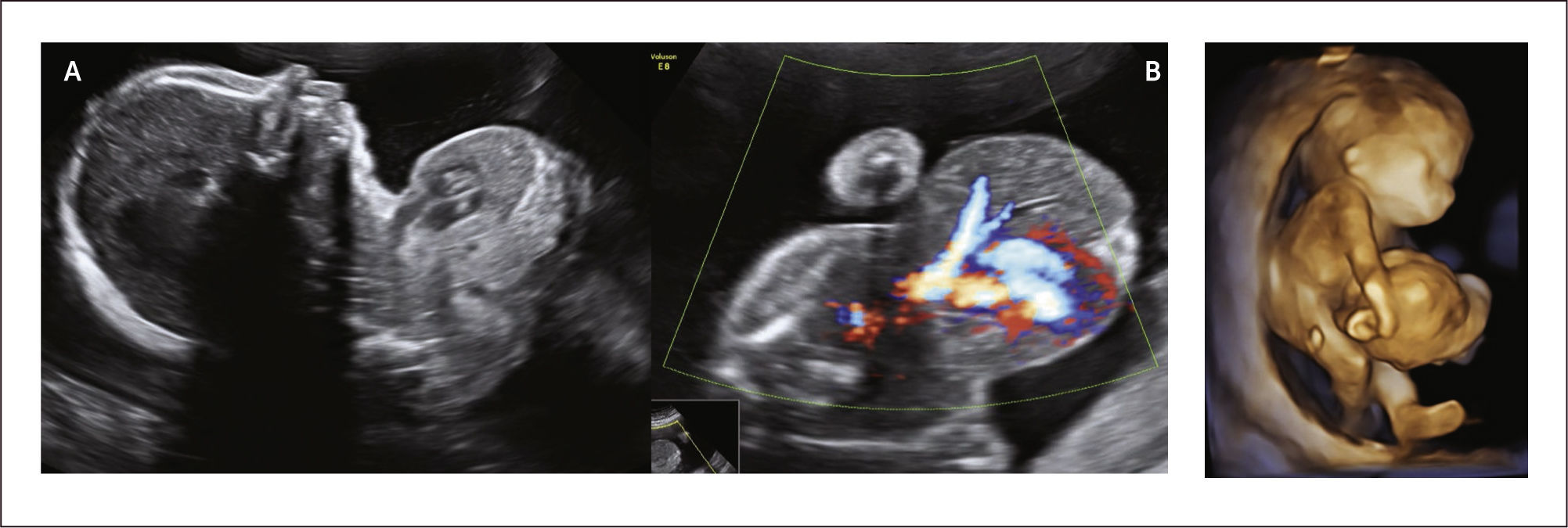
Diagnóstico: Se puede realizar tempranamente, alrededor de las 10 semanas de gestación con la utilización de la ecografía bi y tridimensional (Figura 11 a y b).
Diagnóstico diferencial: El principal es con ectopia cordis aislada: en la pentalogía de Cantrell, el corazón tiene una ubicación normal en el tórax: “ectopia cordis toracoepigástrica”, en tanto que en la ectopia cordis el corazón posee localización ectópica y puede no incluir defecto pericárdico, diafragmático o de pared abdominal; en la “ectopia cordis verdadera” existe una fisura esternal completa que causa que el corazón aparezca fuera de la cavidad torácica. En el síndrome de bandas amnióticas puede asociarse a ectopia cordis, para dar lugar a defectos costoesternales, gastrosquisis o defectos supraumbilicales, diferentes de los producidos cuando la ectopia cordis se asocia a defectos de la línea media con onfalocele y hernia diafragmática. Otros diagnósticos diferenciales son defectos aislados de la pared abdominal, anomalías troncocorporales, síndrome de Beckwith-Wiedemann, osteogénesis imperfecta, alteraciones en la mineralización, alteraciones cromosómicas, body stalk, complejo OEIS (onfalocele, extrofia vesical, ano imperforado, defectos espinales) y con el síndrome de Donnai-Barrow. La hendidura esternal, cuando está comprometida la parte inferior del esternón, generalmente se asocia a ectopia cordis toracoabdominal o a pentalogía de Cantrell aunque con mayor mortalidad; la forma más frecuente es la hendidura parcial y superior21.
Pronóstico: El manejo obstétrico debe incluir una búsqueda exhaustiva de las anomalías asociadas, sobre todo cardíacas (CIV, Tetralogía de Fallot, Doble salida del Ventrículo derecho) y la realización de cariotipo. El diagnóstico debe efectuarse dentro del primer trimestre de la gestación y, de corroborarse, el manejo obstétrico deberá hacerse en centros especializados, ya que el pronóstico de la enfermedad dependerá del manejo oportuno y de las malformaciones asociadas. El parto por cesárea aparentemente no ofrece ventajas, sin embargo algunos autores consideran que disminuye la posibilidad de infección o de ruptura visceral. La gran mayoría de los niños que fallecen dentro de las primeras horas de vida extrauterina es debido a alteraciones respiratorias y hemodinámicas por herniación de las vísceras, sepsis, perforación y torsión intestinal con obstrucción, insuficiencia cardíaca por compresión de la vena cava que impide el retorno venoso al corazón o por torsión de los grandes vasos, arritmias cardíacas letales y desequilibrio hidroelectrolítico. Son factores de mal pronóstico la extensión del defecto toracoabdominal, la anomalía cardíaca congénita asociada y la presencia de otras malformaciones extracardiacas.
LIMB BODY WALL COMPLEX (COMPLEJO MIEMBRO-PARED)Es una enfermedad rara, se caracteriza por un defecto muy severo de la pared abdominal originado por la falta de formación de aéreas del tronco y de miembros inferiores, asociado a trastornos disruptivos.
Incidencia: Se puede encontrar en 1 de 14000 a 42000 embarazo. La incidencia de este defecto rara de 0.21-0.31/10000 nacidos vivos.
Etiología: No se conoce a el porque se origina este defecto, ni se han identificado agentes etiológicos o asociación con defectos genéticos o cromosómicos, pero existen varias teorías que pueden explicar su origen, Hunter et al. propuso el inicio del defecto en la etapa de disco embrionario y que parte de las anomalías asociadas son las complicaciones secundarias al trastorno primario en la embriogénesis.
En 1987, Van Allen sugirió 3 mecanismos etiológicos de este defecto:
- 1.
Obstrucción mecánica secundaria a bandas amnióticas o adhesiones (16%).
- 2.
Ruptura mecánica del amnios en presencia del celoma extraembrionario o por adhesión del amnios a tejido embrionario necrótico posterior al evento disruptivo inicial.
- 3.
Anormalidades en el disco germinal / deformación vs hemorragia (44%)22.
En cuanto a su presentación clínica, Russo describe dos fenotipos dependiendo el mecanismo patogénico. En el primero existen, defectos craneofaciales, bandas amnióticas y adhesiones, lo cual se ha relacionado con disrupción vascular temprana. Y en el segundo grupo, no se observa la presencia de defectos craneofaciales, pero existen anomalías urogenitales, atresia anal, unión abdomino-placentaria, mielo meningocele lumbosacra y cifoscoliosis con persistencia del celoma extraembrionario. Describiendo o identificando el fenotipo de tipo placento-craneal y placento-abdominal.
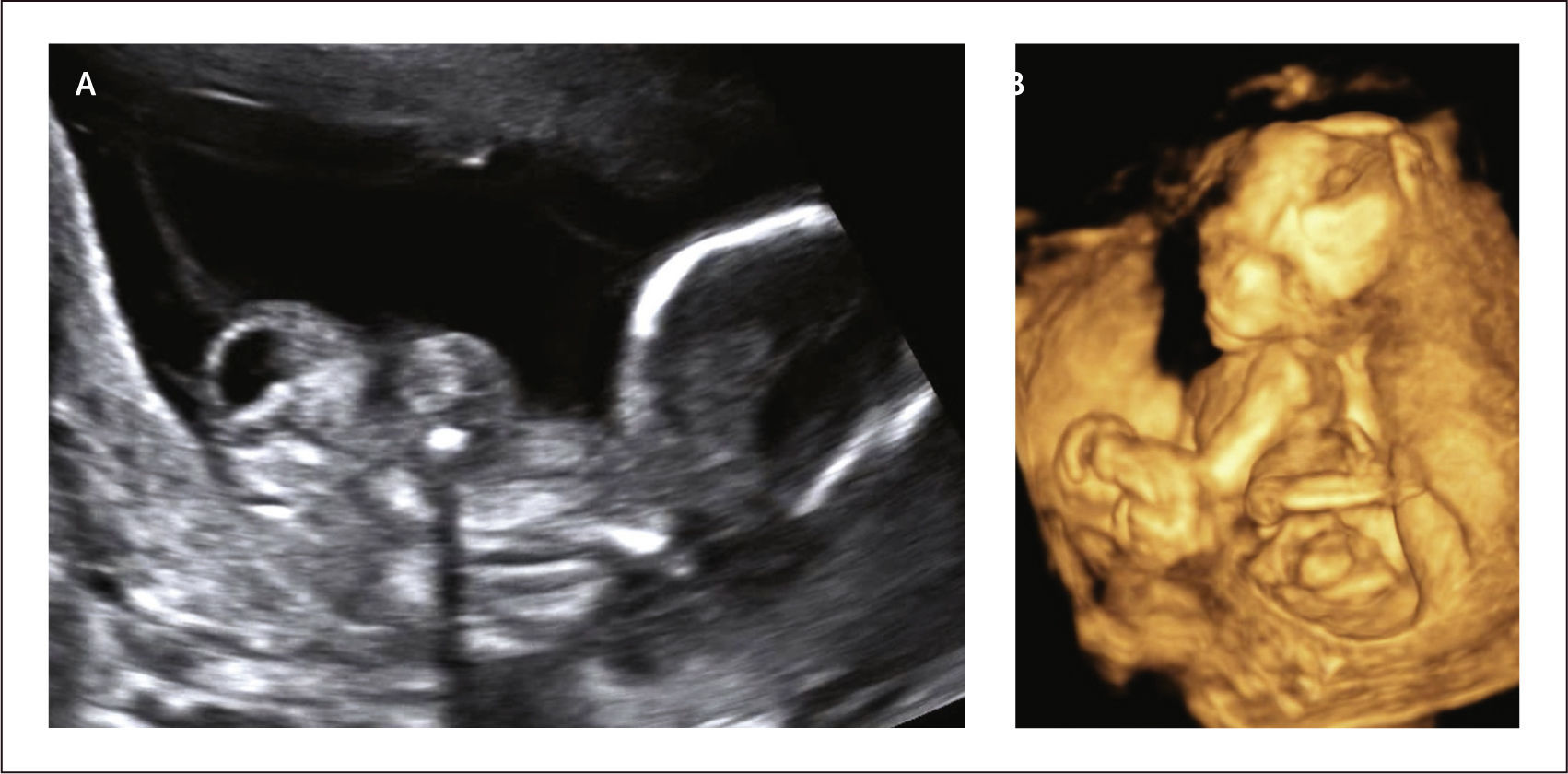
Diagnóstico: Por ultrasonografía se puede realizar el diagnóstico con la presencia de dos de tres de las siguientes características: Excencefalia o encefalocele con hendiduras faciales, toracosquisis o abdominosquisis y defectos de las extremidades, en combinación de un gran defecto de la pared abdominal con protrusión de la vísceras, una escoliosis espinal severa y una yuxtaposición continua del feto a la placenta (Figura. 12). Dada la dificultad para diferenciar las patologías, dentro de este grupo se ha incluido al tallo corporal o body stalk, que es un defecto severo de la pared ventral como resultado del mal desarrollo de las hojas embriológicas cefálica, caudales y laterales que resulta en la falta de desarrollo y formación del cordón umbilical con órganos abdominales fuera de la cavidad y pueden estar fusionadas a la placenta, originalmente fue descrita en 1906 por Keramauner y el diagnóstico se realiza al visualizar la presencia de órganos abdominales fuera del celoma extraembrionario, cordón umbilical “corto” y solo dos vasos umbilicales. Algunos sugieren que un dato que pudiera discrepar en el tallo corporal es que por lo general no está asociado con anormalidades craneofaciales o de las extremidades, aunque para fines prácticos se agrupa en esta patología23.
Malformaciones asociadas: Se han asociado alteraciones externas (defectos craneofaciales, extrofia cloacal y defectos de las extremidades) y alteraciones internas en el 95% de los casos que incluyen defectos cardiacos (56%), ausencia de diafragma (74%), atresia intestinal (22%) y anormalidades renales como agenesia, hidronefrosis o displasia (65%)
Diagnóstico diferencial: Los principales diagnósticos a diferenciar son la secuencia de bandas amnióticas y el síndrome de cordón corto.
Pronóstico: Malo para la función y para la vida, por lo que la detección oportuna de esta patología permite preparar y orientar a la familia sobre el pronóstico y explicar que no hay riesgo de recurrencia en esta anomalía. Es importante llevar el seguimiento de estos fetos para valorar la vitalidad y en caso de presentar actividad uterina no está indicada la tocolisis, ni la utilización de inductores de madurez pulmonar. La interrupción del embarazo es por indicación obstétrica24.
El diagnóstico prenatal de las malformaciones de la pared abdominal nos permite, según corresponda, un manejo perinatal adecuado con ocurrencia del parto en centros donde la cirugía de este grupo de malformaciones pueda realizarse. También nos permiten dar a los padres una adecuada consejería y asesoría mediante el manejo multidisciplinario de estas enfermedades, donde incluimos, además de los especialistas en medicina materno fetal, a neonatólogos, cirujanos infantiles, psiquiatras, psicólogos, etc., que permitan el mejor pronóstico de este paciente no nacido.
Los autores declaran no tener conflictos de interés, en relación a este artículo.
Las imagenes de este artículo han sido autorizadas para su publicación.