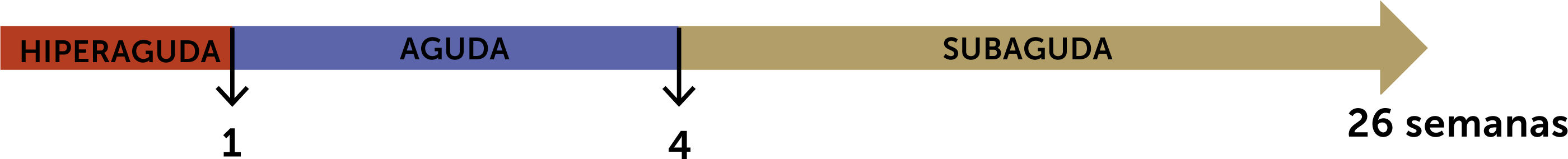La falla hepática fulminante (FHF) es una patología poco frecuente con una alta mortalidad. Requiere un rápido diagnóstico, manejo etiológico, cuando es posible, y una terapia de soporte adecuada en la Unidad de Cuidados Intensivos en la espera de la recuperación hepática o bien cuando esto no ocurre, en la espera del tratamiento definitivo de rescate que es el trasplante hepático. Es necesario una protocolización del manejo, para realizar una práctica sistemática, reproducible y evaluable de la atención clínica que requieren estos pacientes por un equipo multidisciplinario con el fin de mejorar su pronóstico. Este artículo describe una propuesta de protocolo de manejo de FHF en pacientes adultos que se realiza en Clínica Las Condes.
Fulminant hepatic failure (FHF) is a rare condition with a high mortality. It requires a prompt diagnosis, etiological management, when possible, and adequate supportive therapy in the Intensive Care Unit in the expectation of liver recovery or when this does not occur, waiting for the definitive rescue treatment that is liver transplantation. A management protocol is necessary to carry out a systematic, reproducible and evaluable practice of the clinical care required by these patients by a multidisciplinary team in order to improve their prognosis. This article describes a proposed protocol for the management of FHF in adult patients that is performed at Clínica Las Condes.
La Falla Hepática Fulminante (FHF) es una patología infrecuente, pero que debe ser reconocida en forma temprana como emergencia médica, dado su elevado riesgo de mortalidad1. La real prevalencia e incidencia de la FHF son desconocidas. Hay reportes de incidencia de 5 casos por 100000 habitantes/año en países desarrollados2. Se estima una incidencia de 2000 casos/año en Estados Unidos3 y hasta un 8% de los trasplantes hepáticos son por esta causa en base al Registro Europeo4.
Un estudio de 2070 pacientes con FHF en 31 centros de enfermedades hepáticas y trasplante en Estados Unidos comparó la sobrevida en dos periodos de 8 años, periodo 1998-2005 y periodo 2006-2013. La principal causa de trasplante fue la toxicidad por paracetamol, siendo el 53% de los casos en el segundo periodo. Se mostró un incremento en la tasa de sobrevida global de 67.1% vs 75.3%, la sobrevida libre de trasplante (SLT) 45.1% vs 56.2%, y la sobrevida pos trasplante (SPT) 88.3% vs 96.3% en forma significativa. La necesidad de enlistamiento para trasplante disminuyó de un 43.5% a un 32.2% en el segundo periodo. Esto sugiere que un mejor manejo de soporte intensivo ha impactado en la SLT y la SPT3.
En Chile, el número de pacientes que padece esta enfermedad no es completamente conocido, probablemente por un sub registro, falta de derivación a centro de referencia y existencia de múltiples centros privados y públicos sin unificación de la información, la cual se limita a aquellos que llegan a enlistarse como urgencia para un trasplante hepático (TH).
En una revisión retrospectiva de dos centros de referencia público y privado en Santiago, entre 2001 y 2014 se diagnosticaron 168 casos de FHF, donde las principales etiologías fueron hepatotoxicidad idiosincrática inducida por fármacos 30%, hepatitis autoinmune 20% e indeterminado 20%. De los pacientes enlistados (60.7%): 42% se trasplantaron, 44% fallecieron y 13.7% sobrevivieron sin necesitar un trasplante4.
El Comité de Trasplante Chileno hizo una revisión de los trasplantes hepáticos realizados entre octubre de 2011 a diciembre de 2014. De un total de 573 trasplantes, el 9.2% fue por FHF en adultos, con una sobrevida pos trasplante de 57.7% a 12 meses5, siendo menor que los estándares internacionales de 80%8.
2Definición y fundamentosLa Falla Hepática Fulminante (FHF) resulta de un daño agudo y grave provocado por distintas causas que generan disfunción de síntesis hepática definida operacionalmente por la prolongación del INR (International Normalized Ratio)>1.5 y encefalopatía hepática (EH) de cualquier grado de severidad (grados I-IV de West Haven). Esto, en un plazo menor a 26 semanas desde el comienzo de los síntomas y en personas sin una enfermedad hepática previamente conocida6–8.
La FHF requiere un rápido diagnóstico, manejo etiológico, cuando es posible, y una terapia de soporte adecuada en la Unidad de Cuidados Intensivos en la espera de la recuperación hepática o bien, cuando esto no ocurre, en la espera del tratamiento definitivo de rescate que es el trasplante hepático.
Existen guías y recomendaciones internacionales como la European Association for the Study of Liver (EASL)8 y la American Association for the Study of Liver Diseases (AASLD)9 respecto al manejo de soporte de la falla hepática y todas las complicaciones multisistémicas asociada a ella. Estas recomendaciones son basadas en estudios retrospectivos y de casos en su mayoría, dado que grandes trabajos prospectivos son escasos en esta rara enfermedad.
No existe una guía chilena práctica publicada, de recomendaciones para el manejo de la FHF. Es necesario una protocolización del manejo, para realizar una práctica sistemática, reproducible y evaluable de la atención clínica que requieren estos pacientes por un equipo multidisciplinario, con el fin de mejorar su pronóstico.
En consecuencia, el objetivo de este artículo es describir el protocolo de enfrentamiento y manejo de la falla hepática fulminante en pacientes adultos que se ha implementado en nuestro centro de salud desde el año 2016. Esperamos que esta aproximación de protocolo pueda entregar algunas herramientas y algoritmos que podrían ser útiles para todo el equipo de salud que se vea enfrentado a pacientes con esta enfermedad.
Metodología usada para la construcción del protocolo
Se revisaron las principales guías internacionales existentes antes mencionadas8,9 y su aplicación clínica en nuestro centro. Se discutieron diversos temas controvertidos en el manejo tales como, uso de antibióticos profilácticos, indicación de captor de presión intracraneana (PIC), manejo específico en FHF por hepatitis autoinmune con MELD alto, corrección de coagulopatía, entre otros. Basados en la literatura existente y en la experiencia individual y grupal de la Unidad de Hepatología y Trasplante de nuestro establecimiento, con el aporte de especialistas de distintas áreas como infectología, hematología, neurocirugía y medicina intensiva se planteó una postura de manejo local.
Considerando que la optimización del manejo de soporte intensivo ha sido uno de los pilares de los mejores resultados en sobrevida en el último tiempo en pacientes con FHF creemos que la aplicación de esta guía requiere un tiempo prolongado para poder incorporar un número de pacientes significativo para evaluar su impacto en términos de sobrevida.
3Aspectos generales de temporalidad y3.1etiologíaAntes de discutir el protocolo de manejo general se hará hincapié en la evaluación clínica completa realizando anamnesis al paciente y sus familiares para obtener la mayor cantidad de información, revisión de exámenes previos y así conocer la temporalidad en la evolución del caso.
Es importante la clasificación según el tiempo transcurrido entre la aparición de la ictericia y el desarrollo de encefalopatía hepática, dado que son orientadores de posibles etiologías con diferentes pronósticos. Una de las clasificaciones más utilizadas es la de O’Grady, 1993, que divide según evolución hiperaguda (<1 semana), aguda (1-4 semanas), y subaguda (5-12 semanas)10 (fig. 1).
Las FHF hiperagudas y agudas evolucionan en un periodo corto, horas y días, habitualmente la necrosis es masiva con una probabilidad de recuperación espontánea del orden del 20-30%, sin embargo, tiene mayor riesgo de falla multiorgánica. Una de las complicaciones mortales es la hipertensión endocraneana. Es el patrón más típico en la intoxicación por paracetamol, hepatitis vírica A y B e isquemia hepática.
Las FHF subagudas evolucionan durante varias semanas, el riesgo de hipertensión endocraneana es menor y la sobrevida espontánea es menor a 10%, requiriendo en su mayoría de un trasplante para sobrevivir. Patrones más típicos son: Daño hepático por fármacos o Drug Induce Liver Injury (DILI), hepatitis autoinmune y etiologías desconocidas8.
Una buena anamnesis obteniendo información de medicamentos, viajes, condición gravídica, otras patologías y datos de laboratorio pueden orientar respecto a la causa de la FHF. El reconocimiento precoz de la etiología permite entregar el tratamiento específico a dicha enfermedad cuando es posible, favoreciendo la recuperación cuando se detecta en fase inicial.
Las principales causas de FHF y la orientación diagnóstica consensuada se presentan en la tabla 1.
Etiologías y orientación diagnóstica de FHF
| CAUSAS | ORIENTACIÓN DIAGNÓSTICA |
|---|---|
| Toxicidad de Paracetamol: Toxicidad dependiente de la dosis. El riesgo se mide por dependiendo del tiempo transcurrido entre la ingesta del fármaco y su concentración en la sangre (Nomograma de Rumack Mathew)51 | Ingesta conocida o sospechada, bilirrubina baja, transaminasas muy elevadas (>5000) con LDH elevada, falla renal aguda y medición de niveles plasmáticos de paracetamol8. |
| Hepatotoxicidad ó DILI (Drug Induce Liver Injury)• Antituberculosos: Isoniazida; Antiepilépticos: Fenitoina, Ácido Valproico, Carbamazepina• Antibióticos: Ácido Clavulánico, Nitrofurantoína, Cotrimoxazol, Quinolonas• Antifúngicos: Ketoconazol, Itraconazol, Terbinafina.• Antinflamatorios no esteroidales (AINEs)• Estatinas• Anestésicos: Halotano• Otros: Propiltiuracilo, disulfiram, extasis, cocaína,• Quimioterapia contra el cáncer• Inmunoterapia contra el cáncer• Hierbas y suplementos dietarios (HILI: Herbal and dietary supplement Induced Liver Injury): no prescritos para bajar de peso, té verde, hierba de San Juan, Herbalife® etc50,52 | Fármaco consumido en los últimos 6 meses con hepatotoxicidad previamente conocida, productos herbarios y suplementos nutricionales. Evolución generalmente subaguda, con o sin eosinofilia (reacción de hipersensibilidad). Ante dudas respecto a hepatotoxicidad previamente descrita consultar: https://livertox.nih.gov |
| Hepatitis autoinmune | Mujer joven o 4 a 6° década con cuadro agudo o subagudo. Autoanticuerpos ANA/AML/anti LKM1 positivo (80%) e hipergamaglobulina G (60%). Otras enfermedades autoinmunes asociadas. 5% de HAI debutan como FHF. Alto índice de sospecha35. |
| Virus:• Hepatotrópos: virus A, B, D (en portador de virus B) y E.• No hepatotrópos: Epstein Barr (EB), citomegalovirus (CMV), herpes Simplex (HSV) 1 y 2, varicela zoster (VZV), herpes 6.• Otros virus: Fiebre hemorrágica: Fiebre amarilla, dengue | • Hepatitis A: Transaminasa>1000; viajes a zonas endémicas; brotes locales o factores de riesgo.• Hepatitis B: Transaminasas>1000: factores de riesgo; hepatopatía crónica conocida o portador crónico sometido a terapia inmunosupresora potente y reactivación (ej: quimioterapia con rituximab)36 36• Hepatitis E: Mujer embarazada, trasplantado de órgano sólido o viaje a zona endémica. Indistinguible de otras hepatitis virales. Solicitar serología8.Herpes simple 1 o 2 o Zoster: Cuadro sistémico tipo gripe, fiebre alta, lesiones herpéticas orofaríngeas o pélvicas (30-50%). Bilirrubina baja, transaminasas y LDH muy elevada, leucopenia y trombocitopenia; falla renal 65%, coagulación intravascular diseminada (CID) y falla orgánica múltiple (FOM). Mayoritariamente en inmunodeprimidos (trasplantados, embarazadas 3° trimestre y otros). 25% en inmunocompetentes38.Fiebre hemorrágica: cuadro sistémico de tipo gripal, fiebre, manifestaciones hemorrágicas y compromiso hepático. Viajes a zonas endémicas, sin vacunación en caso de fiebre amarilla. Estudio serológico53 36 |
| CAUSAS | ORIENTACIÓN DIAGNÓSTICA |
| Inducido por el embarazo:• Hemolysis, elevated liver enzyme levels, and Low Platelet levels (HELLP)• Hígado graso agudo del embarazo (HGAE) | • HELLP: Embarazo 3° trimestre o postparto. Hipertensión arterial, proteinuria con anemia hemolítica microangiopática, elevación transaminasas y trombocitopenia. Hematoma hepático es una complicación. Criterios diagnósticos: anemia microangiopática con esquistocitos, plaquetas <50.000/mm3, Bil>1,2mg/dl, LDH>600U/L, transaminasas>70U/L39• HGAE: Síntomas iniciales dolor abdominal, vómitos y polidipsia. Elevación leve-moderada de transaminasas, encefalopatía e hígado graso (poco sensible la ecografía). Hipoglicemia marcada. Criterios diagnósticos de Swansea39:Seis o más de los siguientes, en ausencia de otra causa durante el tercer trimestre del embarazo: |
| Vasculares• Isquemia (Hígado de Shock)• Síndrome de Budd Chiari | Antecedente de shock, hipertransaminasemia marcada con LDH elevada, pero rápido descenso tras estabilización hemodinámica. Se puede asociar a falla renal. No siempre es evidente el episodio de hipotensión8.Dolor abdominal, hepatomegalia y ascitis. Enfermedad mieloproliferativa, trombofilia o neoplasia conocida u oculta8 |
| Enfermedad de Wilson | Individuo joven (<40 años), más frecuentemente mujeres, GPT poco elevada, Ratio Bil/FA>2, anemia hemolítica con test de coombs negativo y falla renal. Anillo de Kayser Fleischer (+) (50%)37 |
| Toxinas: Amanita Phalloides | Consumo de amanita (hongos silvestres), cuadro diarreico y falla renal8 |
| Infiltración Maligna (leucemia, linfoma, metástasis) | Hepatomegalia y patrón colestásico generalmente. Contexto clínico. Neoplasia conocida (mama, pulmonar, linfoma y melanoma)8 |
Algoritmo de manejo intrahospitalario
En todo paciente que ingrese con sospecha de FHF debe realizarse la siguiente evaluación:
- 1.
Exámenes iniciales: al ingreso en Unidad de Paciente Crítico (UPC)9
- •
Hemograma, pruebas hepáticas, albúmina, creatinina, electrolitos plasmáticos (ELP), calcemia, magnesemia y fosfemia.
- •
Tiempo de protrombina (INR), tiempo de tromboplastina parcial activada (TTPK) y cuantificación del fibrinógeno.
- •
Factor V de la coagulación (factor independiente de la vitamina K y de síntesis hepática). Considerado como factor pronóstico en criterios de Clichy11.
- •
Gases venosos y/o arteriales si lo amerita.
- •
Lactato.
- •
Amonio (arterial idealmente).
- •
Amilasa y lipasa (dada la asociación entre pancreatitis y toxicidad por paracetamol)
- •
Test de embarazo: gonadotrofina coriónica subunidad Beta.
- •
Creatininquinasa total.
- •
Virus de inmunodeficiencia humana (VIH) (pesquisa).
- •
Evaluación bacteriológica si lleva más de 7 días de evolución, proviene de otro centro o sospecha de infección: Hemocultivos periféricos aeróbicos, hemocultivos de arrastre de catéteres, orina completa y urocultivo, radiografía de tórax, etc. Paracentesis diagnóstica en el caso de ascitis al ingreso: estudio fisicoquímico; fórmula de leucocitos con recuento diferencial; tinción de Gram y cultivo corriente en frasco de hemocultivos aeróbico.
- •
Ecografía abdominal con doppler para evaluar morfología hepática, permeabilidad vascular y presencia de ascitis.
- •
Radiografía de tórax.
- •
Tomografía Axial Computarizada (TAC) de abdomen con contraste (trifásico) sólo frente a casos seleccionados, para evitar toxicidad renal.
- •
TAC cerebral sin contraste (en EH grado III-IV).
- 2.
Estudio etiológico:
- •
Niveles plasmáticos de paracetamol en pacientes con antecedentes de ingesta o de FHF de causa incierta.
- •
IgM hepatitis A.
- •
IgM anticore hepatitis B (anti HBc IgM), y antígeno de superficie hepatitis B (HBsAg).
- •
Anticuerpos anti hepatitis C (muy rara como etiología de la FHF, principalmente como pesquisa en potencial candidato a trasplante).
- •
Anticuerpos anti hepatitis E (IgM e IgG).
- •
Anticuerpos anti nucleares (ANA), anti músculo liso (AML), anti mitocondriales (AMA) y anti LKM-1
- •
Cuantificación de inmunoglobulinas: IgA, G y M
- •
IgM e IgG para virus de Epstein Barr.
- •
IgM e IgG para Citomegalovirus.
- •
Otros según corresponda a determinar por hepatología (ejemplo: ceruloplasmina, cupremia y cupruria 24 horas, IgM Herpes simple 1 y 2 y varicela zoster, estudio parvovirus B19, entre otros).
- •
Biopsia hepática transyugular en casos muy seleccionados.
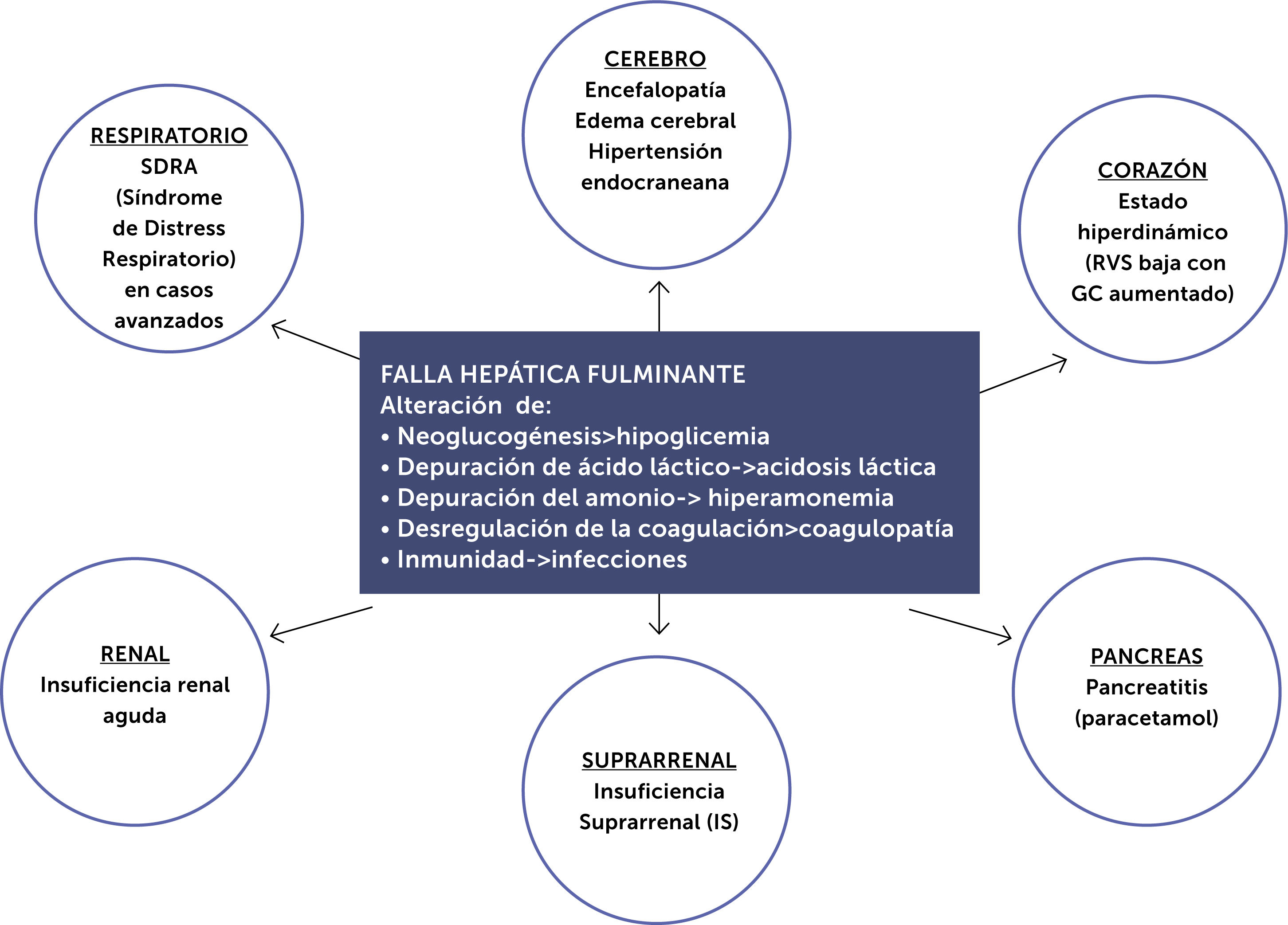
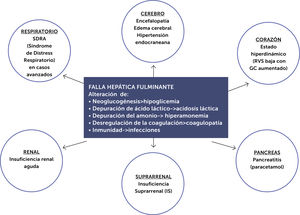
La FHF sin tratamiento específico ni soporte multisistémico puede llevar a disfunción multiorgánica (fig. 2).
- 3.
Tratamiento: El manejo terapéutico tiene 3 pilares:
- i
Manejo general
- ii
Tratamiento específico
- iii
Trasplante hepático
- i.
Manejo general en Unidad de Paciente CrÍtico (UPC)
- A
Encefalopatía hepática (EH)10,12
- 1)
Evaluación de conciencia seriada, cada 2 horas, por enfermera y médico.
- 2)
Evitar sedar a pacientes con EH leve, grado 1-2, para monitorización clínica de estado de conciencia. En caso de crisis de agitación: Priorizar benzodiacepinas e hipnóticos de vida media corta (midazolam y propofol). Si presenta agitación mantenida se debe priorizar la sedación, con intubación si requiere, para no elevar la presión intracraneana.
- 3)
Posición de cuello elevado 30° (no estimular, evitar maniobra de valsalva).
- 4)
Intentar no instalar sonda naso enteral en paciente con EH grado I-II para evitar vómitos o trauma nasal. En caso de vómitos por fármacos (ej: N-acetilcisteína) considerar su instalación o si progresa la EH y requiere intubación; en dicho momento instalar sonda nasogástrica.
- 5)
Hiperamonemia: Lactulosa y rifaximina no han evidenciado beneficio en FHF y la lactulosa puede producir efectos adversos, como distensión de asas intestinales. En pacientes de evolución subaguda podrían tener algún beneficio.
- 6)
Mantener sodio plasmático: 140-145meq/L.
- 7)
Mantener normoglicemia (según protocolo local de UPC).
- 8)
Si progresa a EH grado III/IV o presenta convulsiones, el riesgo de edema cerebral aumenta y se recomienda:
- •
Sedación, intubación endotraqueal y ventilación mecánica.
- •
Mantener natremias 145-155meq/L13.
- •
Realizar TAC cerebral para descartar complicación hemorrágica y edema cerebral severo con herniación del bulbo raquídeo
- •
Se sugiere realizar electroencefalograma (EEG) para descartar status eléctrico no convulsivo (SENC).
Compromiso multisistémico de la falla hepática fulminante.
Modificado de referencia50.
i) Se sugiere el uso de fenitoína en carga y mantención en caso actividad epiléptica persistente. Si bien el perfil de seguridad de esta droga por su metabolismo hepático y riesgo de hepatotoxicidad puede ser cuestionado en la población con FHF, es el anticonvulsivante sugerido por consenso americano9. El uso de levetiracetam pareciera ser una alternativa y se ha comenzado a sugerir su uso en consensos más recientes, aunque faltan estudios para validar su uso en esta población8.
ii) En caso de refractariedad se recomienda benzodiacepinas de vida media corta9.
e) Manejo de edema cerebral e hipertensión endocraneana.b
B. Manejo del edema cerebral e hipertensión endocraneana (HTE)
El avance de la encefalopatía hepática precede al edema cerebral e HTE.
El edema cerebral se presenta hasta en el 35% de las EH III y hasta en el 80% las EH grado IV respectivamente9. La hipertensión endocraneana se presenta en el 30% de las EH graves (grado III/IV)14. Los signos de hipertensión endocraneana (HTE) tales como midriasis, hipertensión arterial y bradicardia son signos tardíos e inútiles para evitar daño cerebral12.
Los factores de riesgo para hipertensión endocraneana (HE) son 1,12,15:
- •
Evolución temporal hiperaguda/aguda
- •
Paciente joven
- •
Falla renal
- •
Necesidad de soporte con drogas vasoactivas
- •
Hiperamonemia persistente>150-200-mol/L.
Monitorización neurológica
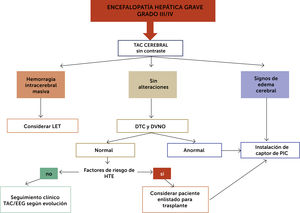
La monitorización invasiva de presión intracerebral (PIC) con captor no ha demostrado beneficio en sobrevida en FHF y puede tener complicaciones hemorrágicas (7%) con mortalidad asociada16. Sin embargo, es de gran utilidad para monitorización y tratamiento de la HE en paciente de alto riesgo de edema candidatos a TH12–14.
Métodos de monitorización no invasiva también se han utilizado para detectar en fase temprana signos indirectos de edema que motiven a una monitorización invasiva, sin embargo, estos métodos no han sido completamente validados en FHF12.
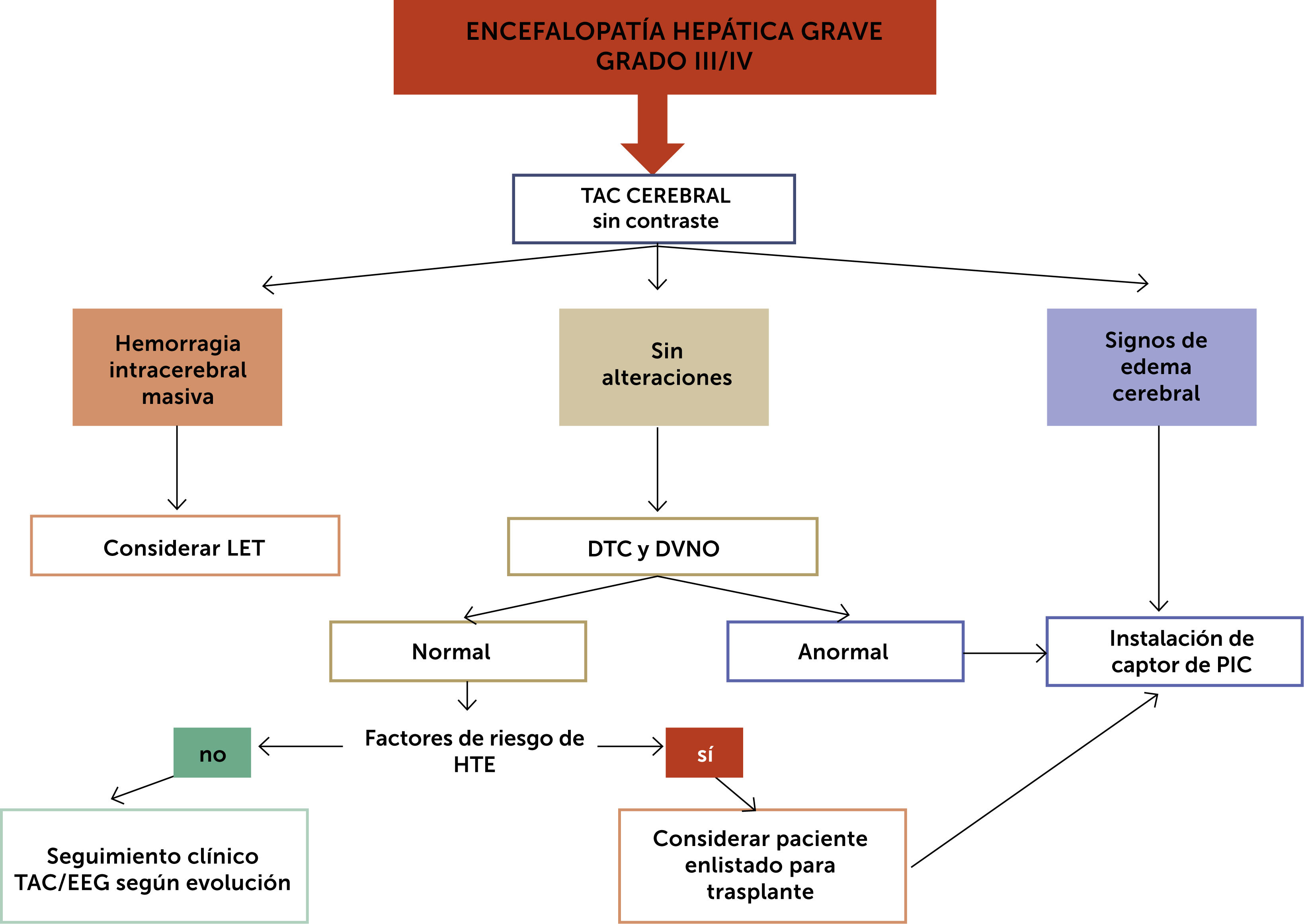
En la fig. 3 se propone un algoritmo de estudio y manejo de EH avanzada, Grado III/IV.
Manejo de la hipertensión endocraneana (HTE)
El objetivo es mantener una Presión Intracraneana (PIC) <20mmHg y una presión de perfusión cerebral (PPC)>50-60mmHg. La refractariedad contraindica el trasplante12.
a) Medidas generales de manejo previamente mencionadas.
b) Mantener sedado preferentemente con propofol y fentanilo en ventilación mecánica invasiva (VMI)
c) Manejo de la osmolaridad plasmática con solución hipertónica para mantener natremia de 145-155 mEq/L.
- •
Bolos intermitentes: NaCl 10% 20ml (4-8 gr) o
- •
Infusión continua: NaCl 3% a 30-100ml/h
d) Mantener PaCO2 límite normal inferior
e) Terapia de reemplazo renal continua (TRRC) en aquellos con encefalopatía avanzada con hiperamonemia>150-200μmol/L y otros factores de riesgo de HE; el objetivo es conseguir un descenso de la amonemia a <100μmol/L. Esta maniobra podría reducir un 38% el valor basal y mejorar la sobrevida libre de trasplante17. Es una terapia de excepción por el momento en pacientes sin falla renal
f) Hipotermia moderada 35° C: Se puede utilizar en el tratamiento de HTE, pero sin beneficio demostrado en prevención de HTE17 y los riesgos son, infección, coagulopatía, arritmias12.
C. Hemodinamia
1. Hipovolemia: Se puede presentar en fase temprana por baja ingesta, vómitos y vasodilatación sistémica con volumen plasmático efectivo reducido. Fenotipo similar a la sepsis y cirrosis con síndrome hepatorenal (resistencias vasculares sistémicas bajas y gasto cardíaco normal o aumentado)8.
Son signos de depleción de volumen la mala perfusión periférica, acidosis metabólica, oliguria y falla renal, pero los parametros de medición, como ácido láctico y saturación venosa central, son de limitada utilidad clínica en casos de falla hepática y perfil hiperdinámico. Para manejo de la hipervolemia se recomienda:
- •
Bolos de solución cristaloide y mantención ajustados a balance para evitar sobrecarga de fluidos.
- •
Evitar sueros hipotónicos.
- •
Albumina intravenosa (IV) podría ser beneficiosa, pero no se recomienda su uso como fluido de primera línea en FHF.
- •
Meta de Presión Arterial (PA) para asegurar perfusión tisular8.
2. Drogas vasoactivas: en caso de persistir la hipotensión arterial luego de una adecuada corrección de volumen:
- •
Instalar catéter venoso central (CVC).
- •
Iniciar con Noradrenalina (NA) y en caso de hipotensión refractaria considerar esteroides por posible insuficiencia suprarenal.
- •
Monitorización de PA con línea arterial.
- •
Se recomienda evaluar la función cardiaca en estos pacientes por método no invasivo de preferencia.
3. Plasmaféresis de alto volumen: En casos muy seleccionados de FHF con EH avanzada y no candidatos a trasplante hepático, se ha demostrado beneficio de la Plasmaféresis de alto volumen (15% del peso corporal ideal de forma diaria, en 3 sesiones, con reposición de plasma fresco congelado) en disminuir el requeri-miento de drogas vasoactivas (DVA), disminuir hiperamonemia y mejorar la sobrevida libre de trasplante19. Es una terapia de excepción por el momento.
D. Respiratorio8
La principal indicación de intubación orotraqueal es para la protección de la via área en paciente que evolucionan a EH grado III/IV. Es poco frecuente observar complicaciones primarias respiratorias en estos pacientes en los primeros días de evolución. Sin embargo, en el paciente ya intubado por necesidad neurológica, en pacientes con requerimiento de politranfusiones, hemodiálisis y estadías prolongadas en UPC el riesgo de complicarse con atelectasias, neumonía, daño por tranfusiones (TRALI en ingles transfusion related acute lung injury) y SDRA aumenta. Las recomendaciones son:
1. Intubación endo-traqueal en caso de progresión de EH a grado III.
2. Sedación previa a intubación con fentanilo y propofol
3. Ventilación protectora: volumen tidal 6ml/kg/peso ideal. Mantener PaCO2 arterial de 35-40mmHg.
4. Kinesioterapia respiratoria al menos 3 veces/día.
5. Cultivos de AETC (Aspirado EndoTraqueal Cuantitativo) periódicos (semanal) en caso de ventilación prolongada. Interpretación según cuadro clínico.
6. En ascitis severa o a tensión considerar paracentesis evacuadora con administración de albúmina intravenosa para prevenir la disfunción circulatoria y renal.
E. Coagulación
La mayoría de las veces se produce un desbalance en la homeostasis de la coagulación y los pacientes con FHF tienen un “estado de coagulación normal” pese a la alteración de los exámenes habituales10. No se recomienda transfundir si no sangra, ya que puede ser deletéreo por aumentar el riesgo de trombosis, de complicaciones pulmonares asociadas a transfusión y alterar la interpretación de exámenes, como tiempo de protombina, para definir la necesidad de trasplante.
Las excepciones que requieren transfusión de hemoderivados son:
- a.
Instalación de captor de PIC
- b.
Hemorragia activa significativa
En dichas excepciones, es importante evaluar:
- Exámenes de coagulación habituales: TTPA, TP (INR), Fibrinógeno, recuento plaquetas.
El tiempo de trombina y productos de degradación del fibrinógeno (Fibrinogen Degradation Product) si están disponibles.
- El tromboelastograma, que es una herramienta que entrega un resultado dinámico del trastorno de la coagulación. Se sugiere usar si está disponible20.
Los objetivos de la transfusión, para estos casos, son:
- Plaquetas>50.000 a 60.000 x mm3
- Fibrinógeno>150 a 200mg/dl
- TP y TTPA corregir a 1.5 veces el normal
- Hemoglobina sanguínea>7g/dl
Según el parámetro alterado, los tratamientos a seguir son:
- Vitamina K (fitomenadiona): 10mg ev. En caso de ser efectivo, se logrará resultado en 4 - 6 horas
- Plasma Fresco Congelado (PFC): aumenta factores de coagulación en 5%. Infusión: 15ml/kg. (1U=150-200ml aprox). De preferencia si además se requiere expansión de volumen. Tiene efecto 5 minutos post administración.
- Complejo de protrombina humana (II, VII, IX y X) (OCTAPLEX 500 UI, 1 ampolla=20ml). Utilizar en hemorragia persistente, procedimiento invasivo alto riesgo y en pacientes con sobrecarga de volumen, como primera opción. Dosis 1-2ml/kg, según severidad de coagulopatía, determinada por el nivel del INR. Dosis máxima 120ml velocidad: 1 – 3ml/min.
- Crioprecipitado: aporta el fibrinógeno. Dosis 1U/10 Kg (1U=30ml aprox).
- Ácido tranexámico: puede ser de utilidad en sangrados graves y en especial si hay aumento de la fibrinólisis, dato que aporta el tromboelastograma. Se debe ser cuidadoso con el uso mantenido, por el riesgo de trombosis.
- Glóbulos Rojos filtrados idealmente, para evitar reacciones transfusionales y disminuir riesgo de infección por citomegalovirus en pacientes seronegativos21.
- Factor VIIa recombinante. Utilizar de forma excepcional, en caso de emergencias, dado el riesgo trombótico22. La dosis habitual es 90 ug/Kg, intravenoso, en bolo de 4-5 minutos. La protrombina se normaliza en 4-5 minutos (vida media 2 horas), no requiere control post administración23.
- Plaquetas: Dosis: 1 U/10 Kg (1U=60ml) ó 1 Concentrado (200cc). Chequear a la hora y 24 horas. Duración 3-5 días, pero puede ser menor, en sangrados graves, por consumo activo y en pacientes sensibilizados. Condiciones especiales que requieren Transfusión de plaquetas son recuentos <10.000 x mm3 y <20.000 x mm3 en paciente con fiebre o infección sistémica24.
F. Renal
Un 40-80% de pacientes con FHF se complican con insuficiencia renal aguda (IRA) y se asocia a mayor mortalidad8.
Los factores de riesgo para la IRA son: mayor edad, FHF por paracetamol, hipotensión arterial, síndrome de respuesta inflamatoria (SIRS) e infecciones.
- 1.
Medidas de prevención: evitar la deshidratación e hipotensión arterial, tratamiento precoz de infecciones, evitar medicamentos nefrotóxicos y uso de medio de contraste.
- 2.
En caso de requerir diálisis, idealmente debe ser terapia de Reemplazo Renal Continua (TRRC).
G. Infecciones
La FHF induce un estado de “inmunoparálisis” por lo cual los pacientes son más susceptibles a infecciones. Estos pacientes tienen mayor riesgo de sepsis y shock séptico (55-90%), principal causa de mortalidad8.
Las infecciones bacterianas más frecuentes son neumonía, infección urinaria, bacteriemia por catéter y bacteriemia espontánea. Los bacilos gram negativos (BGN) son los agentes más frecuentes. Es muy importante conocer la epidemiología local.
La profilaxis de infecciones bacterianas y hongos con antibióticos y antifúngicos respectivamente, ha demostrado beneficio en disminuir el riesgo de infecciones por dichos agentes, pero no ha demostrado beneficio en sobrevida25. Su uso es controvertido por el riesgo de selección y diseminación de resistencia a los antibióticos.
- -
-Recomendamos el uso de antibióticos profilácticos en aquellos pacientes enlistados para trasplante considerando que el desarrollo de sepsis podría ser eventualmente un criterio para desenlistar dicho paciente8.
- -
-Hacer el diagnóstico de infección puede ser difícil dado que los pacientes tienen un estado circulatorio hiperdinámico con variables clínicas que pueden ser confusas y la poca utilidad de parámetros como la PCR y procalcitonina. Debe existir alto índice de sospecha especialmente en pacientes con signos de Systematic Inflammatory Response Syndrome (SRIS), EH en progresión e hipotensión debiendo tratarse con esquemas antibióticos de amplio espectro ajustado a la bacteriología local y/o a su lugar de origen en caso de pacientes trasladados de otras instituciones.
- -
-Sospechar infección bacteriana frente a26:
- •
SRIS, dos o más de los siguientes criterios: Fiebre>38°C o <36°C; leucocitos en sangre>12000 o <4000, Frecuencia cardíaca> 90 x minuto
- •
Deterioro de EH.
- •
Fiebre inexplicada y leucocitosis.
- -
-La FHF es un factor de riesgo para infecciones por hongos, especialmente en pacientes con hospitalización prolongada en UCI. Las infecciones por cándida son más frecuentes. La aspergilosis invasiva deberá sospecharse especialmente en pacientes con falla renal en diálisis, politransfusiones y uso de esteroides por tiempo prolongado (hepatitis autoinmune)27
- -
-Los factores de riesgo para infección por hongos, han sido extrapolados a partor de estudios en pacientes trasplantados hepáticos, como8,27:
- •
Uso previo uso de antibióticos de amplio espectro (>5 días)
- •
Deterioro encefalopatía hepática (EH).
- •
Fiebre que no responde a antibióticos.
- •
Falla renal especialmente en diálisis.
- •
Diabetes.
- •
Considerar en caso de colonización por Cándida en más dos lugares.
Sugerencias:
- 1.
Pesquisa bacteriológica, con tórula rectal y nasal, al ingreso del paciente trasladado de otro centro a UPC y seguimiento periódico según protocolo local.
- 2.
En paciente con criterios de enlistamiento para trasplante, que ingresa por primera vez a UPC y no trasladado de otra institución se sugiere uso de antibiótico profiláctico con piperacilina/tazobactam. Se agregará vancomicina si pesquisa para Staphylococcus aureus meticilino resistente (SAMR) es positivo, si existe algún otro factor de riesgo para ello o si se sospecha sepsis relacionada a accesos vasculares.
- 3.
En aquel paciente con criterios de enlistamiento que ingresa trasladado desde otra institución, se realizará pancultivo (hemocultivos periféricos, hemocultivos de arrastre de catéteres, urocultivo y Aspirado EndoTraqueal Cuantitativo (AETC) si se encuentra en ventilación mecánica invasiva (VMI). Deberá individualizarse la terapia y ésta dependerá del tiempo de hospitalización trascurrido, uso de antibióticos previos, uso de esteroides, así como la epidemiologia de su hospital base. Se agregará fluconazol al esquema antibiótico si cumple factores de riesgo para infecciones por hongos previamente señalados.
- 4.
Seguimiento con cultivos periódicos (bacterianos y hongos) tanto a la admisión como frente a deterioro clínico: Hemocultivos, AETC y urocultivo.
- 5.
Frente a sospecha de nueva infección, pancultivar e iniciar tratamiento empírico de amplio espectro con carbapenémico, vancomicina y fluconazol. Si ha sido tratado previamente con fluconazol reemplazar por equinocandina.
- 6.
Seguimiento con antígeno galactomanano sérico 2 veces por semana en aquellos con FHF con más de 10 días bajo factores de riesgo como uso de esteroides y falla renal en hemodiálisis.
H. Metabólico
Las alteraciones electrolíticas y metabólicas son frecuentes especialmente si hay falla renal asociada8.
- 1.
Control de glicemia cada 2 horas al ingreso y luego ajustar por protocolo glicemia local.
- 2.
Evitar hipoglicemia. Mantener glicemia entre 60 -180mg/dL con infusión continua de solución glucosada 10% o superior.
- 3.
Control y corrección de calcio, magnesio y potasio séricos.
- 4.
La Terapia de Reemplazo Renal Continua (TRRC) debe ser considerada para control de la hiponatremia, otras alteraciones metabólicas y balance de fluidos.
- 5.
Hipofosfatemia es un marcador pronóstico favorable que se asocia a regeneración hepática. Su corrección debe ser cuidadosa.
I. Otros
Se considerará el uso de N acetilcisteina (NAC) en pacientes con FHF de etiología desconocida, no paracetamol con EH leve, grado I-II. Se utilizará en igual posología que sobredosis de paracetamol28.
Se recomienda profilaxis de hemorragia digestiva con inhibidor de bomba de protones29.
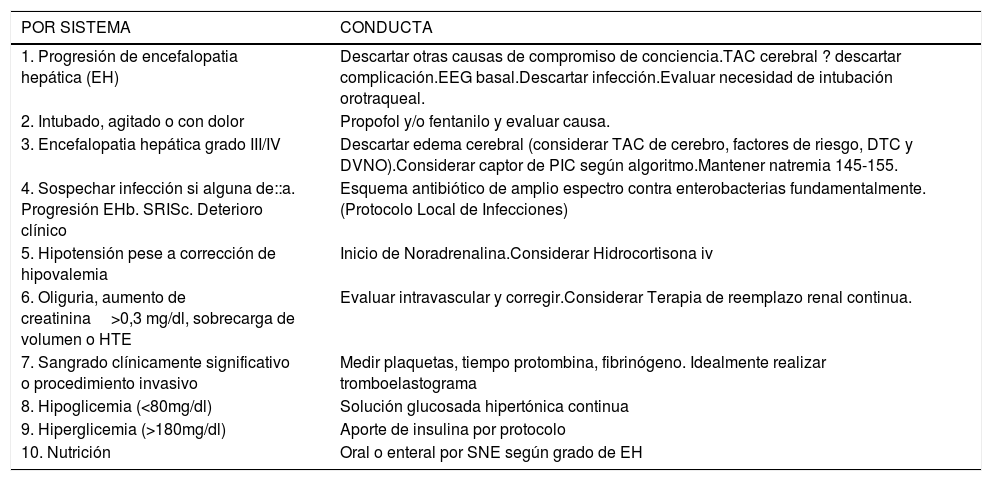
En la tabla 2 se presenta un check list diario de monitoreo multisistémico del paciente con FHF a realizar por equipo de UDC.
“Check list” de monitoreo diario por la UPC
| POR SISTEMA | CONDUCTA |
|---|---|
| 1. Progresión de encefalopatia hepática (EH) | Descartar otras causas de compromiso de conciencia.TAC cerebral ? descartar complicación.EEG basal.Descartar infección.Evaluar necesidad de intubación orotraqueal. |
| 2. Intubado, agitado o con dolor | Propofol y/o fentanilo y evaluar causa. |
| 3. Encefalopatia hepática grado III/IV | Descartar edema cerebral (considerar TAC de cerebro, factores de riesgo, DTC y DVNO).Considerar captor de PIC según algoritmo.Mantener natremia 145-155. |
| 4. Sospechar infección si alguna de::a. Progresión EHb. SRISc. Deterioro clínico | Esquema antibiótico de amplio espectro contra enterobacterias fundamentalmente.(Protocolo Local de Infecciones) |
| 5. Hipotensión pese a corrección de hipovalemia | Inicio de Noradrenalina.Considerar Hidrocortisona iv |
| 6. Oliguria, aumento de creatinina>0,3 mg/dl, sobrecarga de volumen o HTE | Evaluar intravascular y corregir.Considerar Terapia de reemplazo renal continua. |
| 7. Sangrado clínicamente significativo o procedimiento invasivo | Medir plaquetas, tiempo protombina, fibrinógeno. Idealmente realizar tromboelastograma |
| 8. Hipoglicemia (<80mg/dl) | Solución glucosada hipertónica continua |
| 9. Hiperglicemia (>180mg/dl) | Aporte de insulina por protocolo |
| 10. Nutrición | Oral o enteral por SNE según grado de EH |
Ii. Tratamientos específicos:
- 1.
Hepatotoxicidad por Paracetamol: Uso de N-Acetilcisteina (NAC) en caso de:
- a.
Alta cantidad ingerida (más 10-12 gramos en forma aguda, aunque puede ser menos en situaciones especiales: alcohólicos crónicos y desnutridos;
- b.
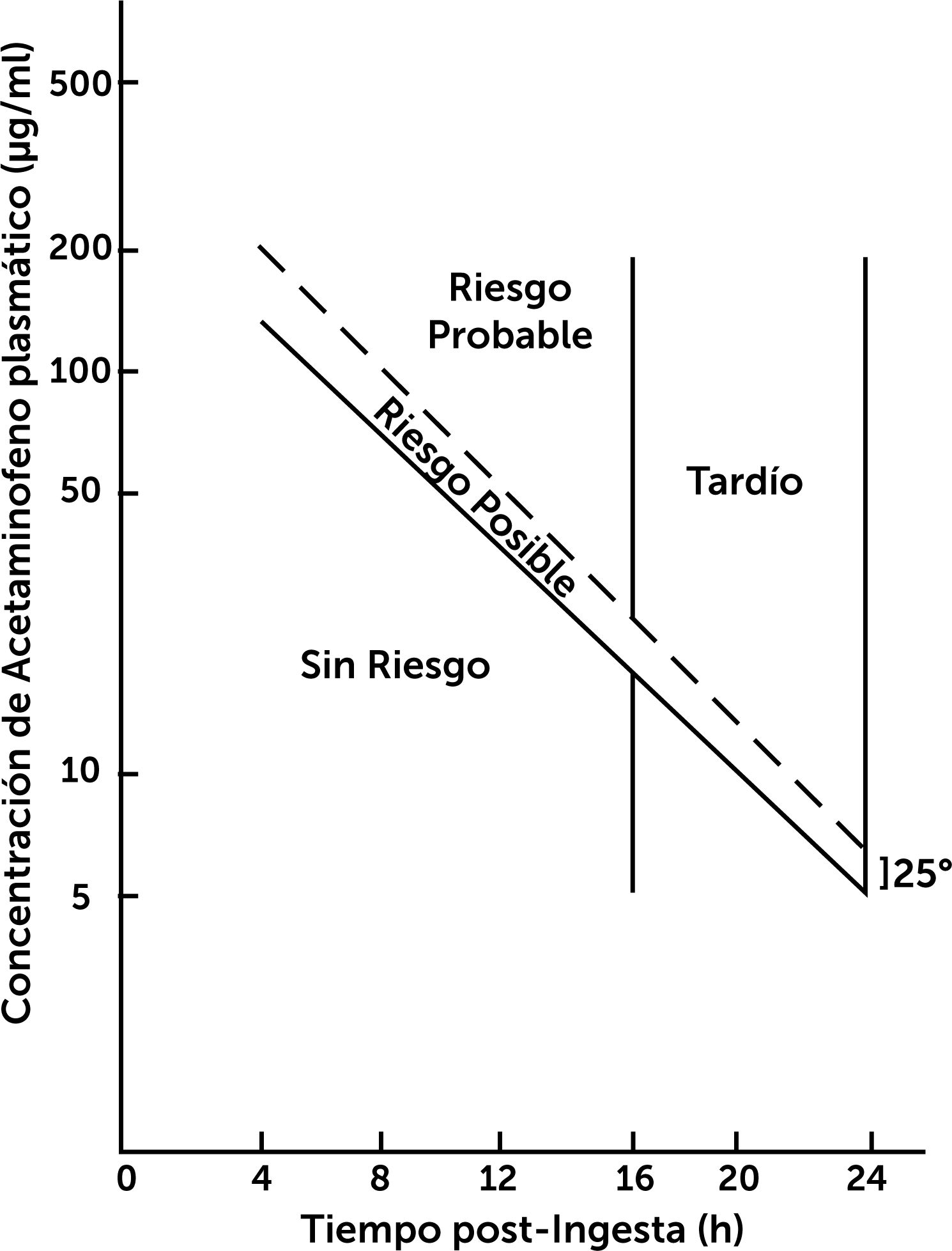
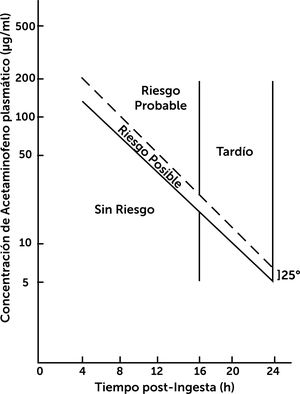
niveles plasmáticos en rango de riesgo según el Nomograma de Rumack Mathew31,32 (fig. 4). Dosis inicial: NAC 140mg/kg (1 dosis) y luego 70mg/kg cada 4 horas (17 dosis) por vía oral o SNG según tolerancia digestiva32,33.
Figura 4.Nomograma de Rumack Mathew.
Riesgo de hepatotoxicidad según niveles plasmáticos de Paracetamol (acetaminofeno) y tiempo transcurrido de su ingesta30.
(0.12MB). - 2.
Hepatitis Autoinmune (HAI) confirmada o altamente probable: En pacientes con HAI una EH leve y MELD<28 serian predictores de respuesta favorable y se recomienda utilizar esteroides a dosis equivalentes a prednisona 1mg/kg/día y con re-evaluación de respuesta precoz. En pacientes con MELD ≥28 y/o EH≥III es discutible su efectividad y existe mayor riesgo de complicaciones infecciosas por lo cual el trasplante precoz podría ser el tratamiento de elección34. La decisión de tratar con esteroides a pacientes con FHF de origen autoinmune debe individualizarse según el grado de EH y MELD del paciente35 así como la disponibilidad de órganos a nivel local.
- 3.
Hepatitis por virus B: Una vez realizado el diagnóstico y previo a iniciar tratamiento se sugiere medir carga viral (CV), HBeAg y anti HBeAg,y en aquellos casos con HBsAg negativo, medir título de anti-HBsAg. Iniciar antiviral entecavir, tenofovir e incluso lamivudina vía oral (VO) con ajuste de dosis según función renal36.
- 4.
Wilson: En general en la presentación aguda fulminante de esta enfermedad no existe ningún tratamiento que mejore la sobrevida a excepción del trasplante hepático (TH)37. En casos de FHF sin criterios de trasplante podría considerarse el uso de penicilamina.
- 5.
Herpes simple: En pacientes con confirmación, sospecha clínica de hepatitis por herpes o de etiología no aclarada. Se recomienda aciclovir 10mg/kg cada 8horas endovenoso38.
- 6.
Preeclampsia/HELLP e hígado graso agudo del embarazo: Interrupción del embarazo39.
- 7.
Síndrome de Budd Chiari: Anticoagulación, derivación portosistémica intrahepática transyugular (TIPS) o trasplante hepático40.
- 8.
Amanita phalloides: Penicilina G (0,5-1 Millon U/kg/día), silimarina (silibinina)41.
- 9.
Hepatitis Isquémica (hígado de shock): Soporte intensivo hemodinámico y tratamiento de la patología de base8.
- 10.
Infiltración tumoral: Soporte y tratamiento de patología de base8.
III. Trasplante hepático
El trasplante hepático está indicado cuando la expectativa de vida sin trasplante es menor que con trasplante en pacientes sin contraindicación para ello. Lo óptimo es contar con modelos pronósticos que permitan discriminar candidatos a trasplante con un alto valor predictivo positivo y negativo. Éstos deben ser simples, precisos, rápido de realizar en forma continua en el tiempo por un equipo con experiencia42. No existe un sistema universalmente aceptado. Los principales modelos con validación son los siguientes (tabla 3):
- a)
Criterios del Kinǵs College (1989): Fue el primer modelo validado y es el más ampliamente usado a nivel mundial43. Varios metaanálisis han demostrado que tiene una alta especificidad 82-94%, con una limitada sensibilidad 68-82%44,45.
- b)
Criterios de Clichy (1986)11: Este modelo basado en el valor del factor V, la edad y la presencia de encefalopatía III/IV tiene un valor predictivo positivo de 82% y valor predictivo negativo de 98%11, sin embargo, estudios posteriores han mostrado menor precisión de éste42.
- c)
El puntaje de MELD(Model for End-stage Liver Disease), con un punto de corte superior a 30.5, tendría una sensibilidad de 77% y especificidad de 72% demostrando ser un buen predictor de necesidad de trasplante46.
Criterios para enlistamiento para Trasplante Hepático de Urgencia
| POR PARACETAMOL | NO PARACETAMOL |
|---|---|
| PH <7.3 luego de reanimación y después de 24 horas de la ingesta (independiente de la encefalopatía) | INR>6.5 |
| Ó | Ó |
| Los tres siguientes criterios:•EH>3•INR >6.5•creatinina >3.4mg/dl | Tres o más de los siguientes criterios:•Etiología indeterminada, por drogas•Edad <10 años o >40años•Intervalo entre inicio de la ictericia y EH >7 días•INR >3.5•Bilirrubina total >17.6mg/dl |
a) Criterios de Kinǵs College43.
Las diferencias entre Criterios de Kinǵs College y MELD son menores, pareciera ser más específico el Kinǵs College y más sensible el MELD46,47. Según un metaanálisis los criterios de Kinǵs College serían más precisos en FHF por paracetamol y el MELD en FHF no paracetamol48.
La guía Europea de FHF sugiere considerar el trasplante en aquellos que cumplen con los Criterios de Kinǵs College o Clichy8 y la guía de la Asociación Americana de Gastroenterología sugiere utilizar el MELD como modelo pronóstico46.
Actualmente en Chile se utiliza las variables pronósticos del Kinǵs College que considera edad, etiología, nivel de encefalopatía, bilirrubina y coagulación. Aquellos pacientes que cumplen dichos criterios pueden ser enlistados como urgencia para TH43. Está en evaluación la incorporación de los Criterios de Clichy y puntaje de MELD ≥30.
Exámenes adicionales a solicitar en candidatos a trasplante de urgencia:
- •
Grupo ABO, Rh
- •
Serologías:
- -
Serología Toxoplasmosis y Chagas.
- -
Virus Linfotrópico de células T (HTLV tipo 1 y 2).
- -
Serología de Sífilis: RPR (Reagina Plasmática Rápida).
- •
Eco abdominal doppler y/o TAC de abdomen trifásico (previamente solicitados).
- •
Radiografía de tórax.
- •
Electrocardiograma y Ecocardiograma transtorácico
- •
Evaluación y pase por cardiólogo
- •
Evaluación y pase por broncopulmonar
- •
Evaluación por psiquiatría para conocer el entorno familiar, educar y fortalecer la red de apoyo para los cuidados pos trasplante.
Experiencia local
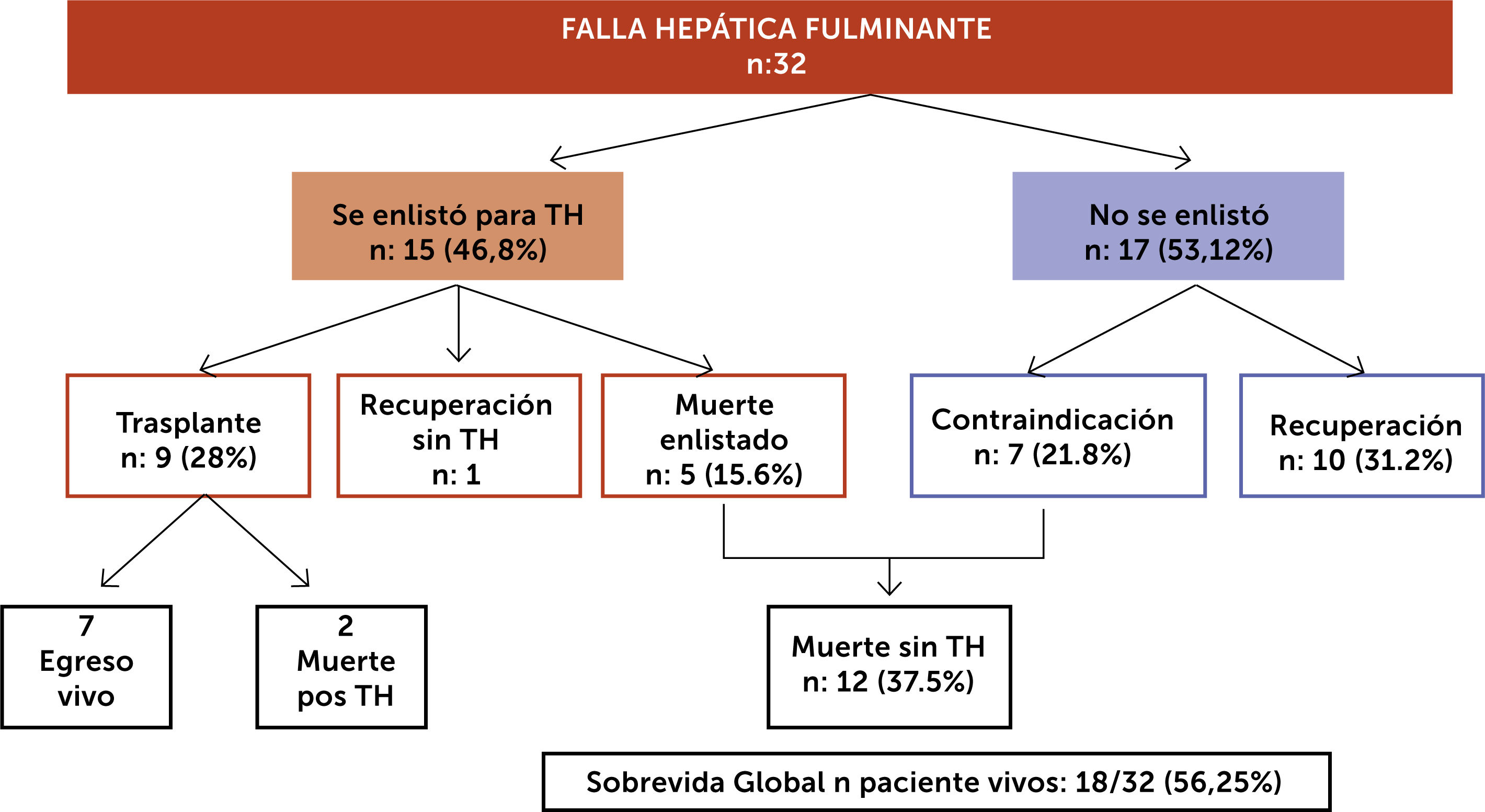
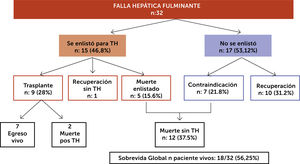
Una revisión de nuestra reciente cohorte de pacientes con FHF diagnosticados entre octubre 2014 a mayo 2018 nos entregó los siguientes datos. De un total de 32 pacientes, 21 fueron mujeres (65.6%) con una mediana de edad 38 años (18-60). La mayoría de los casos eran pacientes derivados de otros centros, principalmente del sistema público cuando se consideró la necesidad de trasplante hepático de urgencia. Las etiologías más frecuentes fueron hepatitis autoinmune (HAI) 13 (40%), virus y fármacos (21% cada uno). La presentación fue aguda en 62%, el resto subaguda. La mediana de MELD fue 32, 62% presentaron encefalopatía hepática (EH) grado III/IV y sólo en 3 pacientes se realizó medición invasiva de presión intracraneana. Las complicaciones fueron insuficiencia renal aguda en 13 (40%) e infección bacteriana 17 (53%). Cinco pacientes utilizaron sistema de soporte externo, cuatro hemofiltración de alto volumen y uno recambio plasmático de alto volumen. Se enlistaron para TH 15 pacientes (46.8%), se trasplantan 9 (28%), dos de ellos fallecen pos trasplante y 5 (15.6%) fallecen en la espera sin trasplante. Se recuperaron sin TH 11 pacientes, (34.3%). No se enlistaron 7 pacientes (21.8%) que tenían contraindicaciones para TH por estar “demasiado enfermos” con disfunción multiorgánica, o comorbilidades graves y todos fallecieron (fig. 5). La mediana de tiempo desde la activación al TH fue de 120 horas (min 24 max 288). El porcentaje de pacientes vivos durante el periodo estudiado fue de un 56.25%. Las variables de mal pronóstico en estudio multivariado fueron la presencia de complicaciones, falla renal, infecciones y hemorragias, (OR 9.42), mayor grado de severidad de la EH (OR 4.1) y la mayor edad (OR 1.06) (IC 95% 1.- 2.3). La derivación tardía de estos pacientes del extrasistema a nuestro centro y la baja tasa de donación de órgano a nivel local con largos periodos de latencia entre la activación y el trasplante podrían asociarse a mayores complicaciones e influir en forma desfavorable en su pronóstico (en prensa)49.
Resultados de cohorte local, 32 paciente con FHF periodo octubre 2014 a mayo 201849
FHF: Falla Hepática Fulminante; TH: Trasplante Hepático.
Creemos que esta propuesta de protocolo podría servir para fortalecer conocimientos del equipo médico que se vea enfrentados a pacientes con FHF, realizando un diagnóstico precoz y tratamiento adecuado, así como una derivación temprana a centros especializados con acceso a trasplante lo cual podría influir en el pronóstico de vida de estos pacientes.
4ConclusiónEsperamos que el objetivo de esta guía de realizar una evaluación sistemática de pacientes con FHF desde la evaluación etiológica y su manejo de soporte intensivo, hasta la valoración de la necesidad de trasplante hepático de urgencia en los casos necesarios sea de utilidad para todo el equipo de salud de los distintos centros de nuestro país. La evaluación de su aplicación y resultados en términos de impacto en sobrevida requerirá de un tiempo más prolongado, su análisis y discusión podría generar mantención o cambios en las conductas tomadas en esta guía a futuro.
5Conflicto de InterésLos autores no tienen conflictos de interés.
Referencias no citadas