Los tumores primarios del cerebro requieren un manejo multidisciplinario. En este artículo se presenta un modelo de tratamiento de los tumores más frecuentes del adulto, siendo el objetivo primordial alcanzar el equilibrio entre sobrevida y calidad de vida. Para este efecto, son agrupados según su clasificación de la Organización Mundial de la Salud (OMS) y se analizan cirugía, radioterapia y quimioterapia según corresponda. Se discute el tratamiento de cada una de estas lesiones considerando el estado clínico del paciente, la localización y tamaño de la lesión y el riesgo de daño funcional del sistema nervioso. En especial, se considera la utilidad de diferentes técnicas que permiten proteger al cerebro durante el tratamiento.
Primary brain tumors require a multidisciplinary management. This article presents a therapy paradigm for the most frequent adult brain tumors, which goal is focused on the balance between survival and quality of life. Surgery, radiotherapy and chemotherapy are analyzed, using World Health Organization (WHO) classification grades. Clinical status, location, size and functional risk are considered in the treatment discussion. Techniques to protect the brain during treatment are specially considered.
Los tumores astrocíticos y oligodendrogliales del cerebro son lesiones que se originan en el mismo tejido cerebral y toman su nombre de los astrocitos, células gliales del sistema nervioso central. Deben diferenciarse de los tumores ependimarios, de plexos coroideos, neuronales, de la región pineal, embrionarios, meningiomas, mesenquimáticos, linfomas, histiocíticos, de la región selar, germinomas y de las lesiones secundarias o metástasis, que pueden alojarse en el cerebro y provienen de un tumor localizado en otro órgano.
Las lesiones primarias del sistema nervioso central fueron clasificadas por la Organización Mundial de la Salud (OMS), siendo la versión más reciente la de 2016. Esta clasificación de importancia pronóstica, gradúa las lesiones en 4 grupos. Se analizará el tratamiento de los tumores astrocíticos y oligodendrogliales del cerebro, seleccionando aquellos que son más frecuentes. Los tumores menos frecuentes y aquellos que serán tratados como problemas especiales como los relacionados a epilepsia, serán presentados en un artículo separado.
TUMORES DE BAJO GRADOCIRUGÍATumores Astrocíticos Grado I OMSAstrocitoma pilocítico. Son frecuentes en edad pediátrica aunque pueden encontrarse en adultos jóvenes. Tienden a ser sólido-quísticos y se localizan preferentemente en el cerebelo, pero también pueden estar presentes en el tercer ventrículo y en los nervios ópticos.
Cuando pueden ser extirpados en forma segura y sin causar un déficit neurológico, la extirpación en bloque de la lesión sólida debería ser curativa. Esto es válido fundamentalmente para las lesiones localizadas en el cerebelo, que es un órgano con gran potencial de recuperación funcional. En el otro extremo, la extirpación en bloque de una lesión localizada en la vía óptica, con alta probabilidad producirá un déficit del campo visual. Por su lento crecimiento, una alternativa es el seguimiento clínico, con campo visual y resonancia magnética.
Tumores Astrocíticos y oligodendrogliales Grado II OMSSon tumores astrocíticos y oligodendrogliales G II OMS el astrocitoma difuso y el oligodendroglioma.
Astrocitoma difusoExisten numerosos artículos con análisis volumétrico que reportan que la resección extensa de estas lesiones prolongaría las expectativas de vida 1,2.
Por otra parte se ha reportado que estas lesiones tienden a aumentar su grado y se malignizan a través del tiempo 3,4. Estos argumentos justifican que en aquellos pacientes en que se diagnostica un astrocitoma difuso se debería intentar una resección lo más amplia posible, evitando producir un déficit neurológico irreversible. Para alcanzar esta meta, es preciso establecer la relación del tumor con zonas corticales y profundas de importancia funcional. La Resonancia Magnética funcional nos permite tener un acercamiento al área motora, lenguaje expresivo y lenguaje comprensivo, información que es usada en la planificación operatoria. La neurofisiología intraoperatoria permite establecer la ubicación del área cortical motora, de lenguaje expresivo, comprensivo y área visual. La estimulación profunda permite establecer vías de importancia funcional. El reconocimiento de estas estructuras durante la intervención quirúrgica permite preservar función neurológica y realizar resecciones más amplias. La instalación de un nuevo déficit es posible cuando se trabaja en el margen de un área funcional del cerebro, no obstante gracias al fenómeno de plasticidad neuronal y a una sobrevida prolongada, estos déficits tienden a ser recuperables. Las imágenes intraoperatorias también ayudan a lograr un mayor grado de resección. Nuestro grupo usa rutinariamente la Ultrasonografía Intraoperatoria y la Resonancia Magnética inmediata con el objetivo de completar una resección incompleta, si es necesario.
OligodendrogliomaCirugía. Como en el astrocitoma difuso, la mayor resección posible, evitando generar un déficit permanente, es el objetivo del tratamiento. El grado de resección nuevamente se correlaciona con las expectativas de vida y el periodo libre de enfermedad, entendido como el lapso sin un nuevo déficit o sin progresión del tumor. Las consideraciones conceptuales y prácticas en relación con la identificación y preservación de funciones cerebrales son similares.
TERAPIAS SISTÉMICASLa quimioterapia se ha empleado en astrocitomas difusos grado II, oligodendrogliomas y oligoastrocitomas, en caso de resección incompleta o en el momento de una recurrencia.
Los tumores con componente de oligodendrogliomas tienen mayor respuesta a la quimioterapia. El tratamiento clásico ha sido la combinación de procarbazine, CCNU y vincristina (PCV) con la cual se logran respuestas de 60 a 70% con mediana de tiempo a progresión de 12 a 18 meses 5.
En pacientes con enfermedad recurrente en una serie de sólo 46 enfermos se reportaron respuestas en el 61% con temozolamida y en el 35% se logró una estabilización de la enfermedad lo que eleva el control clínico a 96%. La mediana de duración de la ausencia de progresión fue de 22 meses y a los 12 meses el 76% estaba sin progresión. La toxicidad, especialmente hematológica fue muy baja 6.
La presencia de la codeleción 1p/19q es frecuente en los tumores con componente oligodendroglial. Su valor pronóstico y predictivo a la quimioterapia no está tan establecido como en los tumores de alto grado, sin embargo,hay evidencias de una mayor respuesta a temozolamida 7.
En estos tumores es posible el uso de esquemas de quimioterapia sucesivos luego de progresiones con una primera línea. La temozolamida (TZM) en estas circunstancias ha presentado porcentajes de respuestas entre el 43 a 63% con medianas de tiempo a progresión tumoral de 67meses.
Se ha investigado el uso de quimioterapia adyuvante, luego de la cirugía, en enfermos de mal pronóstico. El estudio RTOG 9802 seleccionó pacientes mayores de 40 años, con cualquier tipo de resección o menores de 40, pero con resección subtotal, todos con radioterapia post operatoria y los dividió al azar para recibir o no quimioterapia con procarbazina, CCNU y vincristina (PCV). Se incluyeron en el análisis 251 enfermos. Al momento de la publicación, la quimioterapia permitió una prolongación de la supervivencia libre de enfermedad, pero el impacto en la supervivencia no fue demostrativo. A los 5 años con quimioterapia estaban vivos el 72% y sin quimioterapia el 63% (p 0.33) 8.
En la reunión de ASCO 2014 se presentó una puesta al día del estudio, con un seguimiento mediano de 11.9 años, los resultados favorecieron al uso de quimioterapia adyuvante con una mediana de supervivencia 13.3 años versus 7.8 (p=0.03, HR 0.59). La supervivencia libre de progresión fue 10.4 años versus 4 (p=0.002, HR 0.50). A los 5 y 10 años el 73% y el 64% de los pacientes con quimioterapia estaban vivos y con sólo radioterapia 62% y 41% respectivamente. La presencia de un componente de astrocitoma difuso confiere mal pronóstico. No se ha completado el resultado de los datos moleculares 9.
RADIOTERAPIATumores Astrocíticos Grado I OMSLa radioterapia tiene un rol en los gliomas GI, astrocitoma pilocitico, que no se puedan extirpar por riesgo de causar un déficit neurológico o frente a la recidiva tumoral. El control local con radioterapia es sobre el 70% a 20 años 10,11. Algunos trabajos han demostrado que cuando la extirpación del tumor es parcial, el control local mejora si se agrega radioterapia post operatoria, pero no cambia la sobrevida global 12. A pesar de estos estudios el estándar post cirugía es el seguimiento 11. En los casos que se considere radioterapia post operatoria se debe balancear cuidadosamente los riesgos de daño neurológico por el recrecimiento tumoral con los riesgos de efectos secundarios por la irradiación, sobre todo en los pacientes pediátricos. El astrocitoma pilocítico es un tumor de límites precisos, por lo que es posible considerar el tratamiento con radioterapia externa fraccionada o radio cirugía estereotáxica, SRS 13,14.
Tumores Astrocíticos y oligodendrogliales Grado II OMSLa radioterapia está indica en los gliomas GII cuando se produce progresión tumoral después de la cirugía, habitualmente años después de la primera resección. En los casos no resecables, por el riesgo de daño neurológico, o que la progresión tumoral puede producir deterioro neurológico, debe considerarse la radioterapia 15. El carácter infiltrativo de los gliomas GII hace necesario el tratamiento con radioterapia externa fraccionada. Los límites de gliomas GII son imprecisos y para la irradiación es necesario adicionar, al lecho quirúrgico y volumen tumoral visible en la resonancia magnética, un volumen externo, que rodea a los cambios visibles y que corresponde a la enfermedad subclínica. La dosis de radioterapia en los gliomas GII es de 50 a 54Gy en fracciones de 1.8 o 2Gy 16.
La mayoría de los pacientes con glioma GII tienen una evolución favorable, con una mediana de sobrevida libre de progresión de 8 a 10 años. Los oligodendrogliomas tienen en general mejor pronóstico que los astrocitomas difusos. Sin embargo, en los gliomas GII existe un grupo de mal pronóstico, que recidiva precozmente y debería recibir terapia adyuvante a la cirugía. Se han utilizado los índices pronóstico de EORTC, en que los factores de mal pronóstico son: edad mayor a 40 años, histología astrocitoma, tumor mayor de 6cm., cruce de línea media por el tumor y déficit neurológico preoperatorio. Para los estudios se ha seleccionado pacientes con tres o más factores de mal pronóstico y comparado radiación con radio quimioterapia con PCV, (Procarbazina, Lomustina, Vincristina), sin poder demostrar en forma significativa aumento en la sobrevida global 8. Una reciente publicación muestra aumento en sobrevida con radio quimioterapia en pacientes menores de 40 años a expensas de una mayor toxicidad 17. Actualmente la radioterapia sola es el estándar para la mayoría de los gliomas GII.
La reciente incorporación de estudios de cambios genéticos como factores pronósticos en los gliomas GII, identifica la presencia de la codeleción en los genes 1p19q y la mutación de IDH1 como factores de buen pronóstico, sobrevida libre de enfermedad prolongada 18. Está en curso estudios para determinar cuál es la mejor terapia de acuerdo al perfil genético en gliomas GII con marcadores genéticos de mal pronóstico.
TUMOR ASTROCÍTICO DE BAJO GRADO
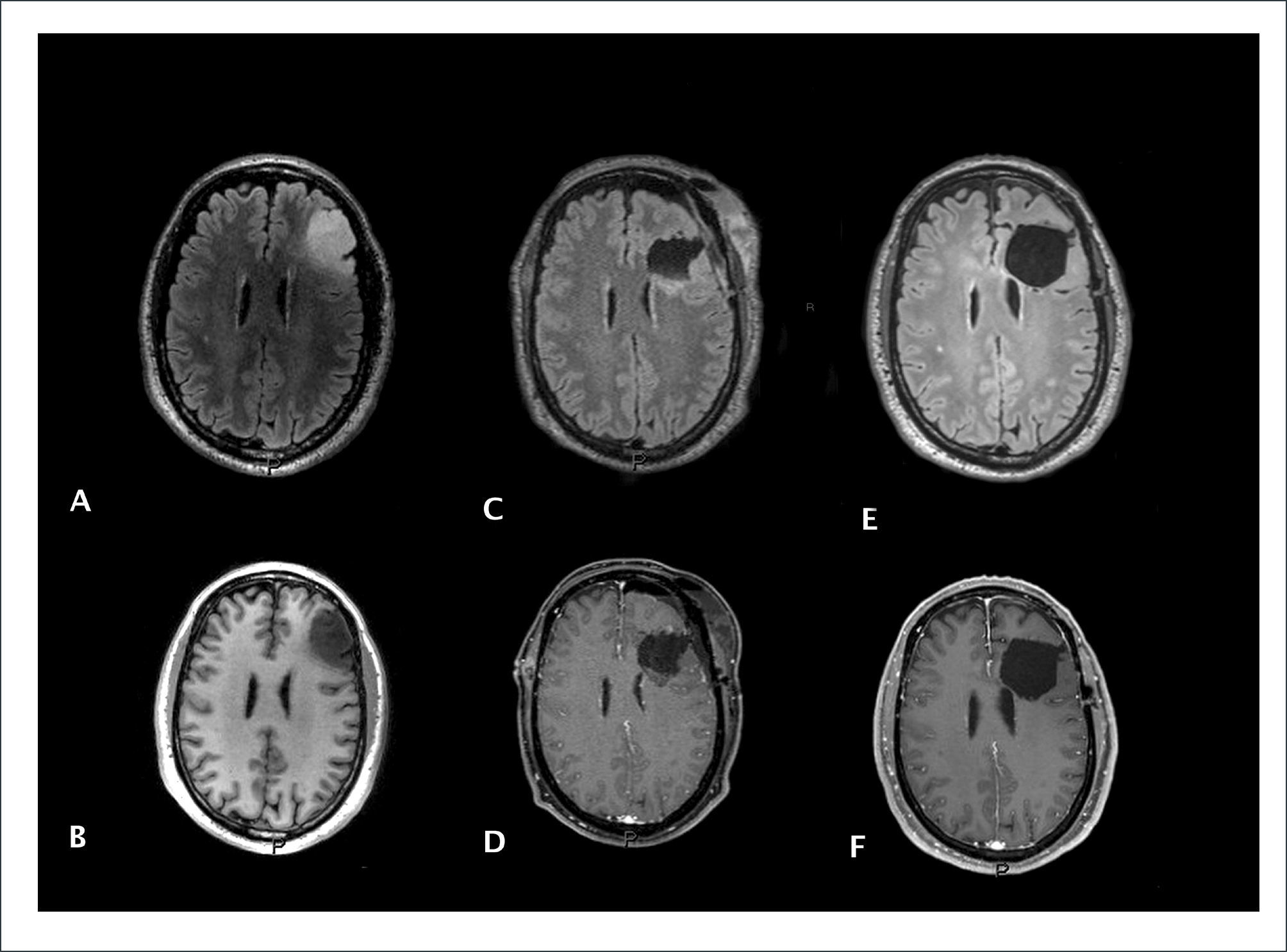
Tumor astrocítico de bajo grado, Oligodendroglioma G II OMS. A Imagen preoperatoria de tumor hiperintenso en secuencia FLAIR y B Señal hipoinensa en secuencia T1 preoperatoria. C y D demuestran una resección completa de la señal hiperintensa en FLAIR e hipointensa en T1 en la RM postoperatoria inmediata. E y F corresponde a un control 18 meses después de la intervención que descarta una recidiva a ese momento.
Cirugía. El tratamiento de estas lesiones se debería enfocar desde la perspectiva de un equilibrio entre el tiempo de sobrevida y la calidad de vida como en el astrocitoma difuso, no obstante la sobrevida esperada es más corta en los astrocitomas anaplásticos. Esto nos lleva a evitar cambios funcionales generados por el tratamiento quirúrgico ya que el tiempo para que se recuperen es menor. Las expectativas de vida como el tiempo libre de síntomas o progresión dependen del grado de resección que se pueda alcanzar 19. Para maximizar el grado de resección, se puede utilizar la neuronavegación guiada por imágenes, donde el objetivo probablemente debería ser fijado en el área de toma de contraste en secuencia T1 y la señal hiperintensa de las secuencias T2 de la resonancia magnética. El grado de resección se puede estimar con el uso de ultrasonografía intraoperatoria. La resección guiada por fluorescencia por 5ALA 20 puede ayudar a identificar la lesión durante la extirpación de gliomas de alto grado, no obstante debe tenerse en consideración que el astrocitoma anaplástico solo tuvo una representación en el 2% del brazo terapéutico con fluorescencia y en el 2% del brazo terapéutico sin fluorescencia. Otra forma de controlar el grado de resección es la resonancia magnética intraoperatoria, sin embargo su alto costo reduce su aplicabilidad. Nuestro grupo utiliza un control con resonancia magnética final con el paciente aun anestesiado. Si existe un remanente extirpable sin afectar la función neurológica, es extirpado a continuación. Con lesiones cercanas a regiones cerebrales elocuentes, todo el procedimiento quirúrgico se realiza en condiciones de monitoreo electrofisiológico intraoperatorio. Como se mencionó antes, en los astrocitomas anaplásticos, se trata de no producir un déficit neurológico durante la resección del tumor.
Oligodendroglioma anaplásticoCirugía. Los oligodendrogliomas anaplásicos son menos frecuentes, por los que existe menos evidencia que para anstrocitoma anaplásico, no obstante parece ser que la resección más amplia posible sin producir daño neurológico significativo es también la conducta más aceptable 21,22. Las consideraciones técnicas son similares a las de los precedentes, salvo que este tipo de tumor no tuvo representación alguna en el estudio con fluorescencia por 5ALA 20.
Tumores Astrocíticos Grado IV OMSGlioblastomaCirugía. El glioblastoma es el tumor para cual contamos con mejor evidencia de que el grado de resección se correlaciona con un mejor pronóstico en cuanto a expectativas y calidad de vida 23. En 2006 se publicó el resultado del estudio en fase III que demostró que el grado de resección se correlaciona con un pronóstico más favorable en términos de un mayor intervalo de vida libre de progresión. El seguimiento posterior de esta cohorte demostró una correlación con la sobrevida 24. La resección total de la lesión como objetivo fundamental, tiene el riesgo de que el paciente adquiera un nuevo déficit neurológico durante el procedimiento. Esto se reflejó en la cohorte del estudio de fluorescencia en que se determinó que los pacientes operados bajo 5 ALA tenían mayor frecuencia de deterioro neurológico dentro de las primeras 48 horas. Sin embargo, el grupo tratado sin 5 ALA, que tenía más tumor residual tendía a deteriorarse neurológicamente antes en el seguimiento 25.
Para lograr un mayor grado de resección consideramos útiles la ultrasonografía intraoperatoria, el uso de fluorescencia por 5 ALA y el control final con RM cerebral. La ultrasonografía permite extirpar mayor cantidad de lesión, comparando las imágenes en distintas etapas de la intervención con una obtenida al inicio de esta. La fluorescencia por 5 ALA se obtiene al estimular al paciente tratado con 5 ALA antes de la intervención con una luz violeta de 440nm y observar la presencia de fluorescencia roja, emitida por las células tumorales que han absorbido la 5 ALA y la han transformado en protoporfirina IX 20. Esta técnica permite distinguir el tumor del cerebro, lo que suele ser imposible con la luz normal del microscopio operatorio. La RM, realizada al final de la intervención puede revelar un remanente tumoral que haya sido pasado por alto por los controles previos de ultrasonografía y fluorescencia por 5 ALA. La neronavegación es útil para diseñar craneotomías más precisas y ayuda a localizar lesiones pequeñas.
Como se mencionó al comienzo, los déficits neurológicos deben ser evitados. Cuando el tumor es cercano o está en un área cerebral funcional elocuente, la RM funcional ayuda a la planificación operatoria, tal como en los tumores de bajo grado. La neurofisiología intraoperatoria permite caracterizar el área motora, las áreas de lenguaje y la corteza visual; la estimulación profunda permite establecer la localización de vías de conexión, como la vía piramidal.
Los glioblastomas deberían ser tratados con la mayor resección quirúrgica posible sin producir daño neurológico.
TERAPIAS SISTÉMICASLa Temozolamida (TMZ) es activo, aunque con resultados modestos, en pacientes con astrocitomas anaplásticos, que están en primera recaída. Yunk y colaboradores, en un grupo de 162 enfermos obtuvieron una supervivencia libre de progresión de 46% y 13.6% a los 6 y 12 meses respectivamente y con una mediana de supervivencia libre de progresión de 5.4 meses. El 46% de los enfermos estaban vivos al año y la mediana de supervivencia fue de 13.6 meses. Como es habitual los efectos adversos con la droga fueron bajos 26.
Actualmente, la mayoría de los enfermos han recibido TMZ en concomitancia con radioterapia o solo, por eso es de interés que la administración del medicamento en dosis de 50mg/m2 en forma continua logra respuesta en estos enfermos tratados con dosis convencionales. La toxicidad es moderada y el tratamiento es bien tolerado.
El mayor aporte de la TMZ ha sido su incorporación como adyuvancia, en forma concomitante con radioterapia y luego sola por 6 meses. Se incluyeron 573 enfermos, casi todos con glioblastomas, en un estudio en que se dividieron los pacientes a recibir solo radioterapia o además la quimioterapia. A los 2 años sobrevivieron el 27% de los que recibieron la combinación y 10.9% con radioterapia sola. A los 5 años las cifras mejoraron 9.8% y 1.9%, diferencias que fueron estadísticamente significativas. Los resultados mejoraron en los enfermos que tuvieron metilación de la metil guanil metil transferasa (MGTM) fueron mejores 27. El intento de aumentar la intensidad de la dosis de TMZ no mejoró los resultados 28.
Este esquema de terapia combinada mostró ser más efectivo y seguro en pacientes de más de 70 años 29. También se ha empleado, en pacientes de más de 65 años el uso de temozolamida sola comparando sus resultados con radioterapia exclusiva. En el estudio NOA-08 se dividieron al azar 412 enfermos a recibir quimioterapia o radioterapia inicial. Al momento de progresión se cambiaba el tratamiento de quimioterapia a radioterapia y viceversa. No hubo diferencias en la supervivencia, mediana de 8.6 meses con temozolamide versus 9.6 con radioterapia. La mayor parte tenía glioblastoma (89%). No hubo diferencias en la calidad de vida. Los pacientes con MGMT metilada tuvieron mejor respuesta con TMZ en cambio no hubo respuesta diferente en los tratados con radioterapia. Es posible que en los enfermos mayor edad y con MCMT metilada sea mejor iniciar terapia con TMZ y usar radioterapia de rescate. 30. Hay menos estudios con quimioterapia adyuvante dirigidos a astrocitomas anaplásticos (AA). En el estudio NOA-04 Se dividieron 318 enfermos con AA en 3 ramas, radioterapia inicial seguida de quimioterapia con PCV o TZM a la progresión o inicio de quimioterapia con PCV o TMZ y luego radioterapia al progresar. No se encontró diferencias en tiempo a progresión ni en supervivencia. La codeleción 1p/19q fue frecuente en los tumores con componente de oligodendroglioma. También porcentajes superiores al 70% de estas histologías tuvieron mutación de IDH1 y en cambio sólo en el 57% de los AA. La mutación de IDH1 tuvo más importancia pronóstica que la codeleción y la MGTM metilada fue predictiva de respuesta a quimioterapia 31.
En la reunión 2016 de ASCO se presentaron los resultados del estudio CATNON. Se dividieron al azar 751 enfermos, sin codeleción, para recibir o no recibir TMZ luego de radioterapia. Los resultados fueron mejores con la quimioterapia, con el 56% de los enfermos que recibieron TMZ versus 44% (p0.003).
En los ologodendrogliomas anaplásticos se han realizado 2 estudios fase III para medir el efecto de la quimioterapia luego de cirugía. En la publicación de EORTC 29951 se incluyeron enfermos con oligodendroglioma anaplásticos o mixtos con al menos un 25% de componente de oligodendroglioma y que tuvieran al menos 3 de las siguientes 5 características: celularidad alta, mitosis, anormalidades nucleares, proliferación endotelial y necrosis. El grupo estuvo formado por 125 oligodendrogliomas anaplástcos y 82 oligoastrocitomas anaplásticos Se dividieron al azar para recibir sólo radioterapia o además quimioterapia con PCV. Luego de un seguimiento mediano de 140 meses se apreció una reducción de la mortalidad de 25%, con una diferencia de 12 meses en la supervivencia, 42.3 meses versus 30.6. Los efectos fueron mayores en los enfermos portadores de la codeleción y MGTM metilada En ausencia de la codeleción parece no haber beneficio 32.
El segundo trabajo es el RTOG 9402. En este caso se incluyeron 291 enfermos en la división al azar para radioterapia sin o con PCV. Los datos se publican con un seguimiento mediano de 11.3 años. No hay diferencia en el grupo total pero sí en presencia de codeleción, mediana de supervivencia 14.7 años versus 7.3, p0.03 16.
Un punto muy discutido ha sido el aporte de la terapia antiangiogénica con bevacizumab. En pacientes con enfermedad recurrente el uso de bevacizumab con o sin irinotecan ha demostrado cierto grado de actividad. Con bevacizumab solo se obtienen 28.24% de respuestas y el 37.8% de los enfermos están vivos a los 6 meses. Al agregar irinotecan las cifras son 42.8% y 50.3% respectivamente 33.
Una dificultad en la evaluación de los resultados con bevacizumab radica en el hecho que ya a las 48 horas, el medicamento mejora la integridad de la barrera hemato-encefálica disminuyendo el realce con el medio de contraste dando la imagen de una falsa respuesta 34.
Un estudio fase III, doble ciego midió el efecto de agregar bevacizumab o placebo al tratamiento con radioterapia y Temozolamida. No hubo diferencia en la supervivencia. 35 Un segundo estudio, también fase III y doble ciego (AVAGLIO) se efectuó en 921 enfermos. Tampoco se demostró una mejoría en la sobrevida y sólo una prolongación en la supervivencia libres de progresión 36.
Análisis retrospectivos del estudio AVAGLIO han planteado la posibilidad de beneficio en algunos grupos de enfermos. Los resultados serían positivos en las variedades proneurales con IDH1 No mutado 37.
Se ha estudiado remplazar la TMZ por bevacizumab más irinotecan en paciente con MGMT no mutada. Un estudio fase II randomizado estudió ambas alternativas. Con irinotecan mejoró la supervivencia sin progresión, pero no hubo diferencia en la supervivencia global 38.
Finalmente no hay demostración de actividad de terapias blancos en estos tumores
RADIOTERAPIATumores Astrocíticos y oligodendrogliales G III OMSLa radioterapia post operatoria se indica en todos los casos de gliomas GIII. Esta se usa en forma concomitante con quimioterapia. Los estudios aleatorizados han utilizado para la quimioterapia la combinación de drogas PCV, pero su uso no se ha generalizado por su toxicidad 16. Por su bajo perfil de toxicidad, la droga utilizada por nosotros en combinación con la radioterapia es la Temozolamida. Debido al mayor grado de infiltración cerebral de los gliomas grado III, los volúmenes que se deben irradiar son mayores que el glioma de menor grado. La dosis empleada en gliomas GIII es de 60Gy en 30 fracciones, siendo más alta que la empleada en gliomas de menor grado.
Los estudios genéticos son empleados como indicadores pronósticos, codeleción 1p19q, mutación de IDH1. Todavía no hay estudios genéticos que permitan diferenciar la indicación de radioterapia o radio quimioterapia.
Tumores Astrocíticos Grado IV OMSEl glioblastoma es el glioma de peor pronóstico, por su frecuente recidiva local y breve sobrevida libre de enfermedad, lo que condiciona una corta sobrevida global. El glioblastoma es el glioma con mayor infiltración subclínica del tejido cerebral, tumor que se extiende por fuera de la lesión visible en la resonancia nuclear magnética. La radioterapia siempre está indicada después de la cirugía y debe entregarse con forma concomitante con Temozolamida, de acuerdo a los estudios randomizados que demuestran aumento en la sobrevida con la combinación 39. Los volúmenes de tratamiento y la dosis son iguales a las empleados en los gliomas grado III, ya que no se ha demostrado beneficio en aumentar la dosis ni los volúmenes 40. La recidiva tumoral de glioblastoma ocurre habitualmente dentro del volumen irradiado a dosis completa.
Los marcadores genéticos son pronósticos del resultado del tratamiento. La sobrevida es más prolongada en los pacientes con la mutación IDH1. La respuesta a quimioterapia se correlaciona con la codeleción 1p19q y la metilación del activador de MGMT 18. Estos marcadores hoy no determinan cambio en la indicación terapéutica.
TUMOR ASTROCÍTICO DE ALTO GRADO
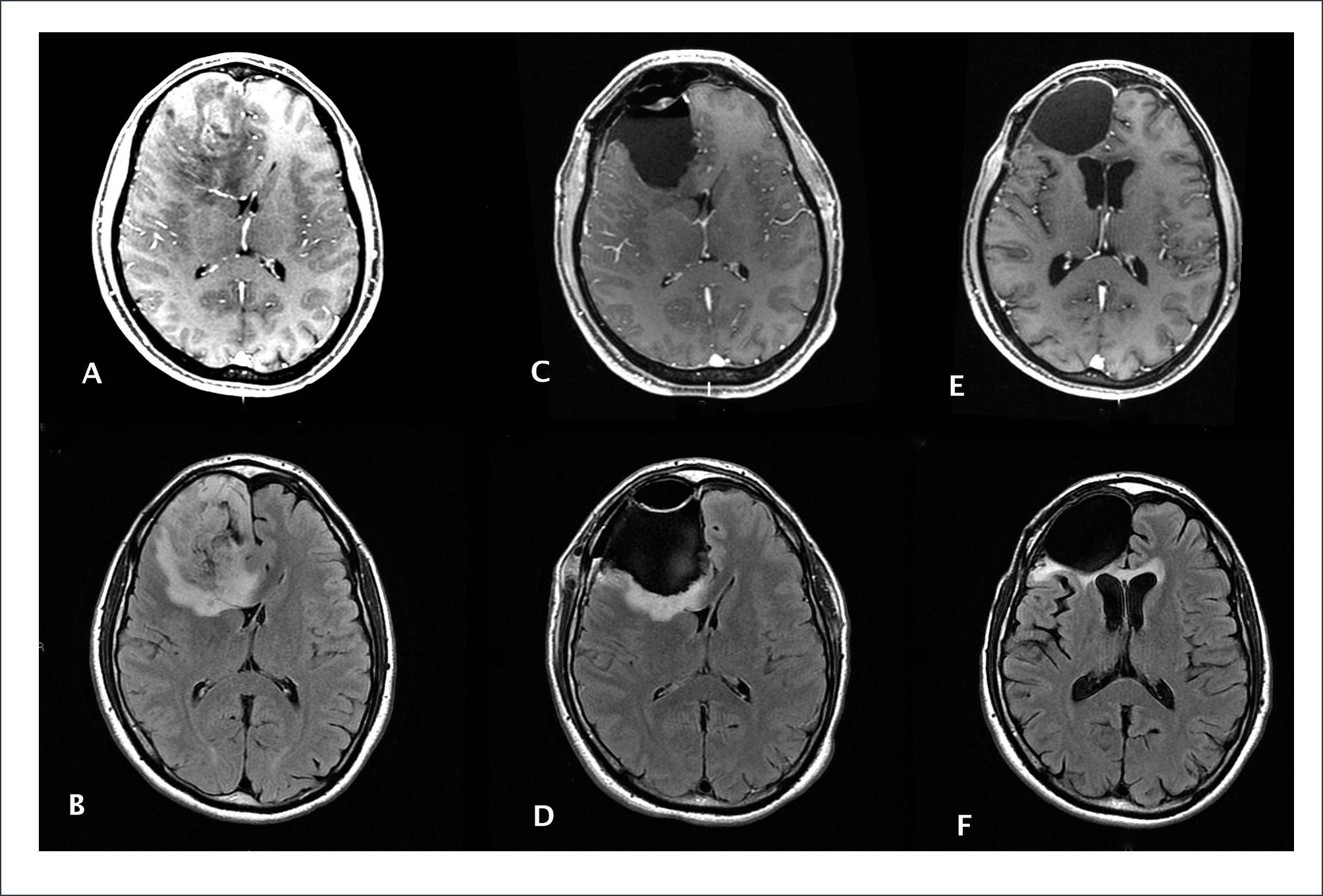
A y B Astrocitoma Anaplásico G III OMS frontal derecho con captación heterogénea de Gadolinio en T1 e hiperseñal en FLAIR. El objetivo de la cirugía fue extirpar la zona de captación de Gadolinio en T1. En C y D se observa la desaparición de la zona de captación de contaste, no obstante persiste hiperseñal en FLAIR en el margen de resección posterior. El paciente fue sometido a radioterapia y a quimioterapia concomitante con Temozolamida. E y F muestran un control alejado, 3 años después de resección, en que no hay captación de gadolineo en T1 y el margen hiperintenso en FLAIR ha disminuido de grosor.
Los autores declaran no tener conflictos de interés, en relación a este artículo.