Este artículo explora el papel de la tomografía computarizada de alta resolución (TCAR) en el diagnóstico de las enfermedades pulmonares intersticiales difusas (EPID), discutiendo los hallazgos tomográficos claves, las alteraciones parenquimatosas y la importancia de identificar diversos patrones radiológicos, con un enfoque especial en el patrón de neumonía intersticial usual (UIP, por sus siglas en inglés). Ante la complejidad y diversidad de manifestaciones de las enfermedades pulmonares intersticiales difusas (EPID), es esencial la evaluación colaborativa de un equipo multidisciplinario, en el que el radiólogo desempeña un papel fundamental en la cadena diagnóstica mediante la TCAR. Este exámen permite la detección de las alteraciones parenquimatosas en las EPID, tales como opacidades en vidrio esmerilado, consolidación, patrones reticulares, bronquiectasias/bronquioloectasias por tracción y panalización. La interpretación y asociación de estos hallazgos, junto con su distribución, facilita el establecimiento de patrones radiológicos específicos que, además de indicar posibles etiologías, orientan las opciones terapéuticas más adecuadas. La adopción de protocolos de imagen específicos y el uso de un lenguaje estandarizado son esenciales para aumentar la precisión diagnóstica. Además, la incorporación de innovaciones tecnológicas, como la avanzada tecnología de conteo de fotones y el análisis automatizado mediante inteligencia artificial, prometen mejorar significativamente la identificación y cuantificación de las alteraciones intersticiales, configurando el futuro de la radiología torácica.
This article explores the role of high-resolution computed tomography (HRCT) in the diagnosis of diffuse interstitial lung diseases (ILD), discussing key tomographic findings, parenchymal changes, and the importance of identifying various radiological patterns, with a special focus on the usual interstitial pneumonia (UIP) pattern. Given the complexity and diversity of manifestations of diffuse ILD, the collaborative evaluation of a multidisciplinary team, in which the radiologist plays a fundamental role in the diagnostic chain using HRCT, is essential. This exam enables the detection of parenchymal alterations in DILD, such as ground-glass opacities, consolidation, reticular patterns, traction bronchiectasis/bronchiectasis, and honeycombing. The interpretation and association of these findings, along with their distribution, facilitate the establishment of specific radiological patterns that, in addition to indicating possible etiologies, guide the most appropriate therapeutic options. The adoption of specific imaging protocols and the use of standardized language are essential to increase diagnostic accuracy. Moreover, the incorporation of technological innovations, such as advanced photon counting technology and automated analysis through artificial intelligence, promise to significantly improve the identification and quantification of interstitial alterations, shaping the future of thoracic radiology.
Las enfermedades pulmonares intersticiales difusas (EPID) representan un desafío diagnóstico y terapéutico en la medicina respiratoria debido a su heterogeneidad clínica y patológica. Se caracterizan por una compleja interacción de factores que afectan el intersticio pulmonar y abarcan un amplio espectro de trastornos con variadas manifestaciones clínicas, radiológicas y patológicas.
En este contexto, la tomografía computarizada de alta resolución (TCAR) ha emergido como una herramienta diagnóstica invaluable, proporcionando una visión detallada de la estructura pulmonar y permitiendo la identificación de patrones específicos asociados con diferentes tipos de EPID.
Este artículo se centra en el patrón de neumonía intersticial usual (UIP, por sus siglas en inglés) dada la frecuencia y significancia clínica que tiene entre las EPID, y por el hecho que la TCAR permite una alta precisión diagnóstica, que en muchos casos puede obviar la necesidad de biopsias pulmonares invasivas.
En esta revisión se explora el papel de la TCAR en el diagnóstico de las EPID, discutiendo los diferentes hallazgos tomográficos, especificando las alteraciones parenquimatosas y la relevancia de describir los diferentes patrones radiológicos. A través de esta revisión buscamos proporcionar una perspectiva actualizada sobre el diagnóstico de las EPID, subrayando los avances recientes y sus futuras directrices en la radiología torácica.
Contexto clínicoLas EPID comprenden múltiples patologías que se caracterizan por afectar el intersticio pulmonar a través de procesos inflamatorios y/o fibróticos1,2.
Se pueden clasificar según su temporalidad (agudas, subagudas o crónicas), etiología (causa identificable, idiopática o desconocida) y si tienen o no compromiso fibrótico (EPID fibróticas y no fibróticas)3,4.
Las causas de daño intersticial en el parénquima pulmonar pueden ser identificables (como por ejemplo neumonitis por hipersensibilidad (HP), enfermedades asociadas al tabaco, aquellas por efectos secundarios de fármacos o las relacionadas con enfermedades del tejido conectivo) o criptogénicas que conforman el subgrupo de enfermedades pulmonares intersticiales idiopáticas. Un porcentaje de estos pacientes, especialmente aquellos con EPID fibróticas, no alcanzan un diagnóstico definitivo, constituyendo un grupo considerado de causa no clasificable (aproximadamente el 15%)5,6.
El manejo de estas patologías, especialmente en radiología, ha evolucionado paralelamente a los avances científicos y al conocimiento más acabado de estas enfermedades. Este progreso ha permitido que a través de un enfoque multidisciplinario con la colaboración de especialistas clínicos, radiólogos y patólogos, muchos de estos pacientes se diagnostiquen con mayor confianza y sin depender exclusivamente de la histología5.
En años recientes, se han desarrollado múltiples consensos por parte de las principales sociedades de imágenes torácicas a nivel mundial, buscando disminuir la variabilidad en la interpretación entre observadores, especialmente en los radiólogos no especialistas. Los avances terapéuticos han sido otro factor impulsor en la creación de estos consensos y también en guías, enfocándose particularmente en identificar ciertos hallazgos predictores al comportamiento con las terapias especialmente de las EPID fibróticas. Por ejemplo, la predominancia de vidrio esmerilado en la imagen torácica sugiere un mayor potencial de respuesta terapéutica a la terapia inmunosupresora, en contraste con los pacientes con mayor fibrosis en los que la terapia antifibrótica suele ser la opción preferida1,2,6,7.
Rol de la radiología torácicaLa herramienta imagenológica más útil en el diagnóstico de estas patologías es la TCAR, que proporciona información anatómica detallada del parénquima pulmonar. Es crucial realizar el examen con cortes finos (menos de 1,5mm) y utilizando algoritmos de reconstrucción de alta frecuencia espacial, en inspiración y evitando artefactos de movimiento. Las reconstrucciones multiplanares (coronal o sagital) pueden ser útiles, especialmente en la evaluación de la distribución cráneo-caudal y en diferenciar áreas de panalización versus bronquiectasias periféricas. Adicionalmente, se pueden adquirir imágenes en espiración cuando se desea evaluar enfermedad de la vía aérea pequeña, detectando atrapamiento aéreo (sospechoso de HP fibrótica). Las imágenes adicionales en decúbito prono son útiles en estos pacientes pues permiten diferenciar el compromiso intersticial subpleural inicial de las atelectasias por decúbito y muchas veces ayudan a distinguir algunos hallazgos subpleurales característicos de ciertos patrones de EPID (respeto subpleural y áreas de panalización)8,9.
Lo primero que el radiólogo debe evaluar es la calidad del examen, descartando artefactos que impidan una adecuada interpretación. Es recomendable tener un enfoque sistemático al momento de interpretar las imágenes tomográficas utilizando lenguaje estandarizado en el informe radiológico.
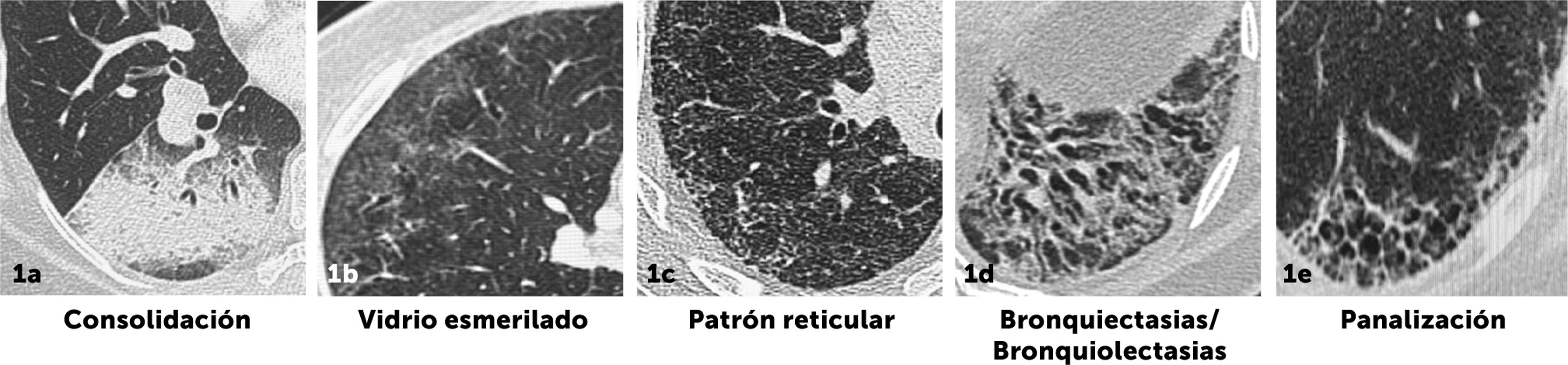
Alteraciones parenquimatosas en TCARLas principales alteraciones radiológicas que podemos encontrar son las que se describen a continuación. Cada una de estas alteraciones ofrece pistas sobre la etapa de la enfermedad y sus posibles etiologías (figura 1).
Vidrio esmerilado: Tenues opacidades pulmonares a través de las cuales se puede visualizar las estructuras vasculares y bronquiales del parénquima pulmonar subyacente. Estas alteraciones pueden indicar etapas iniciales de fibrosis o inflamación alveolar.
Consolidación: Opacidades alveolares densas que no permiten la visualización de la arquitectura vascular y bronquial. En EPID, la consolidación puede sugerir exacerbación aguda, infección secundaria o neumonía en organización, esta última especialmente asociada a enfermedades del tejido conectivo.
Patrón reticular: Red de finas líneas que representan el engrosamiento intersticial. Un patrón reticular con distorsión arquitectónica sugiere enfermedad intersticial fibrótica.
Bronquiectasias/bronquiolectasias por tracción: Dilatación irreversible de la vía aérea generalmente de morfología tortuosa e irregular.
Panal de abeja: Estructuras quísticas de paredes gruesas, agrupadas, de 3-10mm, frecuentemente localizadas en las regiones subpleural y basal. Este patrón es altamente indicativo de fibrosis pulmonar avanzada, especialmente en enfermedades como la fibrosis pulmonar idiopática. Uno de los hallazgos en que más diferencia interobservador se ha demostrado es en la identificación de la panalización, dado que puede ser difícil de diferenciar de enfisema o bronquiectasias.
Patrones radiológicos en EPIDLas guías actuales sugieren que al existir la sospecha diagnóstica de EPID o bien al encontrar hallazgos tomográficos que lo sugieran, es fundamental que el radiólogo determine si estas alteraciones son concordantes con un patrón UIP y cuál es el nivel de confianza para diagnosticarlo (patrón UIP, probable, indeterminado o sugerente de otro diagnóstico). Esto se realiza evaluando la combinación de las alteraciones parenquimatosos así como su distribución en el eje craneocaudal (predominio basal, medial o apical) y axial (por ejemplo predominio subpleural o respecto subpleural inmediato)4,10.
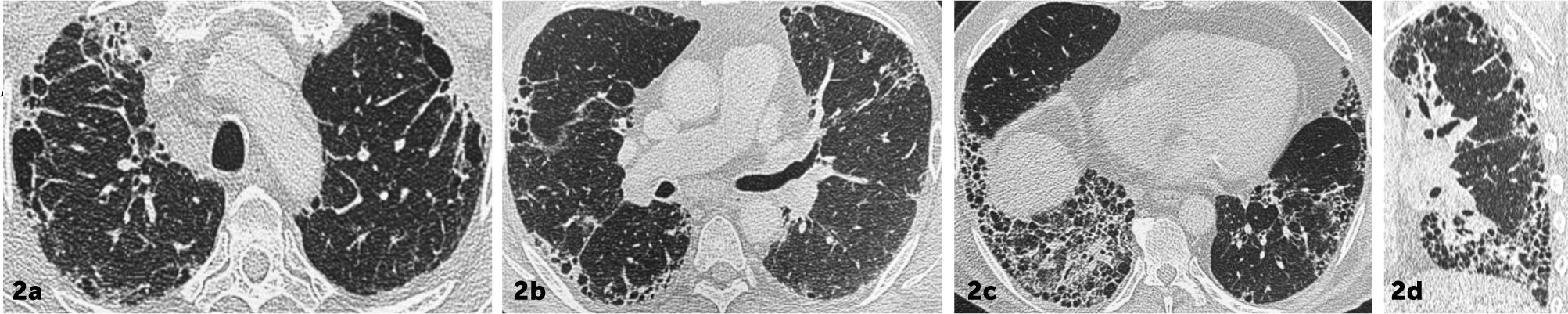
Patrón UIPDistorsión de la arquitectura pulmonar caracterizada por la presencia de opacidades reticulares, bronquiectasia/bronquiolectasias por tracción y panalización, de predominio basal (gradiente ápico-basal) y subpleural. No deben existir características atípicas. Este patrón tiene una correlación del 90% con los hallazgos histopatológicos de UIP5,11. (Figuras 2.1 y 2.2).
Enfermedad pulmonar intersticial fibrótica con patrón UIP
Distorsión de la arquitectura pulmonar bilateral caracterizado por reticulaciones y bronquiectasias por tracción de distribución asimétrica, de predominio subpleural, Se identifican áreas de panalización y gradiente ápico-basal (reconstrucción sagital 2d).
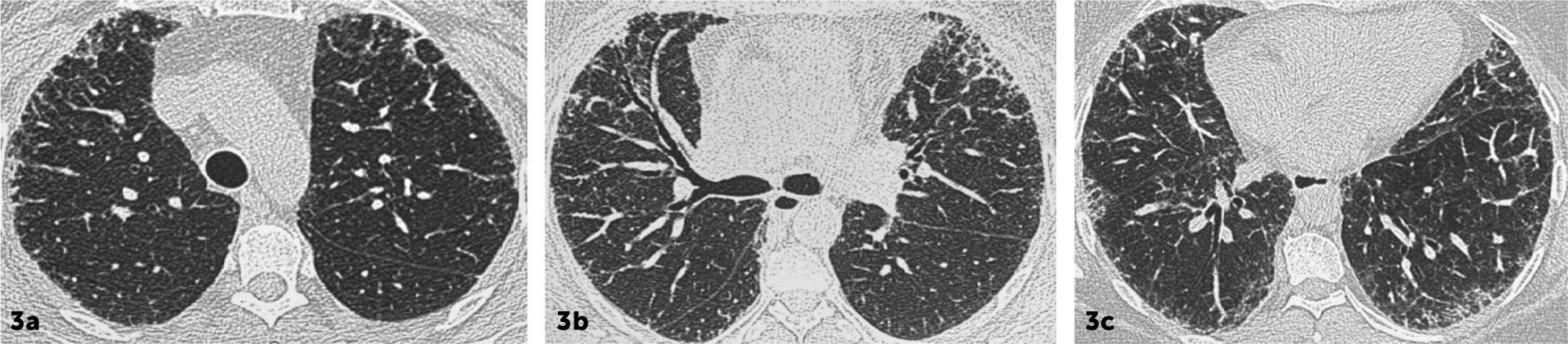
Distorsión de la arquitectura pulmonar caracterizada por la presencia de opacidades reticulares, bronquiectasias/bronquioloectasias por tracción de predominio basal y subpleural. No existe panalización. Alrededor del 80% de los pacientes tienen hallazgos histopatológicos de UIP6. (Figura 3).
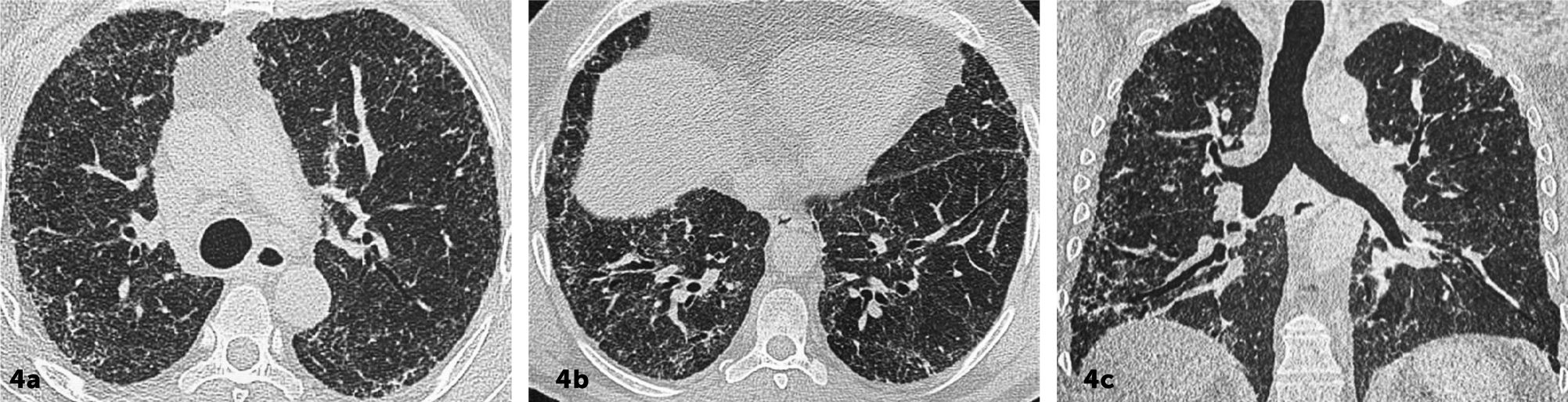
Patrón UIP IndeterminadoCuando las imágenes no cumplen los criterios de UIP definitivo o probable, o si hay hallazgos atípicos que no sugieren otra enfermedad específica. Si bien con este patrón el TCAR no es suficiente para un diagnóstico certero de UIP, cerca del 50% de los pacientes tienen UIP histopatológico9. (Figura 4).
Enfermedad pulmonar intersticial fibrótica con patrón indeterminado para UIP
Se observa distorsión de la arquitectura pulmonar asociado a opacidades reticulares, bronquiectasias/bronquiolectasias por tracción de predominio subpleural. No se observa gradiente ápico basal ni panalización.
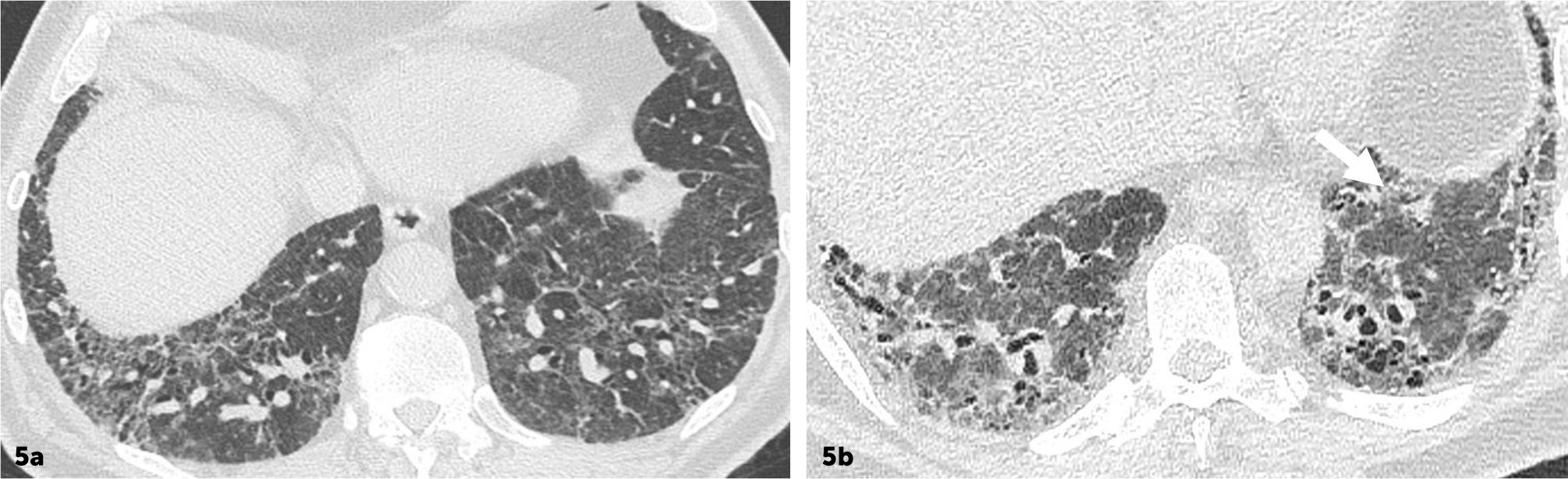
Cuando las características radiológicas sugieren una enfermedad diferente a UIP/IPF. En este caso es útil que el radiólogo proponga diferentes alternativas diagnósticas (figuras 5.1 y 5.2).
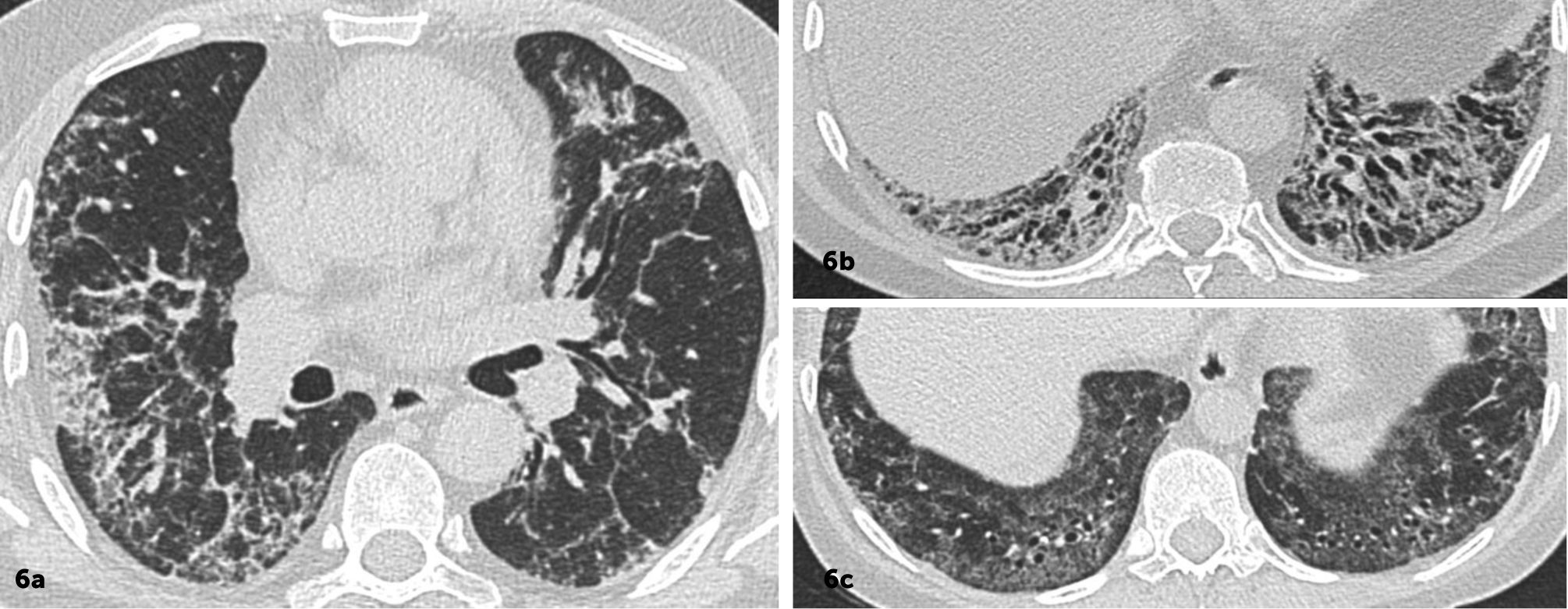
Enfermedad pulmonar interticial difusa con patrón sugerente de neumonía intersticial inespecífica (NII). Imágenes seleccionadas de TC de tórax en el plano axial, ventana pulmonar de dos pacientes
Áreas de densidad en vidrio esmerilado, reticulaciones y bronquiectasias por tracción de predominio basal y peribroncovascular. 6c. Respecto subpleural paravertebral basal bilateral.
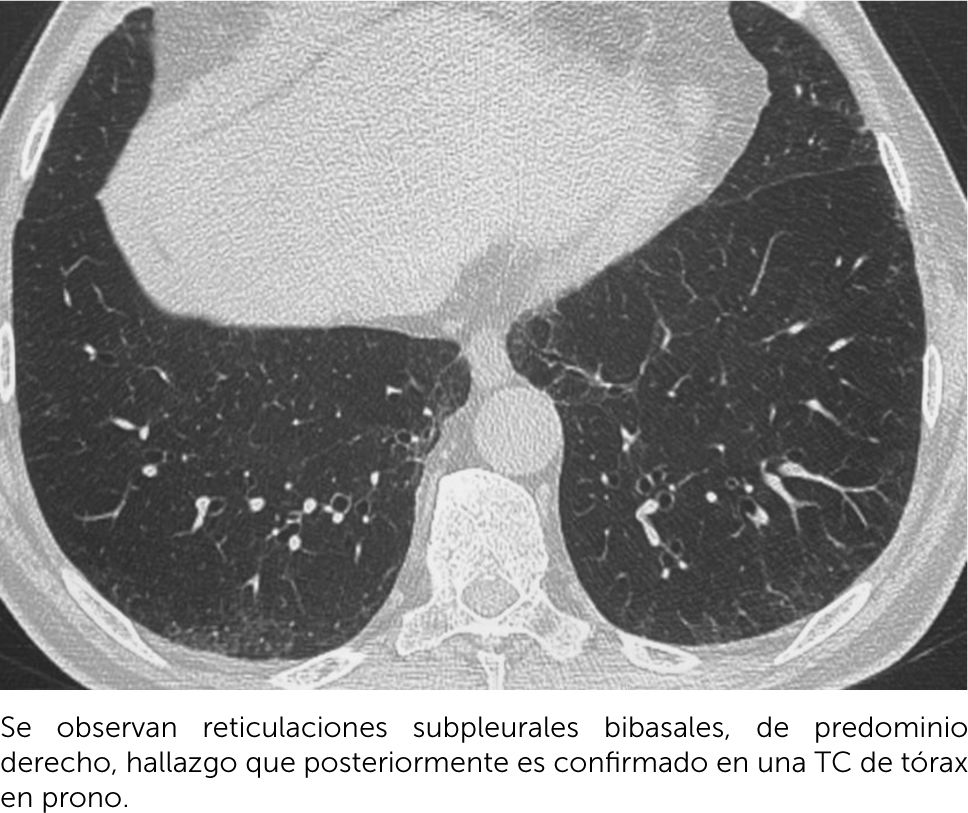
Se considera anormalidades intersticiales pulmonares (ILAs, por sus siglas en inglés) a los hallazgos pulmonares que incidentalmente se detectan en un tomografía computarizada (TC) parcial (de abdomen, por ejemplo) o completo de tórax, que pueden representar potencialmente una EPID sin existir la sospecha diagnóstica de esta enfermedad. Estos hallazgos pueden ser opacidades en vidrio esmerilado, reticulaciones, bronquiectasias/bronquiolectasias por tracción y/o quistes no enfisematosos; que deben comprometer las regiones no dependientes (superiores o ventrales) y más del 5% de cualquier zona pulmonar. Estas alteraciones se subcategorizan según la distribución y la presencia de fibrosis en ILA no subpleural, subpleural no fibrótica, y subpleural fibrótica; siendo aquellas subpleurales fibróticas las que más tienden a la progresión. La diferenciación entre ILAs y EPID clínica y subclínica se basa en los antecedentes clínicos. La ILA no implica ausencia de síntomas respiratorios o deterioro funcional, y en el caso de existir estos puede representar una enfermedad pulmonar intersticial leve. Se ha demostrado que la ILAs son más prevalentes en pacientes de mayor edad y en aquellos con hábito tabáquico. La importancia clínica de este diagnóstico imagenológico es que estos pacientes además de poder evolucionar a una enfermedad pulmonar intersticial, tienen un riesgo significativamente mayor de muerte por cualquier causa12. (Figura 7).
Avances tomográficosLa nueva técnica tomográfica de conteo de fotones ofrece una serie de ventajas sobre los métodos convencionales de la TC. Esta tecnología se caracteriza por su capacidad para contar individualmente los fotones que atraviesan el cuerpo, lo que permite obtener imágenes de mayor precisión y con menos dosis de radiación. El uso de un protocolo de ultra alta resolución que utiliza una matriz de alta definición (1024×1024 píxeles) permite una mejora significativa en la capacidad de visualizar y evaluar con detalle las estructuras pequeñas del tejido pulmonar, así como los cambios mínimos que ocurren en diversas patologías pulmonares, siendo especialmente efectiva en enfermedades intersticiales8.
Inteligencia artificial y enfermedades intersticiales pulmonaresLa inteligencia artificial (IA) está revolucionando el diagnóstico y manejo de las EPID a través de su aplicación en la TCAR. La literatura ha evidenciado que la IA, especialmente el aprendizaje profundo (deep learning) puede identificar, clasificar y cuantificar la extensión del compromiso parenquimatoso intersticial en las imágenes de TCAR, lo que permite un diagnóstico y seguimiento más efectivo de la enfermedad. La IA ofrece una interpretación consistente y objetiva, reduciendo la variabilidad inter e intraobservador. La IA puede procesar rápidamente grandes volúmenes de imágenes, lo que reduce significativamente el tiempo necesario para el diagnóstico. Esto mejora la eficiencia del flujo de trabajo en radiología y permite que los radiólogos expertos se concentren en casos más complejos. Se espera que la IA en un futuro sea capaz de detectar marcadores radiológicos que podrían no ser evidentes para el ojo humano, lo que podría mejorar aún más la precisión diagnóstica, especialmente en pacientes de tamizaje para EPID13,14.
ConclusiónDada la complejidad de las EPID, es esencial adoptar un enfoque diagnóstico multidisciplinario y avanzado, donde la TCAR juega un papel crucial no solo en el diagnóstico y clasificación, sino también en la elección terapéutica.
Por esta razón es necesario un lenguaje radiológico estandarizado y el empleo de protocolos de imagen sistematizados para maximizar la precisión diagnóstica. La adopción de tecnologías avanzadas como la tomografía computarizada de fotones con protocolos de ultra alta resolución subraya un avance significativo en la radiología torácica, mejorando la capacidad de los especialistas para evaluar con precisión las alteraciones intersticiales.
Además, el papel emergente de la inteligencia artificial (IA), especialmente en la aplicación de modelos de aprendizaje profundo, promete revolucionar el diagnóstico, seguimiento y pronóstico de las EPID, ofreciendo interpretaciones objetivas y consistentes que pueden superar las limitaciones de la variabilidad inter e intraobservador.
Consideraciones éticasLas imágenes utilizadas en esta revisión provienen de un banco de imágenes de pacientes anonimizados, adquiridas a lo largo de varios años en el servicio de imágenes torácicas de Clínica Las Condes. Estas imágenes se utilizan exclusivamente con fines educativos y de revisión diagnóstica y no contienen ningún dato personal identificable.
Conflictos de interésLas autoras no declaran conflictos de interés.