Problemas médicos como enfermedades del tiroides, deficiencia de vitamina D, anemia, infecciones del tracto urinario e insulino resistencia entre otros, pueden complicar el embarazo. Dado las molestias propias de la gestación, muchas de estas patologías no son diagnosticadas ni tratadas, aumentando la morbilidad materna y fetal. Algunas de estas enfermedades tienen diferentes criterios diagnósticos comparados con la mujer no embarazada. Se revisan los criterios diagnósticos y tratamientos de los problemas médicos más frecuentes en el embarazo.
Medical problems such as thyroid disease, vitamin D deficiency, anemia, low tract urinary infection and insulin resistance, may complicate pregnancy. Due to various pregnancy related symptoms, many of these diseases are not diagnosed and treated, increasing maternal and fetal morbidity. Some of these diseases have different diagnostic criteria compared to non pregnant women. In this article we review diagnosis and treatment criteria of these common pregnancy associated medical problems.
Las patologías de la glándula tiroides corresponden a la segunda endocrinopatía más frecuente, después de la diabetes mellitus, en las mujeres que se encuentran en edad reproductiva. Dentro de éstas, el hipotiroidismo es la de mayor prevalencia, siendo importante su diagnóstico, incluso antes de la presencia síntomas. Existe una estrecha relación entre la función tiroidea materna y fetal por lo cual, los efectos adversos del hipotiroidismo pueden afectar también al feto (1) el cual requiere para su desarrollo de las hormonas tiroideas, siendo en el primer trimestre totalmente dependiente de la tiroxina materna. En la segunda mitad del embarazo, cuando el feto comienza a producir su propia tiroxina, esta producción depende de los niveles e ingesta del yodo materno (2).
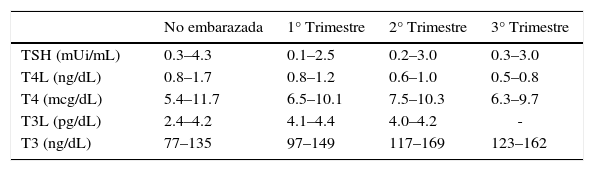
En forma fisiológica, durante el embarazo disminuye la hormona estimulante del tiroides (TSH), aumenta la tiroxina (T4) y la triiodotironina (T3), la fracción libre de T4 (T4 libre) y el índice de T4 libre no cambia y disminuye la recaptación de T3. Esto es secundario al efecto de los estrógenos, los cuales estimulan la producción hepática de la proteína transportadora de tiroxina (TBG) y disminuyen su clearence hepático, con lo cual aumenta su vida media. Además la subunidad alfa de gonadotrofina coriónica humana tiene una reacción cruzada con los receptores de TSH (actividad tirotrópica simil), estimulando la producción de tiroxina por la glándula tiroides con una disminución secundaria de la TSH. En un 20–50% aumenta el volumen de distribución de las hormonas tiroideas, aumenta el metabolismo y el transporte placentario de T4 materna (ya en las primeras cuatro semanas, los requerimientos de hormonas tiroideas aumentan en un 20–40%), se incrementa el volumen de la glándula tiroidea y aumenta la depuración del yodo (1,2). Los valores normales de las hormonas tiroideas se describen en la tabla 1(1,3,4).
Valores normales de hormonas tiroideas según el trimestre del embarazo.
| No embarazada | 1° Trimestre | 2° Trimestre | 3° Trimestre | |
|---|---|---|---|---|
| TSH (mUi/mL) | 0.3–4.3 | 0.1–2.5 | 0.2–3.0 | 0.3–3.0 |
| T4L (ng/dL) | 0.8–1.7 | 0.8–1.2 | 0.6–1.0 | 0.5–0.8 |
| T4 (mcg/dL) | 5.4–11.7 | 6.5–10.1 | 7.5–10.3 | 6.3–9.7 |
| T3L (pg/dL) | 2.4–4.2 | 4.1–4.4 | 4.0–4.2 | - |
| T3 (ng/dL) | 77–135 | 97–149 | 117–169 | 123–162 |
Las sociedades de endocrinología recomiendan realizar la medición de TSH en las mujeres embarazadas con mayor riesgo de patología tiroidea, es decir, aquellas que se encuentran en tratamiento, las que tienen antecedentes de historia familiar de enfermedad tiroidea autoinmune o historia personal de enfermedad autoinmune, radiación a nivel cervical, disfunción tiroidea postparto, hijo previo con patología tiroidea o diabetes mellitus tipo 1 (3,4). A su vez, diferentes estudios han estimado que al no realizar un tamizaje universal, se deja sin diagnosticar hasta un 30% de los hipotiroidismos subclínicos (1).
En las pacientes con hipotiroidismo previo al embarazo, se debe recomendar estar en estado eutiroideo, dado el mayor riesgo de infertilidad y de aborto. Una vez confirmado el embarazo, se deben controlar los niveles de TSH y T4 libre y ajustar la dosis de levotiroxina, según los niveles de TSH (tabla 2) (1).
La incidencia de hipotiroidismo durante el embarazo, definido como aumento de TSH (>p 97.5) y disminución de T4L (
10
mUI/L independiente de T4L, se estima en 0.3 a 0.5%. El hipotiroidismo subclínico, el cual se presenta en pacientes asintomáticas con TSH elevada (2.5 a 10mUI/L) y T4L normal, tiene una incidencia entre 2 y 3% (1,2).Adicionalmente se ha visto que el 50-60% de las pacientes con hipotiroidismo subclínico presentan evidencias de enfermedad autoinmune (anticuerpos anti peroxidasa (TPO) o anti tiroglobulina) (2). Las causas de hipotirodismo son: deficiencia de yodo (OMS recomienda una ingesta diaria 250 microgramo/día), tiroiditis autoinmune de Hashimoto e hipotiroidismo iatrogénico secundario al tratamiento de hipertiroidismo (propiltiuracilo y I 131) (1).
Muchos de los síntomas del hipotiroidismo son similares a los propios del embarazo. El cansancio, el aumento de peso, la disminución de la capacidad para realizar ejercicios y la constipación son frecuentes, así como la caída del pelo, piel seca y bradicardia (1).
En el embarazo el hipotiroidismo clínico y subclínico, se pueden asociar a aborto, anemia, deficiencias neurocognitivas fetales, hipertensión gestacional y preeclampsia, bajo peso de nacimiento, desprendimiento de placenta normoinserta, parto prematuro y aumento de la morbilidad y mortalidad perinatal (1).
La levotiroxina es el principal tratamiento y la readecuación en las dosis se basa en los niveles de TSH (tabla 2). Los niveles de TSH deben ser medidos cada cuatro a seis semanas, hasta las 20 semanas y luego controlar a las 24–28 semanas y a las 32–34 semanas. Los niveles de TSH se deben mantener entre 0.5 y 2.5mUI/L. En el postparto, la dosis debe disminuir a la dosis pre embarazo por cuatro semanas y de acuerdo a los niveles de TSH medidos a las 4–6 semanas postparto. La dosis de inicio de tratamiento, generalmente es de 1.0 a 2.0 microgramos/kg/día (1,2).
Deficiencia de vitamina DLa vitamina D, es un micronutriente esencial que se sintetiza en la piel a nivel subcutáneo después de la exposición a radiación ultravioleta B y que se metaboliza en el riñón e hígado (5).
La vitamina D es esencial para la homeostasis del calcio, así como en la fosforilación y la mineralización óseamediante una vía genómica y otra no genómica. Sin embargo, sus receptores nucleares se distribuyen en diversos tejidos, con una serie de acciones pleotrópicas, incluyendo el metabolismo de la glucosa. Sus acciones no clásicas incluyen el sistema inmune adaptativo e innato, células beta pancreáticas, corazón, sistema cardiovascular, cerebro y tejidos reproductivos. De este modo, la deficiencia de vitamina D puede estar asociada con un mayor riesgo de hipertensión y de enfermedad cardiovascular.
La forma biológicamente activa es la 1,25-dihidroxi vitamina D. La 25 hidroxi vitamina D, es la forma circulante primaria y es el mejor indicador del estado de vitamina D. Se considera deficiencia de vitamina D un nivel de 25 OH vitamina D<20ng/mL e insuficiencia de vitamina D un nivel de 25 OH vitamina D<30ng/mL (5).
Determinantes de los niveles plasmáticos de vitamina D son la pigmentación de la piel, la exposición al sol, la adiposidad y la dieta. Los obesos tienen una respuesta menor a la radiación UVB (57% menor conversión de 7-dihidrocolesterol a vitamina D3). Los receptores de vitamina D en el tejido adiposo disminuyen su disponibilidad a los tejidos blancos. La actividad física contribuye a la exposición solar y a la disminución de la adiposidad (5).
Existen discrepancias para definir en el embarazo la deficiencia de vitamina D de acuerdo a la concentración de 25 OH vitamina D en <10 o <30ng/mL o <25 o <35nmol/L. Diferentes estudios muestran que el 70–80% de las mujeres embarazadas tienen distintos grados de deficiencia de vitamina D. Otros describen hasta un 5-33% de deficiencia de 25 OH vitamina D según la etnia (5).
En el embarazo, la placenta es el principal activador extrarrenal de vitamina D y a su vez tiene receptores de vitamina D, los cuales tendrían un rol en la implantación embrionaria y en la función placentaria, dado sus efectos angiogénicos, inmuno modulatorios y antiinflamatorios.
Se ha visto que las pacientes que desarrollan diabetes gestacional tienen niveles de 25 OH vitamina D un 20% más bajo. También se ha visto que tiene una fuerte correlación positiva el déficit de vitamina D con el grado de insulino resistencia. Incluso, estudios realizados en etapas iniciales del embarazo, han determinado que por cada 5ng/mL de disminución de 25 OH vitamina D, aumenta 1.29 veces el riesgo de desarrollar diabetes gestacional (5).
Un estudio randomizado de suplementación de vitamina D en el embarazo, administrada en dosis altas y por vía endovenosa en pacientes con diabetes gestacional, se evidenció una mejoría en la sensibilidad a la insulina en estas pacientes (6).
El mecanismo de acción en estas pacientes de la vitamina D, es mediante la regulación del calcio extracelular y del citosol, la cual es fundamental para la respuesta de todos los tejidos a la insulina. Además promueve la expresión y actividad de los receptores de insulina, produce un up-regulation de los genes transportadores de glucosa relacionados a la insulina y aumenta la oxidación de la glucosa. Adicionalmente su deficiencia induce una mayor secreción de hormona paratiroidea, la cual reduce la sensibilidad a la insulina en adultos sanos (5).
La suplementación en altas dosis en pacientes con diabetes gestacional, también ha evidenciado efectos beneficiosos en los niveles de glicemia, insulina, colesterol total y LDL.
Respecto a su asociación con preeclampsia, los resultados son controversiales. Varios estudios observacionales han asociado el riesgo de tener niños pequeños para la edad gestacional en población general, probablemente por su acción en el metabolismo del calcio y crecimiento óseo o alterando la función placentaria. En poblaciones de alto riesgo de desarrollar preeclampsia, se observa una asociación de los niveles de vitamina D en el segundo trimestre con mujeres blancas y no obesas (7). Actualmente, también se encuentra en evaluación la asociación entre el déficit de vitamina D y parto prematuro por tener acciones en la inflamación, inmuno modulación y transcripción de genes involucrados en la función placentaria, que son parte de la patogénesis del parto prematuro. Se ha encontrado asociación con fenómenos inflamatorios, sin evidencia de patología placentaria en pacientes con bajos niveles de vitamina D en el segundo trimestre y parto prematuro antes de las 35 semanas en mujeres de raza no blanca, pudiendo tener la vitamina D un rol en la prevención de algún subtipo de parto prematuro (8).
También se encuentra en estudio la asociación de la deficiencia de vitamina D con aborto recurrente, anemia, patologías alérgicas, depresión postparto y cesárea (9,10).
En 2011 el Colegio Americano de Obstetricia y Ginecología (ACOG), recomendó el tamizaje de rutina de los niveles de 25 OH vitamina D en el embarazo y la suplementación con vitamina D (1000–2000 UI/día en mujeres con alto riesgo de déficit de vitamina D) (11). En cambio la Sociedad de Endocrinología y Metabolismo, recomiendó tamizaje a todas las mujeres durante el embarazo y la lactancia (12).
3. AnemiaLa anemia es frecuente durante el embarazo y es causa de morbimortalidad materna y fetal. Por la entrega subóptima de oxígeno y nutrientes a los tejidos de la madre, placenta y feto (13,14).
La OMS la define como Hb< 11g/dL o un Hcto< 33%, en cualquier trimestre del embarazo y CDC como la presencia en el primer y tercer trimestre Hb< 11g/dL o un Hcto< 33% y en el segundo trimestre Hb< 10.5g/dL o un Hcto< 32% (13).
Afecta casi al 50% de todas las mujeres embarazadas en el mundo; principalmente a mujeres de bajo nivel socioeconómico (52% mujeres en países subdesarrollados; 20% en países industrializados; y 40% en América Latina). Además el riesgo aumenta con la progresión del embarazo (8, 12 y 34% en cada trimestre respectivamente) (13).
Durante el embarazo los requerimientos son aproximadamente de 1.190mg, desde la concepción hasta el parto (tabla 3) (13).
La OMS recomienda complementación férrica para todas las embarazadas, sobre todo durante la segunda mitad del embarazo, sin importar el estado basal de la hemoglobina de 6 a 7mg/24 hrs por 20 semanas o 10mg/24 hrs por 6 a 8 semanas (13).
Durante el embarazo se producen varios cambios fisiológicos y hemodinámicos, que influyen en el desarrollo de la anemia dilucional propia del embarazo, como (13):
- •
Disminución progresiva de niveles de Hb, con un nadir de 10.5g/dl entre las 27 y 30 semanas
- •
Niveles séricos de Ferritina comienzan a disminuir al inicio del tercer trimestre y aumenta el mes previo al parto secundario a una respuesta de fase aguda. Nadir de aproximadamente 15g/uL entre las 35 y 38 semanas
- •
Volumen corpuscular medio puede disminuir en el tercer trimestre
- •
Niveles séricos de Eritropoyetina aumentan en forma constante durante el primer y segundo trimestre, más que en el tercero
- •
Niveles maternos de Hepcidina disminuyen al término del embarazo para facilitar la transferencia de hierro y su uso
- •
Aumento del volumen plasmático las primeras seis semanas de gestación y aumenta en un 50% desde la 6a a 34–36a semana
- •
Disminución del número de glóbulos rojos las primeras 12 semanas, con incremento del 20 a 30% desde la 12a semana al tercer trimestre
- •
Volumen plasmático y número de glóbulos rojos disminuyen el mes final del embarazo y vuelven a valores pre-embarazo por la semana 6 a 8a postparto
El diagnóstico se realiza mediante la sospecha clínica por: astenia, adinamia, palidez de piel y mucosas, taquicardia y/o taquipnea. El diagnóstico de certeza es el hemograma (13).
Anemia por Deficiencia de Hierro (13)Se caracteriza por ser una anemia con hipocromía, microcitosis y anisocitosis. Es la causa más frecuente de anemia en el embarazo y se manifiesta principalmente en el tercer trimestre.
Factores de riesgo son: Pobre ingesta nutricional, alteraciones en la absorción (cirugía bariátrica, antiácidos y deficiencia de micronutrientes como vitamina A, vitamina C, Zinc y Cobre).
Sus manifestaciones clínicas son: Fatiga, palidez, taquicardia, disnea, pobre tolerancia al ejercicio y realización de trabajo en forma subóptima. Depresión postparto, interacción pobre materna/infante, daño en la lactancia, bajo peso nacimiento, parto prematuro, restricción de crecimiento intrauterino y aumento de la mortalidad fetal y neonatal.
Diagnóstico de certeza: Anemia (Hb<10.5–11g/dL o un Hcto<32–33%) asociado a ferritina baja (<15–20ug/L). Si ferritina es normal o elevada, se hace el diagnóstico al presentar hipocromía, microcitosis o disminución del volumen corpuscular medio. Aumento de la concentración del receptor soluble de transferrina.
La forma de prevenirla, es mediante la suplementación oral de hierro desde el comienzo de la gestación hasta tres meses postparto (30mg/d (CDC) o 60mg/d (OMS).
El tratamiento depende del grado de anemia:
- •
Anemia leve (Hb 9 a 10.5g/dl): 160–200mg hierro elemental/ día vía oral (aumento 1g/dL de Hb en días)
- •
Anemia moderada a severa (Hb<9g/dL) en segundo o tercer trimestre, intolerancia oral o respuesta inapropiada a hierro oral: Hierro parenteral
- •
Hierro parenteral + Eritropoyetina humana recombinante: alternativa enembarazadas refractarias a hierro oral
Es la anemia causada por niveles de Folatos <2.5–3ng/mL, Vitamina B12 <160–200pg/ml.
Su importancia está dada porque el crecimiento fetal depende de ambos por participar en la síntesis de tetrahidrofolato, componente integral del DNA y maduración nuclear.
Factores de riesgo son: Baja ingesta o malabsorción intestinal (yeyuno) para folatos y malabsorción intestinal (ileon), resección ileal, parásitos intestinales, gastritis atrófica, antihistamínicos e inhibidores de la bomba de protones para vitamina B12.
Este tipo de anemia corresponde al 2–5% las anemiasnormociticas con cambios leves de megaloblastos en médula ósea, mejoran con la suplementación de ácido fólico. Elevación de Homocisteína o ácido Metilmalónico en la mayoría de los casos se debe a una deficiencia significativa de vitamina B12.
Durante el embarazo la suplementación recomendada es de 400ug/d desde el inicio del embarazo hasta tres meses postparto de ácido fólico y 2.6ug/d de vitamina B12.
Anemia por enfermedades infecciosas (13)Anquilostomiasis (deficiencia de hierro), Malaria (anemia hemolítica) y VIH (anemia por múltiples causas).
Anemia Aplástica (13)La mayor parte de los casos se asocia al embarazo, pero en ocasiones es el embarazo quien induce la anemia aplástica mediante efectos inhibitorios eritropoyéticos de los estrógenos y otras hormonas. La mortalidad materna es alta (20 a 50%), depende de la causa subyacente y ocurre la mayoría de las veces por hemorragia o infección. Se describe también muerte fetal (33%) y parto prematuro por corioamnionitis. El tratamiento se basa en globulinas antitimocito, inmunosupresores y/o transplante de células madres. En algunas ocasiones puede haber remisión espontánea.
HEMOGLOBINOPATÍAS(13): Afectan al 5% de la población mundial, quienes pueden ser portadores o manifestar un desorden de la hemoglobina, como la anemia de células falciformes (70%) y talasemias (30%). Su incidencia depende de la zona geográfica (1/1000 en Estados Unidos y 20/1000 en África occidental).
Anemia de células falciformes (13)Durante el embarazo puede tener crisis periódicas pero las complicaciones ocurren en el tercer trimestre, parto y puerperio. Algunas complicaciones maternas son el embolismo pulmonar, el edema pulmonar agudo, neumonía y crisis severas de dolor. Otros riesgos descritos: accidente vascular encefálico, tromboembolismo venoso, hipertensión pulmonar, infecciones, hemorragia postparto, miocardiopatía, hipertensión pulmonar, preeclampsia/eclampsia, desprendimiento prematuro de placenta normoinserta, parto prematuro, rotura prematura de membranas, restricción de crecimiento intrauterino, bajo peso de nacimiento, cesárea, aumento de frecuencia de aborto espontáneo y mortalidad perinatal. A pesar de todos los riesgos anteriores, los resultados maternos y fetales son generalmente favorables. El embarazo debe ser controlado por un equipo multidisciplinario y con estudios de laboratorio periódicos.
Talasemia (13)Se produce una anemia hemolítica y una eritropoyesis inefectiva, secundaria a la destrucción intramedular de los precursores eritrocitarios.
4. Infección urinariaLas infecciones del tracto urinario son las más frecuentes en el ser humano y en el embarazo, incluso las asintomáticas, y se asocian a un aumento en la morbimortalidad materna y neonatal. Son unas de las pocas infecciones que pueden ser potencialmente prevenibles al ser detectadas en un tamizaje de rutina y ser tratadas según corresponda. Su incidencia oscila entre 3 y 35% de las mujeres embarazadas (15). Existen diferentes tipos:
Bacteriuria asintomáticaPresencia de >105 unidades formadoras de colonias de un germen uro patógeno en ausencia de síntomas. Se presenta en 2 a 7% de las embarazadas y requiere de tratamiento antibiótico. De no ser tratadas pueden evolucionar a pielonefritis aguda (8 a 10%) (15).
CistitisEs la infección de la vejiga asociada a síntomas como disuria, urgencia miccional, poliaquiuria y tenesmo vesical entre otros síntomas. Tambien requiere de tratamiento (15).
Pieloneftitis agudaInfección que afecta a uno o ambos riñones, generalmente se acompaña de fiebre y dolor en fosa lumbar, náuseas y vómitos. Puede o no haber sintomatología urinaria. Se presenta en un 0,5–2% de las embarazadas hospitalizadas en Estados Unidos y 10 a 20% de los casos se presentan en el segundo y tercer trimestre. Un 25% de las pacientes presentan una o más recurrencias durante el mismo embarazo (15,16).
Debido a los cambios fisiológicos anatómicos y hormonales del embarazo, aumenta el riesgo de infecciones ascendentes al riñón, tan precoz como las ocho semanas de gestación. Al progresar una bacteriuria asintomática a una pielonefritis, aumentan los riesgos de bacteremia (15–20%), sepsis (2–12%) anemia (25%), insuficiencia renal aguda, distress respiratorio materna (0.5%), partoprematuro (10%) y corioamnionitis (15,16).
El diagnóstico de la infección urinaria en cualquiera de sus formas se basa en el urocultivo. Los uropatógenos más frecuentes son: Escherichia Coli (95%), Streptococo beta hemolítico grupo B, Staphilococcus Aureus, Klebsiella pneumoniae, Enterococo sp, Streptococo sp, Proteusmirabilis, Staphilococcus coagulasa negativo y Pseudomona (16).
Se debe realizar tratamiento antibiótico con el fin de prevenir las complicaciones y considerar la susceptibilidad antimicrobiana mostrada por el antibiograma. En el embarazo, se usan antimicrobianos betalactámicos y especialmente cefalosporinas. La nitrofurantoina tiene un uso más restringido debido al riesgo potencial, extremadamente bajo de anemia hemolítica en poblaciones susceptibles, cuando se utiliza cercana al término. La ampicilina no debiera utilizarse porque su uso masivo ha generado tasas inaceptables de resistencia, solamente se utiliza para el tratamiento de la bacteriuria asintomática o infección urinaria baja por Streptococcus agalactiae (15).
Entre los antibióticos más utilizados destacan: Cefradina 500mg c/6h, Cefadroxilo y Cefuroximo 500mg c/12h, Nitrofurantoína 100mg c/8h, todos ellos durante siete días. Debe realizarse urocultivo de control cuatro a cinco días de terminado el tratamiento. En caso de persistencia o recidiva de la enfermedad se utilizará el antibiótico según antibiograma. En caso de pielonefritis el tratamiento debe ser por vía e/v y con drogas tales como Ceftriaxona o aminoglucósidos. Las quinolonas están contraindicadas a cualquier edad gestacional por su efecto nocivo sobre el desarrollo del sistema óseo fetal.
5. Insulino resistenciaSe define como la disminución de la respuesta biológica a los aumentos de concentración de insulina en los tejidos blanco (hígado, músculo y tejido adiposo). Se relaciona con la fisiopatología de la Diabetes Mellitus tipo 2, Diabetes gestacional y síndrome metabólico (17).
En el embarazo normalmente disminuye la sensibilidad a la insulina en un 50–60% y aumenta en más de un 200% la secreción de insulina. Al producirse un desbalance entre la insulinoresistencia y la capacidad de compensación de las células pancreáticas beta, se manifiesta la diabetes gestacional. Dicho desbalance es mayor en mujeres obesas y aquellas con insulino resistencia pregestacional (17).
Algunos determinantes para el desarrollo de insulino resistencia, pueden ser tan precoces como eventos in utero, fenómeno llamado programación fetal o memoria metabólica, probablemente secundario a fenómenos epigenéticos (17).
Algunos factores de riesgo son: la raza (mayor en mujeres hispánicas y afroamericanas), el sobrepeso y la vida sedentaria y una síntesis aumentada de adipoquinas (TNF-α, leptina y adiponectina) (17).
El embarazo favorece la insulino resistencia, el incremento de hormonas contraregulatorias (hormona de crecimiento placentario, cortisol y progesterona), la producción placentaria de leptina y citoquinas proinflamatorias (5,17).
El diagnóstico se basa en la determinación de los niveles de insulina basal y postcarga y el cálculo HOMA-IR (Glucosa x Insulina)/405). El tratamiento inicial es con régimen bajo en hidratos de carbono y actividad física. El medicamento más utilizado es la metformina, una biguanida que mejora la sensibilidad a la insulina, disminuyendo las concentraciones plasmáticas de glucosa e insulina en ayunas mediante la inhibición de la gluconeogénesis y aumento del consumo periférico de la glucosa. Además disminuye la absorción intestinal de la glucosa y aumenta la sensiblidad a la insulina. Es metabolizada vía citocromo p 450, se excreta por la orina y tiene una vida media de 6,2 hrs. Generalmente se inicia tratamiento con dosis de 500 a 850mg/día, y se va aumentando gradualmente hasta un máximo de 2500mg/día (18).
Los estudios en pacientes embarazadas no reportan casos de hipoglicemia o acidosis láctica ni asociación a malformaciones congénitas. Su uso en pacientes con síndrome de ovario poliquístico tratadas por infertilidad, muestran mejoría en las tasas de embarazo, menor frecuencia de aborto espontáneo y menor desarrollo de diabetes gestacional sin existir diferencias en los resultados neonatales hasta los 18 meses de vida (18,19).
La metformina es considerada en categoría B según la FDA. Un riesgo potencial es la hipoglicemia neonatal por el paso transplacentario de la droga (10–16%). Otros estudios no muestran diferencias con el uso de insulina. Se considera un medicamento seguro en la lactancia con un paso menor al 10% (18).
Los autores declaran no tener conflictos de interés, en relación a este artículo.