La flora vaginal normal, conformada por múltiples microorganismos, juega un rol fundamental en la mantención de un ambiente adecuado de defensa contra ciertas infecciones durante el embarazo. Cuando se altera puede dar origen a Vaginosis Bacteriana, caracterizada por la presencia de múltiples bacterias en número mayor a lo habitual y que en el embarazo pueden potencialmente desencadenar efectos adversos, tanto en la madre como en el feto. Lo mismo ocurre con otro tipo de infecciones vaginales, como Clamydia y Gonorrea, que además de tener un impacto por ser las principales ETS, sus consecuencias en el feto pueden implicar secuelas de por vida. Si bien Estreptococo grupo B en la vagina no corresponde a una infección propiamente tal, su oportuna identificación y tratamiento durante el embarazo y parto, ha mostrado ser útil en la prevención de secuelas del recién nacido. El siguiente artículo aborda las principales infecciones cérvico vaginales, sus características y potenciales daños tanto para la madre como para su hijo.
The normal vaginal flora, made of multiple microorganisms, plays a main role in the maintenance of a suitable environment for defense against certain infections during pregnancy. When altered, can lead to Bacterial Vaginosis, characterized by the presence of multiple bacteria in greater numbers than usual, and during pregnancy can trigger potentially adverse effects on the mother and the fetus. The same goes for other vaginal infections such as Chlamydia and Gonorrhea, which besides having an impact for being the main STDs, its consequences in the fetus may carry lifelong threats. While Group B Streptococcus located in the| vaginal area does not imply an infection, its early Identification and treatment during pregnancy and childbirth has proved to be useful in preventing neonatal damages. The following article addresses the main cervix vaginal infections, their characteristics and potential harm to both the mother and her child.
En el curso de un embarazo normal, la flora microbiana vaginal comensal juega un rol en la protección contra infecciones por una serie de mecanismos. En la mujer no embarazada, la presencia de Vaginosis Bacteriana (VB) se asocia a un mayor riesgo de infección del tracto genital superior e infecciones de transmisión sexual (1,2) así como infección por VIH (3,4).
Durante el embarazo, VB aumenta el riesgo de sepsis postaborto, aborto temprano, aborto recurrente, aborto tardío, Rotura Prematura de Membranas (RPM) y parto pretérmino espontáneo así como prematurez; lo mismo ocurre con coriamnionitis histológica y endometritis postparto, donde VB es uno de los factores de riesgo (5).
De esta forma, la flora vaginal anormal puede predisponer a una colonización ascendente del tracto genital, infiltración de las membranas fetales e invasión de la cavidad amniótica, con el consecuente daño fetal que desencadena todo este proceso infeccioso (6).
Por otra parte, existe una serie de virus y bacterias que en forma aislada, su sola presencia en la vagina y cérvix puede indicar un potencial riesgo perinatal con resultados adversos, tanto para el futuro hijo como para el futuro reproductivo de la gestante, como lo son chlamydiasy virus herpes, entre otros.
En términos históricos, el estudio del ecosistema de los componentes de la vagina comenzó con la identificación de bacterias específicas por técnicas de cultivo tradicional (7) las que se han mostrado hoy en día, ser insuficientes para la identificación y reconocimiento de la diversidad bacteriana de un sitio en particular, como lo es la flora vaginal. Las técnicas independientes de cultivo han ayudado en este punto a realizar una mejor detección de las distintas bacterias. La aplicación de técnicas de amplificación, clonación y análisis de la secuencia de genes que codifican para el RNA ribosomal bacteriano 16S (métodos genotípicos) aplicados a muestras vaginales directamente, ha permitido la identificación precisa de las especies más comunes de Lactobacillus, mostrando que éste no es siempre la especie microbiana dominante en mujeres aparentemente sanas. De esta forma ha sido posible identificar bacterias que habitan la vagina, pero que se desconocía su calidad de comensal, pudiendo asignar un rol protector dentro de los mecanismos de defensa.
Flora Vaginal Normal. Se define como Flora Vaginal Normal (FVN) a aquellos microorganismos que habitualmente se encuentran en la vagina de mujeres sanas. La flora normal se adquiere con rapidez durante y poco después del nacimiento y cambia de constitución en forma permanente a lo largo de la vida. Si bien se han realizado esfuerzos por determinar cuáles son las características últimas de todos estos microorganismos, aún no existe claridad absoluta de todos los agentes comensales de la FVN.
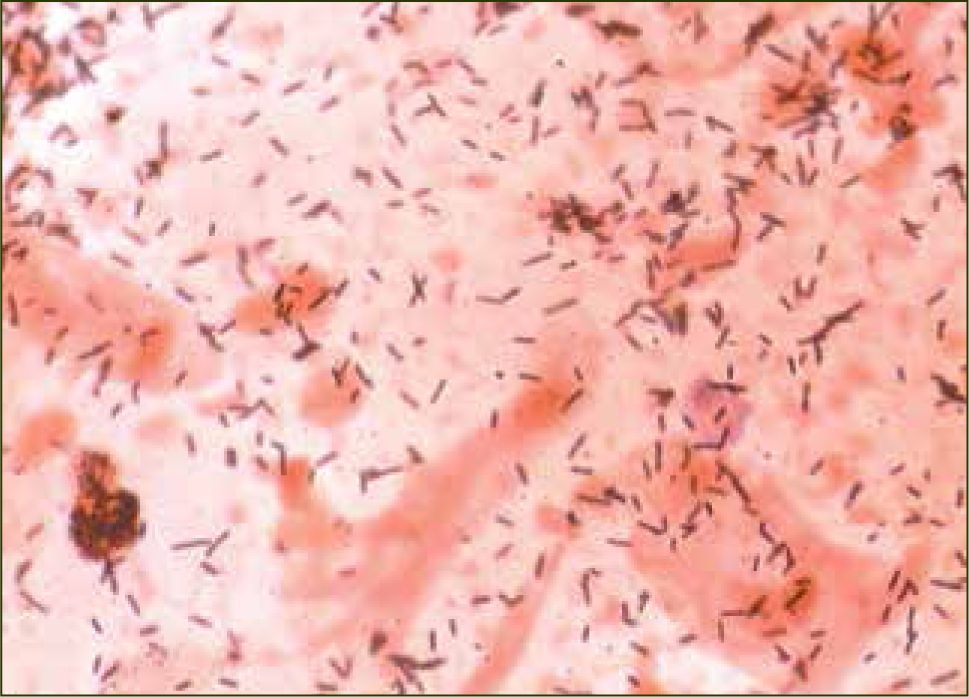
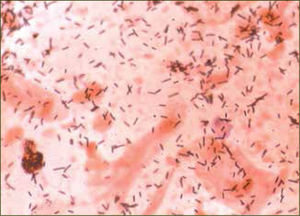
La tabla 1 (8) muestra una relación de los microorganismos que se detectan habitualmente en la vagina de mujeres sanas. La gran mayoría son típicos del hábitat intestinal, lo que sugiere que el tracto entérico podría estar actuando como reservorio de dichos agentes microbianos. Sin embargo, las frecuencias relativas son muy distintas a las que se encuentran en la porción final del tubo digestivo, siendo las diferencias más notables los Lactobacillus (figura 1), que son los dominantes en la vagina, hasta el punto de ser prácticamente exclusivos en muchos casos, mientras que en el intestino son la minoría donde no siempre aparecen y cuando lo hacen, su proporción nunca es mayor del 1 %. El porcentaje de muestras de exudado vaginal, en general, que presentan predominancia de los Lactobacillus es superior al 70%, tanto si el procesamiento incluye el cultivo como si se hace por métodos genotípicos. Por otro lado, las bacterias grampositivas o gramnegativas anaerobias estrictas de los grupos Clostridium-Eubacterium y Bacteroides-Prevotella, respectivamente, que dominan el hábitat del intestino, aparecen esporádicamente en la vagina, lo que sugiere que en esta mucosa son transeúntes más que colonizadoras.
Microorganismos presentes en la va gina de mujeres sanas
| Cocos y bacilos grampositivos anaerobios aerotolerantes | Lactobacillus |
| Streptococcus | |
| Cocos y bacilos grampositivos anaerobios facultativos | Corynebacterium |
| Gardnerella | |
| Staphylococcus (fundamentalmente) | |
| S.epidermidis | |
| Bacilos gramnegativos anaerobios facultativos | Escherichia |
| Klebsiella | |
| Proteus | |
| Micoplasmas | Mycoplasma (sobre todo M.hominis) |
| Ureaplasma | |
| Bacilos y cocos grampositivos anaerobios estrictos | Atopobium |
| Peptococcus | |
| Peptostreptococcus Clostridium | |
| Bifidobacterium | |
| Propionibacterium | |
| Eubacterium | |
| Cocos y bacilos grampositivos anaerobios facultativos | Bacteroides |
| Prevotella |
La presencia predominante de las distintas especies de Lactobacillus promueven un ambiente sano al estar en mayor número, por una parte y produciendo ácido láctico para mantener el ambiente ácido, el cual es inhóspito para muchas bacterias y se correlaciona en forma negativa con VB (9). Por otra parte, Lactobacillus produce también Peróxido de Hidrógeno (H2O2) (10), bacteriocinas, que son radicales hidroxilados tóxicos y que inhiben el crecimiento de bacterias de similares características a la que la producen (11); y probióticos (12).
En la actualidad se ha logrado identificar a más de 120 especies de Lactobacillus, de las cuales más de 20 han sido detectadas en la vagina. Utilizando técnicas moleculares, se puede determinar que FVN no contiene un alto número de especies diferentes de Lactobacillus. Es más, uno o dos Lactobacillus de un rango de tres o cuatro especies (principalmente L.crispatus y L.iners; L. jensenii y L.gasseri) son los dominates; mientras que las otras especies son raras, bajas en títulos y tienden a ser nuevos filotipos (5).
1Vaginosis bacteriana (VB)El nombre deVaginosis Bacteriana ovaginitis no específica fue denominado por un grupo de bacterias que son las causantes etiológicas del cuadro, sin la asociación de una respuesta inflamatoria. Este síndrome clínico se debe al excesivo crecimiento de bacterias que normalmente pudiesen estar en la vagina en menor número que el habitual. Numerosos estudios han mostrado la relación entre Gardnerella vaginalis con otras bacterias como causantes de VB, como son Lactobacillus -principalmente L.gasseri (13)- Prevotella y anaerobios que incluyen Mobiluncus, Bacteroides, Peptostreptococcus, Fusobacterium, Veillonella y Eubacterium. Mycoplasma hominis, Ureaplasma urealyticum, Streptococcus viridans y Atopobium vaginae también has sido asociados con VB (14).
En Estados Unidos, la tasa de VB en embarazadas es de aproximadamente un 16%, siendo diferente este número según grupo racial: 23% en mujeres afroamericanas, 6% en mujeres asiáticas y 4% en mujeres blancas. En Chile, su prevalencia varía entre 27 y 32% en la población general, cifra que se duplica en mujeres con parto prematuro o enfermedad inflamatoria pélvica (15). La infección puede ser transmitida al feto a través de la placenta, causando en casos extremos la muerte fetal.
- a)
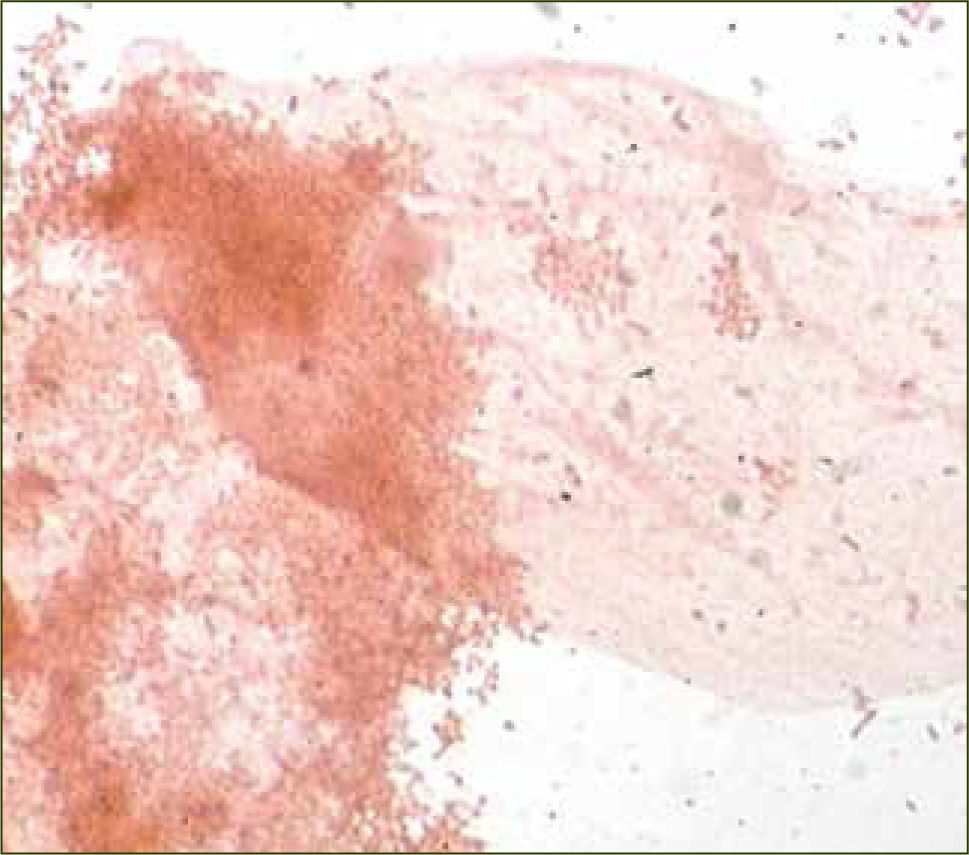
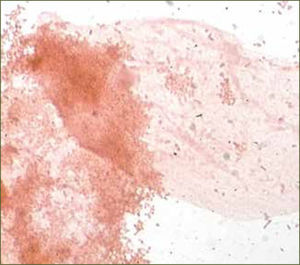
Etiología. Los organismos responsables de VB dependen del pH vaginal. Con un pH de más de 4,5, Gardnerella vaginalis (figura 2) y bacterias anaerobias se convierten en los microorganismos principales de la vagina. La etiología es de naturaleza polimicrobiana sin embargo, está asociada a las bacteriasy sus especies distintas mencionadas previamente.
- b)
Clínica. VB puede ser asintomática en un grupo de pacientes, pero sus manifestaciones clínicas habituales son flujo vaginal anormal, con olor desagradable como a pescado, especialmente después de relaciones sexuales. El flujo se describe como blanco o grisáceo, y puede ir acompañado de ardor miccional o leve prurito alrededor de la vagina.
Las diferentes bacterias pueden ascender y colonizar las membranas, disminuyendo de esta forma la fuerza de tensión de las mismas y causando un debilitamiento de la matriz de las membranas, secundario a la producción de metaloproteasas, que desencadenaría RPM. La infección por G.vaginalis también se asocia con la producción de prostaglandinas, lo que podría desencadenar contracciones uterinas, ablandamiento del colágeno del cérvix y finalmente parto prematuro sin respuesta efectiva a tocolíticos. Según un metanaálisis realizado en 2007, VB presenta doble riesgo de parto prematuro en pacientes asintomáticas (OR: 2.16, 95% CI: 1.56–3.00) y en pacientes con síntomas de parto prematuro (OR: 2.38, 95% CI: 1.02–5.58).También aumenta el riesgo de aborto tardío (OR: 6.32, 95% CI: 3.65–10.94) e infección materna (OR: 2.53,95% CI 1.26–5.08) en pacientes asintomáticas (16).
- c)
Diagnóstico. Además del cuadro clínico, el examen microscópico del flujo es esencial para el diagnóstico de VB.
En el examen microscópico de flujo, tres de los cuatro criterios de Amsel son necesarios para el diagnóstico de VB (17):
- 1.
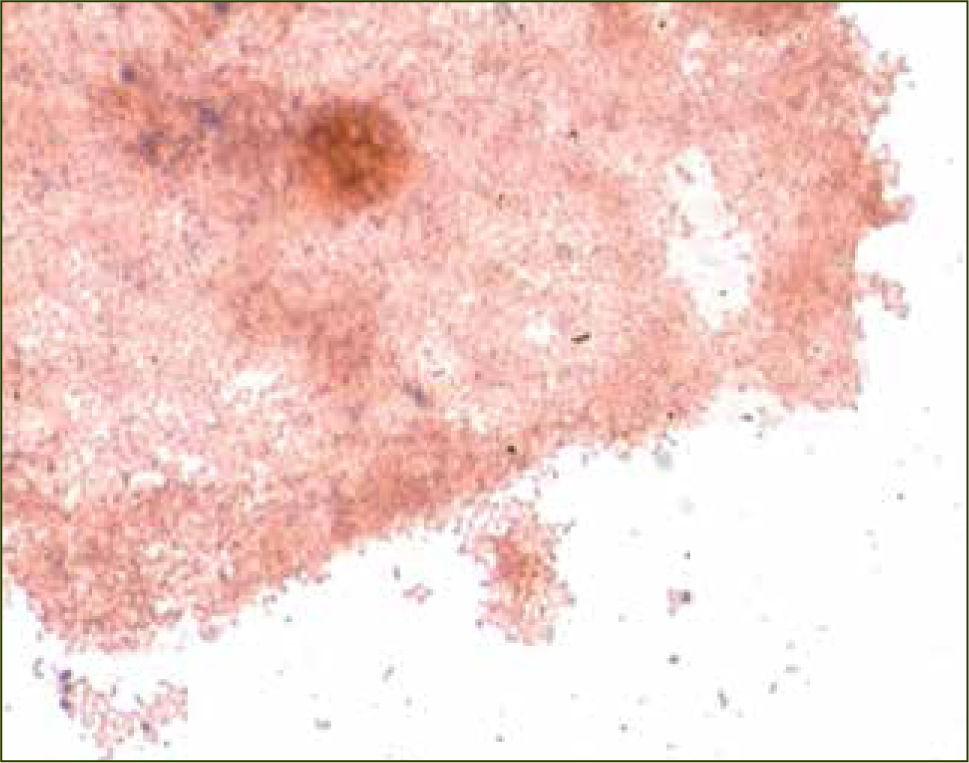
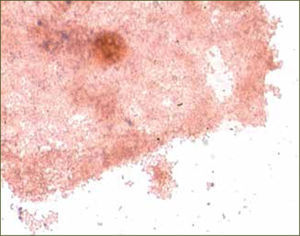
Presencia de Clue cells: Células epiteliales vaginales que tienen un aspecto punteado debido a agregados de cocobacilos (figura 3)
- 2.
pH vaginal sobre 4,5 (90% de las pacientes)
- 3.
Flujo vaginal homogéneo, blanco grisáceo, delgado que recubre la pared vaginal
- 4.
Whiff test positivo, o test de KOH: Olor tipo pescado que se produce cuando se agrega solución al 10% de hidróxido de potasio al flujo vaginal obtenido (70% de las pacientes)
Si por otro lado, se utilizan los criterios del Gram del flujo, se debe cuantificar la presencia de las distintas bacterias y sus características morfológicas, siguiendo los criterios de Nuguet (18), los cuals evalúan tres tipos de bacterias a través de las cadenas de gram: Lactobacillus, Bacteroides/Gardnerella y Mobiluncus. Éstas son clasificadas en una escala de 1–4 (1+ es < 1 célula por campo, 2+ es entre 1–5 células por campo, 3+ es 6–30 células por campo, y 4+ es >30 células por campo.) Con este sistema, a Lactobacillus y Bacteroides/Gardnerella se les asignan puntos entre 0–4, pero a Mobiluncus sólo se le clasifica entre 0-2. El puntaje total obtenido es usado y clasificado como sigue:
Normal: 0-3 Recuento intermedio de bacterias: 4–6 Vaginosis Bacteriana: 7–10.
Ante la ausencia de los medios adecuados, estudios en países subdesarrollados han mostrado que el empleo de dos de los criterios de Amsel, en especial pH elevado y Testde Whiff positivo, bastarían para el diagnóstico de VB (19).
- 1.
- d)
Tamizaje. En la actualidad y según la evidencia hasta ahora disponible, numerosas instituciones de salud como CDC en Estados Unidos (20), ACOG, el Grupo Cochranepara Embarazo y Recién Nacidos, entre otros (21), no recomiendan el tamizaje de VB en embarazos asintomáticos. Distinta es la situación cuando se trata de embarazos de alto riesgo de parto prematuro (por ejemplo, embarazadas con un parto prematuro previo), donde sí tendría beneficio el pesquisar la presencia de VB y su posterior tratamiento.
- e)
Tratamiento. El tratamiento de VB se debe realizar en toda embarazada con sintomatología según se indica en la tabla 2. Aunque VB se asocia a resultados perinatales y maternos adversos según lo señalado previamente, en la actualidad el tratamiento se considera beneficioso en la reducción de síntomas de embarazadas sintomáticas y en el potencial efecto beneficioso en la reducción de riesgo de adquisición de otras enfermedades infecciosas de trasmisión sexual o VIH.
Mycoplasma hominis y Ureaplasma urealyticum, se consideran en forma conjunta en los estudios. El rol de estos microorganismos en Metronidazol 500mg oral 2 veces/día por 7 días Metronidazol 250mg oral 3 veces/día por 7 días Clindamicina 300mg oral 2 veces/día por 7 días infección durante el embarazo y su capacidad de infectar a la placenta y el feto ha sido motivo de controversia. En particular, el rol en la prematuridad podría estar asociado a mecanismos relacionados con la capacidad de estas bacterias de producir citoquinas inflamatorias, desencadenando un parto prematuro de origen infeccioso, por lo que es importante considerarlos y tratarlos frente a cuadros de VB con cultivos positivos para estos agentes y factores de riesgo de prematuridad (22).
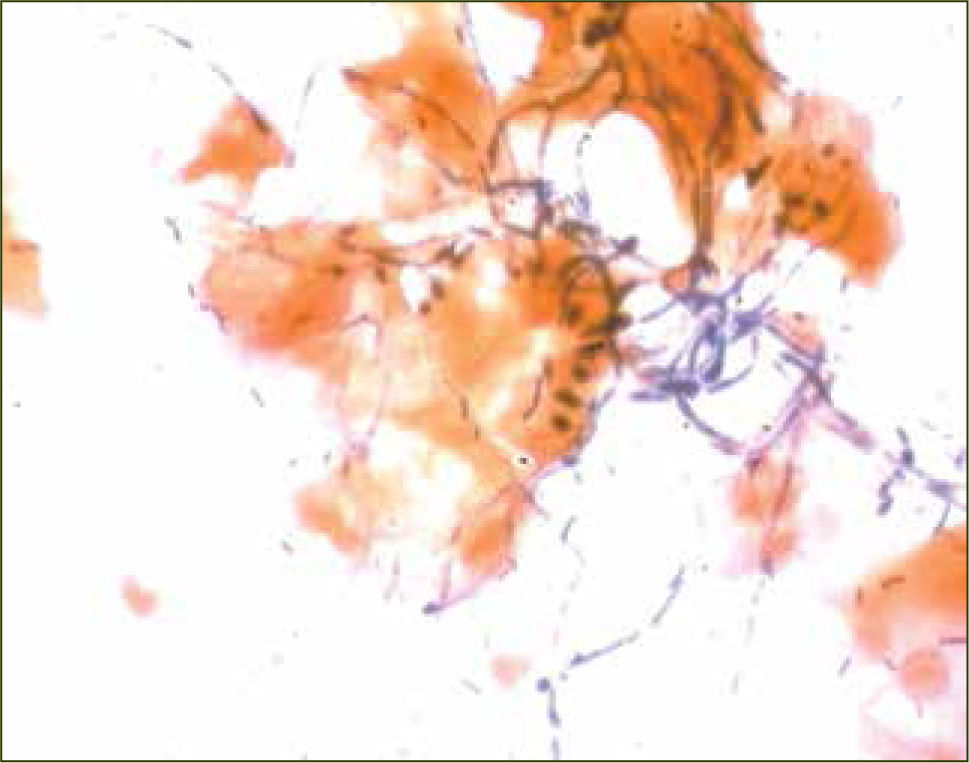
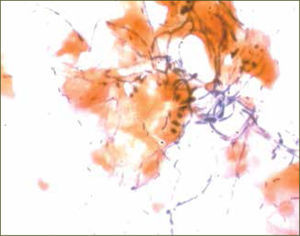
La vulvovaginitis por Candida es una de las afecciones vulvovaginales más frecuente. Al menos el 75% de las mujeres referirá un cuadro único de candidiasis vulvovaginal y entre 40 y 45% podrá presentar dos o más episodios en su vida (23). Su agente causal, en el 90% de los casos, corresponde a Candida albicans, (figura 4) en cuadros únicos o recurrentes, existiendo además otras especies menos frecuentes causantes de esta afección (Candida glabrata, Candida parapsilosis y Candida tropicalis). C.albicans es una de las levaduras saprofíticas que puede estar presente en el 25 al 30% de las mujeres sexualmente activas (24), pudiendo actuar como agente patógeno oportunista en circunstancias especiales cuando se compromete la inmunidad o los mecanismos locales de defensa, entre los que destaca diabetes mellitus, embarazo, obesidad, uso reciente de antibióticos o corticoides, así como cualquier tratamiento inmunosupresor. El embarazo por su parte, debido a los cambios hormonales caracterizados por aumento de la producción de estrógenos que producen a su vez mayor concentración de glicógeno vaginal, junto con la supresión de la inmunidad celular, se asocia no solamente con altos índices de colonización, sino que también con altos índices de infección y recurrencias. Como infección propiamente tal, es la segunda después de VB (15% de las embarazadas) y sólo en casos excepcionales puede causar una infección sistémica (pacientes con sepsis o inmunosupresión importante) (25).
- a)
Clínica. El factor clave a considerar en la patogénesis de Candidiasis Vaginal, es que de ser un microorganismo comensal puede evolucionar a agente causal de vulvovaginitis, con cuadros excepcionales invasivos o diseminados, en cuyos casos sigue la misma vía de infección que cualquier otro microorganismo: colonización y adhesión de C.albicans a la piel o mucosa, penetración de la mucosa y barrera epitelial, infección local y diseminación.
El cuadro clínico es bastante característico, siendo los síntomas principales prurito y ardor vaginal, los que se pueden exacerbar posterior a actividad sexual o durante la micción. Los hallazgos clínicos incluyen edema y eritema de vestíbulo, labios mayores y menores, con la presencia de flujo vaginal blanco, sin olor, espeso, similar a leche cortada o cuajada, que se desprende en forma fácil de las paredes vaginales (26).
El diagnóstico se realiza en forma fácil por el cuadro clínico antes descrito, pero ante la duda del agente causal de vulvovaginitis, se puede realizar test con KOH al 10% en flujo vaginal que revela la presencia de hifas o pseudohifas, o bien a través de la aplicación de cultivos específicos para hongos (27).
Las manifestaciones clínicas de infección en el recién nacido van desde pequeñas infecciones locales de piel o mucosas, como la infección orofaringea (muguet oral), la más frecuente, hasta cuadros severos de hemorragias o infección sistémica con necrosis de cerebro, corazón, pulmones, riñones y otros órganos nobles, donde el cuadro de candidiasis congénita se manifiesta dentro de las primeras 24 horas de vida y es producto de una infección intrauterina o de una colonización vaginal severa al momento del parto y nacimiento, con mecanismos similares a los agentes involucrados en la infección intraamniótica, que incluyen a la vía hematógena, invasión de membranas e infección ascendente luego de rotura de membranas. La presencia de algún cuerpo extraño intrauterino, como puede ser el cerclaje, se asocia como factor de riesgo de candidiasis congénita. Es importante tener en cuenta que si bien, este cuadro de infección local es frecuente, no se asocia con parto prematuro, bajo peso al nacer o RPM (28).
- b)
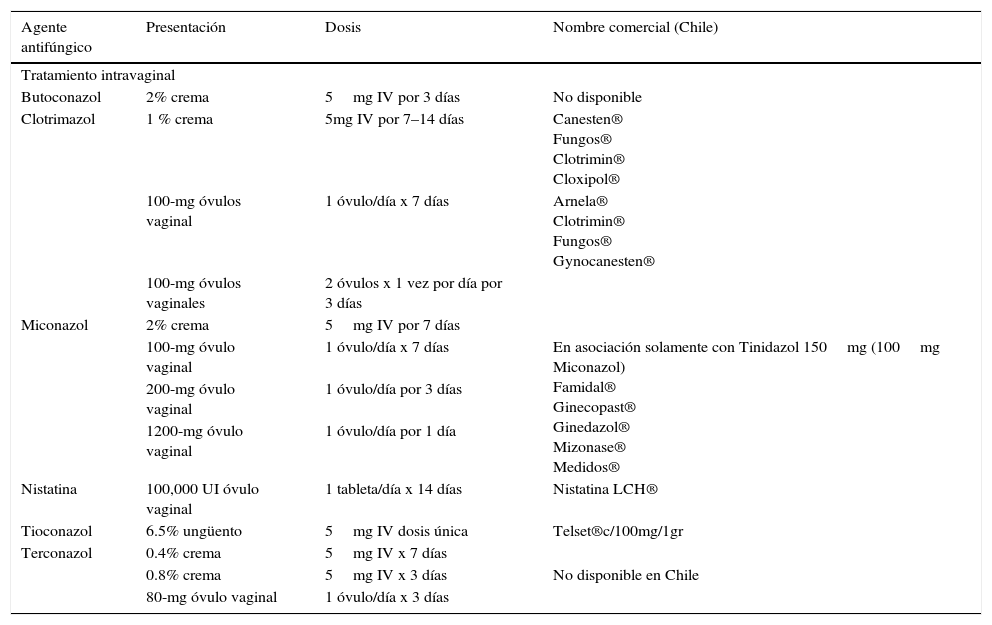
Tratamiento. La tabla 3 muestra los diferentes esquemas de tratamiento aprobados para su uso en el embarazo, siendo de preferencia los derivados azólicos locales como los de primera línea por siete días. Las terapias más largas, entre 7-14 días asociadas a terapias orales cada tres días por dos dosis, estarían indicadas en vulvovaginitis complicadas (recurrencias severas, sintomatología severa).El tratamiento de las parejas sexuales se realiza en el caso de vulvovaginitis recurrente o parejas con balanitis clínica.
Tabla 3.Tratamientos recomendados para Vulvova ginitis por Candida (CDC 2006)
Agente antifúngico Presentación Dosis Nombre comercial (Chile) Tratamiento intravaginal Butoconazol 2% crema 5mg IV por 3 días No disponible Clotrimazol 1 % crema 5mg IV por 7–14 días Canesten®
Fungos®
Clotrimin®
Cloxipol®100-mg óvulos vaginal 1 óvulo/día x 7 días Arnela®
Clotrimin®
Fungos®
Gynocanesten®100-mg óvulos vaginales 2 óvulos x 1 vez por día por 3 días Miconazol 2% crema 5mg IV por 7 días 100-mg óvulo vaginal 1 óvulo/día x 7 días En asociación solamente con Tinidazol 150mg (100mg Miconazol)
Famidal®
Ginecopast®
Ginedazol®
Mizonase®
Medidos®200-mg óvulo vaginal 1 óvulo/día por 3 días 1200-mg óvulo vaginal 1 óvulo/día por 1 día Nistatina 100,000 UI óvulo vaginal 1 tableta/día x 14 días Nistatina LCH® Tioconazol 6.5% ungüento 5mg IV dosis única Telset®c/100mg/1gr Terconazol 0.4% crema 5mg IV x 7 días No disponible en Chile 0.8% crema 5mg IV x 3 días 80-mg óvulo vaginal 1 óvulo/día x 3 días Agente antifúngico Presentación Dosis Nombre comercial (Chile) Tratamiento oral Fluconazol 150-mg tableta oral 1 comp/dosis única. Se repite al tercer día según necesidad Diflucan®
Felcar®
Felsol®
Fluctin®
Ibarin®
Micofin®
Microvaccin®
Plusgin®
Tavor®
La infección por Clamydia puede afectar una serie de órganos, incluyendo el aparato genitourinario. El grupo Chlamydiae corresponde a pequeños pequeñas cocáceas agrupadas en cadena gram negativos que infectan el epitelio escamocelulare incluyen al grupo Chlamydia, donde Chlamydia trachomatis es la especie principal; y al grupo Chlamydophila (Chlamydophila pneumoniae y Chlamydophila psittaci). C.trachomatis se puede diferenciar en 18 serotipos asociados a diferentes patologías:
- •
Serotipos A, B, Ba, y C - Producen Trachoma: enfermedad ocular endémica de África y Asia caracterizada por conjuntivitis crónica y que puede llevar a ceguera
- •
Serotipos D al K - Infección del tracto genital
- •
Serotipos L1-L3 - Producen el Lifogranuloma Venéreo, asociado a úlcera genital en países tropicales.
La infección por C.trachomatis es, en la actualidad, el agente más frecuente responsable de las enfermedades de transmisión sexual en Estados Unidos, con tres millones de nuevas infecciones anualmente (29) y una incidencia en el embarazo de 2 a 3%, siendo mayor en ciertos grupos más vulnerables. En Chile, se estima que la tasa de infección de adolescentesy mujeres jóvenes es del 6,9% (30). Cuando estas pacientes no son tratadas, existe el potencial riesgo de resultados reproductivos adversos, como enfermedad inflamatoria pélvica y secuelas como infertilidad tubaria, embarazo ectópico y dolor pélvico crónico. Por su parte, en el embarazo no existe claridad de asociación directa entre esta infección y parto prematuro, RPM, bajo peso al nacer o muerte neonatal, pues si bien muchos estudios han mostrado esta asociación, otros no han sido capaces de comprobarlas (31,32). Se postula que aquellas pacientes con IgM positivos para C.trachomatis durante el embarazo, serían indicadores de infección aguda y por tanto, con un mayor riesgo de resultado perinatal adverso que aquellas pacientes con infección crónica. Por su parte, en el recién nacido la infección puede ocasionar conjuntivitis neonatal y neumonía (33,34).
Su mecanismo de patogenicidad presenta dos fases: una extracelular, durante la cual la bacteria forma una especie de espora, al tomar contacto con la célula huésped, llamado cuerpo elemental, y que es resistente al medio ambiente. La segunda fase, una vez fagocitada por la célula, se transforma en un cuerpo reticulado, que por un lado impide a través de distintos mecanismos la lisis de esta fagocito y por otro, la síntesis de DNA, RNA y proteínas, utilizando la energía de la célula huésped para formar más cuerpos elementales y así infectar otras células. La transmisión entonces, es a través de contacto directo, donde un hombre infectado puede transmitir al 25% de sus parejas sexuales, sí como también la transmisión vertical en un 50-60% de los casos, especialmente en la segunda fase del parto.
- (a)
Clínica. A diferencia de otras Enfermedades de Transmisión Sexual (ETS), C.trachomatis puede ser asintomática en la mayor parte de la población (80%). La sintomatología puede incluir flujo vaginal, sangrado vaginal postactividad sexual o sin relación a menstruación, dispareunia, entre otros. Siempre se debe considerar como factor causal en recién nacidos con cuadro de neumonía, sobre todo afebril y conjuntivitis.
- (b)
Diagnóstico. El cultivo de C.trachomatis es difícil de obtener con muchos falsos negativos, por factores como técnica de procesamiento (por ejemplo, cadena de frío) y por el número alto de recursos que implica su procesamiento, entre otros factores. Sin embargo, es el único medio recomendable en caso de sospecha de abuso sexual o en situaciones específicas como conjuntivitis de inclusión en niños y trachoma ocular. En el caso de toma de muestras de cérvix, el epitelio columnar del endocérvix es el sitio blanco más frecuentemente afectado por este microorganismo en la mujer. Las muestras son obtenidas con tórulas, una vez visualizado el cuello uterino con ayuda de un espéculo sin lubricantes. Luego de limpiar el ectocérvix y orificio cervical, se introduce una tórula de algodón en el canal endocervical, la distancia suficiente como para que no se observe la punta de algodón. Se efectúa una rotación por algunos segundos y se retira cuidando de no contaminar con secreción vaginal. Las muestras para cultivo y RPC son inoculadas en buffer sacarosa fosfato (2SP). Para el diagnóstico mediante Inmunoflruorecencia Directa (IFD), la muestra es rodada sobre un portaobjeto limpio, mientras que para Ensayo Inmunoenzimático (EIA) y técnicas de amplificación de los ácidos nucleicos, se inocula el medio de transporte diseñado por el fabricante. Las muestras para cultivo celular son transportadas de inmediato en hielo y sembradas, o congeladas a -70°C. Las láminas para IFD y medios de transporte para EIA y técnicas de amplificación de los ácidos nucleicos deben ser almacenadas según las recomendaciones del kit (35).
Las técnicas de amplificación de ácido nucleico (NAATs) tienen muy buena sensibilidad y especificidad el estudio de C.trachomatis, pudiendo identificar pacientes con inóculos bajos del microorganismo y en muestras urinarias donde no se requiere un test invasivo. Dentro de este grupo está la técnica de PCR, TMA (amplificación mediada por transcripción).
- (c)
Tratamiento. Si bien en Estados Unidos existe la recomendación de screening de C.trachomatis para todas las mujeres sexualmente activas menores de 25 años, no hay pautas definidas para realizar lo mismo en nuestro país. El CDC recomienda el estudio de C.trachomatis en todas las embarazadas durante el primer trimestre, para prevención de complicaciones tanto en la madre como en el recién nacido (36). La tabla 4 muestra el esquema de tratamiento en embarazadas. La prevención actual se basa en prácticas de sexo seguro (monogamia, condón) y el tratamiento de todos los pacientes asintomáticos. En la actualidad no existen vacunas para prevención.
Tabla 4.Tratamiento para infección de c.trachomatis en el embarazo
Tratamientos recomendados 1. Azitromcina 1mgVO en dosis única 2. Amoxicilina 500mgVO3/día x7 días Tratamientos alternativos 1. Eritromicina 500mg VO 4/día x 7 días 2. Eritromicina 250mg VO 4/día por 14 días 3. Eritromicina etilsuccinato (jarabe) 800mg - VO 4/día x 7 días 4. Eritromicina etilsuccinato - 400mg VO 4/día x 14 días
Gonorrea es la ETS más antigua y corresponde a la segunda en frecuencia después de C.trachomatis. Es causada por Neisseria gonorrhoeae, un diplococo gram negativo que puede ser asintomático en el 50% de los casos. La embarazada infectada puede transmitir la infección al recién nacido en el momento del parto, provocándole secuelas graves y crónicas por lo cual, la detección y tratamiento oportuno de esta enfermedad evitaría dichas complicaciones.
- (a)
Clínica.N.gonorrhoeae puede infectar útero, cérvix y Trompas de Falopio, con el eventual riesgo de infertilidad o embarazo ectópico. La gran mayoría de las embarazadas son asintomáticas y sólo algunos reportes aislados señalan algunas manifestaciones como flujo vaginal mucopurulento proveniente del endocérvix, disuria, inflamación de glándulas de Skene y Bartholino. La endocervicitis puede desencadenar RPM precoz, coriamnionitis, aborto séptico, RCIU, prematuridad y sepsis postparto. El cuadro de proctitis se desarrolla en el 50% de las mujeres con gonorrea, sobre todo ante la presencia de relaciones sexuales anales. Otro grupo puede desarrollar faringitis gonocócica, también asintomática, siendo la faringe el único sitio afectado en muchos casos.
Los recién nacidos expuestos a N.gonorrhoeae durante un parto vaginal, pueden presentar un cuadro de conjuntivitis agudo conocido como oftalmia neonatorum, sepsis, artritis o meningitis. Sin duda la medida más importante de prevención es el screening y tratamiento de la embarazada infectada.
La infección gonocócica diseminada es causada por la bacteremia de N.gonorrhoeae, siendo el embarazo un factor predisponente a este cuadro. Su presentación clásica es la del síndrome artritis-dermatitis, con poliartralgia migratoria, rash vesico-pustular en articulaciones distales, asociado a fiebre.
- (b)
Screening. Como la gran mayoría de las embarazadas infectadas son asintomáticas, el screening de N.gonorrhoeae es esencial para evitar complicaciones (37), por lo cual ACOG y CDC en Estados Unidos recomiendan el screening a toda embarazada con factores de riesgo para gonorrea (tabla 5) a través de cultivo endocervical, en la primera visita y luego en el tercer trimestre.
Tabla 5.Factores de riesgo para gonorrea en el embarazo
1. Embarazadas con su pareja hombre con gonorrea o uretritis 2. Pacientes con otro tipo de ETS, incluido VIH 3. Paciente con múltiples parejas sexuales 4. Mujeres jóvenes y adolescentes, solteras, urbanas 5. Mujeres drogadictas 6. Mujeres con síntomas y signos de infección del tracto genital inferior - (c)
Diagnóstico. Para una adecuado diagnóstico, las muestras se deben obtener de los potenciales sitios infectados (endocérvix, faringe, recto, uretra) y puestas directamente en medio de cultivo Thayer-Martin. Tanto los cultivos como NAATs, son útiles para el diagnóstico. En el caso de diagnóstico inmediato, el estudio de gram de las secreciones endocervicales puede mostrar diplococo gram negativo en leucocitos polimorfonucleares.
- (d)
Tratamiento. Al iniciar el tratamiento de gonorrea, es importante considerar que N.gonorrhoeae se caracteriza por desarrollar resistencia a múltiples terapias de antibióticos y la sensibilidad de las cepas de gonococos a diferentes antibióticos es materia de permanente revisión. Las cefalosporinas son el tratamiento de elección en Chile (38) y Estados Unidos, administrado en una dosis de ceftriaxona 250mg intramuscular y como alternativa azitromicina 2 grVO por una vez.
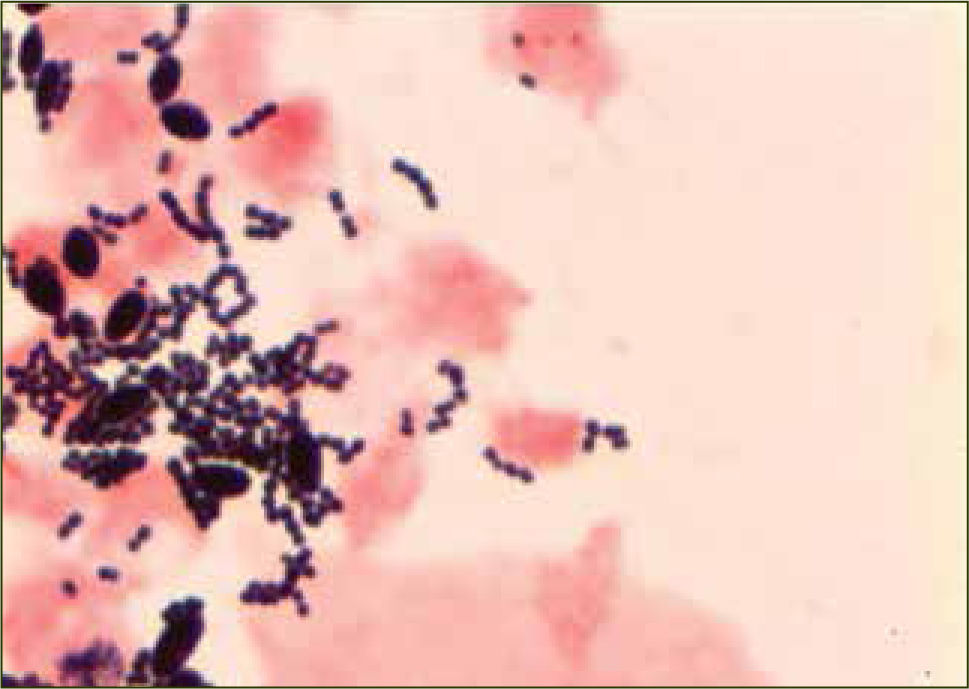
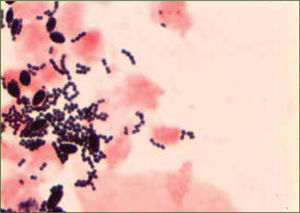
La infección connatal por Estreptococo Grupo B (EGB) o Streptococcus agalactiae sigue siendo una de las principales causas de morbilidad y de mortalidad en los recién nacidos, tanto en Estados Unidos (39) como en el resto del mundo. EGB pertenece al grupo de estreptococo que corresponde al grupo B de Lancefield, según el patrón de hemólisis que estos presentan. El grupo B es aerobio facultativo, gram positivo, diplococo que se agrupa en cadenas y que crece en una variedad de medios bacteriológicos (figura 5). Entre 1 y 2% de las cadenas son no hemolíticas. Para poder mejorar el porcentaje de detección de muestras escasas desde sitios como zona genital o gastrointestinal, es que se utilizan una serie de medios de caldo de cultivos selectivos, dentro de los que se dentro de los que se encuentran medios Todd-Hewitt con o sin glóbulos rojos de oveja y con agentes antimicrobianos como ácido nalidixico y gentamicina o colistina.
- (a)
Epidemiología. Portación asintomática. EGB se puede aislar desde el tracto genital o desde la zona baja del aparato intestinal de las embarazadas en porcentajes que varían entre un 15% a un 40%. Si la muestra es tomada desde el tercio inferior de la vagina y del recto, en vez del cuello uterino y si además, se utiliza un medio de cultivo selectivo, puede mejorar en un 30 a 50% la tasa de detección en la colonización de EGB. El hecho de tomar la muestra desde la semana 35 de embarazo también optimiza la sensibilidad para predecir colonización al momento del parto. En Chile las tasas de portación varían entre un 10 y 20% en estudios realizados en medios de cultivo selectivo (40,41). El principal reservorio de EGB es el tracto intestinal bajo y en general la proporción de aislamiento de recto versus vagina es mayor a uno, siendo el recto el sitio preciso para predecir portación crónica y posterior colonización del tracto genital (42). Se cree que existen también reservorios a nivel genital también, pero correspondería a grupos muy minoritarios de la población.
Transmisión a Recién Nacido. El recién nacido se coloniza con EGB a través de dos vías: una ascendente o in utero, y la otra al momento del parto. Sin mediar acción, la tasa de transmisión vertical de una madre colonizada a su hijo es alrededor de 50% (43) y aquellos recién nacidos cuyas madres tienen una colonización importante o bien factores de riesgo tienen mayor riesgo de desarrollar una infección invasiva de comienzo temprano. La colonización puede ser también observada en unidades de cuidado neonatal cuando existen hospitalizaciones prolongadas, o por propios miembros del grupo familiar, ambos casos por contaminación de las mucosas de los recién nacidos.
- (b)
Clínica. EGB es el microorganismo aerobio más frecuente aislado como agente único o bien junto con una flora polimicrobiana, en pacientes que presentan un cuadro de endometritis postparto de inicio temprano. La mitad de los casos de bacteremia asociadas al embarazo se relacionan con infección del tracto genital superior, placenta o amnios, provocando como resultado la muerte fetal. Otras manifestaciones corresponden a bacteremia en un tercio de las pacientes y sin foco aparente, endometritis sin muerte fetal, coriamnionitis sin muerte fetal, neumonía y sepsis puerperal (44). Se estima que EGB es responsable del 15% de endometritis postparto, 15% de bacteremias puerperales y de 15% de infección de herida operatoria de cesárea (45). Los síntomas y signos de infección local por lo general, se presentan dentro de las primeras 48 hrs postparto. En aquellas pacientes que son portadoras de EGB y que tienen un parto vía cesárea, tienen más riesgo de endometritis, mayor número de rotura prematura de membranas y fiebre postparto si se compara con el grupo de pacientes no colonizadas que tuvieron cesárea. Muchas de las manifestaciones clínicas de endometritis pueden no ser tan específicas, pudiendo presentar fiebre con o sin calofríos, decaimiento, sensibilidad uterina moderada y loquios de leve mal olor (46). Las complicaciones más severas de una endometritis como el absceso pélvico, shock séptico o la tromboflebitis pelviana son raras de observar durante una infección por EGB. Otra de las manifestaciones clínicas de EGB durante el embarazo corresponde a infección del tracto urinario en cualquier trimestre, siendo en la mayoría de los casos asintomática, pudiendo dar manifestaciones como cistitis o más raro aún, pielonefritis.
- (c)
Infección neonatal de inicio temprano. Se define como aquella donde se desarrolla un cuadro de infección sistémica dentro de los primeros seis días de vida, teniendo una media de 12 horas de vida al momento del inicio del cuadro. Aquellos niños que nacen antes de las 37 semanas tienen mayor riesgo de desarrollar la enfermedad invasiva. Los tres cuadros principales en este grupo son septicemia o bacteremia (80–85%) sin foco aparente, neumonía (10%) y meningitis (5–10%) (44)
- (d)
Infección de inicio tardío. Se presenta entre los 7 y 89 días de vida, con una media de 36 días. Se estima que un 50% de los niños afectados corresponden a pretérmino, con tasas de mortalidad de 3 a 5%. La bacteremia sin foco de infección aparente (65%) y la meningitis (25–30%) son las manifestaciones clínicas más frecuentes (44).
- (e)
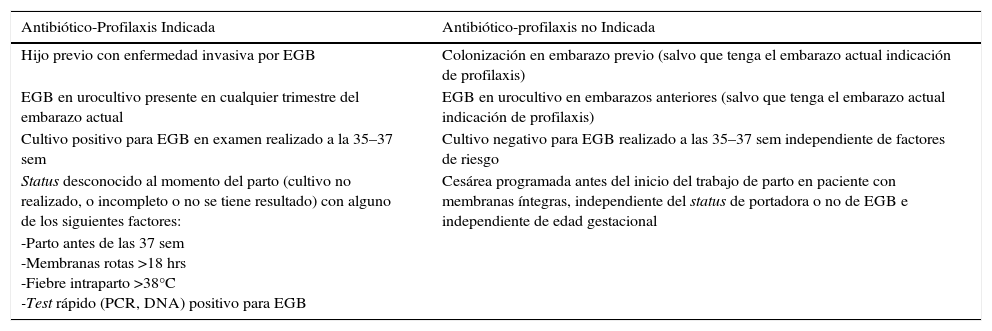
prevención de enfermedad de inicio temprano por Egb. El primer reporte sobre el uso de profilaxis antibiótica endovenosa intraparto data del año 1980 y desde entonces, los distintos trabajos clínicos en esta área han logrado establecer que se produce una reducción efectiva en la transmisión vertical de EGB, medido tanto en el nivel de colonización del niño como de protección para la enfermedad de inicio temprano. Los estudios recientes muestran que la efectividad de esta medida oscila entre 86 y 89% para prevenir la aparición de este cuadro (47). La tabla 6 muestra las indicaciones para profilaxis antibiótica en prevención de enfermedad EGB.
Tabla 6.Indicaciones para uso de antibiótico-profilaxis en la prevención de enfermedad invasiva por EGB
Antibiótico-Profilaxis Indicada Antibiótico-profilaxis no Indicada Hijo previo con enfermedad invasiva por EGB Colonización en embarazo previo (salvo que tenga el embarazo actual indicación de profilaxis) EGB en urocultivo presente en cualquier trimestre del embarazo actual EGB en urocultivo en embarazos anteriores (salvo que tenga el embarazo actual indicación de profilaxis) Cultivo positivo para EGB en examen realizado a la 35–37 sem Cultivo negativo para EGB realizado a las 35–37 sem independiente de factores de riesgo Status desconocido al momento del parto (cultivo no realizado, o incompleto o no se tiene resultado) con alguno de los siguientes factores: Cesárea programada antes del inicio del trabajo de parto en paciente con membranas íntegras, independiente del status de portadora o no de EGB e independiente de edad gestacional -Parto antes de las 37 sem
-Membranas rotas >18 hrs
-Fiebre intraparto >38°C
-Test rápido (PCR, DNA) positivo para EGB - (f)
Toma de muestra. Tomar la muestra del tercio inferior de la vagina seguida del recto (atravesando el esfínter anal). Se puede utilizar una tórula o dos. Las muestras cervicales, perianales, perirectales no son adecuadas para la determinación de portación de EGB y no es necesario el uso de espéculo. Colocar la muestra en un medio de transporte adecuado (Stuart o Amies). La muestra es viable en el medio de transporte por un par de días a temperatura ambiente; sin embargo, el rescate de colonias declina más allá de uno a cuatro días, especialmente a temperaturas elevadas, lo que puede llevara un falso negativo. Cuando sea posible, la muestra deberá ser refrigerada antes de procesarla. Se deberá indicar la solicitud específica para EGB y en aquellas pacientes que son alérgicas a penicilina, determinar el riesgo de anafilaxis. Cuando este riesgo es alto, se deberá solicitar específicamente antibiograma con estudio de resistencia para clindamicina y eritromicina.
- (g)
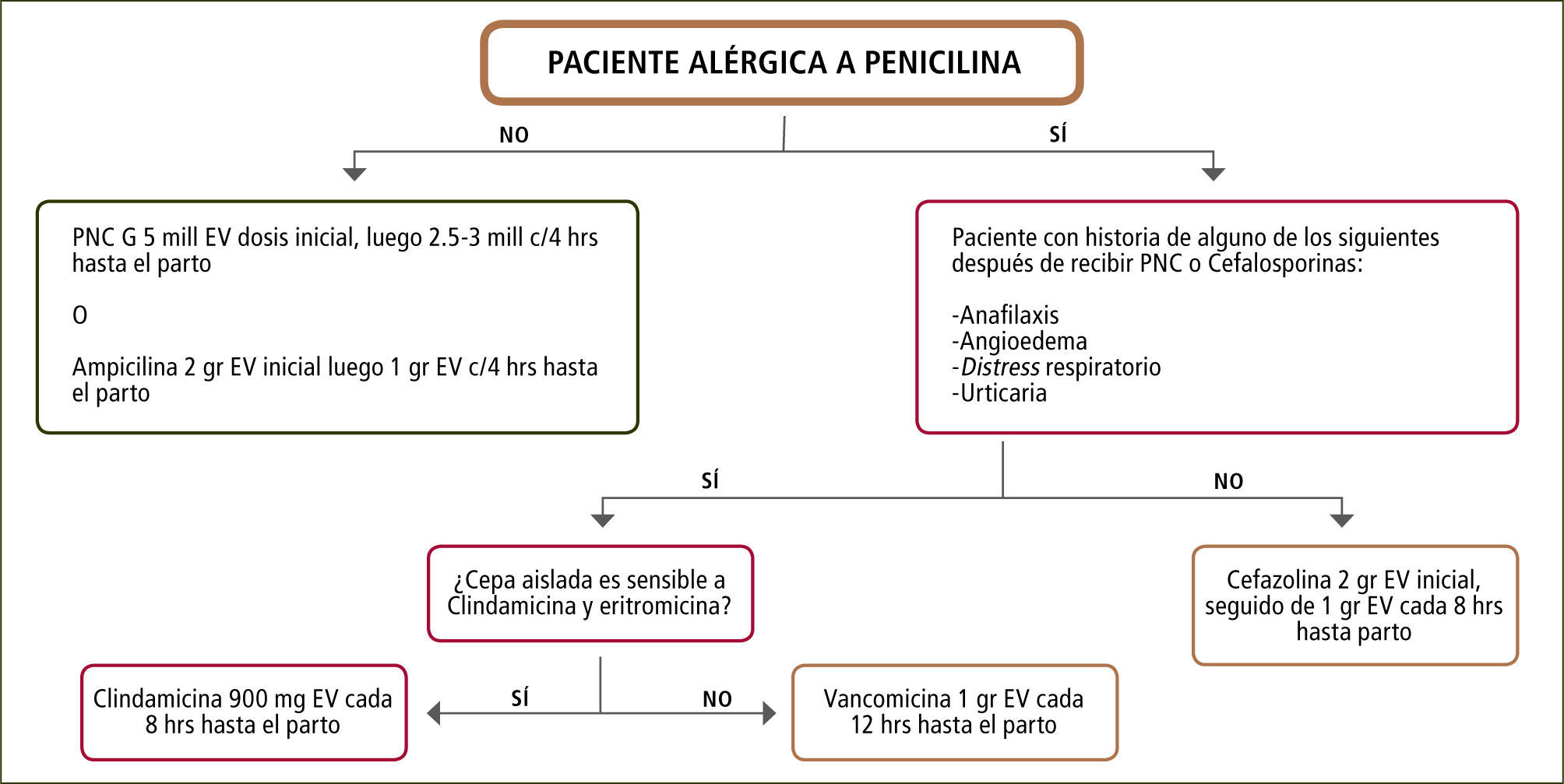
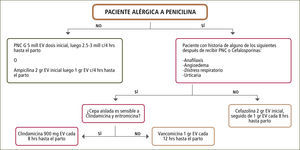
Tratamiento. Penicilina y ampicilina han mostrado ser útiles en la prevención de infección por EGB. Las dosis de ambos antibióticos en la profilaxis intraparto están dirigidas a alcanzar nivel adecuados en la circulación fetal y en líquido amniótico evitando los potenciales niveles séricos de daño neurotóxico en la madre y en el feto. Esta administración debe ser al menos de cuatro horas antes del parto para lograr una prevención efectiva de transmisión de EGB. La eficacia de tratamientos alternativos a estos antibióticos en madres alérgicas a penicilina, para la prevención de enfermedad de inicio temprano, carece de estudios controlados. Se ha propuesto el uso de cefazolina, que tiene un espectro de acción con similar farmacodinamia que penicilina pero existe un 10% de la población alérgica a penicilina que presentará reacción de hipersensibilidad inmediata con el uso de este antibiótico. Por otro lado, el usodeclindamicina, eritromicina ovancomicina carecen de estudios que señalen su uso óptimo para lograr niveles bactericidas en la circulación fetal y en el líquido amniótico (39). La figura 6 muestra el esquema de manejo en pacientes con o sin alergia a penicilina.
Esta revisión abordó los principales microorganismos a los cuales el personal de salud se enfrenta en forma rutinaria y que pueden provocar alguna alteración tanto en la madre como en su futuro hijo. Se debe considerar que la flora comensal juega un rol fundamental en la mantención de un ambiente óptimo para el desarrollo de un embarazo sin patología y que su estudio avanza día a día en la identificación de sus componentes esenciales, considerando además que pudiesen existir variaciones en diversas poblaciones.
La sospecha oportuna de infecciones clásicas como C.trachomatis o Neisseria gonorrhoeae y su tratamiento efectivo asegurarán un resultado reproductivo exitoso. Por otro lado, si bien aún no existen protocolos formales de manejo de la infección connatal por Estreptococo Grupo B, el manejo de embarazadas portadoras de EGB a través de estas pautas ya probadas en Estados Unidos da la tranquilidad de una reducción exitosa de la enfermedad de tipo invasiva por EGB en RN, en la espera de un programa nacional aplicable a toda la población que nos permita una monitorización e identificación adecuada de toda la población embarazada.
El autor declara no tener conflictos de interés, en relación a este artículo.