El paro cardíaco intra-hospitalario es habitualmente precedido de deterioro clínico que puede durar horas o días. Protocolos desarrollados para detectar el deterioro clínico e intervenir a tiempo y adecuadamente pueden prevenir el paro cardíaco. Las condiciones que originan deterioro clínico son mayoritariamente respiratorias y cardiovasculares. El manejo del deterioro clínico frecuentemente requiere el traslado del paciente a unidades de mayor complejidad. Los protocolos de reanimación cardiopulmonar (RCP) deben incluir procedimientos para activar los sistemas de rescate, iniciar RCP básica por personal testigo incluyendo uso de desfibriladores, continuación con RCP avanzada por equipos de especializados considerando uso de técnicas de mayor eficacia hemodinámica, y finalmente manejar el período post-paro cardíaco en unidades de cuidados intensivos. La calidad de la RCP se puede definir en base a parámetros específicos e incluir tecnología para monitorear su efectividad. Cada centro hospitalario tiene la responsabilidad de organizar sistemas de prevención y rescate que otorguen seguridad al paciente hospitalizado.
In-hospital cardiac arrest is usually preceded by clinical deterioration that can last for hours or days. Protocols developed to detect clinical deterioration and intervene early and properly can prevent cardiac arrest. The conditions that cause clinical deterioration are mainly respiratory and cardiovascular. The management of clinical deterioration often requires the transfer of patients to more complex units. Cardiopulmonary resuscitation (CPR) protocols should include procedures to activate rescue systems, initiate basic CPR by witness personnel including use of defibrillators, advanced CPR by specialized teams considering the use of techniques with higher hemodynamic efficacy, and finally manage the post-cardiac arrest period in intensive care units. The quality of CPR can be defined based on specific parameters and include technology to monitor its effectiveness. Each hospital has the responsibility of organizing systems to prevent and respond to cardiac arrest that provide safety to the hospitalized patient.
El paro cardíaco es lamentablemente un evento frecuente en el ambiente intra-hospitalario. Se estima que en los Estados Unidos ocurren ∼209000 paros cardíacos intrahospitalarios cada año en adultos con una sobrevida promedio del 24.8%1. En comparación, en el mismo país cada año ocurren ∼395000 paros cardíacos extra-hospitalarios con una sobrevida promedio en los cuales se intenta reanimación cardiopulmonar (RCP) de sólo un 12%1. Los mecanismos de paro cardíaco son diferentes. Mientras el paro cardíaco extra-hospitalario en la gran mayoría de los casos es un evento súbito en individuos activos, el paro cardíaco intra-hospitalario es frecuentemente el resultado de un deterioro clínico que a menudo no es reconocido o no es tratado apropiadamente. Este deterioro típicamente ocurre en forma gradual en un período de horas o días2,3. En un porcentaje inferior, dependiendo de la proporción de pacientes con enfermedad cardiovascular, el paro cardíaco intra-hospitalario puede presentarse con el perfil extra-hospitalario y por lo tanto, en forma súbita.
La razón principal de esta diferencia reside en los mecanismos de paro cardíaco. En el ambiente extra-hospitalario – especialmente en el adulto – el paro cardíaco es en la gran mayoría un evento cardíaco primario frecuentemente vinculado a enfermedad coronaria. En este contexto, existe un sustrato predisponente y un gatillo del evento que se manifiesta como fibrilación ventricular, actividad cardíaca eléctrica sin pulso, o asistolia. En el ambiente intra-hospitalario, el paro cardíaco es frecuentemente el resultado de trastornos extra-cardíacos de origen respiratorio, hemodinámico, o neurológico que ocasionan disminución crítica de la oxigenación miocárdica ocasionando disminución de la contractilidad que culmina en una actividad cardíaca eléctrica sin pulso y finalmente asistolía. Sin embargo, pacientes admitidos al hospital por problemas cardiovasculares médicos o quirúrgicos pueden también desarrollar paro cardíaco en forma súbita, frecuentemente ocasionado en esta población por fibrilación ventricular4,5.
Dadas estas diferencias, el enfrentamiento al paro cardíaco intrahospitalario debe considerar la oportunidad de reconocer el deterioro clínico e intervenir para prevenir la progresión hacia el paro cardíaco. Por lo tanto, recursos hospitalarios deben concentrarse en el desarrollo de sistemas de reconocimiento precoz del deterioro clínico e intervención oportuna. Estos esfuerzos enfocados en la prevención, deben trabajar en conjunto con mecanismos de respuesta rápida en casos de paro cardíaco súbito, en los cuales reconocimiento del evento, inicio de maniobras de rescate por testigos y optimización de las maniobras de rescate son extremadamente importantes, similar al manejo del paro cardíaco extra-hospitalario. El ambiente intra-hospitalario también permite el acceso a un mayor número de personal de rescate, instrumentos de monitoreo y en ciertos centros especializados la disponibilidad de técnicas de mayor eficacia hemodinámica como la circulación extracorpórea. Por estas y otras razones, el enfoque del paro cardíaco intra-hospitalario difiere del enfoque del paro cardíaco extra-hospitalario. A pesar de estas diferencias, los fundamentos fisiológicos de la RCP son esencialmente los mismos y el éxito o fracaso depende en gran medida de la calidad con la cual se implementan.
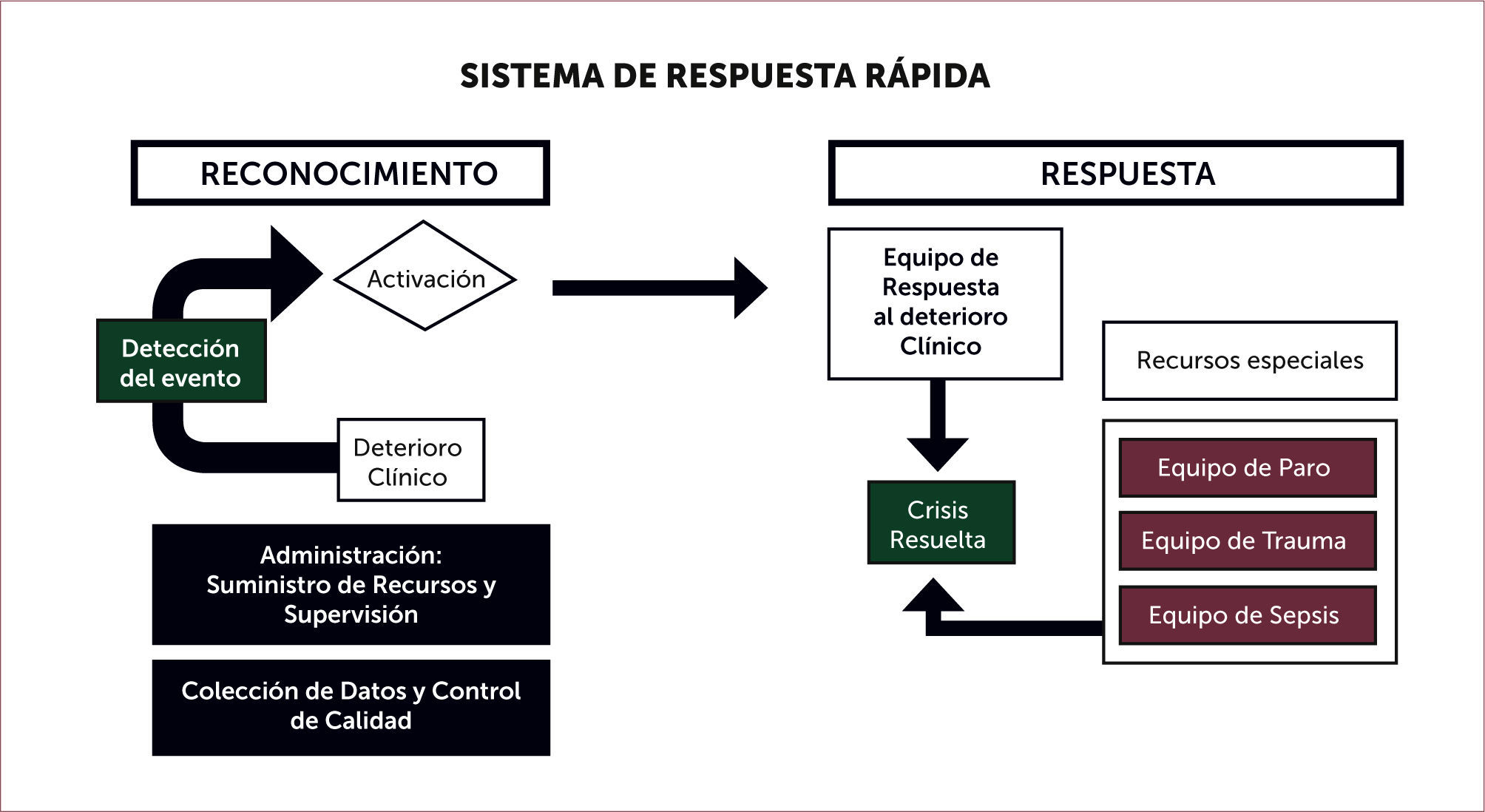
PREVENCIÓN DE PARO CARDÍACO Y SISTEMAS DE RESPUESTA RÁPIDAEl reconocimiento de deterioro clínico como mecanismo fundamental de paro cardíaco intra-hospitalario ha dado origen a sistemas de reconocimiento y respuesta rápida. El primer sistema se originó en Australia6 y subsecuentemente en múltiples instituciones en muchos países. El concepto moderno fue conceptualizado por un comité internacional de intensivistas, anestesiólogos, y médicos de emergencia de Australia, Canadá, Estados Unidos, Noruega, Reino Unido, Suecia, y Taiwán3 como se ilustra en la Figura 1. Estos sistemas son requeridos en Estados Unidos por organismos de acreditación hospitalaria3, y requieren que los hospitales dispongan de:
- (a)
Un sistema de reconocimiento de deterioro clínico con criterios específicos y disponibles para todo el personal médico.
- (b)
Un mecanismo de activación de los sistemas de rescate disponibles para el personal médico así como familiares y conocidos del paciente.
- (c)
Un mecanismo de respuesta que permita manejar el deterioro clínico.
Los métodos utilizados en el reconocimiento del deterioro clínico se basan en la identificación de alteraciones de parámetros fisiológicos por sobre valores umbrales predefinidos en conjunto con eventos clínicos como es la alteración del estado de conciencia, uso de músculos respiratorios accesorios, caída de la diuresis, o simplemente preocupación del personal médico. Alteraciones de parámetros fisiólogos típicamente se centran en los signos vitales identificando valores umbrales bajos y altos (p.ej., frecuencia respiratoria <8 o >28 respiraciones por minuto; oximetría de pulso <90%, frecuencia cardiaca <40 o >140 pulsaciones por minuto; presión arterial sistólica <80 o >200mmHg; entre otros). También existen métodos en los cuales el umbral gatillo depende de la adición de puntos basado en el nivel de anormalidad de varios parámetros fisiológicos7.
La mayoría de los sistemas funcionan con equipos de rescate que evalúan e intentan tratamiento en el lugar del paciente. La composición de estos equipos varía y pueden estar formados por enfermeras, terapéutas respiratorios, becados (residentes) de medicina interna o de cuidados intensivos, o equipos mixtos. También existen sistemas organizados alrededor de los servicios de cuidados intensivos. En nuestro centro hospitalario el reconocimiento de deterioro clínico en cualquier lugar del hospital gatilla la activación del sistema de respuesta rápida mediante una llamada a un centro de despacho (que también se utiliza para la activación del equipo de RCP). La llamada se transfiere a la unidad de cuidados intensivos donde la enfermera evalúa la razón de la llamada y la condición del paciente y en conjunto con el médico residente de intensivo que examina el paciente en su lugar de origen y discute con el intensivista tratante se decide el curso a seguir. Un porcentaje alto de los pacientes son traslados a una unidad de mayor complejidad.
La evidencia científica en apoyo a estos sistemas de reconocimiento y rescate ha sido elusiva, con algunos estudios demostrando un efecto favorable8–12 mientras otros13,14 – especialmente el estudio prospectivo más grande reportado a la fecha15 – dudando de la efectividad en reducir paros cardíacos y admisiones no planeadas a unidades de cuidados intensivo. Sin embargo, revisiones sistemáticas más recientes a pesar de reconocer fallas metodológicas en muchos de los estudios7,16 apoyan un efecto favorable17,18, especialmente en sistemas liderados por intensivistas16.
MANIOBRAS DE RCP Y SU APLICACIÓN CLÍNICAIndependiente del mecanismo por el cual se llega al paro cardíaco, le probabilidad de lograr reestablecer la actividad cardíaca y lograr una sobrevida con función neurológica adecuada depende fundamentalmente de1 la prontitud con la cual se reconoce el evento y se inician las maniobras de RCP,2 la calidad y continuidad de estas maniobras y3 el manejo post-paro luego de reestablecida la circulación espontánea.
Reconocimiento del paro cardíacoEl reconocimiento de paro cardíaco debe ser un acto rápido y simple, basado en1 ausencia de respuesta a estímulos verbales y táctiles y2 ausencia de respiración normal dado que con frecuencia la víctima en paro cardíaco desarrolla respiración agonal, que no debe ser confundida con respiración normal. La respiración agonal ocurre por hipoxia cerebral y refleja la liberación de centros nerviosos normalmente suprimidos. Se reconoce por la activación intensa y simultánea de todos los músculos inspiratorios. La respiración agonal genera ventilación y cierto grado de flujo sanguíneo que tiene un efecto benéfico ayudando al éxito de las maniobras de reanimación19. La detección de pulso para el diagnóstico de paro cardíaco es un punto de discusión dada su baja sensibilidad y especificidad y no es recomendada para el rescatador lego. Se le enseña al rescatador profesional y a personal médico; sin embargo, el intento de detección no debe prolongarse más allá de 10 segundos o simplemente omitir e iniciar la RCP. El efectuar compresión torácica en individuos que no están en paro cardíaco pude causar ocasionalmente daños menores a la caja torácica sin mayor consecuencia y por lo tanto, es aconsejable – cuando en duda – iniciar la RCP20.
RCP básicaLa frecuencia de fibrilación ventricular o taquicardia ventricular sin pulso como causa de paro cardíaco intrahospitalario es inferior a su frecuencia en el ambiente extra-hospitalario, y corresponde típicamente a un porcentaje inferior al 25%4. Sin embargo, el pronóstico es superior al paro cardíaco con actividad eléctrica organizada sin pulso o asistolia4. Por lo tanto, la capacidad para reconocer y rápidamente administrar un choque eléctrico no sincronizado en este grupo de pacientes debe considerarse como intervención prioritaria; aún antes de la llegada del equipo de rescate. Recintos hospitalarios (o en lugares dentro de recintos hospitalarios) en los cuales la llegada de los equipos de rescate no es inmediata (p.ej., menos de 4 minutos), el uso de desfibriladores automáticos externos deben ser considerados como alternativa a los desfibriladores manuales para ser operados por personal sin entrenamiento previo21, sin desmedro del inicio rápido de maniobras básicas de RCP mientras se despliega un desfibrilador. Los desfibriladores automáticos externos se pueden también considerar en lugares donde se congrega público dentro de los hospitales para su uso en caso de paro cardíaco en visitantes. Sin embargo, estudios clínicos actuales no han logrado demostrar la eficacia de desfibriladores automáticos externos en recintos hospitalarios, especialmente cuando los equipos de rescates responden en pocos minutos22,23. Por lo tanto, la decisión en cuanto a su uso debe ser considerada de acuerdo a las circunstancias locales de cada recinto hospitalario.
Maniobras de reanimación básica: Cese del flujo sanguíneo a consecuencia de paro cardíaco ocasiona isquemia tisular, la cual es de mayor intensidad en el corazón y cerebro dada sus demandas energéticas mayores. El objetivo primordial de las maniobras de reanimación es promover flujo sanguíneo sistémico priorizando la perfusión en estos órganos requerido para el restablecimiento de la actividad cardíaca inicial y subsecuentemente sobrevida sin daño neurológico. Demora en el inicio de las maniobras de reanimación compromete el propósito último; de ahí, la importancia de activar el sistema de rescate intra-hospitalario inmediatamente luego de reconocido el paro cardíaco y de iniciar maniobras de RCP básica mientras llega el equipo de rescate. Las maniobras de RCP básica son conceptualmente simples y consisten en promover flujo sanguíneo sistémico mediante compresión torácica y asegurar la mantención de oxigenación sanguínea.
Estas maniobras de RCP deben ser aprendidas por todo el personal médico y utilizadas cada vez que ocurre un paro cardíaco. Las pautas de reanimación cardíaca del 2015 destacan la importancia de la calidad de estas maniobras. Específicamente, se recomienda que el tórax sea comprimido con el paciente descansando en una superficie firme a una profundidad entre 5 y 6cm, a una frecuencia entre 100 y 120 por minuto, permitiendo la re-expansión completa del tórax y disminuyendo las interrupciones de modo que el porcentaje de tiempo durante el cual se efectúan maniobras de compresión – la fracción de compresión torácica – no sea inferior al 60%20. Los fundamentos hemodinámicos de estas recomendaciones se discuten más adelante.
En cuanto a la ventilación, es importante reconocer las circunstancias conducentes al paro cardíaco. Cuando el paro cardíaco es primario (es decir, de origen cardíaco) y por lo tanto, ocurre en forma súbita y presenciado, es adecuado asumir que existe una reserva de oxígeno en los pulmones, la sangre y los tejidos al momento del cese circulatorio. Aún más, esta reserva de oxígeno se renueva con la movilización de gas que ocurre debido a respiraciones agonales y la compresión torácica siempre que se mantenga una vía aérea abierta. Esta reserva de oxígeno permite iniciar las maniobras de RCP utilizando solamente compresión torácica mientras se espera la llegada del equipo de rescate. La duración de esta reserva de oxígeno no se ha definido con precisión, pero probablemente (basado en estudios preclínicos) dura entre 4 y 6 minutos24. Sin embargo, si los individuos efectuando RCP básica están entrenados en ventilación de rescate – como debería ser en personal médico – se recomienda que se efectúe junto a la compresión torácica20. La recomendación especifica es de 30 compresiones seguido por una pausa durante la cual se efectúan dos ventilaciones en pacientes sin vía área establecida. Dada la diversidad de mecanismos de paro cardíaco en el ambiente intrahospitalario (Tabla 1) y su etiología extra-cardíaca en la mayoría de los casos incluyendo falla respiratoria25, el uso de ventilación de rescate en las reanimaciones cardiopulmonares intra-hospitalarias parece razonable. Sin embargo, un estudio reciente de cohorte en más de 10000 pacientes demostró un efecto negativo asociado a la intubación traqueal intentada durante los 15 minutos iniciales de la RCP intra-hospitalaria26. Sin bien los mecanismos responsables de este efecto adverso no están claros, es posible especular que se relacionen con interrupciones en la RCP durante intentos de intubación.
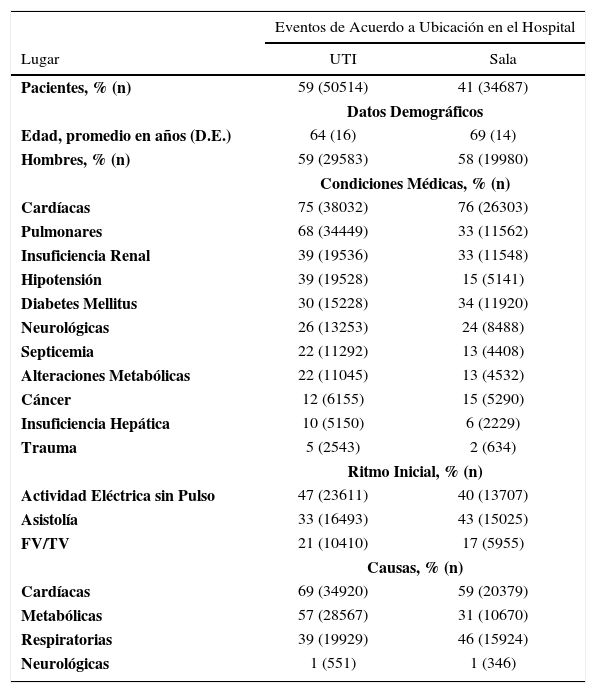
CARACTERÍSTICAS DEL PARO CARDÍACO INTRA-HOSPITALARIO
| Eventos de Acuerdo a Ubicación en el Hospital | ||
|---|---|---|
| Lugar | UTI | Sala |
| Pacientes, % (n) | 59 (50514) | 41 (34687) |
| Datos Demográficos | ||
| Edad, promedio en años (D.E.) | 64 (16) | 69 (14) |
| Hombres, % (n) | 59 (29583) | 58 (19980) |
| Condiciones Médicas, % (n) | ||
| Cardíacas | 75 (38032) | 76 (26303) |
| Pulmonares | 68 (34449) | 33 (11562) |
| Insuficiencia Renal | 39 (19536) | 33 (11548) |
| Hipotensión | 39 (19528) | 15 (5141) |
| Diabetes Mellitus | 30 (15228) | 34 (11920) |
| Neurológicas | 26 (13253) | 24 (8488) |
| Septicemia | 22 (11292) | 13 (4408) |
| Alteraciones Metabólicas | 22 (11045) | 13 (4532) |
| Cáncer | 12 (6155) | 15 (5290) |
| Insuficiencia Hepática | 10 (5150) | 6 (2229) |
| Trauma | 5 (2543) | 2 (634) |
| Ritmo Inicial, % (n) | ||
| Actividad Eléctrica sin Pulso | 47 (23611) | 40 (13707) |
| Asistolía | 33 (16493) | 43 (15025) |
| FV/TV | 21 (10410) | 17 (5955) |
| Causas, % (n) | ||
| Cardíacas | 69 (34920) | 59 (20379) |
| Metabólicas | 57 (28567) | 31 (10670) |
| Respiratorias | 39 (19929) | 46 (15924) |
| Neurológicas | 1 (551) | 1 (346) |
UTI, unidades de tratamiento intensivo; FV/TV, fibrilación ventricular o taquicardia ventricular. Análisis basado en 85.201 paros cardíacos ocurridos entre Enero del 2003 a Septiembre del 2010 en 445 hospitales participantes en el registro Get With the Guidelines—Resuscitation (GWTG-R). Adaptado de Perman SM, Stanton E, Soar J, Berg RA, Donnino MW, Mikkelsen ME, et al. Location of In-Hospital Cardiac Arrest in the United States-Variability in Event Rate and Outcomes. J Am Heart Assoc 2016 Sep 29;5(10):e003638.
Es importante destacar aspectos fisiopatológicos de la RCP pertinentes a la reanimación avanzada. Las maniobras convencionales de compresión torácica son muy limitadas en la cantidad de flujo sanguíneo capaz de generar, raramente superior al 25% del gasto cardíaco normal y por lo tanto insuficiente para satisfacer las demandas metabólicas corporales. El cese circulatorio gatilla una respuesta neurohumoral muy intensa que incluye activación del sistema adrenérgico y liberación de vasopresina produciendo una redistribución preferencial del flujo sanguíneo hacia órganos vitales como el corazón y cerebro mediante vasoconstricción de territorios no inmediatamente vitales como el territorio esplácnico, el músculo esquelético y la piel. Lamentablemente esta respuesta no es suficiente y agentes vasoconstrictores son requeridos en la mayoría de las RCPs. A pesar de estos esfuerzos, la isquemia miocárdica persiste durante la reanimación y en el mejor de los casos se atenúa con el aumento del flujo coronario, pero se revierte solamente una vez reestablecida la circulación espontánea y el flujo coronario correspondiente. El agente vasoconstrictor actualmente recomendado es la adrenalina dado que la evidencia científica no apoya un beneficio superior a la vasopresina27. El efecto vasoconstrictor de la adrenalina es mediado a través de receptores α1- y α2-adrenérgicos. Sin embargo, la adrenalina también activa receptores β1- y β2-adrenérgicos. Los receptores β1-adrenérgicos ubicados en el miocardio estimulan la función contráctil; un efecto que acentúa la isquemia miocárdica. Estudios preclínicos y clínicos recientes28,29 han demostrado que la adrenalina facilita inicialmente el restablecimiento de la actividad cardíaca pero compromete la sobrevida ligado a una acentuación de la disfunción global miocárdica post-paro cardíaco. La vasopresina tiene la ventaja de no activar receptores adrenérgico, pero la desventaja de tener una vida media larga – en contraste con la adrenalina – de modo que el efecto vasoconstrictor persiste en el período post-reanimación pudiendo comprometer la función ventricular por aumento de la post-carga. A pesar de estas desventajas, los agentes vasoconstrictores siguen siendo utilizados rutinariamente en RCP.
El flujo sanguíneo durante la RCP no es solamente bajo – como hemos comentado – pero declina en el tiempo por una serie de razones, incluyendo la pérdida del retroceso elástico torácico – comprometiendo el retorno venoso – y pérdida de la distensibilidad miocárdica – comprometiendo la precargadando como resultado una capacidad decreciente de compresión torácica para mantener flujo sanguíneo. Consecuentemente, existe una ventana de tiempo estrecha durante la cual es posible restablecer la actividad cardíaca usando las maniobras de RCP convencionales. El problema se complica aún más por la incapacidad de los rescatadores para efectuar consistentemente maniobras de calidad30. Para mejorar la calidad de la RCP se han inventado dispositivos mecánicos. A pesar de que estudios clínicos no han logrado demostrar una superioridad hemodinámica sobre la RCP manual, los dispositivos mecánicos tienen ventajas. Remueven el elemento humano de fatiga y la inconsistencia, facilitan el transporte en vehículos en movimiento, y permiten intervenciones coronarias invasivas mientras el paciente está en paro cardíaco31.
Esfuerzos adicionales para mejorar la RCP convencional se han centrado recientemente en mecanismos para mejorar el retorno venoso mediante la intensificación de la presión negativa intra-torácica. Este concepto se materializó en el desarrollo de la válvula de umbral de impedancia, cuya eficacia fue demostrada recientemente en estudios clínicos pero sólo cuando es usada en conjunto con la descompresión torácica activa32. El estudio demostró un incremento moderado de la sobrevida hospitalaria con resultado neurológico adecuado a pesar de no tener impacto en la reanimación inicial. Muchas otras técnicas se han desarrollado pero sin tener un mayor impacto excepto la circulación extracorpórea, como se discute brevemente a continuación33.
La circulación extracorpórea es capaz de promover niveles normales del flujo sanguíneo y de restablecer la actividad cardíaca con facilidad a pesar del fracaso de la RCP convencional. Estudios clínicos recientes demuestran que el uso de circulación extracorpórea puede lograr rescatar con sobrevida casos refractarios a la RCP convencional34,35. Sin embargo, costos y desafíos logísticos limitan el uso de circulación extracorpórea. Si los medios existen, el uso de circulación extracorpórea debe considerarse en el manejo del paro cardíaco refractario a las manobras de RCP convencionales tanto en casos intra-hospitalarios como extra-hospitalarios que llegan al servicio de emergencia en paro cardíaco. La circulación extracorpórea permite estabilizar al paciente y efectuar procedimientos diagnósticos y terapéuticos durante un paro cardíaco.
MONITOREO DURANTE LA RCPExiste la posibilidad de optimizar la eficacia de la RCP mediante el monitoreo fisiológico, permitiendo ajustar la técnica y decidir en forma objetiva el uso de intervenciones específicas.
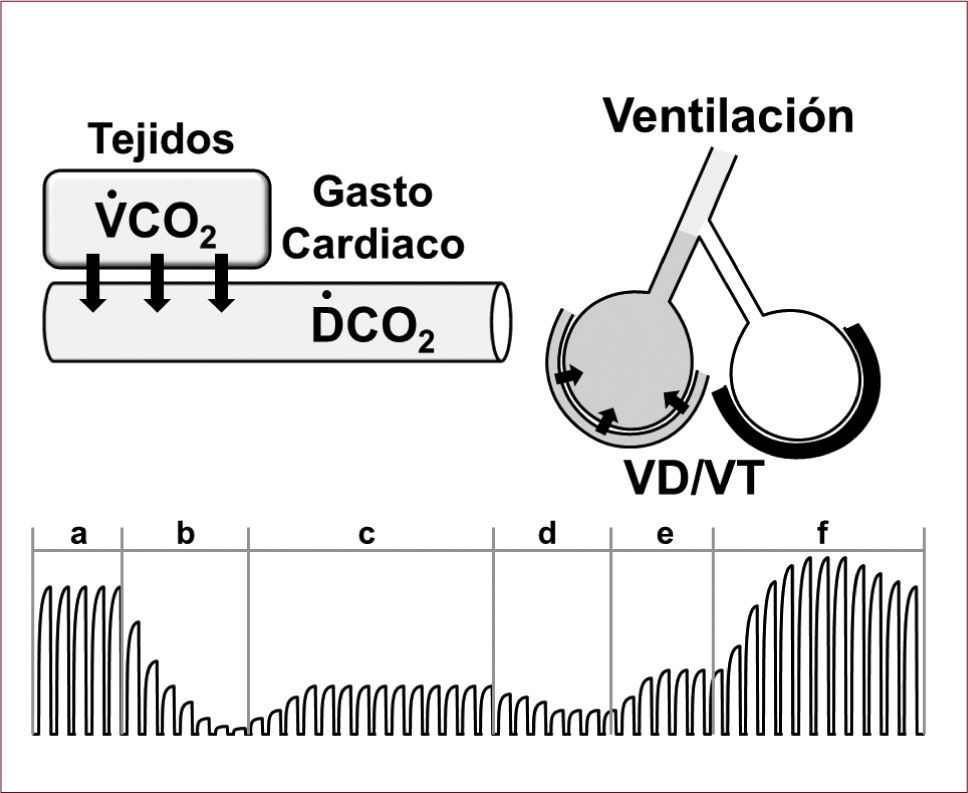
Capnografía y medición del CO2final espirado: Capnografía es la medición de la presión parcial de CO2 en la vía aérea durante el ciclo respiratorio y su representación gráfica. El CO2 final espirado corresponde al gas alveolar, siempre y cuando la espiración no sea interrumpida por la inspiración siguiente como en el caso de pacientes con enfermedad de la vía área y atrapamiento gaseoso. El CO2 final espirado está determinado por los siguientes factores:
- (a)
La producción de CO2 a nivel tisular que depende de la actividad metabólica.
- (b)
El transporte de CO2 desde los tejidos hacia los pulmones que depende del flujo sanguíneo.
- (c)
El porcentaje de espacio muerto alveolar
- (d)
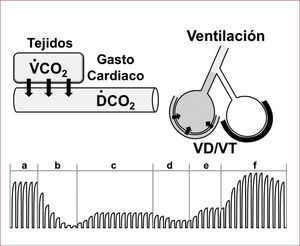
La ventilación pulmonar (Figura 2).
FIGURA 2.FACTORES DETERMINANTES DEL CO2 FINAL ESPIRADO
Factores determinantes del CO2 final espirado incluyen la producción tisular de CO2 (VCO2), el gasto cardíaco transportando el CO2 a los pulmones (DCO2), la proporción de ventilación alveolar que puede disminuir por aumento del espacio muerto (VD/VT) representado en la figura por obstrucción de una arteria pulmonar, y la ventilación. El trazado inferior de capnografía ilustra eventos a observar durante una reanimación cardio-pulmonar: (a), condición basal; (b), cese circulatorio con lavado pulmonar de CO2 en caso de que se mantenga ventilación artificial; (c), compresión torácica generadora de flujo sanguíneo; (d), fatiga del rescatador; (e), rescatador descansado y utilizando técnica más vigorosa; y (f), retorno de la circulación espontánea.
(0.09MB).
Durante la RCP, se presume que la producción de CO2 y el espacio muerto alveolar se mantienen relativamente constantes de modo que el CO2 final espirado depende mayoritariamente del flujo sanguíneo generado y la ventilación proveída. Si la ventilación se mantiene constante, el CO2 final espirado se transforma en una estimación útil del flujo sanguíneo generado y puede ser utilizado para optimizar las maniobras de reanimación. Por ejemplo, midiendo el CO2 final espirado es posible detectar fatiga en el rescatador, compresión torácica inadecuada, re-expansión torácica incompleta, y también sospechar la presencia de un mecanismo de paro cardíaco que bloquea el flujo de sangre o que interfiere con las maniobras de RCP convencionales como sería el caso de una embolia pulmonar, taponamiento cardíaco, o neumotórax36. Estudios han demostrado que un valor de CO2 final espirado menor de 10mmHg predice falla de las maniobras de RCP y que los esfuerzos deben dirigirse a optimizar dichas maniobras para elevar el CO2 final espirado por sobre 20mmHg (Tabla 2)37.
MATRIZ DE CALIDAD DE LA RESUCITACIÓN CARDIOPULMONAR
| PARÁMETRO | VALOR |
|---|---|
| Continuidad de la compresión torácica | Fracción de compresión >60% |
| Frecuencia de la compresión torácica | 100 a 120 compresiones por minuto |
| Profundidad de la compresión torácica | 5 a 6 cm |
| Re-expansión torácica | Completa evitando apoyarse en el tórax |
| Presión arterial directa durante la fase de descompresión torácica | >25mmHg |
| CO2final espirado | >20mmHg |
Adaptado de Meany et al. Cardiopulmonary resuscitation quality: improving cardíac resuscitation outcomes both inside and outside the hospital: a consensus statement from the american heart association. Circulation 2013;128:417-35.
Es importante tener presente que la administración de adrenalina transitoriamente disminuyen el CO2 final espirado, en parte como resultado de un aumento de la post-carga disminuyendo el flujo sanguíneo generado y por un aumento del espacio muerto alveolar38. El caso contrario ocurre si se utiliza bicarbonato de sodio, en el cual el CO2 final espirado aumenta transitoriamente debido a la producción de CO2 cuando el bicarbonato reacciona con protones en la circulación39.
La medición del CO2 final espirado es también útil para reconocer el restablecimiento de la circulación espontánea durante las maniobras de RCP. Cuando esto ocurre, se produce un aumento del CO2 final espirado durante la RCP que puede exceder el valor normal de CO2 final espirado40. Esto ocurre como consecuencia de un aumento de flujo sistémico y lavado del CO2 acumulado de los tejidos durante el paro cardíaco y maniobras de reanimación. El aumento del CO2 final espirado junto a un ritmo eléctrico cardíaco organizado permite interrumpir las maniobras de RCP y verificar si se ha reestablecido la circulación espontánea (Figura 2).
Otro uso importante de la capnografía es la verificación de la colocación correcta del tubo endotraqueal. La presencia de ondas características de CO2 espirado en relación al ciclo respiratorio tiene una sensibilidad y especificidad cercana al 100% y es por lo tanto, el método recomendado. También puede ser usado para verificar permeabilidad de la vía aérea cuando se efectúa ventilación utilizando bolsa auto-inflable y máscara facial.
Presión arterial directa: Si el paro cardíaco ocurre en un paciente monitorizado con presión arterial directa (por ejemplo, en la sala de operaciones o en la unidad de cuidados intensivos) o después de colocar un catéter arterial durante la RCP, se puede entonces utilizar la información para guiar las maniobras de RCP.
Es pertinente discutir ciertos aspectos hemodinámicos de la RCP. El flujo coronario generado por la compresión torácica depende directamente de la presión de perfusión coronaria, definida como la gradiente entra la presión aórtica y la presión en la aurícula derecha durante la fase de descompresión torácica. La presión arterial durante la fase de descompresión depende de la cantidad de sangre eyectada por la compresión anterior y la resistencia vascular periférica, de ahí la importancia de la técnica de compresión torácica y la justificación de agentes vasoconstrictores. La cantidad de sangre que fluye a través del circuito coronario – por territorios no ocluidos – es directamente proporcional a esta presión de perfusión coronaria. Estudios preclínicos y clínicos han demostrado la existencia de un umbral de presión de perfusión coronaria de aproximadamente 15mmHg bajo el cual es prácticamente imposible reestablecer actividad cardíaca41. En ausencia de medición directa de la presión en aurícula derecha, uno puede asumir un valor cercano a 10mmHg y por lo tanto dirigir las maniobras de reanimación para lograr mantener la presión arterial durante la descompresión a un nivel mayor de 25mmHg42. Para lograr este objetivo se debe asegurar que las maniobras de compresión torácica se efectúen en forma óptima. Similarmente, la decisión de administrar un agente vasoconstrictor en presencia de un monitoreo directo de la presión arterial no requiere seguimiento ciego de un algoritmo siendo preferible administrar la dosis para exceder este nivel umbral critico de 25mmHg (Tabla 2). Si bien no existen estudios comparativos en el uso de presión arterial invasiva para guiar el uso de adrenalina, estudios en animales apoyan esta alternativa43,44.
En el territorio cerebral, debido a la existencia de válvulas venosas a la entrada del tórax la presión generada en la vena cava no se transmite a las venas yugulares. Por lo tanto, la gradiente de presiones entre la presión aórtica y las venas que drenan el circuito cerebral se mantiene durante las fases de compresión y de descompresión de modo que la perfusión cerebral se mantiene durante las fases de compresión y de descompresión torácica.
Onda de fibrilación ventricular: La frecuencia y amplitud de la onda de fibrilación ventricular refleja el estado energético del miocardio. En la medida que transcurre el tiempo en fibrilación ventricular la amplitud y frecuencia disminuyen eventualmente terminando en una asistolia. Con las maniobras de RCP y en relación a la generación de flujo coronario, el proceso contrario ocurre y la frecuencia y amplitud aumentan45. La probabilidad de que un choque eléctrico logre terminar la fibrilación ventricular y que se restablezca una actividad eléctrica y mecánica se puede predecir basada en análisis de estas características de la onda de fibrilación ventricular46. Estas observaciones han generado interés en incorporar tecnología para análisis continuo de la onda de fibrilación ventricular durante las maniobras de RCP para decidir el momento óptimo para intentar la desfibrilación eléctrica. Se anticipa que futuros desfibriladores tendrán incorporada esta capacidad de análisis.
Diagnóstico diferencial: Durante la RCP, es también importante considerar el mecanismo precipitante del paro cardíaco y plantearse alternativas de manejo. Por ejemplo, en los casos de toxicidad cardíaca por hiperkalemia, el uso de sales de calcio y bicarbonato puede ser de utilidad. Una fibrilación ventricular resistente al choque eléctrico puede reflejar un contacto inadecuado de los parches de desfibrilación, técnica hemodinámica ineficiente, o la persistencia de una oclusión coronaria requiriendo intervención de urgencia que es posible efectuar mientras se mantiene la RCP utilizando aparatos automáticos de resucitación. El diagnóstico diferencial de la actividad eléctrica organizada sin pulso incluye neumotórax a tensión, taponamiento cardíaco, embolia pulmonar masiva, y también exsanguinación. En el diagnóstico diferencial, el uso de capnografía es útil. Si se mantiene una ventilación constante, una disminución del CO2 final espirado indica una disminución del flujo generado lo cual puede ser una clave diagnóstica de las condiciones anteriormente mencionadas.
La ecografía rápida puede ser muy útil durante la RCP, especialmente para identificar condiciones causantes del paro cardíaco y complicaciones asociadas a la reanimación47. Utilizando equipos portátiles y aprovechando interrupciones durante la compresión torácica, evitando interrupciones prolongadas de la RCP, visualizaciones rápidas de estructuras cardíacas y pulmonares puede servir para reconocer taponamiento cardíaco, embolia pulmonar masiva, neumotórax y también para identificar la seudo actividad cardíaca eléctrica sin pulso en la cual existe actividad contráctil ventricular y tiene un pronóstico mejor.
MANEJO POST-PARO CARDÍACOVarios aspectos del manejo post-paro cardíaco influyen el pronóstico final, y variabilidad en el manejo entre centros hospitalarios se cree explica variabilidad en el pronóstico de sobrevida48. Se han recomendado iniciativas para reconocer centros capacitados y con los recursos necesarios para el manejo post-paro. Los elementos básicos incluyen disponibilidad de cateterismo coronario, protocolos para manejo de la temperatura corporal central, y experiencia en la evaluación pronóstica neurológica además de la capacidad para manejo de un paciente crítico.
En pacientes en los cuales se sospecha un infarto agudo al miocardio, el cateterismo coronario de urgencia debe considerarse, especialmente cuando es un infarto con segmento-ST elevado49. Sin embargo, algunos estudios han demostrado que pacientes con infarto sin segmento-ST elevado también se benefician de un cateterismo coronario de urgencia50. En estas circunstancias, el paciente debe ser enviado a la sala de cateterismo lo antes posible, dentro de la ventana terapéutica del infarto con segmento ST elevado. Algunos expertos opinan que la fibrilación ventricular como mecanismo de paro cardíaco puede ser considerada como indicador de infarto miocárdico e indicación de cateterismo coronario.
Quizás el tratamiento post-paro cardíaco más discutido es el uso de hipotermia. Las pautas del 2010 recomendaban iniciar hipotermia en pacientes que permanecían sin una respuesta adecuada a estímulos verbales manteniendo la temperatura central corporal entre 32°C y 34°C por un período entre 12 horas y 24 horas seguido de un recalentamiento lento de 0.25 a 0.5°C por hora51. Sin embargo, un estudio multicéntrico reciente de calidad superior a los que originaron las recomendaciones aludidas, demostró el mismo resultado con temperatura central de 33°C o 36°C52. Este estudio dio origen al concepto de “target temperature management (TTM)” en el cual se enfatiza el control preciso de la temperatura dentro de un rango entre 32°C y 36°C sin recomendar una temperatura específica53, pero evitando la hipertermia luego de completado la fase de hipotermia53. El tema continuará siendo debatido a la espera de estudios adicionales. En el intertanto, parece razonable decidir en una temperatura (entre 32°C o 36°C) y mantenerla – utilizando métodos de control de temperatura internos o de superficie – por un período de por lo menos 24 horas.
Finalmente, el manejo de estos pacientes requiere de una terapia intensiva con personal dedicado y conocedor de los problemas post-paro cardíaco incluyendo la disfunción miocárdica que característicamente es transitoria pero puede ser muy severa, el manejo de la injuria isquémica cerebral y la evaluación pronóstica con decisiones congruentes. Es importante señalar que la recuperación neurológica puede ser completa a pesar un período prolongado de déficit neurológico. Por lo tanto, debe evitarse sellar el pronóstico en forma precoz e iniciar la evaluación luego de un período mínimo de tres días después de reestablecida la temperatura corporal normal.
CONCLUSIONESEn el ambiente intra-hospitalario, el paro cardíaco habitualmente es precedido por deterioro clínico, lo cual permite instaurar sistemas de reconocimiento e intervención para su prevención. Cuando el paro cardíaco ocurre, los principios de manejo son similares a los del paro cardíaco extra-hospitalario e incluyen el reconocimiento y activación del sistema de rescate intra-hospitalario, inicio de maniobras de RCP básica incluyendo el uso de desfibriladores automáticos externos o manuales, RCP avanzada por el equipo de rescate, y manejo post-paro en unidades de cuidados intensivos. El ambiente intra-hospitalario facilita el acceso a monitoreo fisiológico y la posibilidad de usar técnicas de mayor efectividad hemodinámica. El manejo post-paro es importante dado el potencial impacto pronóstico del cateterismo coronario, manejo de la temperatura central y en el establecimiento del pronóstico neurológico.
El autor declara no tener conflictos de interés, en relación a este artículo.