La reanimación cardiopulmonar avanzada ha experimentado numerosos avances en el último tiempo, tanto en la comprensión del fenómeno fisiopatológico como en la tecnología disponible para actuar en el paro cardiorrespiratorio de diversas etiologías. Sin embargo, a pesar de estos avances, la sobrevida de los pacientes con paro cardiorrespiratorio sigue siendo baja debido a la dificultad de recuperar la circulación espontánea (ROSC) a medida que avanza el tiempo de reanimación. El soporte vital extracorpóreo surge como una terapia efectiva al restaurar el flujo sanguíneo en aquellos pacientes en paro cardiorrespiratorio que no responden a las maniobras convencionales optimas de reanimación cardiopulmonar. ECMO permite mejorar la protección cerebral, manejar el síndrome post-reperfusión, disminuye la mortalidad post-paro cardiorrespiratorio y es un puente para toma de decisiones al otorgar tiempo. La implementación de un protocolo de ECPR requiere de un equipo multidisciplinario, educación continua y preparación constante en manejo de recursos en crisis con simulación de alta fidelidad.
Cardiopulmonary resuscitation has undergone numerous advances in recent times, understanding of the pathophysiological phenomenon as well as technology available in cardiorespiratory arrest of diverse causes. However, in spite of these advances, the survival of patients with cardiorespiratory arrest remains low due to the difficulty of recovering the spontaneous circulation (ROSC) as the resuscitation time elapses. Extracorporeal Life Support emerges as an effective therapy in restoring blood flow in those patients in cardiorespiratory arrest who do not respond to conventional cardiopulmonary resuscitation maneuvers. ECMO improves brain protection, manages post-reperfusion syndrome, decreases cardiorespiratory post-arrest mortality, and is a bridge for decision making. The implementation of an ECPR protocol requires a multidisciplinary team, continuous education and constant preparation in crisis resource management with high fidelity simulation.
La oxigenación por membrana extracorpórea (ECMO-Extracorporeal Membrane Oxygenation), o Soporte Vital Extracorpóreo (ECLS-Extracorporeal Life Support) tiene como objetivo reemplazar parcial o completamente (durante días a meses) la función cardiaca o pulmonar, utilizando dispositivos mecánicos con el fin de esperar una recuperación de los órganos comprometidos o como puente a otros soportes o trasplantes. Es una técnica que tiene como aporte la reducción de mortalidad en enfermos con shock cardiogénico y/o en falla respiratoria catastrófica (mortalidad asociada >80%), así como la necesidad de manejar pacientes como puente a trasplante pulmonar, disminuir los requerimientos de volumen y presión en la ventilación mecánica, manejo de paCO2, como puente a trasplante cardiaco, o como puente a toma de decisiones. Su uso en Unidades de Cuidados Intensivos (ICUs) en Estados Unidos ha aumentado más de 400% desde el 20061 y en Chile de 90 casos/año el 2014 a aproximadamente 180 casos/año el 2016 (Fuente: Encuesta Nacional de ECMO, presentado en ELSO LATAM 2016).
ECMO es una forma de soporte vital extracorpóreo donde una circulación artificial externa extrae sangre venosa desde el paciente, se transfiere O2 y CO2 en un intercambiador de gases (membrana), después de esto la sangre reingresa a la circulación nativa, ya sea nuevamente al territorio venoso (VV-ECMO o ECMO veno-venoso) o al territorio arterial (VA-ECMO o ECMO veno-arterial).
HISTORIALos orígenes de esta técnica se remontan a la década de 1950, cuando John Gibbon desarrolló este sistema como un medio de oxigenación sanguínea a través de un oxigenador de membrana durante las operaciones prolongadas en bypass cardiopulmonar2, posteriormente en la década de los 60 se intentó utilizar como opción en el tratamiento de la insuficiencia cardiovascular y/o respiratoria refractario en pacientes de unidades críticas3,4. Existió mucho entusiasmo en expandir la técnica, sin embargo, en 1979, un estudio controlado randomizado (RCT) realizado en pacientes adultos con insuficiencia respiratoria aguda grave informó una tasa de mortalidad del 90% para los pacientes en ambos grupos5, afectando drásticamente el entusiasmo, el cual se estancó por más de 30 años, donde ECMO se utilizó principalmente para pacientes neonatales y pediátricos con sólo un pequeño número de centros altamente especializados que realizaban ECMO en pacientes adultos.
Sin embargo, las mejoras tecnológicas en los elementos que componen el circuito de ECMO, principalmente membranas del intercambiador de gases y bombas centrífugas, asociado a los avances en otros aspectos de los cuidados críticos, han creado un escenario para el uso de ECMO muy diferente al reportado en el estudio de Zapol et al en 1979.
El impacto del uso como soporte en pacientes adultos, con los elementos actualmente utilizados, no fue conocido sino hasta la publicación del estudio CESAR6, que comparaba el soporte ventilatorio convencional con el uso de membrana de oxigenación extracorpórea en insuficiencia respiratoria hipoxémica severa. El mismo año en que CESAR fue publicado ocurrió la Pandemia de Influenza A (H1N1)7,8. Esto generó una expansión del uso de ECMO, implementándose rápidamente en Chile, como en el resto del mundo, como terapia de última línea en el manejo de la Insuficiencia Respiratoria Catastrófica asociada al Síndrome de Distress Respiratorio del Adulto9.
Esta expansión del uso de ECMO ha permitido validar también su uso en pacientes que presentan shock cardiogénico poco después de sobrevivir a un paro cardiorrespiratorio10–13, así como en otras causas de shock cardiogénico como miocarditis fulminante14, embolismo pulmonar15, hipotermia16, sobredosis medicamentosa17, obstrucción de la vía aérea18 y trastornos electrolíticos severos19. En estos casos, ECMO reemplaza la función cardiaca (VA-ECMO) por un periodo de tiempo indefinido, con una sobrevida que depende de la condición de base y sus posibilidades de recuperación, variando entre un 42 a 36% a corto y largo plazo respectivamente16,20.
En muchos de los casos de shock cardiogénico refractario, los pacientes requirieron de maniobras de reanimación cardiopulmonar antes o durante la instalación del soporte extracorpóreo, asociando un aumento moderado en el riesgo de muerte, sobre todo si la instalación de ECMO se realiza durante las maniobras de reanimación21. El hecho que determina la diferencia de mortalidad entre las diferentes series de shock cardiogénico que requirieron ECMO y que se asociaron a PCR dependen de la selección de los pacientes y la causa que determina el compromiso cardiovascular. Así en aquellos casos en que la causa del paro cardiorrespiratorio es la hipotermia, la sobrevida asociada a la instalación de ECMO es alta22, independiente del tiempo de latencia entre el inicio de la reanimación y la instalación de ECMO, por lo cual ECLS se considera como el “Gold Standard” del paro cardiorrespiratorio hipotérmico refractario. Así mismo, el uso de ECMO en el caso de algunas intoxicaciones ha demostrado una supervivencia inesperada, a pesar de que estos casos se relacionan con arritmias ventriculares recurrentes asociadas al shock cardiogénico profundo17 (Figura 1).
ECPRA la luz de reportes de casos, surgió la interrogante hace algunos años acerca de si ECMO podría utilizarse para restaurar el flujo sanguíneo en aquellos pacientes en paro cardiorrespiratorio por diversas causas que no responden a las maniobras convencionales óptimas de reanimación cardiopulmonar.
A pesar de los avances en reanimación cardiopulmonar en los últimos años, la sobrevida de los pacientes con paro cardiorrespiratorio sigue siendo baja23. Esto se debe a que, en un paro cardiorrespiratorio, la probabilidad de recuperar la circulación espontánea (ROSC) disminuye rápidamente a medida que avanza el tiempo de reanimación y es casi imposible recuperarla después de 30 minutos de reanimación (0-9%)24, dado principalmente a la persistencia de una acidosis metabólica severa o de trastornos potencialmente reversibles, como en el caso del tromboembolismo pulmonar o la oclusión coronaria aguda, en donde a pesar de una reanimación adecuada es imposible mantener una adecuada perfusión de órganos. Además, el pronóstico neurológico se hace ominoso a medida que avanza la reanimación25.
Por lo tanto, el fundamento de la incorporación de esta técnica en el ambiente de un paro cardiorrespiratorio (PCR) es restituir la circulación y oxigenación con ECMO en pacientes con eventos reversibles y con buena calidad de reanimación, con el objetivo de entregar de manera artificial oxígeno a los tejidos, así como también controlar temperatura y manejo de gases sanguíneos a niveles adecuado, asegurando una adecuada perfusión y resultado neurológico, disminuyendo la mortalidad, o como puente a toma de decisiones.
El reporte de casos y publicaciones respecto al uso de ECMO en reanimación ha aumentado dramáticamente en los últimos años, con resultados variables dependiendo de la experiencia de cada centro26, pero han demostrado un aumento de la sobrevida cuando las causas de paro cardiorrespiratorio han sido reversibles.
Es por ello, a la luz de los de los nuevos resultados publicados, que las guías Europeas de Reanimación27 y de la American Heart Association (AHA)28 del año 2015 establecen que el ECMO debe ser considerado como terapia de rescate en reanimación cardiopulmonar cuando las medidas de reanimación avanzada no han sido satisfactorias o cuando la instalación de un soporte extracorpóreo permitiría realizar intervenciones específicas (angioplastía coronaria o embolectomía pulmonar) que no pueden realizarse durante una reanimación convencional.
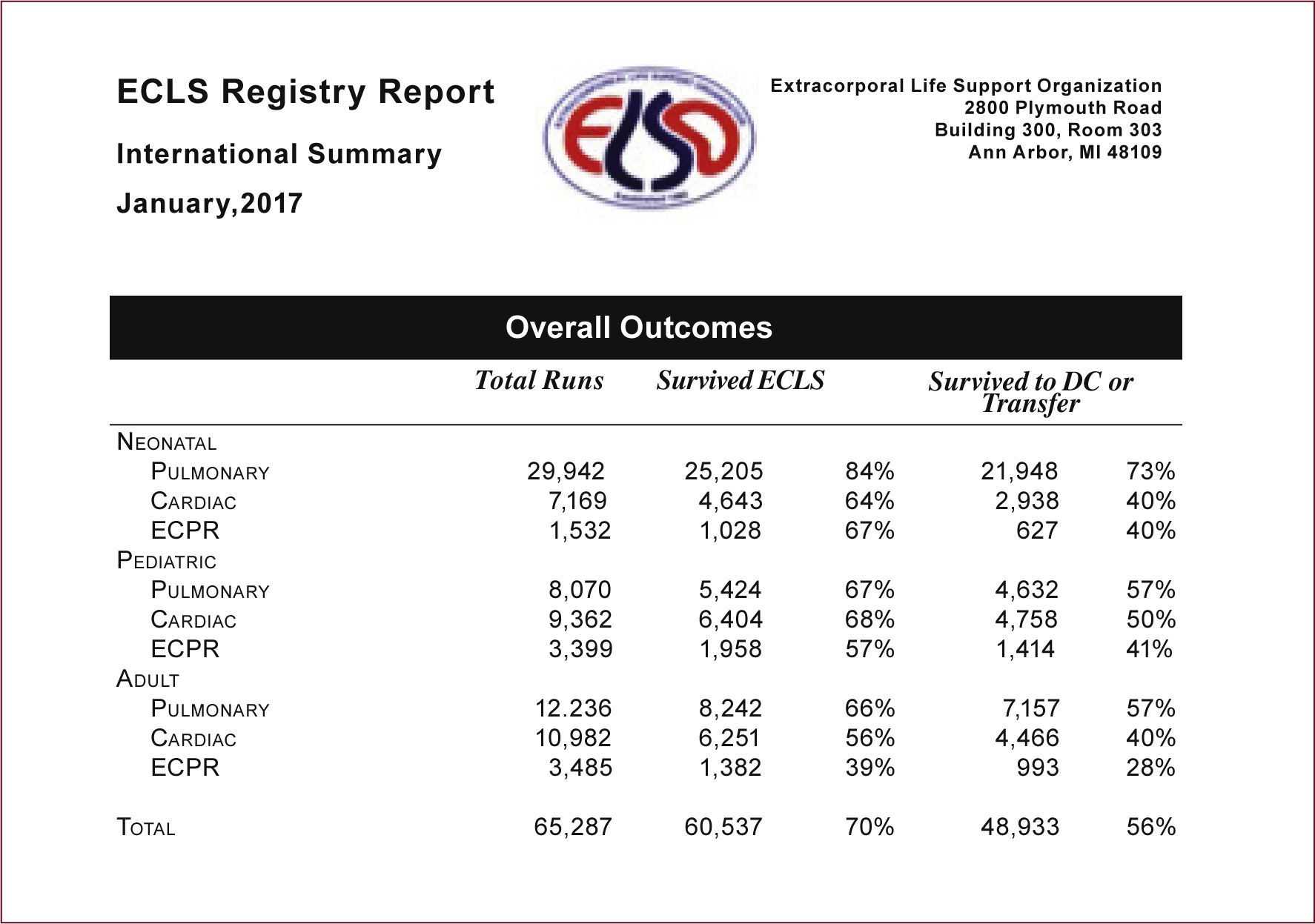
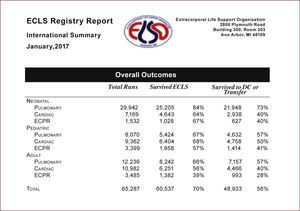
Varios estudios26,29,30 en el último tiempo sugieren que ECPR puede ser eficaz para pacientes con paro cardíaco refractario Intrahospitalario (IHCA-Inhospital Cardiac Arrest), con tasas de sobrevida a 30 días de hasta un 34%. Al ser intrahospitalario, permite reducir los tiempos de respuesta y acortar el periodo entre el inicio de la reanimación cardiopulmonar y la instalación de ECPR, mejorando la probabilidad de sobrevivir al alta, siendo de un 50% cuando el flujo de ECMO se inició dentro de los 30 minutos del IHCA, 30% cuando este se inició entre los 30 a 60 minutos y del 18% cuando fue después de los 60min. Cuando se compara esta sobrevida a la obtenida en la reanimación convencional, se observa que en la reanimación convencional la sobrevida antes de los 30 minutos es de 20%, 9% entre los 30 y 60 minutos y 0% luego de 60 minutos, aún con maniobras de reanimación óptimas. Por lo tanto, queda en evidencia que mientras más tiempo transcurre desde el inicio del IHCA hasta la instalación de ECMO, más pobre es el resultado31,32. Lo más importante de destacar en todos estos casos, además de la sobrevida, es que resultado neurológico fue mejor en todos los casos en que el ECPR fue instalado precozmente33. Por lo tanto, el ECPR debe considerarse en la reanimación cardiopulmonar y debe iniciarse tan pronto el paro cardiorrespiratorio sea considerado como refractario a las maniobras convencionales, teniendo en cuenta que mientras antes es el inicio de ECPR, mejor es la sobrevida y el resultado neurológico.
En el caso de un paro cardiaco refractario extrahospitalario (OHCA), los estudios son más escasos, en su mayoría son informes de casos y muestran mucha variabilidad en sus resultados34. Esta variabilidad tiene su fundamento en los tiempos diferentes de respuesta ante el paro cardiorrespiratorio extrahospitalario y el tiempo transcurrido hasta el inicio de ECMO. Ahora, si bien la sobrevida reportada inicialmente era muy baja, en el último periodo se han reportado resultados más favorables, con sobrevida a los 30 días del 24% con resultado neurológico favorable en 25% de estos pacientes33. Esto puede estar dado a que la organización de los equipos y el tiempo de respuesta a la emergencia es menor a la reportada en el inicio de los programas de ECPR extrahospitalario35. Ante la evidencia del problema del tiempo, algunos equipos de reanimación han iniciado un programa de ECPR prehospitalario36,37, con instalación de ECMO in situ, con resultados no tan alentadores en cuanto a la sobrevida, pero que abre una ventana en el rescate de órganos en el contexto de donación. Sin embargo, al no evidenciarse una clara diferencia entre el tiempo de respuesta del ECPR en paro extrahospitalario, cuando el paciente es trasladado desde el lugar de los hechos al hospital con maniobras de reanimación y uso de dispositivos de compresión automática (Lucas®), y el ECPR pre-hospitalario, hace cuestionable proporcionar ECMO en la escena pre-hospitalaria.
Por lo tanto, ECPR es factible y valioso en el paro cardiorrespiratorio refractario, con resultados que alcanzan en el IHCA al 40-50% de buen resultado neurológico, en comparación al OHCA con 15-30% de buenos resultados neurológicos, y esta diferencia está probablemente relacionada más con la duración del paro cardiorrespiratorio que con la localización del paro cardiaco.
FUNDAMENTOSPero, ¿por qué el soporte extracorpóreo con ECMO funciona en un paro cardiorrespiratorio? ¿qué beneficios ofrece por sobre la reanimación convencional? Un paro cardiorrespiratorio refractario se define como la ausencia de retorno a circulación espontánea en un periodo de 15 minutos con maniobras de reanimación adecuadas (ACLS) y en ausencia de hipotermia39. Además del soporte circulatorio evidente, es decir, permite que la sangre vuelva a circular en el cuerpo impulsada por una bomba centrifuga, este retorno a la circulación permite mejorar la protección cerebral, manejar el síndrome post-reperfusión (habitual en los casos de paro circulatorio), disminuye la mortalidad post-paro cardiorrespiratorio (al disminuir el daño de otros órganos), sobre todo, permite ser un PUENTE para toma de decisiones al otorgar TIEMPO que no tendríamos en una reanimación convencional en que se corre contra el este.
Debido a la alta incidencia de síndrome coronario agudo en pacientes con paro cardiaco y la mejora del resultado con Angioplastía Coronaria Percutánea (ICP) post-reanimación40, se ha reportado que el uso de la ICP asociada a ECPR mejora la tasa de sobrevida de los pacientes (36%) en comparación a los casos en que la angioplastia coronaria se vio retrasada (12%)
En cuanto a la protección cerebral y la prevención del síndrome post-reanimación, ECMO permite, además de asegurar un flujo sanguíneo adecuado, controlar la temperatura (induciendo hipotermia) y asegurar un adecuado aporte de oxígeno, evitando así la hiperoxia (por tanto, disminuye las especies reactivas de oxígeno)32. ECPR es un entorno único en el que las intervenciones destinadas a prevenir lesiones por isquemia-reperfusión pueden aplicarse antes y en el momento del restablecimiento del flujo, lo que permite el uso de muchas intervenciones farmacéuticas prometedoras.
Debido a que es una terapia de última línea, poco disponible y que no beneficia a todos los pacientes, se recomienda utilizar Soporte Vital Extracorpóreo (ECPR) solo en aquellos casos en que:
- -
Las medidas convencionales de reanimación cardiopulmonar han fallado y que no se ha logrado un retorno a la circulación espontánea.
- -
La causa es potencialmente reversible, como sería en el caso de un Infarto Agudo de Miocardio (IAM), un Tromboembolismo Pulmonar Masivo (TEP), en la Hipotermia Severa y en las Intoxicaciones.
- -
El Paro cardiorrespiratorio fue presenciado, con reanimación inmediata y de buena calidad. Un ritmo inicial desfibrilable es un predictor clave de sobrevida después de un paro cardiorrespiratorio al tener más posibilidades de retorno a circulación espontánea. La asistolía como ritmo inicial se relaciona con baja posibilidad de sobrevida y malos resultados neurológicos.
La implementación del Soporte Extracorpóreo (ECMO) puede ser precoz. Esto requiere un equipo de ECMO con experiencia y un programa de ECMO transversal al servicio de Urgencia, Cirugía e Intensivo.
Por lo tanto, la selección de pacientes que realmente serán beneficiados con esta terapia para asegurar buenos resultados es difícil41. Por ello, lo primero es diferenciar nuestros pacientes por lugar del incidente. Es decir, separar aquellos casos que son intrahospitalarios de aquellos que son extrahospitalarios. Un buen resultado en ECPR depende del inicio y calidad de la reanimación, pero por sobretodo, del tiempo de instalación del sistema de soporte extracorpóreo y retorno del flujo sanguíneo. En un paro cardiorrespiratorio extrahospitalario, ya la reanimación precoz y de buena calidad puede no estar asegurada, y la instauración rápida del soporte extracorpóreo puede tardar más de 60 minutos. En el paro cardiorrespiratorio intrahospitalario la presencia de un equipo de reanimación capacitado in situ que asegura una reanimación precoz y de buena calidad, con implementación precoz de un soporte extracorpóreo (en los centros que cuentan con este recurso), ofrece mejores resultados.
Cuando se compara el tiempo de una reanimación convencional al tiempo total de implementación del Soporte Extracorpóreo en Paro Cardiorrespiratorio, surge la pregunta: ¿Por qué el Soporte Extracorpóreo ofrece una mayor sobrevida a pesar que el tiempo transcurrido desde el inicio de las maniobras fue mayor? A diferencia de las maniobras de reanimación cardiopulmonar convencionales que resultan en un estado de perfusión de bajo flujo42,43, con resultados limitados por el tiempo y trauma torácico por las compresiones44, la evidencia muestra que el inicio del soporte extracorpóreo mejora la tasa de desfibrilación satisfactoria, extiende la duración de la reanimación al darnos tiempo de corregir los fenómenos que perpetuaban el no retorno a la circulación espontánea y, sobre todo, mejora el resultado neurológico13. Así, cuando el Soporte Extracorpóreo es iniciado antes de los 30min la sobrevida alcanza el 50% en comparación a un 20% con la reanimación convencional, y cuando este es iniciado entre los 30 y 60min la sobrevida alcanza el 30% comparado con un 0 a 9% con la reanimación convencional. Por lo tanto, la clave está en el tiempo de respuesta de la reanimación e inicio del soporte extracorpóreo10.
Las desventajas del ECPR incluyen un mayor costo, recursos y complejidad de cuidado. Desafortunadamente, no se conoce el costo/beneficio de la ECPR en comparación con la reanimación cardiopulmonar convencional45. El grupo etiologías incluidas susceptibles de ECPR resultan heterogéneas que van desde la hipotermia hasta las arritmias refractarias, por lo que se hace difícil que se pueda incluir una población homogénea en cualquier programa de ECPR. Por lo tanto, existe una profunda brecha de conocimiento en torno al beneficio absoluto, la idoneidad del uso y la gestión del paciente ideal de ECPR, lo que puede conducir a un uso inapropiado y a las diferencias en los resultados.
IMPLEMENTANDO UN PROTOCOLO ECPRCon estos datos, ¿Cómo se implementa un protocolo de ECPR? La sobrevida y la capacidad de implementación de un protocolo de ECPR depende de la experiencia del centro. Además de contar con un programa de ECMO, se requiere un funcionamiento organizado e integral, con compromiso de toda la institución que asegure una respuesta rápida y adecuada a la emergencia. Está demostrado que los centros que tienen un mayor volumen anual de ECMO (>30 casos / año) tienen una menor mortalidad en comparación con los centros con sólo unos pocos casos al año (<6)46.
En Clínica Las Condes, Centro de Excelencia ELSO desde el año 2015, con 240 casos reportados al año 2016 (>50 casos/año en los últimos 2 años), se ha implementado un protocolo de ECPR para paro cardiorrespiratorio Intrahospitalario con el objetivo de disminuir la mortalidad o como puente a toma de decisiones, llevando a la fecha 16 casos, con sobrevida de 38% (3 casos de PCR Extrahospitalario), 3 pacientes pediátricos y 13 pacientes adultos.
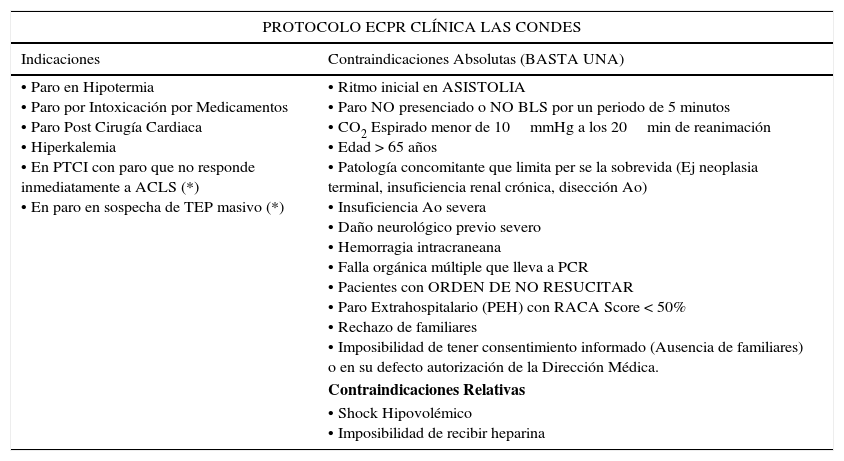
Una vez que se ha determinado que un paro cardiorrespiratorio es refractario (Tiempo >15min en ausencia de Hipotermia), debe decidirse si el paciente puede ser realmente beneficiados con esta terapia, debido a que un buen resultado en ECPR depende del inicio y calidad de la reanimación, pero sobretodo, del tiempo de instalación del sistema de soporte extracorpóreo y retorno del flujo sanguíneo. Es por eso que antes de pensar en la indicación, deben realizarse las siguientes preguntas (Ver tabla 1 y figura 3):
¿La condición de base es potencialmente reversible?
¿El pronóstico neurológico compatible con el esfuerzo?
¿El tratamiento convencional se ha cumplido al máximo?
¿Llevo > de 5min y <15min de ACLS?
¿Es posible iniciar el ECMO antes de 80min de iniciada las maniobras?
¿Está la FAMILIA presente para poder asentir y firmar consentimiento?
ACLS: Advanced Cardiovascular Life Support
Si todos estos puntos se cumplen, se procede a la activación del equipo de ECMO y se procede a la canulación y posterior conexión al circuito ECMO.
PROTOCOLO ECPR CLÍNICA LAS CONDES
| PROTOCOLO ECPR CLÍNICA LAS CONDES | |
|---|---|
| Indicaciones | Contraindicaciones Absolutas (BASTA UNA) |
| • Paro en Hipotermia • Paro por Intoxicación por Medicamentos • Paro Post Cirugía Cardiaca • Hiperkalemia • En PTCI con paro que no responde inmediatamente a ACLS (*) • En paro en sospecha de TEP masivo (*) | • Ritmo inicial en ASISTOLIA • Paro NO presenciado o NO BLS por un periodo de 5 minutos • CO2 Espirado menor de 10mmHg a los 20min de reanimación • Edad > 65 años • Patología concomitante que limita per se la sobrevida (Ej neoplasia terminal, insuficiencia renal crónica, disección Ao) • Insuficiencia Ao severa • Daño neurológico previo severo • Hemorragia intracraneana • Falla orgánica múltiple que lleva a PCR • Pacientes con ORDEN DE NO RESUCITAR • Paro Extrahospitalario (PEH) con RACA Score < 50% • Rechazo de familiares • Imposibilidad de tener consentimiento informado (Ausencia de familiares) o en su defecto autorización de la Dirección Médica. |
| Contraindicaciones Relativas | |
| • Shock Hipovolémico • Imposibilidad de recibir heparina | |
(*): En estos 2 casos activar equipo ECPR de inmediato (no esperar 10min de ACLS).
ACLS: Advance Cardiovascular Life Support.
La canulación para el ECPR (VA-ECMO) se hace por vía periférica, de preferencia femoral47,48, aunque otros lugares periféricos también pueden ser utilizados (Axilar49 aunque ofrecen mayor dificultad técnica durante las maniobras de reanimación, por lo que el abordaje femoral sigue predominando en los adultos50.
Para lograr que el proceso desde la reanimación cardiopulmonar hasta el inicio de ECMO se realice de forma eficiente y en el menor tiempo, la implementación de un programa ECLS exitoso requiere un compromiso multidisciplinario y organizativo significativo para asegurar los recursos y personal necesarios.
El equipo ECMO está conformado por un anestesista y cirujano cardiovascular, Perfusionista e Instrumentista Quirúrgica que se adosan al Equipo reanimador para proseguir con el ECPR. En un estudio reciente que evaluó ECMO para OHCA, la iniciación de ECMO requirió dos médicos de cuidados críticos para la canulación, un tercer médico que proporcionó guiado por ultrasonido de la colocación de la cánula en la vena cava inferior, un cuarto médico dedicado a la reanimación, un coordinador de enfermería para iniciar el circuito, y una sexta persona para infundir solución salina fría para la hipotermia intra-paro. Además, aunque la canulación puede ser factible por los no cirujanos en el servicio de urgencias, es imprescindible la presencia de los cirujanos cardiovasculares debido a los riesgos de lesión vascular que requieren reparación quirúrgica o la necesidad de modificar la conformación del ECMO una vez superada la crisis (VA-ECMO central)51. Además, la iniciación de ECMO en un paciente crítico requiere consideraciones relacionadas con el equipo, las capacidades de los bancos de sangre, la configuración de la canulación, la disponibilidad del personal necesario y la coordinación con los médicos de cuidados críticos que reciben.
Por lo tanto, no solo basta con contar con los equipos necesarios, se requiere coordinación, preparación y capacitación continua del personal en manejo de recursos en crisis (52) (CRM-Crisis Resource Management), optimizando los tiempos y resultados. Es por eso que, además de las capacitaciones técnicas que se realizan constantemente para las Unidades de Cuidados Intensivos y Servicio de Urgencias, se considera fundamental la realización de simulaciones de alta fidelidad y la educación continua de los protocolos de manejo de recursos en crisis, que son llevados a cabo por parte del Equipo de ECMO con el objetivo de fortalecer el trabajo en equipo (Figura 2).
El futuro de ECLS estará centrado en la instalación oportuna de soporte circulatorio mecánico temporal, la selección correcta del paciente, el uso concomitante de diferentes dispositivos temporales, la mejora de las estrategias de weaning y el creciente uso de dispositivos duraderos como terapia de destino o de puente.
Los autores declaran no tener conflictos de interés, en relación a este artículo.