La resonancia magnética muscular (RMM) se ha incorporado al estudio de pacientes con sospecha de miopatía congénita, como complemento al estudio genético e histopatológico. Patrones específicos de afectación de algunos músculos colaboran en la identificación de afecciones que forman parte de un espectro heterogéneo de enfermedades donde la superposición de las presentaciones clínicas es frecuente. Las aplicaciones de la RMM en la población infantil y sus patrones en enfermedades neuromusculares han sido menos descritas en comparación con los adultos, hecho que constituye un importante desafío frente a la necesidad de diagnóstico precoz. A la descripción anatómica del compromiso muscular y a las escalas semi-cuantitativas actualmente en uso se suma la posibilidad de obtener información cuantitativa de la degeneración grasa muscular. La técnica de Dixon permite adicionalmente obtener información objetiva sobre el reemplazo graso de los diferentes grupos musculares y reportarla de manera estandarizarla, pudiendo así contribuir en el seguimiento de la enfermedad.
Magnetic resonance imaging of muscle (RMM) has been incorporated into the study of patients with suspected congenital myopathy, as a complement to the genetic study and histopathological examination. Specific patterns of muscle atrophy collaborate in the identification of conditions included in a heterogeneous spectrum of diseases where the overlap of clinical presentations is frequent. The applications of RMM in pediatric population and their own patterns of neuromuscular diseases have been less described in comparison with adults’ reports, which constitutes an important challenge facing the need for early diagnosis. Additional techniques have been added to anatomical description of fatty replacement and semi-quantitative scales currently in use to obtaining quantitative information of muscle degeneration. Dixon technique has been helpful to obtain objective measurement of fatty replacement in different muscle groups, suitable for standard report, contributing in the follow-up to the disease.
Las enfermedades neuromusculares (ENM) son un conjunto de enfermedades, en su mayoría hereditarias, que comprometen la fuerza muscular provocando limitación en la movilidad de los individuos afectados. Se acompañan de complicaciones cardíacas, tales como miocardiopatías o alteraciones del ritmo cardíaco, insuficiencia respiratoria restrictiva, por debilidad de la musculatura respiratoria y diversos grados de complicaciones musculoesqueléticas como escoliosis progresivas y contracturas articulares generalizadas1,2. En Chile no existe dato sobre la epidemiología de estas enfermedades, diagnosticándose en su gran mayoría como enfermedades musculares inespecíficas. El desconocimiento de las características de estas enfermedades y las necesidades específicas de los pacientes miopáticos, tiene un impacto negativo en la atención médica, tanto de sus requerimientos generales como de la vigilancia específica en la esfera cardiológica, respiratoria o musculoesquelética.
Según el registro de la tabla de Kaplan3 que actualiza periódicamente las ENM monogénicas, se hace referencia a 685 fenotipos distintos de estas enfermedades, 360 genes identificados y 92 locus en espera de identificación génica. Específicamente en relación con las miopatías congénitas (MC), éstas se elevan a 38 fenotipos con al menos 20 genes distintos. La confirmación del diagnóstico de una miopatía específica no sólo establece las opciones de tratamiento, sino que también permite la orientación adecuada con respecto a la historia natural de la enfermedad y permite un consejo genético informado. El diagnóstico de precisión se consigue entonces, con exámenes genéticos que determinan finalmente la mutación subyacente, responsable del cuadro clínico general y del patrón de alteraciones de sistema muscular. La biopsia muscular ha sido hasta ahora el standard dentro del estudio diagnóstico dada la posibilidad de orientar el estudio genético de acuerdo con la caracterización del compromiso histológico e inmunohistoquímico. El uso de la Resonancia Magnética Muscular (RMM), ha emergido como una herramienta de apoyo al diagnóstico de las ENM al documentar la existencia de compromiso muscular selectivo, fenómeno hasta hace poco desconocido, pudiendo representar patrones de compromiso muscular característico en algunas enfermedades4,5. La identificación de estos patrones está lejos de competir con la biopsia en el diagnóstico de estas afecciones. La posibilidad de identificar con facilidad la atrofia muscular y la mayor disponibilidad de la técnica en los departamentos de imágenes son responsables del número creciente de reportes que dan cuenta de la separación entre pacientes sanos y afectados, severidad de las alteraciones y distribución del compromiso muscular, ayudando a planificar, por ejemplo, el lugar de la biopsia o la necesidad y oportunidad de otras intervenciones.
PROTOCOLO Y EXTENSIÓN DEL ESTUDIO CON RMMEl reemplazo graso muscular ha sido reportado hasta ahora, utilizando principalmente secuencias Spin Eco con imágenes potenciadas en T1, donde tejidos como la grasa mostrarán alta intensidad de señal. La evaluación cualitativa del compromiso en RMM ha permitido establecer hasta ahora algunos patrones de compromiso selectivo6,7, bien consolidados en adultos, en algunas miopatías específicas frecuentes, como aquellas secundarias a mutaciones en el gen del colágeno VI (COLVI)8–10, de la rianodina (RYR1)11 y de la selenoproteína 1 (SPN1)12. Aún existe un número importante de miopatías en las que los patrones de compromiso muscular se encuentran a la espera de ser definidos.
Sin embargo, trasladar los hallazgos en imágenes sobre las enfermedades y sus características a la población infantil, representa desafíos adicionales tales como, las limitaciones técnicas relativas a la representación de estructuras de menor tamaño y la coincidencia de alteraciones con menor tiempo de evolución superpuestas al proceso normal de desarrollo en un sistema musculoesquelético todavía en formación, entendiendo que la degeneración grasa no es un fenómeno exclusivo de las miopatías congénitas. La musculatura esquelética comienza su desarrollo precozmente durante la embriogénesis, con proliferación y migración de los mioblastos hacia la pared que envuelve el tronco y las extremidades en formación. La maduración durante la vida fetal, consistente en alineación y fusión progresiva de los mioblastos, da cuenta de la estructura del músculo. La maduración continúa en etapa postnatal, con crecimiento muscular, como respuesta hipertrófica, sin modificación significativa de la estructura, siguiendo la interacción de una compleja red de reguladores que van adaptando las fibras a los requerimientos del individuo13. Si las alteraciones que subyacen a los fenotipos conocidos implican la presencia de proteínas anómalas o mecanismos patogénicos potencialmente presentes en todo el sistema muscular, es razonable considerar que ellas tengan representación en los demás músculos del sistema esquelético, además de la pelvis, muslos y piernas, regiones anatómicas habitualmente incluidas en los protocolos de estudio con resonancia magnética. Haciendo un símil con las enfermedades genéticas que afectan el desarrollo y crecimiento de los huesos14, la evaluación de cuerpo entero del sistema muscular representa las alteraciones específicas de la enfermedad, los músculos normales que no son parte de la afección primaria y el compromiso derivado de las alteraciones no-neuromusculares especialmente en enfermedades severas o complejas, en un mismo estudio15.
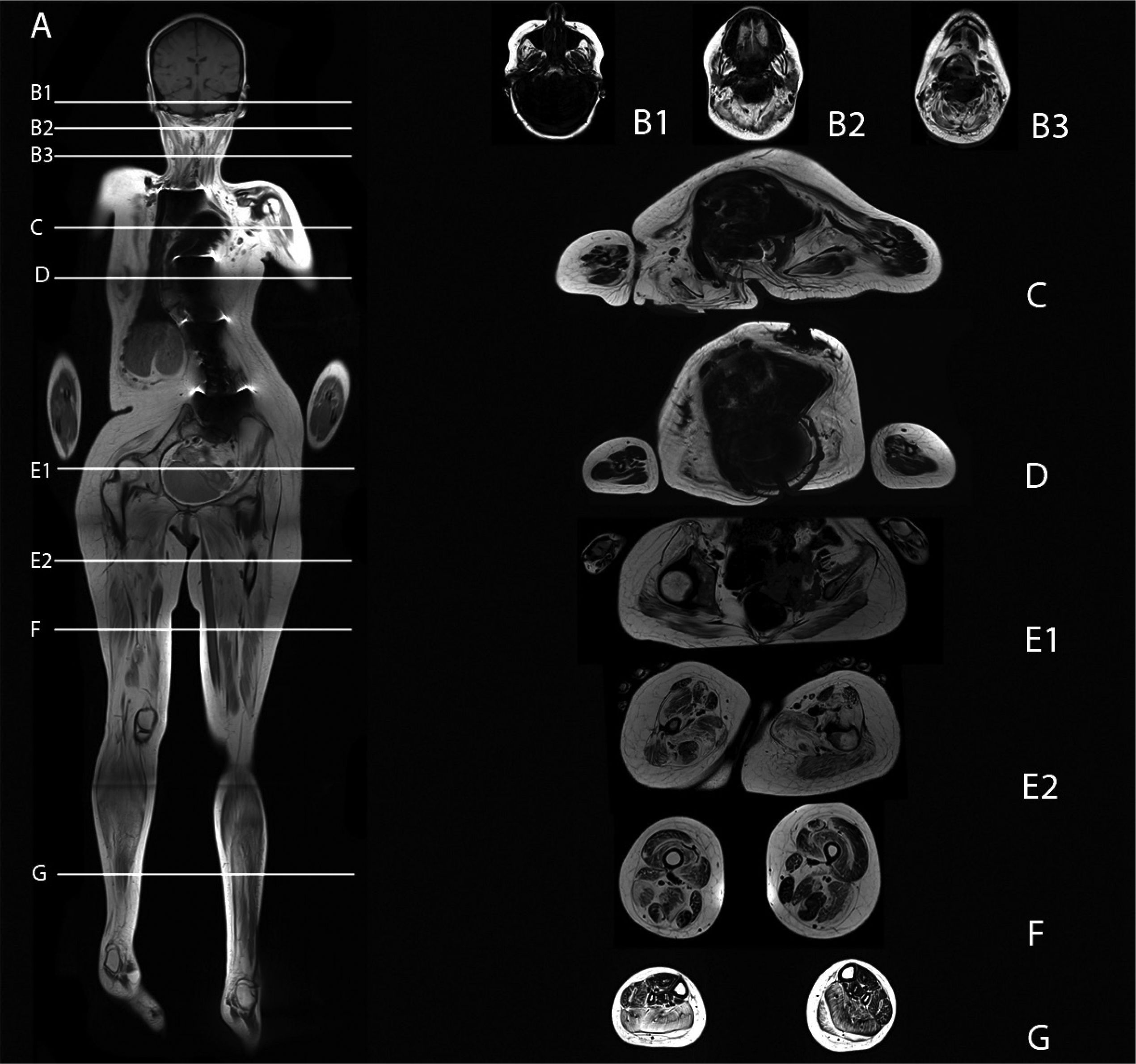
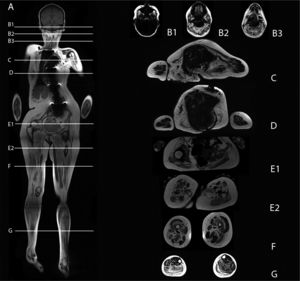
La técnica que incluye la representación del cuerpo completo, utilizada hasta ahora principalmente en la detección y etapificación de tumores, se ha incorporado recientemente en el estudio de las ENM5,16. El uso selectivo de algunas secuencias permite en poco tiempo la demostración adecuada del parénquima muscular, con imágenes multiplanares que entregan abundante información. El diseño de un protocolo de estudio de cuerpo completo infantil requiere adecuada resolución de todos los grupos musculares, haciendo ajuste respecto del tamaño del paciente (Figura 1). Las evaluaciones incluyen la evaluación compartimentalizada e individual de los diferentes grupos musculares. Las imágenes en planos axial y coronal entregan información anatómica, permitiendo la adecuada representación tanto de grupos musculares y compartimientos, como de los cambios ocasionados por el reemplazo graso de los músculos afectados, visible como aumento de la señal y/o cambios estructurales en el espesor del músculo. Los cambios inflamatorios del músculo pueden ser evaluados en secuencias sensibles al agua como son las potenciadas en T2 con saturación grasa o bien STIR, donde se representa con alta intensidad de señal el edema muscular, alteración que habitualmente precede al reemplazo graso. Un protocolo detallado de imágenes de extremidades inferiores se detalla en la referencia 17 y uno de cuerpo completo, se describe en referencia 18.
Paciente con mutación LAMA2
Protocolo de resonancia magnética de cuerpo completo. Imágenes coronales T1 e imágenes axiales con secuencia Dixon en diferentes segmentos. Marcado compromiso muscular simétrico, con reemplazo graso que compromete musculatura facial, axial, ambas cinturas y extremidades inferiores. Destaca marcado remplazo graso del temporal, de la lengua, del subescapular, redondo mayor, latissimus dorsi. En el muslo, el aumento de la fracción grasa es difuso. En la pierna destaca mayor compromiso del compartimento posterior respecto del anterior. Se observa mayor reemplazo del vasto lateral, tibiales y peroneos, con respeto relativo de las fibras superficiales del vasto lateral.
Respecto de la evaluación de pacientes con miopatía congénita, la RMM puede entregar información en dos aspectos principales, el patrón de compromiso y su severidad. El primer y más notable aspecto hace referencia al hecho distintivo del compromiso de algunos músculos o grupos musculares en una enfermedad, distinto del compromiso observado en otra. Así, por ejemplo, en la miopatía relacionada a mutación del receptor tipo I de Rianodina (RYR1), los vastos, el aductor mayor, el bíceps femoral y el sartorio están comprometidos en forma selectiva, a diferencia del recto femoral, gracilis, aductor largo y semitendinoso que se encuentran comparativamente respetados en el muslo y pierna de los pacientes afectados. Esta preferencia que exhiben las enfermedades se conoce como patrón, entendiendo como “típico” aquel que se ajusta a las descripciones conocidas y aceptadas y “atípico” a aquellas que no lo hacen, dando cuenta de la complejidad genética y de la interrelación de mecanismos patogénicos parcialmente descritos. En fase de diagnóstico el conocimiento de los patrones típicos de afectación es útil en el diagnóstico diferencial, teniendo en cuenta el compromiso selectivo o preferente de algunos músculos.
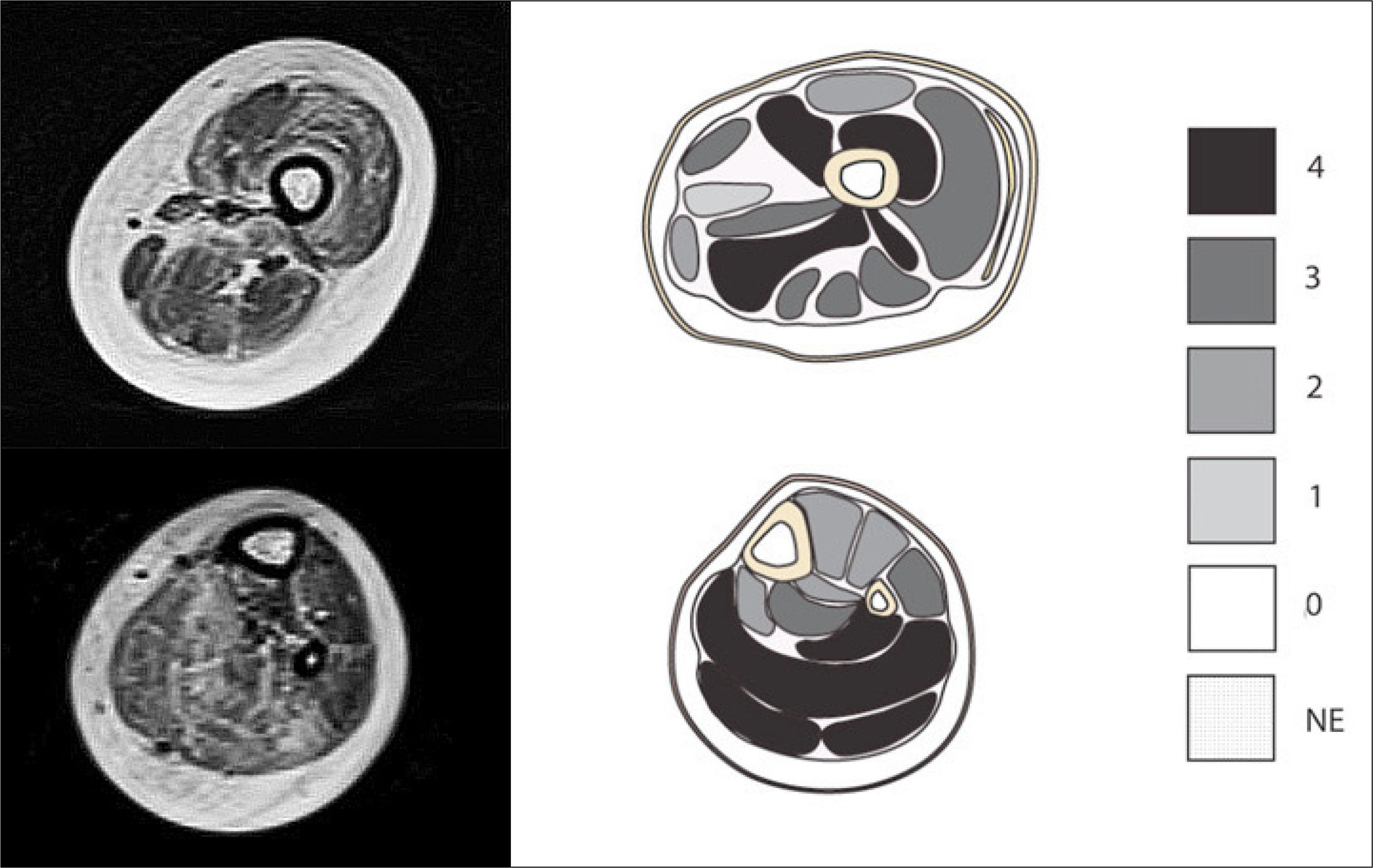
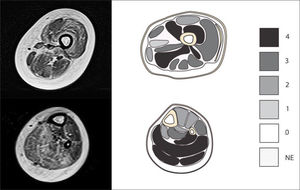
El segundo aspecto tiene relación con la severidad del reemplazo graso de cada músculo. Así, distintas enfermedades podrán comprometer característicamente un mismo músculo en forma leve, moderada o severa como parte de su patrón de afectación. En el año 2002, Mercuri propuso la escala que ha sido más utilizada en la evaluación de la infiltración grasa del músculo estriado en pacientes con enfermedades neruromusculares19. Sus cinco categorías originales, describen la progresión del compromiso muscular, desde el músculo sano sin reemplazo graso, pasando por músculos con áreas de aumento de señal en progresivo mayor número y de mayor tamaño, hasta el músculo, severa y difusamente comprometido, con infiltración estimada en más de 60% del volumen muscular (Tabla 1) (Figura 2). El hecho distintivo de la atrofia y el reemplazo graso muscular no es un fenómeno exclusivo de las enfermedades neuromusculares. En el año 1990 Goutallier describió por su parte una escala para evaluar el reemplazo graso en músculos del hombro posterior a lesiones del manguito rotador en pacientes adultos20,21. Esta descripción subraya el hecho anatómico de la coexistencia de áreas más preservadas de músculo alternadas con estrías grasas progresivamente más numerosas y de mayor tamaño a medida que el compromiso y la severidad aumenta, partiendo desde el músculo normal, sin estrías grasas, hasta segmentos anatómicos con más grasa que músculo, en concordancia con cambios histológicos observados en los mismos músculos (Tabla 2). Si bien, estas escalas y sus modificaciones se basan en la apreciación cualitativa del reemplazo graso en las imágenes adquiridas, desde su descripción inicial, la escala de Goutallier ha extendido su uso, principalmente en el ámbito de la traumatología y la ortopedia, donde se ha incorporado tanto a la descripción como al seguimiento de lesiones musculares primarias y secundarias, por ser reproducible en opinión de varios autores22–26 (Figura 3).
Escala de Mercuri
| Etapa 0: Apariencia normal. |
| Etapa 1: Aspecto “apolillado” inicial, con áreas pequeñas de aumento de señal. |
| Etapa 2a: Aspecto “apolillado” tardío, con numerosas áreas discretas del aumento de señal con confluencia inicial, que constituyen menos del 30% del volumen de los músculos. |
| Etapa 2b: Aspecto “apolillado” tardío, con numerosas áreas discretas del aumento de señal con confluencia inicial, que representan el 30% y el 60% del volumen individual del músculo. |
| Etapa 3: Apariencia blanquecina y borrosa debido a la confluencia de áreas de aumento de señal. |
| Etapa 4: Estadío final, la señal del músculo es sustituida por tejido conectivo y la grasa, con borde de fascia y estructuras neurovasculares distinguibles. |
Etapas de la infiltración grasa muscular19.
Clasificación de Goutallier
| Grado 0: Músculo normal |
| Grado 1: Músculo con algunas estrías grasas |
| Grado 2: Músculo con estrías considerables, pero aún más músculo que grasa |
| Grado 3: Cantidad similar de músculo y grasa |
| Grado 4: Más grasa que músculo |
Grado de infiltración grasa muscular20.
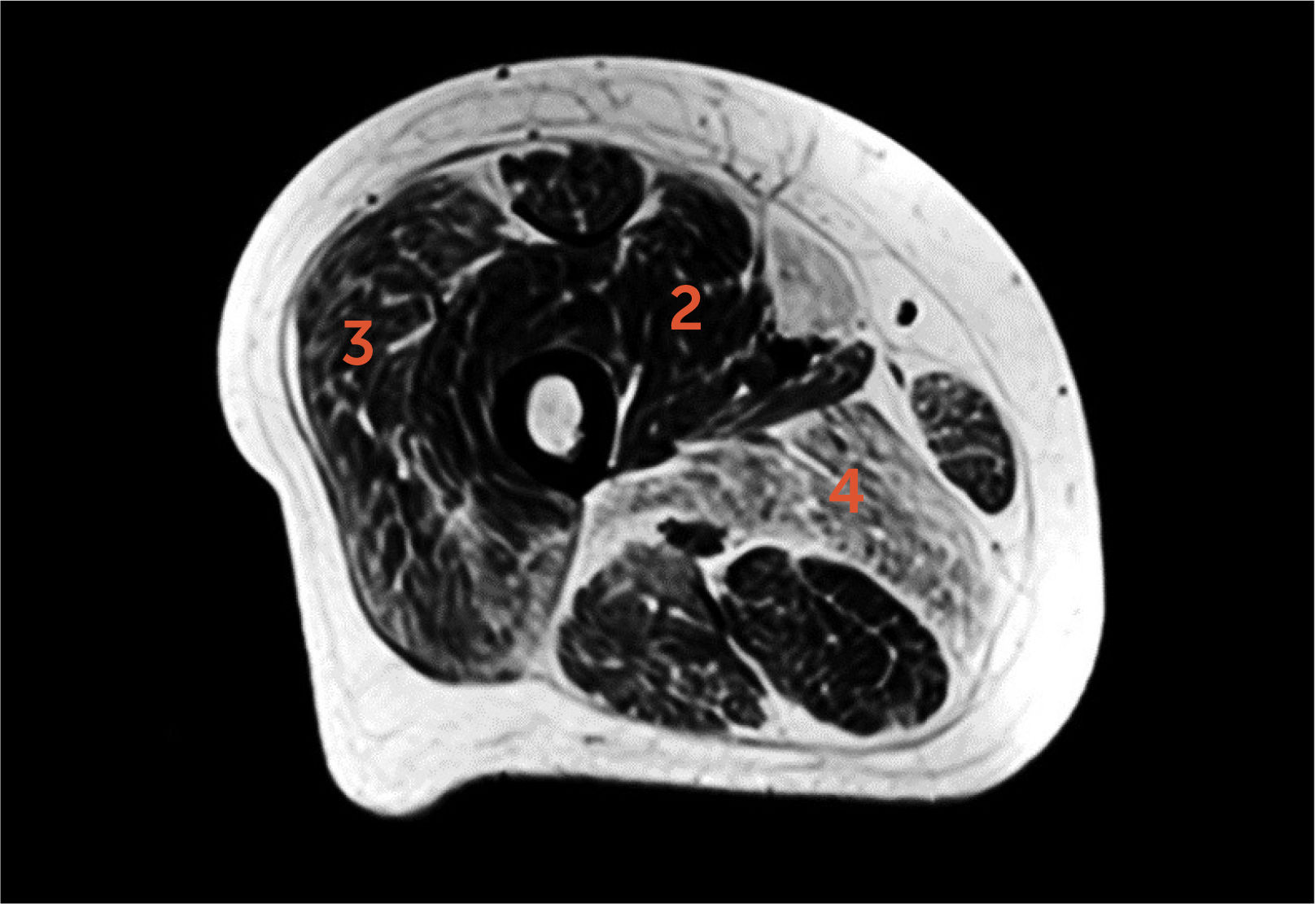
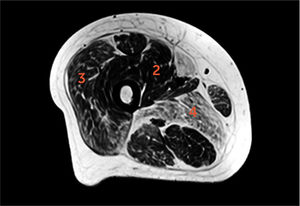
Paciente con miopatía nemalínica
Imagen axial T1 del muslo proximal. Estimación de infiltración grasa de acuerdo a escala de Goutallier. Estrías grasas considerables en vasto medial, intermedio y recto femoral del cuádriceps (grado 2), tanto grasa como músculo en vasto lateral (3) y más grasa que músculo en aductor mayor (4).
Adicionalmente, se han descrito algunos signos en imágenes relacionados a algunas alteraciones subyacentes. Músculos que comparten un compartimento anatómico y que tienen un comportamiento distinto respecto del reemplazo graso ofrecen esta diferencia en imágenes, con relaciones relativamente estables descritas en la literatura para algunas enfermedades. Es así como, en la evaluación las descripciones comparadas, habitualmente incluyen a los pterigoídeos lateral y medial, al sartorio y al gracilis y al grupo de músculos aductores. La evaluación de cuerpo completo ofrece la posibilidad de evaluar otros compartimentos musculares, hasta ahora menos descritos; como el serrato y el trapecio, el tríceps y el bíceps, los grupos flexor y extensor del antebrazo o el compromiso regional de los músculos paraespinales. Otros signos se refieren a la morfología particular del reemplazo graso en un mismo músculo. Como el signo de la diana (target o sombra central) con reemplazo graso peritendíneo del aspecto proximal del músculo recto femoral o el signo del sándwich donde el compromiso se dispone en bandas paralelas en las imágenes axiales del vasto lateral del cuádriceps, con reemplazo graso periférico que deja una banda central de fibras más respetadas, ambos atribuidos con mayor frecuencia a miopatía relacionada a Colágeno VI8–10. Si bien, estos signos ayudan a orientar el diagnóstico, alteraciones con aspecto similar en imágenes pudieran ser reconocidas en otras enfermedades. Las imágenes de resonancia en estas formas particulares de reemplazo graso pudieran ser expresión tanto de la alteración genética subyacente como de alteraciones adquiridas, relacionadas, por ejemplo, al desbalance postural, al compromiso de la marcha o a la presencia de contracturas, en una interacción músculo-tejido conectivo, todavía en estudio27.
La interpretación actual de las imágenes debiera ser entonces una síntesis de las alteraciones de los diferentes grupos musculares, considerando aquellos segmentos corporales más afectados, identificando aquellos músculos que están distintivamente afectados y respetados, acompañado de una escala reproducible de la estimación de la severidad, para comparación en el diagnóstico y seguimiento de las alteraciones.
CUANTIFICACIÓNA diferencia de lo que sucede con la Tomografía Computarizada (TC), donde las imágenes son representadas de acuerdo con una escala invariable de grises que depende de la densidad de las diferentes estructuras (unidades Hounsfield), la intensidad de señal en Resonancia Magnética depende del tiempo que tardan los diferentes tejidos, sometidos a un campo magnético, en liberar la energía previamente absorbida al ser estimulados con un pulso de radiofrecuencia (tiempos de relajación T1 y T2). La representación de la señal proveniente de estas estructuras se modifica constantemente debido a la compleja y variable interacción electromagnética de los núcleos magnéticamente activos con su ambiente. En consecuencia, la determinación aislada de la intensidad de señal de una estructura no es un indicador numérico comparable. Teniendo en consideración la necesidad de obtener mediciones técnicamente reproducibles e independientes de la variación atribuible a condiciones que alteran la intensidad de señal en otras secuencias, la técnica de Dixon comenzó a ser utilizada para estimar el reemplazo graso muscular. La técnica, descrita en 1984, consiste en una secuencia técnicamente referida como de Eco Gradiente, donde utilizando diferentes tiempos de adquisición, es posible separar de manera confiable la señal proveniente de agua y grasa28,29. Luego de su descripción, dada la baja resolución de las imágenes obtenidas en los resonadores de la época, la técnica quedó en desuso. Hace algunos años y coincidente con los avances en los equipos, la técnica reapareció, especialmente en estudios abdominales30,31.
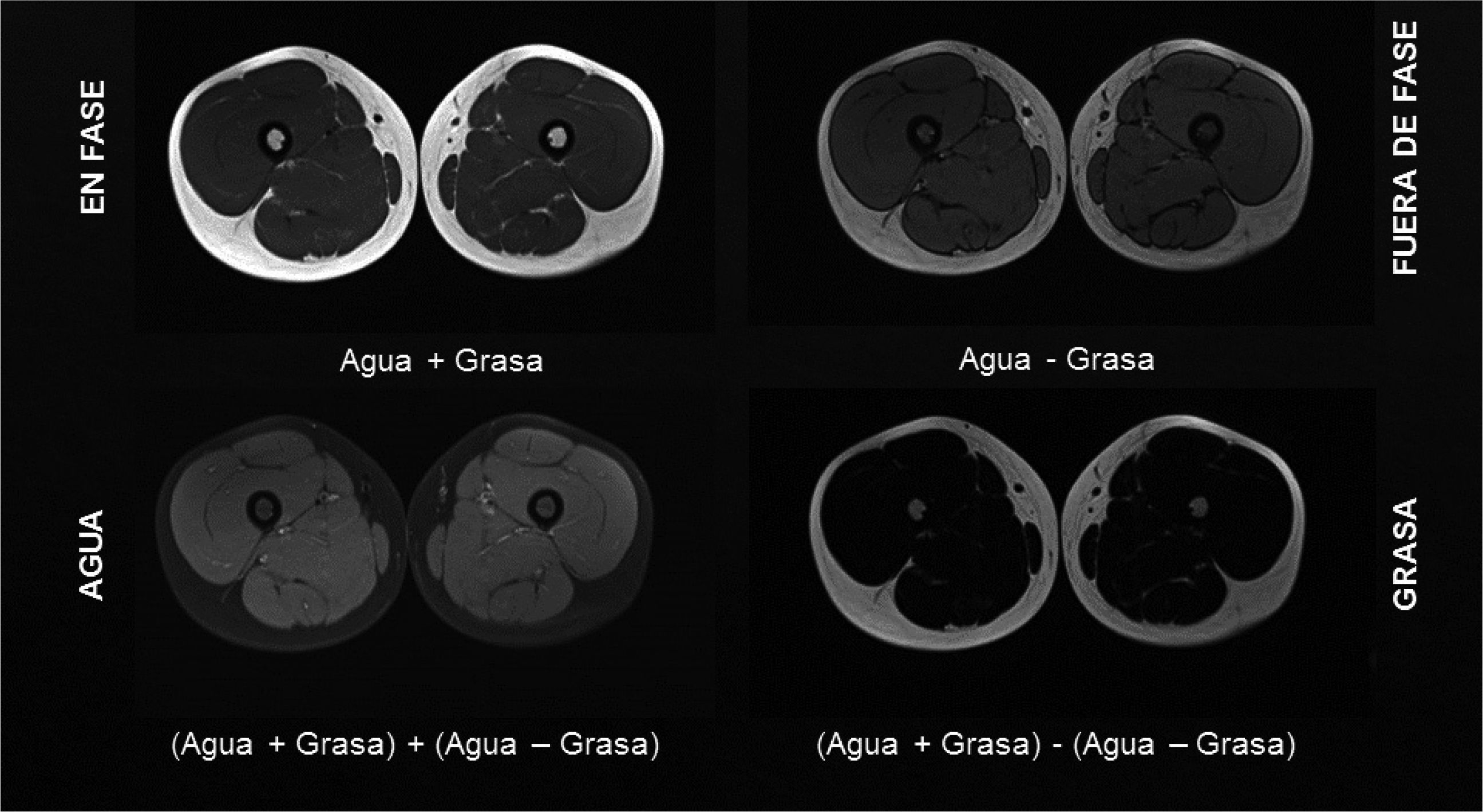
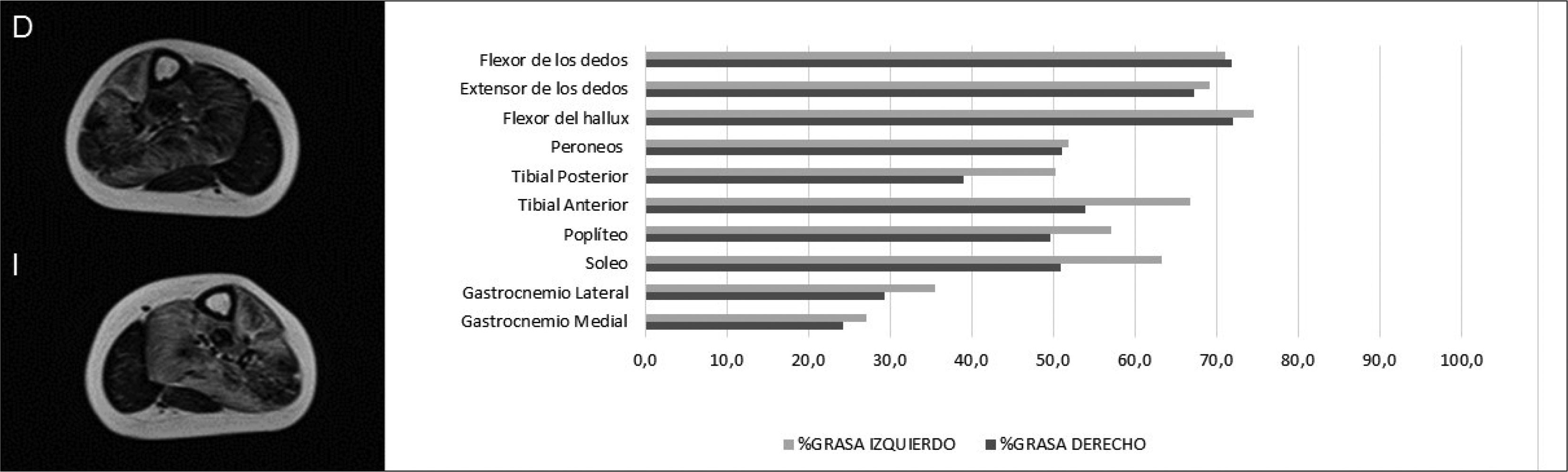
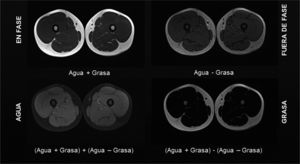
Con la secuencia Dixon de 3 puntos31 se obtienen, en una sola adquisición, cuatro imágenes simultáneas, donde la intensidad de señal de las diferentes estructuras es representación de la combinación de la intensidad de señal proveniente agua y grasa (Figura 4). La reducción progresiva de los tiempos de exploración con esta técnica ha hecho posible efectuar evaluaciones de cuerpo completo para cuantificación del reemplazo muscular con duración cercana a 30 minutos18. Su efectividad en la evaluación del reemplazo graso muscular ha sido previamente reportada32,33 y su utilización es actualmente creciente, dada la posibilidad de estimar de manera porcentual el reemplazo graso, conociendo la intensidad de señal proveniente exclusivamente de grasa respecto de la intensidad de señal total del músculo, expresada entonces como fracción grasa (Figura 5)18,34,35. Los músculos normales tienen aspecto homogéneo, sin estrías grasas visibles, con escasa variación en la fracción grasa intramuscular. En niños sanos se ha reportado 5% como fracción grasa promedio de la musculatura estriada, similar al 2-6% reportado en adultos, con cambios no superiores a 2% en el espesor del mismo músculo para la población infantil. En niños sanos es posible observar mayor variabilidad en músculos como el glúteo mayor, tensor de la fascia lata o los extensores lumbares con rangos entre 2.3 y 10.4%18,35.
Una vez resuelto el problema de la reproducibilidad de la señal en resonancia, existe un problema adicional en la estimación de la fracción grasa. No es difícil apreciar cómo la atrofia muscular y reemplazo graso de cualquier causa no es un fenómeno uniforme dentro del músculo, reconociendo áreas de músculo respetado que se alternan con tractos de grasa de diferente tamaño, en concordancia con los patrones anatómicos de reemplazo graso descritos por Goutallier. La necesidad de realizar múltiples determinaciones en músculos de pacientes miopáticos ha sido previamente reportada18. Las mediciones aisladas son insuficientes para expresar el compromiso global del músculo, el que con frecuencia tiene un comportamiento asimétrico, con mayor reemplazo en las regiones peritendíneas o en situación periférica, dejando fibras centrales relativamente normales, por ejemplo. Los promedios aritméticos de mediciones en diferentes zonas del músculo permiten estimar mejor el grado de atrofia muscular, sin embargo, representan una generalización gruesa del compromiso graso heterogéneo, en distribución y tamaño, que presentan los músculos de estos pacientes y que en el futuro debiera ser objeto de evaluaciones volumétricas.
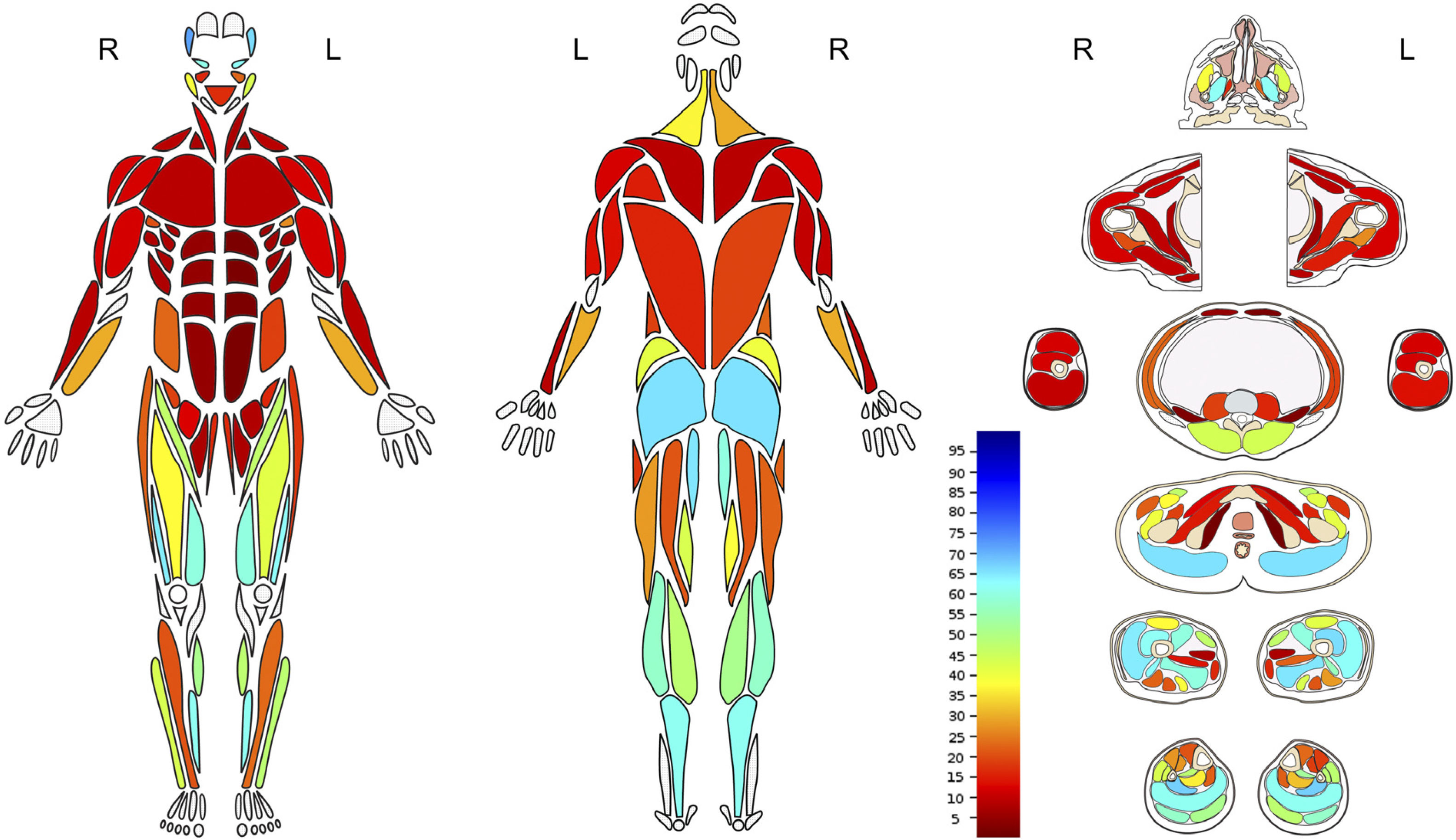
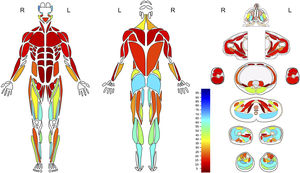
Por último, el estudio de cuerpo completo con la determinación detallada de la fracción grasa de cada músculo genera un gran volumen de datos, lo que representa un desafío adicional en la síntesis y transformación de los datos en información de utilidad clínica. En la literatura, por ejemplo, para la representación de las alteraciones, algunos autores utilizan matrices de distinto tipo en tonos de gris o color 32,36–38, o esquemas donde se representan algunos músculos utilizando diferentes tonos de gris o escalas de colores7,39. El compromiso graso expresado en una fracción numérica admite múltiples formas de representación. Los gráficos, histogramas y las escalas colorimétricas permiten condensar información dando cuenta de los patrones regionales, facilitando el reporte de los hallazgos39,40. Con estas premisas el estudio actual de la musculatura estriada en nuestro centro se compone de la evaluación utilizando secuencias Dixon desde la cabeza hasta los pies, con estimación de la fracción grasa de 117 músculos. Estos datos son condensados en un diagrama de cuerpo completo que representa el reemplazo graso porcentual en una escala colorimétrica con incrementos de 5%, que acompaña al reporte radiológico (Figura 6).
Paciente con miopatía relacionada a mutación SPEG
Mapa anatómico con escala colorimétrica que representa reemplazo graso muscular con rango de 0 a 100%, en músculos superficiales y profundos. Se observa compromiso predominante músculos de cara y cuello, de la pelvis y de extremidades inferiores, especialmente el compartimento anterior del muslo y posterior de la pierna.
Gran parte del conocimiento existente respecto de las imágenes de resonancia magnética de las miopatías congénitas se limita a pequeñas series de pacientes con estudios restringidos a las extremidades inferiores. La necesidad de detectar alteraciones en forma precoz, de comparar en forma objetiva las alteraciones en los diferentes grupos musculares y de proporcionar un método que permita el seguimiento de las enfermedades, ha justificado la implementación de técnicas cuantitativas de evaluación, así como la extensión de su uso en la población pediátrica. Las innovaciones en las técnicas de resonancia magnética han permitido obtener imágenes de cuerpo completo, sin el inconveniente de la radiación ionizante y cada vez en menor tiempo, lo que ha determinado su uso creciente en pediatría. La resonancia de cuerpo entero permite un análisis global de la musculatura esquelética haciendo evidente el hecho de que algunas enfermedades comprometen predominantemente algunos músculos respecto de otros, en una disposición descrita como patrón. La gran cantidad de información entregada por el estudio debe ser representada en forma simplificada y esquemática para el médico clínico, sinterizando aquellos hallazgos relacionados a la enfermedad que motiva el estudio. La evaluación del grado de infiltración grasa se ha realizado hasta ahora según métodos semicuantitativos de acuerdo con una escala visual, hecho que limita la posibilidad de comparar en forma objetiva los hallazgos frente a futuros estudios. La cuantificación de la fracción grasa sumada a la caracterización estandarizada de las alteraciones constituye una valiosa herramienta para el diagnóstico y seguimiento de los pacientes con enfermedades que comprometan en forma primaria o secundaria el sistema muscular, permitiendo objetivar la mejoría o el deterioro frente a posibles intervenciones clínicas o farmacológicas.
Declaración de interésDeclaro que los autores Ximena Ortega, Gonzalo Corral, Gonzalo Rojas, Javier Carrizo, Bernardita Suárez y Claudia Castiglioni, no tienen conflictos de interés respecto del presente artículo.