La tuberculosis sigue constituyendo un problema de salud pública a nivel mundial con casi nueve millones de casos nuevos en 2012 y se estima que un tercio de la humanidad está infectada. A nivel nacional, si bien las tasas son alentadoras, la variación regional es muy importante. En los últimos años se han registrado progresos importantes tanto en el conocimiento de la conducta del bacilo de Koch, el causante de la enfermedad, como en los métodos para detectarlo. Así los IGRAS (Interferon G Release Assays) nos ayudan a detectar con mayor especificidad a los infectados y el Xpert MTB / RF permite en menos de dos horas detectar la presencia del bacilo en pacientes enfermos, con una buena sensibilidad y además, con el agregado que detecta la resistencia a rifampicina.
También se han probado nuevos esquemas de quimioprofilaxis efectivos y los esquemas actuales de terapia antituberculosa a nivel nacional serán modificados, ya que la terapia bisemanal es considerada poco segura en los pacientes irregulares donde puede generar resistencia. Se estudian intensamente nuevas vacunas aún sin resultados clínicamente aplicables.
Tuberculosis, still remain a mayor public health problem with near 9 million of new cases in 2012 and a third of world population infected with Mycobacterium tuberculosis according to WHO. In Chile although we are improving, still have a big regional variation. In the last time we have improve our knowledge about the bacilli behaviour. Igras allow us more specificity for tuberculosis infection and Xpert / MB,/RF has a good sensibility to detect the Koch bacilli even in patient with negative acid fast bacilli. It also gives us information about Rifampicin sensibility.
We have now new therapy’s for Mycobacterial infection as affective as isoniazid given for 9 months. Soon we will change our national guidelines have just changed about therapy to follow WHO recommendations. We still do not have a new vaccine although there is increasing research in the area.
La tuberculosis está entre las enfermedades infecciosas que causa mayor morbilidad y mortalidad en el mundo y a pesar de que hoy, disponemos de una terapia eficaz que logra curarla, aún estamos lejos de poder erradicarla.
Situación actualLa OMS (1) estimó que en 2012 a nivel mundial se registraron 8.6 millones de casos nuevos de tuberculosis, de los cuales un 13% se presentaron en pacientes VIH (+). Más del 90 %, de acuerdo a esta estimación, son casos nuevos y más del 60 % de éstos, se localizan en Asia y en el área pacífico oeste.
Un total de 530.000 casos nuevos se presentaron en niños menores de 15 años de edad.
Hubo 450.000 personas que desarrollaron una tuberculosis multiresistente (TB-MR) (tuberculosis resistente a rifampicina e isoniazida) y se estimó que 170.000 de éstos murieron a causa de su TB-MR. En el año 2009 sólo un 48 % de las TB-MR fueron tratadas con éxito mientras que un 15 % fallecieron y 28 % se perdieron de seguimiento, probablemente por reacciones adversas o porque simplemente abandonaron la terapia.
La mortalidad global por TBC fue de 990.00 en VIH (−) y 430.000 en VIH (+). La prevalencia de acuerdo a la misma fuente es de 12 millones de pacientes y se estima que un tercio de la humanidad está infectada por el bacilo de Koch, de acuerdo a la OMS (2008) (2). Esto es muy importante ya que en los países con baja prevalencia de tuberculosis, se espera que la mayoría de los casos vendrán de la reactivación de una tuberculosis latente y no del contagio de pacientes con tuberculosis activa.
Aunque la tuberculosis puede afectar cualquier órgano, la mayoría de los casos son pulmonares. Aproximadamente un 80 % del total de los pacientes tienen compromiso pulmonar aislado o como parte de una tuberculosis más diseminada, pero las cifras son muy variables dependiendo de la población analizada.
La situación actual de la tuberculosis en Chile, aunque ha mejorado significativamente, en los últimos años, las tasas de disminución se han detenido. La tasa preliminar de incidencia de 2012 calculada por el Ministerio de Salud fue de 12,7/ 100.000 habs. (en 2000 era de 13,9) (3) Sin embargo, la variación regional es enorme, así en Arica la tasa es de 34 y en O’Higgins es de 5,2. El área oriente de Santiago, donde estamos instalados, tiene una tasa de 7,22 / 100.000 habs.
De estos casos 9,6 / 100.000 habs. son tuberculosis pulmonares y 3,1 casos extra pulmonares. Si miramos las tasas por edad veremos que la mayor incidencia de tuberculosis está entre los mayores de 65 con un 22,4% de todos los casos nuevos. La MR en Chile afortunadamente sigue bajo el 1%.
PatogénesisSi una persona recibe una carga bacilar dispersada en el aire desde un paciente con tuberculosis activa, única fuente de contagio, algunos de éstos bacilos llegarán al alvéolo. Allí son rápidamente fagocitados por los macrófagos y pueden ser eliminados, por el sistema inmune natural, como ocurre la mayoría de las veces.
Si sobreviven la primera línea de defensa se multiplican activamente en los macrófagos, invadiendo las células cercanas como las células epiteliales y endoteliales, alcanzando un desarrollo importante que se puede difundir a otros órganos, a través de los linfáticos o por vía hematógena.
Cuando el sistema inmune responde a la infección atrae linfocitos, neutrófilos y otras células inmunes, para formar un infiltrado que asume la forma característica del granuloma. Posteriormente se desarrolla una capa fibrosa que puede llegar finalmente a calcificarse, lo que antes se conocía como Complejo de Ghon. Siempre se pensó que la reactivación venía de estas lesiones, sin embargo, en el último tiempo se ha mostrado que los bacilos que originan la reactivación pueden estar en otras partes del pulmón, incluso en áreas que parecen no afectadas. Así Hernández Pardo (4) pudo mostrar con técnicas de biología molecular, en un país con alta prevalencia de tuberculosis, la presencia de bacilos en pulmones sanos de personas fallecidas de otras causas. No ocurrió lo mismo en los controles de un país con baja incidencia de tuberculosis. Éstos estaban en fibroblastos y células endoteliales. También se ha observado la presencia de bacilos en adipocitos o en la grasa periférica de varios órganos (5).
Por lo tanto, la evidencia sugiere que los bacilos pueden persistir en órganos, tejidos y células que no tienen directa relación con el sitio de infección primaria. Frente a condiciones adversas el bacilo es capaz de reducir su metabolismo a la mínima expresión. Esta respuesta está mediada por genes Dos R que son inducidos por la hipoxia, pero también en respuesta a óxido nítrico o déficit de nutrientes (6).
Pueden persistir en este estado “durmiente” por largo tiempo, pero siempre hay algunos metabólicamente activos, llamados “scouts”, los cuales son eliminados por el sistema inmune y serían los responsables de la inducción de las células de memoria.
Entonces, frente a la infección tuberculosa de un receptor, pueden ocurrir tres situaciones diferentes:
- 1.
El sistema inmune del receptor es capaz de eliminar completamente el bacilo.
- 2.
La multiplicación del bacilo no logra ser controlado por el sistema inmune y éste es capaz de producir una enfermedad clínica, habitualmente llamada tuberculosis primaria.
- 3.
Los mecanismos defensivos del huésped, son capaces de controlar el crecimiento del bacilo aunque no lo logran eliminarlo completamente. En esta situación no hay enfermedad clínica, pero hay un riesgo que se estima entre 5–10 % que el bacilo se escape del control del sistema inmune y genere enfermedad, la que habitualmente se conoce como tuberculosis post primaria.
Es la condición con la que denominamos a las personas que tienen una respuesta inmune al bacilo de Koch, sin enfermedad, es decir, una persona con PPD (+), no vacunada, pero en quien no podemos demostrar enfermedad.
Sabemos que tienen bacilos, no sólo por la respuesta inmune que, puede ser de memoria, sino porque enferman más. Se estima que las personas PPD (+) tienen un riesgo de enfermar del 10% a lo largo de la vida y la gran mayoría de los casos ocurren en los dos primeros años. También sabemos que si les administramos isoniazida como profilaxis, la que actúa sólo sobre los bacilos que se están multiplicando, evitamos que enfermen en una alta proporción de casos. Sin embargo, hoy por hoy, no tenemos ninguna técnica, clínicamente aplicable que nos revele la presencia de los bacilos en el organismo, sólo podemos ver la respuesta inmune.
En los últimos años apareció una nueva tecnología capaz de medir la respuesta inmune en forma más específica. Se trata de los denominados IGRAS (Interferon G Release Assays) que miden la liberación de interferón gama por los linfocitos, al exponerlos a antígenos que son propios del bacilo de Koch. Se utiliza habitualmente ESAT 6 y Proteína 10, antígenos que no tienen el bacilo utilizado en la vacuna (Mycobacterium bovis), así se elimina el efecto que tiene ésta sobre el PPD. La técnica requiere de controles positivos y negativos, pero aún así los resultados indeterminados siguen siendo un problema. Además los IGRAS tienen la ventaja de ser exámenes que sólo requieren de una muestra de sangre y no necesitan de una segunda visita del paciente, como es necesario para leer el PPD.
Existen dos IGRAS aprobados y de uso bastante difundido: TPSOT-TB. ELISPOT test (TSpot) y Quantiferon Gold in tuve test (QFT-GIT). El primero mide el interferón en los linfocitos y el otro en el plasma.
Ambas técnicas parecen ser más específicas que el PPD, especialmente en países donde existe un programa de vacunación BCG, pero la sensibilidad es parecida al PPD. Pareciera que el ELSPOT es ligeramente más sensible especialmente en inmunodeprimidos, donde tanto el PPD como todos los IGRAS disminuyen su rendimiento. En las distintas situaciones de inmunodepresión como los insuficientes renales, los pacientes VIH (+), los con terapia inmunodepresora, los trasplantados etc., el rendimiento disminuye pero afecta en forma diferente a cada test (7).
También con estas técnicas nuevas se evita el efecto booster que tiene el PPD.
Es importante señalar que tanto los IGRAS como el PPD no discriminan entre infección o enfermedad y por lo tanto, una persona con PPD (+) o IGRAS (+), no tiene una infección latente a menos que descartemos que tiene enfermedad.
Ni el PPD ni los IGRAS tiene una buena capacidad para predecir quiénes, entre los infectados, van a desarrollar enfermedad. Así en un metaanálisis reciente (8) el valor predictivo positivo para los IGRAS fue de 2.7% vs 1.5% para el PPD. Estos valores mejoran bastante cuando se analizan sólo los grupos de mayor riesgo (6.8% para los IGRAS y 2.4% para el PPD).
Sin embargo, el valor predictivo negativo es muy alto: 99.7% para los IGRAS y 99.4 para el PPD. Esto significa que una persona PPD negativa, tiene un riesgo de enfermar que es casi cero.
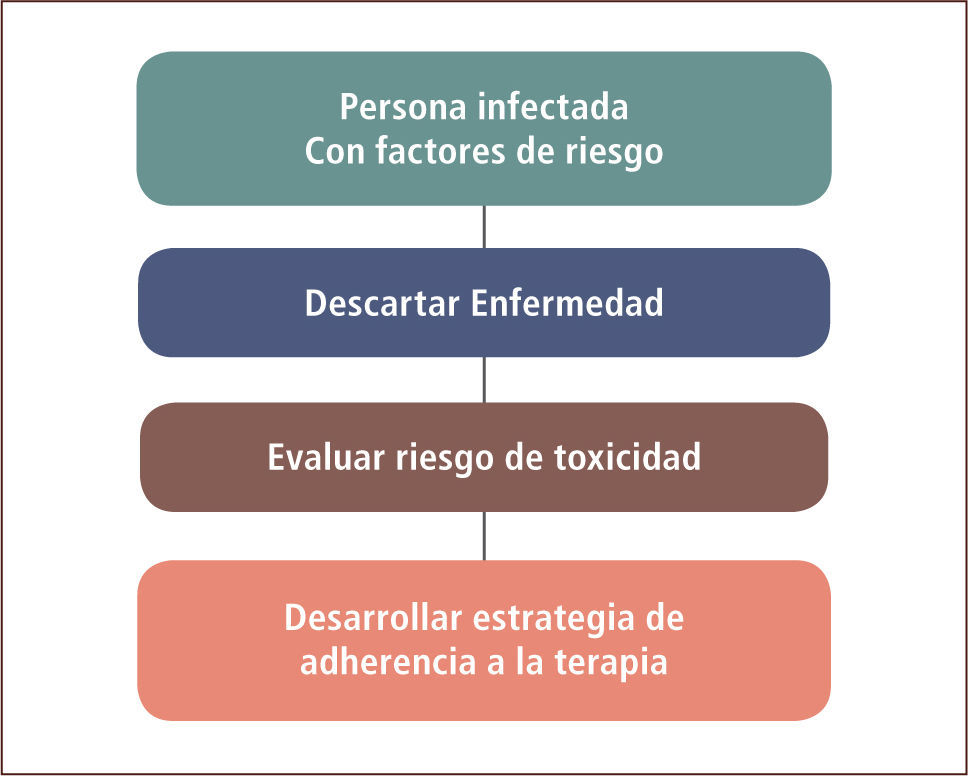
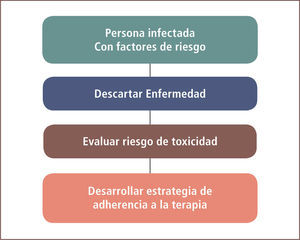
La Insoniacida (HIN) administrada por nueve o seis meses ha demostrado reducir en forma significativa el riesgo de enfermar (9). Como el valor predictivo positivo tanto del PPD como de los IGRAS son bajos, no tiene sentido tratar a todas las personas infectadas, sino sólo a las que tienen un riesgo mayor de enfermar (tabla 1) (10). Así los infectados recientes conversión reciente del PPD), los pacientes VIH (+) y aquéllos con lesiones residuales de tuberculosis que no han sido tratados, tienen un mayor riesgo de enfermar. En estas tres situaciones hay evidencia cierta de su beneficio con la quimioprofilaxis. En estas tres condiciones la evidencia del beneficio está bien demostrada. Por tanto, un paciente en cualquiera de estas condiciones tendría indicación de quimioprofilaxis a no ser que tenga un riesgo importante de toxicidad con la HIN o que, por alguna razón, se sospeche que tendrá mala adherencia.
Riesgo de un infectado de enfermar
| FACTOR DE RIESGO | Riesgo estimado de TBC en relación a personas sin factores de riesgo |
|---|---|
| RIESGO ALTO | |
| VIH sin terapia | 110–70 |
| VIH en terapia | 50–110 |
| Trasplante | 20–74 |
| Silicosis | 30 |
| IRC requiriendo hemodiálisis | 10–25 |
| Carcinoma de cabeza y cuello | 16 |
| Infección tbc reciente | 15 |
| Secuelas radiológicas de tbc | 6–19 |
| Inhibidores del TNF α | 2–9 |
| RIESGO MODERADO | |
| Terapia esteroidal | 5 |
| Diabetes | 2–4 |
| Infección en la infancia 0–4 años | 2–5 |
| RIESGO LIGERAMENTE AUMENTADO | |
| IMC < 20 | 2–3 |
| Fumador de un paquete | 2–3 |
| Granuloma en la radiografía | 2 |
| BAJO RIESGO | |
| Persona infectada sin factores de riesgo | 1 |
| MUY BAJO RIESGO | |
| Persona con PPD (+) en el segundo examen. Booster | 0.5 |
En el último tiempo la utilización de los agentes llamados biológicos, que bloquean el interferón, por el mayor riesgo de reactivar una tuberculosis latente, han hecho necesario evaluar la presencia de ésta, antes de iniciar la terapia. No todos los agentes tienen el mismo riesgo de reactivar una tuberculosis y al parecer es el Infliximab el que produce una mayor reactivación. La tuberculosis en estas situaciones suele ser bastante atípica y aparece mayoritariamente en los primeros meses de iniciado el tratamiento.
La quimioprofilaxis aprobada en nuestro medio es la isionazida administrada por nueve meses. En general la profilaxis con isionazida tiene una mala adherencia a la terapia, así en la mayoría de los trabajos ha sido de alrededor del 60%. Hay otros esquemas utilizados con buenos resultados, como la rifampicina administrada por cuatro meses o rifampicina más isoniacida diarios por tres meses. La rifapentina más isoniazida una vez por semana durante tres meses, administrada bajo observación, también ha logrado buenos resultados (10).
La decisión de dar quimioprofilaxis entonces, es una decisión clínica para cada paciente individual en que se valora el riesgo que tiene de desarrollar una tuberculosis versus la posible toxicidad al agregar HIN. También debe considerarse la eventual adherencia que tendrá el paciente al medicamento. Fundamental antes de iniciarla es descartar la enfermedad (esquema 1).
Tuberculosis pulmonar activaEl diagnóstico precoz de la tuberculosis pulmonar activa es de primera importancia para cortar la cadena de transmisión de la enfermedad. Los síntomas clásicos de la tuberculosis pulmonar son: tos, expectoración, pérdida del apetito, baja de peso, fiebre, sudoración nocturna y hemoptisis. El compromiso extra pulmonar varía entre un 10 y 40% dependiendo de la raza, la edad, el estado inmunológico, las co-morbilidades y también de la cepa de micobacteria.
En las personas con VIH (+) con recuentos de CD4 menores a 200, la presentación suele ser atípica, con compromiso ganglionar y pleural. El compromiso extra pulmonar puede llegar hasta el 50%. En estos pacientes la tuberculosis asintomática o subclínica es un hecho común y en algunas regiones llega hasta el 10%. Por eso en esta situación particular, en lugares de alta prevalencia, la presencia de fiebre, tos, sudoración nocturna o pérdida de peso, son suficientes para iniciar una terapia mientras se completa el estudio.
La baciloscopía y el cultivo de Koch siguen siendo las herramientas diagnósticas fundamentales. Idealmente los cultivos en medios líquidos, ya sea colorimétricos (MGIT) o radiométricos (BACTEC) son los que nos entregan resultados más precoces.
Me parece importante señalar que tanto el PPD como los IGRAS no tienen ningún rol en el diagnóstico de enfermedad, ya que sólo miden la respuesta inmune contra el bacilo de Koch.
Una nueva arma diagnóstica muy importante es el Xpert MTB/ RF, un sistema basado en biología molecular, cerrado y automático, que requiere poco entrenamiento y que en menos de dos horas nos informa de la presencia del bacilo, con el agregado de decirnos si es resistente o sensible a la RF.
La OMS ha implementado este sistema, a nivel global, con la idea de producir un quiebre en el aumento de la multirresistencia (TB MDR).
Se eligió la RF porque tiene solamente un gen que codifica para la resistencia y además porque el 90% de los resistentes a RF lo son a la HIN. Este sistema está implementado en el Instituto Nacional del Tórax, y está abierto a todo el país. Sólo se requiere enviar la muestra. La sensibilidad de esta técnica en muestras de expectoración, en pacientes sólo con cultivo positivo es alrededor del 80%. La especificidad cercana al 100%. La sensibilidad para detectar la resistencia a RF es de 99.1% con una especificidad de 100% (11).
Otra forma de medir la resistencia es Observación Microscópica de la Susceptibilidad a Drogas (MODS) que es capaz de detectar resistencia a RF e HIN. Pero como ninguno de éstos está disponible en países de alta prevalencia, se estima que sólo el 10% de los casos multirresitentes son diagnosticados, de los cuales la mitad recibiría terapia adecuada.
Para el diagnóstico de enfermedad aún seguimos dependiendo de la demostración del bacilo, pero en la actualidad hay técnicas promisorias en estudio como las que detectan RNA en sangre. Esto, de concretarse, representará un cambio importante. Significaría no depender del esputo, lo que es de primerísima importancia especialmente en niños (12).
Si no disponemos de bacteriología es la histología la que nos suele confirmar el diagnóstico. Esto suele ocurrir por ejemplo en pleura o ganglios, donde confirmar el diagnóstico por bacteriología es poco frecuente. Lamentablemente nuestros cirujanos no están habituados a mandar la muestra para cultivo, lo que muchas veces complica aún más nuestras dificultades diagnósticas en estas situaciones.
En un reducido número de casos el diagnóstico es presuntivo y se realiza un tratamiento de prueba evaluar la respuesta a la terapia. El tratamiento de prueba es, como decía el Profesor Victorino Farga, un acto solemne y no implica suspender el estudio diagnóstico si no muy por el contrario, mantenerse alerta a cualquier evento que confirme o descarte la tuberculosis.
TBC y VIHLa tuberculosis acelera la evolución de la infección por VIH y puede incluso llevar al paciente a la muerte. Los pacientes tuberculosos con VIH (+) sin terapia antiretroviral, especialmente los que tienen recuento celular bajo, tienen un alto riesgo de mortalidad. Todos esto pacientes deberían iniciar la terapia antiviral lo más precozmente posible, con la excepción de la meningitis tuberculosa, ya que por el síndrome de reconstitución inmune (SRI) se pueden agravar.
Este síndrome, caracterizado por un agravamiento del cuadro respiratorio, reactivación de fiebre, aparición o aumento de las adenopatías, es más frecuente mientras más bajo sea el recuento inicial de CD4 y mientras más precoz se inicie la terapia antituberculosa. Puede presentarse hasta en el 50% de los pacientes con CD4 bajo 50 células/ml (13).
TratamientoEl tratamiento además de ser asociado debe ser controlado y prolongado. Asociado, para evitar la selección de mutantes resistentes y prolongado, ya que el bacilo puede permanecer inactivo largo tiempo evitando la acción de las drogas. Los tratamientos cortos generan por esta razón recaídas y por ello, en aquellos pacientes con lesiones extensas es recomendable prolongar el tratamiento. El esquema actual de cuatro drogas en la etapa inicial de dos meses, es seguido de cuatro meses de terapia bisemanal y es capaz de curar más del 95% de los enfermos sin embargo, en la práctica se logra curar al menos a un 90%.
Aunque hasta ahora el esquema variaba según la población bacilar, esto acaba de cambiar. La idea es dar el mismo esquema para todos y tres veces por semana, en lugar de las dos actuales. La idea detrás del aumento en la frecuencia es evitar la aparición de multirresistencia. En la fase bisemanal, debido a que la Rifampicina (RF) y la Isoniacida (HIN) tienen una velocidad de inicio de la acción y una duración muy diferente, la irregularidad en la terapia aunque sea asociada puede generar resistencia ya que la RF terminará actuando sola por períodos prolongados. Dar el mismo esquema para todos, obedece sólo a razones administrativas que persiguen simplificar las normas.
Esquema Actual En USO
| TUBERCULOSIS ACTIVA | |
| ETAPA 1 | HIN / RF /PZ / EMB diario por dos meses |
| ETAPA 2 | HIN /RF tres veces por semana por cuatro meses |
| PACIENTES ANTES TRATADOS POR TBC | |
| ETAPA 1 | HIN / RF / PZ / EMB/ SM diario por un mes. Al mes se suspende SM y se sigue con las cuatro drogas por otro mes |
| ETAPA 2 | HIN / RF tres veces por semana por cuatro meses |
HIN: Isoniacida / RF: Rifampicina / EMB: Etambutol / PZ: Pirazinamida / SM: Streptomicina.
Con la aparición de la MR, la búsqueda de nuevas drogas se ha intensificado. Probablemente la eficacia de las quinolonas, especialmente el moxifloxacino, contra la tuberculosis, constituye uno de los avances más importantes en terapia. La bedaquilina (TMC-207) una dyarilquinolina; o el delamanid (OPC-6783) un nitroimidazol, han demostrado que agregadas a la terapia habitual para la multirresistencia son capaces de mejorar la conversión del cultivo a los dos meses. Éstas han sido aprobadas por Food and Drugs Administration para el tratamiento de la MR.
Nuevas vacunasAunque la actual vacuna se sigue administrando más de 100 millones de veces al año en el mundo, está fuera de toda duda que su eficacia es limitada. Protege a los niños de la meningitis tuberculosa y de la tuberculosis diseminada, pero no protege a los adultos de la tuberculosis pulmonar ni tampoco evita la tuberculosis latente. La eficacia variable en los distintos ensayos oscila entre 0 a 80% lo que se ha atribuido a numerosos factores: geográficos, pérdida de genes que serían esenciales para el desarrollo de inmunidad, pérdida de inducción de la respuesta de CD8, exposición a micobacterias ambientales o infección por helmintos previo a la vacunación (14).
Como aún no sabemos los factores de la respuesta inmune que son esenciales para conseguir la eliminación del bacilo, las nuevas vacunas en estudio, miden aquellos factores que parecen importantes, como la respuesta de CD4 T y CD8T. La interleukina 17 también parece esencial.
Hay en la actualidad tres tipos de vacunas en estudio: reingeniería de la BCG con idea de mejorar su respuesta inmune, reforzar la respuesta previa de la BCG o vacunas vivas nuevas.
Aún no ha aparecido una vacuna con mejores resultados que la BCG.
DesafiosLos desafíos futuros a juicio del autor están en buscar nuevos métodos diagnósticos, tanto para la tuberculosis activa como para la tuberculosis latente. Liberarse de la necesidad de la muestra de expectoración para el diagnóstico puede ser un avance relevante. Mejorar nuestra capacidad para detectar aquellas personas con una tuberculosis latente que tienen mayor riesgo de enfermar.
Acortar el tratamiento con nuevas drogas que ojalá ayuden también a curar las cepas multiresistentes.
Por último, encontrar una vacuna eficaz para evitar la enfermedad sería una ayuda enorme para su erradicación de la faz de la tierra
El autor declara no tener conflictos de interés, en relación a este artículo.