Las vacunas han sido una de las herramientas más útiles para lograr disminuir la mortalidad infantil. Sin embargo, los beneficios de las vacunas para menores de un año son dispares, debido a que son muy pequeños para ser vacunados. Otro grupo vulnerable son las embarazadas, quienes presentan mayor morbimortalidad por enfermedades como la influenza. La inmunización materna puede proteger a la madre contra las infecciones prevenibles por vacuna y al recién nacido mediante el traspaso de anticuerpos específicos al feto. No hay evidencia de resultados adversos en el embarazo o el feto/recién nacido por la vacunación de mujeres gestantes con vacuna inactivada contra virus, bacterias o toxoides. Por lo tanto, el embarazo no debe impedir que las mujeres reciban las vacunas que están médicamente indicadas. En Chile, se recomienda la vacunación de las mujeres gestantes, antes o durante la temporada de influenza. A fines de 2017 se implementó la vacunación con dTpa de las embarazadas con más de 28 semanas de gestación, con el objetivo de proteger al recién nacido contra el coqueluche y sus complicaciones. En el presente artículo, se hace una revisión de la literatura disponible sobre la vacunación de las embarazadas, principalmente enfocado en inmunización contra la influenza, el coqueluche y los beneficios en sus hijos.
Vaccines have been one of the most useful tools to reduce infant mortality. However, the benefits of vaccines for children under one year are disparate, because they are too small to be vaccinated. Another vulnerable group are pregnant women, who have a higher morbidity and mortality due to diseases such as influenza. Maternal immunization can protect the mother against vaccine-preventable infections and the newborn by transferring specific antibodies to the fetus. There is no evidence of adverse outcomes in pregnancy or the fetus / newborn by vaccination of pregnant women with inactivated vaccine against viruses, bacteria or toxoids. Therefore, pregnancy should not prevent women from receiving vaccines that are medically indicated. In Chile, vaccination is recommended for pregnant women, before or during the influenza season. In addition to the end of 2017, vaccination with Tdap of pregnant women with more than 28 weeks of gestation was implemented, with the aim of protecting the newly born against pertussis and its complications. In this article, we review the available literature on the vaccination of pregnant women, mainly focused on immunization against influenza, pertussis and benefits in their children.
Las vacunas han sido una de las herramientas más útiles para lograr disminuir la mortalidad infantil1. Sin embargo, los beneficios de las vacunas para los niños menores de un año son dispares. Debido a que el sistema inmune neonatal es inmaduro, el inicio de la mayoría de las vacunas programáticas es entre las 6 y 8 semanas de vida, lo que determinan que adquieran protección entre las 14 semanas y 6 meses de edad. Esto explica que sean los lactantes de 3 a 6 meses los que presentan la mayor carga de enfermedades inmunoprevenibles. Otro grupo vulnerable son las embarazadas, quienes presentan mayor morbimortalidad por enfermedades como la influenza, como ocurrió durante la pandemia de influenza H1N1 del 2009. Posterior a la implementación masiva de vacunación antiinflueza, se comprobó su seguridad y eficacia durante la gestación2,3. La inmunización materna puede proteger a la madre contra las infecciones prevenibles por vacuna y al recién nacido mediante el traspaso de anticuerpos específicos al feto4. Afortunadamente los controles de salud regulares durante el embarazo, hacen que la implementación de la vacunación durante este período sea accesible al sistema de salud.
FISIOLOGÍA DEL TRASPORTE DE ANTICUERPOS TRANSPLACENTARIOSLa transferencia natural de anticuerpos de la madre al feto a través de la placenta y la leche materna ha sido ampliamente estudiada. La transferencia transplacentaria es un proceso activo mediado por el receptor Fc que facilita el transporte efectivo de IgG5. Hay preferencia de transporte de IgG1 e IgG3, siendo más efectivo que el de IgG4 e IgG2. Este proceso comienza a las 17 semanas de gestación y progresa durante el embarazo. A las 33 semanas, los niveles de IgG maternos y fetales son equivalentes y al momento del parto, los fetales superan los niveles maternos6.
Con la vacuna del sarampión se ha observado un proceso llamado “interferencia”, caracterizado por la inhibición de la respuesta del lactante frente a la vacunación primaria cuando tiene anticuerpos maternos dirigidos a este antígeno. Este fenómeno ha sido estudiado principalmente con la vacuna del sarampión, razón por la cual esta se administra a los niños al año de vida7-9. Sin embargo, la respuesta de las células T a las vacunas no parece verse afectada por los anticuerpos pasivos y es probable que sea responsable de las rápidas respuestas de memoria observadas después de la vacunación de refuerzo.
INMUNIZACIÓN PREVIA AL EMBARAZOAl momento de planificar un embarazo, las mujeres debieran confirmar ser inmunes frente a las enfermedades infecciosas que pueden significar un riesgo tanto para ellas, como para su hijo. De lo contrario, es el momento ideal para recibir ciertas vacunas, que pudieran estar contraindicadas durante la gestación. Estas incluyen: sarampión rubéola parotiditis y varicela10. Además, deben tener un esquema primario contra tétanos, difteria y coqueluche.
INMUNIZACIÓN DURANTE EL EMBARAZONo hay evidencia de resultados adversos en el embarazo o el feto/recién nacido por la vacunación de mujeres gestantes con vacuna inactivada contra virus, bacterias o toxoides. Por lo tanto, el embarazo no debe impedir que las mujeres reciban las vacunas que están médicamente indicadas.
Las vacunas vivas pueden presentar un riesgo teórico para el feto. Sin embargo, existe abundante literatura disponible que describe la seguridad de las vacunas vivas atenuadas, incluidas las vacunas contra la rubéola monovalente, las vacunas combinadas contra el sarampión, rubéola, parotiditis (SRP) y la vacuna oral contra la poliomielitis (OPV), no informándose efectos adversos significativos para el feto después de la administración de éstas. Por lo tanto, la contraindicación de la vacuna SRP se considera una medida puramente precautoria11-13.
Los beneficios de vacunar a las mujeres embarazadas superan los riesgos potenciales de exposición a una infección particular a la madre o al feto. El uso de vacunas seleccionadas en el embarazo es un aspecto importante de la atención prenatal, que no solo mejora la salud materna, sino que también beneficia al neonato4.
A pesar de esto, existen barreras para la vacunación. El personal de salud que atiende a las mujeres embarazadas, es fundamental para poder aumentar la aceptación materna a las vacunas. Al no ofrecer la vacuna, ya sea por temor a las demandas o por el desconocimiento de las recomendaciones y de la evidencia, pierden una oportunidad única de prevención. Un estudio realizado en España, mostró que la razón más importante para no recomendar vacunas durante la gestación fue la preocupación relacionada con los eventos adversos, seguido por la falta de experiencia en la prescripción de estas14. Dado que los obstetras son percibidos como los profesionales más confiables por las embarazadas, estos no deben perder la oportunidad de recomendar las vacunas, considerando que sus indicaciones no solo serán beneficiosas para la madre, sino que también influirán en la percepción posterior para vacunar a sus hijos, disminuyendo su reticencia15.
Se están realizando esfuerzos mundiales para desarrollar, evaluar e implementar nuevas vacunas destinadas específicamente para su uso en mujeres embarazadas en países de ingresos bajos y medios. Dado que es fundamental monitorear la seguridad y la eficacia para garantizar el éxito de los programas y la confianza de los pacientes, se han propuesto sistemas para vigilar y evaluar los efectos adversos que pudiesen presentarse exclusivamente en este período. Un conjunto de 21 definiciones de caso, que incluyen resultados obstétricos (muerte materna en el embarazo, trabajo de parto prematuro, sufrimiento fetal agudo, preeclampsia/eclampsia, hemorragia posparto, hemorragia prenatal, aborto, diabetes gestacional, parto disfuncional, retraso del crecimiento intrauterino) y neonatales (muerte fetal, muerte neonatal, parto prematuro, infección neonatal, malformaciones congénitas, bajo peso de nacimiento, pequeño para la edad gestacional, encefalopatía neonatal, distrés respiratorio, retraso del desarrollo y microcefalia) han sido desarrolladas en el marco del proyecto GAIA (Global Alignment of Immunization Safety Assessment in pregnancy), con el objetivo de poder comparar y analizar datos de seguridad entre diferentes productos y poblaciones, y así fortalecer los programas de inmunización en mujeres embarazadas16,17.
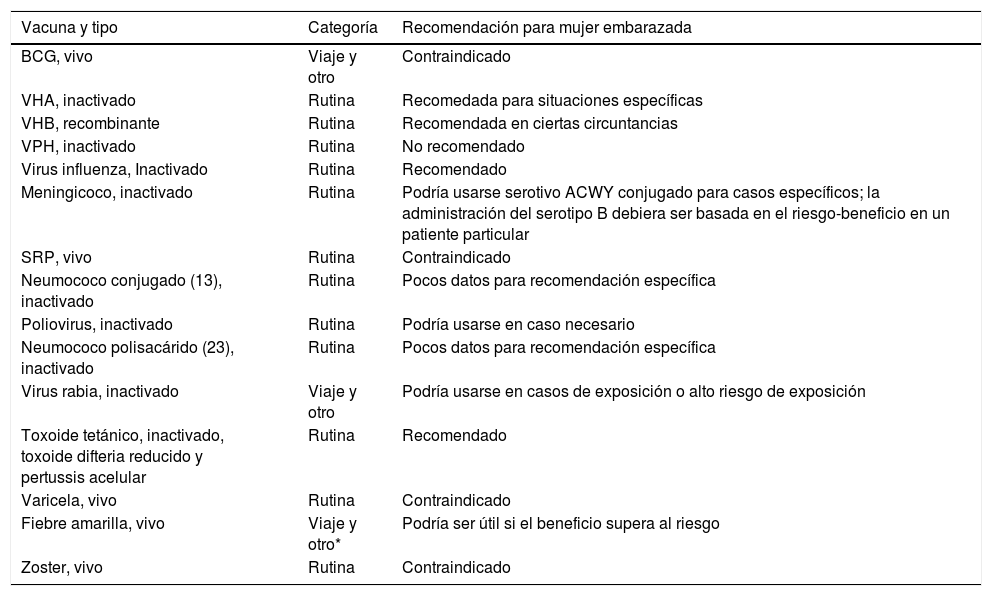
Las diferentes vacunas y su recomendación en mujeres embarazadas se resumen en la tabla 1.
Resumen de las diferentes vacunas y sus recomendaciones en mujeres embarazadas
| Vacuna y tipo | Categoría | Recomendación para mujer embarazada |
|---|---|---|
| BCG, vivo | Viaje y otro | Contraindicado |
| VHA, inactivado | Rutina | Recomedada para situaciones específicas |
| VHB, recombinante | Rutina | Recomendada en ciertas circuntancias |
| VPH, inactivado | Rutina | No recomendado |
| Virus influenza, Inactivado | Rutina | Recomendado |
| Meningicoco, inactivado | Rutina | Podría usarse serotivo ACWY conjugado para casos específicos; la administración del serotipo B debiera ser basada en el riesgo-beneficio en un patiente particular |
| SRP, vivo | Rutina | Contraindicado |
| Neumococo conjugado (13), inactivado | Rutina | Pocos datos para recomendación específica |
| Poliovirus, inactivado | Rutina | Podría usarse en caso necesario |
| Neumococo polisacárido (23), inactivado | Rutina | Pocos datos para recomendación específica |
| Virus rabia, inactivado | Viaje y otro | Podría usarse en casos de exposición o alto riesgo de exposición |
| Toxoide tetánico, inactivado, toxoide difteria reducido y pertussis acelular | Rutina | Recomendado |
| Varicela, vivo | Rutina | Contraindicado |
| Fiebre amarilla, vivo | Viaje y otro* | Podría ser útil si el beneficio supera al riesgo |
| Zoster, vivo | Rutina | Contraindicado |
Recomendaciones del CDC 202058.
En caso de viaje por motivos de fuerza mayor, las embarazadas deben recibir dosis estándar (y no dosis fraccionada), previa evaluación médica que considere la relación beneficio v/s riesgo de la vacunación59.
Ya es reconocido el aumento de la morbilidad y mortalidad de la influenza en mujeres embarazadas, principalmente en mujeres con más semanas de gestación o comorbilidades18,19, hallazgos que fueron reforzados después de la pandemia de influenza H1N1 en 200920. Efectos específicos de la influenza materna incluyen muerte fetal, parto prematuro y recién nacido pequeño para la edad gestacional21-23.
Se han reportado varios estudios de vacunas contra la influenza en mujeres embarazadas, siendo los realizados durante la pandemia de H1N1 los que incluyen a un mayor número de pacientes. Estos estudios demostraron que con la vacuna se generan títulos de anticuerpos con transferencia transplacentaria, comparables entre mujeres embarazadas y no embarazadas24-26. También se estudió la respuesta inmune en embarazadas con y sin VIH, observándose que la vacuna fue inmunogénica en ambos grupos27.
Los estudios de seguridad a gran escala en mujeres embarazadas durante la pandemia también documentaron que las vacunas eran bien toleradas y seguras durante el embarazo28,29. Posteriormente se ha encontrado que la coadministración con vacuna con toxoide tetánico inactivado, toxoide diftérico reducido y pertussis acelular (dTpa) no se ha asociado con aumento de efectos adversos maternos ni neonatales.
Múltiples estudios mostraron que no solo disminuye las infecciones confirmadas por el laboratorio y su gravedad en las mujeres embarazadas, sino que también en sus hijos27,30. Una revisión sistemática y metaanálisis publicada el año 2018, concluye que la vacunación materna contra influenza reduce el riesgo de tener influenza confirmada en el lactante menor de 6 meses en un 48% y previene la hospitalización por influenza en un 72%31.
Todas estas razones determinan que la vacunación contra influenza durante el embarazo esté ampliamente recomendado a nivel mundial. En Chile, se recomienda la administración de vacuna de influenza inactivada trivalente a las gestantes en cualquier trimestre del embarazo32, antes o durante la temporada de influenza, al igual que el Comité Asesor de Prácticas de Inmunización del CDC (ACIP) y el Colegio Americano de Ginecología y Obstetricia33,34. En Chile, el año 2019 la cobertura de esta vacuna en mujeres embarazadas alcanzó a un 93,1%35.
Una revisión Cochrane publicada el 2018, concluye que la inmunización contra la influenza en cualquier etapa del embarazo puede estar justificada durante pandemias o para mujeres con comorbilidad. De lo contrario, puede administrarse sin potenciales complicaciones maternas ni neonatales durante la segunda mitad del embarazo, incluso cuando se administra junto a la vacuna dTpa36.
CoquelucheEl coqueluche sigue siendo un problema en los lactantes. A pesar de la amplia vacunación de los niños con vacuna acelular, los lactantes menores siguen expuestos a esta enfermedad37. La mayor morbilidad y mortalidad del coqueluche se observa en los lactantes antes de su serie de inmunización primaria, a los 6 meses de vida38. En Chile, entre el 2010 y 2017 el 85% de los casos fallecidos por coqueluche correspondían a menores de 3 meses. Un 81% de los casos no habían alcanzado a recibir ninguna dosis de vacuna39.
Durante esta última década se ha demostrado que la transferencia transplacentaria de anticuerpos contra el coqueluche es efectiva. Sin embargo, los niveles de anticuerpos preexistentes en las madres que no han sido inmunizadas recientemente son bajos40-42. La vacunación de la embarazada es inmunogénica e induce una rápida respuesta de anticuerpos tanto en la madre como en el lactante. Estas altas concentraciones de anticuerpos contra el coqueluche persisten durante los dos primeros meses de vida y no alteran sustancialmente la respuesta a la vacunación rutinaria del lactante43-45. Ya desde las 13-25 semanas de gestación se produce transferencia de Ig G anti Bordetella pertussis46. El mayor traspaso de anticuerpos se produce cuando la embarazada se vacuna entre las 27 y 31 semanas de gestación, en comparación a cuando lo hace entre las 31 y 36 semanas o después de las 36 semanas37,47.
La vacuna acelular en mujeres embarazadas ha demostrado ser segura. Estudios que abarcan a más de 150 mil mujeres vacunadas, principalmente a fines del segundo trimestre o durante el tercero, confirman que no hay riesgo de complicaciones maternas o eventos adversos (incluido malformaciones congénitas) en los hijos de madres vacunadas 48.
Su efectividad quedó demostrada con la instauración de la vacunación de las embarazadas en Reino Unido, donde alcanzó un 91% en el lactante menor de 3 meses, cuando la vacuna fue administrada a la embarazada al menos una semana antes del nacimiento49. En Argentina, después de la implementación de la vacunación en embarazadas disminuyeron los casos de lactantes fallecidos por coqueluche en un 87%50. En Australia, se realizó un estudio caso control de lactantes menores de 6 meses, cuyas madres habían o no recibido la vacuna dTpa entre las 28 y 32 semanas de gestación. Se encontró que la vacuna fue altamente efectiva en prevenir enfermedad severa. El mayor efecto se observó en prevención de enfermedad en menores de 3 meses (efectividad de un 69%) y en prevenir hospitalización (efectividad de un 94%)51.
El Comité Asesor de Prácticas de Inmunización del CDC, recomienda que todas las mujeres embarazadas reciban vacunas dTpa en cada embarazo (separadas por al menos un año), para maximizar la respuesta de anticuerpos maternos y su transferencia pasiva al feto52,53. El Colegio Americano de Ginecología y Obstetricia también recomienda la vacunación entre las 27 – 36 semanas (pudiendo ser antes de 27 semanas en situaciones especiales) y repetir en cada embarazo. Las madres que no recibieron la vacuna durante embarazo, deben recibirla en el postparto inmediato34.
A fines de 2017 se implementó en Chile la vacunación contra el coqueluche utilizando vacuna pertussis acelular asociada a toxoide tetánico inactivado y toxoide diftérico reducido en las embarazadas mayores de 28 semanas de gestación54. Durante el año 2018-19, la cobertura alcanzada en el país fue de un 70,6%. Durante el año 2019, la cobertura en el país fue solo de un 63,5%55. Un aumento en la cobertura impactaría positivamente en la efectividad de la vacunación56. Además, dado que los recién nacidos pre-término o los hijos de madres que se vacunan dentro de la semana previa al nacimiento se ven menos beneficiados del programa, una estrategia que podría contribuir sería cambiar el inicio de la vacunación a las 20 semanas de gestación, para evitar asociar erróneamente abortos y/o malformaciones fetales propias del primer trimestre con la vacuna dTpa, de manera de ofrecer una mayor oportunidad de inmunización a las madres que presentan partos prematuros57. Esta medida ya ha sido incorporada en algunos países y esperamos que un futuro sea discutida en nuestro país.
CONCLUSIÓNEn conclusión, podemos decir que la vacunación de la embarazada contra la influenza y el coqueluche es una medida segura y efectiva para proteger tanto a la madre, como al recién nacido en sus primeros meses de vida. Nuestros esfuerzos debiesen enfocarse en mantener altas coberturas de vacuna contra influenza y mejorar las coberturas de vacuna contra el coqueluche de manera de optimizar la efectividad de estas. Nuevas vacunas para embarazadas (virus respiratorio sincicial y Streptococcus grupo B) se encuentran actualmente en desarrollo.
Declaración de conflicto de interésLa autora declara no tener conflictos de interés.