El recién nacido de pretérmino (RNPT), especialmente el menor de 32 semanas de edad gestacional, presenta un mayor riesgo de adquirir infecciones y que estas sean de curso más grave respecto a los recién nacidos de término (RNT), debido, entre otros factores a una inmadurez de varios componentes del sistema inmune. Muchas de estas infecciones son inmunoprevenibles por vacunas disponibles en nuestro medio y la recomendación actual es vacunar a los lactantes nacidos de pretérmino o bajo peso, salvo pocas excepciones, con todas las vacunas rutinariamente recomendadas según su edad cronológica al igual que un RNT. Sin embrago, en muchas oportunidades se observa un retraso en los calendarios de inmunización de estos lactantes principalmente por las aprehensiones respecto a la inmunogenicidad y seguridad de las vacunas en esta población. El objetivo de este artículo es revisar la evidencia disponible respecto a la eficacia y seguridad de las vacunas habitualmente utilizadas en lactantes, enfocados en los RNPT.
Preterm infants, especially those born with less than 32 weeks of gestational age, have a higher risk of acquiring serious infections compared to term infants due among other factors, to a decrease in several components of the immune system. Many of these infections are immunopreventable by vaccines available in our country. The current recommendation is to vaccinate all preterm or low weight born infants with few exceptions, using vaccines routinely recommended according to their chronological age just as term infants. However, on many occasions there is a delay in the immunization schedules of these infants mainly due to the apprehensions regarding the immunogenicity and safety of vaccines in this population. The aim of this article is to review the available evidence regarding the efficacy and safety of vaccines commonly used in preterm infants.
Una de las intervenciones más exitosas en salud pública ha sido la introducción de programas de vacunación a nivel mundial, logrando reducir e incluso erradicar enfermedades inmunoprevenibles con alta morbimortalidad. Sin embargo, a pesar de la disponibilidad de múltiples vacunas eficaces y seguras, su uso es aún limitado en grupos especiales como los recién nacidos (RN) y niños prematuros (RNPT). En el mundo, cerca de un 10% de los lactantes nacen prematuramente (antes de las 37 semanas de gestación) siendo la principal causa de morbimortalidad neonatal, aumentando significativamente a menor edad gestacional especialmente en aquellos <32 semanas y/o <1.500 gr Recien Nacido Bajo Peso Nacimiento (RNBPN)1,2. Los RNPT y los RNBPN tienen mayor riesgo de adquirir infecciones, en especial aquellas inmunoprevenibles por lo que la inmunización neonatal (antes de los 28 días de vida) y en la embarazada permitiría dar una protección precoz en esta etapa más vulnerable3.
Universalmente se recomienda que la vacunacion en el RNPT se realice según edad crónológica independiente del peso de nacimiento ni edad gestacional (EG), siguiendo las recomendaciones para los RN de término y lactantes en general (dosis completa). A pesar de esto existen dificultades y demoras en el cumplimiento de las inmunizaciones en el RN4. Esta revisión tiene como objetivo realizar una puesta al día sobre la inmunización en el RN, analizando la evidencia en inmunogenicidad, reactogenicidad y seguridad de las vacunas disponibles de administrar en este grupo etáreo.
PREMATUREZ E INFECCIÓN POR ENFERMEDADES INMUNOPREVENIBLESEl RN, en especial el <32 semanas de EG, tiene un sistema inmune anatómicamente intacto, “naive” (sin una exposición previa a un antígeno) pero, con una demostrada disminución de la función de algunos de sus componentes, como una menor concentración de anticuerpos y capacidad de reconocimiento de agentes infecciosos. En la respuesta inmune celular neonatal predomina la línea celular Th2, con una disminución de las citoquinas proinflamatorias de la línea celular Th1. Esta adaptación evita la reacción aloinmune entre madre y feto, facilita la transición del ambiente intra al extrauterino permitiendo la colonización normal y formación adecuada del microbioma del neonato. Además de la conocida inmadurez de los mecanismos de barrera (piel y mucosas) estas características hacen que sean más vulnerables a las infecciones. Sin embargo, la mayoría de los RN sobreviven a este período gracias al paso placentario de anticuerpos maternos (IgG), mecanismo activo que ocurre a partir de la semana 14 de gestación, aumenta despúes de la semana 28 y no es sino hasta después de las 32 semanas de gestación que las concentraciones de anticuerpos son suficientes para prevenir infección. Esta transferencia natural de anticuerpos se ve interrumpida por el nacimiento de un RNPT. El inmunocompromiso del prematuro se acentúa por la pobre disponibilidad de recibir en forma temprana leche materna, que confiere inmunidad pasiva mediante IgA y otros inmunomoduladores5.
Por otra parte, es conocido que el RNPT tiene mayor riesgo de adquirir infecciones inmunoprevenibles, como infección por Bordetella pertussis RR 1.86 (95% IC 1.33-2.38), con una presentación de mayor severidad OR 5.0 (95%IC 1.27-19.71), mayor riesgo de enfermedad neumocócica invasora (ENI) RR 2.6 en RNBPN y 9,1 en <32 semanas (p=0,03)6, comparado con el RN de término. A su vez se ha descrito mayor riesgo de hospitalización por Rotavirus y por influenza y sus complicaciones7. Todas ellas enfermedades inmunoprevenibles.
INMUNOGENICIDAD EN EL RNT Y PRETÉRMINO (PT)El principal desafío en la vacunación del RNT y PT es lograr alcanzar una adecuada respuesta inmune (inmunogenicidad) y protección de una determinada enfermedad (eficacia). Existe controversia sobre la inmunogenicidad en este grupo, basada en una probable respuesta subóptima o hiporespuesta además de la posible interferencia con los anticuerpos maternos8. Se conoce que la respuesta inmune a vacunas es directamente proporcional a la EG, pero, a su vez existen otros factores que podrían afectar la producción de anticuerpos como es la situación clínica al recibir la vacuna, los tratamientos asociados, la composición de la vacuna y su calendario de administración. Sin embargo, se logra una adecuada respuesta inmune a pesar de estos factores en la mayoría de los RNPT. En un seguimiento a largo plazo de RNBPN, se compararon las medias geométricas de anticuerpos de 16 niños prematuros extremos (<29 sem y <1.000 gr) que habían recibido el esquema de vacunación completo según edad cronológica, con la de niños de término pareados por edad. No se observaron diferencias en anticuerpos específicos contra tétanos, hepatitis B, pertussis, polio 1 y 2. Para anticuerpos anti-Hib se observó medias geométricas más bajas en los RNPT pero, todos alcanzaron niveles de anticuerpos anti-Hib >0,15μg/dl, considerado como nivel seroprotector. Para los anticuerpos anti-difteria y polio 3, las medias geométricas resultaron más bajas9,10. Estos datos refuerzan el concepto de que la adherencia al esquema de vacunación es aún más crítica en relación a los RN de término.
SEGURIDADLa administración de vacunas de rutina en RNPT es generalmente segura y bien tolerada. Se han reportado en RNPT un aumento de la incidencia o aparición de eventos cardiorespiratorios como apneas y/o bradicardias luego de la primera inmunización con DTPw (células enteras) o DTPa (acelular) en RNs de muy bajo peso de nacimiento11, que ha motivado el retraso de la vacunación en este grupo.
La relación entre la administración de vacuna DTPa y la aparición de eventos adversos cardiorespiratorios se ha estudiado ampliamente, sin embargo, no se ha encontrado una clara relación3. Carbone y cols. realizó un estudio prospectivo, aleatorizado controlado en el año 2008, donde se excluyó la posibilidad de que los RNPT vacunados con DTPa presenten apneas y/o bradicardias secundarias a la vacunación en las siguientes 48hrs de ésta. La presencia de apneas y bradicardias se observó en un 16,1% y 58,1% en el grupo vacunado y en un 20,4% y 56,1% en el grupo control, respectivamente12. Por otra parte, Montague E y cols, observó la presencia de eventos adversos serios en RNPT con displasia broncopulmonar, grupo de mayor riesgo de presentar complicaciones por su patología de base, no encontrando diferencias significativas con el grupo control en el aumento de soporte ventilatorio ni en el requerimiento de oxígeno (aumento de FIO2>10%) hasta 72hrs. de ocurrida la vacunación en ambos grupos13.
Es así, que los eventos cardiorrespiratorios ocurridos en relación a la inmunización en prematuros parecen ser más propios de su condición de base que causados por la vacuna. El principal factor de riesgo de presentar una apnea frente a una vacuna en las unidades neonatales, es el antecedente de haber presentado apneas en las 24hrs. previas a la vacunación, siendo más frecuentes en aquellos RNs con menor peso de nacimiento y enfermedades más severas. Se recomienda entonces mantener en observación a aquellos pacientes que van a ser vacunados en una Unidad de Neonatología por al menos 48hrs post inmunización14.
PROTECCIÓN INDIRECTA DEL RNLa vacunación oportuna y completa de los contactos de RN y sobre todo aquellos RNPT es fundamental. Es necesario insistir que los hermanos y otros contactos, cumplan con el programa de vacunación habitual. Los padres, cuidadores y otros contactos de estos niños debieran recibir anualmente vacuna contra la influenza.
Vacunación de la embarazada: Desde el año 1998 se recomienda la vacunación contra influenza en la embarazada; con esto no sólo se protege a la embarazada que tiene alto riesgo de complicaciones y de hospitalización, sino que también al RN y lactante durante los primeros meses de vida cuando la vacuna de influenza aún no puede ser indicada en el niño. Existe evidencia de que la vacunación de la mujer embarazada retrasa el primer episodio de influenza y disminuye su gravedad en el RN y lactante si se infecta9.
Al mismo tiempo, se incorporó a nuestro programa nacional de inmunizaciónes (PNI) desde el año 2017, la inmunización a la embarazada con vacuna de coqueluche (dTpa) desde las 28 semanas de gestación con el objetivo proteger al RN los primeros meses de vida15. Los anticuerpos maternos transferidos vía transplacentaria al RN podrían proporcionar protección contra el coqueluche en forma temprana y antes de comenzar la serie primaria de vacunación con dTp. La vacunación en el segundo trimestre del embarazo produce mayores niveles de anticuerpos en lactantes, incrementa las oportunidades de vacunación y permite proteger a los prematuros. En algunos países recomiendan su administración a partir de la semana 20, en cada embarazo16.
VACUNAS DE USO HABITUAL EN EL RNLa vacuna ideal para el RN, debiese ser oral más que intramuscular o subcutánea, generar una respuesta inmune protectora después de sólo una dosis de vacuna con mínima interferencia con los anticuerpos maternos. Esta respuesta a su vez debe gatillar una memoria adecuada con dosis sucesivas (lactante), sin generar una hiporespuesta al ser administrada concomitantemente con otras vacunas y debe ser segura17.
Se analizarán las vacunas más frecuentemente usadas en el RN.
1. Vacuna BCG (Bacilo Calmette–Guérin)a. Generalidades:La tuberculosis continúa siendo un problema de salud primordial a nivel mundial, corresponde a la principal causa de muerte por un agente infeccioso en el mundo. La Organización Mundial de la Salud (OMS) estimó que el año 2018, 10 millones de personas enfermaron de tuberculosis18. En Chile, la tasa de incidencia fue de 15,6 casos por 100.000 habitantes para el año 2017, lo que corresponde a un total de 2.740 casos19. Los niños menores de 4 años presentan mayor riesgo de enfermedad diseminada (tuberculosis miliar y meningitis tuberculosa) y muerte por la infección por Mycobacterium tuberculosis20.
La vacuna Bacilo Calmette-Guerin (BCG) es una vacuna viva atenuada derivada del Mycobacterium bovis, única vacuna aprobada en el mundo para prevenir la tuberculosis. Habitualmente administrada en los días posteriores al nacimiento en los RN con el objetivo de reducir la incidencia de enfermedad tuberculosa, principalmente las formas diseminadas. La vacuna induce una reacción de hipersensibilidad retardada e inmunidad mediada por células a las 4-8 semanas post inmunización21.
b. Eficacia y seguridad de la vacuna BCG en RNPTEn el RNPT y aquellos de muy bajo peso de nacimiento (<1.500gr), la vacunación con BCG suele ser retrasada lo que se ha asociado a disminución de las tasas de cobertura hasta tres veces respecto a aquellos RNT con peso adecuado, lo que los hace vulnerables a contraer la infección, especialmente en los grupos de mayor riesgo. Lo anterior está basado en que existe escasa evidencia respecto a la inmunogenicidad y seguridad de la vacunación BCG en esta población20.
Un estudio publicado el año 1999 por Thayyil-Sudhany cols, evaluó la inmunogenicidad de la vacuna BCG en 62 RNPT. Se analizó la respuesta a la vacuna mediante la reacción PPD a las 6-8 semanas post inmunización, entre los RNPT vacunados a las 34-35 semanas de EG con aquellos en que se retrasó la vacunación hasta las 38-40 semanas de EG. No hubo diferencias en la respuesta inmune celular a la vacuna (80% v/s 80,7% de positividad de PPD a las 6-8 semanas post vacunación) y no se observaron efectos adversos en ninguno de los grupos22. Posteriormente, Saroha y cols. estudiaron la inmunogenicidad y seguridad de la vacuna en 180 RNPT de 31-33 semanas, un grupo recibió la vacuna BCG a las 72hrs post nacimiento y el otro grupo fue vacunado a las 34 semanas de EG, ambos grupos tuvieron porcentajes similares de aparición de cicatriz BCG y reacción PPD positiva a los 6 meses de edad (39,1% v/s 37,5%), al igual que los niveles de IFN-γ (60% v/s 65% de los RNPT con PPD negativo aumentaron en forma significativa los niveles de IFN-γ). Respecto a efectos adversos sólo dos pacientes presentaron linfoadenopatías axilares, uno en cada grupo23. El año 2019 se publicó una revisión sistemática que incluyó 40 estudios con un total de 10.568 RNPT (entre 26-37 semanas) y/o RN de bajo peso de nacimiento (0,69-2,5kg) que fueron vacunados antes del séptimo día post nacimiento y 4310 que recibieron la vacuna a edades variables entre el octavo día y los 12 meses de vida. En ambos grupos se observó un perfil de seguridad, reactogenicidad y tasas de conversión PPD similares21.
c. Recomendación:- •
La OMS recomienda que aquellos RNPT sanos, mayores de 31 semanas de EG pueden recibir la vacuna BCG al igual que aquellos <2.500gr clínicamente estables e idealmente no retrasar la vacunación más allá del alta y con dosis habituales.
- •
Sin embargo, en nuestro país, la normativa ministerial indica vacunar a los RNPT cuando han alcanzado un peso igual o superior a 2.000 gr, por lo que la inmunización en RN con peso menor sigue siendo considerado un error programático, situación que podría ser reanalizada a luz de la evidencia actual.
- •
Está contraindicada la vacunación en aquellos RN con sospecha de inmunodeficiencia como aquellos con antecedentes de hermanos portadores de inmunodeficiencia combinada severa, y en hijos de madres VIH (+) se sugiere esperar el recuento diferencial de linfocitos previo a la vacunación, salvo que se trate de un RN con SIDA clínico, situación muy poco frecuente.
La transmisión perinatal es la causa más frecuente de infección por virus de hepatitis B (VHB) en zonas endémicas intermedias (2-8%) y altas (>8%), siendo Chile un país de baja endemia (<2%). Se conoce que el riesgo de una infección crónica por VHB es inversamente proporcional al momento de la adquisición del virus: 90% RNs, 30% si la infección ocurre antes de los 6 años y un 5% en el niño mayor o el adulto inmunocompetente. La inmunización universal a partir del nacimiento y otras estrategias exitosas de vacunación contra la hepatitis B han resultado en una dramática reducción de la transmisión del VHB en países con una endemicidad histórica. Con esta estrategia se espera una reducción de las enfermedades relacionadas con el VHB como la hepatitis crónica, cirrosis hepática y carcinoma hepatocelular, que causan gran preocupación desde el punto de vista de la salud pública y la economía en estas áreas24,25.
En Chile se incorporó la vacunación contra VHB en el RN en abril del 2019 como una de las estrategias para eliminar la transmisión vertical (TV) y así evitar la cronicidad. Los lineamientos de vacunación del Ministerio de Salud (MINSAL) recomiendan vacunar a todo RN antes de las primeras 24hrs de vida, excepto en el <2000 gr donde queda bajo criterio médico26.
b. Eficacia y seguridadExiste suficiente evidencia sobre la inmunogenicidad, eficacia y seguridad de la vacuna de VHB en el RN. La vacuna de VHB, es inactivada, por lo que no tiene capacidad de producir la enfermedad. Está desarrollada mediante técnica recombinante y constituída por HBsAg producido en cultivos de levaduras. La vacuna que se utiliza en el Programa Nacional de Inmunizaciones (PNI) es monovalente con 10 mcg HBsAg recombinante para el RN y combinada hexavalente para lactantes (DTPa+Hib+ IPV+ VHB) en una pauta de 2, 4, 6 y 18 meses.
Tras la aplicación de la pauta vacunal habitual (3 dosis) se detectan niveles protectores de anticuerpos (anti HBsAg >10mUI/ml) en más del 90% de los adultos y del 95% de los niños y adolescentes. Uno de los primeros estudios al respecto publicado en 1992 reportó menores tasas de seroconversión en pacientes inmunizados con peso menor de 1000 gr comparado con aquellos con más de 2000 gr en un esquema de 3 dosis. Posteriormente, entre 1997 y 1999 comunicaciones en EE.UU. concluyeron que ni el bajo peso de nacimiento ni la edad gestacional extrema influía en las tasas de seroconversión para la vacuna de VHB27,28. A pesar de estos estudios, la AAP recomienda que en RN <2000 gr, hijos de madres seronegativas se difiera la vacuna a los 30 días de vida o antes del alta hospitalaria, mientras que si la madre es seropositiva (HBsAg) se recomienda vacunar dentro de las primeras 12 horas de vida, independiente del peso. No se debe considerar esta dosis como parte de la serie primaria y debe recibir 3 dosis posteriores27. En Chile los lactantes reciben 4 dosis de vacuna combinada además de la dosis neonatal por lo que no es necesario tener en cuenta el peso de nacimiento a la hora de la vacunación frente a la hepatitis B29. Hasta ahora en nuestro país, desconocemos el estado serológico de VHB de las madres, no se ha incorporado el cribado universal a la embarazada que permitiría discriminar, salvo en algunos servicios de salud donde se realiza cribado en madres extranjeras y en chilenas con conductas de riesgo30.
En los casos de madres con infección por VHB (HBsAg positivo), la administración asociada de IgVHB permite reducir la transmisión en más de un 90%, siendo los RN de mayor riesgo los que son hijos de madres con replicación viral activa (HbeAg (+)) o carga viral elevada31.
Falta información respecto a seguridad de vacunas administradas en periodo neonatal inmediato en población de BPN y/o RNPT, ya que los estudios encontrados hacen referencia a vacunación a las 4-6 semanas de vida de acuerdo a calendarios de vacunación habituales utilizando vacunas combinadas donde los eventos secundarios encontrados pueden atribuirse a otros componentes de la vacuna. Una experiencia nacional aún no publicada de uso de vacuna de VHB en RNPT menores de 2000 grs, no mostró reacciones adversas asociadas a la vacuna independiente del peso de nacimiento (Izquierdo G).
c. Recomendación- •
Vacunar a todos los RN con vacuna VHB antes de las primeras 24hrs de vida con vacuna monovalente VHB. No vacunar con vacuna combinada hexavalente antes de las 6 semanas de vida.
- •
En caso de tratarse de RN hijos de madre con HBsAg (+) administrar la vacuna VHB + IgVHB antes de las 12hrs de vida.
- •
En los menores de 2000 grs evaluar la estabilidad del paciente antes de vacunar. Estabilidad se define como aquel paciente sin compromiso hemodinámico y requerimientos de drogas vasoactivas, pacientes con FIO2 menor de 40% (CPAP – VMI) por más de 2hrs, sin requerimientos transfusionales ni sangrado activo.
- •
En los menores de 1000 gr vacunar idealmente bajo monitorización en UCI neonatal.
- •
Sólo en caso de hijos de madre seronegativa conocida y menores de 2000 gr se podría retrasar la vacunación de VHB al mes de vida. Si se desconoce el estatus serológico materno asumir como positiva y vacunar antes de las 24hrs de vida.
La vacuna combinada hexavalente administrada a los lactantes en nuestro país desde el año 2018, prevee la proteción contra las infecciones causadas por Corynebacterium diphtheriae, Clostridium tetani, virus polio, Haemophilus influenzae tipo B (Hib), virus de hepatitis B y Bordetella pertussis. Las vacunas combinadas tienen la ventaja de disminuir el número total de punciones en los lactantes y sobre todo en aquellos RNPT aumentando así la adherencia a la vacunación. Se administra en un esquema primario de 3 dosis (2, 4 y 6 meses) más un refuerzo a los 18 meses de edad32. Se conoce que los RNPT y de bajo peso de nacimiento tienen una mayor susceptibilidad a la infección por Hib y B.pertussis principalmente33,34.
b. Inmunogenicidad y seguridadNumerosos estudios realizados en las últimas décadas han confirmado una adecuada inmunogenicidad y eficacia de la vacuna hexavalente en los RNPT, incluidos los de muy bajo de peso de nacimiento, iniciándose a los 2 meses de edad crónológica, procedimiento que se realiza en dosis similares a los RNT y en RN aún hospitalizados11,32,34.
Si bien los niveles de anticuerpos alcanzados en RNPT con el esquema primario son menores a los de los RNT, éstos alcanzan niveles protectores adecuados. Vázquez y cols, reportaron títulos de anti-HBsAg de VHB >10 mUI/ml en un 93,7% de los pacientes menores a 1500 gr y alcanzan títulos de anticuerpos protectores anti difteria, tétanos, Hib, polio virus, B.pertussis en entre un 92,4 y 100% de los pacientes. Existe una tendencia a tener una leve menor respuesta de anticuerpos en RN de BPN para algunos de los componentes de pertussis que se recupera con la dosis de refuerzo a los 18 meses35.
La principal reacción adversa descrita es la presencia de apneas, que pueden ocurrir durante las 72hrs (peak entre 12 a 24hrs) de la administración de la vacuna hexavalente. Se presentan con mayor frecuencia en RNPT con mayor comorbilidad asociada a la prematurez13. Los eventos descritos como apneas y/o desaturación se recuperan espontáneamente y son más frecuentes con la primera dosis de vacuna. De presentar un evento cardiorrespiratorio con la primera dosis de vacuna se recomienda administrar la segunda dosis con observación en un ambiente hospitalario36. Klein y cols. observaron que el principal predictor de eventos cardiorrespiratorios con la inmunización es haber presentado apneas en las últimas 24hrs, aumentando el riesgo en 25 veces14. En relación a la fiebre se observa que es más frecuente en RNT que en RNPT; 40,4% versus 27,6%, respectivamente36.
c. Recomendación- •
No retrasar la vacunación con hexavalente en RNPT por lo que se recomienda vacunar a los 2 meses cronológicos, independiente del peso.
- •
En el caso de haber presentado apneas en las 24hrs previas a la vacunación se prefiere diferir y reevaluar. Si no es posible, vacunar igual y mantener monitorizado.
- •
Monitorizar a los pacientes vacunados en una Unidad de Neonatología por al menos 48 a 72hrs post inmunización.
La infección por Streptococcus pneumoniae es una causa reconocida de enfermedad en la población pediátrica. Los RNPT son particularmente vulnerables a padecer infecciones graves por este agente, especialmente los menores de 32 semanas de EG con un riesgo de 1,6 veces respecto a los RNT37.
Desde los años 60, dos tipos de vacuna anti-neumocócicas fueron incorporadas en forma exitosa; las vacunas conjugadas; inicialmente 7-valente, 10-valente conjugada con la proteína-D del Haemophius influenzae no tipificable y posteriormente la vacuna 13-valente, además de la vacuna polisacárida 23-valente indicada en mayores de 2 años con factores de riesgo38.
Desde el año 2000, varios países han incorporado la vacuna conjugada dentro de sus programas de inmunización. La vacunación anti-neumocócica rutinaria ha disminuido significativamente la incidencia de enfermedad neumocócica invasora (meningitis, neumonía y sepsis) y de otitis media aguda causada por Streptococcus pneumoniae39.
La vacuna conjugada 13-valente fue licenciada el año 2008 y es la que se administra hoy en día en la mayoría de los países que cuentan con inmunización rutinaria contra Streptococcus pneumoniae, incluyendo Chile desde el año 2017.
b. Seguridad y eficacia de la vacuna conjugada anti-neumocócica en RNPTPara la vacuna conjugada 13-valente, Martinón-Torres et al. evaluaron su eficacia en un estudio multicéntrico con grupos paralelos, incluyeron 200 RN, 100 fueron RNPT. Todos recibieron un esquema de vacunación a los 2,3 y 4 meses con una dosis de refuerzo a los 12 meses de edad. Un mes después de haber completado el esquema primario, más del 85% de los sujetos alcanzó concentraciones de anticuerpos IgG ≥0.35microg/ml, pero, la proporción de respondedores fue significativamente menor entre los RNPT para los serotipos 5, 6A and 6B comparado con los RNT. Sin embargo, esta diferencia desapareció al mes de haber recibido la dosis de refuerzo a los 12 meses de edad (97% de los sujetos alcanzaron concentraciones protectoras de anticuerpos, excepto para el serotipo 3)40.
Kent A. et al. compararon tres esquemas de vacunación en 210 RNPT <35 semanas semanas de EG, un esquema primario reducido a los 2 y 4 meses, esquema acelerado a los 2, 3 y 4 meses y un esquema extendido a los 2, 4 y 6 meses, todos recibieron una dosis de refuerzo a los 12 meses. Luego de recibir el esquema primario de inmunización, 75% (62–85, IC 95%), 88% (76–95, IC 95%), y 97% (87–99, IC 95%) de los RNPT inmunizados con el esquema reducido, acelerado y extendido respectivamente, alcanzaron concentraciones protectoras de anticuerpos para al menos la mitad de los serotipos incluidos en la vacuna 13-valente41.
Respecto a la seguridad de la vacuna en RNPT, Duan et al. publicaron un meta-análisis que incluyó 2.131 RNPT y 10.960 RNT inmunizados con vacunas conjugadas 7, 10 o 13-valente. La tasa de reacciones locales (26% in RNPT vs. 23,1% 3n RNT) fue el evento adverso más comúnmente reportado, sin diferencias estadísticas entre los grupos. Respecto a las reacciones sistémicas, la incidencia de fiebre >38°C, decaimiento, irritabilidad o inapetencia varía entre 29,3% a 53,3% en RNPT sin diferencia significativa respecto a los RNT. No se reportaron efectos adversos serios ni muertes en ninguno de los estudios incluidos en la revisión38.
c. Recomendación- •
Aunque los RNPT tienen una menor inmunogenicidad a la vacuna comparado con los RNT, las concentraciones de anticuerpos alcanzan niveles aceptables y debieran ser suficientes para conferir protección.
- •
En Chile, la vacuna conjugada anti-neumocócica 10-valente, fue incorporada al programa nacional de inmunizaciones en noviembre del año 2010 y reemplazada por la vacuna 13-valente el año 2017. El esquema administrado en nuestro país para RNPT considera 3 dosis en esquema primario (2, 4 y 6 meses), con un refuerzo a los 12 meses de edad.
La enfermedad meningocócica invasora (EM) es una enfermedad grave causada por Neisseria meningitidis (Nmen) con elevada morbimortalidad. Se han identificado 13 serogrupos, de los cuales 6 (A, B, C, W135, X e Y) pueden afectar al ser humano.
El grupo de edad con mayor riesgo de presentar una EM en nuestro país es el de lactantes menores a un año, seguido del grupo de entre uno y cuatro años. El serogrupo prevalente en Chile había sido el W hasta el año 2017, el 2018 apenas sobrepasó el 51% del total de casos con seroagrupación. En el año actual, a la semana epidemiológica 38, el 49,1% de ellos (26 casos) pertenece al serogrupo B, 41,5% (22 casos) al serogrupo W, 5,7% (3 casos) al serogrupo C y 3,8% (2 casos) al serogrupo Y42.
Entre los factores de riesgo para EM destaca tener un sistema inmune inmaduro (menores de 1 año) o alterado (pacientes asplénicos funcionales o quirúrgicos, pacientes con déficit de factores del complemento, infección por VIH) que favorecen un curso fatal de la enfermedad43.
Actualmente se dispone en nuestro país de vacunas tetravalentes Nmen ACWY conjugada con toxoide tetánico (ACWY-TT Nimenrix®) y conjugada con proteína CRM197 (Menveo®); y de la vacuna multicomponente contra Nmen B (4CmenB Bexsero®) para su uso desde los 2 meses de vida. La vacuna ACWY-TT está incorporada en el PNI con una dosis a los 12 meses.
b. Inmunogenicidad y seguridadLa vacuna ACWY-TT posee una adecuada inmunogenicidad y perfil de seguridad, con valores entre 97 a 100% de seroconversión/serorespuesta para los distintos serogrupos. No se han observado casos de EM en pacientes vacunados. Existen escasos datos en RNPT, la mayoría de ellos realizados con vacuna monovalente Nmen C incorporada en el PNI de distintos países en el lactante, que indican una adecuada eficacia y perfil de seguridad44.
Los estudios realizados en lactantes con vacuna Nmen B mostraron una efectividad del 83% frente a cualquier cepa y del 94,6% frente a las cepas de Nmen B cubiertas por la vacuna, con una reducción del 50% de casos en la población objetivo17. Se caracteriza por ser reactogénica en lactantes, destacando dolor local, irritabilidad y fiebre45.
Recientemente el Reino Unido realizó un estudio donde se evaluó la seguridad de la vacuna 4CmenB en RNPT (menores de 35 semanas de EG) hospitalizados en Unidades Neonatales, no observando un aumento significativo en la frecuencia de eventos cardiorrespiratorios como apneas, desaturación o bradicardia en este grupo. Se describió con mayor frecuencia fiebre e irritabilidad por lo que se recomienda el uso asociado de paracetamol45.
c. Recomendaciones- •
Según la epidemiología nacional, con mayor concentración de casos en el menor de 1 año, se recomienda vacunar con vacuna Nmen ACWY y Nmen B desde los 2 meses de vida.
- •
A los RNPT con patologías de base (cardíaca, renal, respiratoria y/o digestiva) se puede solicitar vacuna Nmen ACWY a través de solicitud especial al MINSAL46.
La infección por rotavirus (RTV) es la principal causa de diarrea infantil grave en todo el mundo y un problema relevante de salud pública en los países desarrollados. Los RNPT constituyen una población vulnerable tanto en términos de riesgo de infección como gravedad de presentación de la enfermedad. Los RNPT, entre otros factores, han tenido una menor transferencia materna de anticuerpos y habitualmente la tasa de lactancia materna en ellos es menor que en los RNT. A su vez, tienen un mayor riesgo de enfermedad grave por RTV, incluso varios meses después del nacimiento, en comparación con los RNT y los RN con peso normal al nacer. La deshidratación grave, las deposiciones con sangre y la enterocolitis necrosante son más comunes en los prematuros que en los RNT47.
b. Eficacia y seguridad vacuna RTV en RNExisten dos vacunas frente al RTV disponibles: la vacuna pentavalente bovina-humana reordenada y la monovalente humana atenuada, ambas vacunas muestran una eficacia similar en términos de prevención de diarreas graves48.
Omeñaca y cols. evaluó la inmunogenicidad con 1009 prematuros que recibieron la vacuna monovalente frente al RTV o placebo, con dos dosis, siguiendo las mismas recomendaciones que para los RNT33. La tasa de seroconversión de anticuerpos IgA anti-RTV tras la segunda dosis fue del 86% globalmente en el grupo vacunado (76% con EG de 27-30 semanas y 88% entre 31 a 36 semanas de gestación) frente al 16% en el grupo placebo. Los eventos adversos observados fueron similares en ambos grupos (5% vacunados vs. 7% placebo). En otro estudio se comparó la vacuna pentavalente de RTV con placebo, administrándose tres dosis a un total de 2.070 RNPT entre 25 a 36 semanas de EG49. La eficacia en reducción del número de hospitalizaciones frente a placebo fue del 100% (IC 95%: 59-100), y del 92% (IC 95%: 57-100) respecto a la reducción de las visitas a urgencias. Los eventos adversos fueron similares en los dos grupos. En ninguno de los dos ensayos clínicos se comunicaron casos de invaginación intestinal.
La evidencia disponible indica que la vacunación frente a RTV en RNPT es bien tolerada y segura, con una eficacia similar a la de los RNT. La transmisión horizontal del virus vacunal es posible, si bien no ha sido documentada en unidades de hospitalización48,49. Los RNPT <1500 grs habitualmente se encuentran hospitalizados a la edad de vacunación por RTV por lo que se recomienda vacunar igual si su condición clínica lo permite, sin retrasos. Se contraindica la vacunación por RTV cuando los lactantes han presentado una reacción alérgica grave (anafilaxia) a la dosis previa, antecedente de alergia al látex (vacuna monovalente), diagnóstico de inmunodeficiencia combinada severa o aquellas inmunodeficiencias humorales con requerimiento de inmunoglobulina mensual o contar con el antecedente de invaginación intestinal o patología intestinal que la predisponga. La falla intestinal adquirida (intestino corto) no contraindica la administración de vacuna de RTV, por otra parte, se sugiere vacunar en este grupo50.
c. Recomendación- •
Se recomienda que todos los RN menores de 32 semanas de edad gestacional al nacer, siempre que su condición clínica lo permita y no exista contraindicación, reciban la vacunación frente RTV sin retrasos, incluyendo su administración mientras estén hospitalizados.
- •
No esperar hasta después del alta ya que puede sobrepasar el límite de edad para recibir la última dosis de la vacuna y se reduzca la cobertura de vacunación en esta población.
- •
Al vacunar al paciente hospitalizado, tomar las siguientes precauciones para evitar la transmisión horizontal: higiene de manos antes y después de la manipulación del paciente, precauciones de contacto y adecuado desecho de pañales48.
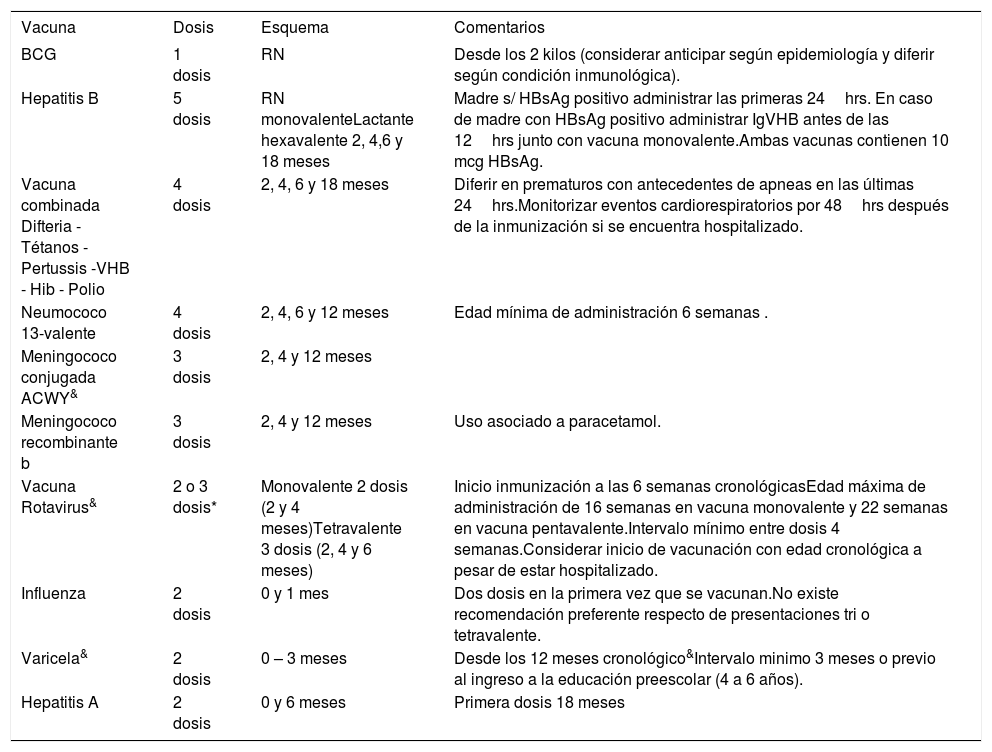
En la tabla 1 se muestran todas las vacunas con sus esquemas de administración en el recien nacido y el recién nacido prematuro disponibles en Chile.
Vacunas y esquemas de administración en el RN prematuro disponibles en Chile
| Vacuna | Dosis | Esquema | Comentarios |
|---|---|---|---|
| BCG | 1 dosis | RN | Desde los 2 kilos (considerar anticipar según epidemiología y diferir según condición inmunológica). |
| Hepatitis B | 5 dosis | RN monovalenteLactante hexavalente 2, 4,6 y 18 meses | Madre s/ HBsAg positivo administrar las primeras 24hrs. En caso de madre con HBsAg positivo administrar IgVHB antes de las 12hrs junto con vacuna monovalente.Ambas vacunas contienen 10 mcg HBsAg. |
| Vacuna combinada Difteria -Tétanos - Pertussis -VHB - Hib - Polio | 4 dosis | 2, 4, 6 y 18 meses | Diferir en prematuros con antecedentes de apneas en las últimas 24hrs.Monitorizar eventos cardiorespiratorios por 48hrs después de la inmunización si se encuentra hospitalizado. |
| Neumococo 13-valente | 4 dosis | 2, 4, 6 y 12 meses | Edad mínima de administración 6 semanas . |
| Meningococo conjugada ACWY& | 3 dosis | 2, 4 y 12 meses | |
| Meningococo recombinante b | 3 dosis | 2, 4 y 12 meses | Uso asociado a paracetamol. |
| Vacuna Rotavirus& | 2 o 3 dosis* | Monovalente 2 dosis (2 y 4 meses)Tetravalente 3 dosis (2, 4 y 6 meses) | Inicio inmunización a las 6 semanas cronológicasEdad máxima de administración de 16 semanas en vacuna monovalente y 22 semanas en vacuna pentavalente.Intervalo mínimo entre dosis 4 semanas.Considerar inicio de vacunación con edad cronológica a pesar de estar hospitalizado. |
| Influenza | 2 dosis | 0 y 1 mes | Dos dosis en la primera vez que se vacunan.No existe recomendación preferente respecto de presentaciones tri o tetravalente. |
| Varicela& | 2 dosis | 0 – 3 meses | Desde los 12 meses cronológico&Intervalo minimo 3 meses o previo al ingreso a la educación preescolar (4 a 6 años). |
| Hepatitis A | 2 dosis | 0 y 6 meses | Primera dosis 18 meses |
&RNPT con patología cardíaca, renal, respiratoria y digestiva (Solicitud vacuna especial MINSAL) (47).
El RNPT y de bajo peso de nacimiento debe ser vacunado según el esquema habitual de acuerdo a la edad cronológica. No hay evidencias científicas que avalen retrasar el esquema de vacunación en estos niños por razones de seguridad o insuficiente inmunogenicidad. Los pediatras y el personal de salud deben fomentar la vacunación. La protección indirecta del RNPT a través de vacunas del PNI y la vacunación activa a sus madres durante el embarazo y a sus contactos cercanos, son una manera de proteger a este grupo altamente susceptible de infección.
Declaración de conflicto de interésLas autoras declaran no tener conflictos de interés con respecto a este artículo.