el cáncer de mama triple negativo (TNBC) tiene un pronóstico pobre. La cirugía, la radioterapia y la quimioterapia son las únicas opciones de tratamiento dado que no tiene tratamientos diana. La modulación del receptor de andrógeno (AR) en el TNBC ha demostrado que puede inhibir el desarrollo celular y aumentar la apoptosis in vivo e in vitro. Parece que la pérdida de expresión de E-cadherina y GATA3 en el TNBC puede estar relacionada con un comportamiento más agresivo.
Objetivoevaluar si la expresión de AR en el TNBC se asocia a un pronóstico más favorable.
Material y Métodoses un estudio descriptivo retrospectivo de una cohorte de 163 pacientes con TNBC tratados desde 2003 hasta 2017. Se realiza determinación inmunohistoquímica de AR, E-cadherina y GATA3 en los especímenes quirúrgicos. El estudio estadístico se lleva a cabo con el SPSS versión 25.
Resultadoslos TNBC AR positivos son tumores más diferenciados y menos proliferativos que los AR negativos (p < 0,05) aunque esto no se asocia a una mejor supervivencia global o libre de enfermedad. No se observa una peor supervivencia relacionada con la pérdida de expresión de GATA3 y E-cadherina.
Conclusionesno se observan diferencias en la supervivencia del TNBC relacionadas con la expresión de AR. Pueden ser opciones de tratamiento en el TNBC la utilización combinada de moduladores selectivos de los receptores de andrógenos y otros fármacos como los pi3K inhibidores o inmunomoduladores, por las frecuentes mutaciones pi3K de TNBC que expresan AR y por la utilidad de la inmunoterapia en el TNBC.
Triple Negative Breast Cancer (TNBC) has dreadful prognosis. Surgery, radiotherapy and chemotherapy are the only effective therapies, since it has no target treatments. In TNBC, AR modulation has been demonstrated to inhibit cell development and increase apoptosis in vitro and in vivo.
ObjectiveTo assess whether AR in TNBC is associated with a better prognosis.
Material and methodsThis study is a retrospective description of a cohort of 163 TNBC patients, who underwent treatment from 2003 to 2017. Immunohistochemical determinations were examined in the surgical specimen for AR, E-cadherina and GATA3.
ResultsAR positive TNBC are more differentiated and less proliferative tumors than AR negative (p < 0.05). However, this fact has not been significantly associated with better overall survival nor disease free survival. Loss of expression of GATA3 and E-cadherina has not been related to worse overall survival in our paper.
ConclusionsAlthough no difference in TNBC survival related to AR expression has been observed, determination of AR may be useful in TNBC due to possibility of modulating AR as a target therapy. Future treatment options in TNBC may be the combined use of selective androgen receptor and other drugs such as Pi3K inhibitors or immunomodulators, due to the frequent pi3K mutations of AR positive TNBC and the usefulness of immunotherapy in TNBC.
El cáncer de mama triple negativo se asocia a un mal pronóstico1. La falta de tratamientos específicos y el comportamiento agresivo del tumor se asocia a recaídas frecuentes los 3 primeros años tras el diagnóstico2,3. El receptor de andrógeno (AR) es uno de los marcadores más controvertidos en el cáncer de mama. Aunque el cáncer de mama triple negativo (TNBC) expresa menos AR que otros cánceres, la presencia del AR permite la manipulación de la vía androgénica como opción terapéutica4. El AR ha resurgido en el cáncer de mama debido al desarrollo de nuevos agentes antirreceptores de andrógeno para el cáncer de próstata4 y varios estudios han mostrado que el AR puede ser un factor pronóstico predictivo en el cáncer de mama5. La asociación frecuente de TNBC AR positivo con mutaciones pi3K, puede permitir una terapia combinada con moduladores del AR e inhibidores pi3K/mTOR6.
Lehmann et al. obtuvieron una clasificación del TNBC basada en perfiles de expresión génica. Así se clasificaron como basal similar (BL1 y BL2), mesenquimal, mesenquimal similar a células madre, inmunomodulador, inestable, inclasificable y receptor de andrógeno luminal (LAR). El LAR expresa 9 veces más AR que otros TNBC7, por eso las líneas celulares tipo LAR se han utilizado como modelo para la modulación del AR en TNBC, además algunos datos preclínicos apoyan la utilización de moduladores del receptor de andrógeno en el subtipo LAR de TNBC8.
El antagonista del AR bicalutamida se ha utilizado en el cáncer de mama metastásico que expresa AR, con una razón de beneficio clínico del 19%9. El AR parece crucial en la transformación epitelial mesenquimal (EMT) que precede a las metástasis, por lo que los moduladores selectivos de los receptores de andrógenos (SARM) pueden ser un tratamiento en el cáncer de mama AR positivo10.
GATA3 y E-cadherina han sido también marcadores estudiados en el TNBC11. La pérdida de expresión de GATA3 y E-cadherina se ha asociado a un mal pronóstico en el TNBC11,12.
El tratamiento neoadyuvante en el TNBC se asocia a un 30% de respuesta patológica completa (pCR) y la enfermedad residual se relaciona con riesgo de recurrencia2,12. La elevada expresión de AR y GATA3 en el TNBC se relaciona con tumores quimiorresistentes que no recaen13.
Material y métodoSe trata de un estudio descriptivo retrospectivo de una cohorte de 163 pacientes con TNBC intervenidas en el Complejo Asistencial Universitario de Salamanca (CAUSA) desde junio de 2003 hasta diciembre de 2017. El estudio se realizó tras la aprobación del Comité de Ética e Investigación con el Medicamento (CEIM) de nuestro centro.
La media de seguimiento fue de 49,8 meses y la mediana de 44 meses.
Se analizaron los siguientes parámetros: edad del paciente, tipo de cirugía, fecha de intervención quirúrgica, tamaño tumoral, grado histológico, tipo histológico, afectación ganglionar, metástasis, estadio, invasión linfovascular, necrosis, ki67 (MIBI), terapia adyuvante, neoadyuvancia, recidiva local, recidiva a distancia, supervivencia libre de enfermedad y supervivencia global.
Las pacientes tratadas con quimioterapia neoadyuvante fueron aquellas que tenían un tumor mayor de 2 cm o cualquier T con afectación ganglionar. Los regímenes de quimioterapia utilizados en neoadyuvancia fueron antraciclinas y taxanos, a los que se asociaron derivados del platino los últimos 4 años. En adyuvancia también se utilizaron antraciclinas y taxanos. La capecitabina se utilizó solo en las neoadyuvancias sin respuesta completa.
Se realizó un estudio inmunohistoquímico (IHQ) de AR, GATA3 y E-cadherina con el kit de revelado BOND en 163 muestras almacenadas y conservadas en parafina de especímenes quirúrgicos. Se utilizaron el anticuerpo primario monoclonal anti-E-cadherina (clon: EP700Y) Master Diagnóstica, anticuerpo primario monoclonal de ratón anti-GATA3 (clon: L50–823) y anticuerpo monoclonal antirreceptor de andrógeno (clon: AR 44). Solo en los casos en los que hubo pCR se recurrió a las muestras de biopsia con aguja gruesa diagnósticas para hacer la determinación inmunohistoquímica.
Se consideraron AR positivos aquellos tumores con más del 10% de los núcleos teñidos, GATA3 positivos los que tenían más de un 30% de los núcleos teñidos14 y la E-cadherina se consideró positiva cuando se colorearon más del 30% de las membranas celulares11. El estudio inmunohistoquímico fue realizado por un patólogo experto en mama.
Estudio estadísticoSe utilizó la versión 25 del SPSS para el estudio estadístico. Las pruebas de chi cuadrado y el test exacto de Fisher se utilizaron para estudiar la relación entre la expresión de AR y el resto de las variables, así como para ver para ver si la expresión de AR en quimorresistentes se relacionaba con mayor riesgo de recaída local, a distancia o ambas. La t de Student se utilizó para ver si había diferencia en el tiempo a la recaída en los quimiorresistentes según expresaran AR. Las curvas de Kaplan Meier se utilizaron para el estudio de supervivencia y la regresión logística de Cox se para identificar las variables a partir de las que se puede predecir supervivencia.
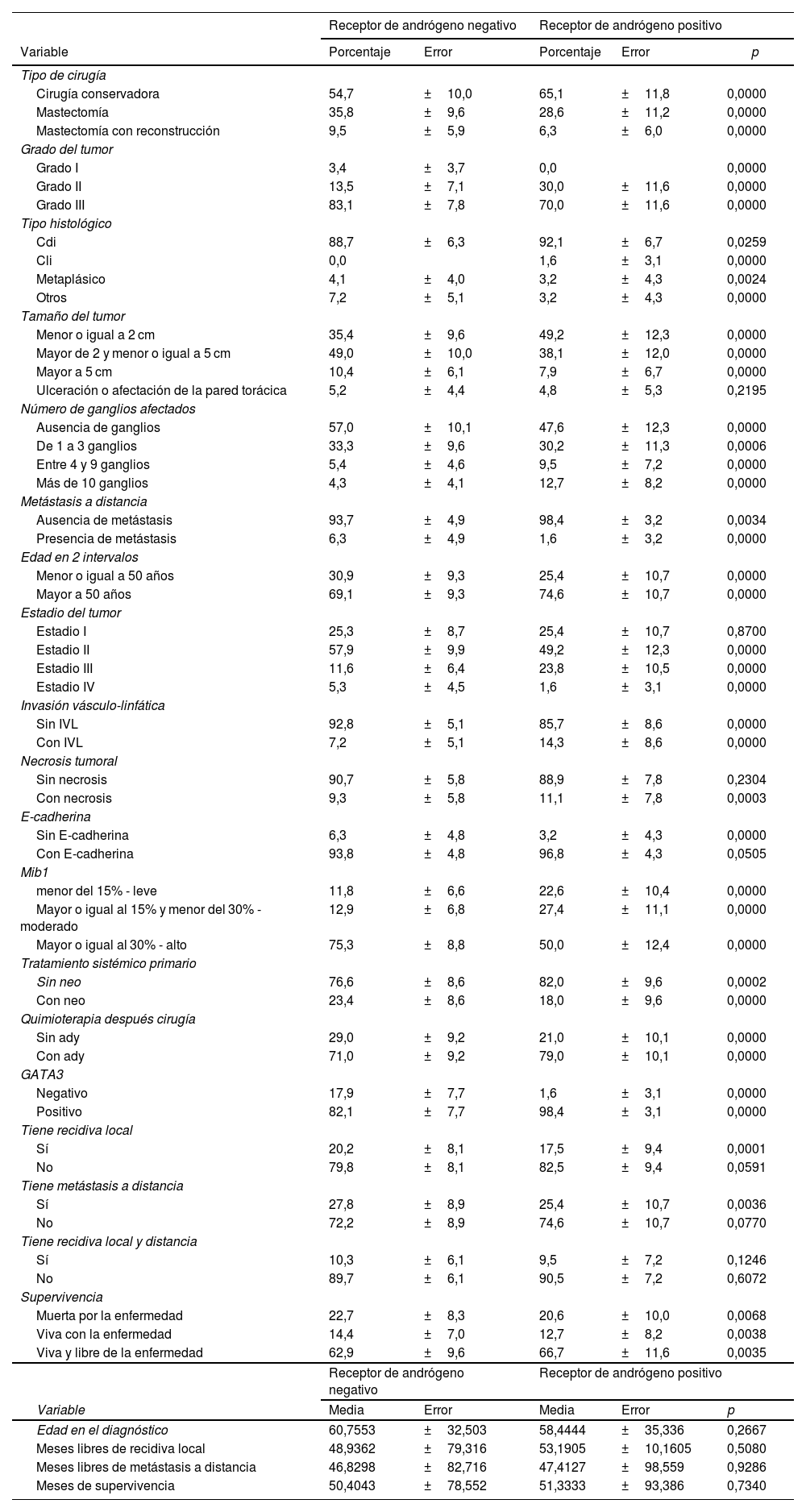
ResultadosEn la tabla 1 se muestra las características de las series completas de TNBC AR positivos y AR negativos. Tras analizar la relación entre la expresión del AR y las variables clínico-patológicas de la tabla 1, solo el grado de diferenciación (fig. 1), el índice de proliferación (Ki67/MIB1) (fig. 2) y la expresión de GATA3 fueron estadísticamente significativos (p < 0,05). Había más tumores de grado 2 entre los tumores AR positivos que, entre los negativos y la mayoría de los tumores AR negativos eran de grado 3. La relación entre la expresión de AR y el ki67/MIB1 fue también significativa, dado que el 75% de los tumores AR negativos presentaban ki67 mayor del 30%, mientras que los AR positivos no eran tan proliferativos. El 98% de los tumores AR positivos fueron GATA3.
Aspectos clínico-patológicos de la cohorte de pacientes (n = 163)
| Receptor de andrógeno negativo | Receptor de andrógeno positivo | ||||
|---|---|---|---|---|---|
| Variable | Porcentaje | Error | Porcentaje | Error | p |
| Tipo de cirugía | |||||
| Cirugía conservadora | 54,7 | ±10,0 | 65,1 | ±11,8 | 0,0000 |
| Mastectomía | 35,8 | ±9,6 | 28,6 | ±11,2 | 0,0000 |
| Mastectomía con reconstrucción | 9,5 | ±5,9 | 6,3 | ±6,0 | 0,0000 |
| Grado del tumor | |||||
| Grado I | 3,4 | ±3,7 | 0,0 | 0,0000 | |
| Grado II | 13,5 | ±7,1 | 30,0 | ±11,6 | 0,0000 |
| Grado III | 83,1 | ±7,8 | 70,0 | ±11,6 | 0,0000 |
| Tipo histológico | |||||
| Cdi | 88,7 | ±6,3 | 92,1 | ±6,7 | 0,0259 |
| Cli | 0,0 | 1,6 | ±3,1 | 0,0000 | |
| Metaplásico | 4,1 | ±4,0 | 3,2 | ±4,3 | 0,0024 |
| Otros | 7,2 | ±5,1 | 3,2 | ±4,3 | 0,0000 |
| Tamaño del tumor | |||||
| Menor o igual a 2 cm | 35,4 | ±9,6 | 49,2 | ±12,3 | 0,0000 |
| Mayor de 2 y menor o igual a 5 cm | 49,0 | ±10,0 | 38,1 | ±12,0 | 0,0000 |
| Mayor a 5 cm | 10,4 | ±6,1 | 7,9 | ±6,7 | 0,0000 |
| Ulceración o afectación de la pared torácica | 5,2 | ±4,4 | 4,8 | ±5,3 | 0,2195 |
| Número de ganglios afectados | |||||
| Ausencia de ganglios | 57,0 | ±10,1 | 47,6 | ±12,3 | 0,0000 |
| De 1 a 3 ganglios | 33,3 | ±9,6 | 30,2 | ±11,3 | 0,0006 |
| Entre 4 y 9 ganglios | 5,4 | ±4,6 | 9,5 | ±7,2 | 0,0000 |
| Más de 10 ganglios | 4,3 | ±4,1 | 12,7 | ±8,2 | 0,0000 |
| Metástasis a distancia | |||||
| Ausencia de metástasis | 93,7 | ±4,9 | 98,4 | ±3,2 | 0,0034 |
| Presencia de metástasis | 6,3 | ±4,9 | 1,6 | ±3,2 | 0,0000 |
| Edad en 2 intervalos | |||||
| Menor o igual a 50 años | 30,9 | ±9,3 | 25,4 | ±10,7 | 0,0000 |
| Mayor a 50 años | 69,1 | ±9,3 | 74,6 | ±10,7 | 0,0000 |
| Estadio del tumor | |||||
| Estadio I | 25,3 | ±8,7 | 25,4 | ±10,7 | 0,8700 |
| Estadio II | 57,9 | ±9,9 | 49,2 | ±12,3 | 0,0000 |
| Estadio III | 11,6 | ±6,4 | 23,8 | ±10,5 | 0,0000 |
| Estadio IV | 5,3 | ±4,5 | 1,6 | ±3,1 | 0,0000 |
| Invasión vásculo-linfática | |||||
| Sin IVL | 92,8 | ±5,1 | 85,7 | ±8,6 | 0,0000 |
| Con IVL | 7,2 | ±5,1 | 14,3 | ±8,6 | 0,0000 |
| Necrosis tumoral | |||||
| Sin necrosis | 90,7 | ±5,8 | 88,9 | ±7,8 | 0,2304 |
| Con necrosis | 9,3 | ±5,8 | 11,1 | ±7,8 | 0,0003 |
| E-cadherina | |||||
| Sin E-cadherina | 6,3 | ±4,8 | 3,2 | ±4,3 | 0,0000 |
| Con E-cadherina | 93,8 | ±4,8 | 96,8 | ±4,3 | 0,0505 |
| Mib1 | |||||
| menor del 15% - leve | 11,8 | ±6,6 | 22,6 | ±10,4 | 0,0000 |
| Mayor o igual al 15% y menor del 30% -moderado | 12,9 | ±6,8 | 27,4 | ±11,1 | 0,0000 |
| Mayor o igual al 30% - alto | 75,3 | ±8,8 | 50,0 | ±12,4 | 0,0000 |
| Tratamiento sistémico primario | |||||
| Sin neo | 76,6 | ±8,6 | 82,0 | ±9,6 | 0,0002 |
| Con neo | 23,4 | ±8,6 | 18,0 | ±9,6 | 0,0000 |
| Quimioterapia después cirugía | |||||
| Sin ady | 29,0 | ±9,2 | 21,0 | ±10,1 | 0,0000 |
| Con ady | 71,0 | ±9,2 | 79,0 | ±10,1 | 0,0000 |
| GATA3 | |||||
| Negativo | 17,9 | ±7,7 | 1,6 | ±3,1 | 0,0000 |
| Positivo | 82,1 | ±7,7 | 98,4 | ±3,1 | 0,0000 |
| Tiene recidiva local | |||||
| Sí | 20,2 | ±8,1 | 17,5 | ±9,4 | 0,0001 |
| No | 79,8 | ±8,1 | 82,5 | ±9,4 | 0,0591 |
| Tiene metástasis a distancia | |||||
| Sí | 27,8 | ±8,9 | 25,4 | ±10,7 | 0,0036 |
| No | 72,2 | ±8,9 | 74,6 | ±10,7 | 0,0770 |
| Tiene recidiva local y distancia | |||||
| Sí | 10,3 | ±6,1 | 9,5 | ±7,2 | 0,1246 |
| No | 89,7 | ±6,1 | 90,5 | ±7,2 | 0,6072 |
| Supervivencia | |||||
| Muerta por la enfermedad | 22,7 | ±8,3 | 20,6 | ±10,0 | 0,0068 |
| Viva con la enfermedad | 14,4 | ±7,0 | 12,7 | ±8,2 | 0,0038 |
| Viva y libre de la enfermedad | 62,9 | ±9,6 | 66,7 | ±11,6 | 0,0035 |
| Receptor de andrógeno negativo | Receptor de andrógeno positivo | ||||
| Variable | Media | Error | Media | Error | p |
| Edad en el diagnóstico | 60,7553 | ±32,503 | 58,4444 | ±35,336 | 0,2667 |
| Meses libres de recidiva local | 48,9362 | ±79,316 | 53,1905 | ±10,1605 | 0,5080 |
| Meses libres de metástasis a distancia | 46,8298 | ±82,716 | 47,4127 | ±98,559 | 0,9286 |
| Meses de supervivencia | 50,4043 | ±78,552 | 51,3333 | ±93,386 | 0,7340 |
Ady: Adyuvancia; IVL: invasión vásculo-linfática.
La edad de las pacientes (considerando menores y mayores de 50 años) y el Ki67/MIB1 fueron significativos respecto al estado AR. Todas las pacientes AR positivo con Ki67 < 15% tenían más de 50 años.
Todos los TNBC apocrinos (tipo LAR) de nuestra serie eran AR positivos y poco o moderadamente proliferativos.
No se observó mayor riesgo de desarrollo de metástasis relacionado con la pérdida de la expresión de E-cadherina ni con la pérdida de expresión de GATA3.
Solo 5 pacientes de los 33 que recibieron neoadyuvancia obtuvieron pCR y 4 de ellos fueron AR negativos, aunque esto no fue estadísticamente significativo. Entre los pacientes quimorresistentes, no hubo diferencias en porcentajes de recidivas locales, a distancia o ambas ni en tiempo a la recidiva según fueran AR positivos o negativos.
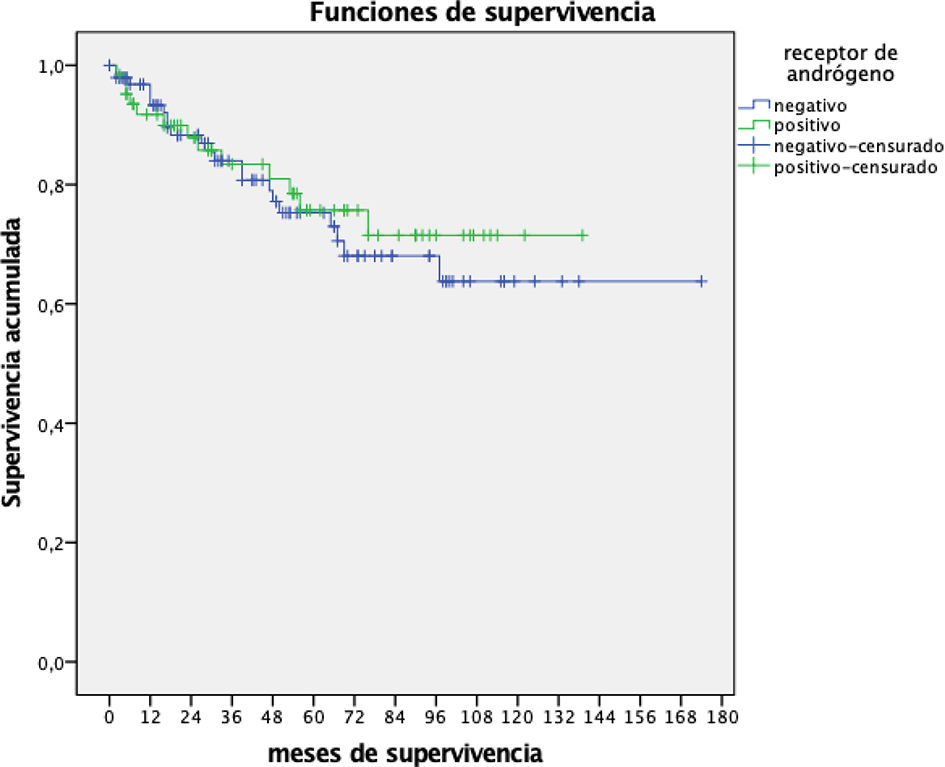
En los análisis de supervivencia (curvas de Kaplan-Meier, figs. 3 y 4), no se observaron diferencias estadísticamente significativas entre pacientes AR positivos y AR negativos, tanto en supervivencia global como libre de enfermedad.
Realizado el análisis multivariante de regresión de Cox, las únicas variables significativas a partir de las que se pudo predecir supervivencia fueron el grado, el tamaño tumoral y la invasión vásculo linfática. Estratificado por expresión de AR, la predicción de supervivencia es ligeramente mejor en AR negativos (fig. 5).
DiscusiónLa terapia antirreceptor de andrógeno puede ser un tratamiento para los TNBC AR positivos15 aunque la identificación de los pacientes TNBC AR positivos que se benefician de este tratamiento es difícil5.
La prevalencia de la expresión inmunohistoquímica de AR en nuestra serie fue del 39,4%, en la literatura oscila entre el 15 y el 60% y no se han encontrado diferencias de supervivencia utilizando diferentes puntos de corte para definir la positividad de AR (mayor del 1% o mayor del 10% de los núcleos teñidos)16.
Numerosos estudios indican mejor pronóstico en cánceres de mama que expresan altos niveles de AR10,16,17, sin embargo, en nuestro estudio no se han encontrado diferencias de supervivencia global ni libre de enfermedad entre TNBC AR positivos y AR negativos.
Los TNBC AR positivos, como se ha visto en otras series (incluyendo la nuestra), son tumores más diferenciados y menos proliferativos que los TNBC que no expresan AR, esto puede estar relacionado con una mayor quimiorresistencia. En nuestro estudio solo 5 pacientes de los 33 que recibieron neoadyuvancia obtuvieron pCR (en otras series hasta el 30% alcanza pCR) y 4 de ellos fueron AR negativos, aunque esto no fue estadísticamente significativo. En algunos trabajos no se han observado diferencias en los porcentajes de pCR dependiendo de la expresión de AR, pero el subtipo LAR de la clasificación de Lehmann que expresa gran cantidad de AR, es el más quimiorresistente18,19.
En el subtipo LAR es frecuente un ki 67 bajo. En nuestra serie todos los TNBC tipo LAR tenían un ki67 moderado o bajo, eran AR positivos y el 80% eran GATA3 positivos (como en otros estudios)14. La mayoría de los TNBC LAR se han clasificado como tumores luminales por expresión de genes7,20 y en las líneas celulares tipo LAR son frecuentes además las mutaciones pi3K, lo que les puede hacer sensibles a los inhibidores pi3K21.
No todos los TNBC AR positivos por IHQ son subtipo LAR por expresión génica, los TNBC AR positivos representan una enfermedad heterogénea, lo que sugiere que no todos ellos se beneficien de terapia anti-AR22.
El AR tiene reacción cruzada con otras vías de señalización; como se ha indicado anteriormente con la vía pi3K, a su vez relacionada con el gen supresor tumoral PTEN, por lo que pacientes AR positivos con mutaciones pi3K o con deficiencia PTEN pueden beneficiarse de SARM asociados a pi3K inh6,9,21,23.
También son frecuentes las mutaciones ERBB2 y ERBB3 en líneas celulares LAR, por lo que el bloqueo AR puede inhibir el crecimiento de líneas celulares ERBB2 positivas AR positivas21.
El marcador GATA3 se relaciona con pronóstico favorable en TNBC y se expresa de forma moderada o alta en el 30–40% de los TNBC24. En nuestra serie, el 88% de los TNBC fueron GATA3 positivos considerando un punto de corte del 30%. La pérdida de la expresión de GATA3 en el TNBC se ha relacionado con un fenotipo más agresivo y peor supervivencia libre de recurrencia12, sin embargo, en nuestro trabajo no se ha demostrado que la pérdida de expresión de GATA3 se relacione con peor supervivencia.
La consideración de la E-cadherina como posible factor pronóstico en el TNBC se tuvo en cuenta debido a que la E-cadherina y beta catenina son marcadores epiteliales que descienden en los procesos de EMT que preceden al desarrollo de metástasis y que, a su vez, están relacionados con el AR10. El estímulo del AR puede inducir EMT y desarrollo de metástasis10. No obstante, en nuestro estudio, no se observó que la pérdida de expresión de E-cadherina se relacionara con peor supervivencia.
El poder metastásico de los cánceres se debe a la liberación de factores paracrinos que se producen durante la interacción célula epitelial-célula mesenquimal y la modulación del AR inhibe estos factores paracrinos25.
La utilización del SARM de nueva generación enzalutamida, ha demostrado que otros subtipos de TNBC no LAR y que también expresan AR (subtipos mesenquimal, mesenquimal similar a células madre y basal similar tipo 2) son dependientes de forma crítica del AR.
El estímulo del AR aumenta la secreción de anfirregulina, ligando del receptor de factor de crecimiento epidérmico (EGFR), por eso los fármacos anti-EGFR pueden potenciar el efecto de los SARM en los TNBC AR positivos que presentan mutaciones ERBB28. Las mutaciones frecuentes de pi3K y la elevada expresión de ERBB2 en TNBC AR positivos refuerza la utilización combinada de inhibidores pi3K y SARM o SARM y anti-EGFR6,26.
También se ha utilizado la enzalutamida con el paclitaxel en neoadyuvancia para mejorar la pCR de TNBC RA positivos26.
La evidencia acumulada indica el valor pronóstico y predictivo de los linfocitos que infiltran el tumor (TIL) en cáncer de mama27. Los TIL son significativamente más elevados en el TNBC y la presencia de elevados niveles de TIL se relaciona con mejor supervivencia libre de enfermedad y con mayor tasa de pCR28. Parece que existe una menor expresión de TIL en los TNBC AR positivos tipo LAR29. La combinación de quimioterapia convencional con inmunoterapia (pembrolizumab) puede aumentar el porcentaje de respuestas pCR en TNBC27.
Los pacientes que alcanzan respuesta completa en neoadyuvancia tienen mejor pronóstico, no obstante, parece que no todos los TNBC quimiorresistentes recaen. Existe una firma pronóstica obtenida a partir de TNBC que recibieron neoadyuvanvcia y fueron quimiorresistentes, de la que se obtuvieron diferentes marcadores pronósticos13.
Los marcadores luminales GATA3 y el AR eran relativamente altos en el TNBC quimiorresistentes que no recayeron, mientras que otros marcadores de tipo basal, célula madre y EMT, correspondían a tumores quimiorresistentes con pronóstico desfavorable13.
En nuestra serie no hubo diferencias estadísticamente significativas en porcentajes de recaída local, a distancia, ni en tiempo a la recaída entre TNBC quimiorresistentes AR positivos y AR negativos.
Hay 2 entidades de TNBC quimiorresistentes: uno es el LAR, para el que un SARM puede ser más efectivo que la quimioterapia tradicional y otro los tumores tipo células madre, para los que fármacos tipo inhibidores de wnt/beta catenina pueden ser más adecuados13,30.
Otros tratamientos prometedores en la actualidad para el TNBC son los análogos de platino e iPARP (inhibidores de la poli ADP ribosa), los inhibidores de kinasas y el sacituzumab govitecan como fármaco conjugado con anticuerpo30.
ConclusionesNo se han encontrado diferencias estadísticamente significativas en supervivencia global ni libre de enfermedad entre TNBC AR positivos y negativos.
La pérdida de expresión de E-cadherina y de GATA3 no se ha relacionado con peor supervivencia.
Los TNBC AR positivos son tumores más diferenciados y menos proliferativos que los AR negativos.
La modulación del AR puede mejorar la quimiorresistencia de los TNBC AR positivos.
La determinación del AR en TNBC se puede recomendar como posible terapia diana sola o combinada con otras terapias relacionadas con la señalización de AR.
Consideraciones éticasLa investigación fue aprobada por el Comité de Ética de la Investigación con Medicamentos del Área de Salud de Salamanca. Referencia CEIC:PI9810/2017.
Consentimiento informadoLos autores confirman que cuentan con el consentimiento informado de los pacientes.
FinanciaciónNo ha habido apoyo financiero para la realización del estudio.
Conflicto de interesesLos autores declaran que no hay conflictos de intereses.