A pesar del aumento en la prevalencia del cáncer de mama, el seguimiento de estas pacientes no está totalmente estandarizado. La Sociedad Española de Senología y Patología Mamaria propuso la elaboración de un documento de consenso sobre el seguimiento que debería proponerse a las pacientes afectas de lesiones de mama in situ e infiltrantes en estadios i-iii, tratadas con intención curativa, una vez finalizados los tratamientos iniciales. En su realización han colaborado profesionales de toda España de distintas especialidades y ámbitos de actuación. Fue presentado en el Primer Congreso Español de la Mama, que se celebró en octubre de 2013 en Madrid, para su refrendo por parte de la Sociedad, y se recogieron las aportaciones de los asistentes a la sala. El objetivo principal del seguimiento es la detección precoz de recurrencias locorregionales y a distancia, de nuevos primarios, y valorar los efectos secundarios de los tratamientos aplicados. Debe también cubrir las necesidades de soporte psicológico, así como la rehabilitación y reinserción sociolaboral posterior y la educación para la salud, corrigiendo hábitos de vida no saludables. No se han descrito diferencias significativas entre el seguimiento minimalista y el intensivo, respecto al índice de recurrencia, la supervivencia global y la calidad de vida. El tipo y los años de seguimiento deberían ser distintos para cada paciente según su riesgo de recidiva y la clasificación molecular de su lesión. Este consenso ha tenido el apoyo de otras sociedades científicas relacionadas con la enfermedad mamaria, asistentes al Primer Congreso Español de la Mama.
Despite the increasing prevalence of breast cancer, there is no standardized protocol for the follow-up of breast cancer survivors. The Spanish Society of Senology and Breast Disease has supported a consensus document on the follow-up of breast cancer survivors, aimed at patients diagnosed with stage i to iii disease and with invasive and intraepithelial (in situ) lesions, and treated with curative intent, after completion of the initial treatment. Practitioners from all over Spain, with different specialities and areas of activity, participated in the drafting in the document. It was presented at the First Spanish Breast Congress (Primer Congreso Español de la Mama), which took place in October 2013, for the Society's approval. Input from the audience was considered. The main aim of follow-up is the early detection of local and distant recurrences, of new primaries, and evaluation of the adverse effects of the therapies applied. Follow-up should also include psychological support, education on healthy habits, rehabilitation, and social and work reintegration. No significant differences between minimalistic and intensive follow-up have been reported regarding recurrence, overall survival, and quality of life. The length, intervals, and intensity of follow-up should be tailored according to each patient's individual risk of relapse and molecular subtype. This consensus document has the support and endorsement of other scientific societies related to breast disease and present at the congress.
El cáncer de mama es la neoplasia más frecuente en la mujer; experimentó un incremento entre los años 1980 y 1990, que se cree atribuible a la creciente esperanza de vida, al uso del tratamiento hormonal sustitutivo y a los programas de cribado poblacional, aunque a pesar de ello las tasas de mortalidad se han reducido en un 25% en los países desarrollados. Según el último informe de GLOBOCAN, de 2012 (http://globocan.iarc.fr), se estima una disminución de la mortalidad en España del 13% entre 1990 y 2011, y una predicción de prevalencia a los 5 años del 40,8%.
El seguimiento de estas mujeres no está correctamente estandarizado y utiliza múltiples recursos sanitarios, de coste variable, pudiendo ir desde una actitud minimalista hasta un seguimiento intensivo. Puede definirse un seguimiento estándar, que constaría de historia y exploración clínica, mamografía y pruebas clínicamente indicadas por sintomatología; y otro intensivo, que incluiría, de forma rutinaria, alguna o todas las siguientes: radiografía de tórax, ecografía abdominal, analítica, marcadores tumorales, gammagrafía ósea, etc. Lo mismo ocurre con la frecuencia de los controles clínicos, que pueden ser desde trimestrales hasta anuales. Un metaanálisis1 sobre programas de seguimiento comparando el examen físico regular y la mamografía anual frente a un seguimiento intensivo no demuestra diferencia alguna en términos de diagnóstico precoz de la recidiva, supervivencia global (SG) o calidad de vida.
Ante la falta de protocolos para realizar el seguimiento aceptados de forma mayoritaria por las sociedades científicas, la Sociedad Española de Senología y Patología Mamaria se propuso la elaboración de un documento de consenso sobre el seguimiento que debe proponerse a las pacientes afectas de lesiones de mama in situ e infiltrantes en estadios i-iii, tratadas con intención curativa, una vez finalizadas las terapias locorregionales y la quimioterapia, si estaba indicada. Por lo tanto, el periodo de tratamiento hormonal o con medicación anti-HER2 quedará incluido en este periodo. Este consenso tiene el apoyo de otras sociedades científicas: Sociedad Española de Oncología Radioterápica, Grupo Español de Oncología Radioterápica de Mama, Sociedad Española de Ginecología y Obstetricia, Sección de Mama de la Asociación Española de Cirujanos y de la Sociedad Española de Médicos de Atención Primaria.
Para aumentar la operatividad se establecieron 4 preguntas básicas:
- 1.
¿Cuál es el motivo de hacer seguimiento?
- 2.
¿Se debe seguir a todas las pacientes de la misma forma?
- 3.
¿Cómo y quién debe realizar el seguimiento?
- 4.
¿Qué necesidades tiene el médico de asistencia primaria para asumir el seguimiento?
Los participantes fueron distribuidos en grupos para responder a las 4 preguntas (ver anexo 1). Se nombró un coordinador por grupo, encargado de moderar las discusiones virtuales, y se redactaron los 4 documentos borradores; posteriormente se unificaron en uno, que se consensuó con todos los participantes. Este documento fue presentado en el Primer Congreso Español de la Mama, que se celebró en octubre de 2013 en Madrid, para su refrendo por parte de la sociedad, y el documento definitivo, recogiendo las aportaciones de la sala, es el que se expone a continuación.
¿Cuál es el motivo de hacer el seguimiento?El objetivo principal del seguimiento es la detección precoz de enfermedad potencialmente curable, como recaídas locales y nuevos tumores primarios homolaterales o contralaterales. El seguimiento debe cubrir todas las necesidades derivadas de los riesgos relacionados con los tratamientos aplicados y soporte psicológico, así como la rehabilitación y reinserción sociolaboral posterior y la educación para la salud.
La incidencia de recidiva local es relativamente baja. No existen estudios aleatorizados respecto al impacto de la detección precoz de recidiva local en la supervivencia, pero estudios observacionales sobre vigilancia con mamografía después del tratamiento2 y un estudio caso-control3, realizados en mujeres mayores de 65 años al diagnóstico, evidencian que esta mejora la SG. Tres revisiones sistemáticas4–6 de estudios observacionales no han demostrado que el seguimiento periódico con mamografías aumente la supervivencia de las pacientes con cáncer de mama. Con respecto a la recidiva a distancia, existen estudios retrospectivos que muestran que en el estadio iv la resección del tumor mamario y/o de las metástasis, cuando son pocas y localizadas, podría aumentar la supervivencia libre de progresión, aunque esta situación no parece justificar un seguimiento exhaustivo, ya que no se observa un aumento de la SG7,8. Es importante valorar los efectos secundarios de cualquiera de los tratamientos aplicados para optimizar la calidad de vida de la paciente, y replantear o individualizar sus protocolos de tratamiento. Las revisiones basadas en historia, exploración clínica y mamografía, en ausencia de sintomatología acompañante, parecen ser suficientes para el control de las pacientes.
El seguimiento es considerado por las pacientes como un aspecto muy importante en el devenir de su enfermedad, siendo el miedo a la recaída la principal demanda de soporte psicológico. En un estudio9 en que se preguntaba a pacientes, oncólogos y médicos de atención primaria (AP) sobre sus expectativas en cuanto al seguimiento de las pacientes diagnosticadas de cáncer de mama, existía una franca discrepancia entre los grupos, por tanto, es necesario establecer unas pautas sobre cuáles son las necesidades, y cuáles sus posibles soluciones.
En la educación en materia de salud global, para corregir hábitos de vida no saludables debe colaborar todo el equipo multidisciplinar desde el mismo momento del diagnóstico inicial. Existen estudios10 que demuestran un beneficio en la supervivencia en las pacientes que realizan ejercicio físico; otros11 evidencian lo mismo con la pérdida de peso, pero la ingesta de alcohol se ha relacionado en varios estudios12,13 con una menor supervivencia.
La asunción de las responsabilidades del seguimiento por parte del equipo multidisciplinar que incluye médicos del hospital y de AP, y en algunos aspectos por Enfermería, es deseable y debe servir para evitar duplicidades de visitas y exploraciones, que incomodan a la paciente y encarecen el proceso.
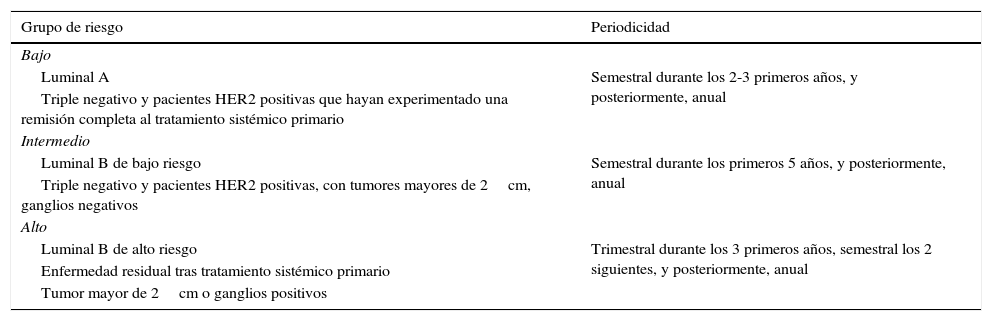
¿Se debe seguir a todas las pacientes de la misma forma?Actualmente se realiza el mismo tipo de seguimiento a todas las mujeres, independientemente del estadio de la enfermedad o del tratamiento recibido, por lo que es posible que sea excesivo en algunos casos y escaso en otros. Es importante observar que en un momento en que se intenta individualizar el proceso de diagnóstico y tratamiento, no exista también una individualización en el seguimiento. No hay evidencia que avale seguir a todas las pacientes de cáncer de mama de forma reglada, si bien la frecuencia del seguimiento se debe ajustar a las necesidades individuales de cada paciente14. Para intentar individualizar el seguimiento podemos clasificar a las pacientes según el riesgo de recaída, el subtipo molecular, y otras situaciones propias de cada individuo. Esta clasificación afectará fundamentalmente a la frecuencia del seguimiento durante los primeros años, como muestra a modo de resumen la tabla 1.
Personalización del seguimiento clínico
| Grupo de riesgo | Periodicidad |
|---|---|
| Bajo | |
| Luminal A | Semestral durante los 2-3 primeros años, y posteriormente, anual |
| Triple negativo y pacientes HER2 positivas que hayan experimentado una remisión completa al tratamiento sistémico primario | |
| Intermedio | |
| Luminal B de bajo riesgo | Semestral durante los primeros 5 años, y posteriormente, anual |
| Triple negativo y pacientes HER2 positivas, con tumores mayores de 2cm, ganglios negativos | |
| Alto | |
| Luminal B de alto riesgo | Trimestral durante los 3 primeros años, semestral los 2 siguientes, y posteriormente, anual |
| Enfermedad residual tras tratamiento sistémico primario | |
| Tumor mayor de 2cm o ganglios positivos | |
Las guías de práctica clínica no recomiendan un seguimiento específico en función de factores de riesgo de recidiva, ya que no hay evidencia de su repercusión en la supervivencia. La revisión Cochrane concluye que el seguimiento con exploración física y mamografía anual es tan eficaz como los controles más intensivos en la detección de recidiva, la SG y la calidad de vida. Sin embargo, hay evidencia de que la edad inferior a 40 años implica un peor pronóstico. En estos casos podría estar justificado un protocolo de seguimiento específico, con una periodicidad de las revisiones cada 3-4 meses durante los 2-3 primeros años, cada 6 meses hasta el quinto año y, posteriormente, anual; debería considerarse ecografía/resonancia magnética complementarias si se trata de una mama de alto riesgo (densidad mamográfica alta, antecedentes de irradiación de pared torácica en preadolescencia, etc.).
Otro grupo de alto riesgo sería el de las pacientes con mutaciones BRCA que desarrollan un primer cáncer de mama y no optan por una mastectomía bilateral; a estas debería aplicárseles el protocolo de seguimiento intensivo anteriormente descrito.
Teniendo en cuenta las necesidades individuales de las pacientes, el impacto psicológico y social, el efecto de las terapias hormonales, el linfedema, etc., se realizarán otras evaluaciones adicionales. La American Society of Clinical Oncology15 además incide en la autoexploración de las mamas y en la educación de las pacientes en reconocer síntomas de recurrencia.
Las diferentes sociedades recomiendan un primer control mamográfico tras cirugía conservadora no antes de los 6 meses posteriores a la radioterapia, siendo lo más recomendable al año. El tiempo medio de seguimiento en las unidades de Patología Mamaria recomendado por las guías clínicas es de 5 años, con seguimientos posteriores por AP y, en algunos casos (Reino Unido), vuelta de nuevo al programa de cribado poblacional con mamografías cada 2 años.
Según la clasificación molecular. Nivel de evidencia: iib/iiiLa nueva clasificación molecular del cáncer invasivo de mama determina un cambio en el manejo y seguimiento de las pacientes con cáncer de mama16–23. Las pacientes con un mayor riesgo de recaída, especialmente con cánceres triple negativo, podrían beneficiarse de un seguimiento más intensivo que incluiría la resonancia magnética durante los primeros 5 años, que ya ha demostrado un valor predictivo positivo mayor en este subtipo tumoral.
Las pacientes con tumores luminales A muestran el perfil más favorable24–27, por lo que podría plantearse un seguimiento anual a partir del segundo año. El mal pronóstico del subtipo HER2 positivo se ha visto modificado sustancialmente en los últimos años por la aplicación, en adyuvancia y en neoadyuvancia, de trastuzumab. Las mujeres que alcanzan respuestas ypT0N0/ypTisN0 se consideran curadas si trascurridos 3 años no ha habido recaída de la enfermedad28,29. Los tumores luminales B son un grupo heterogéneo, con comportamientos biológicos y presentación clinicorradiológica diferentes; es el más desconocido y, por ello, hacer recomendaciones es difícil, por lo que sería útil aplicar los criterios clínicos (edad, TNM, densidad mamográfica, presencia de carcinoma in situ, invasión linfovascular marcada, etc.) para catalogar los casos en riesgo bajo/medio/alto y aplicar el seguimiento que proceda.
Otras situacionesPacientes incluidas en ensayos clínicos: el seguimiento viene establecido y usualmente se prolonga a 10-15 años. Debe realizarse en las unidades de Patología Mamaria.
Las pacientes tratadas siguiendo los criterios del ensayo ACOSOG Z001130 no parecen precisar de ningún seguimiento especial de la axila por el bajo índice de recaídas locales, por tanto, y a falta de nuevos estudios, el seguimiento de estas pacientes debe ser similar a los casos con GC negativo.
El seguimiento de las pacientes con carcinoma ductal in situ debe ser igual que el de las lesiones invasivas de bajo riesgo: historia clínica y exploración física cada 6-12 meses, mamografía anual tras finalizar la radioterapia.
En el caso del carcinoma lobulillar in situ, que se considera un marcador de riesgo de cáncer en la misma mama y en la contralateral, y debido a su escasa expresión mamográfica, se recomienda valorar mamografía asociada a resonancia magnética y/o ecografía (según criterio del radiólogo), y examen clínico anual.
Las hiperplasias ductales o lobulillares atípicas y la atipia de epitelio plano precisan una extirpación quirúrgica y, al menos, una primera valoración clínica y mamográfica a los 6 meses, y posteriormente, controles anuales. Debe valorarse el momento de pasar a controles habituales establecidos según la edad.
¿Cómo y quién debe hacer el seguimiento?Dado que en el tratamiento del cáncer de mama interviene un equipo multidisciplinar, una vez la paciente ha finalizado la etapa terapéutica es crucial coordinar el papel de todos los especialistas, se debe llegar a un grado de acuerdo o compromiso y no duplicar ni omitir actos que se considere adecuado realizar.
En líneas generales se puede hablar de una primera etapa con un seguimiento más intenso, y una segunda, con un seguimiento más laxo. La primera etapa corresponderá a los 5 primeros años después de los tratamientos, siendo las revisiones más frecuentes, porque la mayor parte de las recaídas se producen en este periodo; el intervalo entre revisiones oscila entre 3-6 meses durante los 2-3 primeros años, y 6-12 meses hasta el quinto. Durante la segunda etapa, de 5 años en adelante, se recomienda un control anual sin límite de edad, tal como proponen diversas sociedades, como la American Society of Clinical Oncology15, la European Society for Medical Oncology31,32, o la European Society of Breast Cancer Specialists33. Las recomendaciones del N Institute for Health and Care Excellence34 son algo diferentes: las revisiones después de los 3 años se realizan en AP. Existen otras guías internacionales, todas relativamente parecidas35,36, con evaluación anual; para la European Society for Medical Oncology31,32, control anual y mamografía de control 6 meses después de radioterapia; finalmente, la European Society of Breast Cancer Specialists33 no tiene consenso sobre la frecuencia y duración de la exploración física (nivel de evidencia i).
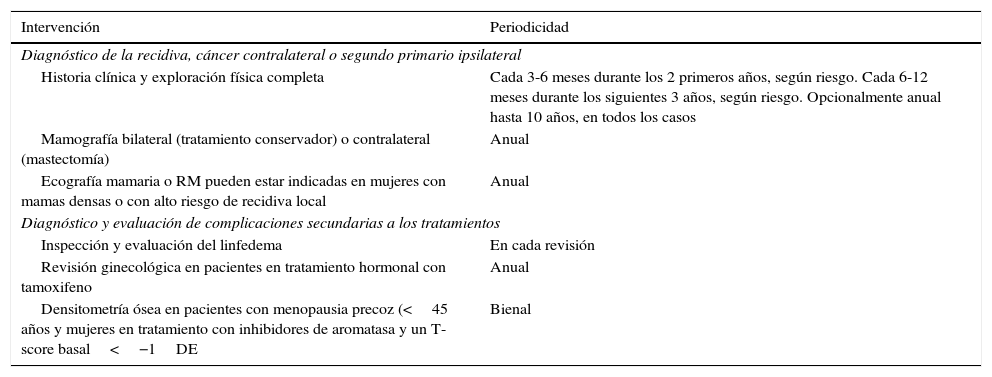
La definición de la frecuencia y las pruebas a realizar es responsabilidad de la Unidad de Mama, y cada una de ellas adaptará sus recursos humanos y materiales de la manera más conveniente. De acuerdo con las recomendaciones de las guías internacionales, la coordinación del seguimiento de la paciente asintomática tratada de un cáncer de mama la podrá realizar cualquiera de los siguientes especialistas: cirujano/ginecólogo, oncólogo médico o radioterápico y médico de familia. Existen diversos trabajos que no demuestran ventajas, en cuanto a supervivencia37–41, si dichos controles se realizan en otros ámbitos. Es preciso conocer que en España, el Real Decreto 1566/1998, de 17 de julio, por el que se establecen los criterios de calidad en radioterapia, establece que las revisiones de un paciente que haya recibido radioterapia debe efectuarlas un oncólogo radioterápico. A modo de resumen se presentan las pruebas recomendadas y su frecuencia en la tabla 2.
Frecuencias y pruebas a realizar
| Intervención | Periodicidad |
|---|---|
| Diagnóstico de la recidiva, cáncer contralateral o segundo primario ipsilateral | |
| Historia clínica y exploración física completa | Cada 3-6 meses durante los 2 primeros años, según riesgo. Cada 6-12 meses durante los siguientes 3 años, según riesgo. Opcionalmente anual hasta 10 años, en todos los casos |
| Mamografía bilateral (tratamiento conservador) o contralateral (mastectomía) | Anual |
| Ecografía mamaria o RM pueden estar indicadas en mujeres con mamas densas o con alto riesgo de recidiva local | Anual |
| Diagnóstico y evaluación de complicaciones secundarias a los tratamientos | |
| Inspección y evaluación del linfedema | En cada revisión |
| Revisión ginecológica en pacientes en tratamiento hormonal con tamoxifeno | Anual |
| Densitometría ósea en pacientes con menopausia precoz (<45 años y mujeres en tratamiento con inhibidores de aromatasa y un T-score basal<−1DE | Bienal |
Existe bastante evidencia42,43 de que el seguimiento por AP, e incluso por enfermeras especializadas, proporciona los mismos resultados que el seguimiento por especialistas, no observándose diferencias significativas en términos de supervivencia y satisfacción de las pacientes. La American Society of Clinical Oncology15 contempla la posibilidad de transferir a AP a las pacientes con tumores de menos de 5cm y menos de 4 ganglios positivos, al año del diagnóstico, con la conformidad de la paciente. Los inconvenientes de esta transferencia serían: la sensación de «abandono» sufrida por parte de la paciente y la pérdida de la satisfacción de no poder ver la evolución de las mismas por el equipo multidisciplinar hospitalario. A nivel de auditoría interna de la unidad, se hace más difícil elaborar los datos de supervivencia y recaída local a largo plazo. Existe la vía intermedia de realizar el seguimiento dentro de la unidad, dejándolo a cargo de una enfermera especializada. Se considera de gran importancia el papel de Enfermería en ámbitos como la información y consejo sobre estilos de vida, animar y fortalecer la adherencia al tratamiento adyuvante, el afrontamiento de la enfermedad y la calidad de vida. Transferir parcialmente el seguimiento a Enfermería no parece impactar en la supervivencia ni en la satisfacción de las pacientes44. El inconveniente es que la unidad debe disponer de suficientes recursos humanos y económicos para afrontar esta carga de trabajo adicional. Se han publicado estudios de coste-eficacia41 que demuestran que el seguimiento por una enfermera/médico de AP, o incluso de manera telefónica, es factible, e igualmente eficaz cuando se cumplen las condiciones adecuadas.
¿Qué necesidades tiene el médico de asistencia primaria para asumir el seguimiento?El médico de AP es la puerta de acceso y el que da continuidad a todo el circuito asistencial, por ello, y dada la alta prevalencia del cáncer de mama, debe estar implicado en el seguimiento de estas pacientes. Sin embargo, debe tenerse en cuenta que pasar el seguimiento del hospital a AP puede originar 2 efectos: por una parte, ejercer un notable «beneficio» al desligarse del servicio oncológico, y por otra, un efecto de «desamparo» por desligarse de los especialistas con los que ha pasado varias revisiones. Además de este efecto en las pacientes, que implica que sea imprescindible mantener el apoyo psicológico45 en el momento del alta hospitalaria, también debe tenerse en cuenta que actualmente, los médicos de AP no están familiarizados con el seguimiento de las mujeres tratadas por cáncer de mama, ya que no lo han hecho de forma reglada, por lo que mejorar su formación oncológica es fundamental, tanto en diagnóstico como en tratamiento del cáncer de mama. Igualmente, sería muy deseable la rotación de los MIR de Medicina de Familia por las unidades de Mama y por los diferentes servicios que tratan cáncer de mama, para familiarizarse con los protocolos de seguimiento establecidos.
Otro punto importante es la integración de los médicos de AP en las unidades de Mama, incluso puede ser interesante crear la figura del médico de AP responsable de la enfermedad mamaria que acuda a la Unidad de Mama del hospital de referencia y transmita la información al resto de los profesionales. En algunas comunidades autónomas los especialistas en AP, tanto ginecólogos como cirujanos generales, podrían asumir mejor el papel de enlace con la Unidad; esta integración ayudaría a establecer un circuito de derivación unidades de Patología Mamaria/AP, que debería ser bidireccional y bien definido y consensuado por ambas partes. Así, deben habilitarse los mecanismos para que desde AP se disponga de consulta rápida de las dudas, sobre todo al inicio del seguimiento, y facilitar la vuelta de pacientes a la unidad hospitalaria de forma rápida en caso de necesidad. Es fundamental el establecimiento de la historia clínica electrónica única, junto con un apartado de historia clínica laboral en la que se deberían reflejar las actividades laborales que ha tenido la paciente y los riesgos a los que ha estado o está expuesta.
La recuperación de la vida en todos los aspectos es lo más beneficioso para el estado de ánimo y el afrontamiento de la situación. En muchas ocasiones esta reincorporación no puede realizarse al finalizar el tratamiento, ya que la paciente puede necesitar un tiempo de recuperación prolongado debido a los efectos secundarios, y a pesar de que la gran mayoría de las pacientes tienen voluntad de reincorporación laboral, el 65% no lo hacen. El equipo médico debería conocer las tareas a realizar por las pacientes en su trabajo, para minimizar el impacto laboral. Para el especialista en Medicina del Trabajo o de AP es fundamental conocer los tiempos estimados del tratamiento y de seguridad en los que se podría considerar que la paciente puede incorporarse a su trabajo, y los efectos secundarios habituales de los tratamientos de administración prolongada (hormonoterapia, trastuzumab); para ello, es importante realizar una anamnesis laboral ante el diagnóstico de cáncer de mama, lo que orientará sobre la necesidad o no de incapacidad laboral temporal (IT) y los tiempos necesarios.
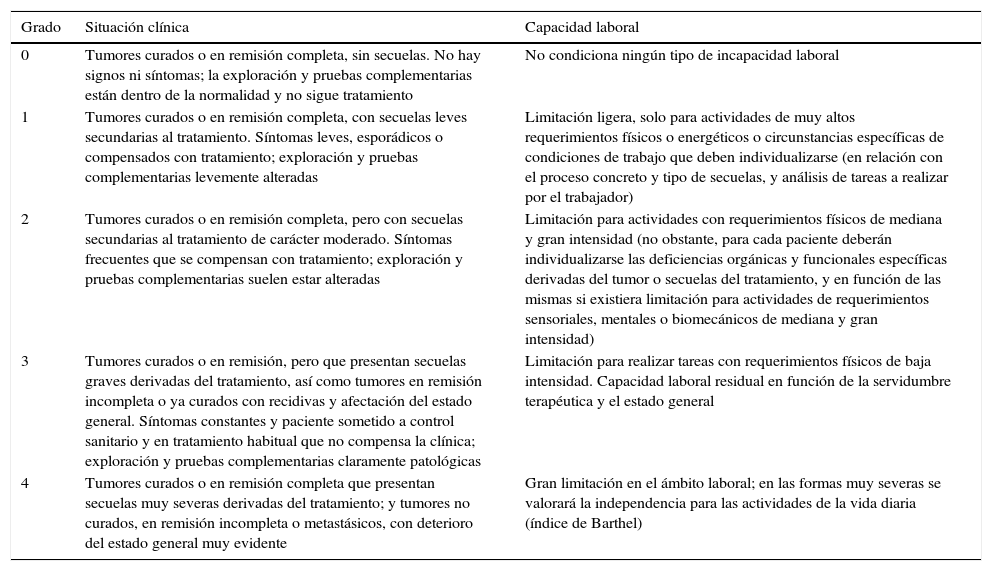
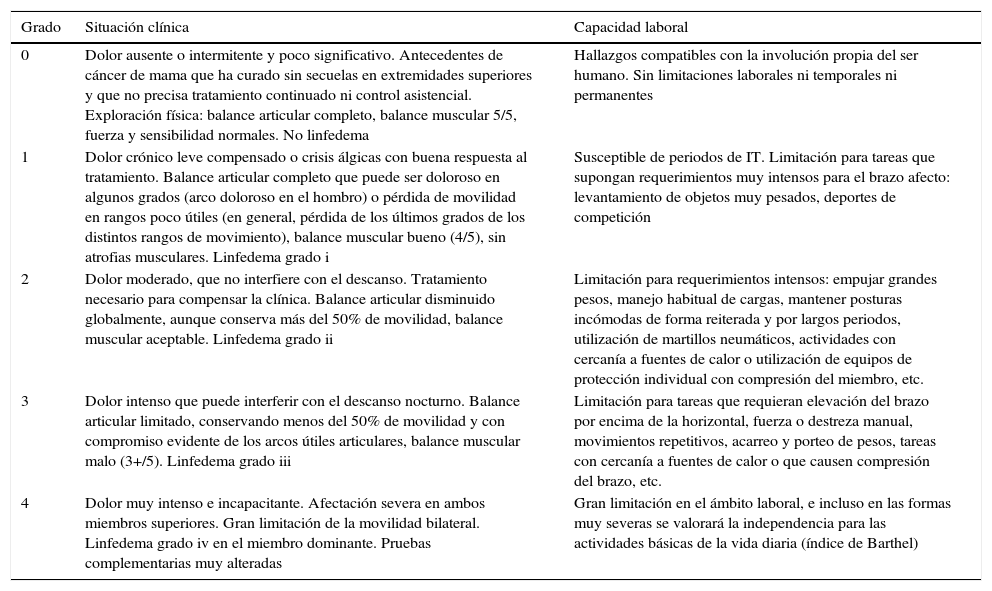
Durante el diagnóstico y tratamiento del cáncer de mama, lo habitual es que la paciente permanezca en situación de IT, y se pueden establecer varios grupos en relación con la duración de esta, según los tratamientos recibidos. En procesos clínicos graves, el tiempo estándar de incapacidad correspondería al tiempo necesario de estudio, confirmación y valoración de respuesta al tratamiento, antes de plantear una posible incapacidad permanente. La valoración definitiva de los pacientes oncológicos se debe realizar una vez finalizadas las acciones terapéuticas; en el caso del cáncer de mama, los tiempos estándar oscilan entre 90 y 240 días. Estos tiempos están publicados y actualizados en las guías emitidas por el Instituto Nacional de la Seguridad Social46. En las tablas 3 y 4 se muestran los criterios de incapacidad laboral para el cáncer de mama establecidos por la Sociedad Española de Médicos de Atención Primaria47.
Valoración funcional del cáncer de mama
| Grado | Situación clínica | Capacidad laboral |
|---|---|---|
| 0 | Tumores curados o en remisión completa, sin secuelas. No hay signos ni síntomas; la exploración y pruebas complementarias están dentro de la normalidad y no sigue tratamiento | No condiciona ningún tipo de incapacidad laboral |
| 1 | Tumores curados o en remisión completa, con secuelas leves secundarias al tratamiento. Síntomas leves, esporádicos o compensados con tratamiento; exploración y pruebas complementarias levemente alteradas | Limitación ligera, solo para actividades de muy altos requerimientos físicos o energéticos o circunstancias específicas de condiciones de trabajo que deben individualizarse (en relación con el proceso concreto y tipo de secuelas, y análisis de tareas a realizar por el trabajador) |
| 2 | Tumores curados o en remisión completa, pero con secuelas secundarias al tratamiento de carácter moderado. Síntomas frecuentes que se compensan con tratamiento; exploración y pruebas complementarias suelen estar alteradas | Limitación para actividades con requerimientos físicos de mediana y gran intensidad (no obstante, para cada paciente deberán individualizarse las deficiencias orgánicas y funcionales específicas derivadas del tumor o secuelas del tratamiento, y en función de las mismas si existiera limitación para actividades de requerimientos sensoriales, mentales o biomecánicos de mediana y gran intensidad) |
| 3 | Tumores curados o en remisión, pero que presentan secuelas graves derivadas del tratamiento, así como tumores en remisión incompleta o ya curados con recidivas y afectación del estado general. Síntomas constantes y paciente sometido a control sanitario y en tratamiento habitual que no compensa la clínica; exploración y pruebas complementarias claramente patológicas | Limitación para realizar tareas con requerimientos físicos de baja intensidad. Capacidad laboral residual en función de la servidumbre terapéutica y el estado general |
| 4 | Tumores curados o en remisión completa que presentan secuelas muy severas derivadas del tratamiento; y tumores no curados, en remisión incompleta o metastásicos, con deterioro del estado general muy evidente | Gran limitación en el ámbito laboral; en las formas muy severas se valorará la independencia para las actividades de la vida diaria (índice de Barthel) |
Fuente: Vicente-Herrero et al.47.
Valoración de la limitación funcional del miembro superior como secuela del cáncer de mama
| Grado | Situación clínica | Capacidad laboral |
|---|---|---|
| 0 | Dolor ausente o intermitente y poco significativo. Antecedentes de cáncer de mama que ha curado sin secuelas en extremidades superiores y que no precisa tratamiento continuado ni control asistencial. Exploración física: balance articular completo, balance muscular 5/5, fuerza y sensibilidad normales. No linfedema | Hallazgos compatibles con la involución propia del ser humano. Sin limitaciones laborales ni temporales ni permanentes |
| 1 | Dolor crónico leve compensado o crisis álgicas con buena respuesta al tratamiento. Balance articular completo que puede ser doloroso en algunos grados (arco doloroso en el hombro) o pérdida de movilidad en rangos poco útiles (en general, pérdida de los últimos grados de los distintos rangos de movimiento), balance muscular bueno (4/5), sin atrofias musculares. Linfedema grado i | Susceptible de periodos de IT. Limitación para tareas que supongan requerimientos muy intensos para el brazo afecto: levantamiento de objetos muy pesados, deportes de competición |
| 2 | Dolor moderado, que no interfiere con el descanso. Tratamiento necesario para compensar la clínica. Balance articular disminuido globalmente, aunque conserva más del 50% de movilidad, balance muscular aceptable. Linfedema grado ii | Limitación para requerimientos intensos: empujar grandes pesos, manejo habitual de cargas, mantener posturas incómodas de forma reiterada y por largos periodos, utilización de martillos neumáticos, actividades con cercanía a fuentes de calor o utilización de equipos de protección individual con compresión del miembro, etc. |
| 3 | Dolor intenso que puede interferir con el descanso nocturno. Balance articular limitado, conservando menos del 50% de movilidad y con compromiso evidente de los arcos útiles articulares, balance muscular malo (3+/5). Linfedema grado iii | Limitación para tareas que requieran elevación del brazo por encima de la horizontal, fuerza o destreza manual, movimientos repetitivos, acarreo y porteo de pesos, tareas con cercanía a fuentes de calor o que causen compresión del brazo, etc. |
| 4 | Dolor muy intenso e incapacitante. Afectación severa en ambos miembros superiores. Gran limitación de la movilidad bilateral. Linfedema grado iv en el miembro dominante. Pruebas complementarias muy alteradas | Gran limitación en el ámbito laboral, e incluso en las formas muy severas se valorará la independencia para las actividades básicas de la vida diaria (índice de Barthel) |
Fuente: Vicente-Herrero et al.47.
Para individualizar el periodo de IT es necesario conocer las condiciones laborales y los riesgos asociados del trabajo de la paciente y su compatibilidad con el grado de funcionalidad postratamiento; también debe tenerse en cuenta el turno horario por la posible vinculación del riesgo de cáncer de mama con la alteración del ritmo circadiano en trabajadoras nocturnas, en relación con las modificaciones en la secreción de melatonina, que ya ha sido reconocido como indemnizable en algunos países48,49. En los casos en los que el trabajador se incorpore a su puesto de trabajo después de periodos largos de IT, o incluso de incapacidad permanente, debe conocerse la necesidad de realización de un reconocimiento específico de vigilancia de la salud (reconocimiento médico de retorno), que es una obligación legal para el empresario. El médico de AP debería tener conocimientos suficientes en estos temas, ya que es el encargado de extender el correspondiente parte de baja, acto médico que lo que hace es certificar que la paciente está sometida a tratamiento médico e imposibilitada para su actividad laboral (artículo 128 de la LGSS).
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Coordinadores: Manuel Algara López. Oncología Radioterápica. Parc de Salut Mar. Barcelona
Dolores Sabadell Mercadal. Ginecología. Parc de Salut Mar. Barcelona
¿Cuál es el motivo de hacer el seguimiento?
Coordinador: Francisco Vicente García. Cirugía General. Complejo Hospitalario de Navarra
Encarna Adrover Cebrián. Oncología Médica. Complejo Hospitalario Universitario de Albacete
Luis Apesteguía Ciriza. Radiología. Complejo Hospitalario. Pamplona
Eloisa Bayo Lozano. Oncología Radioterápica. Hospital Juan Ramón Jiménez. Huelva.
Meritxell Bellet. Oncología Médica. Hospital Vall d’Hebron. Barcelona.
Maximo Izquierdo Sanz. Ginecología. Hospital Universitario Quirón Dexeus. Barcelona.
María Victoria Garrido Manzano. Médico Inspector en el Instituto Nacional de la Seguridad Social. Castellón.
Milagros González Béjar. Servicio Madrileño de Salud. Madrid
Antonio Mariscal Martínez. Radiodiagnóstico. Hospital Germans Trias i Pujol. Badalona. Barcelona
Mar Vernet Tomás. Ginecología. Parc de Salut Mar. Barcelona
¿Se debe seguir a todas las pacientes de la misma forma?
Coordinador: Encarna Adrover Cebrián. Oncología Médica. Complejo Hospitalario Universitario de Albacete
Mercè Abizanda González. Médico de familia. Barcelona
Eloisa Bayo Lozano. Oncología Radioterápica. Hospital Juan Ramón Jiménez. Huelva
Carmen Cereijo Garea. Enfermera del Área de Xestión Integrada A Coruña
Araceli López-Guillen García. Médico Inspector en el Instituto Nacional de la Seguridad Social. Murcia
Antonio Mariscal Martínez. Radiodiagnóstico. Hospital Germans Trias i Pujol. Badalona. Barcelona
Belen Merck Navarro. Cirugía. Universidad Cardenal Herrera. Valencia
Rafael Molina Porto. Diagnóstico Biomédico. Hospital Clínic. Barcelona
Ángel Montero Luis. Oncología Radioterápica. Hospital Ramón y Cajal. Madrid
Luis Pina Insausti. Radiología. Clínica Universitaria de Navarra. Pamplona
Carmen Cereijo Garea. Enfermera del Área de Xestión Integrada A Coruña
Sònia Servitja Tormo. Oncología Médica. Parc de Salut Mar. Barcelona
Mar Vernet Tomás. Ginecología. Parc de Salut Mar. Barcelona
Sergi Vidal Sicart. Medicina Nuclear. Hospital Clínic. Barcelona
¿Cómo y quién debe realizar el seguimiento?
Coordinador: Miquel Prats de Puig. Ginecología. Clínica Planas. Barcelona
Mercè Abizanda González. Médico de familia. Barcelona
Carmen Cereijo Garea. Enfermera del Área de Xestión Integrada A Coruña
Ezequiel González Patiño. Oncología Radioterápica. Hospital Clínico. Santiago de Compostela
Araceli López-Guillen. Médico Inspector en el Instituto Nacional de la Seguridad Social. Murcia
Rafael Molina Porto. Diagnóstico Biomédico. Hospital Clínic. Barcelona
Ángel Montero Luis. Oncología Radioterápica. Hospital Ramón y Cajal. Madrid
Montse Muñoz Mateu. Oncología Médica. Hospital Clínic. Barcelona
Luis Pina Insausti. Radiología. Clínica Universitaria de Navarra. Pamplona
Maribel Pons Pallas. Ginecología. Barcelona
Sònia Servitja Tormo. Oncología Médica. Parc de Salut Mar. Barcelona
Sergi Vidal Sicart. Medicina Nuclear. Hospital Clínic. Barcelona
Francisco Vicente García. Cirugía General. Complejo Hospitalario de Navarra
¿Qué necesidades tiene el médico de asistencia primaria para asumir el seguimiento?
Coordinador: Milagros González Béjar. Servicio Madrileño de Salud. Madrid.
Luis Apesteguía Ciriza. Radiología. Complejo Hospitalario. Pamplona
María Victoria Garrido Manzano. Médico Inspector en el Instituto Nacional de la Seguridad Social. Castellón.
Ezequiel González Patiño. Oncología Radioterápica. Hospital Clínico. Santiago de Compostela
Araceli López-Guillen García. Médico Inspector en el Instituto Nacional de la Seguridad Social. Murcia
Belén Merck Navarro. Cirugía. Universidad Cardenal Herrera. Valencia
Maribel Pons Pallas. Ginecología. Barcelona