Evaluar la calidad del procedimiento de la biopsia selectiva del ganglio centinela en la Unidad de Patología Mamaria de un hospital comarcal, sin servicio de Medicina Nuclear.
Material y métodosSe diseñó un estudio descriptivo, retrospectivo, en el que se incluyeron 104 pacientes con cáncer de mama no avanzado. El día previo a la cirugía se les realizó una linfogammagrafía en el hospital de referencia. Como instrumento de gestión, se empleó la guía clínica de autoevaluación de la Sociedad Española de Senología y Patología Mamaria. Estudiamos la eficacia en la detección del ganglio centinela, la sensibilidad y la media de ganglios centinelas axilares aislados por paciente. Se evaluaron tanto los resultados globales obtenidos por la Unidad de Mama, como los obtenidos individualmente por cada uno de los 3 cirujanos que la integran.
ResultadosSe cumplieron los 3 criterios esenciales de la guía de autoevaluación, siendo: la detección del ganglio centinela del 94,2%, la sensibilidad acreditada del 93,2%, y la media de ganglios centinela axilares extraídos de 1,66±0,84. Estos criterios también se cumplieron a nivel individual, por cada uno de los 3 cirujanos que integran la unidad. La aplicación de la guía de autoevaluación nos dio una puntuación global de 33 sobre 71 puntos, siendo el nivel de calidad ii el más prevalente.
ConclusionesEn nuestra unidad, la aplicación de la guía publicada por la Sociedad Española de Senología y Patología Mamaria para evaluar los aspectos esenciales y básicos de la biopsia selectiva del ganglio centinela en cáncer de mama nos ha permitido confirmar que realizamos el procedimiento con suficiente garantía de calidad, y además, promover aspectos de mejora.
To assess the quality of selective sentinel lymph node biopsy in the Breast Diseases Unit of a district hospital without a Nuclear Medicine service.
Methods and materialA retrospective, descriptive study was conducted in 104 patients with nonadvanced breast cancer. The day before surgery, the patients underwent lymph node mammography in the referral hospital. The self-evaluation clinical guideline of the Spanish Society of Senology and Breast Pathology was used as part of the management protocol. We studied the efficacy of sentinel lymph node detection, the sensitivity of the procedure, and the mean number of axillary sentinel lymph nodes isolated per patient. Both the overall results obtained by the Breast Diseases Unit and the results obtained individually by each of the 3 surgeons working in the unit were evaluated.
ResultsThe 3 main criteria of the self-evaluation guideline were fulfilled, namely: sentinel lymph node detection in 94.2%, the sensitivity ratio in 93.2% and the mean number of sentinel lymph nodes removed, 1.66±0.84. These criteria were also fulfilled by each of the 3 surgeons working in the unit. The score of the self-assessment guideline was 33 out of 71 points, with level ii being the most prevalent level of quality.
ConclusionsIn our unit, application of the guidelines published by the Spanish Society of Senology and Breast Pathology to evaluate essential and basic aspects of selective sentinel lymph node biopsy in breast cancer demonstrated that quality criteria are being met in our unit, and allowed us to promote quality improvements.
Desde su introducción por Krag et al.1 y Giuliano et al.2, la biopsia selectiva del ganglio centinela (BSGC) es el procedimiento de elección para realizar una adecuada estadificación de los ganglios linfáticos axilares, en pacientes con cáncer de mama no avanzado. Permite seleccionar un subgrupo de pacientes en los que la linfadenectomía axilar no aporta ningún beneficio adicional.
Diversas organizaciones, como la Sociedad Americana de Oncología Clínica3 y el National Comprehensive Cancer Network, o consensos como el de Philadelphia4, o Saint Gallen5, han señalado que la BSGC es una alternativa válida a la disección axilar, en pacientes con cáncer de mama en estadios precoces, sin adenopatías axilares palpables y ecográficamente negativas.
La seguridad diagnóstica de la BSGC ha sido validada en gran número de estudios6–8, que la comparan con la tradicional disección axilar en el mismo paciente. En un metaanálisis llevado a cabo por Miltenburg et al.9 se concluye que la BSGC refleja con exactitud el estado de los ganglios axilares en un 97% de los casos, y presenta un 5% de falsos negativos.
La falta de disponibilidad de un servicio de Medicina Nuclear en el propio hospital ha sido el principal argumento que se ha expuesto para no practicar esta técnica10,11. Otros factores que pueden intervenir son el nivel de formación oncológica del cirujano, la necesidad de establecer una indispensable coordinación multidisciplinar, y la experiencia quirúrgica del equipo en la cirugía mamaria12,13.
En los últimos años se ha generado un creciente interés por la implementación de la técnica en múltiples áreas geográficas14–16. Antes de comenzar a realizar esta técnica de forma sistemática en un determinado centro, se recomienda una fase de validación del equipo multidisciplinar, que implica la necesidad de acreditar unos resultados adecuados que permitan incluir el procedimiento en su cartera de servicios17–20.
El objetivo común es alcanzar un estándar de calidad en todos los pasos del proceso para salvaguardar el principio de máxima eficacia y seguridad para la paciente21,22 y para el equipo médico que la trata, así como el principio de equidad, en las prestaciones del sistema sanitario, independientemente de circunstancias geográficas o de nivel económico o sociocultural.
Numerosos centros especializados realizan la BSGC en nuestro país23. Sin embargo, los resultados publicados por estos equipos no permiten diferenciar la procedencia de los pacientes; es decir, no se puede inferir cuáles son los resultados obtenidos en los pacientes atendidos en el centro especializado y cuáles los procedentes de pacientes de otros centros sanitarios de menor nivel.
El objetivo del presente trabajo ha sido evaluar la calidad del procedimiento de BSGC en un hospital comarcal (Hospital de Jarrio) de nuestra comunidad autónoma (Asturias), que no dispone de un servicio de Medicina Nuclear en el propio hospital.
Material y métodosEl mapa sanitario de Asturias está configurado en 8 áreas sanitarias. En la zona occidental se localiza el área i, a la que pertenece el Hospital de Jarrio, que da cobertura a una población de 49.323 habitantes. Se encuentra situado a 115Km de distancia de Oviedo, donde se ubica el Hospital Universitario Central de Asturias, centro de atención especializada de referencia.
Se diseñó un estudio descriptivo y retrospectivo que incluyó 104 pacientes, diagnosticadas de cáncer de mama entre enero de 2008 y enero de 2013, y que, cumpliendo los criterios de inclusión, optaron por la BSGC. Todas las pacientes firmaron un consentimiento informado específico para el procedimiento. Este estudio se aprobó por el Comité de Ética de nuestro hospital. El día previo a la cirugía se les realizó una linfogammagrafía en el hospital de referencia (Hospital Universitario Central de Asturias).
Para la recogida de datos se elaboró una hoja de recopilación de información, que contenía las variables estudiadas. Los informes médicos de la historia clínica se utilizaron como fuente de información.
Como instrumento de gestión para medir la idoneidad del proceso BSGC se empleó la guía clínica de autoevaluación de la Sociedad Española de Senología y Patología Mamaria24.
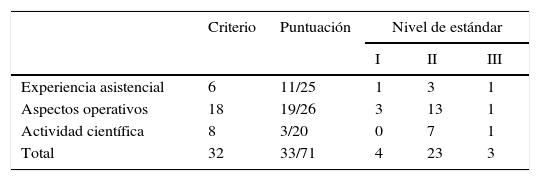
Esta guía valora 32 criterios relacionados con los principales factores que intervienen en el proceso de la BSGC: 6 de los criterios analizan aspectos asistenciales, 18, los aspectos operativos, incluyendo entre ellos 3 indicadores clasificados como esenciales, y 8 criterios valoran la actividad formativa y científica de la unidad.
Analizamos como indicadores esenciales: la eficacia en la detección del ganglio centinela (GC), la sensibilidad y la media de ganglios centinelas axilares aislados por paciente. Se evaluaron tanto los resultados globales obtenidos por la Unidad de Mama como los obtenidos individualmente por cada uno de los 3 cirujanos que la integran. Así mismo, se cumplimentaron los criterios correspondientes a los aspectos operativos, experiencia asistencial y actividad formativa que recoge la guía.
En cada criterio se obtiene una puntuación que se asocia con un nivel de estándar de calidad. La guía establece 4 niveles de estándares de calidad:
- -
Nivel 0: no se cumplen los requisitos mínimos para la buena práctica de la BSGC.
- -
Nivel I: se cumplen los requisitos mínimos, pero el resultado es francamente mejorable.
- -
Nivel II: se cumplen con suficiencia.
- -
Nivel III: los requisitos se cumplen en grado de excelencia.
El resultado final de la autoevaluación se define en función del nivel de estándar más prevalente en el conjunto de los criterios cuantificados.
ResultadosLa edad media de las pacientes fue de 58,9±8,45 años, con un rango de 31 a 88 años. El tamaño tumoral medio fue de 19,4±9,25mm, con un rango de 3 a 45mm. El tipo histológico más frecuente fue el carcinoma ductal infiltrante, con un 82,7%. Para el diagnóstico anatomopatológico del tumor se empleó la biopsia con aguja gruesa en el 59,6% de los casos, la punción-aspiración con aguja fina en el 19,2%, y la biopsia diferida en el 17,3%.
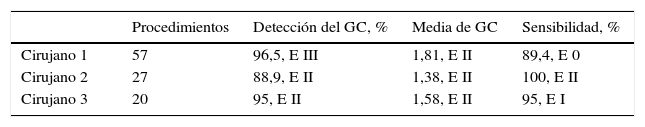
En primer lugar, hemos evaluado los 3 criterios operativos considerados requisitos imprescindibles para implementar la BSGC en el proceso asistencial del cáncer de mama. Se cumplieron los 3 criterios esenciales (tabla 1), siendo: la detección del GC del 94,2%, la sensibilidad acreditada del 93,2% y la media de GC axilares extraídos de 1,66±0,84). Estos criterios también se cumplieron a nivel individual, por cada uno de los 3 cirujanos que integran la unidad (tabla 2).
Criterios esenciales
| Criterio | Intervalo | Estándar | Resultado |
|---|---|---|---|
| Eficacia en la detección del GC | <85% | 0 | |
| 85-95% | II | 94,2% | |
| >95% | III | ||
| Sensibilidad acreditada (VP/VP+FN) | <90% | 0 | |
| 90-95% | I | 93,2% | |
| >95% | II | ||
| Media de GC axilares | No disponible | 0 | |
| >2,2 | I | ||
| <2,2 | II | 1,66 |
FN: falsos negativos; GC: ganglio centinela; VP: verdadero positivo.
En negrita se resaltan nuestros resultados.
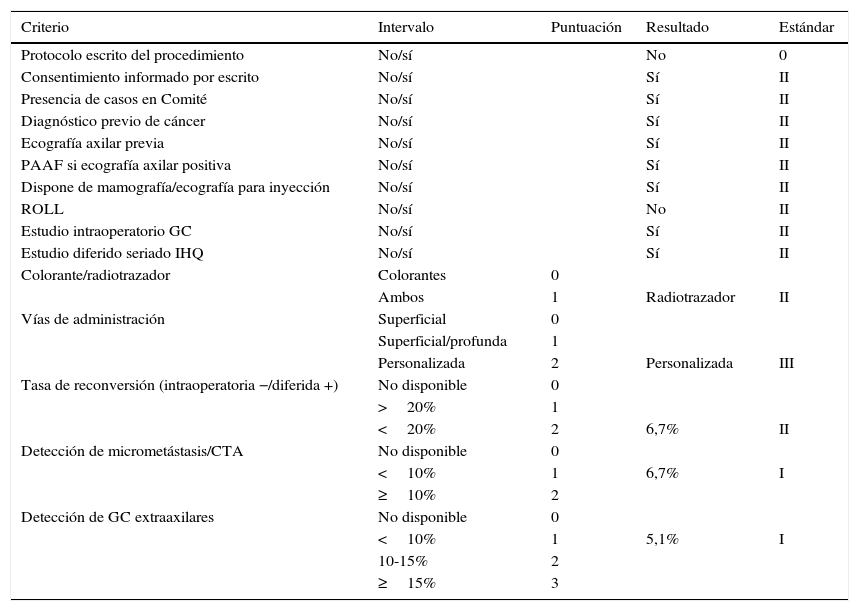
En la tabla 3 se recogen los resultados de la evaluación de los criterios operativos. Estos criterios, que se centran en la seguridad del procedimiento y en asegurar el cumplimiento de los criterios de inclusión, se correspondían con un nivel estándar ii.
Aspectos operativos
| Criterio | Intervalo | Puntuación | Resultado | Estándar |
|---|---|---|---|---|
| Protocolo escrito del procedimiento | No/sí | No | 0 | |
| Consentimiento informado por escrito | No/sí | Sí | II | |
| Presencia de casos en Comité | No/sí | Sí | II | |
| Diagnóstico previo de cáncer | No/sí | Sí | II | |
| Ecografía axilar previa | No/sí | Sí | II | |
| PAAF si ecografía axilar positiva | No/sí | Sí | II | |
| Dispone de mamografía/ecografía para inyección | No/sí | Sí | II | |
| ROLL | No/sí | No | II | |
| Estudio intraoperatorio GC | No/sí | Sí | II | |
| Estudio diferido seriado IHQ | No/sí | Sí | II | |
| Colorante/radiotrazador | Colorantes | 0 | ||
| Ambos | 1 | Radiotrazador | II | |
| Vías de administración | Superficial | 0 | ||
| Superficial/profunda | 1 | |||
| Personalizada | 2 | Personalizada | III | |
| Tasa de reconversión (intraoperatoria −/diferida +) | No disponible | 0 | ||
| >20% | 1 | |||
| <20% | 2 | 6,7% | II | |
| Detección de micrometástasis/CTA | No disponible | 0 | ||
| <10% | 1 | 6,7% | I | |
| ≥10% | 2 | |||
| Detección de GC extraaxilares | No disponible | 0 | ||
| <10% | 1 | 5,1% | I | |
| 10-15% | 2 | |||
| ≥15% | 3 |
CTA: células tumorales aisladas; GC: ganglio centinela; IHQ: inmunohistoquímica; PAAF: punción-aspiración con aguja fina; ROLL: localización radioguiada de lesiones ocultas.
Los criterios relacionados con el estudio patológico del GC valoran la realización del análisis intraoperatorio, que consistió en hacer citología por impronta y cortes en congelación, y el estudio diferido, con cortes seriados e inmunohistoquímica de todos los GC intraoperatorios negativos. En nuestro caso, cumplimos ambos indicadores.
La tasa de reconversión, es decir, los GC dados como negativos en el estudio intraoperatorio que finalmente son metástasis, resultó ser del 6,7%. La tasa de micrometástasis o de células tumorales aisladas es un criterio de calidad, que exige el análisis exhaustivo ganglionar; el 6,7% obtenido se corresponde con el nivel i. Detectamos ganglios extraaxilares en el 5,1%.
En relación con la autoevaluación de la experiencia asistencial, que se recoge en la tabla 4, de los resultados obtenidos, la mayoría en un nivel estándar ii de calidad, cabe destacar que al ser un hospital comarcal, el promedio pacientes/año y el promedio de casos anuales/equipo están en un nivel estándar de i y 0, respectivamente.
En el apartado de actividad científica y docente, dentro de los ítems que se puntúan en la guía, mediante criterios con menor exigencia de resultados, aunque solo aportamos la asistencia a cursos y congresos, nuestra unidad ha obtenido unos resultados correspondientes en su mayoría a un nivel ii de estándar.
En la tabla 5 se resumen nuestros resultados. Obtuvimos una puntuación global de 33 sobre un máximo de 71. El nivel estándar más prevalente fue el ii, que se corresponde con la suficiencia para la realización de la BSGC en nuestra unidad.
Dentro del estudio también se analizaron los casos en que no se encontró el GC, que fueron 6. La linfogammagrafía previa a la cirugía fue negativa en 2 casos, detectando un GC en cada uno de los otros 4 casos. El día de la intervención, con la sonda gamma, no se detectó radioactividad axilar en 5 casos, y en otro, la radioactividad era difusa. Se realizó linfadenectomía axilar (LA) en todas las pacientes, encontrándose metástasis ganglionares en 2 de ellas.
De los 7 casos de GC informados como falsos negativos histológicos en el estudio intraoperatorio, en la biopsia diferida se informaron: 4 casos con presencia de micrometástasis, uno con presencia de células tumorales aisladas y 2 con macrometástasis. Se realizó LA en los 2 casos de macrometástasis y en uno de micrometástasis, no encontrándose afectación ganglionar en ninguno de los 3 casos.
Desde un punto de vista clínico, en el seguimiento de estas pacientes, que osciló entre 12 y 70 meses (media 35,19±6,7), se consideraron como falsos negativos de la técnica aquellos casos que presentaron una recidiva axilar durante el periodo de seguimiento. Hasta la fecha no tenemos constancia de ninguna recidiva axilar.
DiscusiónDesde un punto de vista quirúrgico, las cuestiones de la BSGC que deben ser analizadas pueden resumirse en 3 puntos: el porcentaje de identificación del GC, el número de procedimientos que el cirujano debe realizar para adquirir un adecuado nivel de experiencia, y la incidencia de falsos negativos.
Diferentes sociedades científicas, en reuniones de consenso, han publicado recomendaciones para la acreditación quirúrgica en la BSGC3–5,10. En España, estos parámetros de validación han sido una tasa de identificación del GC≥95% y una tasa de falsos negativos≤5%. En la reunión de consenso de Murcia en 2006, se planteó la progresiva sustitución de la fase de validación por un proceso de aprendizaje supervisado por un grupo de experiencia. Aunque continúa el debate sobre el número óptimo de procedimientos a realizar, existe un consenso en obtener una alta tasa de identificación (>85%) con bajo índice de falsos negativos (5-10%)25–29.
En nuestro caso, al tratarse de un hospital comarcal, y teniendo en cuenta las dificultades que esto implica (movilidad de los profesionales, la distancia al hospital de referencia, la carga asistencial, el número reducido de casos anuales), dentro de la fase de validación para el abandono de la LA se optó por un modelo mixto, es decir, validación estadística y tutelada.
La validación estadística se realizó con un registro de 15 casos consecutivos. En el mismo acto se realizó la BSGC seguida de la LA, y se examinaron los datos concernientes a la identificación del GC, los falsos negativos y la sensibilidad.
La validación tutelada se llevó a cabo en el Servicio de Ginecología del hospital de referencia, acreditado para la técnica del GC. Consistió en la asistencia como ayudante-cirujano en el proceso BSGC por parte de un ginecólogo del servicio.
La totalidad de los casos en la validación estadística fueron realizados por 2 ginecólogos, con experiencia en la cirugía oncológica de la mama, como hemos comentado.
En esta fase, de los 15 GC realizados, se detectaron 12 (80%), con 2 falsos negativos (13%). Al analizar los resultados, y aunque estas cifras no cumplen los estándares recomendados por las diferentes sociedades científicas, tenemos que comentar que el número de casos es pequeño, y que a esta casuística tenemos que añadirle la experiencia de los casos realizados bajo tutela en el hospital de referencia. El aprendizaje acumulado en ambas vías fue lo que nos decidió a implementar la BSGC en fase de aplicación.
Consideramos que en la fase de validación, sin seguir un proceso riguroso de acreditación, han sido fundamentales aspectos como: la familiarización a través de la bibliografía científica con la técnica, el seguir un protocolo definido para los 3 aspectos técnicos del procedimiento (medicina nuclear, cirugía, anatomía patológica), el contar con servicios de Medicina Nuclear y Anatomía Patológica validados, y el ser cirujanos con experiencia en cirugía oncológica de la mama.
En fase de aplicación de la BSGC se incorporó un tercer ginecólogo a esta técnica, también con experiencia en la cirugía de la mama, que fue tutelado por los otros 2 ginecólogos de la unidad.
En nuestra unidad se elaboró inicialmente un documento de consentimiento informado para la BSGC, cuya estructura y contenido se ajustaban a la exigencia ética y jurídica encaminada a garantizar un correcto proceso informativo a la enferma30, aunque carecía de los valores relativos a la eficacia de la técnica de nuestro equipo. Tras este estudio, estamos en disposición de incorporar estos datos al consentimiento para BSGC, y con la base de datos creada, realizar una revisión sistemática actualizada de la técnica en cada momento, acreditando con suficiente evidencia científica, su seguridad, eficacia y contribución al tratamiento del cáncer de mama.
El porcentaje de resultados falsamente negativos, cuyas cifras varían en la literatura entre un 5-10%, está en relación con el tamaño del tumor primario, siendo significativamente superior en T3 que en T1-T2, y con el número de GC obtenidos en la BSGC, de forma que disminuye cuando se obtienen 3 o más GC31. Es tema de controversia el número de GC que deben ser extraídos; aunque en la guía de la Sociedad Española de Senología y Patología Mamaria son aceptables hasta 3 GC, recomiendan limitar su número a 232.
En nuestro equipo tenemos una media de 1,66 GC, correspondiéndose con un número de falsos negativos de 6,7. Un aspecto que nos pareció interesante analizar fue la aparición de falsos negativos, que conlleve una recidiva axilar durante el periodo de seguimiento, que hemos realizado hasta enero de 2013. En la muestra analizada no hemos hallado ningún caso de recidiva local, aunque este estudio presenta la limitación del escaso número de pacientes estudiadas, y precisaría de un seguimiento a largo plazo de estas, porque si bien es cierto que la mayoría de las recidivas ocurren en la primera década, particularmente entre 2 y 5 años, pueden ocurrir mucho más tarde, principalmente en tumores con receptores positivos33,34.
Los porcentajes de recidiva descritos en la literatura en estudios observacionales a partir de largas series muestran valores entre 0,3-0,12%35–38.
Con la incorporación de la BSGC en nuestro centro, hemos consolidado la cirugía mínimamente invasiva de axila, simplificando la complejidad posoperatoria del proceso, lo que se traduce en una reducción del tiempo de ingreso. Esto permite colaborar en programas de corta estancia en la cirugía del cáncer de mama, lo que tiene un importante impacto económico para el sistema sanitario, al reducir el coste global del proceso39,40. El uso racional de los recursos es un elemento esencial para mejorar la eficiencia de nuestro sistema, y en un futuro, contribuir a mejorar las prestaciones a nuestros ciudadanos.
Como conclusión, creemos que la guía publicada por la Sociedad Española de Senología y Patología Mamaria es una herramienta útil y sencilla para evaluar los aspectos esenciales y básicos de la BSGC en el cáncer de mama. Su aplicación en nuestra unidad nos ha permitido confirmar que realizamos el procedimiento con suficiente garantía de calidad, y además, promover aspectos de mejora en nuestra práctica habitual.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
AutoríaHan participado en la concepción y diseño, la adquisición de los datos, el análisis e interpretación de los datos del trabajo que ha dado como resultado el artículo en cuestión: José Antonio Díaz Blanco, Ángel López Vázquez, Rafael Maroto Páez, Marta María Castillo Núñez, Patricia Morales del Burgo y Ana Álvarez Blanco.
Han participado en la redacción del texto y posibles revisiones del mismo: José Antonio Díaz Blanco y Ángel López Vázquez.
Han aprobado la versión que finalmente va a ser publicada: José Antonio Díaz Blanco, Ángel López Vázquez, Rafael Maroto Páez, Marta María Castillo Núñez, Patricia Morales del Burgo y Ana Álvarez Blanco.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.